Похожие презентации:
Презентация на тему Арены
1. Ароматические углеводороды
Арены1
2.
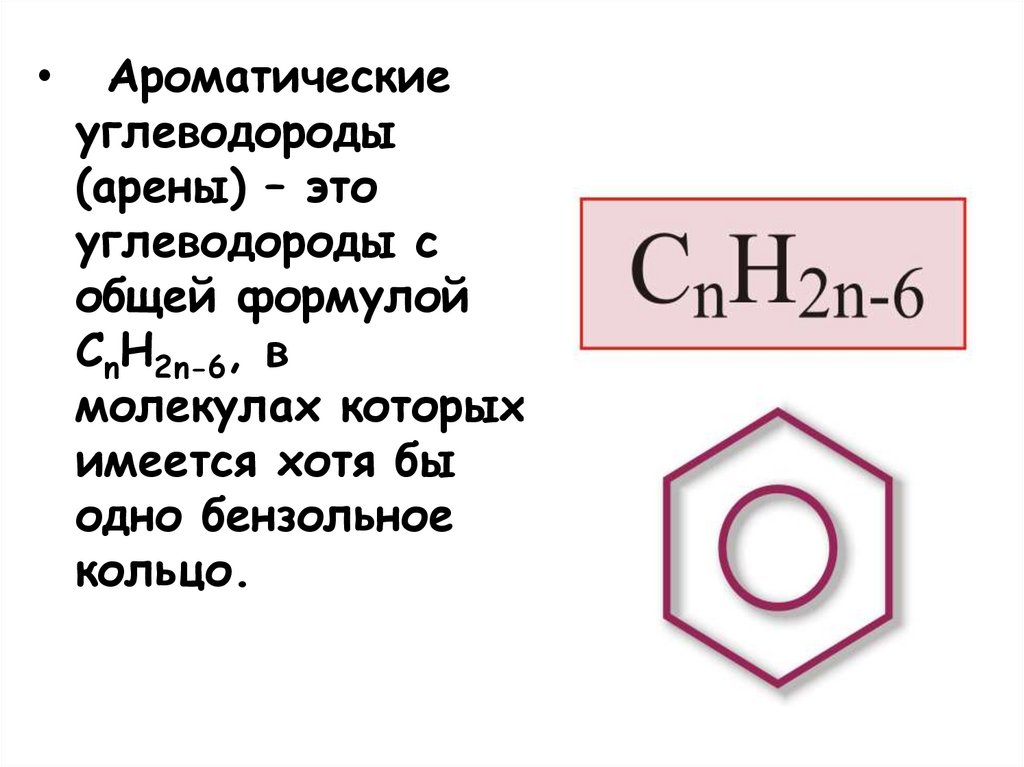
Ароматические
углеводороды
(арены) – это
углеводороды с
общей формулой
СnH2n-6, в
молекулах которых
имеется хотя бы
одно бензольное
кольцо.
2
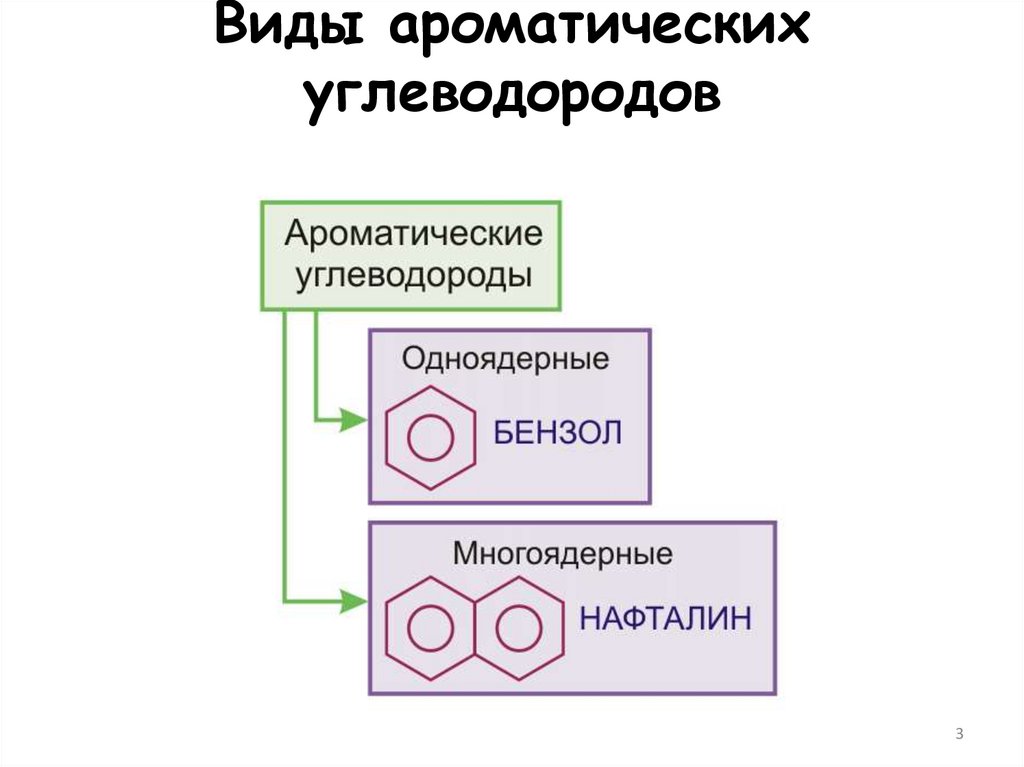
3. Виды ароматических углеводородов
34. Майкл Фарадей (1791 - 1867)
Майкл Фарадей
(1791 - 1867)
Английский физик и
химик, член Лондонского
королевского общества.
Один из основателей
количественной
электрохимии. В 1823 г.
впервые получил жидкие
хлор, сероводород, оксид
углерода(IV), аммиак,
оксид азота(IV). В 1825 г.
открыл бензол, изучил его
физические и некоторые
химические свойства.
Положил начало
исследованиям каучука. В
1833 - 1836 гг. установил
количественные законы
электролиза.
4
5. Фридрих Август Кекуле 1829 - 1896
Немецкий химикорганик. Предложил
структурную формулу
молекулы бензола. С
целью проверки гипотезы
о равноценности всех
шести атомов водорода в
молекуле бензола
получил его галоген-,
нитро-, амино-, и
карбоксипроизводные.
5
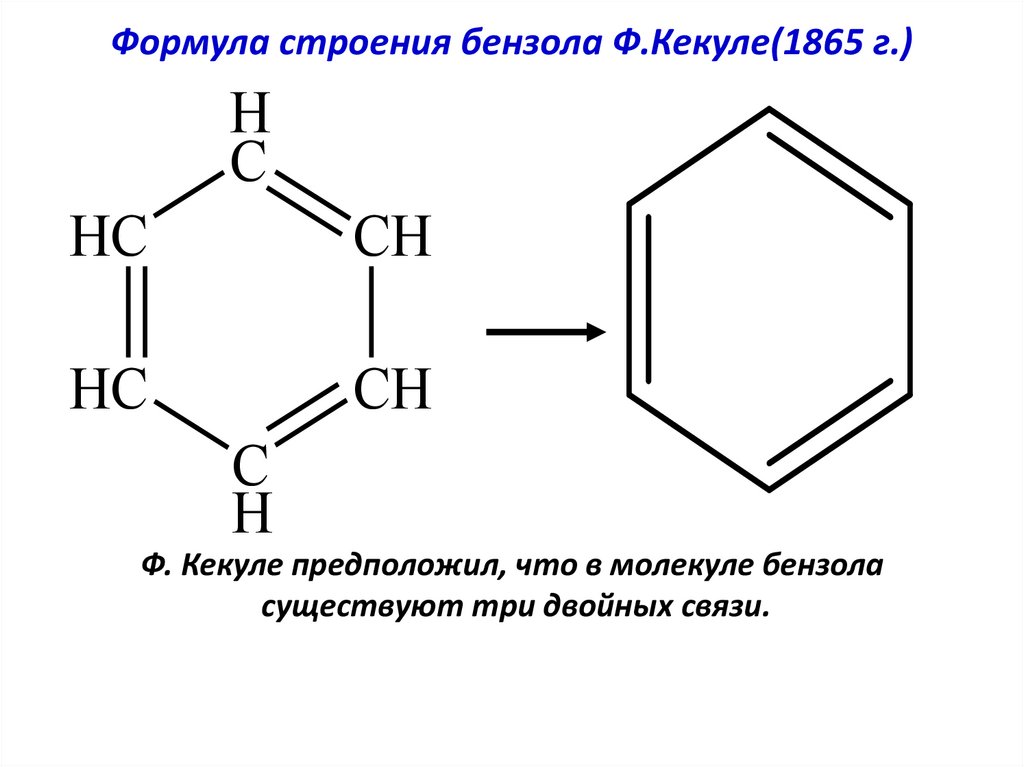
6. Формула строения бензола Ф.Кекуле(1865 г.)
HC
HC
CH
HC
CH
C
H
Ф. Кекуле предположил, что в молекуле бензола
существуют три двойных связи.
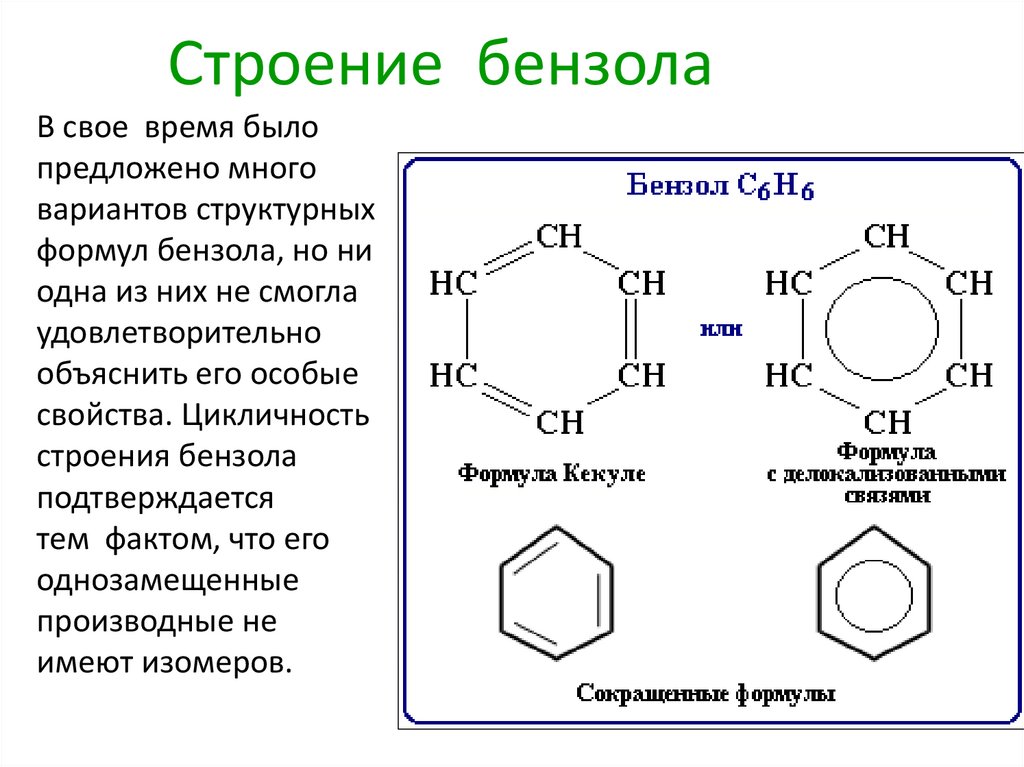
7. Строение бензола
В свое время былопредложено много
вариантов структурных
формул бензола, но ни
одна из них не смогла
удовлетворительно
объяснить его особые
свойства. Цикличность
строения бензола
подтверждается
тем фактом, что его
однозамещенные
производные не
имеют изомеров.
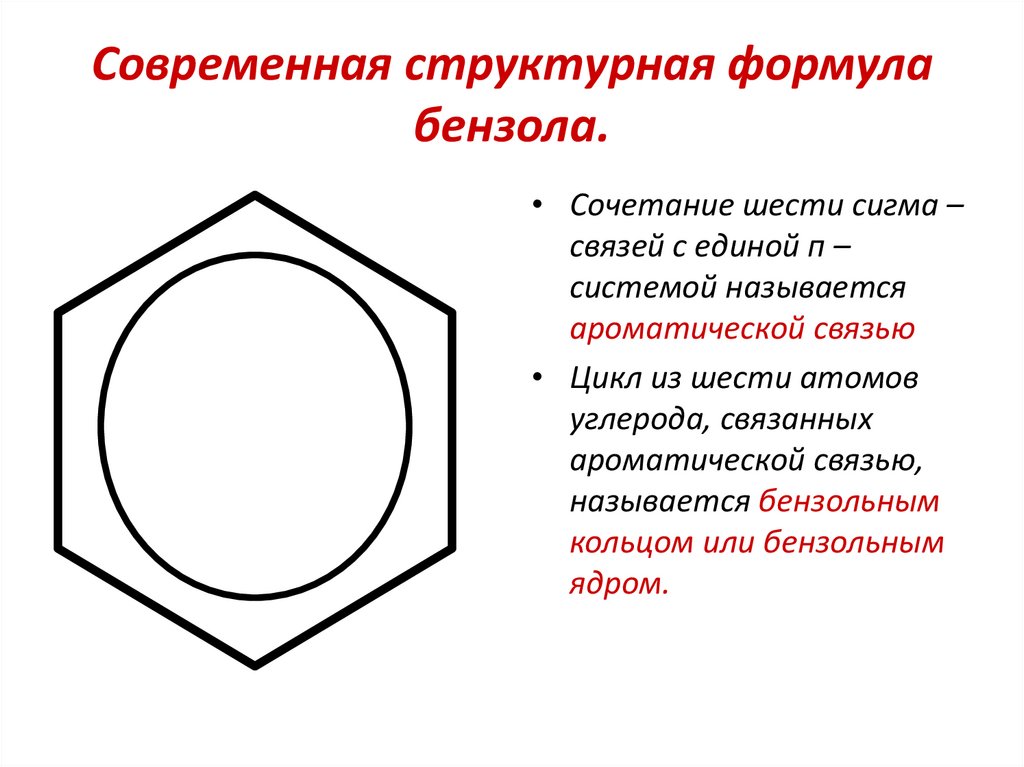
8. Современная структурная формула бензола.
• Сочетание шести сигма –связей с единой п –
системой называется
ароматической связью
• Цикл из шести атомов
углерода, связанных
ароматической связью,
называется бензольным
кольцом или бензольным
ядром.
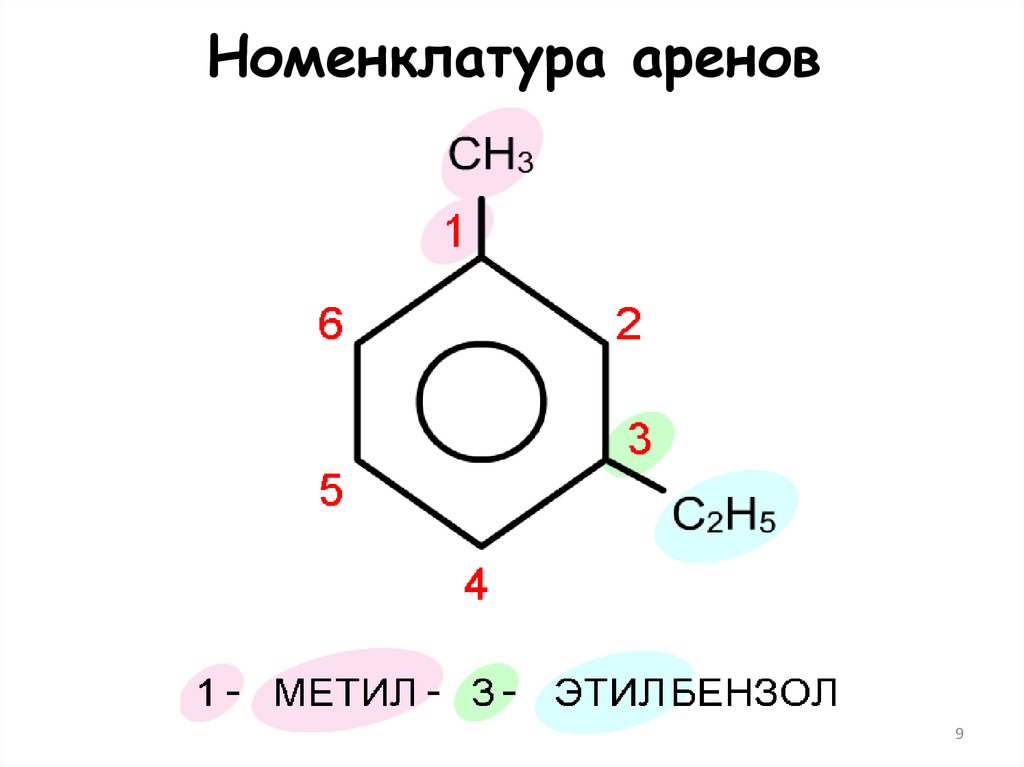
9. Номенклатура аренов
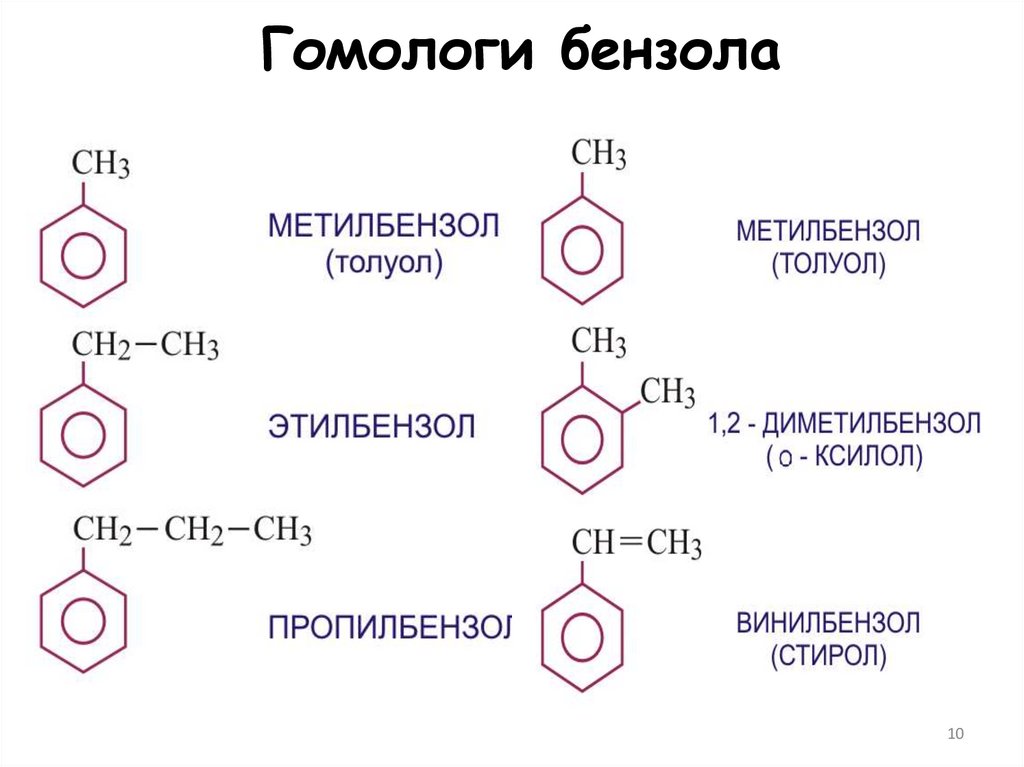
910. Гомологи бензола
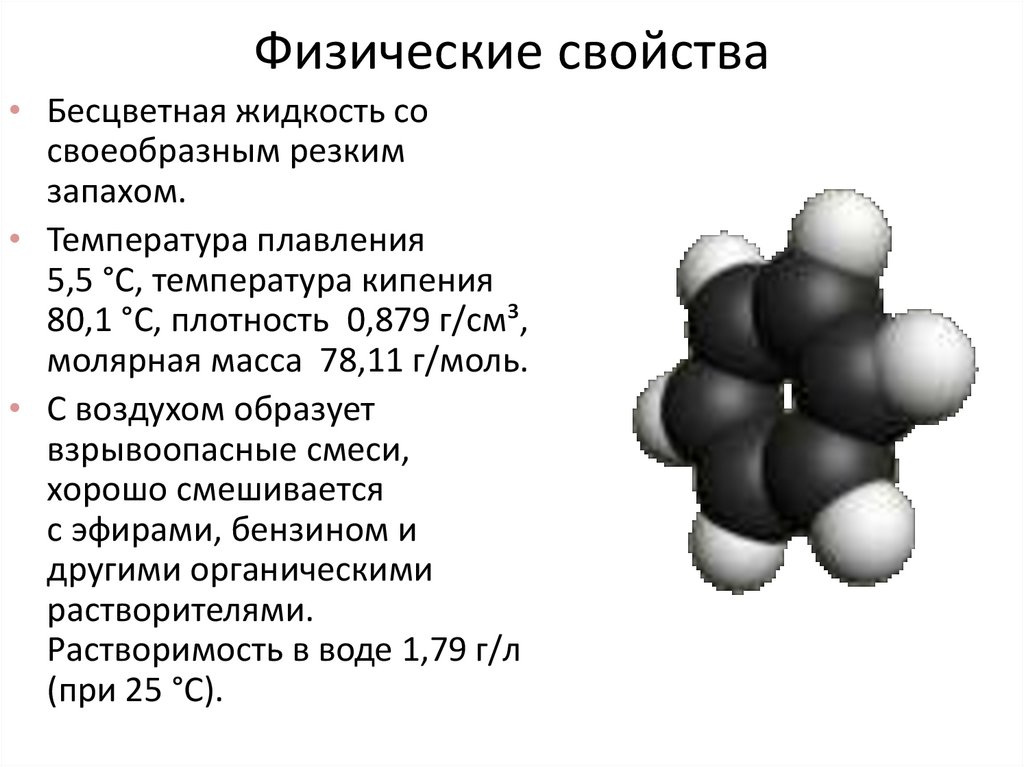
1011. Физические свойства
• Бесцветная жидкость сосвоеобразным резким
запахом.
• Температура плавления
5,5 °C, температура кипения
80,1 °C, плотность 0,879 г/см³,
молярная масса 78,11 г/моль.
• С воздухом образует
взрывоопасные смеси,
хорошо смешивается
с эфирами, бензином и
другими органическими
растворителями.
Растворимость в воде 1,79 г/л
(при 25 °C).
12.
1213. Способы получения аренов
1314.
Арены получают главным образом при сухой
перегонке каменного угля. При нагревании
каменного угля в ретортах или коксовальных печах
без доступа воздуха при 1000 – 1300 0С происходит
разложение органических веществ каменного угля с
образованием твердых, жидких и газообразных
продуктов.
• Альтернативным источником получения аренов
служит древесина. В самой древесине аренов нет,
однако при ее пиролизе они образуются и могут быть
выделены.
• В странах богатых нефтью арены получают при ее
переработке. Нефтяные продукты нагревают при
температуре 700 0С, в результате чего из продуктов
разложения нефти удается получить 15-18% аренов.
14
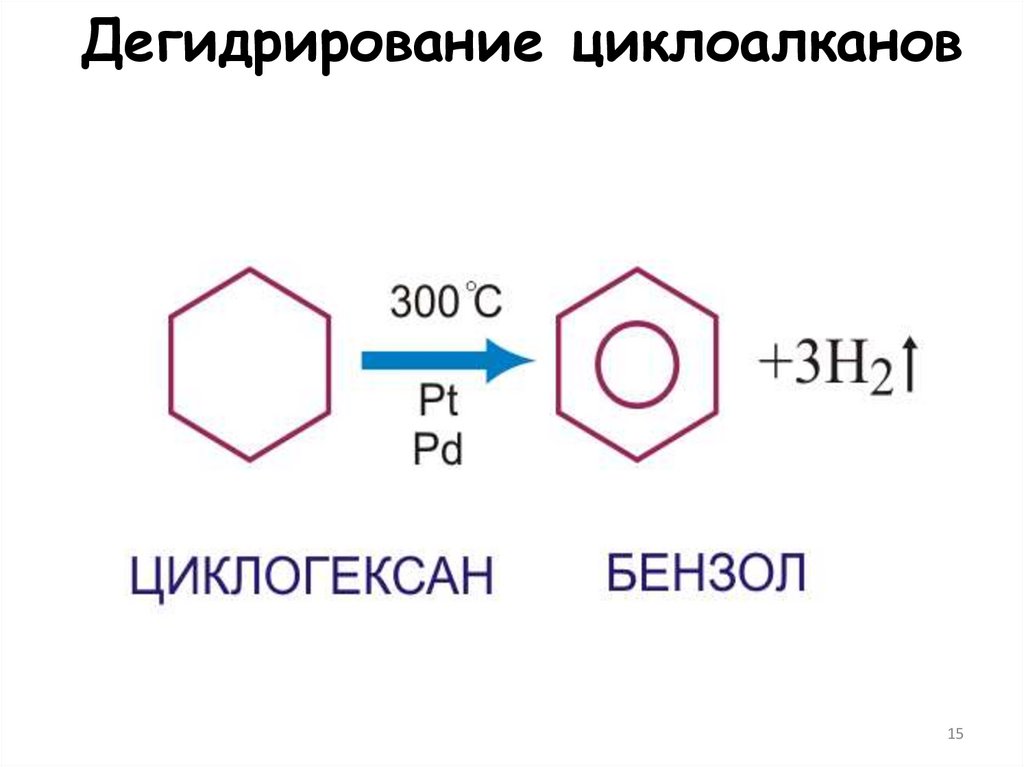
15. Дегидрирование циклоалканов
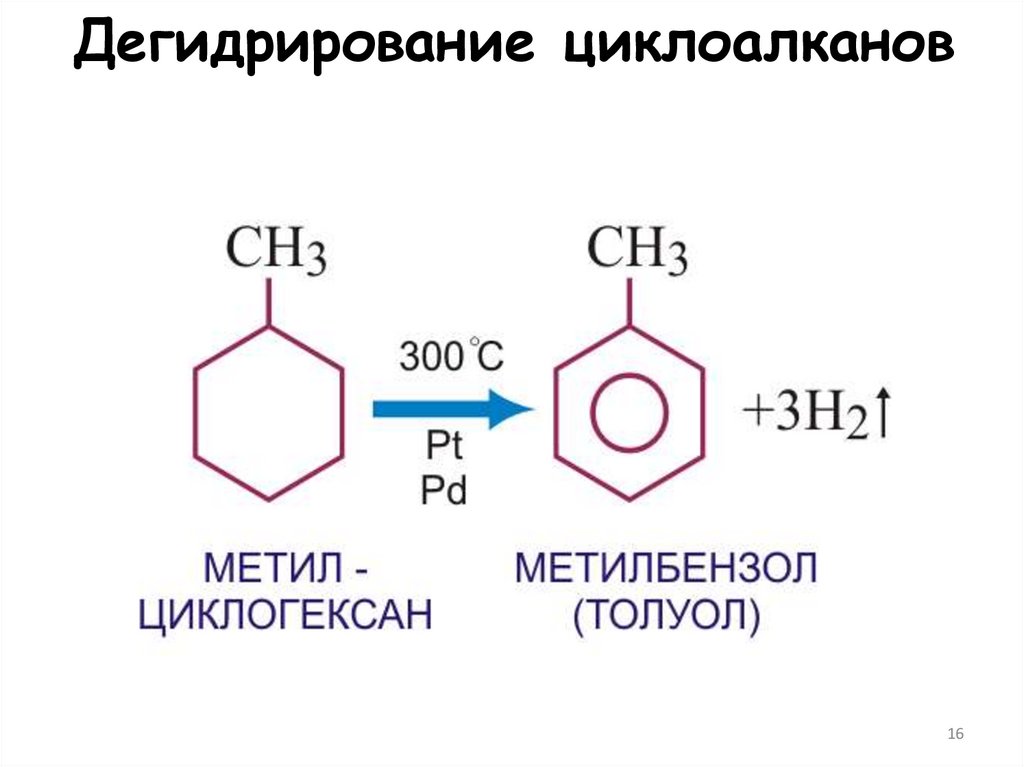
1516. Дегидрирование циклоалканов
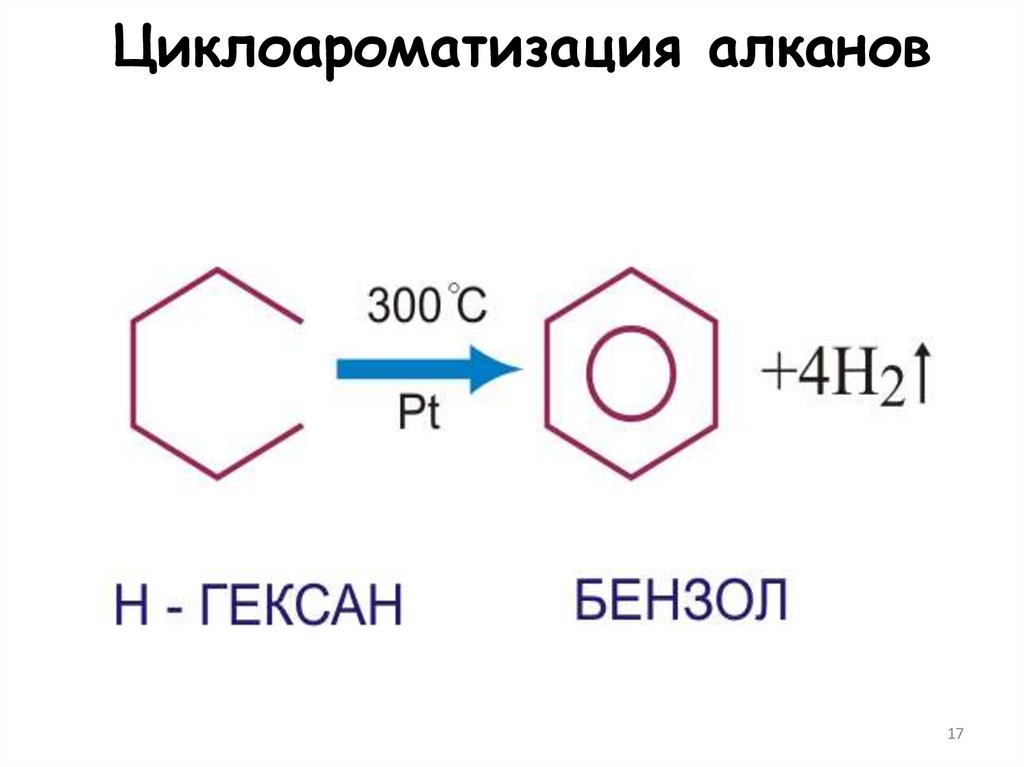
1617. Циклоароматизация алканов
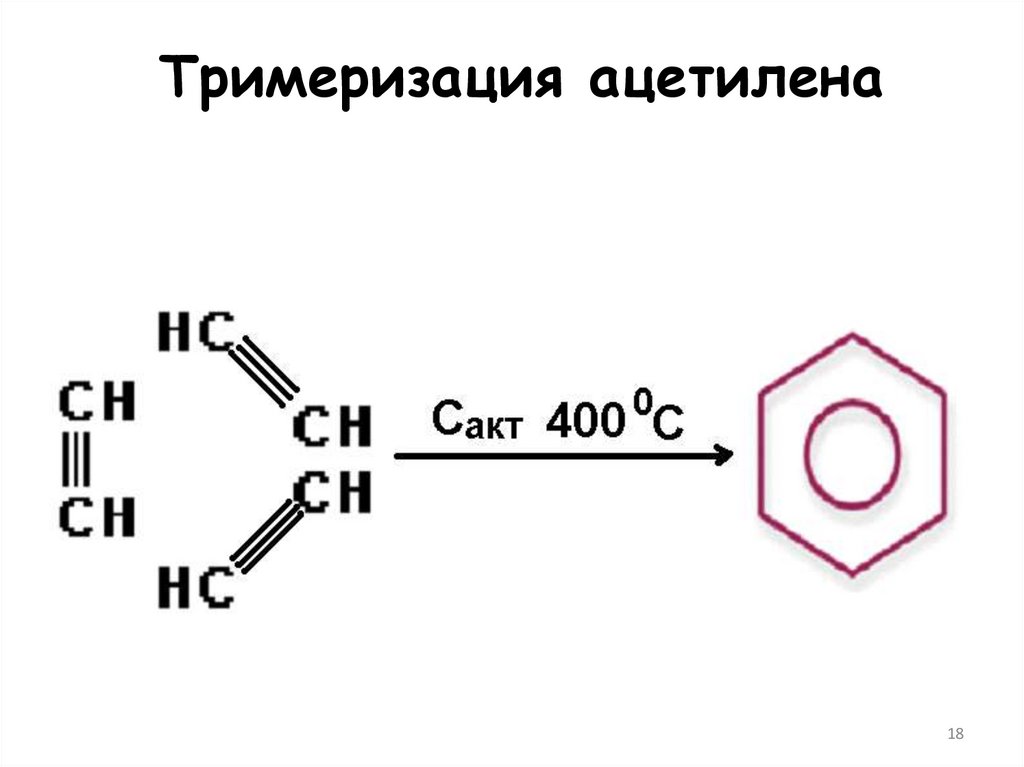
1718. Тримеризация ацетилена
1819. Химические свойства
1. Подобно ненасыщенным углеводородам бензолгорит сильно коптящим пламенем.
2С6Н6 + 15О2 12 СО2 + 6 Н2О
2. Реакции замещения (хлорирование) в
присутствии катализатора (FeCl3)
С6H6 + Cl2 → С6H5Cl + HCl образуется хлорбензол
(фенилхлорид ).
3. В отсутствие катализатора при нагревании или
освещении идёт радикальная реакция
присоединения.
С6H6 + 3Cl2 (освещение)→ C6H6Cl6 образуется
гексахлорциклогексан.
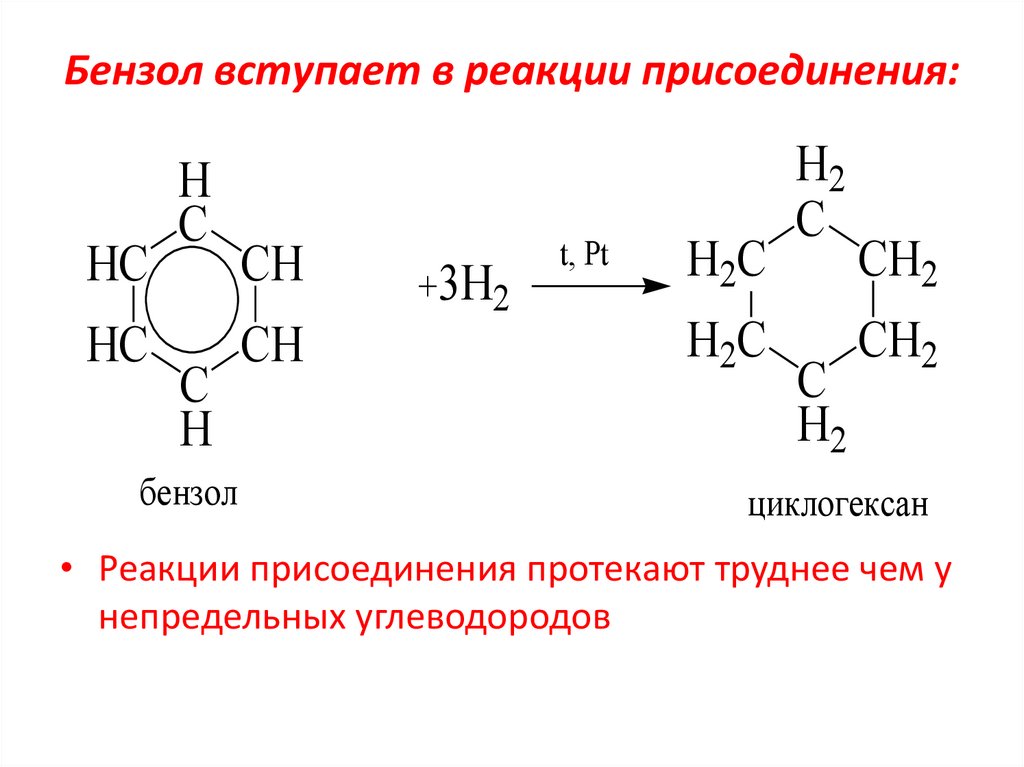
20. Бензол вступает в реакции присоединения:
HCHC
H
C
C
H
бензол
CH
CH
+3H2
t, Pt
H2C
H2C
H2
C
C
H2
CH2
CH2
циклогексан
• Реакции присоединения протекают труднее чем у
непредельных углеводородов
21.
4. Взаимодействие с галогенопроизводнымиалканов (алкилирование бензола, реакция
Фриделя-Крафтса) в присутствии AlCl3 :
С6H6 + С2H5Cl → С6H5С2H5 + HCl образуется
этилбензол
5. Реакция нитрования в присутствии
концентрированной серной кислоты
С6H6 + HNO3 → С6H5NO2 + H2O образуется
нитробензол.
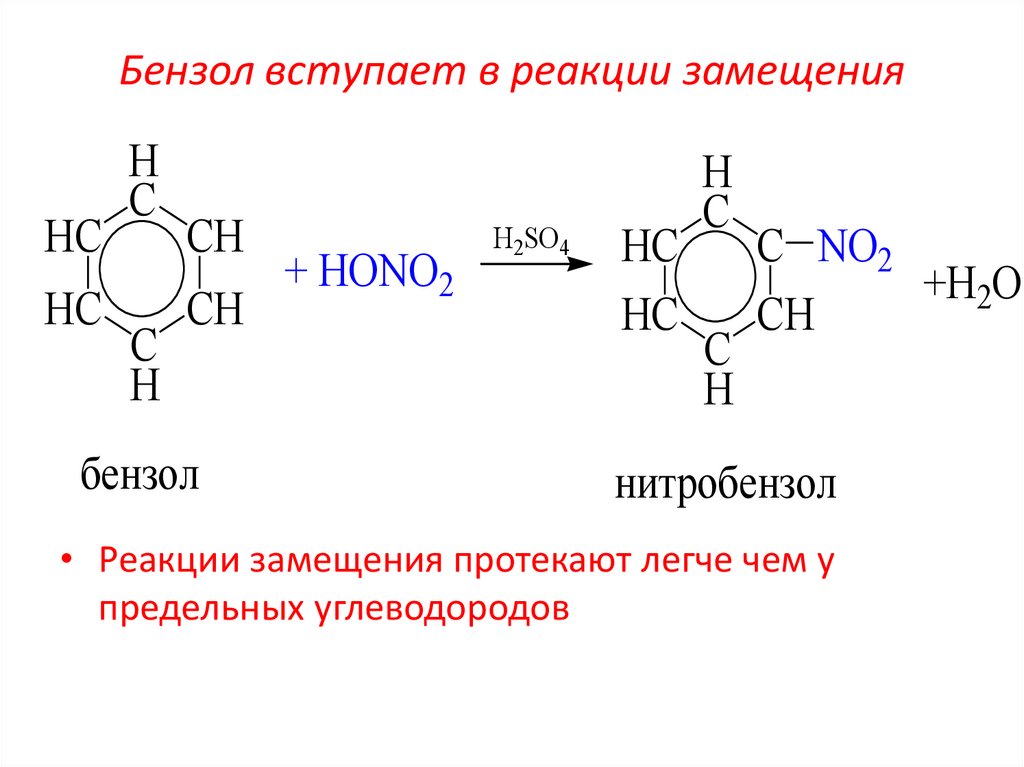
22. Бензол вступает в реакции замещения
HCHC
H
C
C
H
CH
CH
бензол
+ HONO2
H2SO4
HC
HC
H
C
C
H
С NO2
+H2O
CH
нитробензол
• Реакции замещения протекают легче чем у
предельных углеводородов
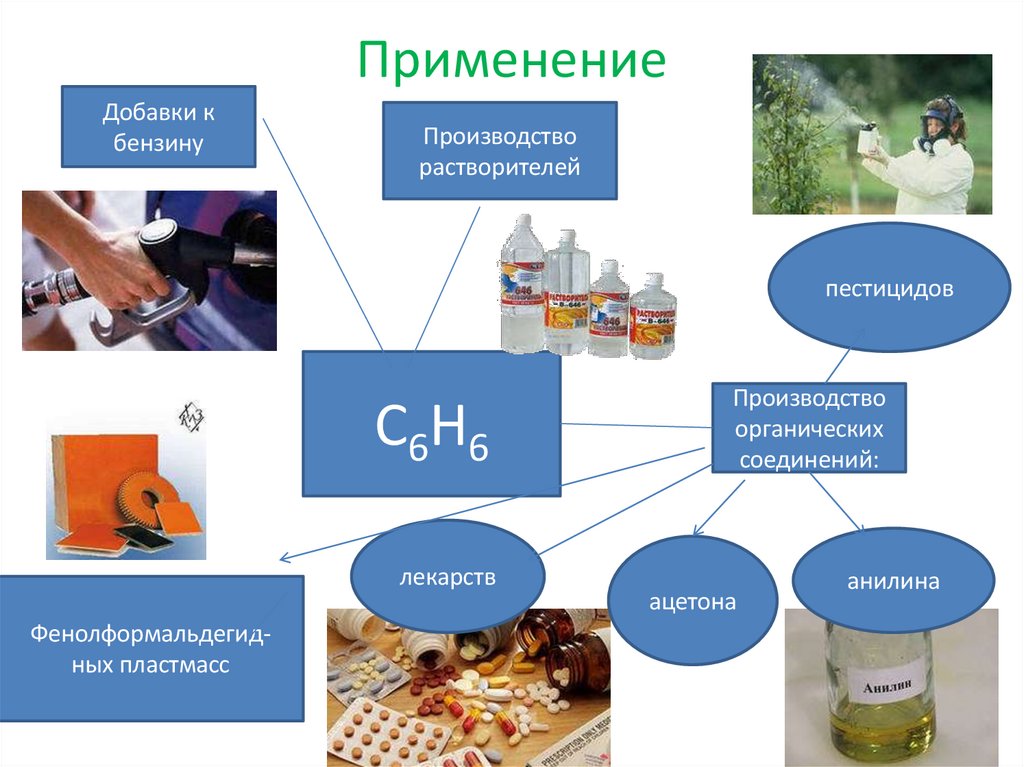
23. Применение
Добавки кбензину
Производство
растворителей
пестицидов
С6Н6
лекарств
Фенолформальдегидных пластмасс
Производство
органических
соединений:
ацетона
анилина
24.
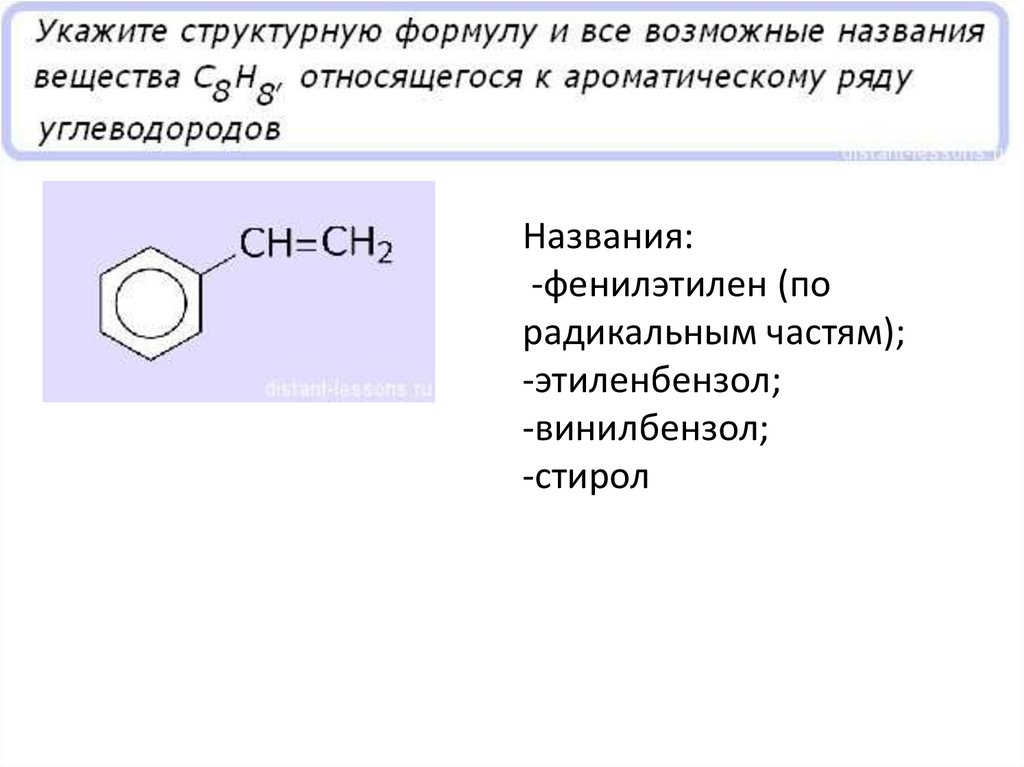
Названия:-фенилэтилен (по
радикальным частям);
-этиленбензол;
-винилбензол;
-стирол
25.
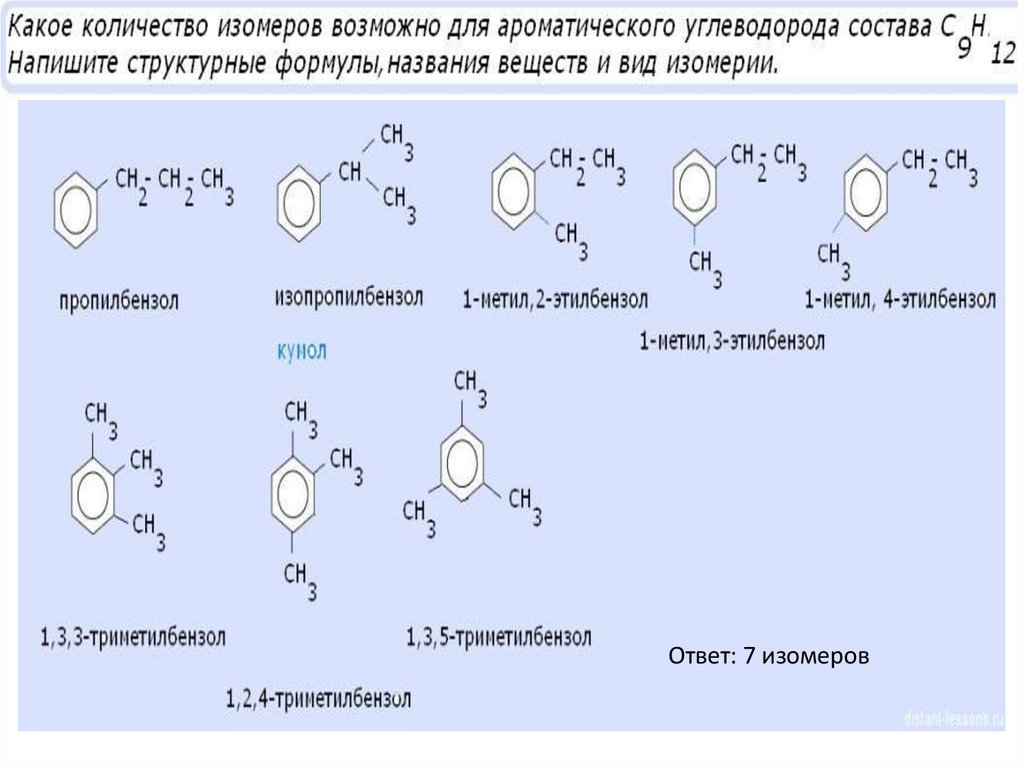
Ответ: 7 изомеров26.
По относительной плотности определяем молекулярную массуарена:
Mr(CnH2n-6) = D·Mr(воздуха) = 4.62 · 29 г\моль = 134 г\моль
Подставляем в общую формулу значения атомных масс:
12n + 2n — 6 = 134
n=10
C10H14









 Химия
Химия








