Похожие презентации:
Ароматические углеводороды (лекция 10)
1.
Ароматическиеуглеводороды
2.
• Гибридное состояние атома углерода в молекуле в большойстепени определяет химическое поведение соединения.
• Алканы, образованные sp3-гибридными атомами углерода,
инертны по отношению к большинству реагентов.
• Производные этилена имеют склонность к присоединению
электрофильных реагентов, что приводит к разрушению πсвязи и образованию более устойчивых σ-связей.
• Химические свойства пространственно ненапряженных
циклоалканов почти не отличаются от свойств этана, пропана
и т.д. Аналогично, довольно близкую реакционную
способность имеют бутадиен и циклогексадиен.
• Поведение циклических соединений, скелет которых
образован исключительно sp2-гибридными атомами,
зачастую принципиально отличается от свойств их линейных
аналогов.
• Своеобразие свойств этих соединений заставило выделить их
в отдельный класс ароматических соединений.
Происхождение этого названия связано с тем, что многие из
представителей ряда имеют специфический, зачастую
приятный, аромат.
3.
• Ароматические соединения (арены) –циклические органические соединения, которые
имеют в своём составе ароматическую систему.
• Основными отличительными свойствами
являются повышенная устойчивость
ароматической системы и, несмотря на
ненасыщенность, склонность к реакциям
замещения, а не присоединения.
4.
Открытие бензола• Впервые бензолсодержащие смеси,
образующиеся в результате перегонки
каменноугольной смолы, описал
немецкий химик Иоганн Глаубер в
книге Furni novi philosophici,
опубликованной в 1651 году.
• Бензол как индивидуальное вещество
был описан Майклом Фарадеем,
выделившим это вещество в 1825 году
из конденсата светильного газа,
получаемого коксованием угля.
• В 1833 году, получил бензол при сухой
перегонке кальциевой соли бензойной
кислоты немецкий физико-химик
Эйльгард Мичерлих. Именно после
этого получения вещество стали
называть бензолом.
5.
Открытие бензола• Изучением бензола серьёзно
занялся немецкий химик
Фридрих Август Кекуле,
которому в 1865 году и
удалось предложить
правильную – циклическую
формулу этого соединения.
• Ф. Кекуле представлял в своём
воображении бензол в виде
змеи из шести атомов
углерода. Идея же о
цикличности соединения
пришла ему во сне, когда
воображаемая змея укусила
себя за хвост.
6.
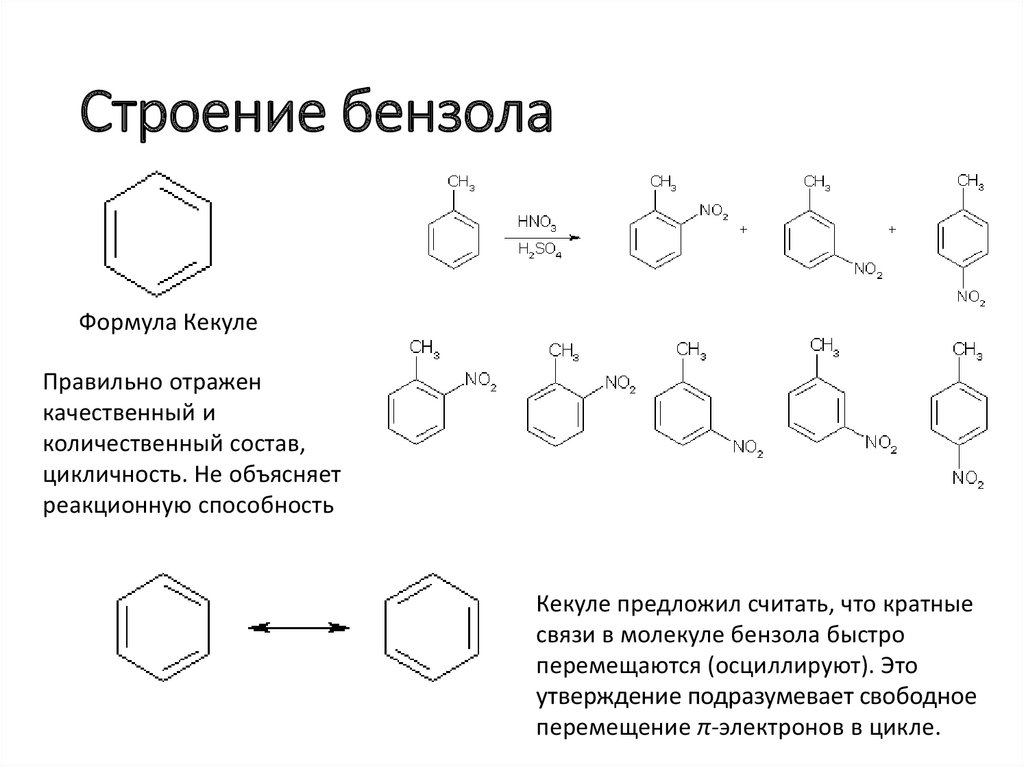
Строение бензолаФормула Кекуле
Правильно отражен
качественный и
количественный состав,
цикличность. Не объясняет
реакционную способность
Кекуле предложил считать, что кратные
связи в молекуле бензола быстро
перемещаются (осциллируют). Это
утверждение подразумевает свободное
перемещение π-электронов в цикле.
7.
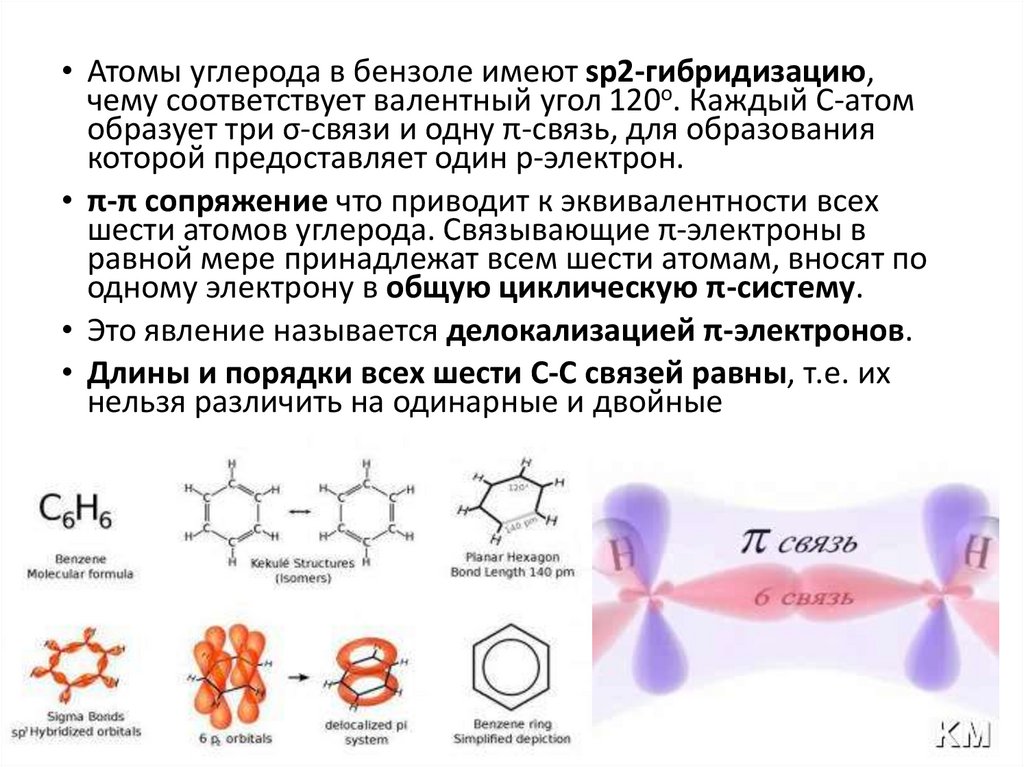
• Атомы углерода в бензоле имеют sp2-гибридизацию,чему соответствует валентный угол 120о. Каждый С-атом
образует три σ-связи и одну π-связь, для образования
которой предоставляет один р-электрон.
• π-π сопряжение что приводит к эквивалентности всех
шести атомов углерода. Связывающие π-электроны в
равной мере принадлежат всем шести атомам, вносят по
одному электрону в общую циклическую π-систему.
• Это явление называется делокализацией π-электронов.
• Длины и порядки всех шести С-С связей равны, т.е. их
нельзя различить на одинарные и двойные
8.
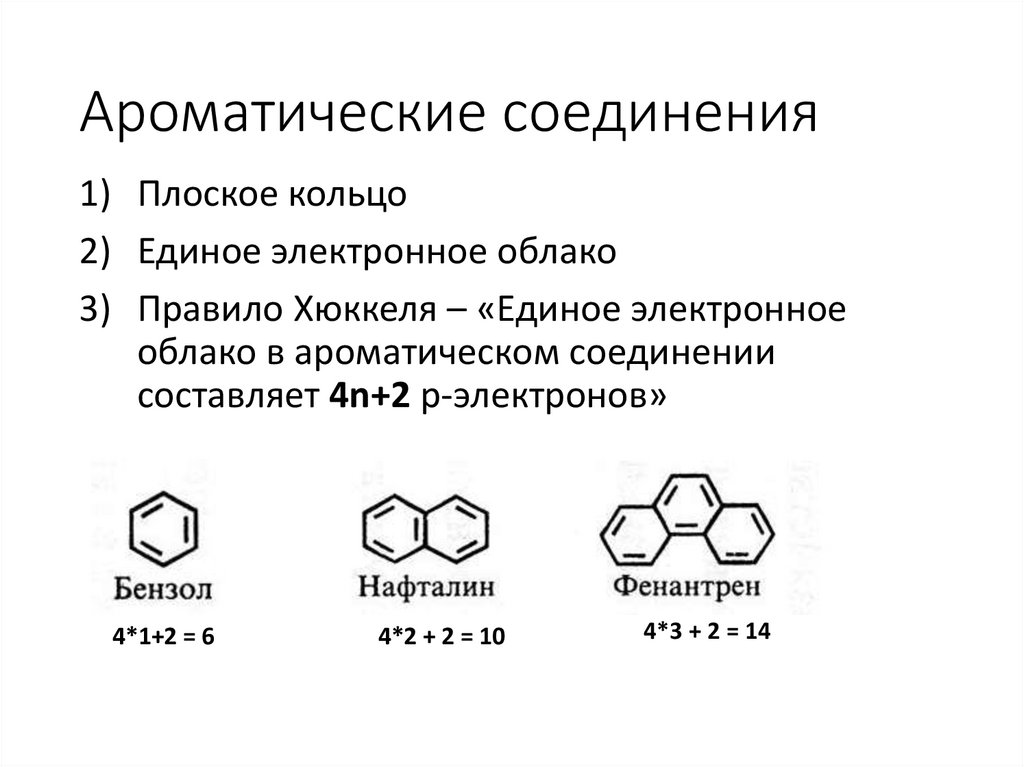
Ароматические соединения1) Плоское кольцо
2) Единое электронное облако
3) Правило Хюккеля – «Единое электронное
облако в ароматическом соединении
составляет 4n+2 p-электронов»
4*1+2 = 6
4*2 + 2 = 10
4*3 + 2 = 14
9.
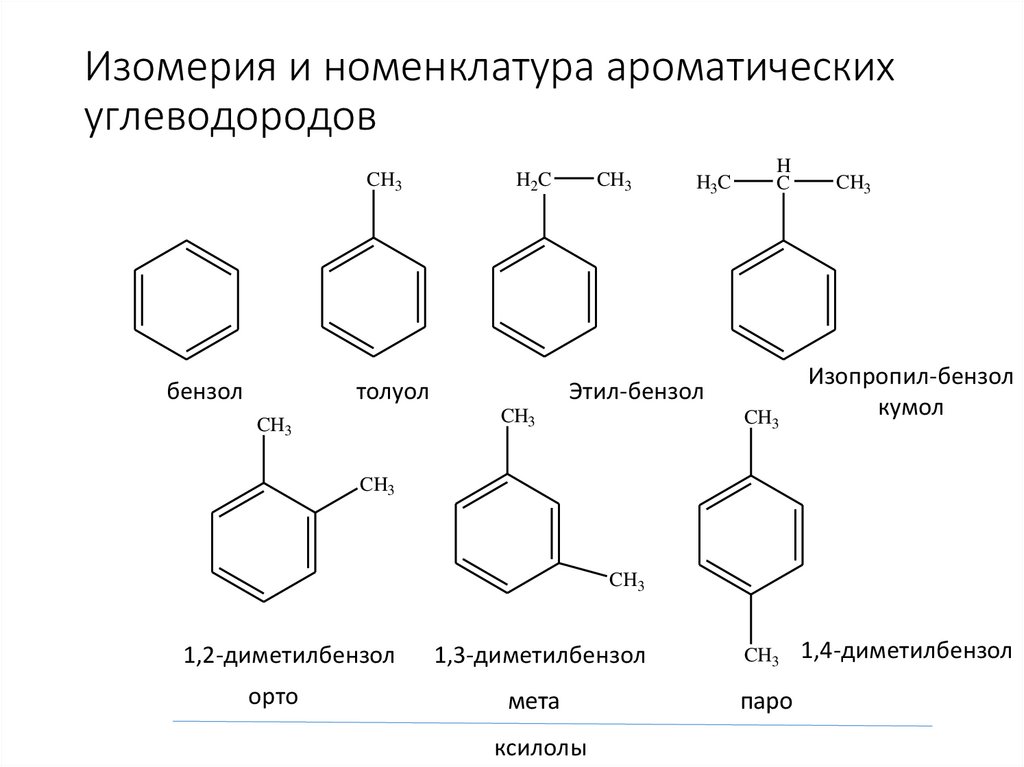
Изомерия и номенклатура ароматическихуглеводородов
CH3
бензол
H2C
толуол
CH3
H
C
Этил-бензол
CH3
CH3
H3C
CH3
CH3
Изопропил-бензол
кумол
CH3
CH3
1,2-диметилбензол
орто
1,3-диметилбензол
CH3
мета
паро
ксилолы
1,4-диметилбензол
10.
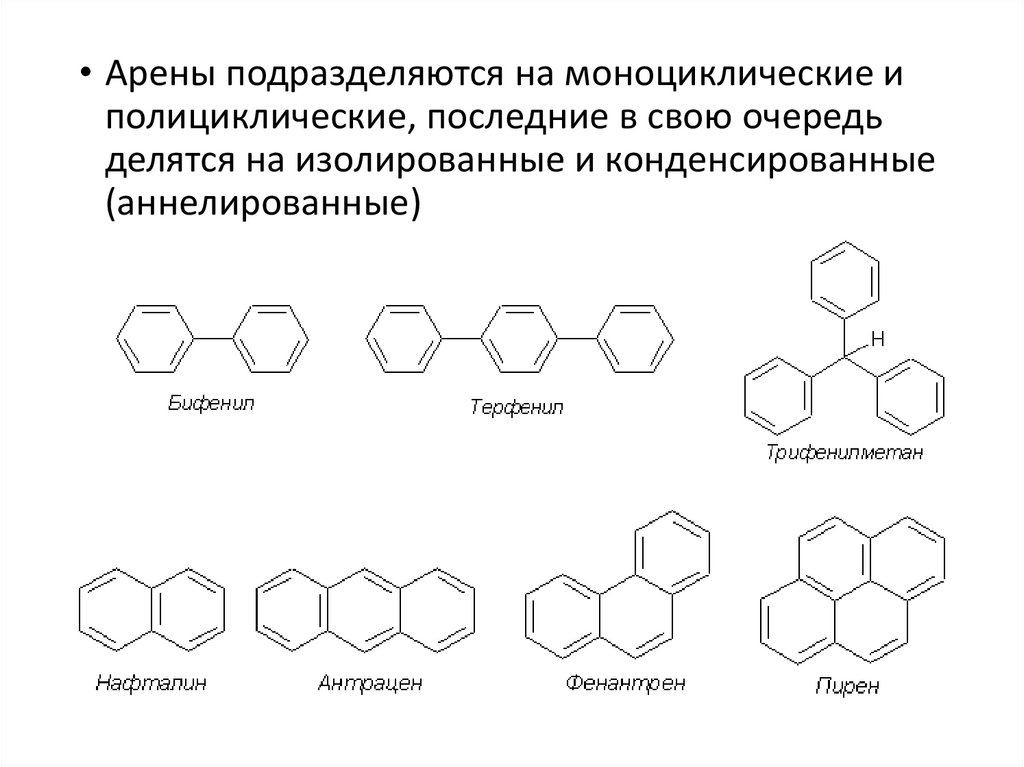
• Арены подразделяются на моноциклические иполициклические, последние в свою очередь
делятся на изолированные и конденсированные
(аннелированные)
11.
Получение ароматическихулеводородов
1) Из природных объектов. Перегонкой каменного
угля – фракции каменноугольной смолы
Название фракции
Температура
кипения, 0С
Состав
Легкое масло
170
Бензол, толуол, ксилол,
стирол, этилбензол
Среднее масло
170-240
Метилбензолы,
нафталин, фенол,
хинолин
Тяжелое масло
240-20
Метилнафталины,
фенол, крезол,
дифенил, флюорен
Антраценовое
масло
270-320
Антрацен,
метилантрацен,
фенантрен
12.
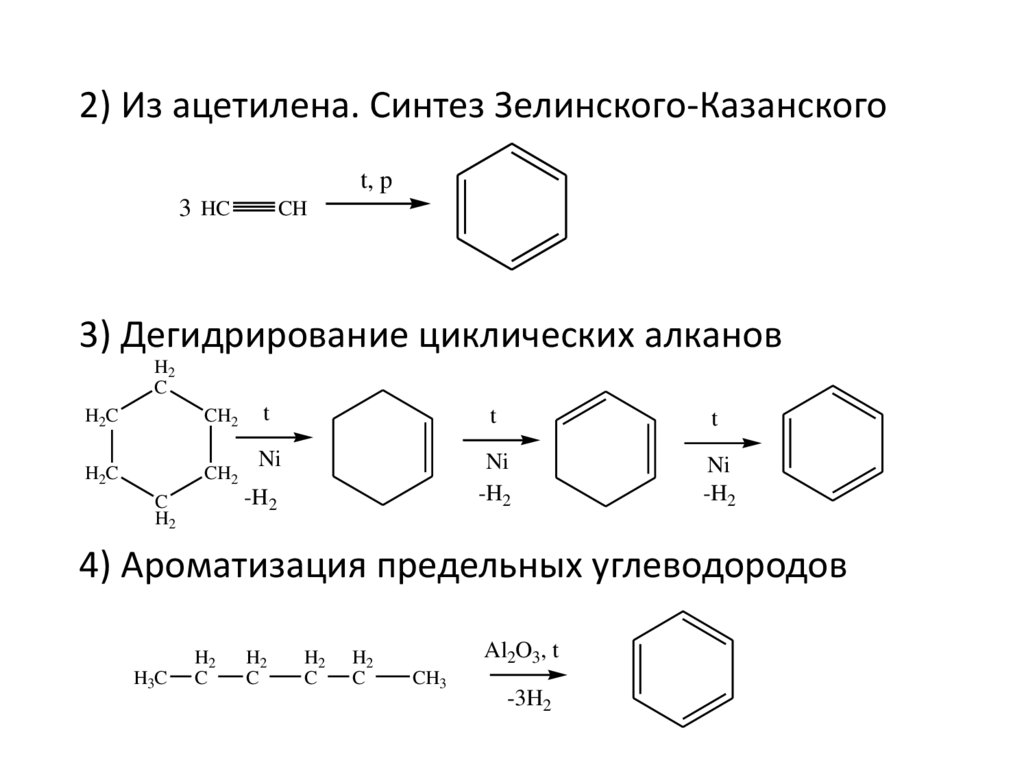
2) Из ацетилена. Синтез Зелинского-Казанскогоt, p
3 HC
CH
3) Дегидрирование циклических алканов
H2
C
H2C
CH2
H2C
CH2
t
t
t
Ni
Ni
-H2
Ni
-H2
-H2
C
H2
4) Ароматизация предельных углеводородов
H3C
H2
C
H2
C
H2
C
H2
C
Al2O3, t
CH3
-3H2
13.
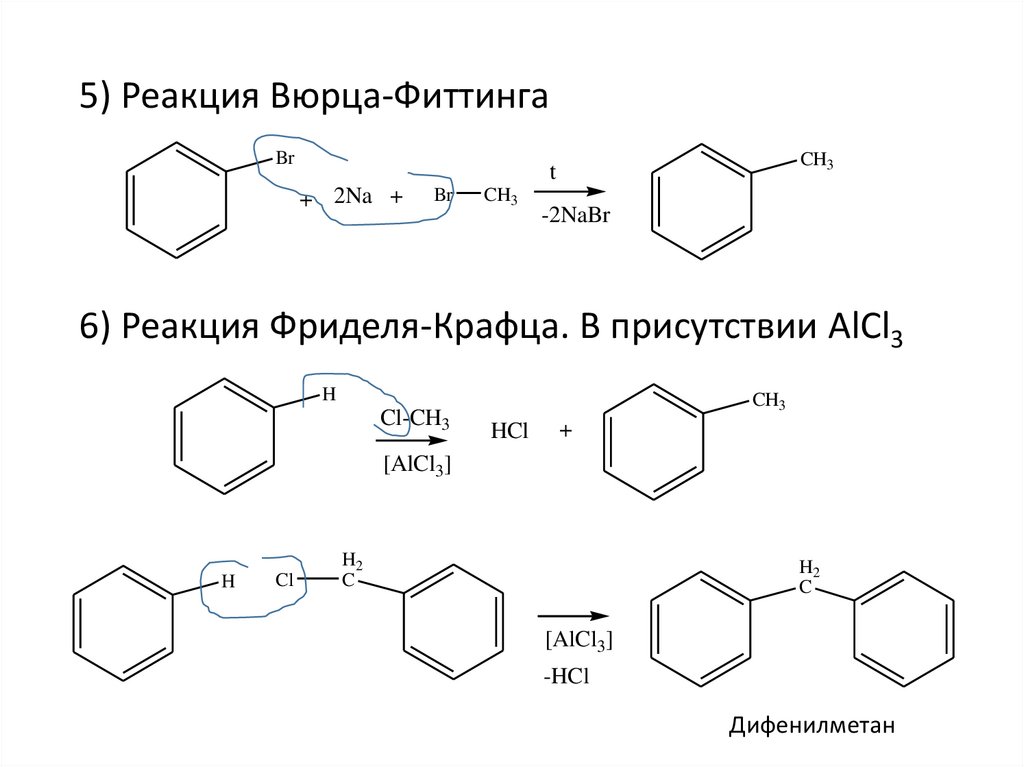
5) Реакция Вюрца-ФиттингаBr
CH3
t
+ 2Na +
Br
CH3
-2NaBr
6) Реакция Фриделя-Крафца. В присутствии AlCl3
H
Cl-CH3
CH3
HCl
+
[AlCl3]
H
Cl
H2
C
H2
C
[AlCl3]
-HCl
Дифенилметан
14.
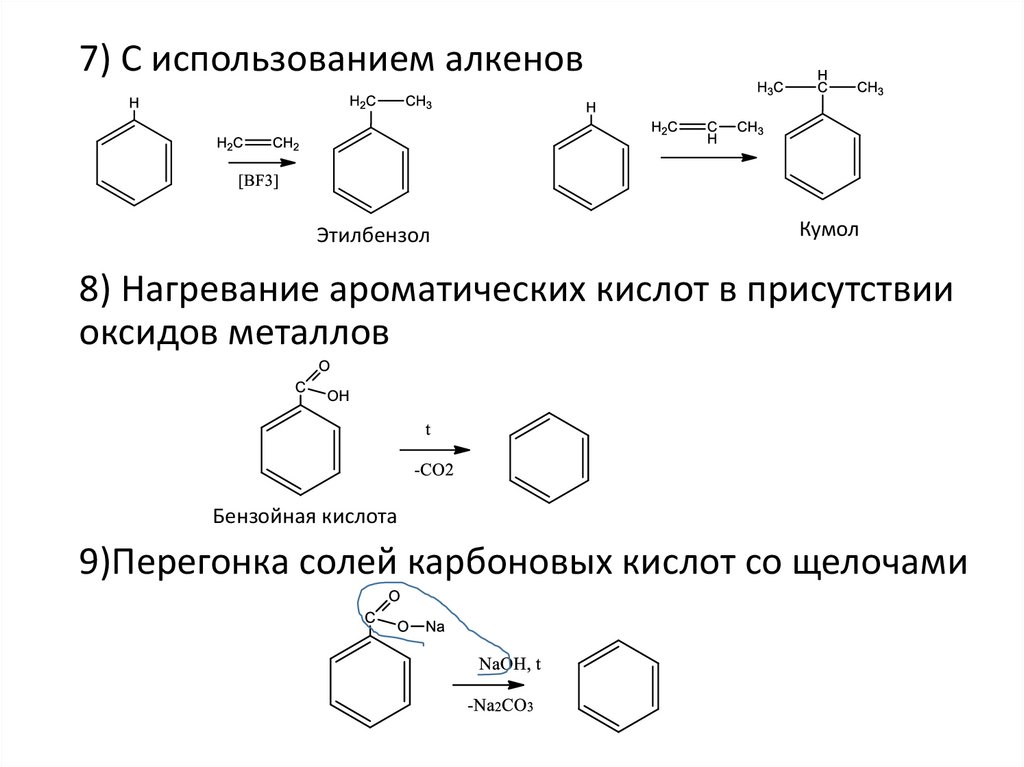
7) С использованием алкеновЭтилбензол
Кумол
8) Нагревание ароматических кислот в присутствии
оксидов металлов
Бензойная кислота
9)Перегонка солей карбоновых кислот со щелочами
15.
Физические свойства• Жидкости или твердые вещества со
специфическим запахом
• Плотность аренов выше, чем
циклоалканов
• Нерастворимы в воде, с
органическими углеводородами
смешиваются в любых соотношениях
• Температуры кипения изомеров
отличаются незначительно, изомеры
с несколькими радикалами кипят
при более высокой температуре
• Вдыхание паров ароматических
углеводородов вызывает
отравление, токсичны, канцерогенны
16.
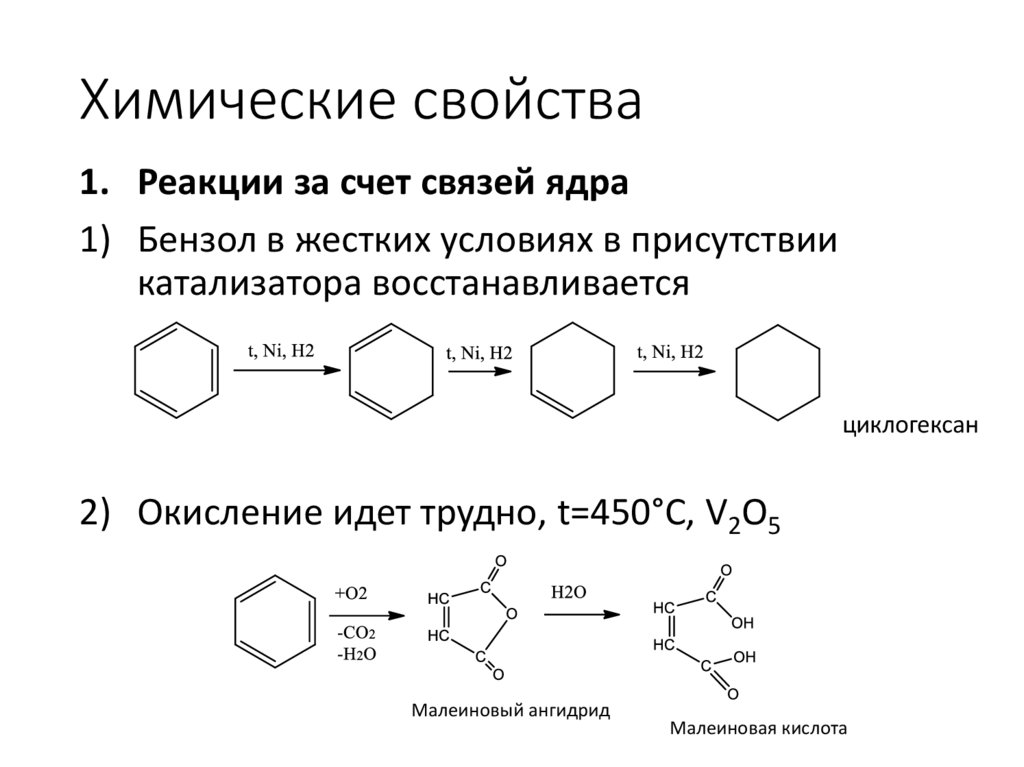
Химические свойства1. Реакции за счет связей ядра
1) Бензол в жестких условиях в присутствии
катализатора восстанавливается
циклогексан
2) Окисление идет трудно, t=450°C, V2O5
Малеиновый ангидрид
Малеиновая кислота
17.
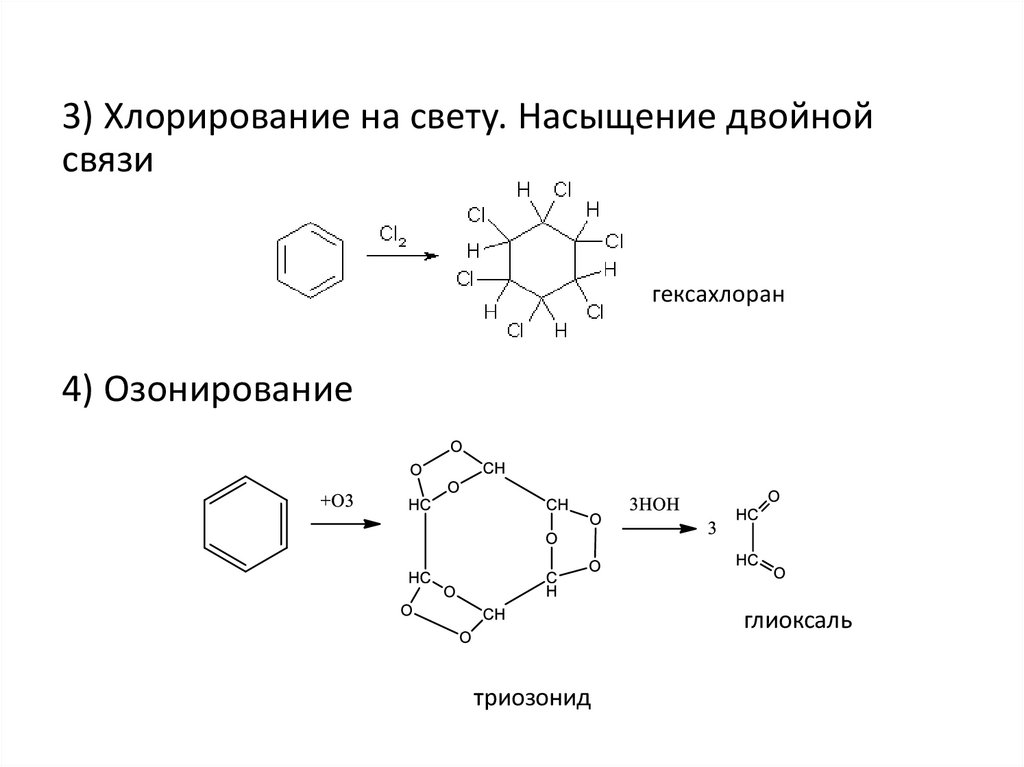
3) Хлорирование на свету. Насыщение двойнойсвязи
гексахлоран
4) Озонирование
глиоксаль
триозонид
18.
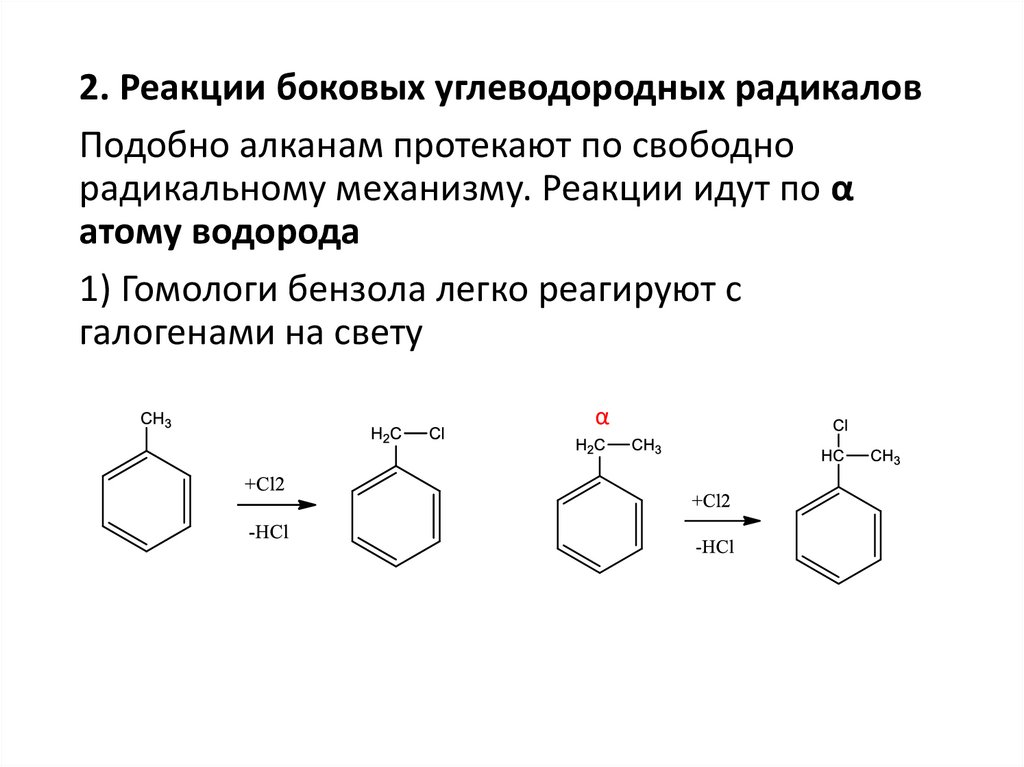
2. Реакции боковых углеводородных радикаловПодобно алканам протекают по свободно
радикальному механизму. Реакции идут по α
атому водорода
1) Гомологи бензола легко реагируют с
галогенами на свету
α
19.
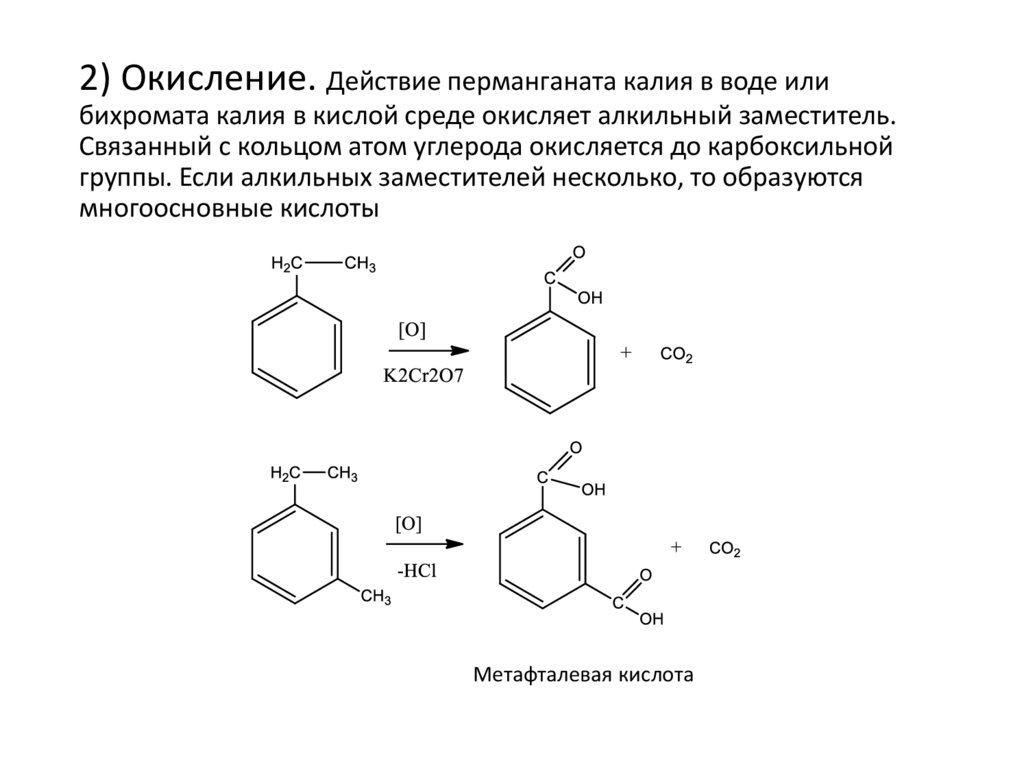
2) Окисление. Действие перманганата калия в воде илибихромата калия в кислой среде окисляет алкильный заместитель.
Связанный с кольцом атом углерода окисляется до карбоксильной
группы. Если алкильных заместителей несколько, то образуются
многоосновные кислоты
Метафталевая кислота
20.
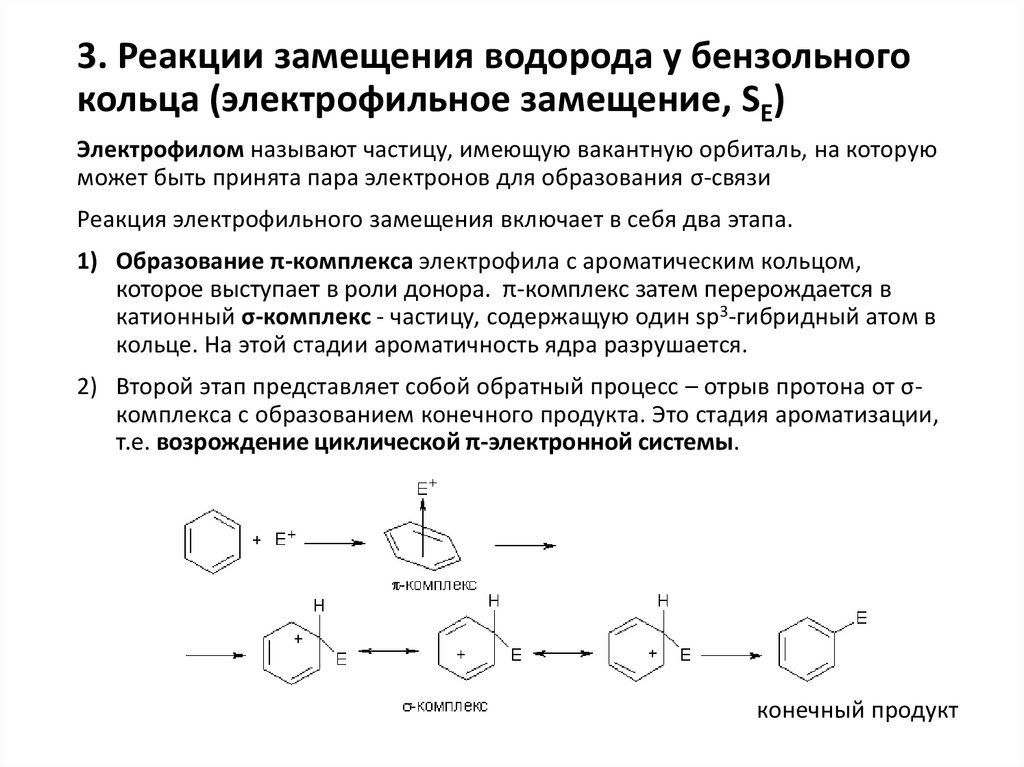
3. Реакции замещения водорода у бензольногокольца (электрофильное замещение, SE)
Электрофилом называют частицу, имеющую вакантную орбиталь, на которую
может быть принята пара электронов для образования σ-связи
Реакция электрофильного замещения включает в себя два этапа.
1) Образование π-комплекса электрофила с ароматическим кольцом,
которое выступает в роли донора. π-комплекс затем перерождается в
катионный σ-комплекс - частицу, содержащую один sp3-гибридный атом в
кольце. На этой стадии ароматичность ядра разрушается.
2) Второй этап представляет собой обратный процесс – отрыв протона от σкомплекса с образованием конечного продукта. Это стадия ароматизации,
т.е. возрождение циклической π-электронной системы.
конечный продукт
21.
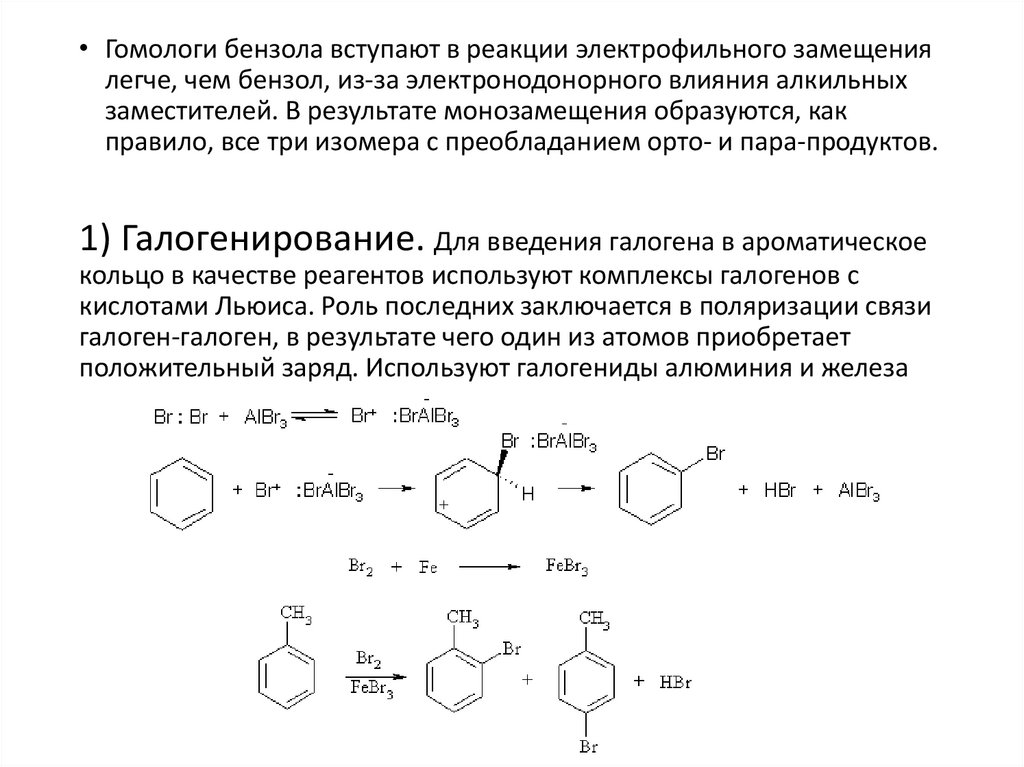
• Гомологи бензола вступают в реакции электрофильного замещениялегче, чем бензол, из-за электронодонорного влияния алкильных
заместителей. В результате монозамещения образуются, как
правило, все три изомера с преобладанием орто- и пара-продуктов.
1) Галогенирование. Для введения галогена в ароматическое
кольцо в качестве реагентов используют комплексы галогенов с
кислотами Льюиса. Роль последних заключается в поляризации связи
галоген-галоген, в результате чего один из атомов приобретает
положительный заряд. Используют галогениды алюминия и железа
22.
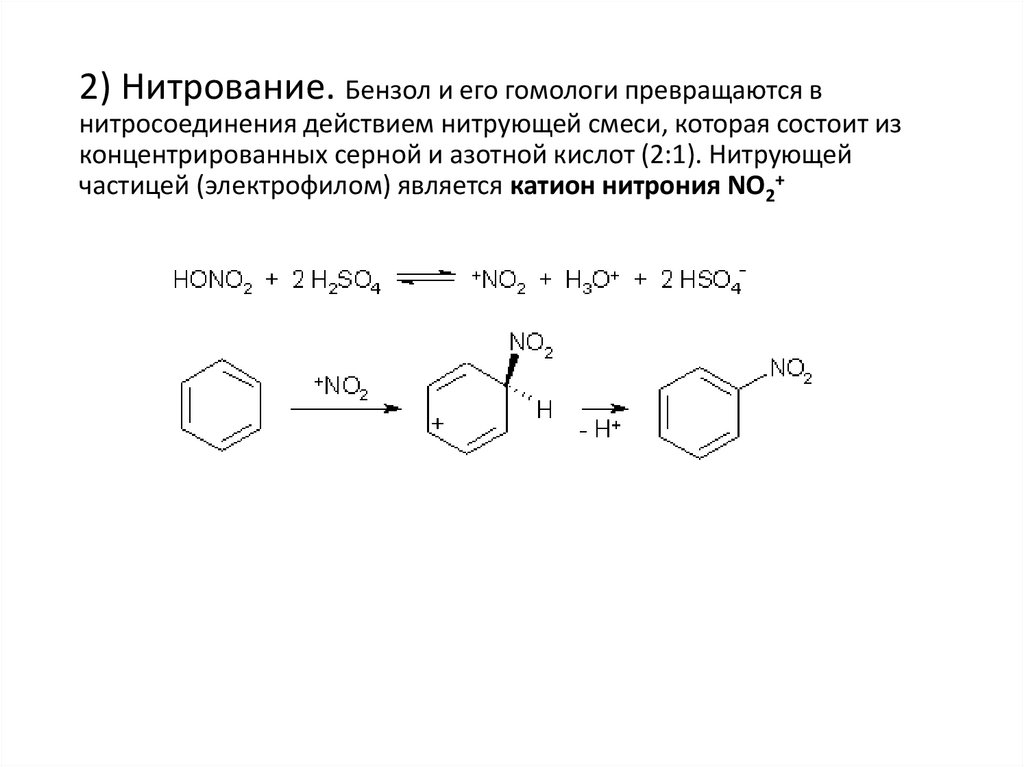
2) Нитрование. Бензол и его гомологи превращаются внитросоединения действием нитрующей смеси, которая состоит из
концентрированных серной и азотной кислот (2:1). Нитрующей
частицей (электрофилом) является катион нитрония NO2+
23.
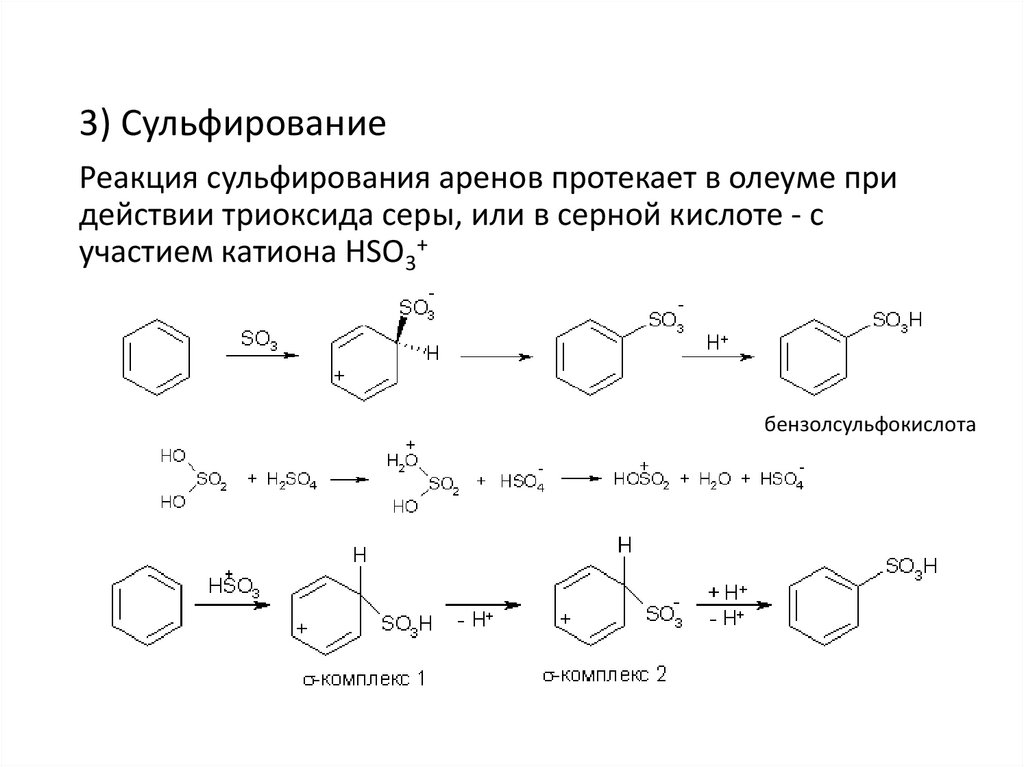
3) СульфированиеРеакция сульфирования аренов протекает в олеуме при
действии триоксида серы, или в серной кислоте - с
участием катиона HSO3+
бензолсульфокислота
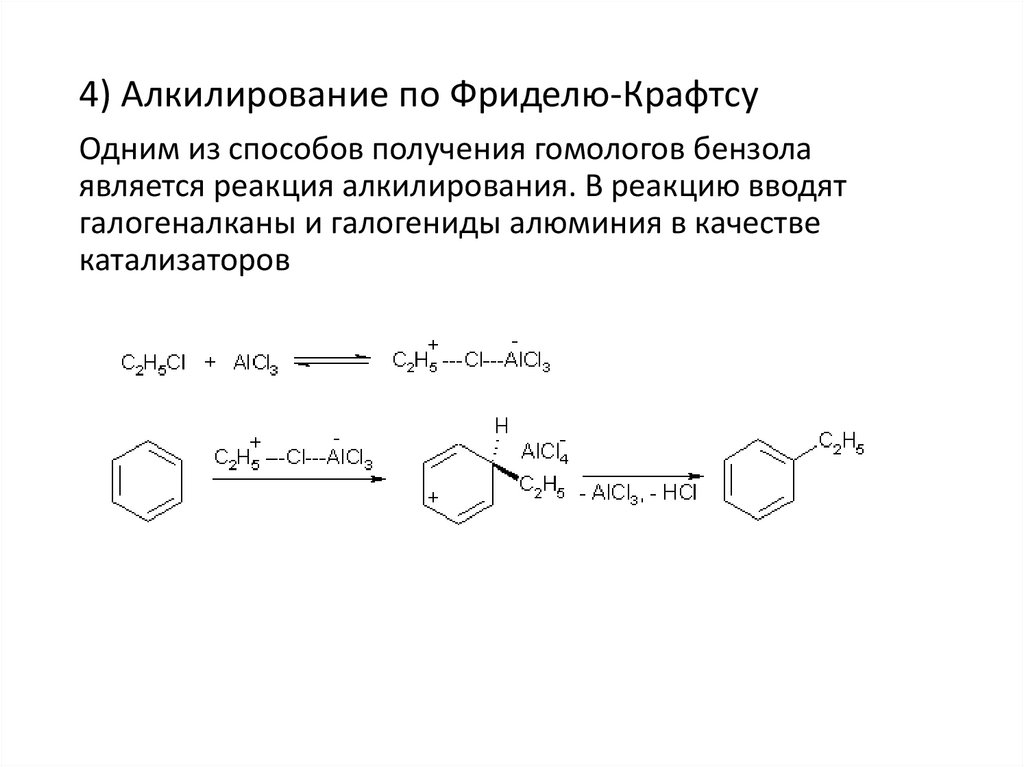
24.
4) Алкилирование по Фриделю-КрафтсуОдним из способов получения гомологов бензола
является реакция алкилирования. В реакцию вводят
галогеналканы и галогениды алюминия в качестве
катализаторов
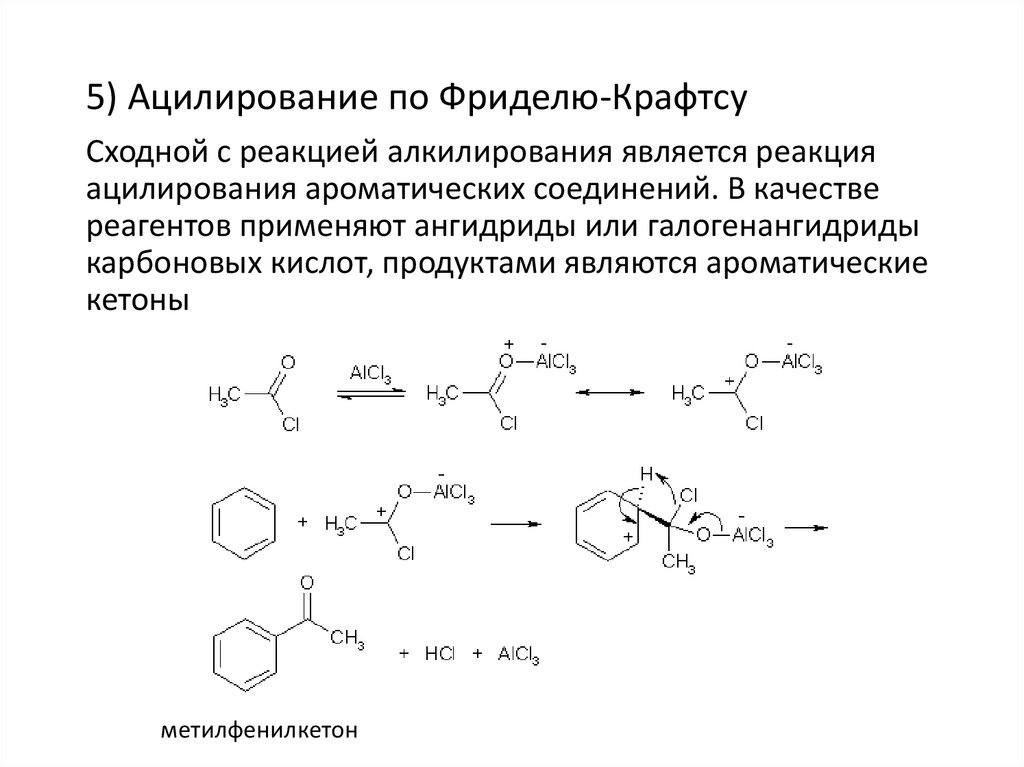
25.
5) Ацилирование по Фриделю-КрафтсуСходной с реакцией алкилирования является реакция
ацилирования ароматических соединений. В качестве
реагентов применяют ангидриды или галогенангидриды
карбоновых кислот, продуктами являются ароматические
кетоны
метилфенилкетон
26.
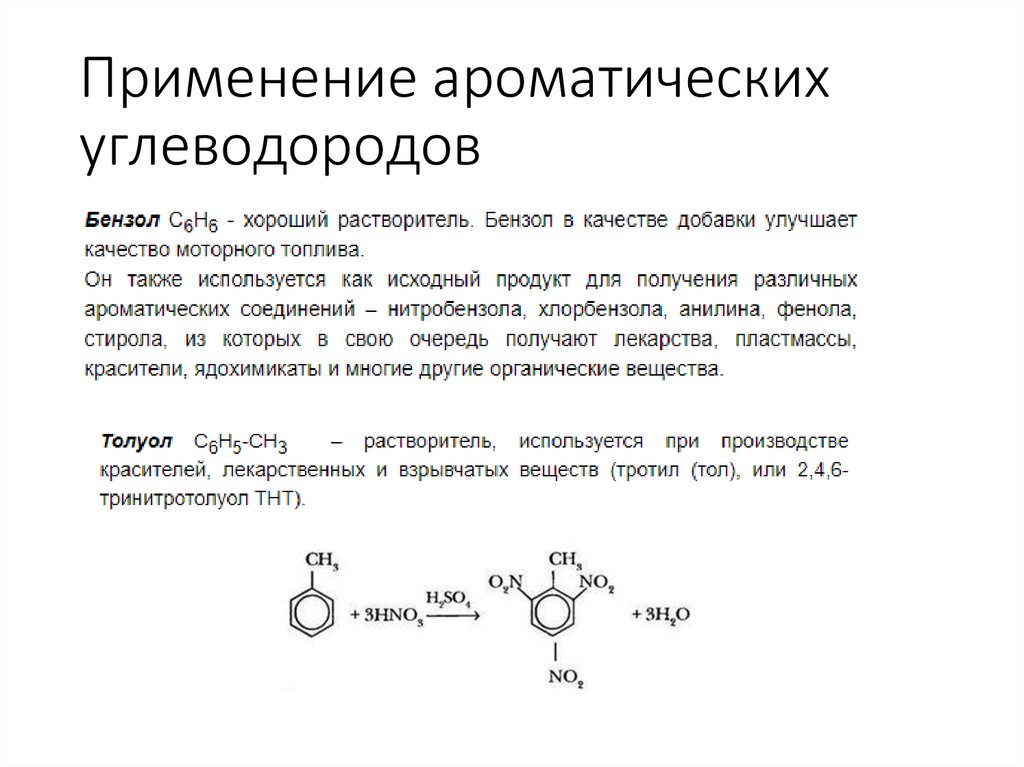
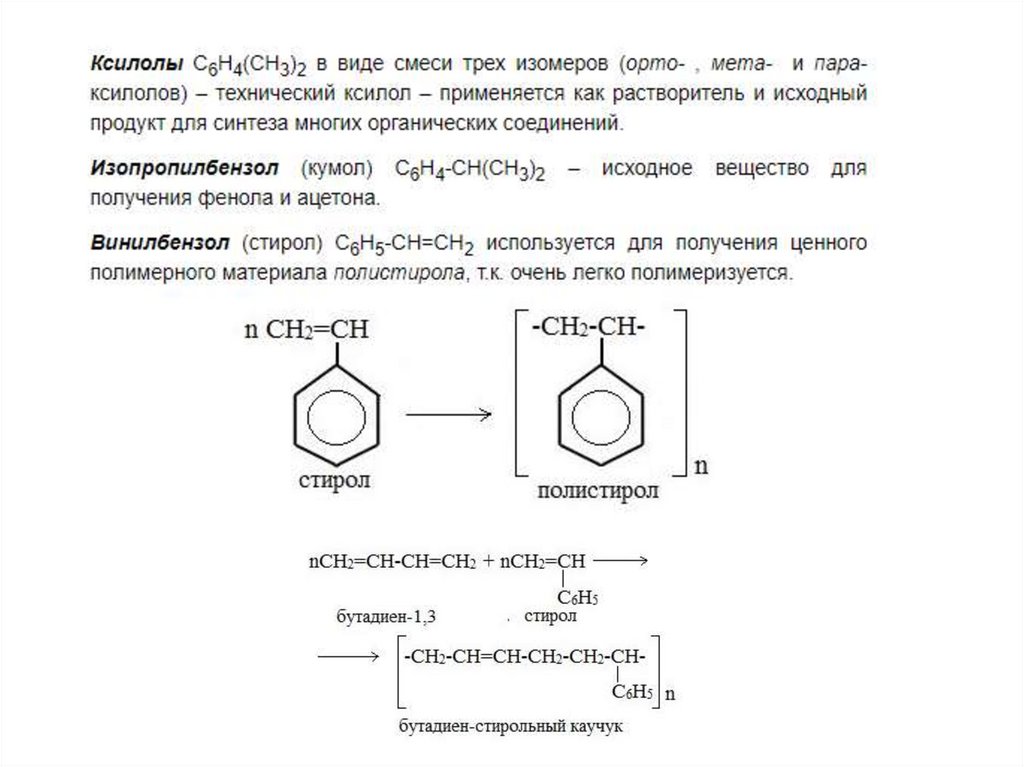
Применение ароматическихуглеводородов







 Химия
Химия








