Похожие презентации:
ГАЛОГЕНЫ в орг.чел
1.
Галогены2.
Общая характеристика галогеновCl
F
Вr
3.
Галогены – F, Cl, Br, I – химическиеэлементы VII группы, главной
подгруппы ПСХЭ Д. И. Менделеева
Строение внешней электронной
2
оболочки галогенов – …nS nP
5
В ряду F – Cl – Br – I окислительные
свойства галогенов ослабевают
4.
Открытие галогеновХлор открыт
шведским
химиком К.Шееле
в 1774 г.
Бром открыт в 1826 г.
французским химиком
А.Баларом.
Йод получен в 1811
г. французским
учёным Б.Куртуа.
Фтор в свободном
виде получил впервые
в 1886 г. французский
химик Анри Муассан.
5.
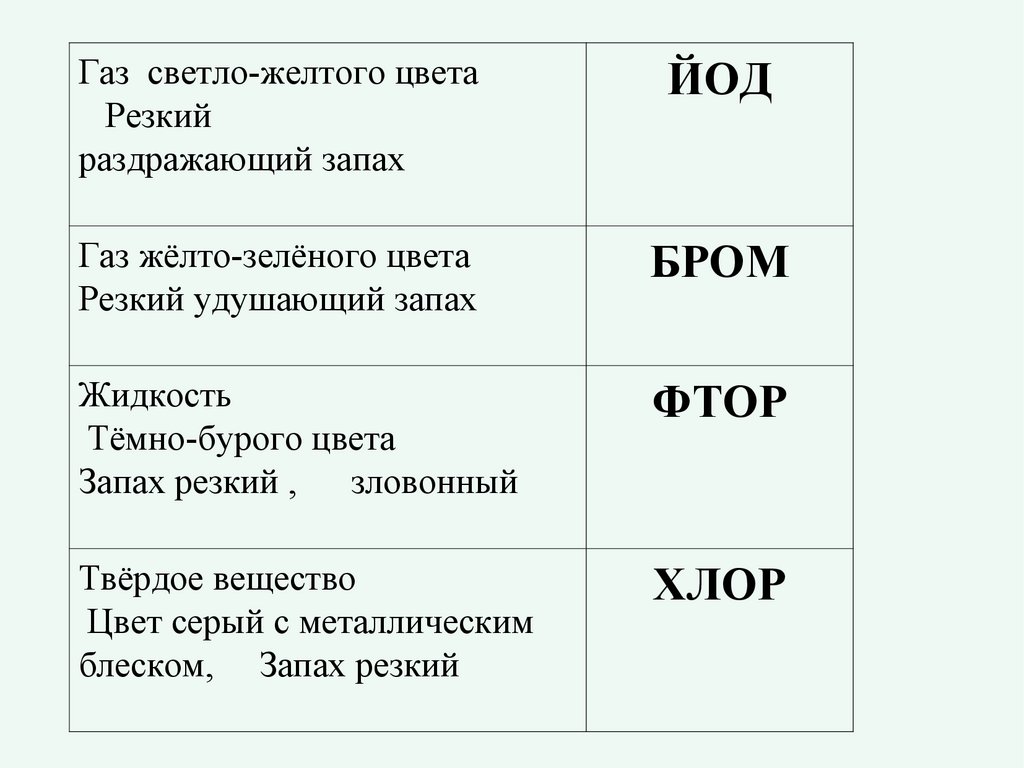
Газ светло-желтого цветаРезкий
раздражающий запах
ЙОД
Газ жёлто-зелёного цвета
Резкий удушающий запах
БРОМ
Жидкость
Тёмно-бурого цвета
Запах резкий , зловонный
ФТОР
Твёрдое вещество
Цвет серый с металлическим
блеском, Запах резкий
ХЛОР
6.
Ядовиты !ФТОР – ГАЗ(Н.У.)
Светло-желтый
Бром- Жидкость(н.у)
Тёмно-бурый
Запах резкий ,
Резкий
раздражающий запах
зловонный
Хлор- газ (н.у.)
Жёлто-зелёный
Резкий удушающий
запах
Иод –твёрдое вещество
Цвет серый с
металлическим блеском,
Запах резкий
Возгоняется
7.
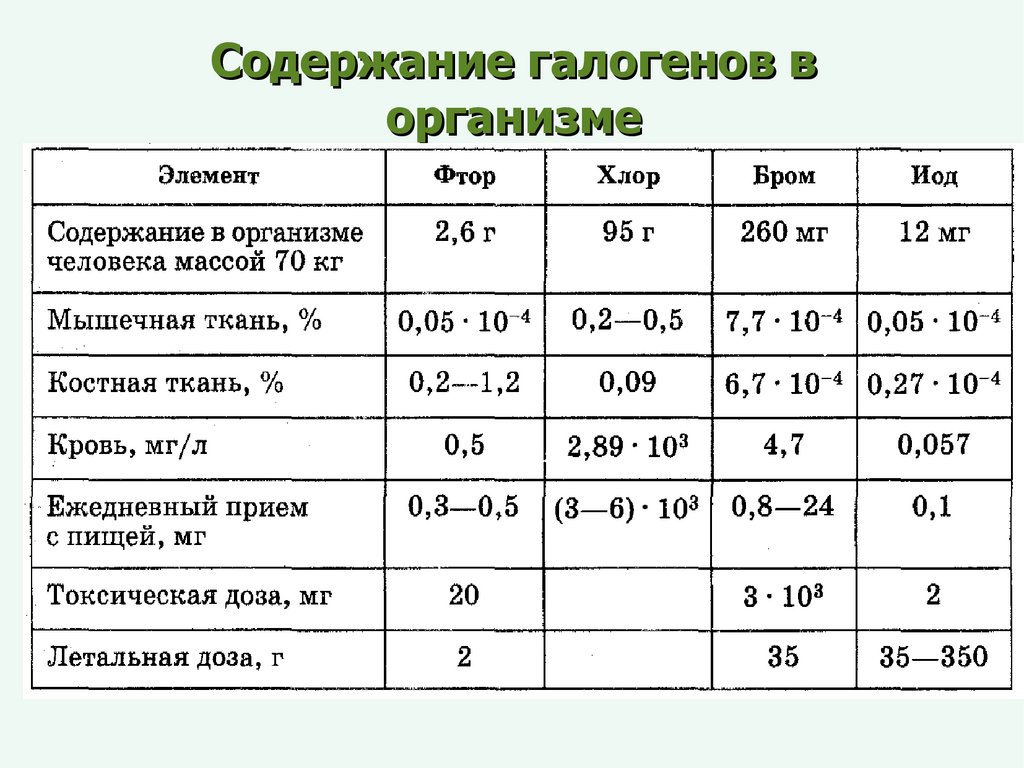
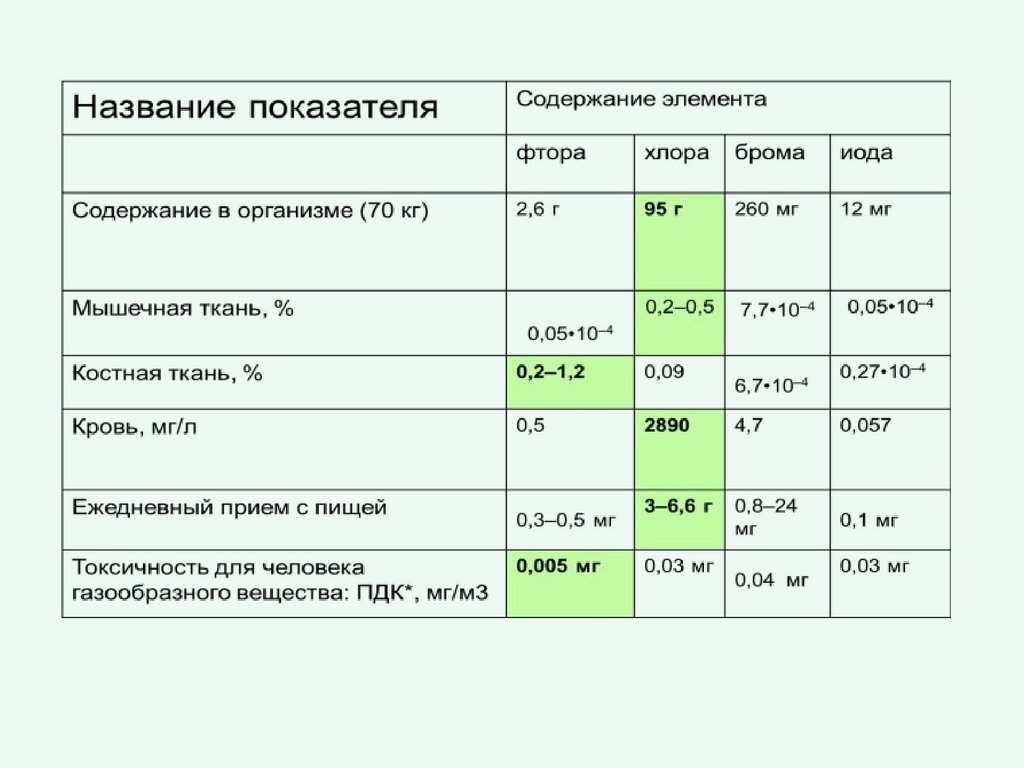
Содержание галогенов ворганизме
(по Дж.Эмели, 1993г.)
8.
9.
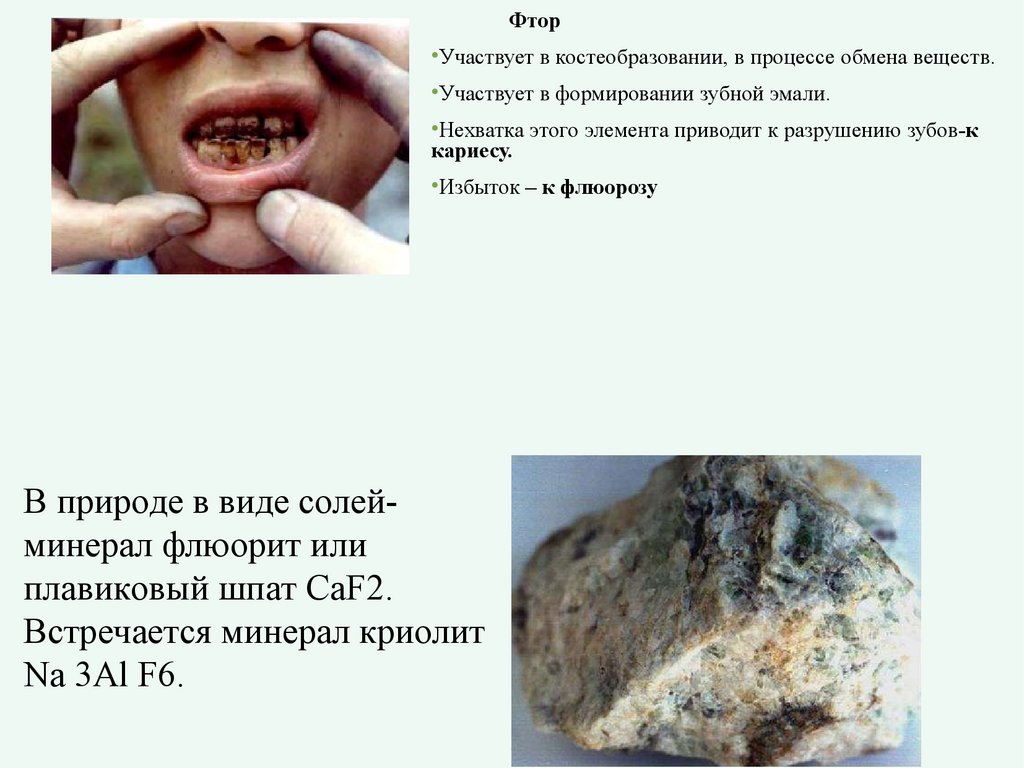
ФторУчаствует в костеобразовании, в процессе обмена веществ.
Участвует в формировании зубной эмали.
Нехватка этого элемента приводит к разрушению зубов-к
кариесу.
Избыток – к флюорозу
В природе в виде солейминерал флюорит или
плавиковый шпат СаF2.
Встречается минерал криолит
Na 3Al F6.
10.
Применение фтораФтор широко применяют при
получении различных фторидов;
в производстве тефлона
(антипригарное покрытие), других
фторопластов, фторкаучуков;
фторсодержащих органических
веществ и материалов, которые
широко применяют в технике,
особенно в тех случаях, когда
требуется устойчивость к
агрессивным средам, высокой
температуре и т. п.;
В качестве фреонов и хладонов - в
холодильных и морозильных
установках, в аэрозольных баллонах;
в производстве зубной пасты
11.
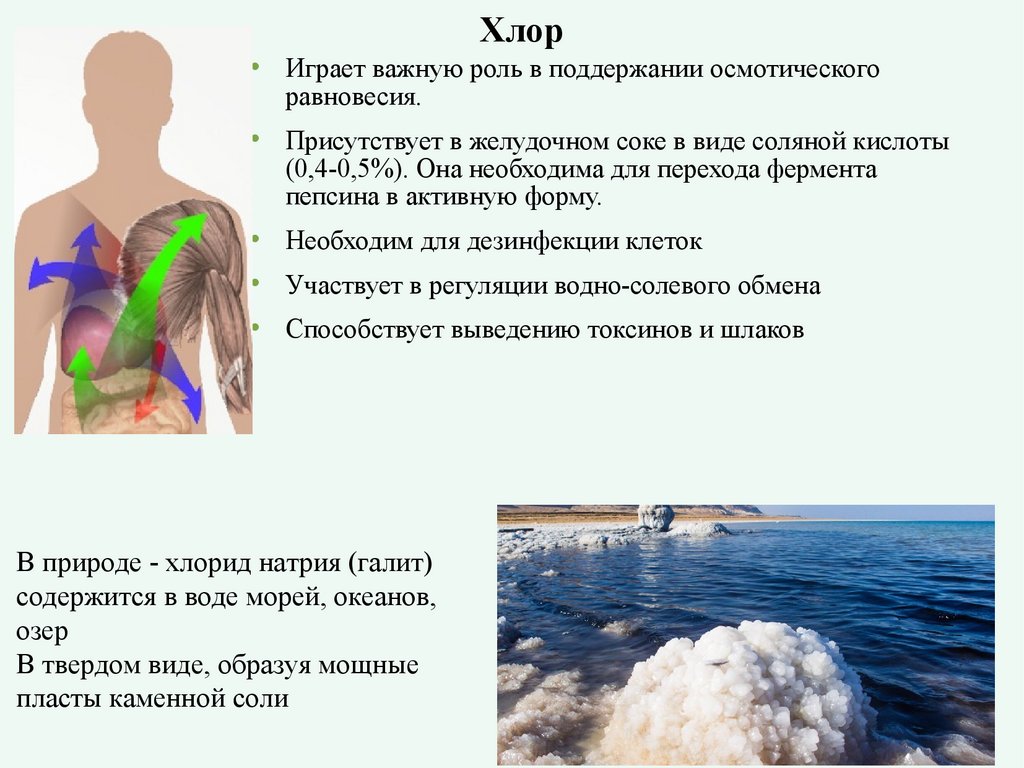
ХлорИграет важную роль в поддержании осмотического
равновесия.
Присутствует в желудочном соке в виде соляной кислоты
(0,4-0,5%). Она необходима для перехода фермента
пепсина в активную форму.
Необходим для дезинфекции клеток
Участвует в регуляции водно-солевого обмена
Способствует выведению токсинов и шлаков
В природе - хлорид натрия (галит)
содержится в воде морей, океанов,
озер
В твердом виде, образуя мощные
пласты каменной соли
12.
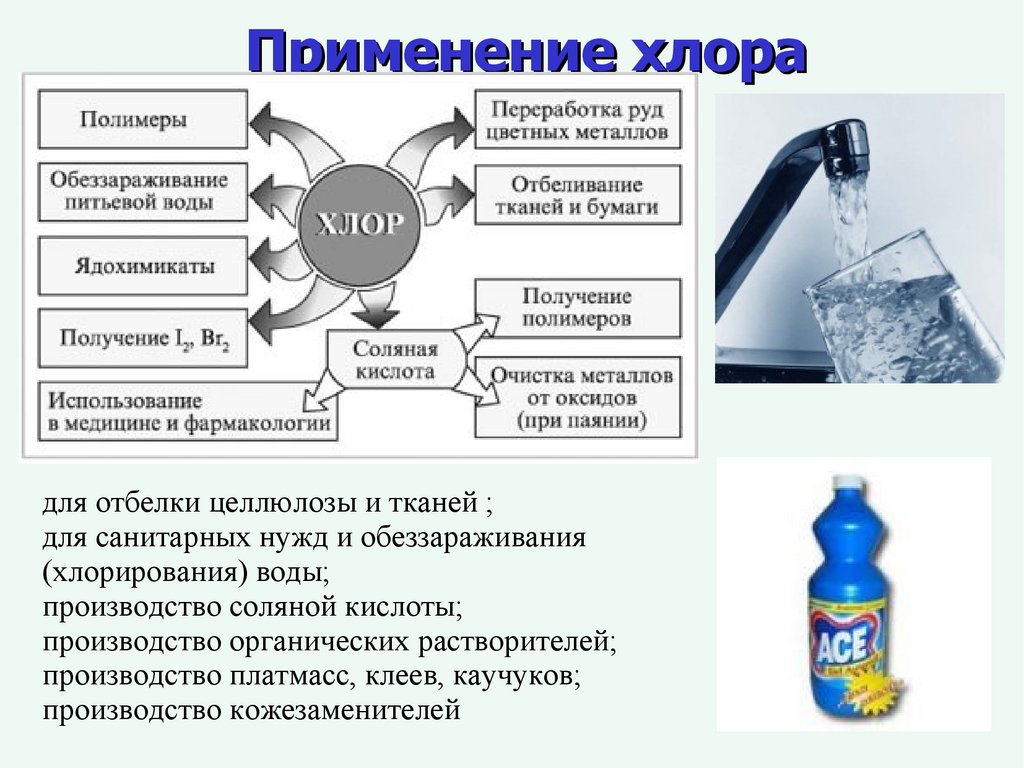
Применение хлорадля отбелки целлюлозы и тканей ;
для санитарных нужд и обеззараживания
(хлорирования) воды;
производство соляной кислоты;
производство органических растворителей;
производство платмасс, клеев, каучуков;
производство кожезаменителей
13.
Йод участвует в метаболизме щитовиднойжелезы и присущих ей гормонах. При
недостатке – заболевание эндемический зоб.
Повышает умственную работоспособность
Обеспечивает иммунитет, процессы роста и
развития.
• Недостаток йода приводит к образованию
жировых запасов
Содержится в малых
количествах в морской
воде
Существуют
некоторые водоросли,
которые накапливают
йод в своих тканях,
например ламинарии.
Зола этих водорослей
служит сырьем для
получения йода.
14.
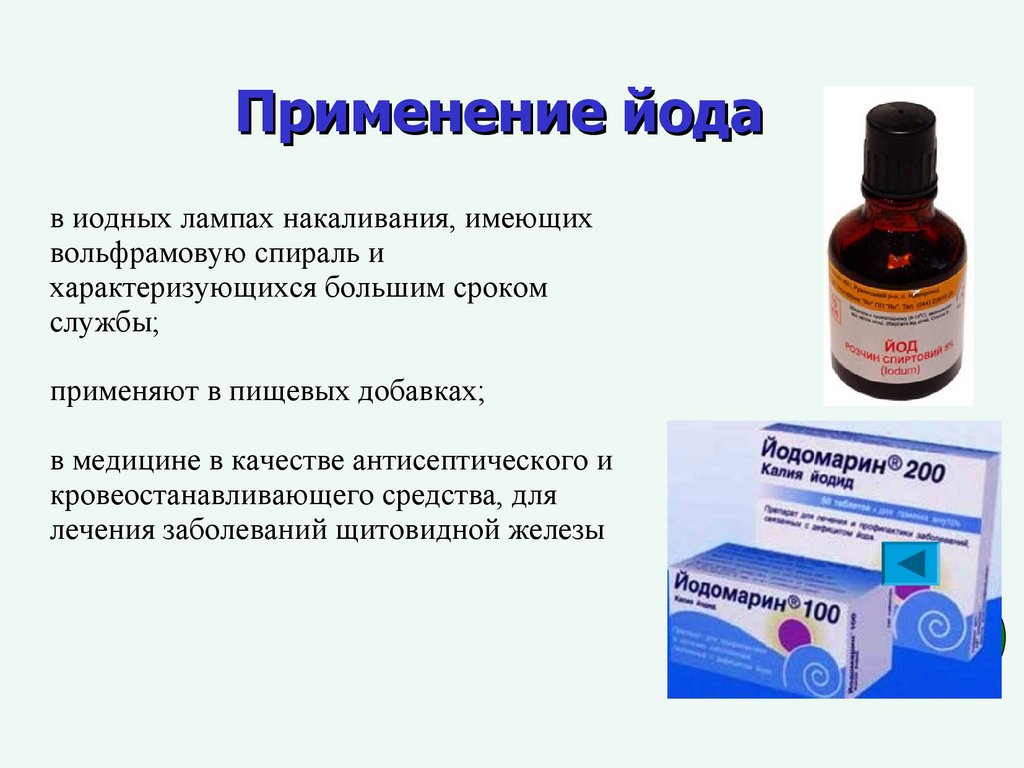
Применение йодав иодных лампах накаливания, имеющих
вольфрамовую спираль и
характеризующихся большим сроком
службы;
применяют в пищевых добавках;
в медицине в качестве антисептического и
кровеостанавливающего средства, для
лечения заболеваний щитовидной железы
15.
Бром находится в крови, мозге, печени,почках. Больше всего его в мозге.
Бром регулирует работу нервной
системы, процессы возбуждения и
торможения
В свободном состоянии в
природе не встречается.
Встречается в природе в виде
солей натрия и калия вместе с
солями хлора, а также в воде
соленых озер и морей.
16.
Применение бромадля получения пестицидов,
ингибиторов горения;
в медицине в качестве
успокоительного средства.
Успокаивающее действие
бромистых препаратов
основано на их способности
усиливать процессы
торможения в центральной
нервной системе.
17.
Фтор-F21.Для получения HF
2 Для получения фреона
3 Для получения веществ, иcполь. в
борьбе с вредителями с/х
4. Для получения тефлона
Иод-J2
Используют в медицине для
борьбы с заболеваниями
щитовидной железы и
получения иодной настойки (510% р-ра иода в спирте)
Хлор-Cl2
1 Для получения медикаментов,
пластмасс, красителей.
2.Для отбеливания тканей и
бумаги
3. Для обеззараживания питьевой
воды.
Бром-Br2
Для получения различных
лекарств, при лечении
нервных заболеваний
18.
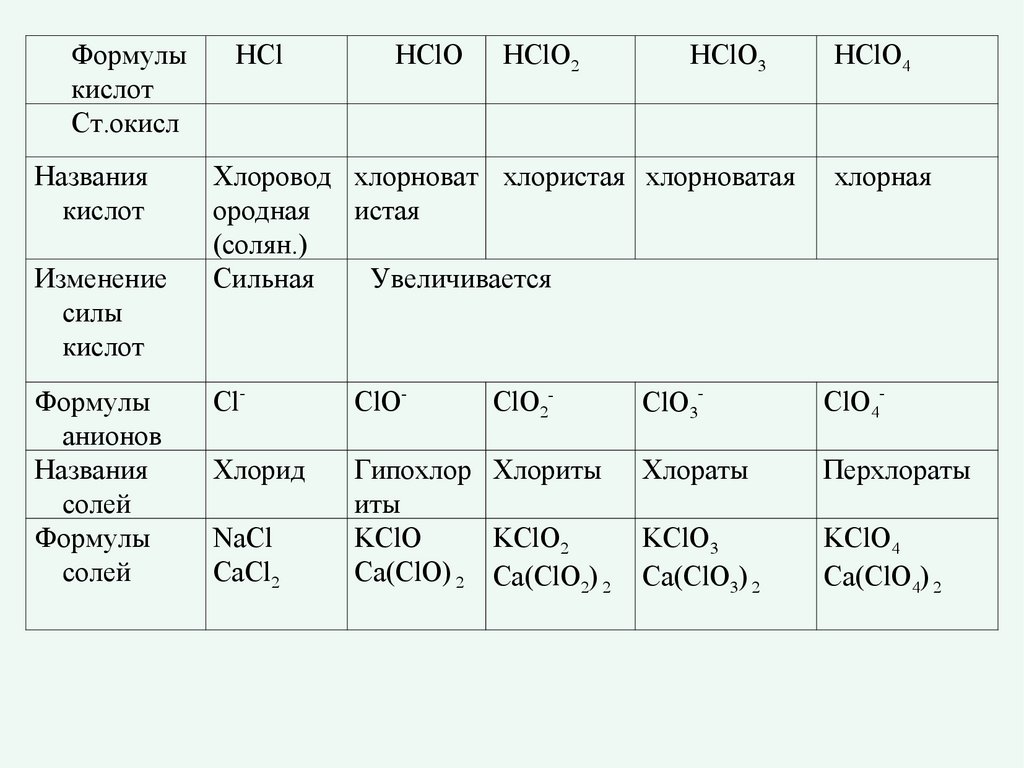
Формулыкислот
Ст.окисл
Названия
кислот
Изменение
силы
кислот
Формулы
анионов
Названия
солей
Формулы
солей
HCl
HClO
HClO2
HClO3
HClO4
Хлоровод хлорноват хлористая хлорноватая
ородная
истая
(солян.)
Сильная
Увеличивается
хлорная
Cl-
ClO-
ClO3-
ClO4-
Хлорид
Гипохлор Хлориты
иты
KClO
KClO2
Сa(ClO) 2 Сa(ClO2) 2
Хлораты
Перхлораты
KClO3
Сa(ClO3) 2
KClO4
Сa(ClO4) 2
NaCl
CaCl2
ClO2-
19.
хлорирование водыхлорная вода (раствор хлора в воде)
хлорная известь Са(ОСl)2
С12 + Н2О = НОС1 + НС1
В водном растворе образуется кислая среда в
которой свертываются белки.
Гипохлорит- ионы ОС1- обладают
бактерицидным свойством.
20.
21.
Составить уравнения к цепочке:Хлор – Хлороводород- Хлорид натрия- ХлорХлорид алюминия –Гидроксид алюминия
Вычислить массу 448 л хлора.
22.
Вычислите, сколько граммов морскойкапусты необходимо съедать ежесуточно для
того, чтобы восполнить суточную потребность
(800 мг) организма в йоде. В 100 г морской
капусты содержание йода составляет 250 мг.












 Химия
Химия








