Похожие презентации:
Индивидуальный_проект_по_химии_Модинpptx (2)
1. «Химия углеводородного сырья и моя будущая профессия »
Государственное бюджетное профессиональное образовательноеучреждение «Кстовский нефтяной техникум им. Б. И. Корнилова»
Индивидуальный проект по дисциплине: Химия
«ХИМИЯ УГЛЕВОДОРОДНОГО СЫРЬЯ
И МОЯ БУДУЩАЯ ПРОФЕССИЯ »
Проект выполнил: Модин Кирилл
Студент группы: 2024-ТНГ-94Д
Руководитель работы:
Кокурочкина Татьяна
Викторовна,
преподаватель химии.
2. актуальность
АКТУАЛЬНОСТЬ"Химия углеводородного сырья и моя будущая
профессия" актуален как никогда, поскольку он
направлен на решение ключевых задач, стоящих
перед нефтегазовой отраслью в условиях глобальных
вызовов: обеспечение энергетической безопасности,
повышение эффективности, снижение воздействия на
окружающую среду и развитие инноваций.
Подготовка квалифицированных технологов,
обладающих глубокими знаниями в области химии
углеводородного сырья, является необходимым
условием для устойчивого развития нефтегазовой
промышленности в будущем.
3. Цель и задачи
ЦЕЛЬ И ЗАДАЧИЦЕЛЬ:
• Показать взаимосвязь знаний о
химии углеводородного сырья и
навыков, необходимых в моей
будущей профессии технолога по
переработке нефти и газа.
ЗАДАЧИ:
• Изучить конкретный аспект химии
углеводородного сырья и его применение
в выбранной профессии.
• Продемонстрировать понимание
основных технологических
процессовипереработки нефти и газа и их
химических основ.
• Оценить перспективность выбранной
профессии и возможности карьерного
роста.
4. Состав углеводородного сырья
СОСТАВ УГЛЕВОДОРОДНОГО СЫРЬЯ• Алканы (Парафины);
• Циклоалканы (Нафтены);
• Алкины (Ацетилены);
• Ароматические углеводороды;
• Неуглеводородные соединения:
• Сернистые соединения (меркаптаны, сульфиды, дисульфиды,
тиофены);
• Азотистые соединения (пиридины, пирролы);
• Кислородсодержащие соединения (карбоновые кислоты,
фенолы, спирты);
• Металлоорганические соединения (порфирины, ванадий,
никель).
5. Физико-химические свойства углеводородов и их влияние на процессы переработки
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВАУГЛЕВОДОРОДОВ И ИХ ВЛИЯНИЕ НА ПРОЦЕССЫ
ПЕРЕРАБОТКИ
Температура кипения увеличивается с увеличением молекулярной
массы. Разветвленные углеводороды имеют более низкую
температуру кипения, чем линейные.
Плотность зависит от молекулярной массы и структуры.
Ароматические углеводороды обычно более плотные, чем
алифатические.
Вязкость увеличивается с увеличением молекулярной массы и
уменьшается с повышением температуры.
Растворимость. "Подобное растворяется в подобном". Углеводороды
хорошо растворимы в органических растворителях и плохо
растворимы в воде.
6. Основные химические реакции углеводородов
ОСНОВНЫЕ ХИМИЧЕСКИЕ РЕАКЦИИУГЛЕВОДОРОДОВ
• Крекинг:
Расщепление больших молекул углеводородов на
более мелкие. Может быть термическим или
каталитическим.
• Термический крекинг:
Проводится при высокой температуре и приводит
к образованию алкенов.
• Каталитический крекинг:
Проводится в присутствии катализаторов
(цеолиты, алюмосиликаты) и позволяет получать
более высококачественные продукты.
7.
• Риформинг:Превращение алканов и циклоалканов в
ароматические углеводороды. Используется для
повышения октанового числа бензина.
• Алкилирование:
Присоединение алкена к алкану или
ароматическому углеводороду. Используется для
производства высокооктановых компонентов
бензина.
• Изомеризация:
Превращение линейных алканов в разветвленные.
Разветвленные алканы имеют более высокое
октановое число.
8.
• Полимеризация:Соединение множества молекул мономеров в
длинную цепь полимера. Используется для
производства полимеров (полиэтилен,
полипропилен и др.).
• Гидрирование:
Присоединение водорода к ненасыщенным
углеводородам. Используется для насыщения
двойных и тройных связей, удаления серы и
азота из нефти.
9.
• Дегидрирование:Отщепление водорода от насыщенных
углеводородов. Используется для производства
алкенов и ароматических углеводородов.
• Окисление:
Реакция углеводородов с кислородом.
Используется для сжигания топлива и получения
химических продуктов (альдегиды, кислоты).
• Газификация:
Превращение твердого углеводородного сырья
(уголь, биомасса) в газообразную смесь (синтезгаз).
10. Роль катализаторов в процессах переработки углеводородного сырья
РОЛЬ КАТАЛИЗАТОРОВ В ПРОЦЕССАХПЕРЕРАБОТКИ УГЛЕВОДОРОДНОГО СЫРЬЯ
Катализаторы играют ключевую роль в
большинстве процессов переработки
углеводородного сырья. Они позволяют
ускорить химические реакции, снизить
температуру и давление, повысить
выход целевых продуктов и улучшить
селективность процесса.
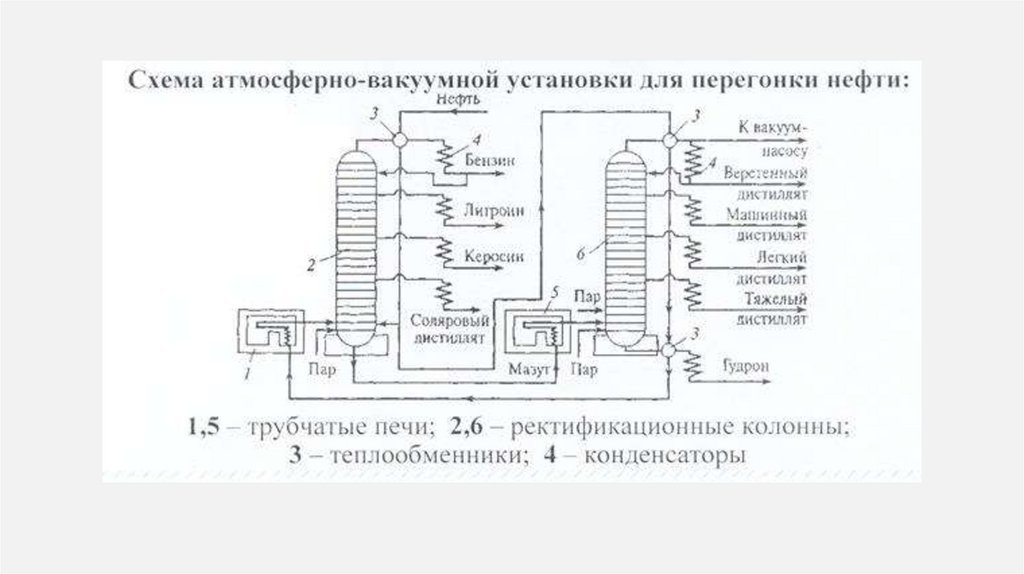
11. Первичная переработка нефти (атмосферная и вакуумная перегонка)
ПЕРВИЧНАЯ ПЕРЕРАБОТКА НЕФТИ(АТМОСФЕРНАЯ И ВАКУУМНАЯ ПЕРЕГОНКА)
Разделение нефти на фракции по температурам
кипения. Фракционная перегонка
(дистилляция). Разделение основано на том,
что различные углеводороды, входящие в
состав нефти, имеют разные температуры
кипения. Более легкие углеводороды, с
меньшей молекулярной массой, имеют более
низкие температуры кипения, чем более
тяжелые углеводороды.
12.
Сырая нефть предварительно нагревается втрубчатых печах до температуры 350-400 °C (для
атмосферной перегонки) или до 450-500 °C (для
вакуумной перегонки).
Нагретая нефть поступает в ректификационную
колонну - высокий вертикальный аппарат с
множеством горизонтальных тарелок (пластин)
внутри. На тарелках поддерживается
определенная температура.
Горячие пары нефти поднимаются по колонне.
По мере подъема температура в колонне
постепенно снижается (от нижней части к
верхней).
13.
Когда температура паров достигает температуры кипенияопределенной фракции, эта фракция конденсируется на
соответствующей тарелке. Более легкие фракции (с более
низкой температурой кипения) поднимаются выше и
конденсируются в верхней части колонны, а более
тяжелые фракции (с более высокой температурой
кипения) конденсируются в нижней части колонны.
Сконденсированные фракции отбираются с разных
уровней колонны. Проводится при атмосферном
давлении. Позволяет разделить нефть на легкие и средние
фракции.
Вакуумная перегонка. Проводится под вакуумом
(пониженным давлением). Используется для переработки
остатка после атмосферной перегонки (мазута). Вакуум
позволяет снизить температуру кипения тяжелых
углеводородов, предотвращая их термическое разложение
(крекинг).
14.
15. Вторичные процессы
ВТОРИЧНЫЕ ПРОЦЕССЫ• Термический крекинг (пиролиз). Проводится
при высокой температуре (700-900 °C) без
катализатора. Основные продукты - этилен и
пропилен (олефины).
• Каталитический крекинг. Проводится в
присутствии катализаторов (цеолиты,
алюмосиликаты) при более низкой температуре
(450-550 °C). Основные продукты - бензин,
олефины и легкие газообразные углеводороды.
• Гидрокрекинг. Проводится в присутствии
катализатора и водорода. Позволяет получать
бензин, керосин и дизельное топливо.
Уравнение реакции:
CₙH₂ₙ₊₂ → CₓH₂ₓ₊₂ + CᵧH₂ᵧ (где n > x + y)
Температура: Повышение температуры
увеличивает скорость реакции крекинга и
выход олефинов (особенно в термическом
крекинге).
Давление: Снижение давления способствует
образованию олефинов.
16.
• РиформингДегидрирование циклогексана: C₆H₁₂ → C₆H₆ + 3H₂
Изомеризация гексана: CH₃(CH₂)₄CH₃ →
CH₃CH(CH₃)CH₂CH₂CH₃
Катализаторы. Платина (Pt) или рений (Re) на
носителе из оксида алюминия (Al₂O₃),
модифицированном хлором (Cl).
Увеличение температуры способствует образованию
ароматических углеводородов, но может также
увеличить выход побочных продуктов.
Снижение давления способствует дегидрированию
и образованию ароматических углеводородов.
17.
• АлкилированиеУравнение реакции: C₄H₁₀ (изобутан) + C₄H₈
(бутен) → C₈H₁₈ (алкилат)
Катализаторы: Серная кислота (H₂SO₄) или
плавиковая кислота (HF). Твердые кислотные
катализаторы (например, ионообменные смолы)
также используются.
Низкая температура (0-10 °C для H₂SO₄ и -10 - 0 °C
для HF) способствует образованию алкилатов и
подавляет побочные реакции.
18.
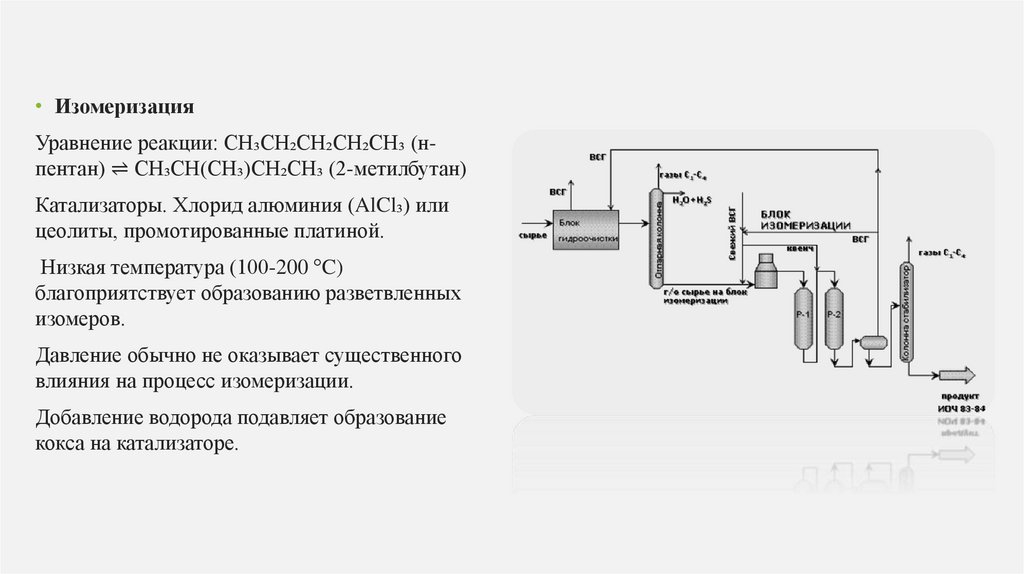
• ИзомеризацияУравнение реакции: CH₃CH₂CH₂CH₂CH₃ (нпентан) ⇌ CH₃CH(CH₃)CH₂CH₃ (2-метилбутан)
Катализаторы. Хлорид алюминия (AlCl₃) или
цеолиты, промотированные платиной.
Низкая температура (100-200 °C)
благоприятствует образованию разветвленных
изомеров.
Давление обычно не оказывает существенного
влияния на процесс изомеризации.
Добавление водорода подавляет образование
кокса на катализаторе.
19.
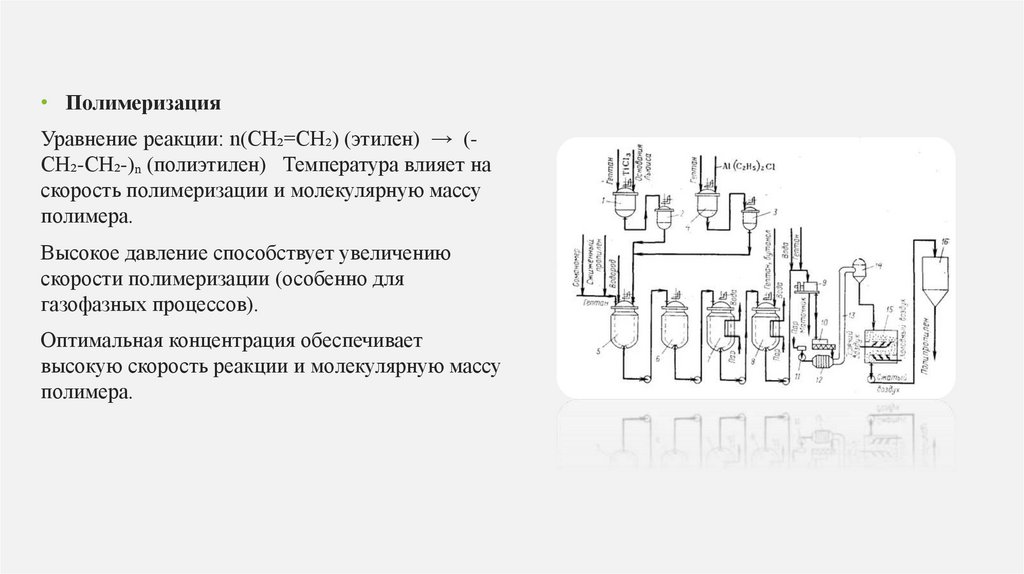
• ПолимеризацияУравнение реакции: n(CH₂=CH₂) (этилен) → (CH₂-CH₂-)ₙ (полиэтилен) Температура влияет на
скорость полимеризации и молекулярную массу
полимера.
Высокое давление способствует увеличению
скорости полимеризации (особенно для
газофазных процессов).
Оптимальная концентрация обеспечивает
высокую скорость реакции и молекулярную массу
полимера.
20. Очистка и облагораживание
ОЧИСТКА И ОБЛАГОРАЖИВАНИЕПроцессы очистки и облагораживания
предназначены для удаления
нежелательных примесей из нефтяных
фракций, улучшения их качества и
соответствия требованиям
экологической безопасности.
21. Гидроочистка
ГИДРООЧИСТКА• Уравнения реакций
RSH + H₂ → RH + H₂S (гидрирование меркаптанов)
R₂S + 2H₂ → 2RH + H₂S (гидрирование сульфидов)
RNH₂ + H₂ → RH + NH₃ (гидрирование аминов)
• Катализаторы: Кобальт-молибденовые (Co-Mo) или никельмолибденовые (Ni-Mo) сульфиды на носителе из оксида
алюминия (Al₂O₃).
• Повышение температуры увеличивает скорость
гидроочистки.
• Высокое давление способствует гидрированию.
22. Депарафинизация
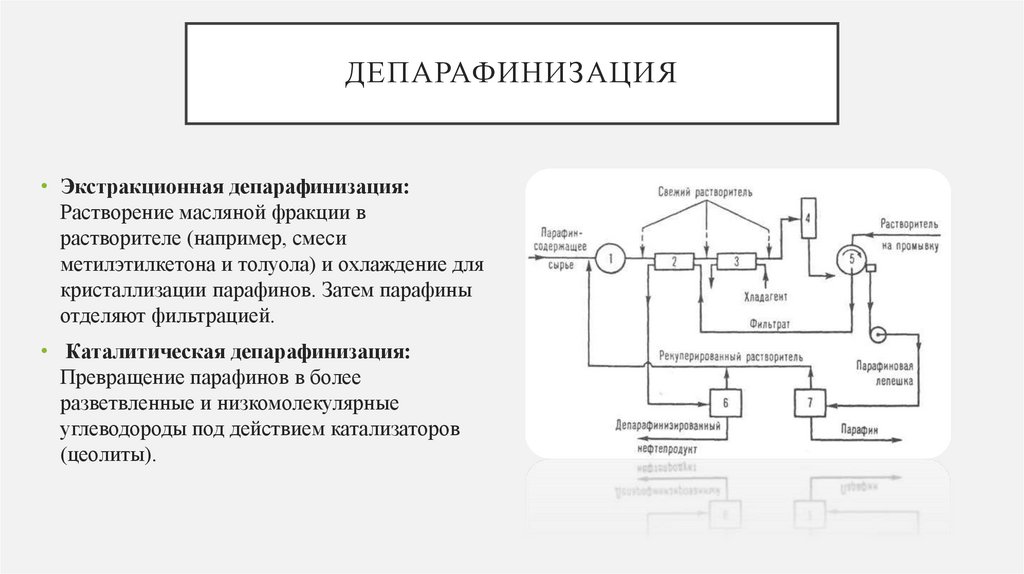
ДЕПАРАФИНИЗАЦИЯ• Экстракционная депарафинизация:
Растворение масляной фракции в
растворителе (например, смеси
метилэтилкетона и толуола) и охлаждение для
кристаллизации парафинов. Затем парафины
отделяют фильтрацией.
• Каталитическая депарафинизация:
Превращение парафинов в более
разветвленные и низкомолекулярные
углеводороды под действием катализаторов
(цеолиты).
23. Сероочистка (Удаление сероводорода)
СЕРООЧИСТКА (УДАЛЕНИЕСЕРОВОДОРОДА)
• Аминовая очистка:
Абсорбция H₂S растворами аминов (например, моноэтаноламин
(МЭА), диэтаноламин (ДЭА), метилдиэтаноламин (МДЭА)). Затем
амин регенерируется нагреванием, а H₂S направляется на
дальнейшую переработку.
• Процесс Клауса:
Превращение H₂S в элементную серу путем частичного сжигания
H₂S с последующей каталитической реакцией с диоксидом серы
(SO₂).
• Уравнения реакций:
2H₂S + 3O₂ → 2SO₂ + 2H₂O (полное сгорание H₂S)
2H₂S + SO₂ → 3S + 2H₂O (реакция Клауса)
24. Перспективы профессии технолога по переработке нефти и газа
ПЕРСПЕКТИВЫ ПРОФЕССИИ ТЕХНОЛОГАПО ПЕРЕРАБОТКЕ НЕФТИ И ГАЗА
• Востребованность профессии в нефтегазовой
отрасли.
• Возможности карьерного роста (от оператора до
руководителя производства).
• Развитие новых технологий переработки
углеводородного сырья (например, переработка
тяжелой нефти, синтез-газа).
• Важность профессии для обеспечения
энергетической безопасности и устойчивого
развития.
• Необходимость повышения квалификации и
освоения новых знаний и навыков.
25. Роль технолога по переработке нефти и газа
РОЛЬ ТЕХНОЛОГА ПО ПЕРЕРАБОТКЕНЕФТИ И ГАЗА
Разработка и оптимизация технологических процессов.
Контроль за соблюдением технологических
регламентов и требований безопасности.
Проведение лабораторных и промышленных
испытаний.
Анализ причин возникновения аварийных ситуаций и
разработка мер по их предотвращению.
Внедрение новых технологий и оборудования.
Взаимодействие с другими специалистами (инженеры,
механики, химики-аналитики).
26. Вывод
ВЫВОДХимия углеводородного сырья - это сложная и многогранная
область знаний, которая играет важную роль в современной
экономике и технологическом развитии. Понимание основных
принципов этой химии необходимо для эффективной добычи,
переработки и использования углеводородного сырья, а также
для разработки новых материалов и технологий. Современная
нефтегазовая промышленность требует
высококвалифицированных специалистов, обладающих
глубокими знаниями в области химии углеводородного сырья,
способных разрабатывать и внедрять инновационные решения
для повышения эффективности и экологичности производства.
27. Материал использованный в создании проекта:
МАТЕРИАЛ ИСПОЛЬЗОВАННЫЙ ВСОЗДАНИИ ПРОЕКТА:
1. https://cyberleninka.ru/article/n/roluglevodorodov-kak-himicheskogo-syrya
2. https://foxford.ru/wiki/himiya/prirodnyeistochniki-uglevodorodov
3. https://postupi.online/professiya/specialistpo-pererabotke-nefti-i-gaza/
4. https://vuzopedia.ru/professii/1690
























 Химия
Химия








