Похожие презентации:
Гальванический элемент
1. Гальванический элемент
2.
Электрохимический элемент включает в себя проводникиразличного рода. В нём происходят превращение энергии в
электрическую, что позволяет использовать некоторые
электрохимические элементы цепи в качестве источников
электрического тока.
В электрохимической цепи различают внешнюю и внутреннюю
цепи. Внешняя цепь – это выводы электродов и прибор для
измерения ЭДС. Внутренняя цепь и есть гальванический элемент.
Химическим гальваническим элементом называют устройство из
двух электродов, в котором химическая энергия превращается в
электрическую.
3.
4.
Уравнение (1) называют диффузионнымпотенциалом. Он не представлен в виде
термодинамической величиной, т.к. зависит
от соотношения подвижностей ионов и
строения переходной границы, разделяющей
оба раствора. Диффузионный потенциал
убирают, применяя солевой мостик.
5.
6.
7.
8.
Установим, каким образомобразуется ЭДС
(гальванического
элемента) электрической
цепи.
9.
Система, состоящая из двух электродов, погруженныхв раствор электролита, способна производить
электрическую работу, т.е. служить источником
электрической энергии. Подобные системы называют
электрохимическими цепями. Цепи, которые
используются на практике для получения
электрического тока, называются гальваническими
элементами. Составная часть гальванического
элемента – полуэлемент:
Разность потенциалов между электродами зависит от
условий, в которых она определяется.
10.
В гальваническом элементе сами по себе равновесные электродыобразуют неравновесную систему. Причина неравновесности
является разница плотностей электролитов в металлах и,
следовательно, стремлении их переходить от одного металла к
другому по внешней цепи. Одновременно во внутренней цепи
происходит перенос ионов. Перенос происходит до тех пор, пока не
создаётся определённое (равновесное) для каждой температуры
соотношение концентраций (активностей) электролитов в двух
растворах. Электрохимическая цепь является равновесной при
условии, что электрохимическое равновесие наблюдается на
каждой фазовой границе, а разность потенциалов на концах цепи Е
скомпенсирована разностью потенциалов от внешнего источника
тока.
11.
Разность потенциалов будет максимальной приравновесных условиях работы цепи, т.е. когда
внешнее сопротивление бесконечно велико, а ток в
цепи – бесконечно мал. Такая разность потенциалов
получила название электропроводностей силы (ЭДС).
Если же на отдельных фазовых границах (хотя бы на
одной) равновесие не устанавливается, то разность
потенциалов на концах цепи не равна ЭДС.
12.
В основе работы всякой электрохимической цепилежит окислительно-восстановительная реакция,
происходящая на электродах или в растворе.
В первом случае цепи называются химическими,
во втором – Ox-Red.
В химических цепях на отрицательном электроде
(аноде) происходит окисление, а на
положительном (катоде) – восстановление.
13.
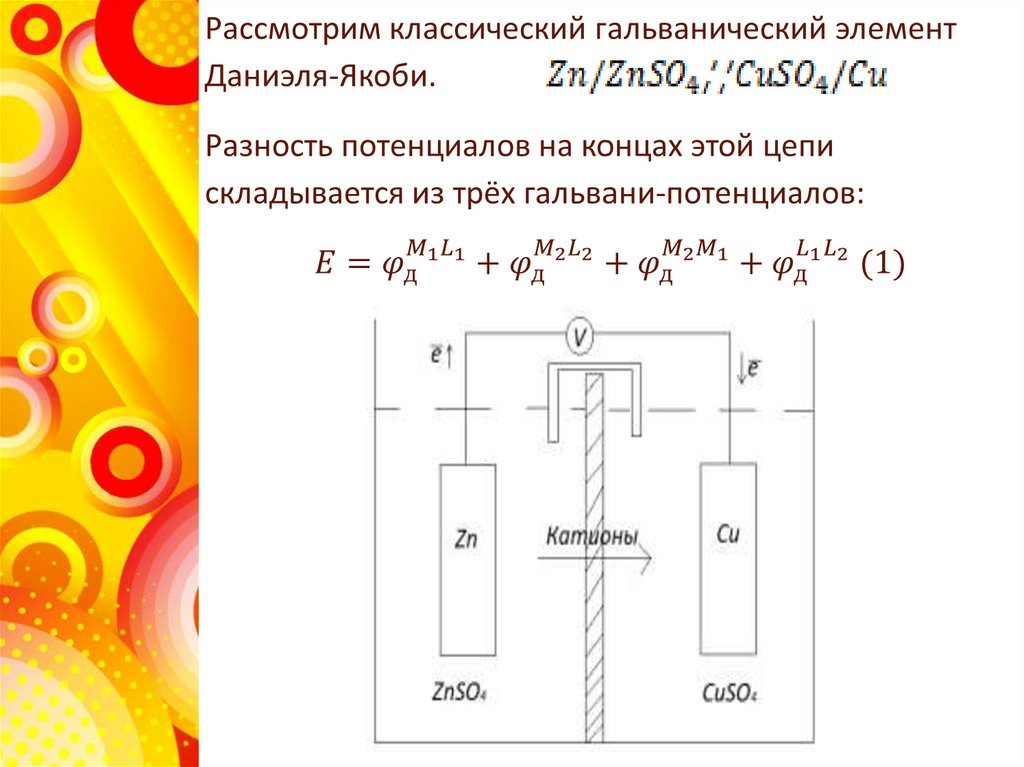
Вернёмся к элементу Даниэля-Якоби. Разомкнутыйэлемент находится в заторможенном состоянии
неравновесном и может быть в этом состоянии как
угодно долго. Замыкание электродов металлически
проводником снижает торможение.
На Zn- электроде (электрохимически более активном)
протекает термодинамически необратимый процесс:
окисление
На Cu - электроде - термодинамически необратимый
процесс:
Восстановление
Суммарный процесс:
или
14.
В гальванических элементах химическиереакции на электродах протекают тем
медленнее, чем большим
сопротивлением обладает внешняя цепь
(выводы, вольтметры).
15.
16.
17.
18.
19.
Обратимые электроды и составленные из нихобратимые элементы могут быть рассмотрены в
термодинамически обратимом (равновесном)
состоянии. Протекание через элемент бесконечно
малого тока – условие термодинамической
обратимости. Если через элемент проходит
измеримый ток, то он перестаёт быть
термодинамически обратимым и переходит в
химический источник тока.
20.
Обратимо работающие элементы – это такиеэлементы, в которых после размыкания цепи на
каждом электроде устанавливается равновесие.
В обратимом электроде реакцию можно
прекратить, присоединив к нему внешний
источник тока с таким же значением ЭДС, но
противоположного знака. Если увеличить ЭДС
внешнего источника тока на малую величину, то
реакция пойдёт в обратном направлении.





















 Химия
Химия








