Похожие презентации:
Физическая химия. Часть вторая
1.
ФИЗИЧЕСКАЯ ХИМИЯЧасть вторая
2.
Физическая химия – наука, изучающая общиезакономерности химических процессов и явлений и
объясняющая их с точки зрения фундаментальных
физических законов
2
3.
Что изучаем в этом семестре?• Разделы:
– Электрохимия. Раздел, изучающий закономерности перехода
химической энергии в электрическую; процессы,
протекающие с участием заряженных частиц в проводниках и
на межфазных поверхностях; описывается устройство
электродов и гальванических элементов, а также принципы их
работы
– Формальная кинетика. В разделе рассматриваются
закономерности протекания физико-химических процессов во
времени, в частности, зависимость скорости реакции от
концентрации реагирующих веществ
– Кинетика сложных реакций. Раздел, посвященный изучению
особенностей протекания во времени сложных химических
реакций, т.е. реакций протекающих через ряд элементарных
стадий
3
4.
Учебники и учебные пособия• Физическая химия, Т. 2/ под ред. К.С. Краснова. – М.: Высш. шк., 1995.
– 319 с.
• Физическая химия/ А.Г. Стромберг, Д.П. Семченко; под ред. А.Г.
Стромберга. – М.: Высш. шк., 1988. – 496 с.
• Сборник примеров и задач по физической химии/ И.В. Кудряшов, Г.С.
Каретников. – М.: Высш. шк., 1991. – 527 с.
• Практикум по физической химии/ под ред. В.В. Буданова,
Н.К.Воробьева. – М.: Химия, 1986. – 352 с.
• Краткий справочник физико-химических величин/ под ред. А.А.
Равделя, Л.М. Пономаревой. – СПб.: Иван Федоров, 2003. – 238 с.
• Кинетика химических реакций: учеб. пособие/ Ю.В. Поленов, Е.В.
Егорова; Иван. гос. хим.-технол. ун-т. – Иваново: ИГХТУ, 2010. – 68 с.
• Основные понятия и определения курса «Физическая и коллоидная
химия»: учеб. пособие/ М.П. Немцева, А.Г. Кротов; под. ред. О.В.
Лефедовой; Иван. гос. хим.-технол. ун-т. – Иваново: ИГХТУ, 2005. – 109
с.
4
5.
ЭЛЕКТРОХИМИЯЭлектрохимия – раздел физической химии,
посвящённый изучению закономерностей
взаимного превращения химической и
электрической форм энергии, а также
систем, в которых эти превращения
совершаются.
Электрохимия изучает свойства проводников
электричества и процессы с участием
заряженных частиц – ионов и электронов.
5
6.
• Электрохимическая система – устройство, состоящее изпроводников электричества I и II рода.
• В проводнике имеется большое число заключённых носителей
заряда, то есть заряженных частиц, которые могут свободно
перемещаться внутри объёма проводника и под действием
приложенного к проводнику электрического
напряжения создают ток проводимости
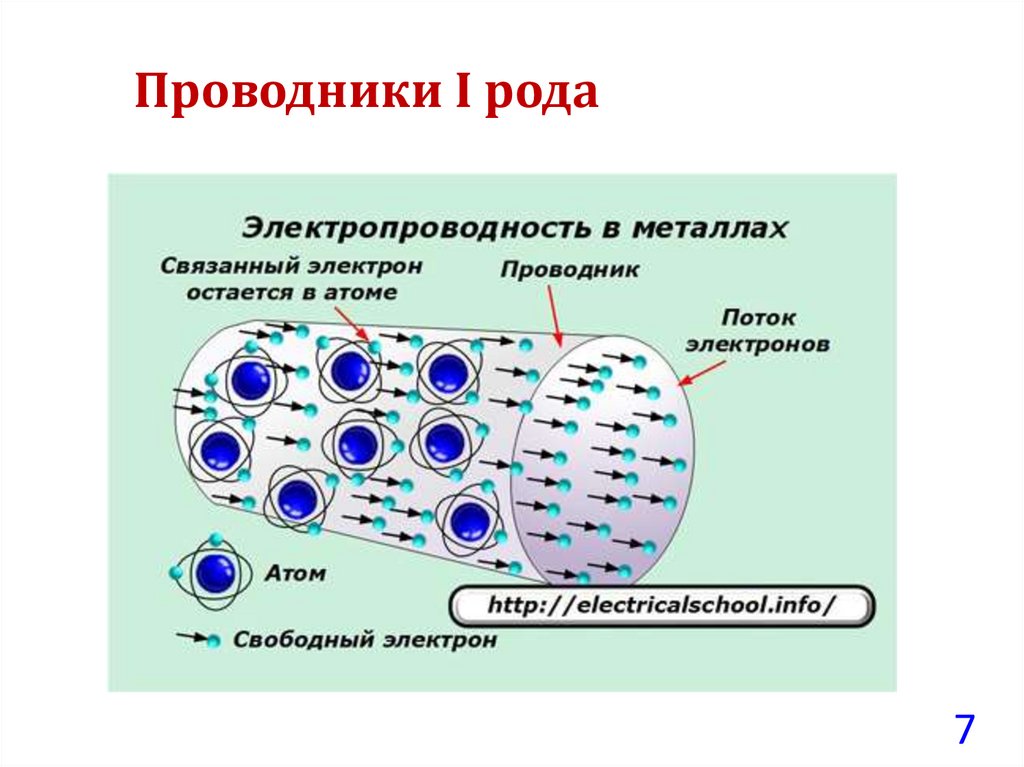
• Проводники I рода – обладают электронной проводимостью
(металлы и полупроводники), и при пропускании через них
электрического тока в системе не наблюдается каких-либо
химических изменений.
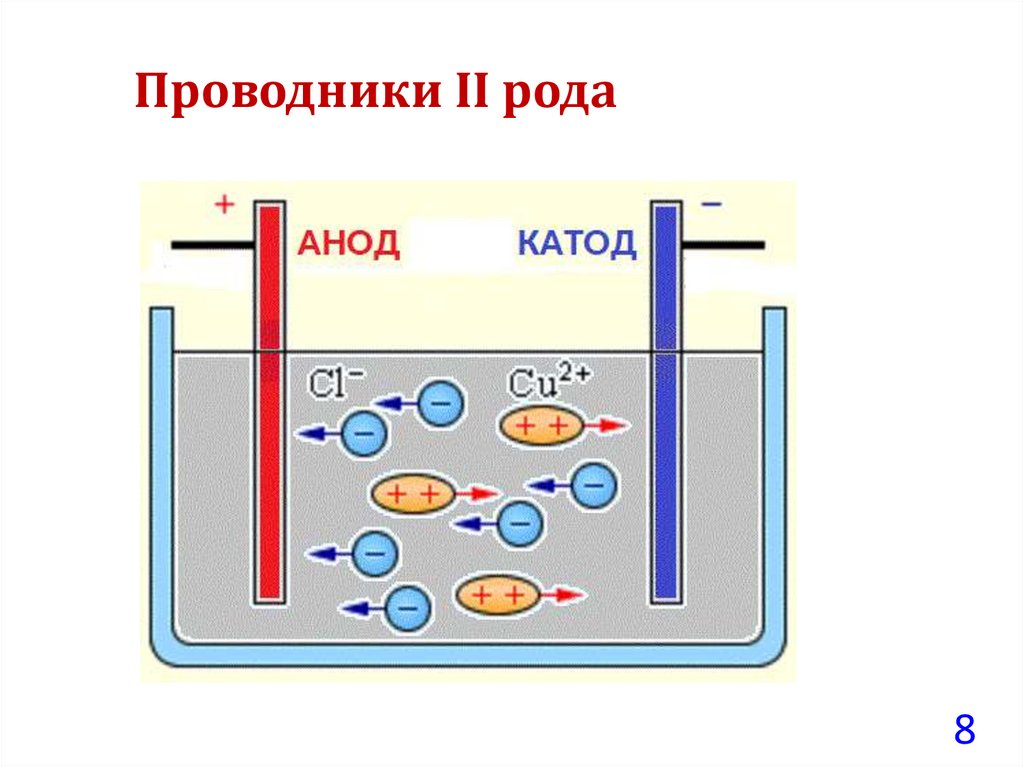
• Проводники II рода – обладают ионной проводимостью
(растворы, расплавы электролитов), и прохождение через них
тока сопровождается химическими превращениями.
6
7.
Проводники I рода7
8.
Проводники II рода8
9.
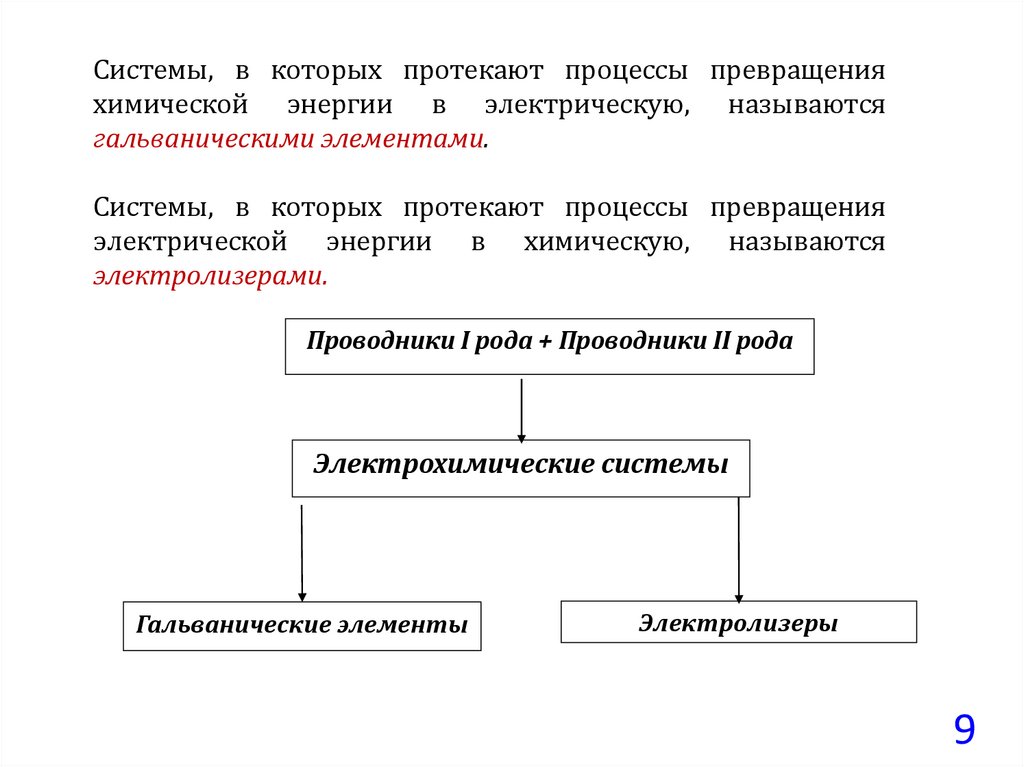
Системы, в которых протекают процессы превращенияхимической энергии в электрическую, называются
гальваническими элементами.
Системы, в которых протекают процессы превращения
электрической энергии в химическую, называются
электролизерами.
Проводники I рода + Проводники II рода
Электрохимические системы
Гальванические элементы
Электролизеры
9
10.
В состав гальванического элемента(электрохимической цепи) или электролизёра входят
два полуэлемента или электрода, которые, в свою
очередь, состоят из металла или полупроводника,
погруженных в раствор или расплав электролита.
Вследствие разности химических потенциалов
реагентов в соприкасающихся фазах происходит
переход заряженных частиц из одной фазы в другую,
что приводит к возникновению скачка потенциала (φ)
на границе раздела и протеканию электрохимической
реакции.
Потенциал электрода φ является его электрической
характеристикой.
10
11.
Для осуществления взаимного превращения химической иэлектрической форм энергии необходимо создать контакт
между проводниками I рода через внешнюю цепь (металл) и
связать проводники II рода (жидкости) через
полупроницаемую мембрану или солевой
(электролитический) мостик т.е. собрать гальванический
элемент или электрохимическую цепь.
Алгебраическая сумма потенциалов, возникающая на
границе:
металл/жидкость и жидкость/жидкость,
характеризует работу гальванического элемента и
называется электродвижущей силой (ЭДС) – обозначается
буквой E.
Потенциалы электродов и электродвижущая сила
измеряются в вольтах (В).
11
12.
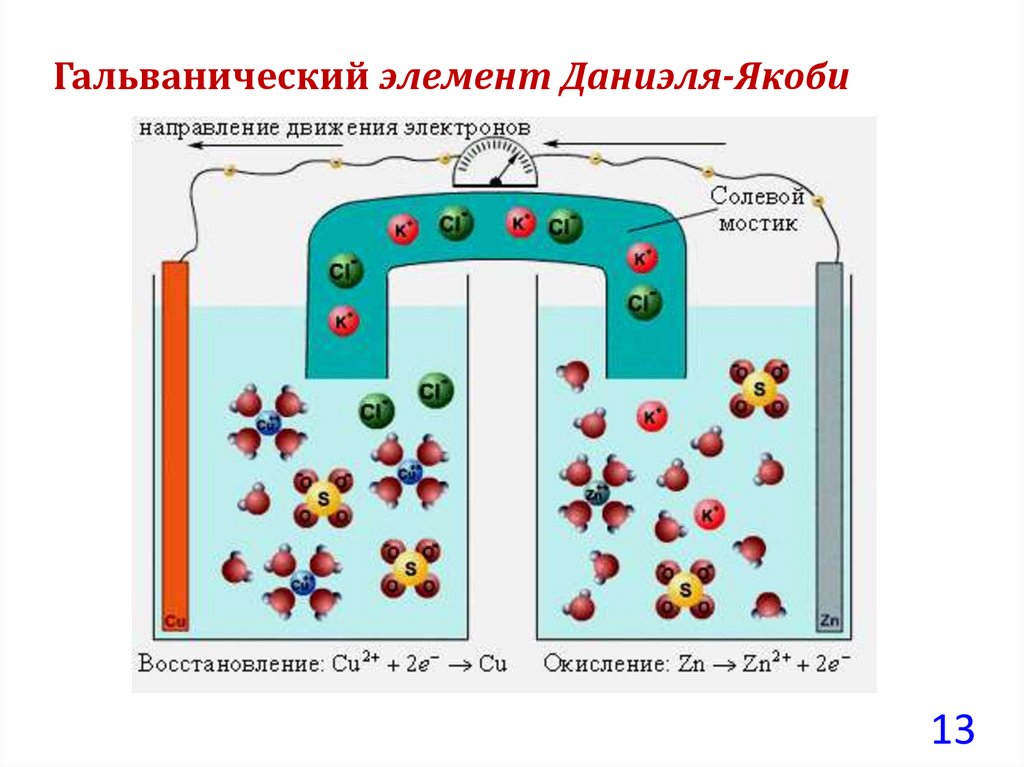
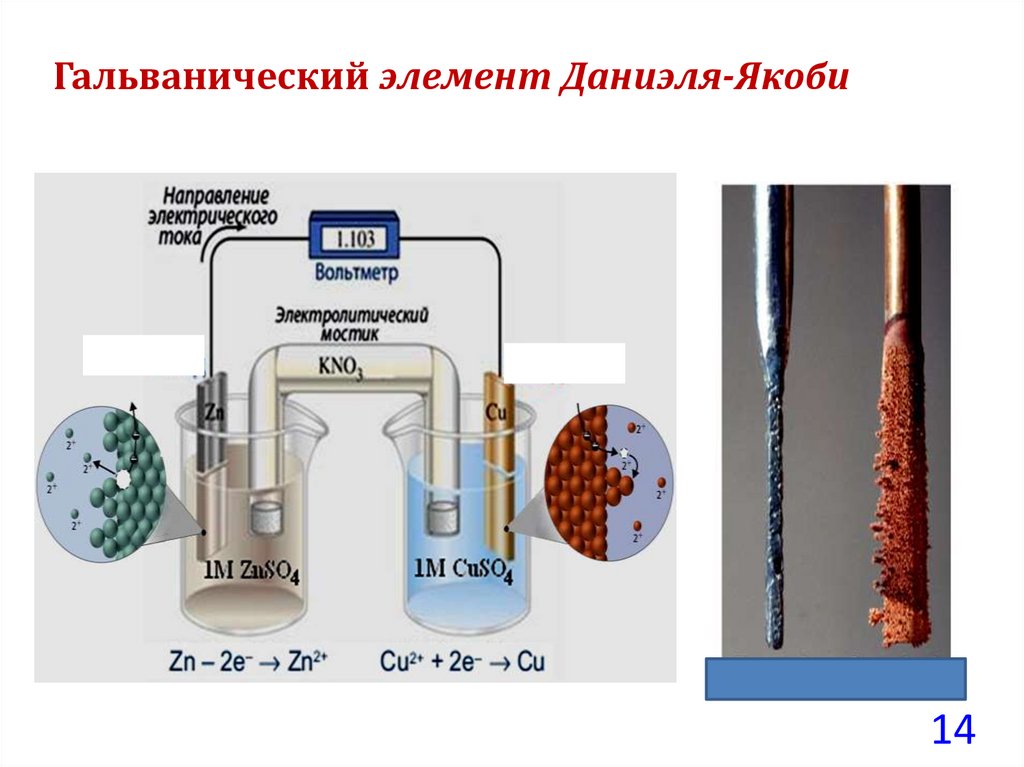
Гальванический элемент Даниэля-ЯкобиРассмотрим подробно обратимый гальванический элемент
Даниэля-Якоби (Джон Фредерик Даниэль, Борис Семенович
Якоби).
Состоит из двух полуэлементов (электродов):
– цинковой (Zn) и медной (Cu) пластин,
помещенных соответственно в растворы сульфатов цинка
(ZnSO4)и меди (CuSO4).
Между растворами может находиться полупроницаемая
мембрана или солевой мостик.
12
13.
Гальванический элемент Даниэля-Якоби13
14.
Гальванический элемент Даниэля-Якоби14
15.
Реакции на отдельных электродахзапишем в виде:
Zn→Zn2++2ē (окисление)
Сu2++2ē→Сu (восстановление).
Суммарный
окислительновосстановительный
процесс
в
электрохимической цепи выражается
реакцией:
– Zn│Zn2+║Cu2+│Cu +.
Если замкнуть цепь, соединив металлы проводником, то на
цинковом электроде начнется процесс отрыва электронов и
перехода ионов с поверхности металла в раствор – окисление
цинка.
На медном электроде электроны будут присоединяться к
ионам металла, перешедшим из раствора на поверхность –
восстановление меди.
Таким образом, в гальваническом элементе возникнет
электрический ток: электроны начнут перемещаться от
отрицательного цинкового на положительный медный электрод.
15
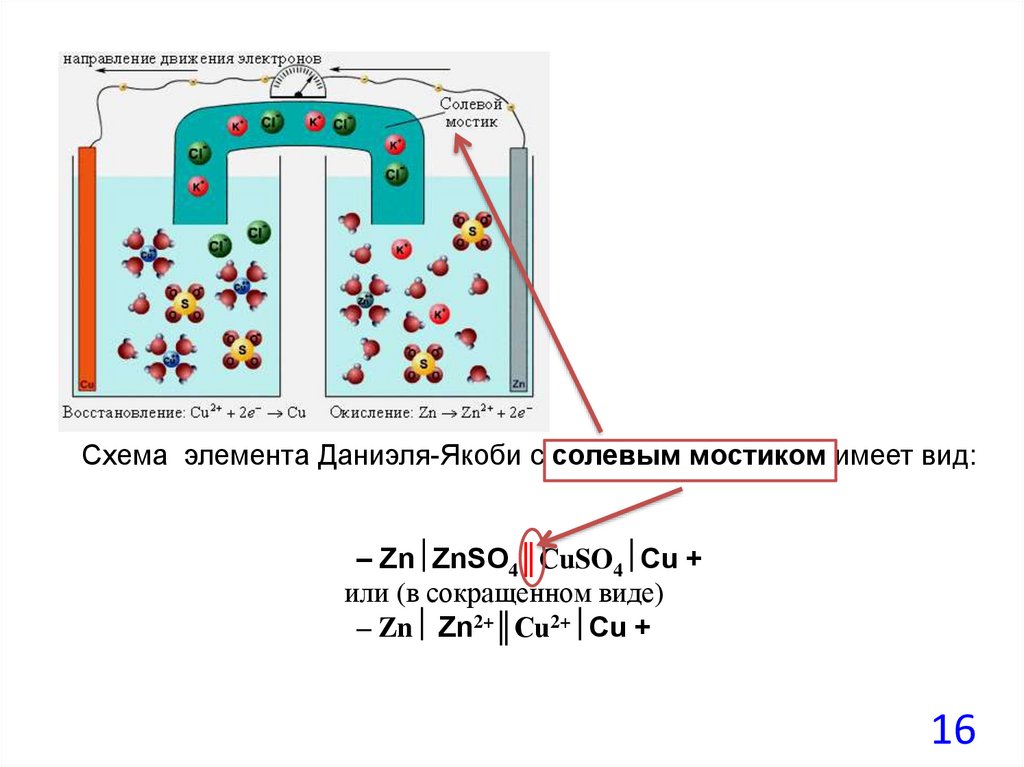
16.
Схема элемента Даниэля-Якоби с солевым мостиком имеет вид:– Zn ZnSO4║СuSO4 Cu +
или (в сокращенном виде)
– Zn Zn2+║Cu2+ Cu +
16
17.
Все электроды и, соответственно, гальваническиеразделить на:
обратимые
и
необратимые.
элементы можно
Электрод и гальванический элемент НЕобратимы, если при перемене
направления электрического тока в них протекают различные по природе
окислительно-восстановительные реакции.
Электрод и гальванический элемент обратимы, если при перемене
направления электрического тока протекают обратные друг другу, т.е.
противоположные по направлению окислительно-восстановительные
реакции.
17
18.
НЕобратимые электроды:Например, к таким электродам можно отнести цинк,
погруженный в раствор соляной кислоты (Zn HCl).
В зависимости от направления тока во внешней цепи на
электроде происходит:
или восстановление катионов водорода: 2Н++2ē→Н2
или окисление цинка:
Zn→Zn2++2ē.
Обратимые электроды:
Например, медь, погруженная в раствор СuSO4, т.е. медный
электрод (Сu Сu2+), относится к обратимым.
На нем при смене направления тока будут протекать:
или реакции восстановления меди Сu2++2ē→Сu
или ее окисления
Сu → Сu2++2ē.
18
19.
НЕобратимые гальванические элементы:Гальванический элемент, состоящий из двух электродов Zn HCl и
Сu HCl является необратимым. Схема гальванического элемента с
одним электролитом в этом случае имеет вид:
– Zn HCl Сu +.
При его работе:
на меди будет протекать реакция восстановления водорода
2Н++2ē→Н2,
цинк будет окисляться: Zn→Zn2++2ē.
При пропускании через элемент электрического тока в обратном
направлении:
• на цинке пойдет реакция восстановления водорода: 2Н++2ē→Н2,
•медь при этом будет окисляться Сu→Сu2++2ē.
Обратимые гальванические элементы:
Гальванический элемент Даниэля-Якоби является обратимым,
поскольку при пропускании через него электрического тока в обратном
направлении реакции на электродах пойдут в обратном направлении –
восстановление цинка: Zn2++2ē→Zn и окисление меди: Сu→Сu2++2ē.
19
20.
Электролиты – вещества, которые в растворе или расплавесамопроизвольно полностью или частично
распадаются на
.
заряженные частицы – ионы, способные к самостоятельному
существованию.
Процесс распада электролита в растворе на ионы называется
электролитической диссоциацией.
Первой количественной теорией электролитической диссоциации
была теория С. Аррениуса (1883–1887гг.).
Основные положения теории Аррениуса:
• При растворении электролиты (кислоты, основания и соли)
распадаются (диссоциируют) на противоположно заряженные ионы
самопроизвольно без пропускания через раствор электрического тока.
• Часть молекул электролита может не диссоциировать. Конкретное
вещество в одном растворителе является электролитом, а в другом –
может не распадаться на ионы. Доля молекул, распавшихся на ионы,
называется степенью диссоциации α.
α
Nдиссоц. мол е кул
Nобщее число молекул
20
21.
Основные положения теории Аррениуса (продолжение):.
• Степень диссоциации зависит от природы растворителя и электролита,
концентрации электролита, температуры, присутствия других электролитов
в растворе. Для сильных электролитов величина α→1, для слабых
электролитов – α«1.
• Раствор электролита рассматривается как простая механическая смесь
ионов, недиссоциированных молекул электролита и молекул растворителя,
взаимодействие между которыми отсутствует.
• Процесс диссоциации обратим. Равновесие между ионами и
недиссоциированными молекулами подчиняется, закону действующих масс
и описывается константой диссоциации Kдис.
К Zν А Zν ν К Z ν А Z
Kдис
С ν z С ν z
К
А
С
где ν+, ν– и z+, z– – число и заряд катионов и анионов, образующихся при
диссоциации. При этом выполняется условие (ν+)(z–)=(ν–)(z+).
21
22.
Электролиты, содержащие по одному катиону и аниону.
(NaCl, CuSO4) называются бинарными. Для таких электролитов с
учетом степени диссоциации α и исходной концентрации
электролита в момент растворения получим соотношение,
называемое законом разведения Оствальда.
.
К А К А
С(1 α) αС αС
α 2С
Kдис
1 α
С учетом того, что для слабых электролитов α«1, выражение
сводится к виду:
Kдис α 2С
α
Kдис
С
22
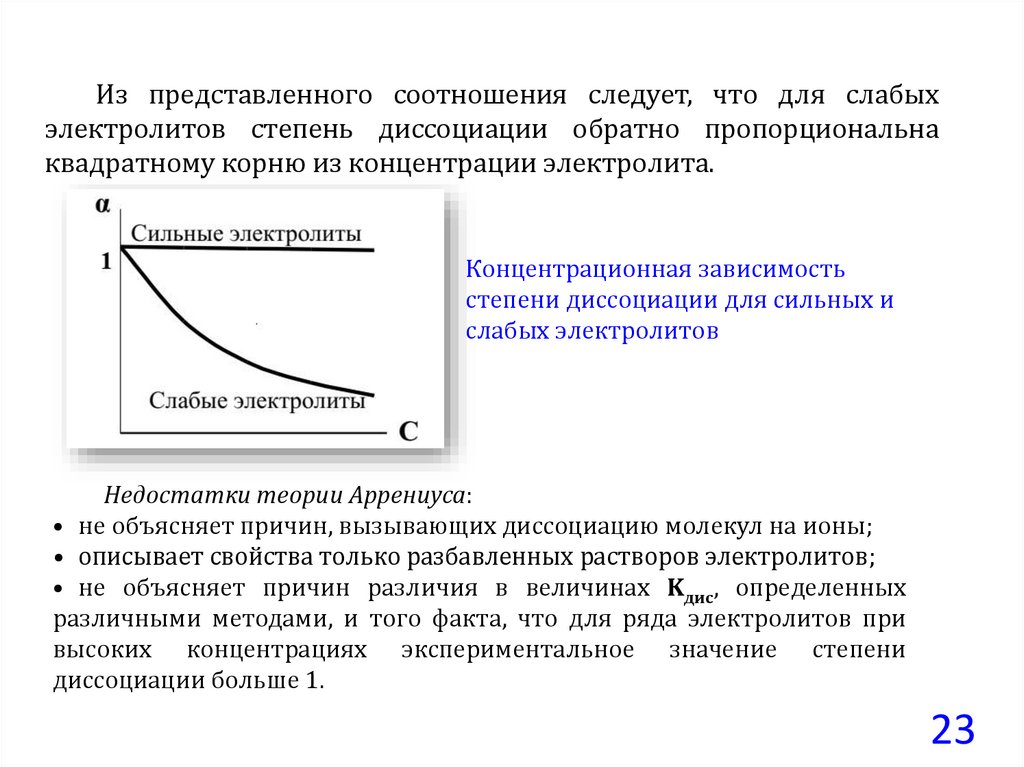
23.
Из представленного соотношения следует, что для слабыхэлектролитов степень диссоциации обратно пропорциональна
квадратному корню из концентрации электролита.
Концентрационная зависимость
степени диссоциации для сильных и
слабых электролитов
Недостатки теории Аррениуса:
• не объясняет причин, вызывающих диссоциацию молекул на ионы;
• описывает свойства только разбавленных растворов электролитов;
• не объясняет причин различия в величинах Kдис, определенных
различными методами, и того факта, что для ряда электролитов при
высоких концентрациях экспериментальное значение степени
диссоциации больше 1.
23
24.
Дальнейшееразвитие
теория
электролитической
диссоциации получила в работах В. Оствальда, И. А. Каблукова, В.
Нернста, П. Дебая, Э. Хюккеля и др.
Современная
теория
объясняет
электролитическую
диссоциацию сольватацией ионов молекулами растворителя:
в растворе ионы существуют в виде сольватированных
(гидратированных в случае водных растворов) частиц, способных
к электростатическому взаимодействию друг с другом.
Это приводит к тому, что свойства растворов электролитов
значительно отличаются от свойств идеальных растворов,
причем в большей степени, чем в случае неэлектролитов.
Меру отклонения растворов от идеальности характеризует
коэффициент активности γ. Концентрацию при работе с
растворами электролитов заменяют активностью a. Указанные
величины связаны соотношением a = Сγ, где С− концентрация
24
25.
Средние ионные величиныВ связи с тем, что в растворах электролитов всегда
присутствуют два вида заряженных частиц, надежных и
простых методов определения величины a и γ конкретных
индивидуальных ионов не существует.
Поэтому в теории и практике расчетов характеристик
гальванических элементов и электродов применяются
понятия средняя ионная активность электролита а± и
средний ионный коэффициент активности электролита γ ±.
В термодинамике растворов электролитов обычно
используется моляльная шкала концентраций – m (число моль
растворенного вещества в 1000 г растворителя), поэтому
можно записать:
1
a
m
ν = ν+ + ν– – общее число ионов
25
26.
am
1
Пример
Для раствора сульфата алюминия диссоциация протекает по
схеме:
Al2(SO4)3→2Al3++3SO42–
Значит, ν+ = 2, ν− = 3.
Тогда средняя ионная активность раствора Al2(SO4)3 :
m 108 m
3 15
a 2 3
2
5
26
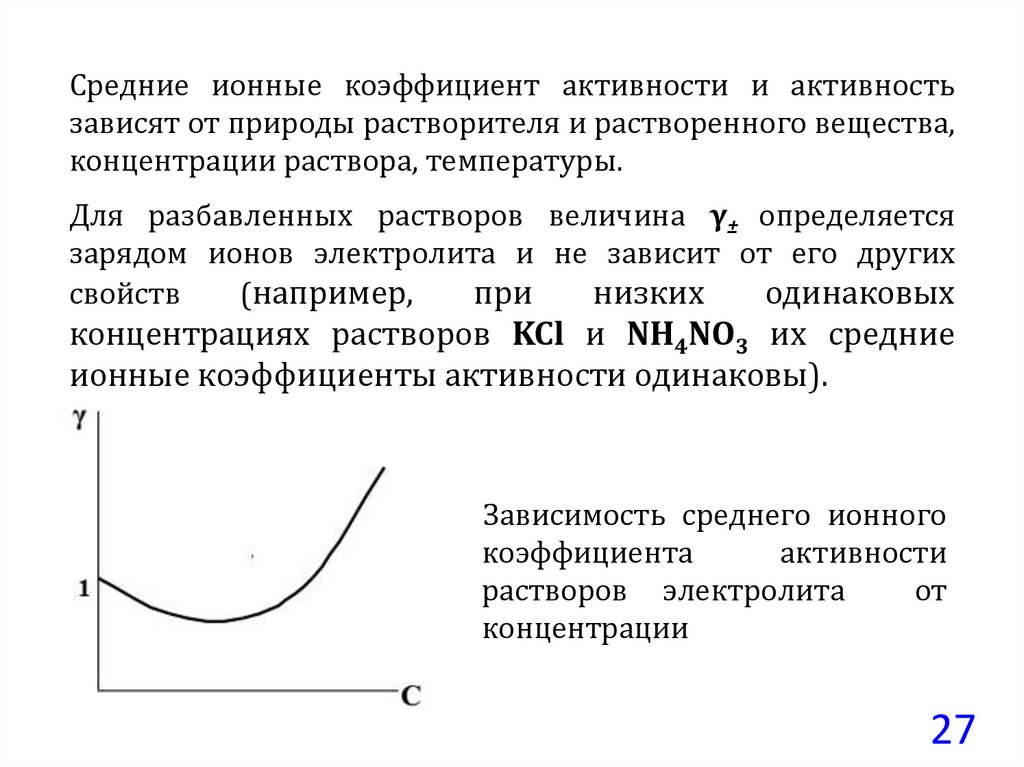
27.
Средние ионные коэффициент активности и активностьзависят от природы растворителя и растворенного вещества,
концентрации раствора, температуры.
Для разбавленных растворов величина γ± определяется
зарядом ионов электролита и не зависит от его других
свойств
(например,
при
низких
одинаковых
концентрациях растворов KCl и NH4NO3 их средние
ионные коэффициенты активности одинаковы).
Зависимость среднего ионного
коэффициента
активности
растворов электролита
от
концентрации
27
28.
Коэффициент активности γ± зависит от общей концентрацииионов и величины их зарядов, т.е. от ионной силы раствора I,
которая рассчитывается по формуле:
I
1
(mi z i2 )
2 i
где mi и zi – моляльность и заряд
. индивидуального иона в
составе электролита.
Для раствора сульфата алюминия, диссоциирующего в водном
растворе по уравнению Al2(SO4)3→2Al3++3SO42-, получим:
1
1
2
2
I (mAl3 z Al3 mSO2 z SO2 ) (2m 32 3m 22 ) 15m
4
4
2
2
28
29.
Как найти коэффициент активности γ±?Способ А:
Для большого числа электролитов в широком интервале
молярных концентраций и температур средние ионные
коэффициенты активности водных растворов экспериментально
определены и занесены в справочники.
Способ Б:
При отсутствии справочных данных величину
вычислить (оценить) по уравнению Дебая-Хюккеля
γ± можно
29
30.
Электростатическая теория сильныхэлектролитов Дебая-Хюккеля
Допущения теории Дебая-Хюккеля.
• Электролит в растворе диссоциирован полностью, и концентрация
ионов может быть рассчитана по аналитической концентрации
электролита.
• Ионы рассматриваются как точечные заряды, другие свойства ионов,
в том числе радиус, не учитываются.
• Ионы окружены ионной атмосферой, образованной противоположно
заряженными ионами, в которой распределение ионов подчиняется
законам классической статистики. Ионная атмосфера рассматривается
как непрерывная среда.
• Учитывается только электростатическое взаимодействие ионов друг
с другом и ионной атмосферой.
• Растворитель
выступает
только
в
качестве
среды,
не
взаимодействующей
с
ионами.
Причем
диэлектрическая
проницаемость раствора принимается равной диэлектрической
проницаемости чистого растворителя.
30
31.
Электростатическая теория сильныхэлектролитов Дебая-Хюккеля
На основании этих допущений получено уравнение для
расчета среднего ионного коэффициента активности –
предельный закон Дебая:
lg A z z I
где Аγ – коэффициент Дебая; I – ионная сила раствора.
Величина коэффициента Аγ зависит от температуры и природы
растворителя, его плотности и диэлектрической проницаемости.
При температуре 298 К в водном растворе Аγ = 0,5107.
Предельный закон справедлив только для разбавленных
растворов. Так, в водных растворах бинарных электролитов он
соблюдается при I<10-2.
31
32.
Электростатическая теория сильныхэлектролитов Дебая-Хюккеля
При более высоких концентрациях используется второе
I
приближение теории Дебая-Хюккеля: lg A z z
1 I
Второе приближение применимо для растворов с ионной силой
I≤0,05.
Зависимости среднего ионного
коэффициента активности от ионной
силы раствора LiCl, рассчитанные по
предельному закону и уравнению 2го приближения теории ДебаяХюккеля, а также
экспериментальные данные
32
33.
Электростатическая теория сильныхэлектролитов Дебая-Хюккеля
.
Для растворов с I≤0,3 применимо уравнение третьего
приближения теории Дебая-Хюккеля (уравнение Дэвиса).
lg A z z
I
1 I
0,2 I
33
34.
Теория гальванического элементаВозникновение скачка потенциала на границе
раздела фаз металл/раствор и раствор
Каждый электрод характеризуется определенным значением
электродного
потенциала
φ.
Он
возникает
на
границе
соприкосновения металла или полупроводника (проводник I рода) и
раствора электролита (проводник II рода), вследствие перехода
электрических зарядов через границу раздела фаз.
Переход заряженных частиц между фазами обусловлен разностью
химических потенциалов в соприкасающихся фазах и в случае контакта
металл/жидкость
(раствор
электролита)
сопровождается
формированием
двойного
электрического
слоя
(ДЭС)
и
возникновением скачка потенциала φ на границе раздела. Основными
причинами возникновения скачка потенциала являются:
• ионизация атомов металла на ионы (MZ+) и электроны внутри
металла (Мe): Me↔MeZ++zē;
• сольватация ионов металла, находящихся на его поверхности,
молекулами растворителя (L): MeZ++nL↔MeZ+·nL.
34
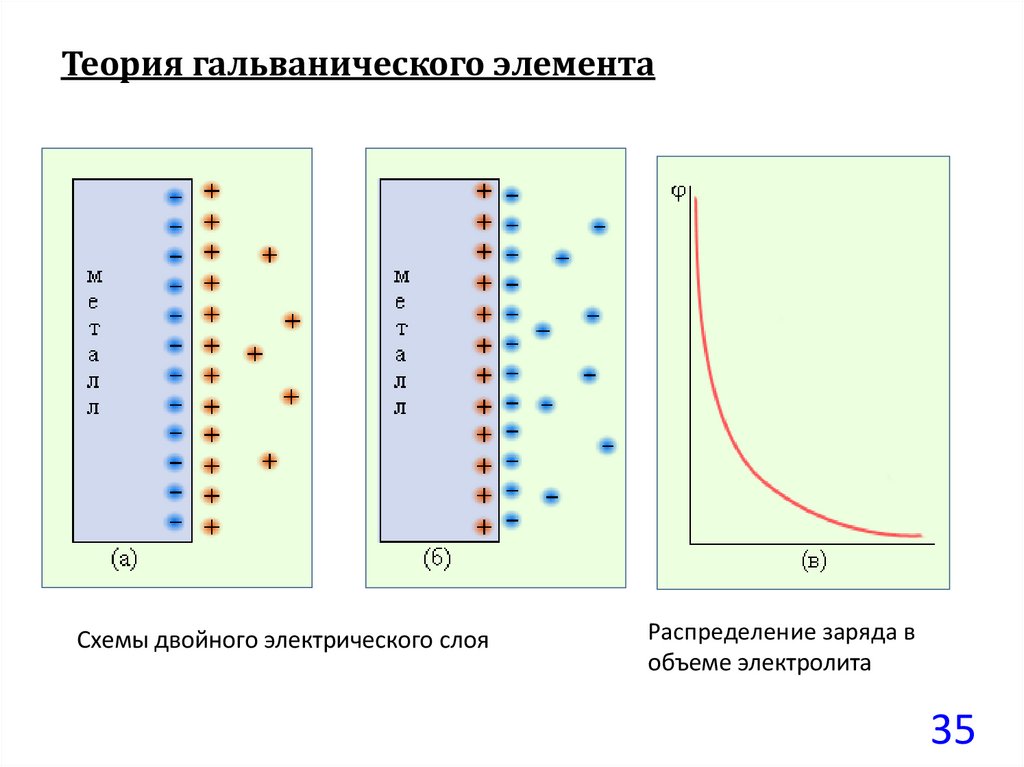
35.
Теория гальванического элементаСхемы двойного электрического слоя
Распределение заряда в
объеме электролита
35
36.
Электродвижущая сила гальванического элементаУравнение Нернста
Электрической характеристикой электрохимической цепи или
гальванического элемента является электродвижущая сила (ЭДС) – E.
ЭДС характеризует работу по перемещению единичного
положительного заряда (q= 1 Кл) вдоль контура электрохимической
системы.
Здесь речь идет о полезной электрической работе (W' > 0),
совершаемой в гальваническом элементе
Работа по переносу заряда равна: WP ,T ( rG )P ,T zFE
где F – постоянная Фарадея F=96485 Кл/моль ; z – число электронов,
участвующих в окислительно-восстановительной реакции.
Математически ЭДС равна алгебраической сумме всех скачков потенциалов,
возникающих на границах раздела фаз, входящих в состав разомкнутого
гальванического элемента:
Е диф
где φ+ и φ– – равновесные электродные потенциалы положительного и
отрицательного электродв; φдиф – равновесный диффузионный потенциал на
границе раздела жидкость/жидкость
36
37.
Электродвижущая сила гальванического элементаУравнение Нернста
Допустим, в гальваническом элементе обратимо протекает
окислительно-восстановительная реакция:
1 A1 2 A 2 3 A 3 4 A 4
На основании уравнения изотермы химической реакции, с учетом
того, что реакция протекает в неидеальном растворе, используя
вместо давлений активности реагентов, можно записать:
a3 3 a4 4
( rG )P ,T RT ln K a RT ln
a1 1 a2 2
Константа равновесия:
a3 3 a4 4
Ka
a1 1 a2 2
Учтем, что ( r G ) P ,T zFE , поделим всё уравнение на −zF,
и заменим знак у 2-го слагаемого с учетом свойств логарифмов:
RT
RT a1 1 a2 2
E
ln K a
ln
zF
z F a 3 3 a4 4
37
38.
Электродвижущая сила гальваническогоэлемента
.
.
Уравнение Нернста
RT
RT a1 1 a2 2
E
ln K a
ln
zF
z F a 3 3 a4 4
В стандартных условиях, т.е. когда активности всех участников
реакции равны единице, ЭДС гальванического элемента называют
стандартной и обозначают Е0. Стандартная ЭДС связана с
константой равновесия соотношением:
RT
0
E
zF
ln K a
Величина E0 может быть рассчитана по стандартным потенциалам
φо электродов (приведенным в справочной литературе):
Е 0 0 0
Итак, получаем уравнение Нернста:
1
2
R
T
a
a
E E0
ln 1 3 2 4
zF a3 a4
38
39.
Термодинамика обратимого гальванического элементаУравнение Гиббса-Гельмгольца при постоянных давлении и
температуре с учетом свойств характеристических функций может
быть записано в виде:
G
r G r H T r S r H T r
T P
Для обратимой реакции в гальваническом элементе, с учетом
формулы
( G ) zFE
r
получим:
P ,T
( zFE )
rG r H T
T
P
Тогда:
E
r G r H z FT
T P
39
40.
Термодинамика обратимого гальванического элементаE
r G r H zFT
T P
Члены уравнения имеют следующий
физический смысл:
– тепловой эффект химической реакции, протекающей в
r H гальваническом
элементе, или полный запас химической энергии;
r G zFE
– полезная электрическая работа (W’P,T), получаемая за
счет энергии химической реакции, протекающей в
гальваническом элементе, или свободная энергия;
E
r S zF
T
P
– изменение энтропии в ходе реакции;
– энергия, которой обменивается система
r G
E с окружающей средой при работе
Qобр T r S T
zFT
T
T P элемента в обратимом режиме, или
связанная энергия химической реакции.
E
– изобарный температурный коэффициент ЭДС.
T P
W rG
η
Qнеобр r H
– коэффициент полезного действия гальванического
элемента
40
41.
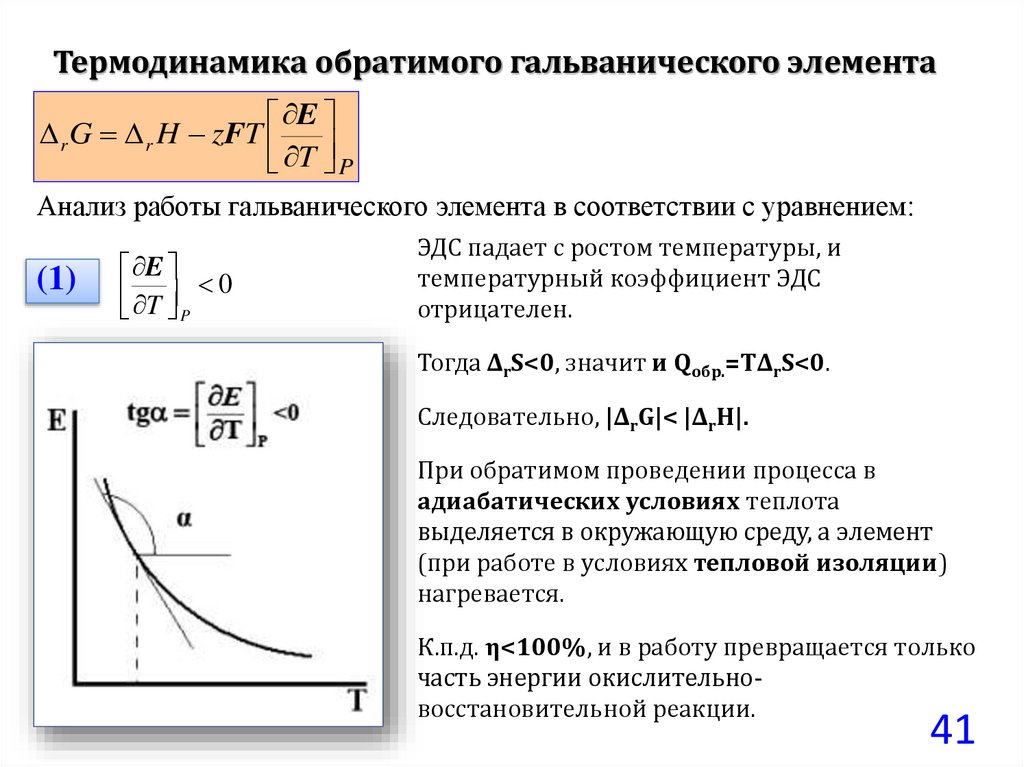
Термодинамика обратимого гальванического элементаE
r G r H zFT
T P
Анализ работы гальванического элемента в соответствии с уравнением:
(1)
E
T 0
P
ЭДС падает с ростом температуры, и
температурный коэффициент ЭДС
отрицателен.
Тогда ΔrS<0, значит и Qобр.=TΔrS<0.
Следовательно, |ΔrG|< |ΔrH|.
При обратимом проведении процесса в
адиабатических условиях теплота
выделяется в окружающую среду, а элемент
(при работе в условиях тепловой изоляции)
нагревается.
К.п.д. η<100%, и в работу превращается только
часть энергии окислительновосстановительной реакции.
41
42.
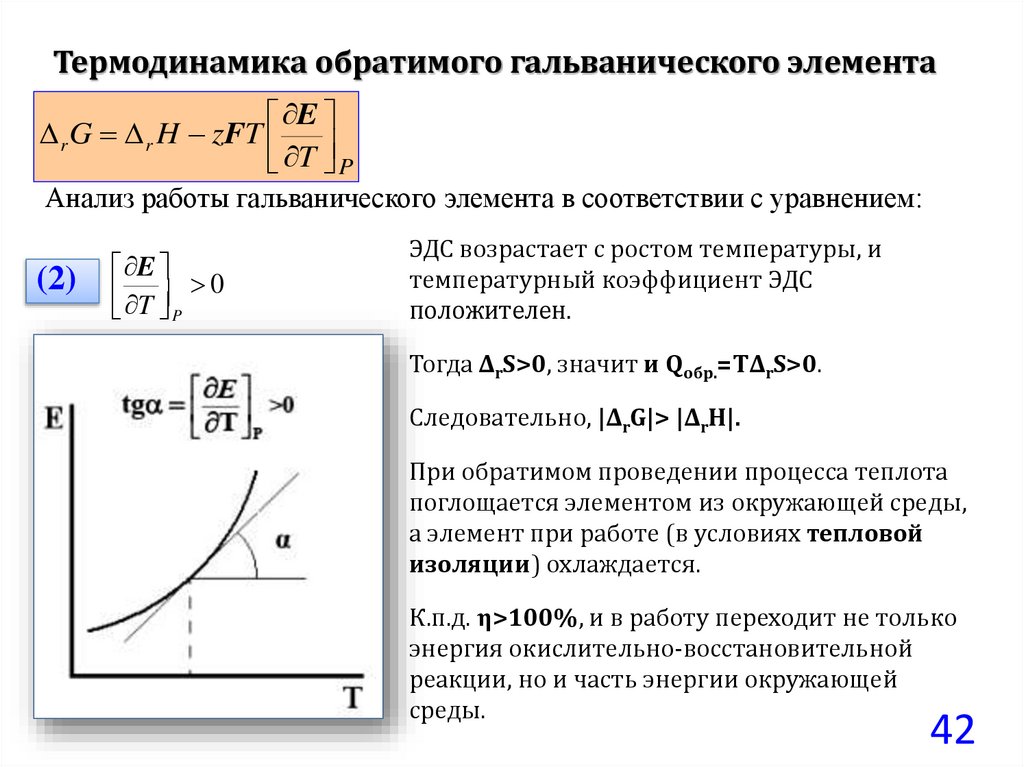
Термодинамика обратимого гальванического элементаE
r G r H zFT
T P
Анализ работы гальванического элемента в соответствии с уравнением:
(2)
E
T 0
P
ЭДС возрастает с ростом температуры, и
температурный коэффициент ЭДС
положителен.
Тогда ΔrS>0, значит и Qобр.=TΔrS>0.
Следовательно, |ΔrG|> |ΔrH|.
При обратимом проведении процесса теплота
поглощается элементом из окружающей среды,
а элемент при работе (в условиях тепловой
изоляции) охлаждается.
К.п.д. η>100%, и в работу переходит не только
энергия окислительно-восстановительной
реакции, но и часть энергии окружающей
среды.
42
43.
Термодинамика обратимого гальванического элементаE
r G r H zFT
T P
Анализ работы гальванического элемента в соответствии с уравнением:
(3)
E
T 0
P
ЭДС гальванического элемента не зависит от
температуры (рис. 3.6, в), температурный
коэффициент ЭДС равен нулю.
Тогда ΔrS=0, значит и Qобр.=0.
Следовательно, |ΔrG|= |ΔrH|.
Коэффициент полезного действия η=100 %, и в
полезную работу полностью превращается
энергия химической реакции, протекающей в
гальваническом элементе.
43
44.
Электродный потенциалРанее было отмечено, что на границе раздела металл/раствор в
составе электрода возникает скачок потенциала, который называют
электродным потенциалом – φ.
Экспериментально величину скачка потенциала определить
невозможно. Однако разность электродных потенциалов в
гальваническом элементе, характеризующих его ЭДС, может быть
легко измерена.
Для этого используют цепь, в которой одним из электродов
выбран водородный электрод (H+│H2,Pt) (см. раздел «Газовые
электроды»).
Стандартный потенциал водородного электрода в 1953 г. было
решено условно считать равным нулю при любой температуре.
В электрохимии стандартными являются следующие условия:
активность ионов в растворе а=1 моль/кг и давление Р=1 атм.
44
45.
Гальванические элементы, используемые для определенияэлектродных потенциалов медного (а) и цинкового (б) электродов
.
– Рt,Н2│Н+ Cu2+│Cu +
– Zn│Zn2+ Н+│Н2,Рt +
Например, потенциал медного электрода (Cu2+│Cu) численно равен ЭДС
электрохимической цепи, представленной на рис. (а):
Е Cu 2 Cu H H Cu 2 Cu
2
0
45
46.
Реакцию восстановления на отдельном электроде, протекающую сучастием окисленной (Ox) и восстановленной (Red) форм вещества,
называют электродным процессом или потенциалопределяющей
реакцией. В общем виде его можно представить как:
oxOx ze red Red
Тогда уравнение для расчета потенциала электрода может быть
представлено в виде уравнения Нерста:
aOxo x
RT
ln red
zF
a Re d
0
При Т=298 К с учетом перехода от натурального логарифма к
ox
десятичному получим:
0,059 aOx
lg red
z
a Re d
0
46
47.
oxa
R
T
0
ln Oxred
zF
a Re d
Величина стандартного электродного потенциала φо зависит
только:
от температуры
от природы участников окислительно-восстановительного
процесса.
Значения φо металлических электродов определяют положение
металла в ряду напряжений и приведены в справочной литературе
(см. также «Электрохимический ряд напряжений металлов»).
47
48.
Классификация электродовЭлектроды первого рода
Электроды I рода обратимы по одному виду ионов:
o или только по катионам
oили только по анионам
К ним относятся электроды:
металлические
металлоидные
амальгамные
газовые
48
49.
Классификация электродовЭлектроды первого рода
Металлические электроды
Металлические электроды состоят из металлической пластинки,
погруженной в раствор соли того же металла, и обозначаются схемой
МeZ+│Мe.
При работе элемента, включающего такой электрод, на
металлической пластинке идет процесс перехода катионов из металла
в раствор либо из раствора в металл. Электродный процесс
записывается в виде: МeZ++zē→Мe.
Металлические электроды обратимы только по катиону, и их
потенциал связан с активностью катиона в растворе.
Уравнение Нернста:
Mе
Z
Mе
0
Mе Z Mе
RT a Mе Z
ln
zF
a Mе
49
50.
Классификация электродовЭлектроды первого рода
Амальгамные электроды
Амальгамные электроды состоят из амальгамы металла,
находящейся в контакте с раствором, содержащим ионы этого металла,
и обозначаются схемой МeZ+│Мe(Hg).
Амальгама представляет собой твердый раствор металла и ртути.
Электродный процесс записывается в виде: МeZ++zē→Мe(Hg).
Амальгамные электроды обратимы только по катиону, и, согласно
уравнению Нернста, их потенциал связан с активностью катиона в
растворе и с активностью металла в составе амальгамы. Следует
отметить, что aMe(Hg)≠1.
MеZ Mе( Hg)
0
Mе Z Mе ( Hg)
RT aMеZ
ln
zF aMе( Hg)
50
51.
Классификация электродов.
Электроды первого рода
Металлоидные электроды
Металлоидные электроды состоят из неметалла, погруженного в
раствор соли, содержащей анионы этого неметалла, и обозначаются
схемой А│АZ–.
Данный тип электродов обратим только относительно аниона, и их
потенциал связан с активностью анионов. Электродный процесс
записывается в виде: A+zē→Az–, а уравнение Нернста:
A AZ A0 AZ
RT aA
ln
zF aAZ
Селеновый Se│Se2– и йодный I2кр│I– электроды относятся к
металлоидным электродам I рода.
Для йодного электрода потенциалопределяющая реакция: 2I–+2ē→I2, а
уравнение Нернста:
RT
I I I0 I
2
2
2F
ln aI2
51
52.
Классификация электродов.
Электроды первого рода
Газовые электроды
Газовые электроды также относятся к электродам первого рода. Они
представляют собой инертный (не участвующий в реакции) металл,
погруженный в раствор, через который пропускается (барботируется) газ.
В состав раствора входит электролит, содержащий ионы, которые
участвуют в потенциалопределяющей реакции.
Устройству газового электрода соответствует схема:
инертный металл, газ│раствор.
52
53.
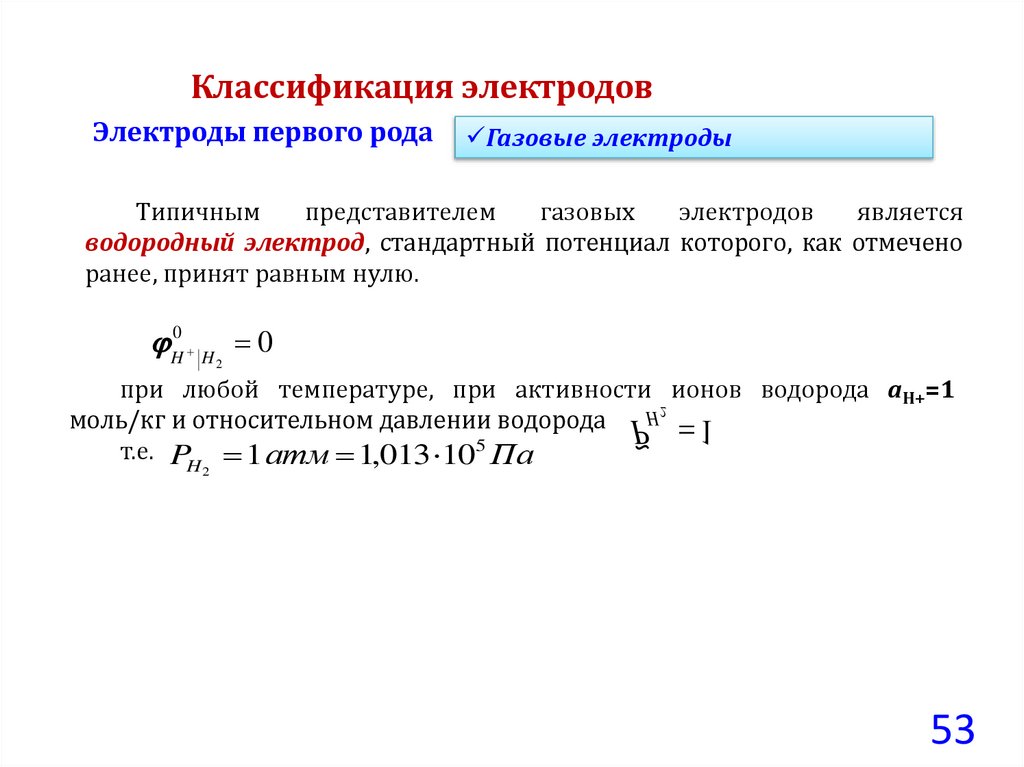
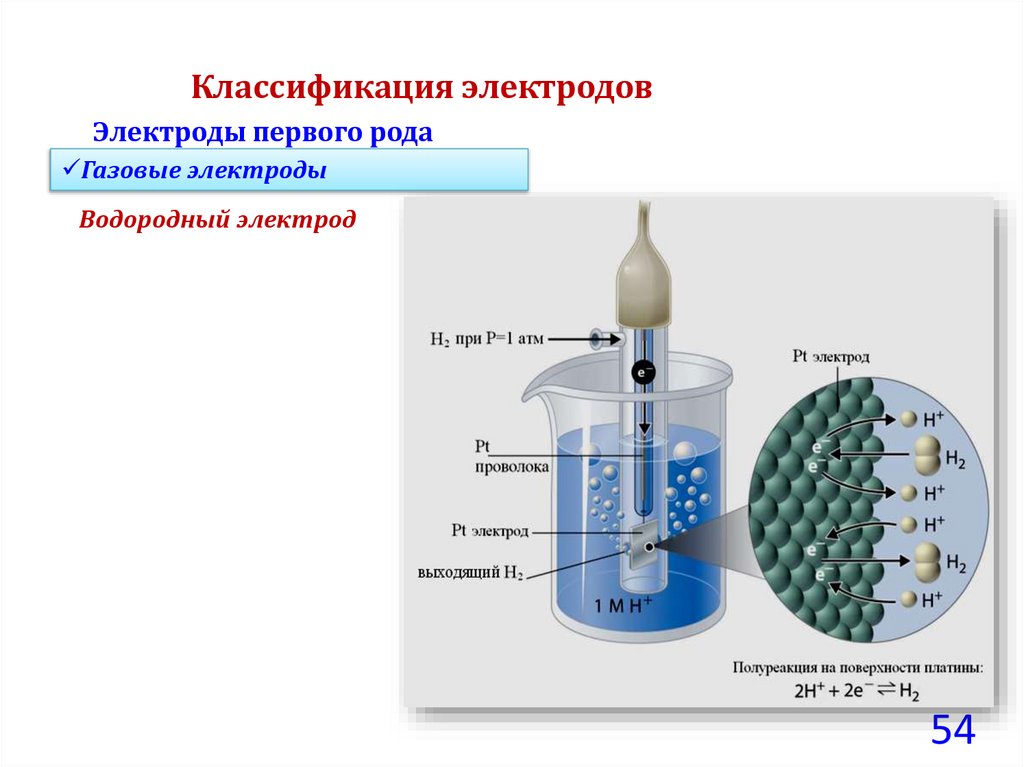
Классификация электродовЭлектроды первого рода
Газовые электроды
Типичным
представителем
газовых
электродов
является
водородный электрод, стандартный потенциал которого, как отмечено
ранее, принят равным нулю.
H0 H 0
2
при любой температуре, при активности 2 ионов водорода aН+=1
H 1
моль/кг и относительном давлении водорода P
~
т.е. PH 1 атм 1,013 105 Па
2
53
54.
Классификация электродовЭлектроды первого рода
Газовые электроды
Водородный электрод
54
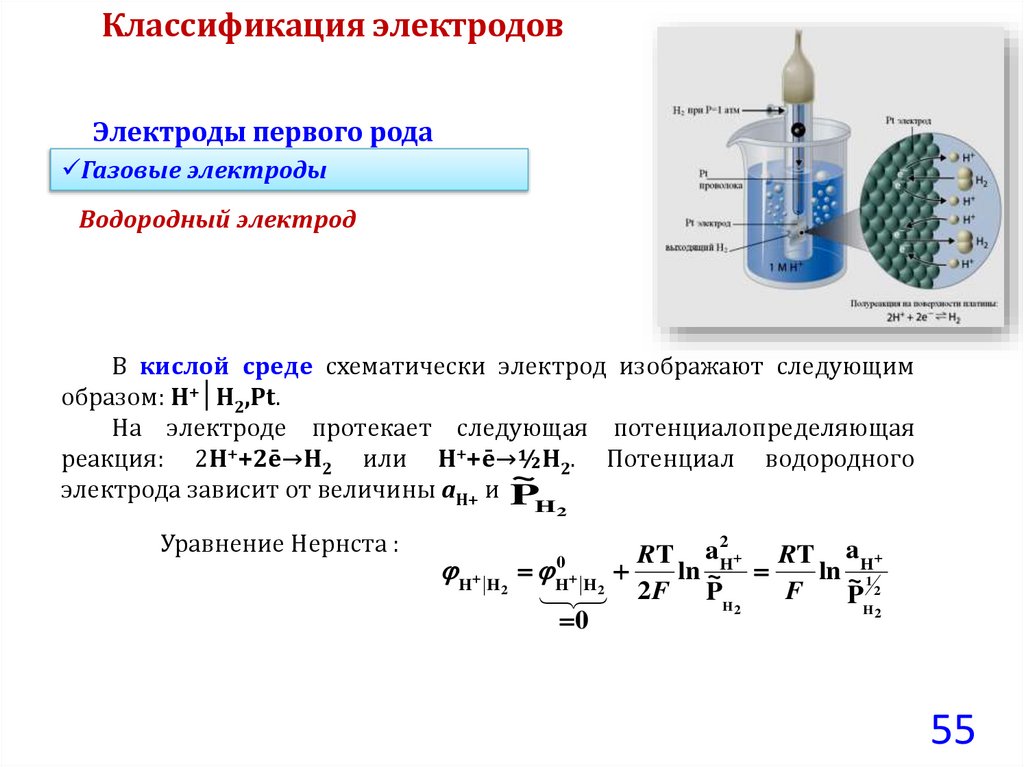
55.
Классификация электродовЭлектроды первого рода
Газовые электроды
Водородный электрод
В кислой среде схематически электрод изображают следующим
образом: Н+│Н2,Рt.
На электроде протекает следующая потенциалопределяющая
реакция: 2Н++2ē→Н2 или Н++ē→½Н2. Потенциал водородного
~
электрода зависит от величины aН+ и P
H2
Уравнение Нернста :
H H
2
2
RT a H
0
ln ~
H H2
0
2F
PH
2
RT a H
ln ~ 1
F
P 2
H2
55
56.
Классификация электродовЭлектроды первого рода
Газовые электроды
Водородный электрод
При пропускании водорода через щелочную среду на электроде
протекает потенциалопределяющая реакция, 2Н2О+2ē→Н2+2ОН–,
при этом схема газового электрода записывается следующим
образом:
Рt,Н2│Н2О,ОН–.
Потенциал электрода также зависит от величины pH и
описывается выражением:
2
H OH
2
RT
0
ln ~
H 2 OH
2F P
aH 2О
2
a
ОH
H
2
56
57.
Классификация электродовЭлектроды второго рода
Электрод второго рода – это металл, покрытый труднорастворимым
соединением этого металла (солью, оксидом, гидроксидом), который
погружен в раствор, содержащий анионы, входящие в состав
труднорастворимого соединения.
Схематично в общем виде представляется как AZ-|MеA,Mе.
В потенциалопределяющей реакции принимают участие как катионы,
так и анионы. В реакции восстановления участвуют катионы металла,
возникающие при диссоциации труднорастворимого соединения, которая
протекает также с образованием анионов:
MеA→ν–AZ–+ν+MеZ+
ν+MеZ++zē→ν+Me.
В итоге получим суммарное уравнение электрохимического процесса:
MеA+zē→ ν+Me+ν–AZ–
57
58.
Классификация электродовЭлектроды второго рода
.
Примером электрода второго рода является
хлорсеребряный электрод:
КСl│АgСl,Аg
Хлорсеребряный электрод обратим
относительно анионов хлора в соответствии с
потенциалопределяющей реакцией:
AgCl+ē→Ag+Cl–.
Величина потенциала хлорсеребряного
электрода зависит от активности ионов
хлора, данная зависимость имеет следующий
вид:
Cl AgCl ,Ag
RT
0
ln aCl
Cl AgCl ,Ag
F
58
59.
Классификация электродов.
Окислительно-восстановительные электроды
Окислительно-восстановительным (или редокс-электродом) называется
электрохимическая система, состоящая из инертного проводника первого
рода, помещенного в раствор электролита, содержащего окисленную (Ox) и
восстановленную (Red) форму вещества. Устройство электрода может быть
представлено схемой:
Ox,Red│Pt.
Процессы получения и отдачи электронов атомами или ионами
происходят на поверхности металла (обычно платины), который в
электродном процессе не участвует и является лишь переносчиком
электронов.
Пример: Fe3+ + ē ↔ Fe2+
RT aFe 3
Fe 3 ,Fe 2 Fe 3 ,Fe 2
ln
F
aFe 2
59
60.
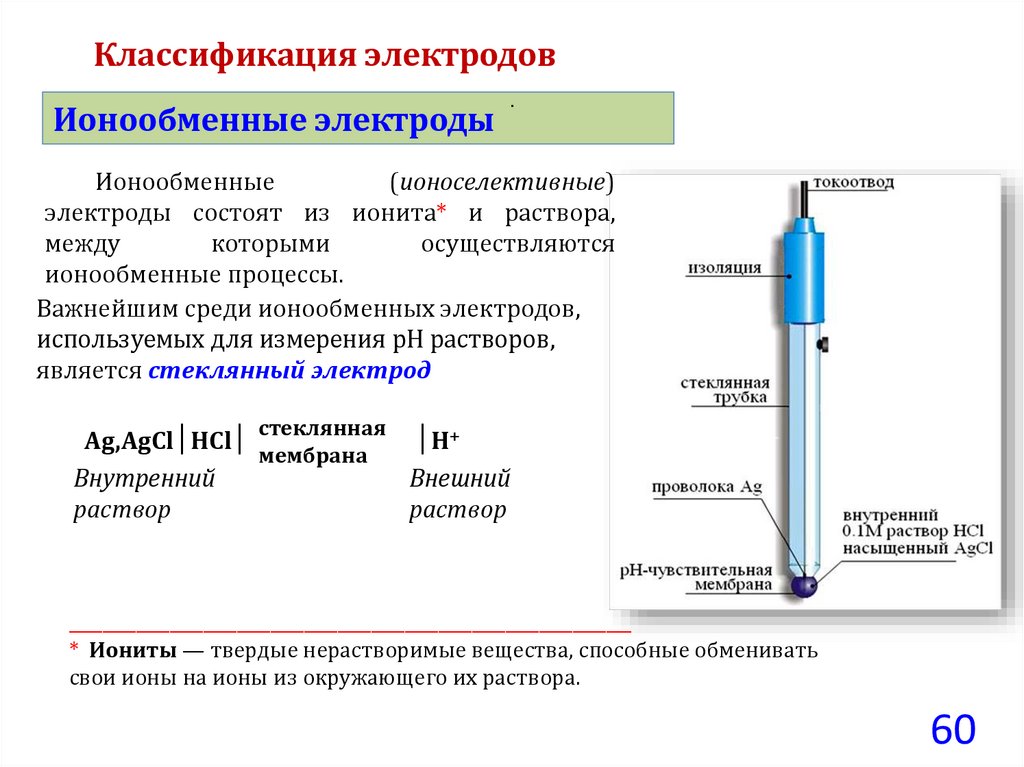
Классификация электродовИонообменные электроды
.
Ионообменные
(ионоселективные)
электроды состоят из ионита* и раствора,
между
которыми
осуществляются
ионообменные процессы.
Важнейшим среди ионообменных электродов,
используемых для измерения pH растворов,
является стеклянный электрод
стеклянная
Аg,АgСl│НСl│
мембрана
Внутренний
раствор
│Н+
Внешний
раствор
___________________________________________________________________
* Иониты — твердые нерастворимые вещества, способные обменивать
свои ионы на ионы из окружающего их раствора.
60
61.
Типы гальванических элементови их практическое применение
Классификация гальванических элементов
В соответствии с особенностями устройства и электродных
реакций гальванические элементы классифицируются по
нескольким типам.
По характеру процессов, протекающих на электродах, при
изменении направления тока различают обратимые и
необратимые гальванические элементы (раньше нами были
подробно рассмотрены их особенности).
По наличию или отсутствию диффузионного потенциала
электрохимические цепи делятся на элементы без переноса и с
переносом ионов.
По характеру окислительно-восстановительного процесса и
реакций на электродах гальванические элементы делятся на
химические и концентрационные цепи.
61
62.
Типы гальванических элементов и их практическое применениеЭлементы без переноса ионов
К ним относятся электрохимические цепи, в которых
отсутствует непосредственный контакт между растворами
электролитов, вследствие чего диффузионный потенциал снижается
практически до нуля. Это цепи с одним электролитом, а также
элементы с двумя электролитами с солевым (электролитическим)
мостиком.
Например, электрохимическая цепь с одним электролитом:
– Рt,Н2│НСl│АgСl,Аg +.
Солевой мостик представляет собой концентрированный
(обычно насыщенный)
раствор хорошо растворимой соли, у
которой скорости движения катиона и аниона и их молярные
электрические проводимости приблизительно равны (KCl, KNO3,
NH4NO3).
Простейшей электрохимической цепью с солевым мостиком без
переноса ионов является гальванический элемент Даниэля-Якоби,
схема которого представляется в виде:
– Zn│Zn2+║Cu2+│Cu +.
62
63.
Типы гальванических элементов и их практическое применениеЭлементы с переносом ионов
К таким гальваническим элементам относят те, в которых
осуществляется непосредственный контакт растворов
электролитов и происходит перенос ионов на границе
раздела раствор│раствор.
При этом растворы могут
отличаться концентрацией одного и того же электролита или
содержать различные электролиты.
Например:
– Cd | CdSO4 AgNO3 |Ag +
или
– Zn | ZnSO4 ZnSO4 | Zn +
a1(Zn2+ ) ≠ a2(Zn2+ )
В этом случае ввиду различия в скоростях переноса катионов и
анионов через границу соприкосновения растворов в цепи
возникает диффузионный потенциал
63
64.
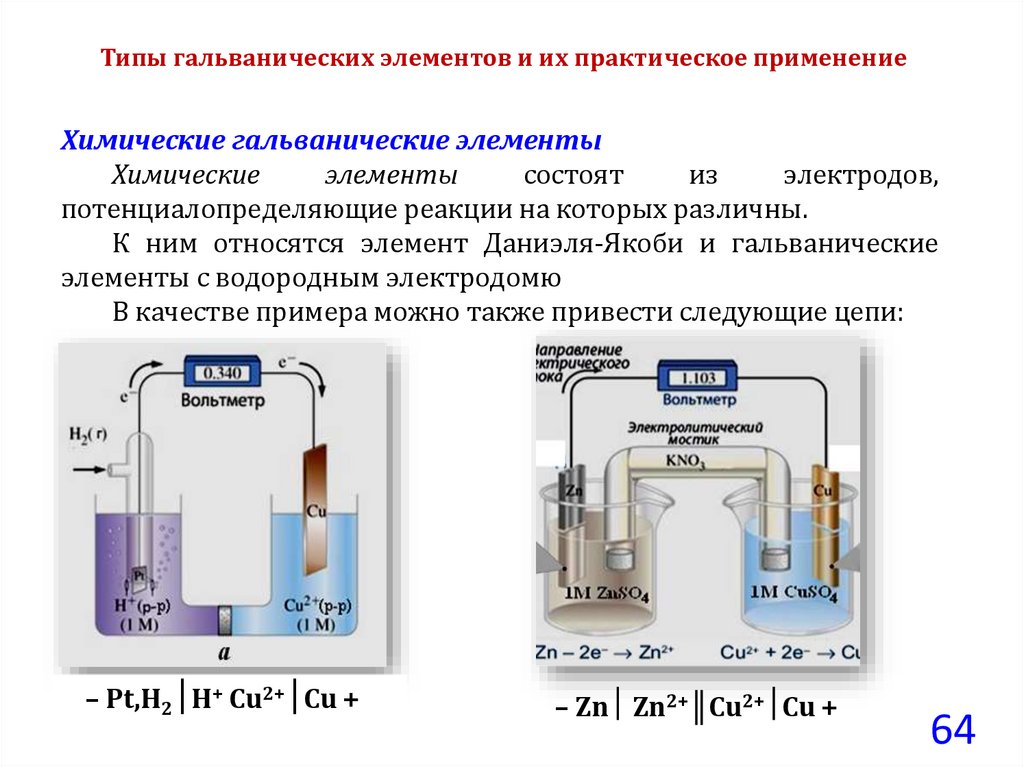
Типы гальванических элементов и их практическое применениеХимические гальванические элементы
Химические
элементы
состоят
из
электродов,
потенциалопределяющие реакции на которых различны.
К ним относятся элемент Даниэля-Якоби и гальванические
элементы с водородным электродомю
В качестве примера можно также привести следующие цепи:
– Рt,Н2│Н+ Cu2+│Cu +
– Zn Zn2+║Cu2+ Cu +
64
65.
Типы гальванических элементов и их практическое применениеКонцентрационные цепи
Концентрационные цепи состоят из электродов, на
которых
протекают
одинаковые
по
природе
потенциалопределяющие реакции, но в противоположных
направлениях.
По этой причине стандартные потенциалы электродов в
цепи будут одинаковы, и стандартная ЭДС будет равна нулю,
E0=0.
В состав таких цепей могут входить одинаковые
электроды с различной активностью ионов в растворах
электролитов.
Например:
– Ni | NiSO4 || NiCl2 | Ni +.
a1(Ni 2+ ) < a2(Ni 2+ )
65
66.
Типы гальванических элементов и их практическое применениеПрактическое применение электрохимических систем
Потенциометрия – важный метод исследования и анализа, в
основе которого лежат:
−термодинамические
соотношения
между
ЭДС
электрохимических систем или электродными потенциалами,
физико-химическими параметрами растворов и химических
реакций
Потенциометрия используется для решения следующих задач[
определение стандартных потенциалов электродов и
констант равновесия электродных реакций;
определение средних ионных коэффициентов активности
электролитов в растворах;
определение
термодинамических
характеристик
химических реакций
определение pH растворов
66
67.
Практическое применение электрохимических системОпределение pH растворов
Водородный показатель – отрицательный десятичный логарифм
активности ионов водорода в растворе: pH=–lgаН+
Определение pH в кислых средах с водородным
электродом производят с помощью электрода сравнения,
к примеру, хлорсеребряного.
Pt, H2 H+║ KCl│AgCl, Ag.
Очевидно, что ЭДС цепи и рН раствора при 298 К можно
рассчитать по соотношениям:
E Cl AgCl ,Ag H H Cl AgCl ,Ag 0,059pH
2
pH
E Cl AgCl ,Ag
0,059
67
68.
Практическое применение электрохимических системОпределение pH растворов
Недостатки водородного электрода в качестве индикаторного:
достаточно медленное установление равновесия на
электроде,
узкая область измерения pH≤7,
необходимость использования высокочистого водорода
присутствие посторонних окислителей или
восстановителей в растворе также искажают результаты
измерений
68
69.
Практическое применение электрохимических системОпределение pH растворов
.
Для определения pH с хингидронным (хг) электродом собирают
цепь:
Ag,AgCl│KCl║С6H4O2,С6H4 (OH)2,H+│Pt.
ЭДС цепи и рН раствора при 298 К можно рассчитать по
соотношениям:
0
E хг Cl AgCl ,Ag хг
0,059pH Cl AgCl ,Ag
pH
0
хг
Cl AgCl ,Ag E
0,059
Недостатками хингидронного электрода являются
неточность измерений в присутствии окислителей
восстановителей и ограниченная область измерения pH≤8
69
70.
Практическое применение электрохимических системОпределение pH растворов
.
Определение pH со стеклянным электродом проводится с
помощью электрохимической цепи:
стеклянная
Аg,АgСl│НСl│
мембрана
Внутренний
раствор
│Н+
Внешний
раствор
E Cl AgCl ,Ag cт Cl AgCl ,Ag cт0 m pH
Стеклянный электрод прост в эксплуатации, используется в
широком
диапазоне
pH=1÷14,
его
потенциал
быстро
устанавливается.
К основному недостатку электрода можно отнести хрупкость
стеклянной мембраны.
70
71.
Практическое применение электрохимических системТо́ пливный элеме́ нт, ТЭ (англ. fuel cell) — это электрохимическое устройство,
электрохимический источник тока, непосредственно преобразующий
химическую энергию топлива в электрическую энергию.
ЭДС в топливном элементе возникает в результате электрохимических процессов
из постоянно поступающих активных веществ.
Наиболее совершенными промышленно выпускаемыми источниками тока
являются низкотемпературные топливные элементы с рабочей температурой
ниже 200 °C. В качестве топлива в них используются водород,
жидкие углеводороды и другие виды топлива, в качестве катализатора,
обычно, платина
КПД промышленно выпускаемых топливных элементов достигает 60 %, как и у
наиболее совершенных электростанций с парогазовой установкой. В гибридных
установках, где топливные элементы используются совместно с паросиловыми
машинами, КПД комплексной установки может достигать 75 %[4].
Топливные элементы имеют высокий уровень экологической безопасности, в них
могут использоваться возобновляемые виды топлива
71
72.
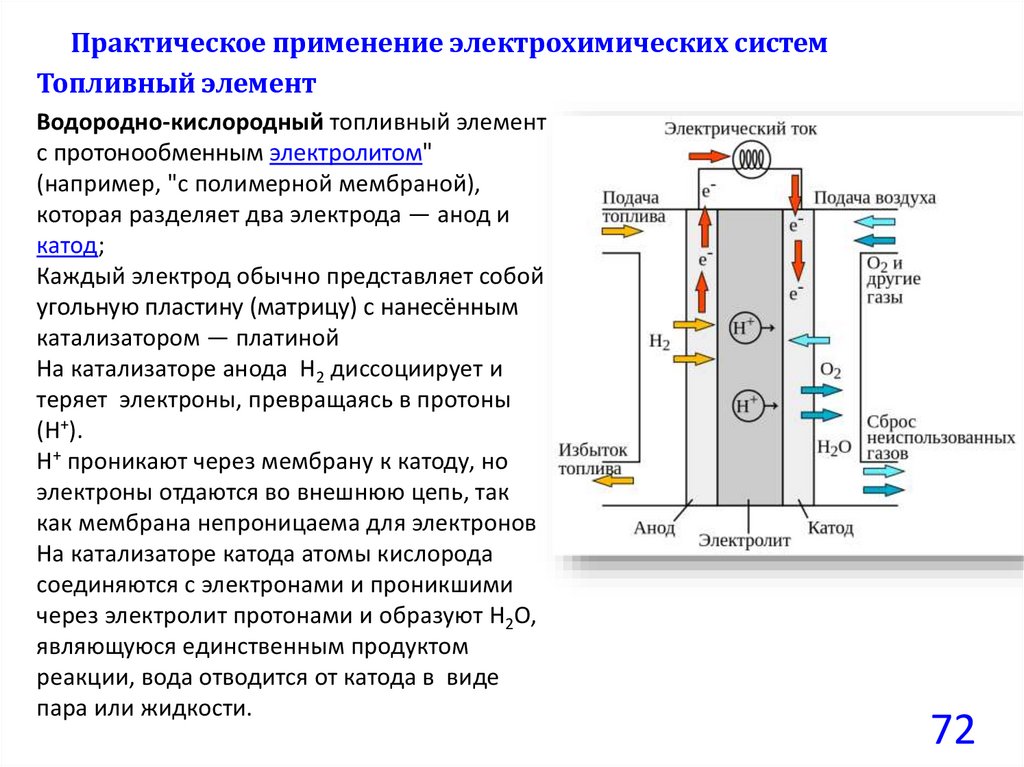
Практическое применение электрохимических системТопливный элемент
Водородно-кислородный топливный элемент
с протонообменным электролитом"
(например, "с полимерной мембраной),
которая разделяет два электрода — анод и
катод;
Каждый электрод обычно представляет собой
угольную пластину (матрицу) с нанесённым
катализатором — платиной
На катализаторе анода Н2 диссоциирует и
теряет электроны, превращаясь в протоны
(Н+).
Н+ проникают через мембрану к катоду, но
электроны отдаются во внешнюю цепь, так
как мембрана непроницаема для электронов
На катализаторе катода атомы кислорода
соединяются с электронами и проникшими
через электролит протонами и образуют Н2О,
являющуюся единственным продуктом
реакции, вода отводится от катода в виде
пара или жидкости.
72























































 Химия
Химия








