Похожие презентации:
Алкены_
1. Непредельные углеводороды
Алкены2. Алкены (этиленовые углеводороды)
это углеводороды, содержащие в молекулеодну двойную связь.
CnH2n общая формула (n = 2,3,4….)
С2Н4 – этилен – этен СН2 = СН2
С3Н6 – пропен
СН2 = СН – СН3
С4Н8 - бутен
С5Н10 - пентен
С6Н12 - гексен
3. Физические свойства
По физическим свойствам этиленовыеуглеводороды близки к алканам. При
нормальных условиях углеводороды C2–C4 –
газы, C5–C17 – жидкости, высшие
представители – твердые вещества.
Температура их плавления и кипения, а также
плотность увеличиваются с ростом
молекулярной массы. Все алкены легче воды,
плохо растворимы в ней, однако растворимы в
органических растворителях.
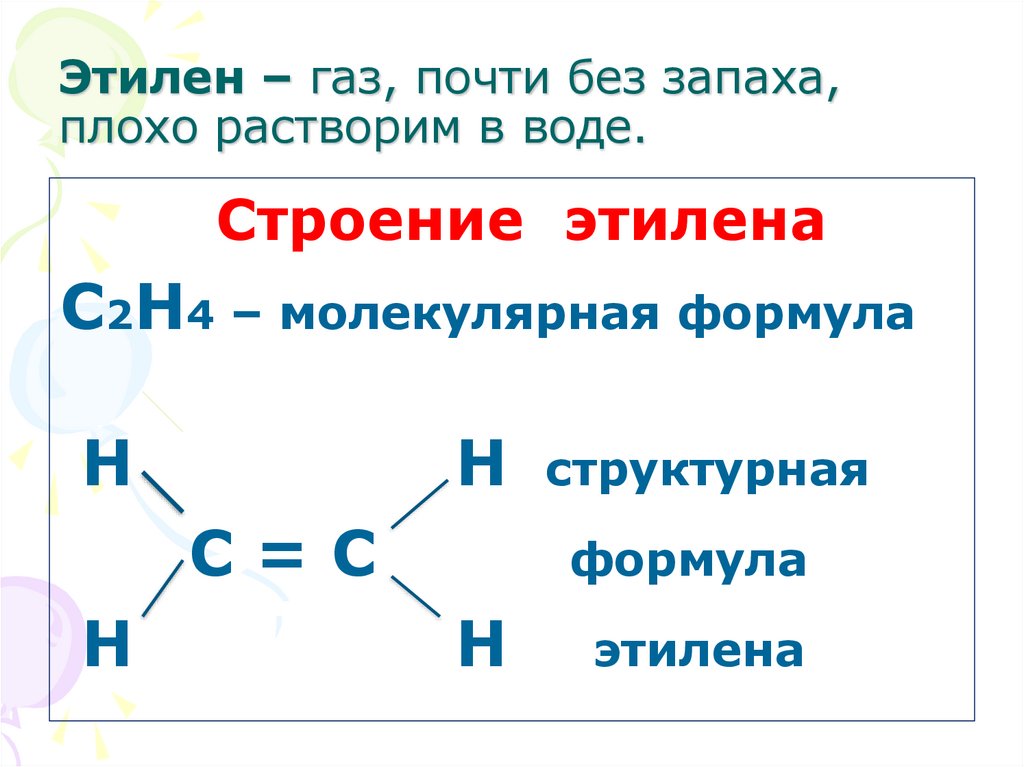
4. Этилен – газ, почти без запаха, плохо растворим в воде.
Строение этиленаС2Н4 – молекулярная формула
Н
Н структурная
С=С
Н
формула
Н
этилена
5.
Запомните.Простая (ординарная) связь – это всегда
σ-связь.
В кратных (двойных или тройных) связях –
одна σ-связь, а остальные π-связи.
6. Изомерия алкенов
1) углеродного скелетаCH2 = CH – CH2 – CH3
бутен-1
CH2 = C – CH3
׀
CH3
2-метилпропен-1
2) положения двойной связи
CH2 = CH – CH2 – CH3
CH3 – CH = CH – CH3
бутен-1
бутен-2
3) классов соединений (циклоалканы)
CH2 = CH – CH2 – CH3
CH2 – CH2
бутен-1
|
|
CH2 – CH2
циклобутан
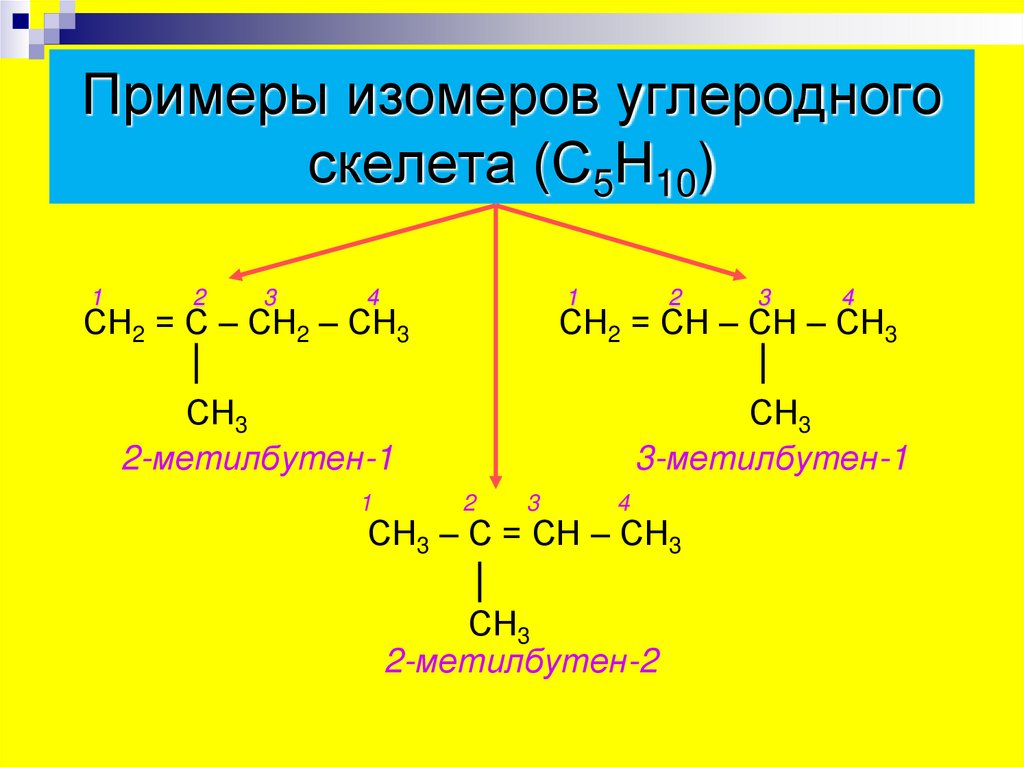
7. Примеры изомеров углеродного скелета (С5Н10)
12
3
4
1
2
3
4
СН2 = С – СН2 – СН3
СН2 = СН – СН – СН3
СН3
2-метилбутен-1
СН3
3-метилбутен-1
1
2
3
4
СН3 – С = СН – СН3
СН3
2-метилбутен-2
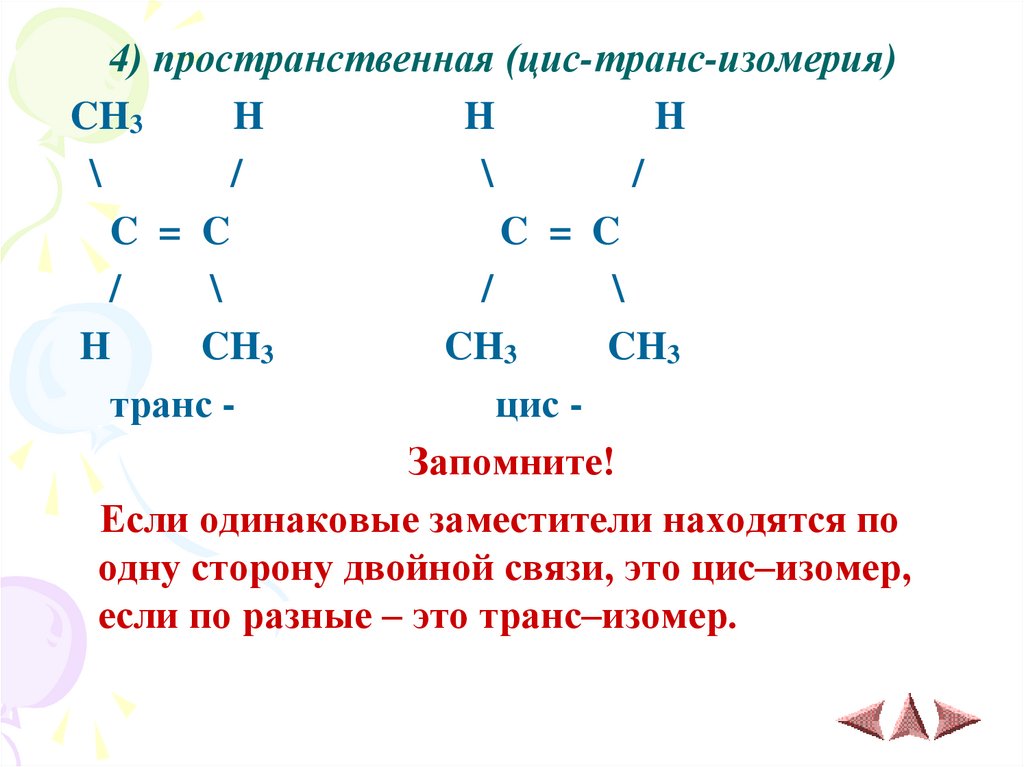
8.
4) пространственная (цис-транс-изомерия)CH3
H
H
H
\
/
\
/
C = C
C = C
/
\
/
\
H
CH3
CH3
CH3
транс цис Запомните!
Если одинаковые заместители находятся по
одну сторону двойной связи, это цис–изомер,
если по разные – это транс–изомер.
9. Номенклатура алкенов
• Название алкенов по систематической номенклатуреобразуют из названий алканов, заменяя суффикс –ан
на –ен, цифрой указывается номер того атома
углерода, от которого начинается двойная связь.
• Главная цепь атомов углерода должна обязательно
включать двойную связь, и ее нумерацию проводят с
того конца главной цепи, к которому она ближе.
• В начале названия перечисляют радикалы с указанием
номеров атомов углерода, с которыми они связаны.
Если в молекуле присутствует несколько одинаковых
радикалов, то цифрой указывается место каждого из
них в главной цепи и перед их названием ставят
соответственно приставки: ди-, три-, тетра- и т.д.
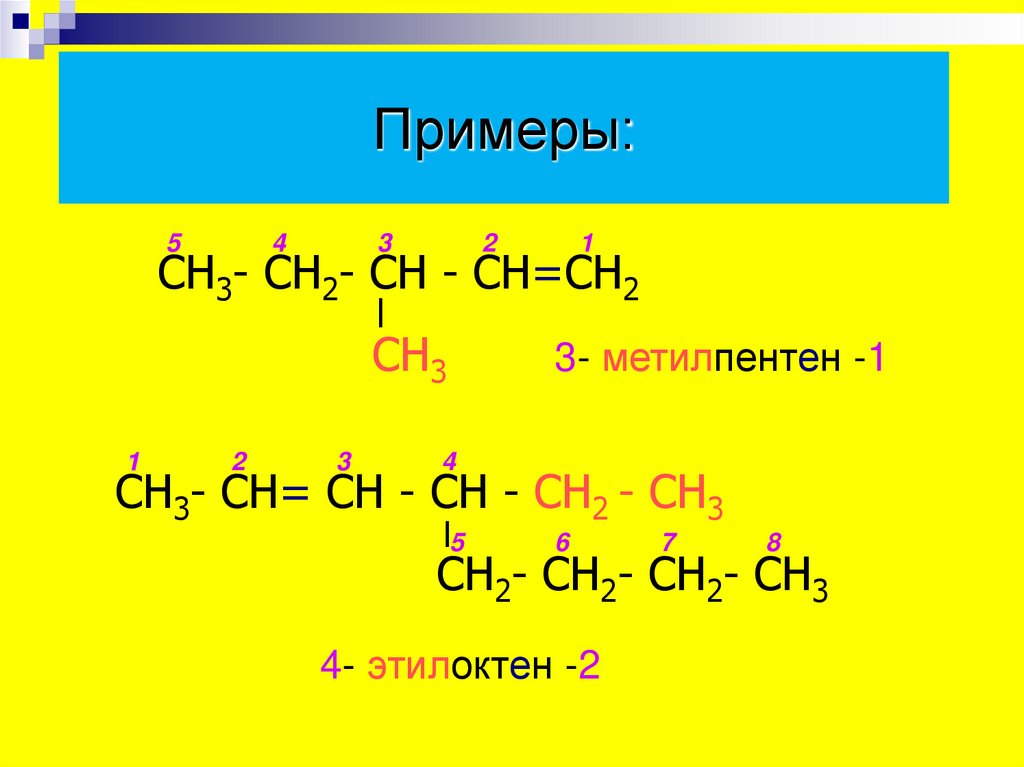
10. Примеры:
54
3
2
1
СН3- СН2- СН - СН=СН2
СН3
1
2
3
3- метилпентен -1
4
СН3- СН= СН - СН - СН2 - СН3
5
6
7
8
СН2- СН2- СН2- СН3
4- этилоктен -2
11. Реакции присоединения
1. Гидрирование.CН2 = СН2 + Н2
СН3 – СН3
Этен
этан
Условия реакции: катализатор – Ni, Pt, Pd
2.
Галогенирование.
CН2 = СН – СН3 + Сl – Сl
пропен
1
2
Cl
Cl
3
СН2 – СН – СН3
1,2-дихлорпропан
Реакция идёт при обычных условиях.
12. Реакции присоединения
3.1
2
3
Гидрогалогенирование.
4
1
СН2 = СН – СН2 – СН3 + Н – Сl
3
4
Cl
2-хлорбутан
4.
2
3
CН3 – СН – СН2 – СН3
Бутен-1
1
2
Гидратация.
CН2 = СН – СН3 + Н – ОН
пропен
1
2
3
СН3 – СН – СН3
ОН
пропанол-2
Условия реакции: катализатор – серная кислота, температура.
Присоединение молекул галогеноводородов и воды к молекулам
алкенов происходит в соответствии с правилом В.В.
Марковникова.
13. Гидрогалогенирование гомологов этилена
ПравилоВ.В. Марковникова
Атом водорода
присоединяется к
наиболее
гидрированному атому
углерода при двойной
связи, а атом галогена
или гидроксогруппа – к
наименее
гидрированному.
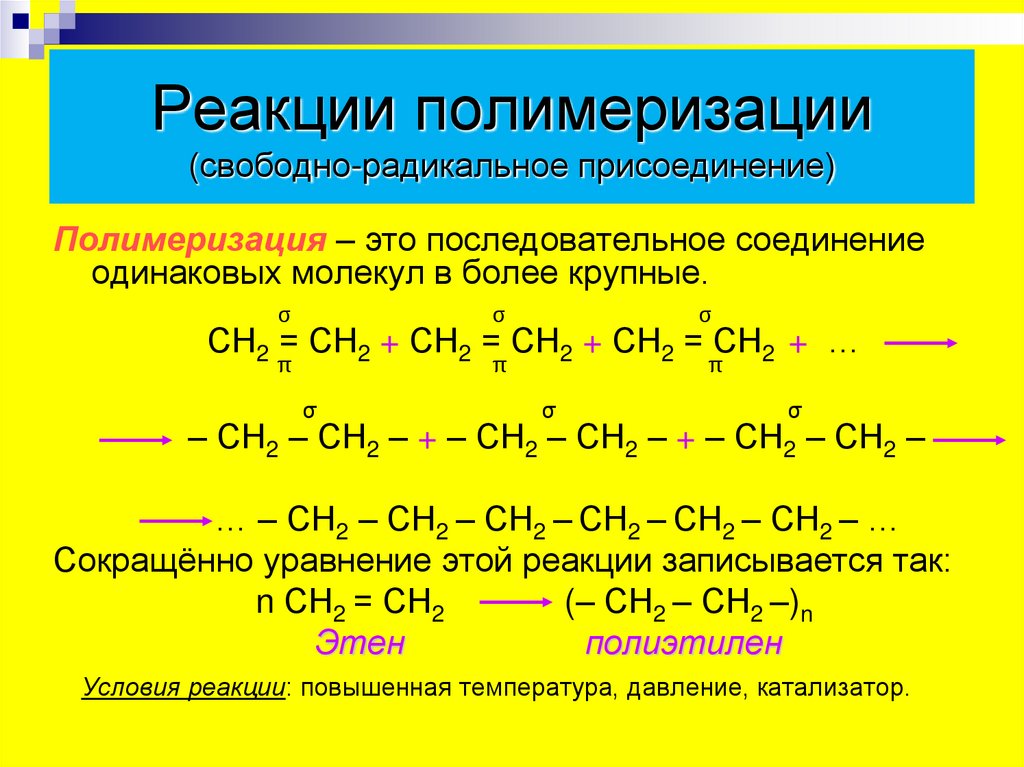
14. Реакции полимеризации (свободно-радикальное присоединение)
Полимеризация – это последовательное соединениеодинаковых молекул в более крупные.
σ
σ
σ
π
π
π
СН2 = СН2 + СН2 = СН2 + СН2 = СН2 + …
σ
σ
σ
– СН2 – СН2 – + – СН2 – СН2 – + – СН2 – СН2 –
… – СН2 – СН2 – СН2 – СН2 – СН2 – СН2 – …
Сокращённо уравнение этой реакции записывается так:
n СН2 = СН2
(– СН2 – СН2 –)n
Этен
полиэтилен
Условия реакции: повышенная температура, давление, катализатор.
15. Горение алкенов
Алкены горят красноватым светящимсяпламенем, в то время как пламя предельных
углеводородов голубое.
С4Н8 + 8О2
бутен
4СО2 + 4Н2О
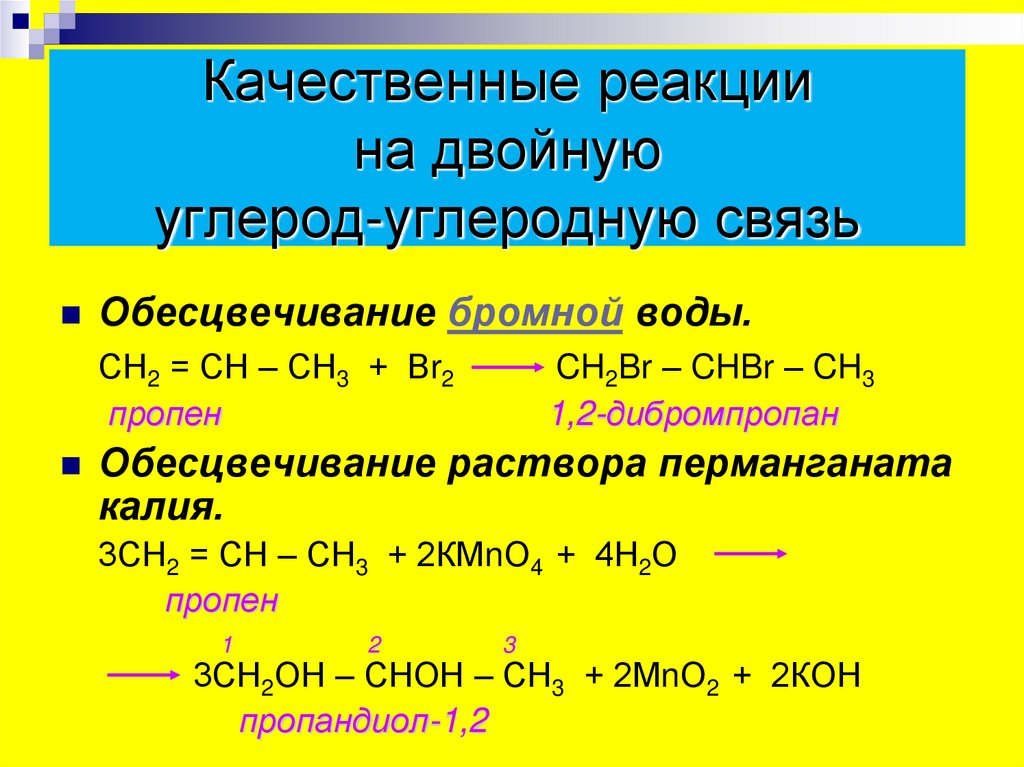
16. Качественные реакции на двойную углерод-углеродную связь
Обесцвечивание бромной воды.СН2 = СН – СН3 + Вr2
пропен
CH2Br – CHBr – CH3
1,2-дибромпропан
Обесцвечивание раствора перманганата
калия.
3СН2 = СН – СН3 + 2КМnО4 + 4Н2О
пропен
1
2
3
3СН2ОН – СНОН – СН3 + 2МnО2 + 2КОН
пропандиол-1,2
17. Вывод:
Реакции присоединения,окисления и полимеризации
алкенов идут за счет разрыва
двойной связи ( π-связи).
18. Получение алкенов
1) Дегидрирование (отщепление водорода) алкановпри повышенной температуре с катализатором.
СН3 – СН3 → СН2 = СН2 + Н2
С2Н6 → С2Н4 + Н2
t, kat
2) Дегидратация (отщепление воды) спиртов
при нагревании с водоотнимающими средствами
(концентрированная серная или фосфорная
кислоты) или при пропускании паров спирта
над катализатором (окись алюминия).
CH3 – CH2 – OH → CH2 = CH2 + H2O
С2Н5ОН → С2Н4 + Н2О
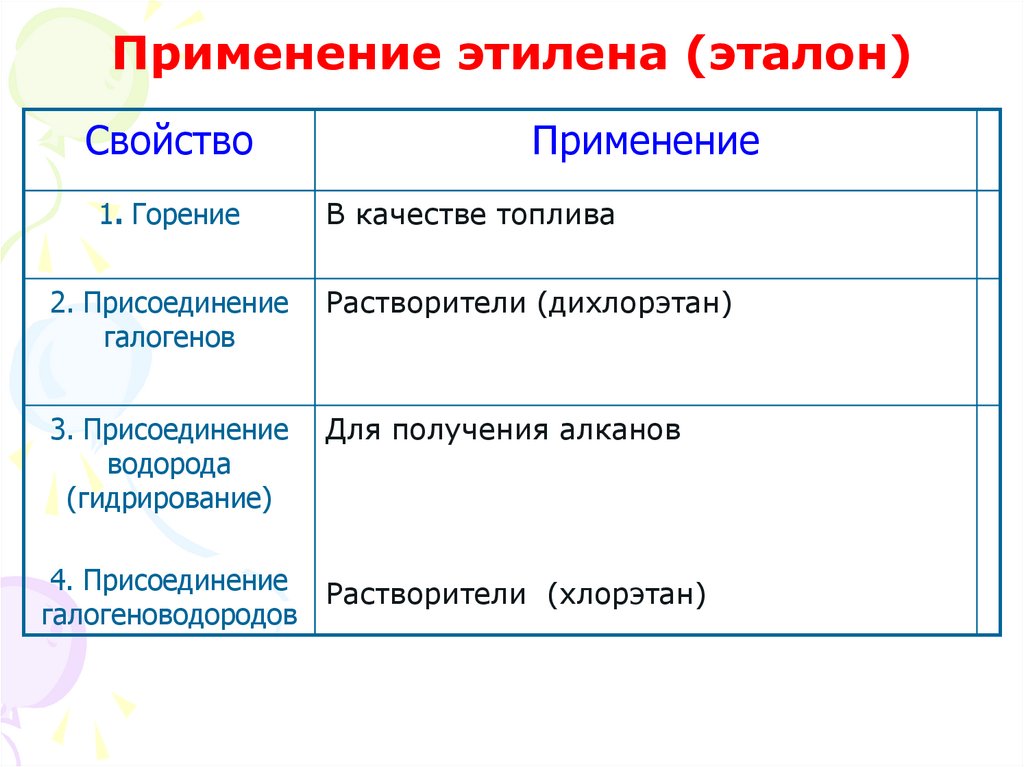
19. Применение алкенов
Алкены широко используются впромышленности в качестве исходных
веществ для получения многих важнейших
продуктов.
Наибольшее значение имеет этилен и его
производные.
Применение этилена и его
производных:
20. Применение этилена (эталон)
Свойство1. Горение
Применение
В качестве топлива
2. Присоединение
галогенов
Растворители (дихлорэтан)
3. Присоединение
водорода
(гидрирование)
Для получения алканов
4. Присоединение Растворители (хлорэтан)
галогеноводородов
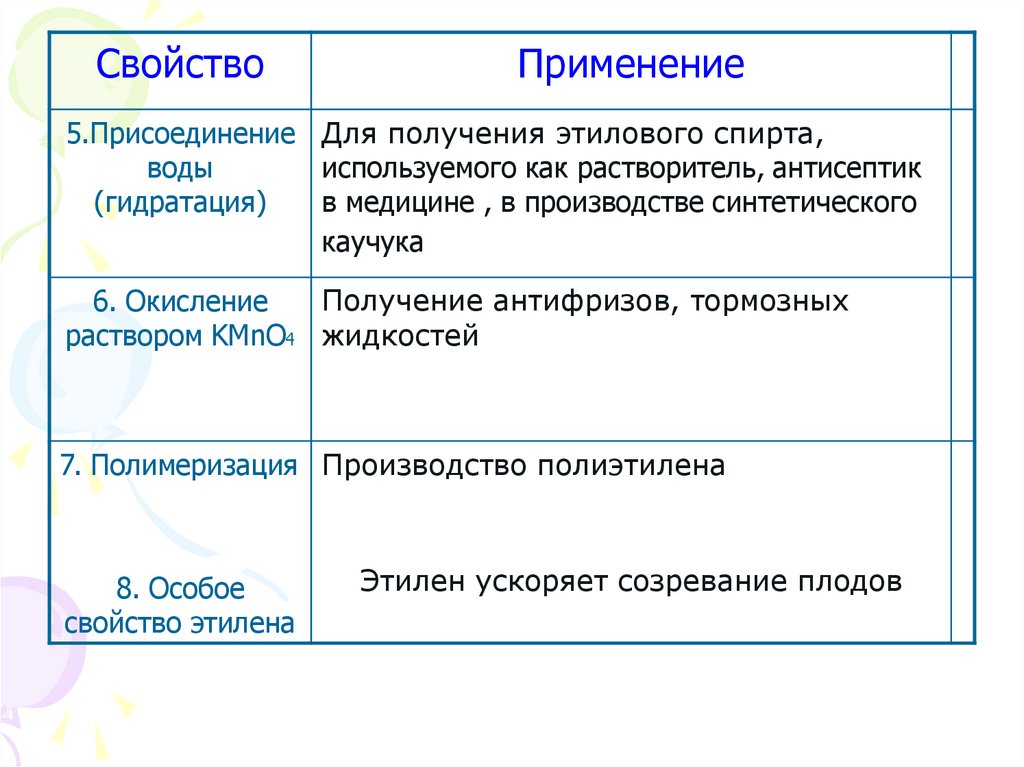
21.
СвойствоПрименение
5.Присоединение Для получения этилового спирта,
воды
используемого как растворитель, антисептик
(гидратация)
в медицине , в производстве синтетического
каучука
Получение антифризов, тормозных
6. Окисление
раствором KMnO4 жидкостей
7. Полимеризация Производство полиэтилена
8. Особое
свойство этилена
Этилен ускоряет созревание плодов













 Химия
Химия








