Похожие презентации:
Лекция 9-10 КС и ДС
1. Лекция «Строение комплексных (координационных) соединений. Устойчивость в растворах»
Кафедра медицинской ифармацевтической химии
Лекция
«Строение комплексных (координационных)
соединений. Устойчивость в растворах»
1
2.
Основные понятия и номенклатуракомплексных соединений
3.
Комплексные(координационные)
соединения
–
устойчивые
химические
соединения сложного состава, в которых есть
хотя бы одна химическая связь, образованная по
донорно-акцепторному механизму.
Пример: катион аммония [NH4]+ :
NH3 + H+ → [NH4]+
Атом N – донор электронной пары;
ион H+ - акцептор (свободна орбиталь)
K4+ Fe2+(CN)6- 4-
4. Альфред Вернер (12.12.1866 -15.11.1919)
В 1893 г. А. Вернер опубликовалосновные
положения
координационной теории. Главным
в
учении
явилось
признание
центричного строения комплексных
соединений. Согласно этой теории,
все группы, входящие в состав
комплексного
соединения,
располагаются
определенным
образом вокруг иона металла –
комплексообразователя (центрального
атома;
по
современным
представлениям - иона)
Co(NH3)6 Cl3 -
Co(III)
5.
Комплексные соединения состоят изкомплексообразователя и лигандов , образующих
внутреннюю сферу, и внешней сферы, состоящей
из ионов, которые компенсируют заряд
внутренней сферы.
Ион-комплексообразователь Лиганды (адденды)
K4+ Fe2+(CN)6- 4Внешняя
сфера
Внутренняя сфера
6.
Комплексообразователь(центральный
атом) - атом или ион, который является
акцептором электронных пар, предоставляя
свободные атомные орбитали, и занимает
центральное положение в комплексном
соединении.
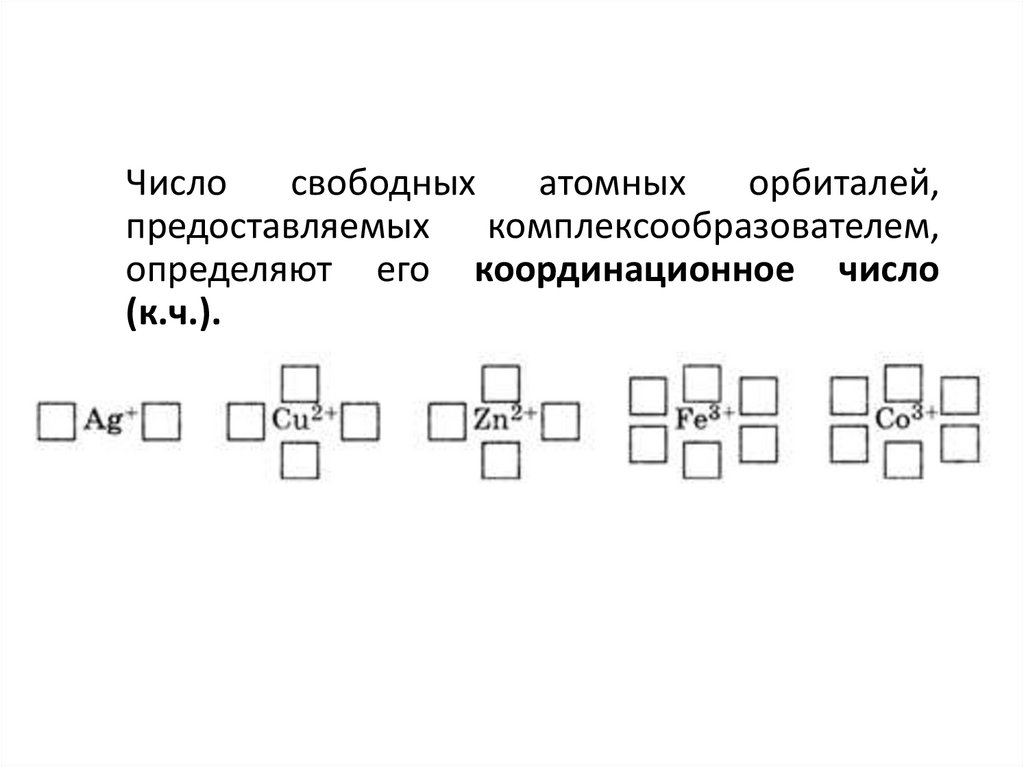
7.
Числосвободных
атомных
орбиталей,
предоставляемых комплексообразователем,
определяют его координационное число
(к.ч.).
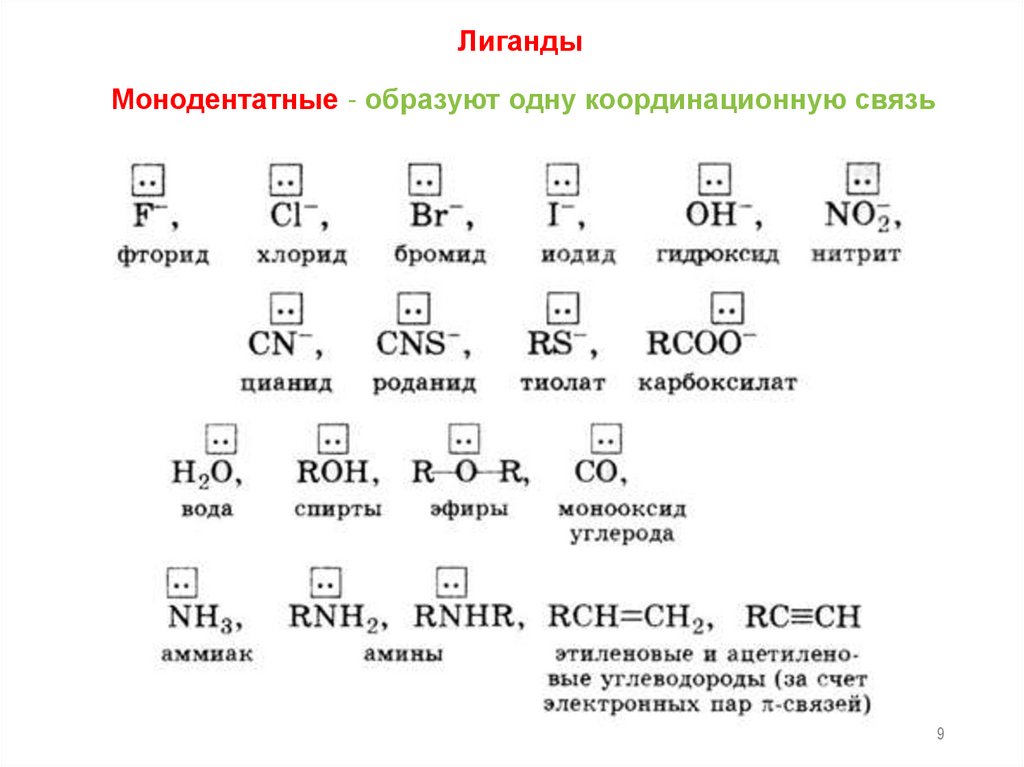
8.
Лиганды – молекулы или ионы, которые являютсядонорами электронных пар и непосредственно
связаны с комплексообразователем.
Лигандами являются ионы или молекулы, содержащие
неподеленные (свободные) электронные пары или достаточно
подвижные π-электронные пары.
По
числу
связей,
образуемых
лигандом
с
комплексообразователем, лиганды делятся на моно-, ди- и
полидентатные.
9.
ЛигандыМонодентатные - образуют одну координационную связь
9
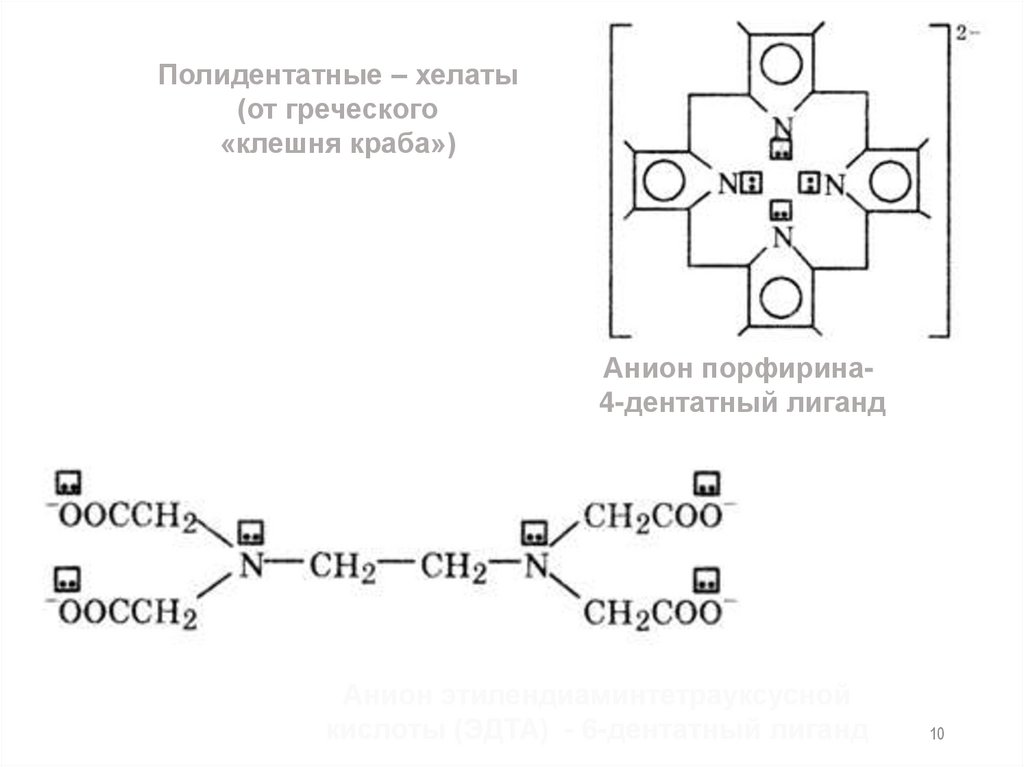
10.
Полидентатные – хелаты(от греческого
«клешня краба»)
Анион порфирина4-дентатный лиганд
Анион этилендиаминтетрауксусной
кислоты (ЭДTA) - 6-дентатный лиганд
10
11.
Хелаты – устойчивые комплексы металлов сполидентатными лигандами, в которых центральный атом
является компонентом циклической структуры.
12.
Большинство комплексных соединений,как и сами ионы металлов, имеют окраску
12
13.
Заряд внутренней сферы комплексного соединения zравен алгебраической сумме зарядов комплексообразователя и
всех лигандов.
Внутренняя сфера может быть :
а) заряжена положительно – катион
Cu2+ (NH3)4 z
z = +2 + 4·0 = +2
Cu2+ (NH3)4 2+
Co 3+ (NH3)4(CN)‒ 2 z z = +3 + 4·0 + 2· (‒1) = +1 Co 3+ (NH3)4(CN)‒ 2 +
б) заряжена отрицательно – анион
Fe3+(CN)‒6 z
z=+3+6·(‒1)=‒3
Ni2+(CNS) ‒6 z z=+2+6·(‒1)=‒4
в) электронейтральна
Fe0 (CO)5 z
z = 0 + 5·0 = 0
Pt2+ (NH3)2 Cl‒2 z z = +2 + 2·0 + 2 ·(‒1) = 0
Fe3+(CN) ‒6 3 Ni2+(CNS) ‒6 4-
Fe0 (CO)5 0
Pt2+ (NH3)2 Cl‒2 0
14. Номенклатура
• Название числительных :2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса…
• Названия лигандов:
Cl- - хлоро
I- - иодо
CN- - циано
OH- - гидроксо
SO42- - сульфо
H2O – аква
NH3- аммин
CO - карбонил
NO - нитрозил
15. Название КС катионного типа […]+
Название КС катионного+
типа […]
• 1.Внешняя сфера
• 2.Лиганды и их кол-во
• 3. Центральный ион по-русски в родительном падеже
Пример:
• [ Ni+2(H2O)05Cl-]+Cl- - Хлорид хлоропентаакваникеля(II)
• [Zn(H2O)4]SO4 - Сульфат тетрааквацинка
• [Ag(NH3)2]Cl - Хлорид диамминсеребра
16. Название КС анионного типа […]-
Название КС анионного типа[…]• 1.Лиганды и их кол-во
• 2.Центральный ион (лат.) с окончанием «ат»
• 3.Внешняя сфера по-русски в родительном
падеже
Пример:
• K3[Fe+3(CN)-6]3- - гексацианоферрат(III) калия
• Na2[HgI4] - тетраиодомеркурат(II) натрия
• K3[Al(OH)6] - гексагидроксоалюминат калия
17. Название внутрикомплексных солей […]0
Название внутрикомплексныхсолей […]0
• 1.Лиганды, их кол-во
• 2.Центральный
ион
именительном падеже
по-русски
в
Пример :
• [Pt2+(NH3)2Cl2]0 - дихлородиамминплатина
(II)
18.
[Ag(NH3)2]Cl – хлорид диамминсеребра[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II)
[Pt(NH3)2Cl2] – дихлородиамминплатина (II)
[Pt(NH3)6]Cl4
хлорид гексамминплатины (IV)
K4[Fe(CN)6]
гексацианоферрат (II) калия
K3[Fe(CN)6]
гексацианоферрат (III) калия
18
19.
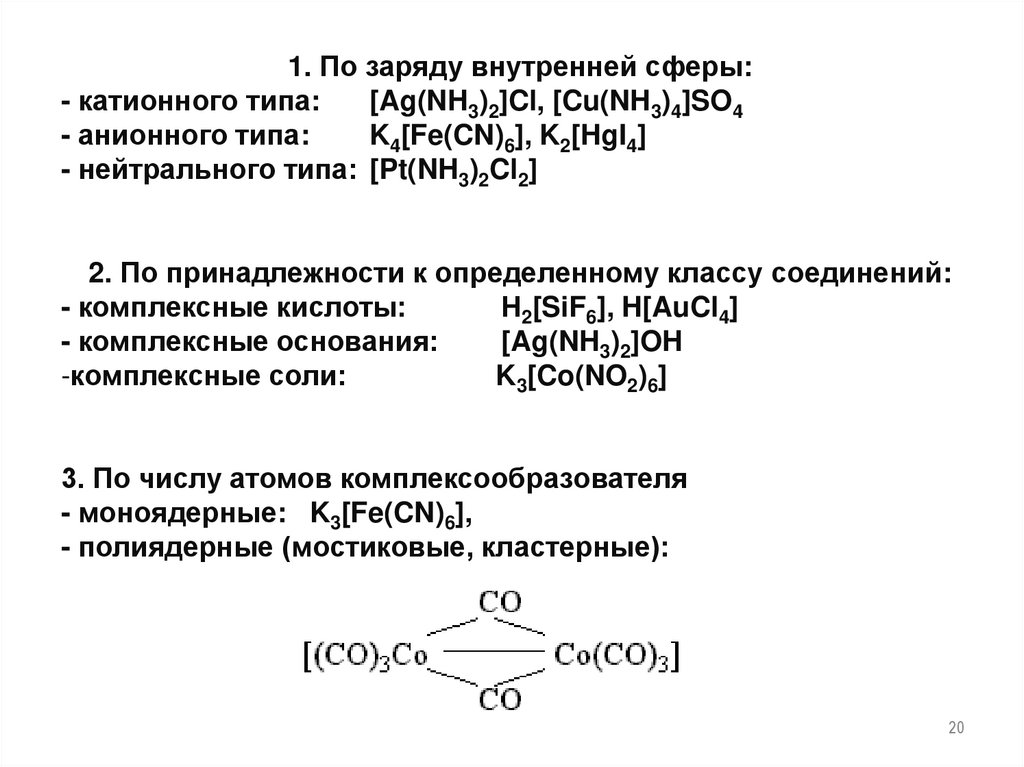
Классификация комплексныхсоединений
20.
1. По заряду внутренней сферы:- катионного типа:
[Ag(NH3)2]Cl, [Cu(NH3)4]SO4
- анионного типа:
K4[Fe(CN)6], K2[HgI4]
- нейтрального типа: [Pt(NH3)2Cl2]
2. По принадлежности к определенному классу соединений:
- комплексные кислоты:
Н2[SiF6], H[AuCl4]
- комплексные основания:
[Ag(NH3)2]OH
-комплексные соли:
K3[Co(NO2)6]
3. По числу атомов комплексообразователя
- моноядерные: K3[Fe(CN)6],
- полиядерные (мостиковые, кластерные):
20
21.
4. По природе лигандов внутренней сферы:-ацидокомплексы (анионы кислотных остатков):
K3[Fe(CN)6], K2[HgI4]
-аквакомплексы:
[Al(H2O)6]Cl3
-аммиакаты: (разлагаются при нагревании):
[Ag(NH3)2]OH, [Pt(NH3)2Cl2]
-гидроксокомплексы:
K3[Cr(OH)6]
- гидридные (получают только в неводных средах):
Li[AlH4], Na[BH4]
- оксалатные (С2O42-), карбонатные (СO32-), цианидные (CN-),
галогенидные (F-, Cl-, Br-, I-), роданидные (CNS-),- карбонилы
(CO)
21
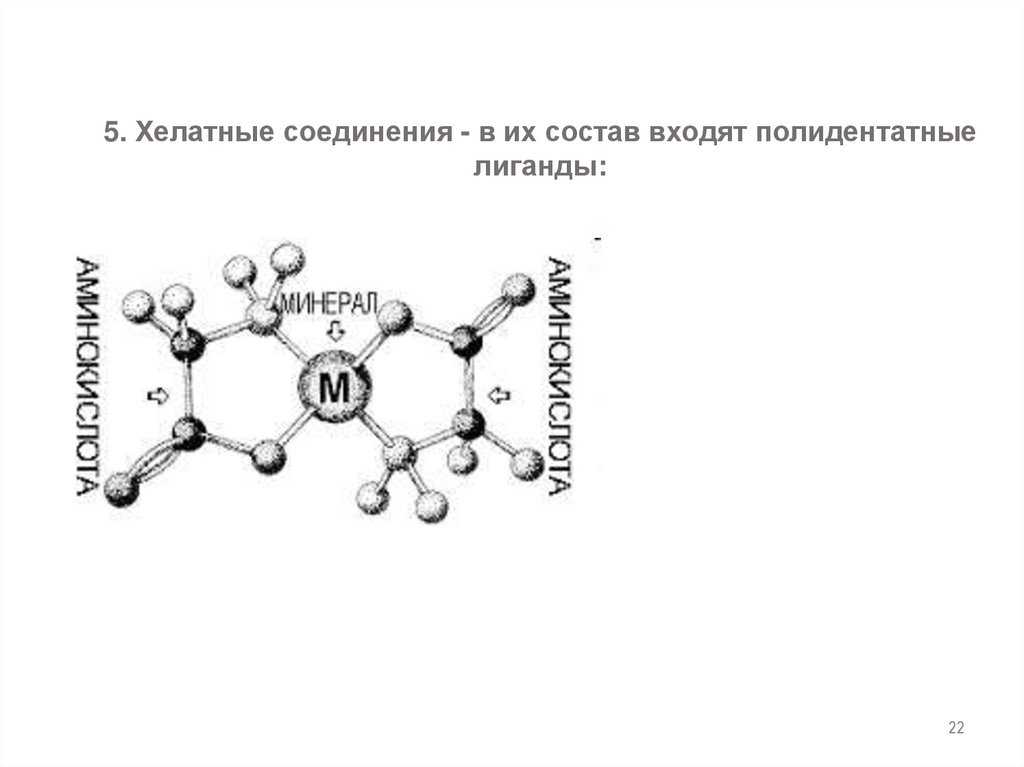
22.
5. Хелатные соединения - в их состав входят полидентатныелиганды:
22
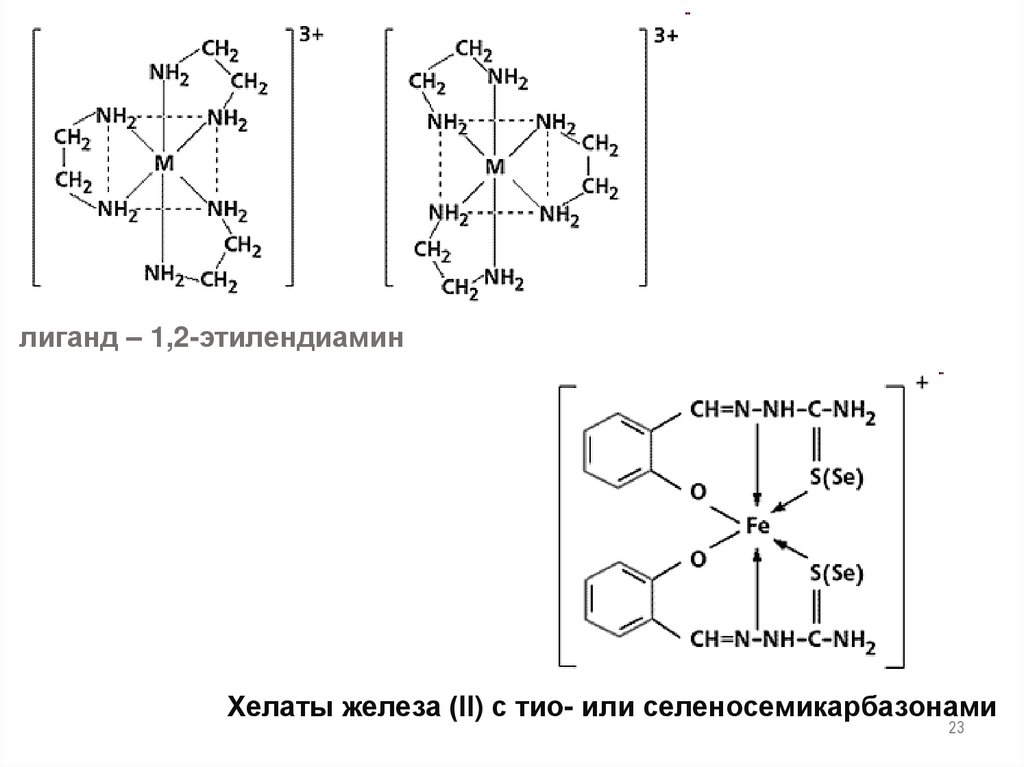
23.
лиганд – 1,2-этилендиаминХелаты железа (ll) с тио- или селеносемикарбазонами
23
24.
Изомериякомплексных соединений
25.
1. Ионизационная изомерия - различное распределениеионов между внутренней и внешней сферами комплекса:
[Pt(NH3)4Cl2]Br2 и [Pt(NH3)4Br2]Cl2.
2. Координационная изомерия - различное распределение
комплексообразователей или лигандов между комплексными
катионами и анионами:
[Co(NH3)6][Cr(CN)6]
[Cr(NH3)6][Co(CN)6]
3. Гидратная изомерия определяется характером связей
молекул воды, входящих в состав комплекса
[Сr(Н2О)6]Сl3
сине-серая
[Сr(Н2О)4Сl2]Сl·2Н2О
темно-зеленая
25
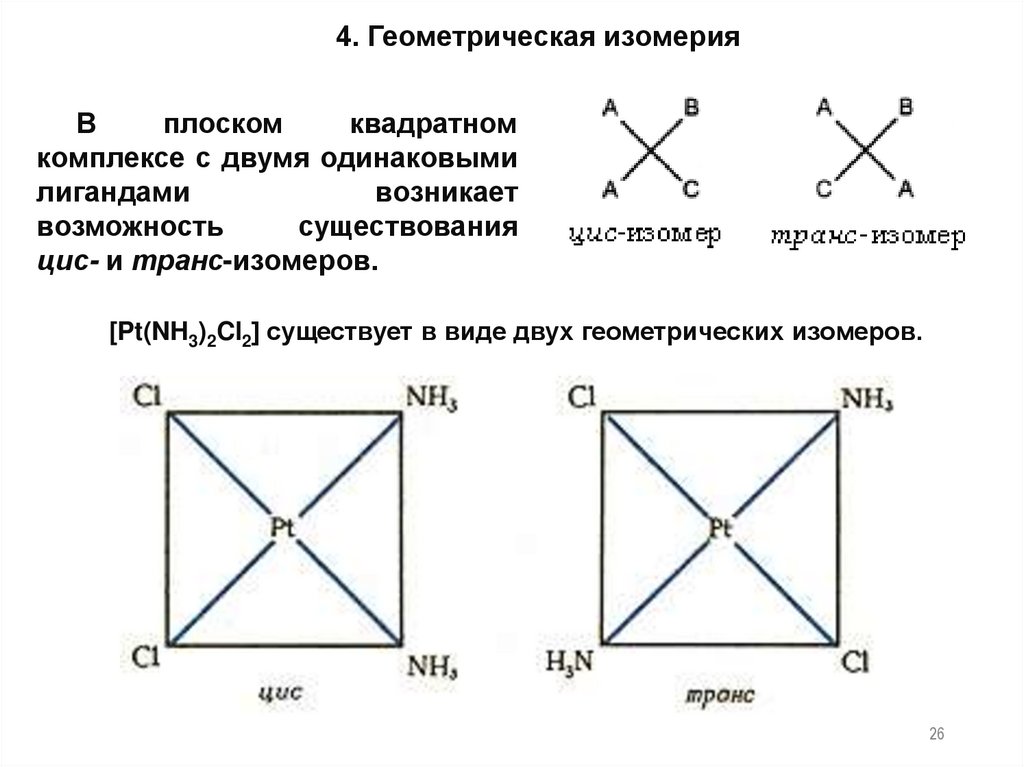
26.
4. Геометрическая изомерияВ
плоском
квадратном
комплексе с двумя одинаковыми
лигандами
возникает
возможность
существования
цис- и транс-изомеров.
[Pt(NH3)2Cl2] существует в виде двух геометрических изомеров.
26
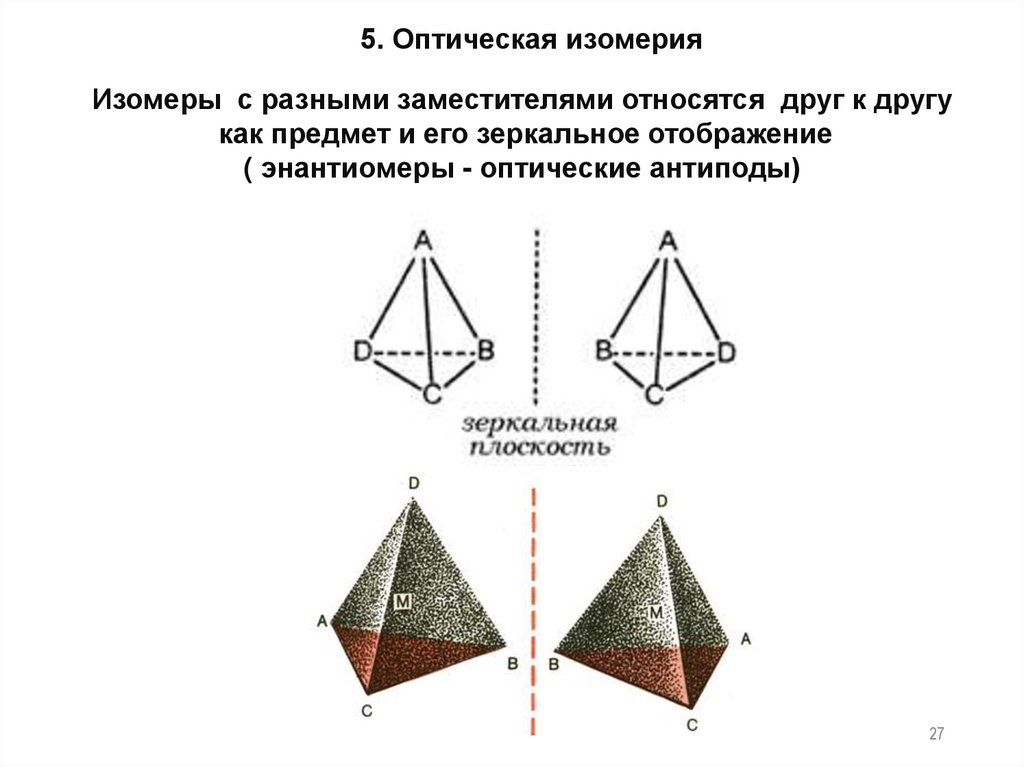
27.
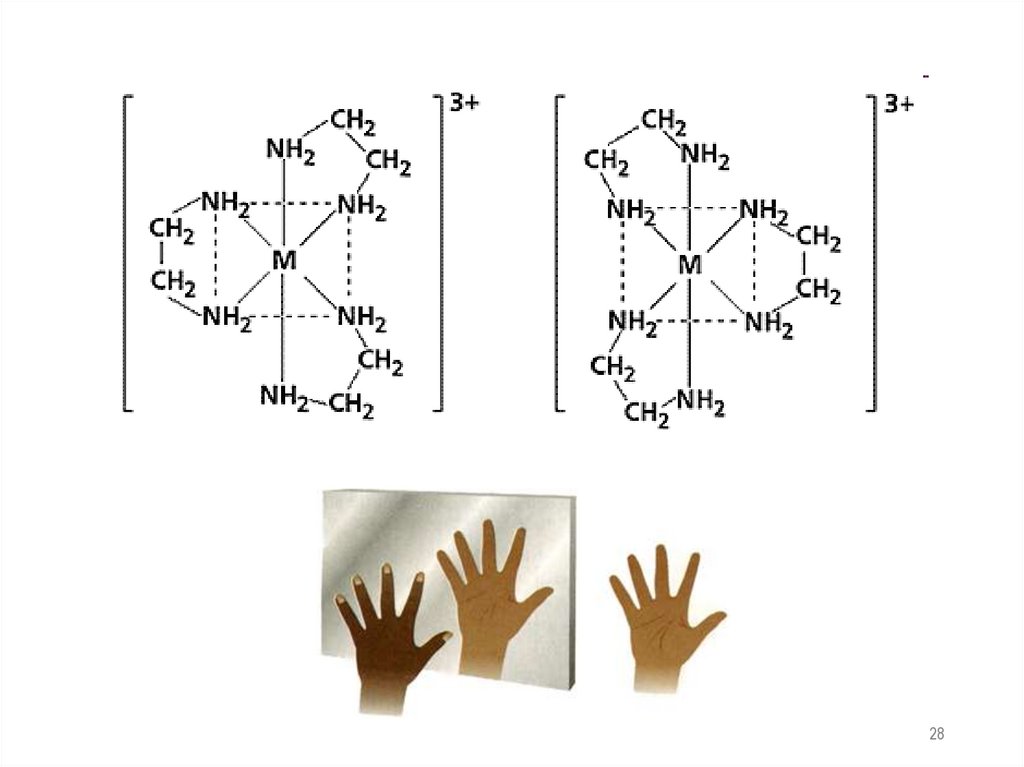
5. Оптическая изомерияИзомеры с разными заместителями относятся друг к другу
как предмет и его зеркальное отображение
( энантиомеры - оптические антиподы)
27
28.
2829.
Химические свойствакомплексных соединений
30.
• Если КС растворимо в воде, то на внутреннюю ивнешнюю сферу оно диссоциирует полностью.
Внутренняя сфера КС – слабый электролит –
диссоциирует обратимо и ступенчато. На
каждой ступени диссоциации внутренней
сферы из неё выходит один лиганд. Даже 1-ая
ступень диссоциации КС идет слабо, а каждая
последующая ступень протекает еще слабее.
• Константа равновесия для диссоциации
комплексного иона называется константой
нестойкости К нест.
31.
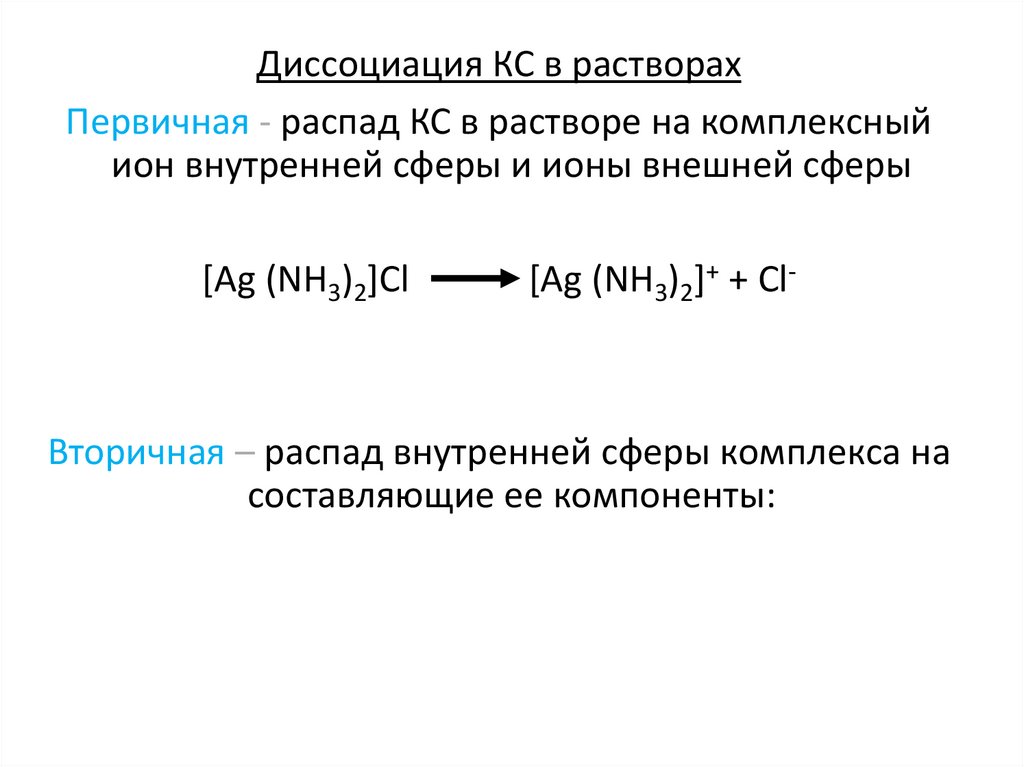
Диссоциация КС в растворахПервичная - распад КС в растворе на комплексный
ион внутренней сферы и ионы внешней сферы
[Ag (NH3)2]Cl
[Ag (NH3)2]+ + Cl-
Вторичная – распад внутренней сферы комплекса на
составляющие ее компоненты:
32.
Константа нестойкости и константа устойчивости[Ag(NH3)2 ]Cl
Кн 1
I. Ag(NH3)2+ AgNH3+ + NH3
Кн 2
II. AgNH3+ Ag+ + NH3
Кн
Ag(NH3)2+ Ag+ + 2NH3
[NH3 ] [AgNH 3 ]
Кр Кн1
[Ag(NH 3 ) 2 ]
[Ag ] [NH3 ]
Кн 2
[AgNH 3 ]
[Ag ] [NH 3 ]2
Кн
[Ag(NH 3 ) 2 ]
Кн = Кн1 · Кн2
Чем меньше Кн, тем комплекс прочнее.
КУСТ = 1/КНЕСТ
Чем больше Ку, тем комплекс прочнее.
32
33.
Трансформация или разрушение комплексногосоединения происходит в тех случаях, когда
компоненты его внутренней сферы, вступая во
взаимодействие
с
добавленным
реагентом,
связываются или трансформируются вследствие
образования:
а) более устойчивого комплекса
б) малодиссоциирующего соединения
в) малорастворимого соединения
г) окислительно-восстановительных превращений
34.
А. Трансформация комплекса с образованием болееустойчивого комплекса в результате:
- более
прочного
связывания
лигандов
с
новым
комплексообразователем
(реакции
обмена
комплексообразователя):
[Cu(NH3)4]SO4 + 2 H2SO4 →CuSO4 + 2 [NH4]2SO4
- более прочного связывания комплексообразователя с новым
лигандом (реакции обмена лигандами):
[Pt(NH3)4]Cl2 + 4 KCN → K2[Pt(CN)4] + 4 NH3 + 2 KCl
Реакции трансформации КС протекают в сторону образования более устойчивых КС, у
которых константа нестойкости внутренней сферы меньше, чем у исходных соединений.
35.
Б. Разрушение гидроксокомплексов в кислой среде изза образования малодиссоциированного соединения Н2О:Na2[Zn(OH)4] + 4 HCl → 2 NaCl + ZnCl2 + H2O
36.
В.Разрушение
комплексного
соединения
с
образованием малорастворимого соединения, в котором
комплексообразователь или лиганд связан прочнее, чем в
комплексе:
[Ag(NH3)2]Cl + KI → AgI+ 2 KCl + 2 NH3
37.
Г. Трансформация или разрушение комплексногосоединения
в
результате
окислительновосстановительных превращений
- лиганда:
K2[CdI4] + 2 Cl2 →2 KCl + CdCl2 + 2 I2
- комплексообразователя:
2 K4[Fe(CN)6] + Cl2 → 2 K3[Fe(CN)6] + 2 KCl
38.
Медико-биологическая ролькомплексных соединений
39.
1. Ионы d-металлов образуютферментами, аминокислотами;
комплексы
с
белками,
2. Комплексы с серосодержащими спиртами используются
при отравлениях тяжелыми металлами (Pb, Cd, Sn, Hg);
R-OH
R-SH
C2H5 S
C2H5 S
Pb
3. Трилон «Б» (ЭДТА) используется при мочекаменной болезни
для разрушения камней и выведения осадков;
4. Сu2+-содержащий комплекс - супероксиддисмутаза (СОД)
препятствует накоплению в организме свободных радикалов.
39
40.
5. Трилонометрия применяется для определения:содержания ионов кальция, цинка, магния, железа в
фармпрепаратах,
общего кальция в сыворотке крови, костях и хрящах
жесткости воды, обусловленной наличием ионов Са2+
и Mg2+ в виде гидрокарбонатов Ca(HCO3)2 и Mg(HCO3)2
6. Цис-изомер дихлордиамминплатины (II)
обладает
противоопухолевой
активностью и применяется в качестве
лекарственного
средства
при
онкологических заболеваниях.
40
41.
Цис-изомер вступает в организме в конкуренцию сфрагментами, образованными донорными атомами
пуриновых и пиридиновых оснований, входящих в состав
ДНК и блокирует участки, принимающие участие в процессе
передачи генетической информации.
41
42.
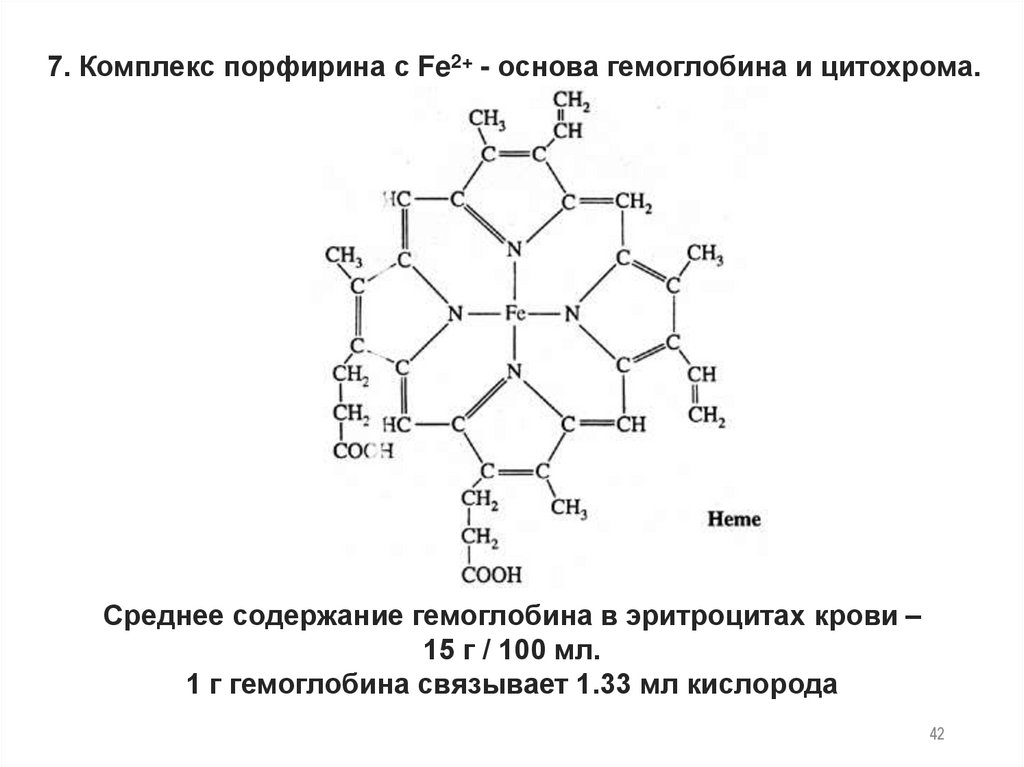
7. Комплекс порфирина с Fe2+ - основа гемоглобина и цитохрома.Среднее содержание гемоглобина в эритроцитах крови –
15 г / 100 мл.
1 г гемоглобина связывает 1.33 мл кислорода
42
43.
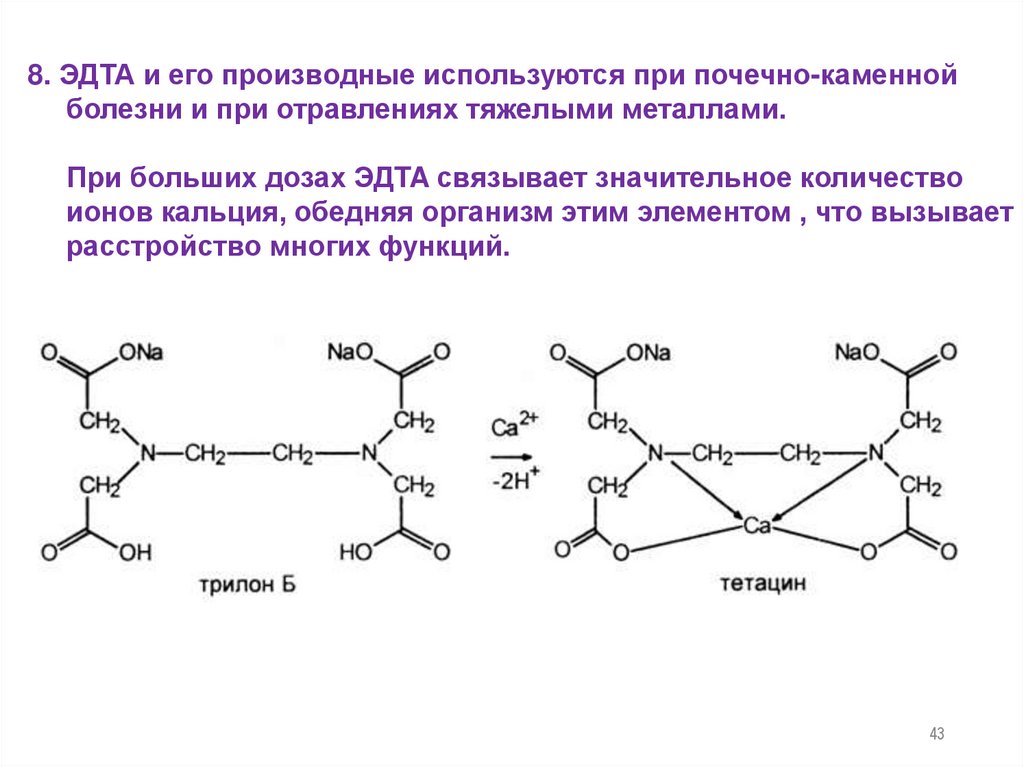
8. ЭДТА и его производные используются при почечно-каменнойболезни и при отравлениях тяжелыми металлами.
При больших дозах ЭДTA связывает значительное количество
ионов кальция, обедняя организм этим элементом , что вызывает
расстройство многих функций.
43
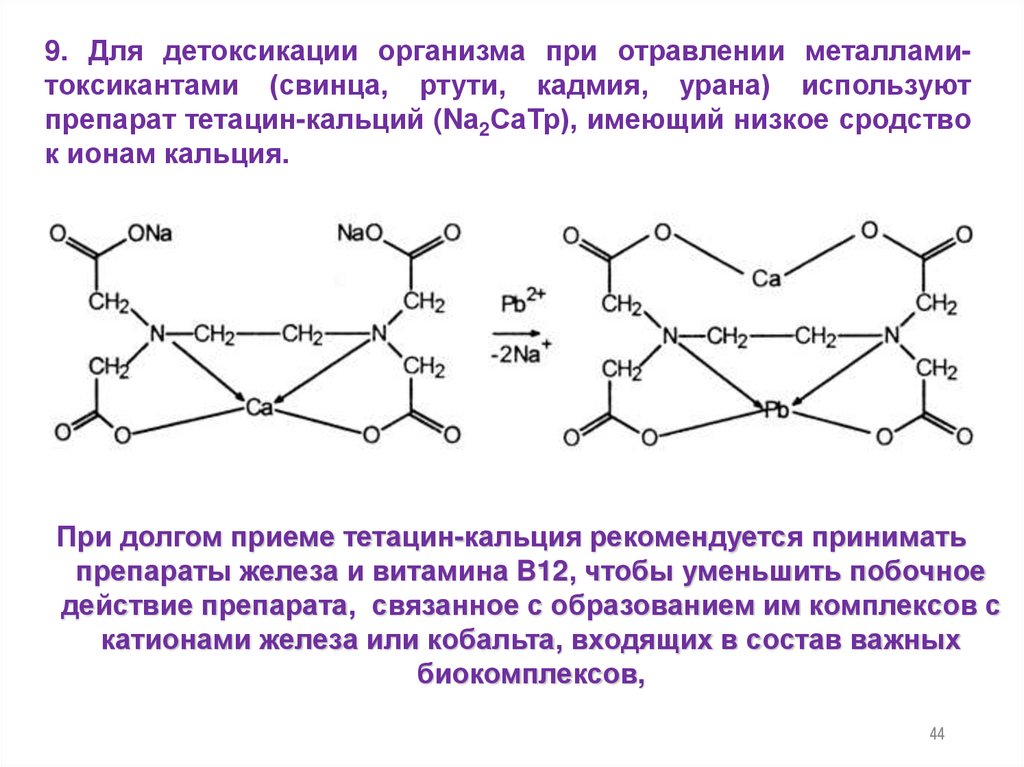
44.
9. Для детоксикации организма при отравлении металламитоксикантами (свинца, ртути, кадмия, урана) используютпрепарат тетацин-кальций (Nа2СаТр), имеющий низкое сродство
к ионам кальция.
При долгом приеме тетацин-кальция рекомендуется принимать
препараты железа и витамина B12, чтобы уменьшить побочное
действие препарата, связанное с образованием им комплексов с
катионами железа или кобальта, входящих в состав важных
биокомплексов,
44
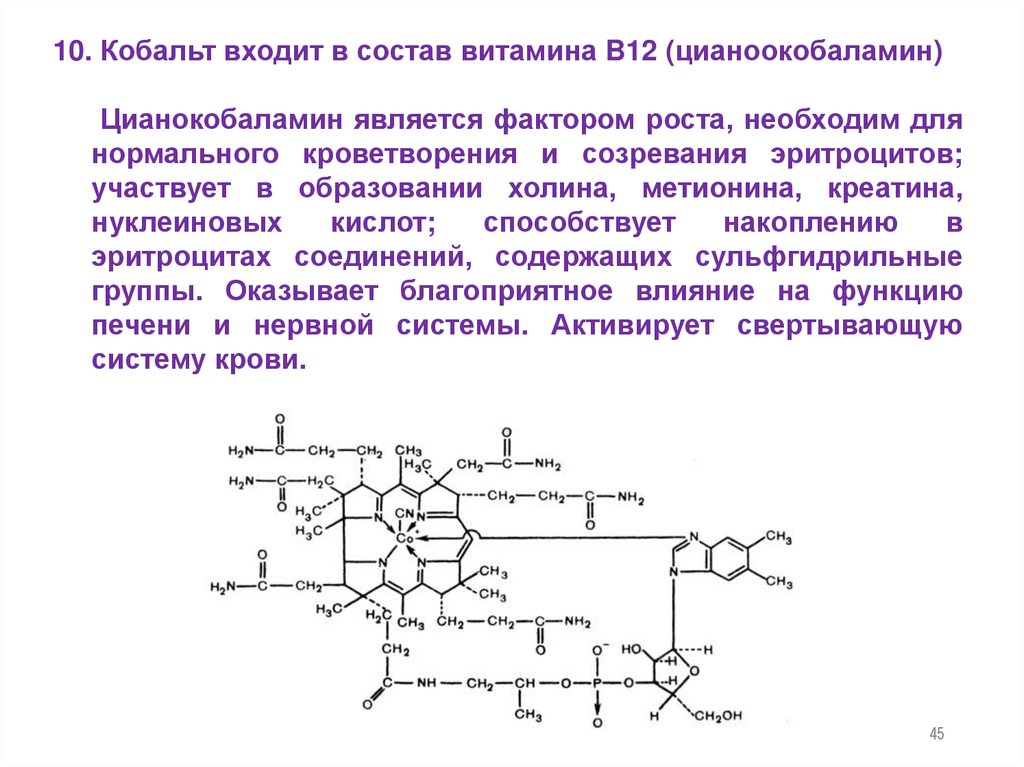
45.
10. Кобальт входит в состав витамина B12 (цианоокобаламин)Цианокобаламин является фактором роста, необходим для
нормального кроветворения и созревания эритроцитов;
участвует в образовании холина, метионина, креатина,
нуклеиновых
кислот;
способствует
накоплению
в
эритроцитах соединений, содержащих сульфгидрильные
группы. Оказывает благоприятное влияние на функцию
печени и нервной системы. Активирует свертывающую
систему крови.
45
46.
КОЛЛОИДНЫЕ РАСТВОРЫ47.
Коллоидные растворы– гетерогенные системы, состоящие из
дисперсионной среды (непрерывная фаза),
дисперсной фазы (прерывная) и стабилизатора.
47
48.
Разработал (1898) методикуполучения и ультрафильтрации
коллоидных растворов.
Сконструировал (1903)
ультрамикроскоп для
наблюдения броуновского
движения. Исследовал
свойства и коагуляцию
коллоидных растворов.
Предложил классификацию
Зигмонди Рихард
коллоидных частиц по их
Адольф
размерам и взаимодействию с
1.06.1865
– 23.09.1929
Нобелевская
премия (1925г) « за дисперсионной средой. Изучал
(1911) структуру гелей.
установление гетерогенной
природы коллоидных растворов Разработал способы получения
и за разработанные в этой связи цветного стекла, в том числе
матового.
методы, имеющие
48
фундаментальное значение в
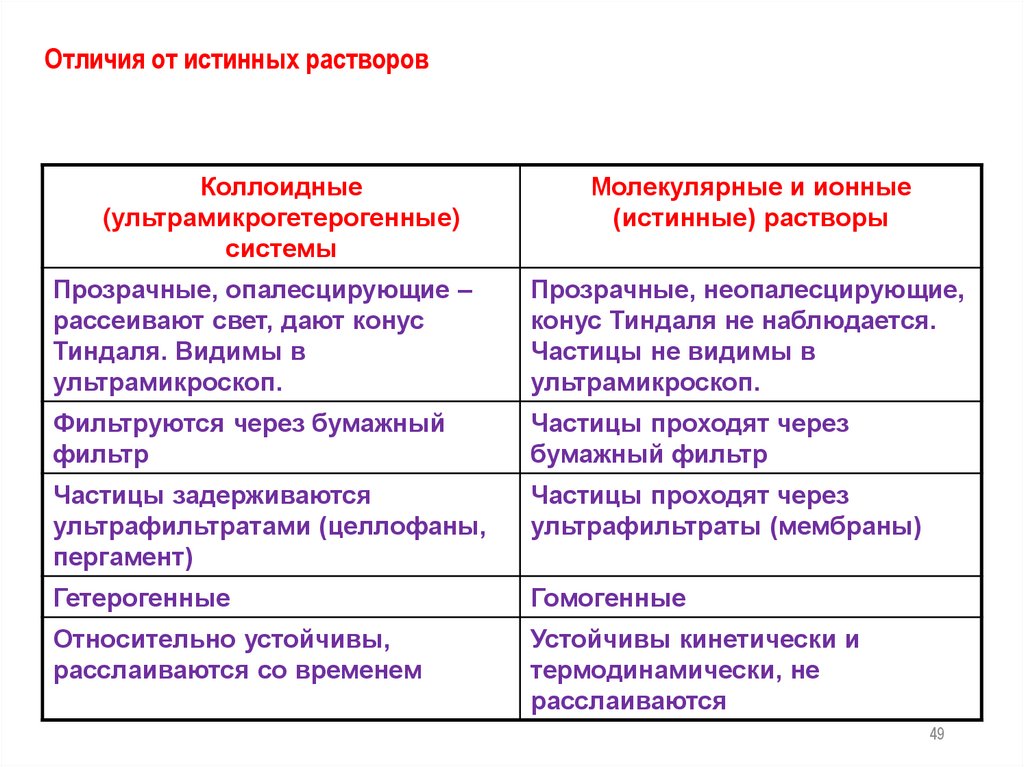
49.
Отличия от истинных растворовКоллоидные
(ультрамикрогетерогенные)
системы
Молекулярные и ионные
(истинные) растворы
Прозрачные, опалесцирующие –
рассеивают свет, дают конус
Тиндаля. Видимы в
ультрамикроскоп.
Прозрачные, неопалесцирующие,
конус Тиндаля не наблюдается.
Частицы не видимы в
ультрамикроскоп.
Фильтруются через бумажный
фильтр
Частицы проходят через
бумажный фильтр
Частицы задерживаются
ультрафильтратами (целлофаны,
пергамент)
Частицы проходят через
ультрафильтраты (мембраны)
Гетерогенные
Гомогенные
Относительно устойчивы,
расслаиваются со временем
Устойчивы кинетически и
термодинамически, не
расслаиваются
49
50.
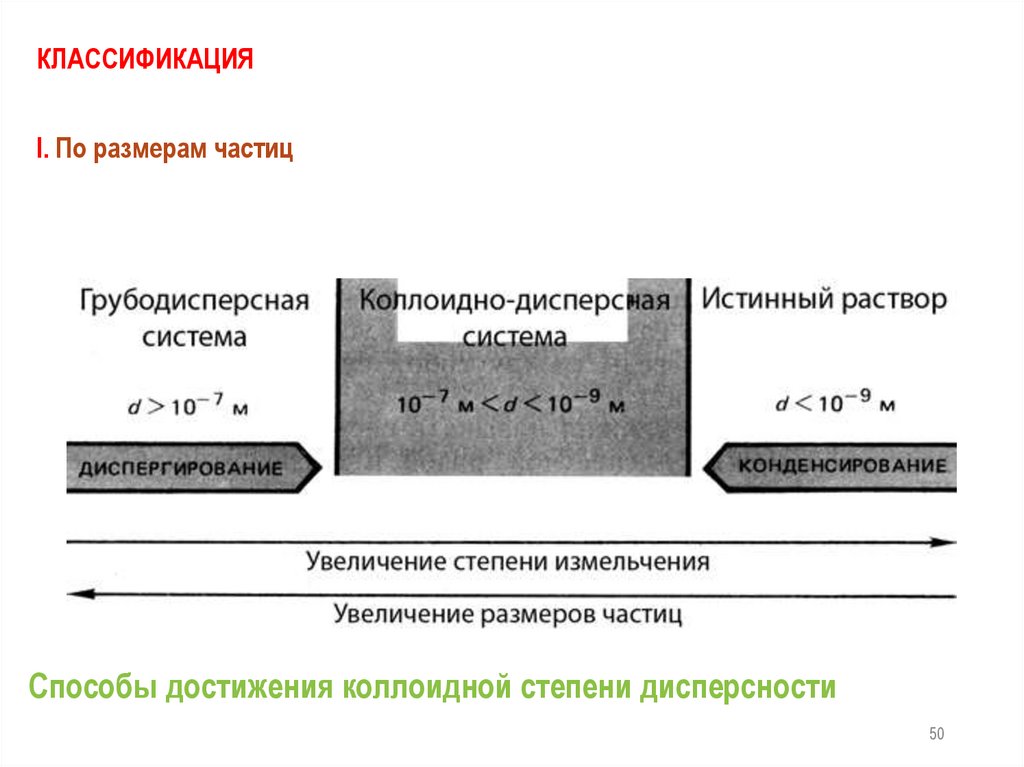
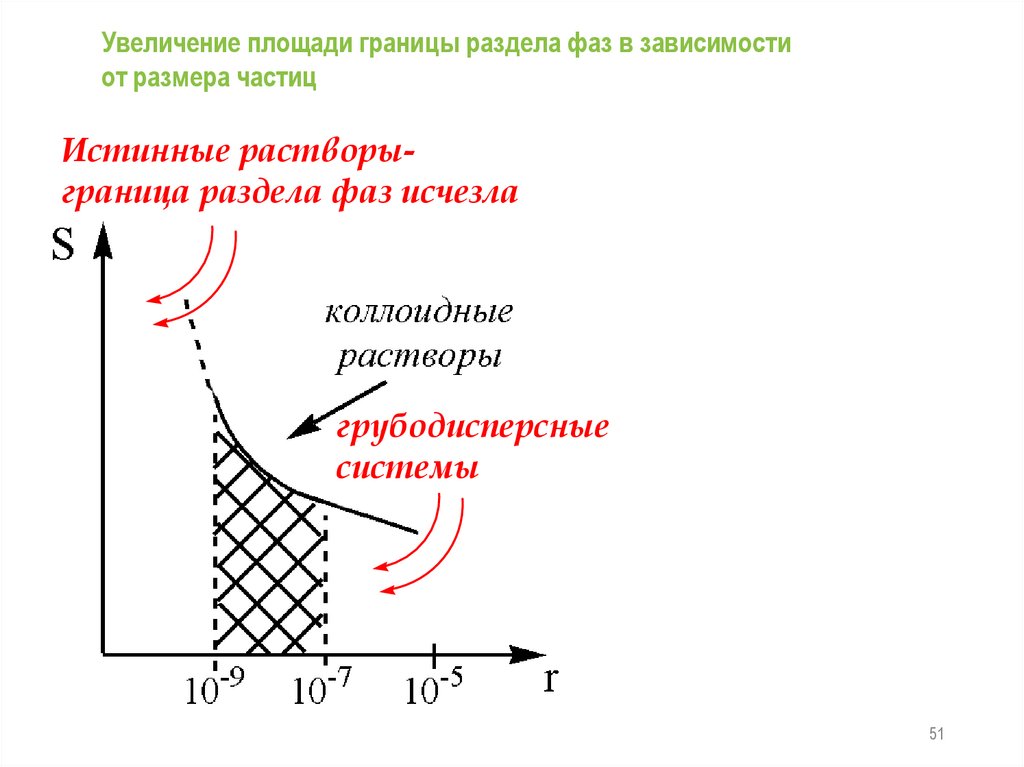
КЛАССИФИКАЦИЯI. По размерам частиц
Способы достижения коллоидной степени дисперсности
50
51.
Увеличение площади границы раздела фаз в зависимостиот размера частиц
Истинные растворыграница раздела фаз исчезла
грубодисперсные
системы
51
52.
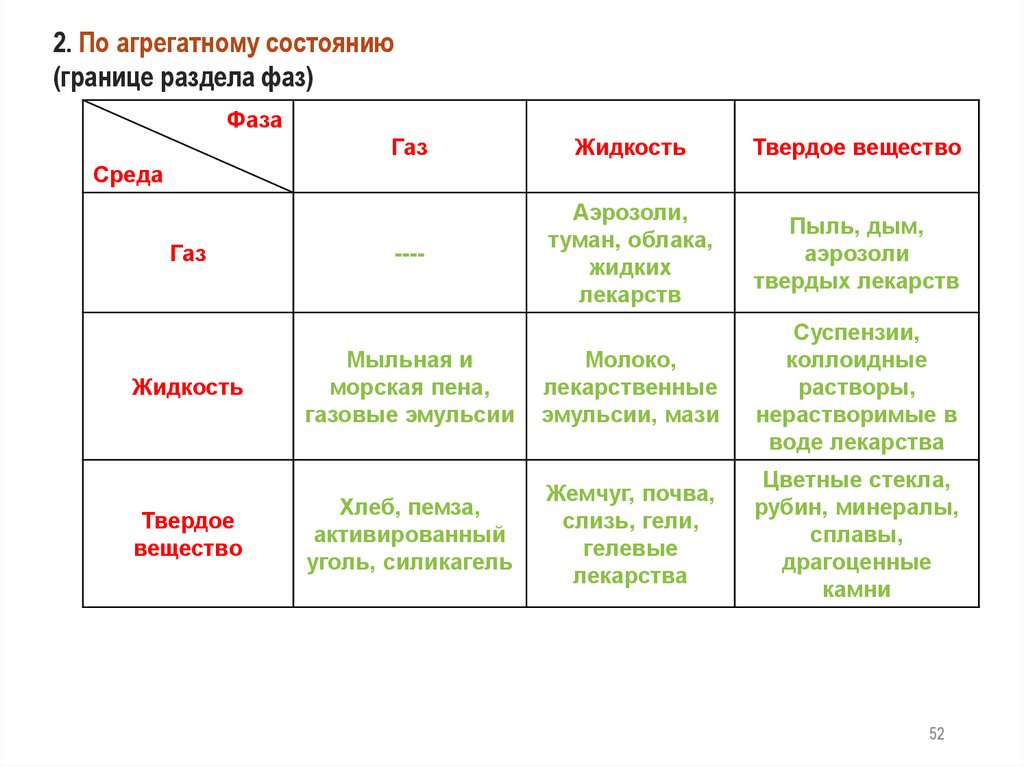
2. По агрегатному состоянию(границе раздела фаз)
Фаза
Газ
Жидкость
Твердое вещество
----
Аэрозоли,
туман, облака,
жидких
лекарств
Пыль, дым,
аэрозоли
твердых лекарств
Мыльная и
морская пена,
газовые эмульсии
Молоко,
лекарственные
эмульсии, мази
Суспензии,
коллоидные
растворы,
нерастворимые в
воде лекарства
Хлеб, пемза,
активированный
уголь, силикагель
Жемчуг, почва,
слизь, гели,
гелевые
лекарства
Цветные стекла,
рубин, минералы,
сплавы,
драгоценные
камни
Среда
Газ
Жидкость
Твердое
вещество
52
53.
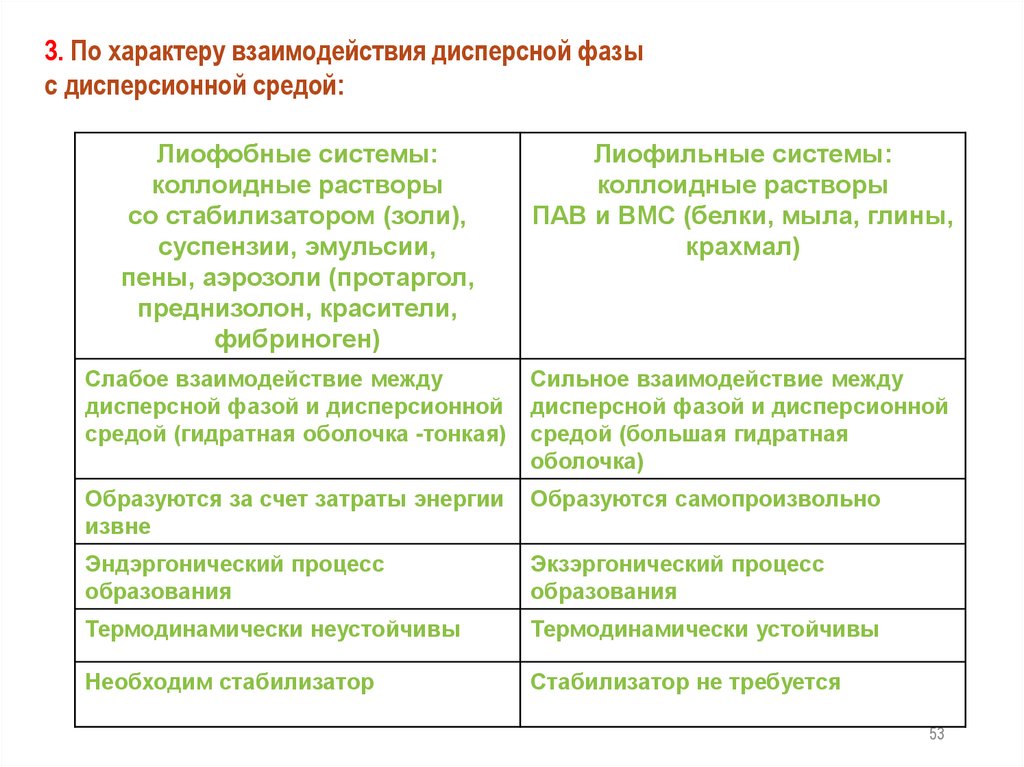
3. По характеру взаимодействия дисперсной фазыс дисперсионной средой:
Лиофобные системы:
коллоидные растворы
со стабилизатором (золи),
суспензии, эмульсии,
пены, аэрозоли (протаргол,
преднизолон, красители,
фибриноген)
Лиофильные системы:
коллоидные растворы
ПАВ и ВМС (белки, мыла, глины,
крахмал)
Слабое взаимодействие между
дисперсной фазой и дисперсионной
средой (гидратная оболочка -тонкая)
Сильное взаимодействие между
дисперсной фазой и дисперсионной
средой (большая гидратная
оболочка)
Образуются за счет затраты энергии
извне
Образуются самопроизвольно
Эндэргонический процесс
образования
Экзэргонический процесс
образования
Термодинамически неустойчивы
Термодинамически устойчивы
Необходим стабилизатор
Стабилизатор не требуется
53
54.
4. По структурно-механическим свойствамСвободнодисперсные системы:
лиозоли, суспензии, эмульсии,
кровь, биологические мембраны,
аэрозоли - туманы, дым, пыль
Связнодисперсные системы:
лиогели, студни, волокнистые
и пористые капиллярные
системы (костная ткань, студни)
Дисперсная фаза подвижна, обладает
текучестью. Представлена
отдельными не связанными между
собой частицами, относительно
равномерно распределенными в
объеме дисперсионной среды
Дисперсная фаза практически
неподвижна, так как образует
сплошную структуру (сетку, каркас),
внутри которой заключена
дисперсионная среда
5. По природе дисперсионной среды
Жидкая - лиозоли
Воздух - аэрозоли
Твердая - солидозоли
54
55.
Способы получения золейI. Дисперсионные
- из грубодисперсных систем (измельчение)
a) Механическое дробление - осуществляют с
помощью шаровых и коллоидных мельниц в
присутствии
жидкой
дисперсионной
среды
и
стабилизатора.
б) Измельчение с помощью ультразвука
(дробление почечных камней)
55
56.
в) Электрическое диспергирование используют для получения золей металлов.При получении органозолей (дисперсионная
среда – органический растворитель)
применяют высокочастотный искровой
заряд.
Теодор Сведберг
(30.08.1884-25.021971)
Его исследования были посвящены получению гидрозолей
металлов с помощью распыления электрической искрой.
Определил коэффициент диффузии коллоидных растворов,
блестяще подтвердив теорию Эйнштейна-Смолуховского.
Усовершенствовал ультрацентрифугу. Сфотографировал путь
коллоидных частиц через ультрамикроскоп. Нобелевская премия
(1926) «за работы в области дисперсных систем»
56
57.
г)Пептизация
раздробление
свежеприготовленных рыхлых осадков на
отдельные
коллоидные
частицы
при
добавлении
небольшого
количества
электролита - пептизатора.
Пептизация имеет биологическое значение: рассасывание атеросклеротических бляшек, почечных и печеночных камней, действие
антикоагулянтов при тромбофлебитах сводится, в сущности, к явлению
пептизации.
57
58.
II. Конденсационные– из истинных растворов (укрупнение).
а )Физические - метод замены растворителя.
Раствор вещества прибавляют к жидкости, в которой растворенное вещество
мало растворимо и выделяется в виде высокодисперсной фазы. Золи серы,
холестерина и канифоли получают добавлением спиртовых растворов этих
веществ к воде.
б) Химические
1) Реакции восстановления
2KAuO 2 3HCHO K 2CO3 2Au 3HCOOK KHCO3 H 2O
m[Au] nAuO (n x)K xK .
2
x
Формула мицеллы золя золота
58
59.
2) Реакции окисления8KMnO 4 Na 2S2 O3 H 2O 8MnO 2 3K 2SO 4 3Na 2SO 4 2KOH
m[MnO ]nMnO (n x)K xK
2
x
4
мицелла MnO2
(при электрофорезе движется к аноду)
59
60.
3) Реакции двойного обменаBa ( NO3 ) 2 K 2SO4 BaSO 4 2KNO3
избыток
m[BaSO ]nBa 2(n x)NO 2xNO
2x
2
4
3
3
движется
к катоду
Ba ( NO3 ) 2 K 2SO4 BaSO 4 2KNO3
избыток
m[BaSO ]nSO 2(n x)K 2xK к аноду
4
2
4
2x
движется
60
61.
г) Реакции гидролизаFeCl3 3H 2 O Fe(OH) 3 3HCl.
Гидролиз используют для получения
золей гидроксидов тяжелых металлов,
повышая температуру и с увеличивая
разведение.
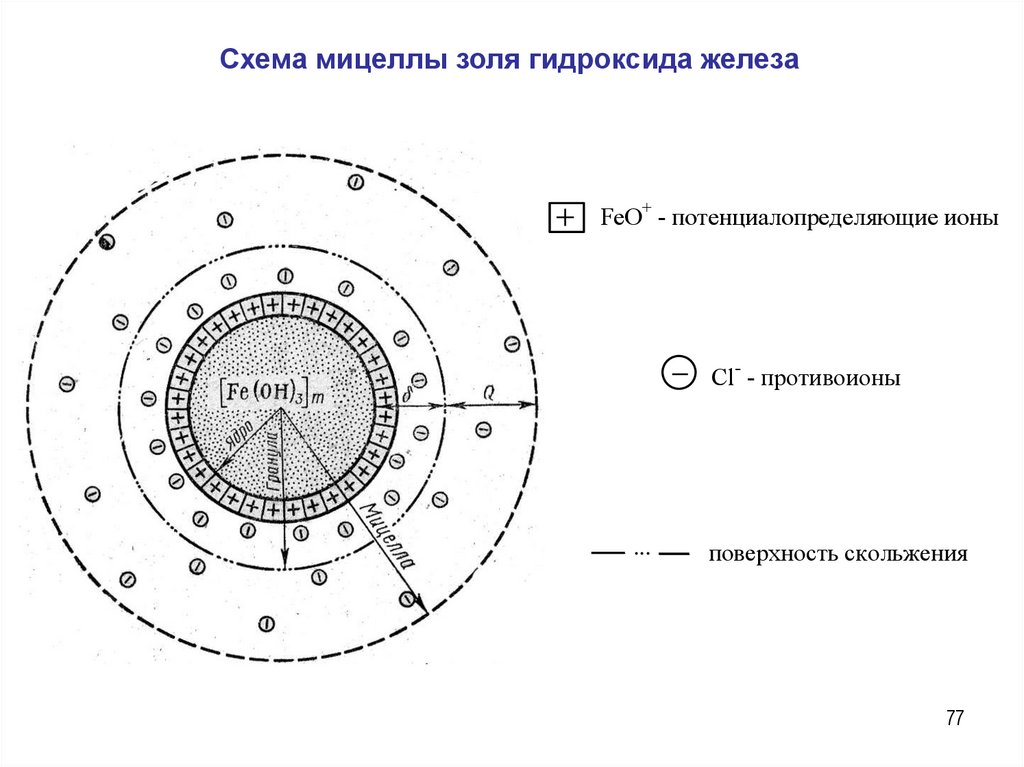
Мицелла золя гидроксида железа
( движется к катоду )
m[Fe(OH) ]nFeO (n x)Cl xCl .
3
x
-
61
62.
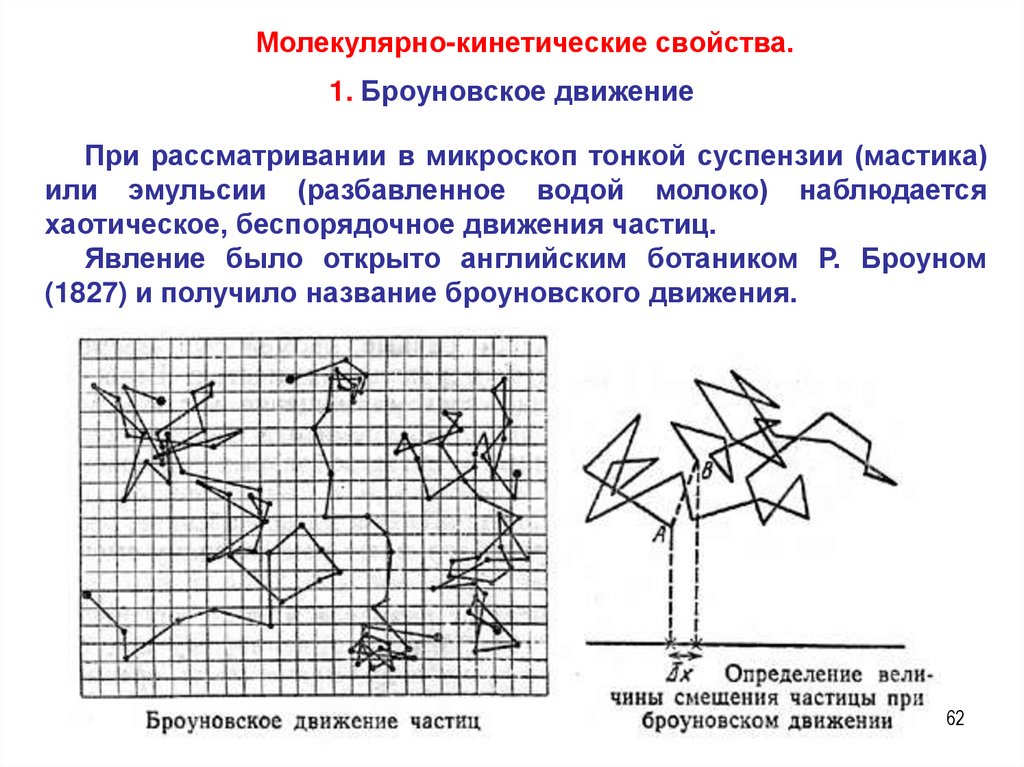
Молекулярно-кинетические свойства.1. Броуновское движение
При рассматривании в микроскоп тонкой суспензии (мастика)
или эмульсии (разбавленное водой молоко) наблюдается
хаотическое, беспорядочное движения частиц.
Явление было открыто английским ботаником Р. Броуном
(1827) и получило название броуновского движения.
62
63.
2. Диффузия– процесс направленного движения вещества
из области бóльших концентраций в область меньших.
63
64.
3. Седиментация– процесс оседания частиц дисперсной фазы в жидкой или
газообразной среде под действием силы тяжести
Закон Стокса
2 g(d ф ρ ср. ) 2
V ·
r
9
η
Теодор Сведберг
30.08.1884 -26.02.1971
Исследование седиментационного
равновесия проводят в ультрацентрифугах,
которые позволяют превышать ускорение
силы тяжести в сотни тысяч раз.
В
Нобелевской
лекции
(1927)
Сведберг
описал
большое
потенциальное значение, какое, по его мнению будет иметь
ультрацентрифуга для прогресса во многих областях, включая
64
медицину, физику, химию и промышленность.
65.
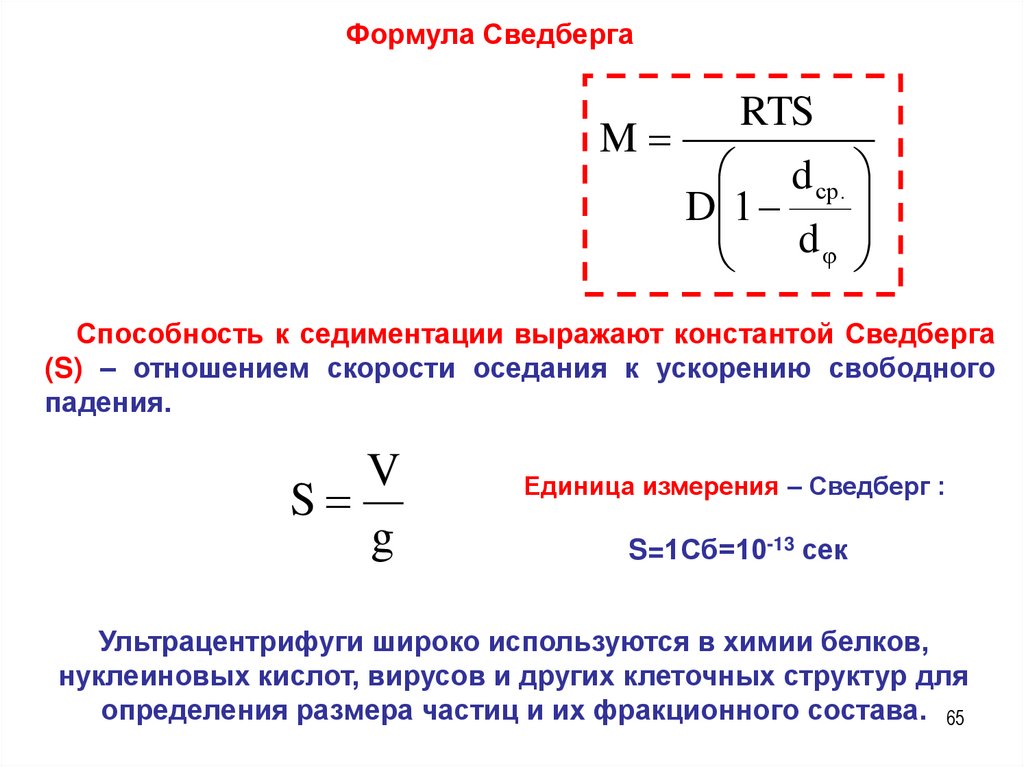
Формула СведбергаRTS
M
d ср.
D 1
d
φ
Способность к седиментации выражают константой Сведберга
(S) – отношением скорости оседания к ускорению свободного
падения.
V
S
g
Единица измерения – Сведберг :
S=1Сб=10-13 сек
Ультрацентрифуги широко используются в химии белков,
нуклеиновых кислот, вирусов и других клеточных структур для
определения размера частиц и их фракционного состава. 65
66.
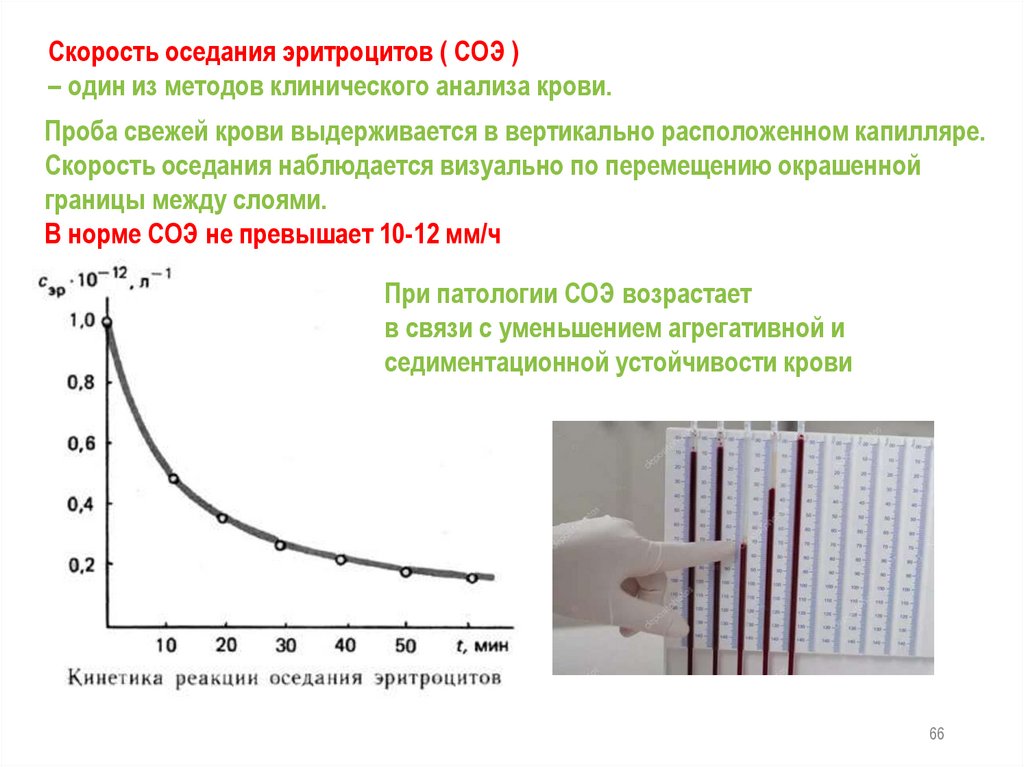
Скорость оседания эритроцитов ( СОЭ )– один из методов клинического анализа крови.
Проба свежей крови выдерживается в вертикально расположенном капилляре.
Скорость оседания наблюдается визуально по перемещению окрашенной
границы между слоями.
В норме СОЭ не превышает 10-12 мм/ч
При патологии СОЭ возрастает
в связи с уменьшением агрегативной и
седиментационной устойчивости крови
66
67.
4. Осмотическое давлениеОсмотическое давление - величина, измеряемая минимальным гидравлическим
давлением, которое нужно приложить к раствору, чтобы осмос прекратился.
Движущая сила осмоса - стремление к выравниванию концентраций.
Растворитель устремляется в область повышенной концентрации вещества.
Процесс прекращается, когда давление становится равным атмосферному.
67
68.
Осмотическое давление коллоидных растворов незначительно и проводитьнаблюдения в обычных условиях очень трудно.
Коллоидная частица по сравнению с обычной молекулой обладает
очень большой массой, поэтому при одинаковой массовой
концентрации в коллоидном растворе содержится во много раз
меньшее число частиц коллоида, чем в истинном растворе
1%-ный коллоидный раствор золя золота с частицами в 1
ммкм имеет осмотическое давление, примерно в 20 раз
меньше, чем 1%-ного раствора сахара при этих же условиях.
68
69.
Оптические свойства коллоидныхрастворов
69
70.
Закон РэлеяИзучал световые и звуковые волны
электромагнетизм, механику,
капиллярность, термодинамику.
Нобелевская премия (1904) «за
исследования плотностей наиболее
распространенных газов и за открытие
аргона в ходе этих исследований».
Джон Уильям Стретт,
третий барон Рэлей
(12.11.1842 – 30.06.1919)
70
71.
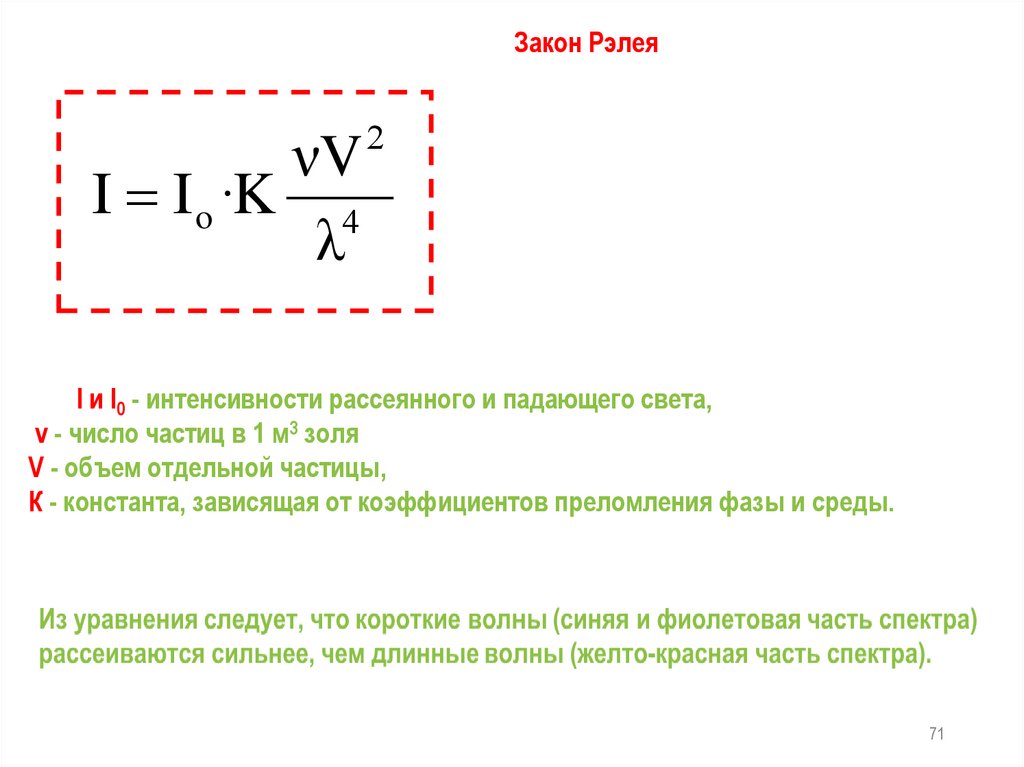
Закон РэлеяνV
I I o ·K 4
λ
2
I и I0 - интенсивности рассеянного и падающего света,
v - число частиц в 1 м3 золя
V - объем отдельной частицы,
К - константа, зависящая от коэффициентов преломления фазы и среды.
71
72.
Опалесценция явление рассеяния света мутной средой, обусловленное еёоптической неоднородностью.
Наблюдается матовое свечение (чаще всего голубоватых
оттенков) при освещении большинства коллоидных растворов.
72
73.
Конус ТиндаляВ основе эффекта лежит рассеяние
видимого света коллоидными частицами,
которое связано с размерами коллоидных
частиц и длиной волны падающего света.
Джон Тиндаль
(1820 –1893)
73
74.
Частицы, размеры которых соизмеримы с длиной полуволны r=1/2λ, аименно такими являются коллоидные частицы, рассеивают свет во все
стороны: световые волны, наталкиваясь на подобные частицы, огибают их,
и луч отклоняется от прямой линии (явление дифракции света).
Конус Тиндаля тем ярче, чем выше концентрация и больше размер частиц.
Интенсивность светорассеяния резко увеличивается с уменьшением длины световой
волны.
Высокодисперсные системы рассеивают более короткие световые волны и поэтому
имеют голубоватую окраску.
74
75.
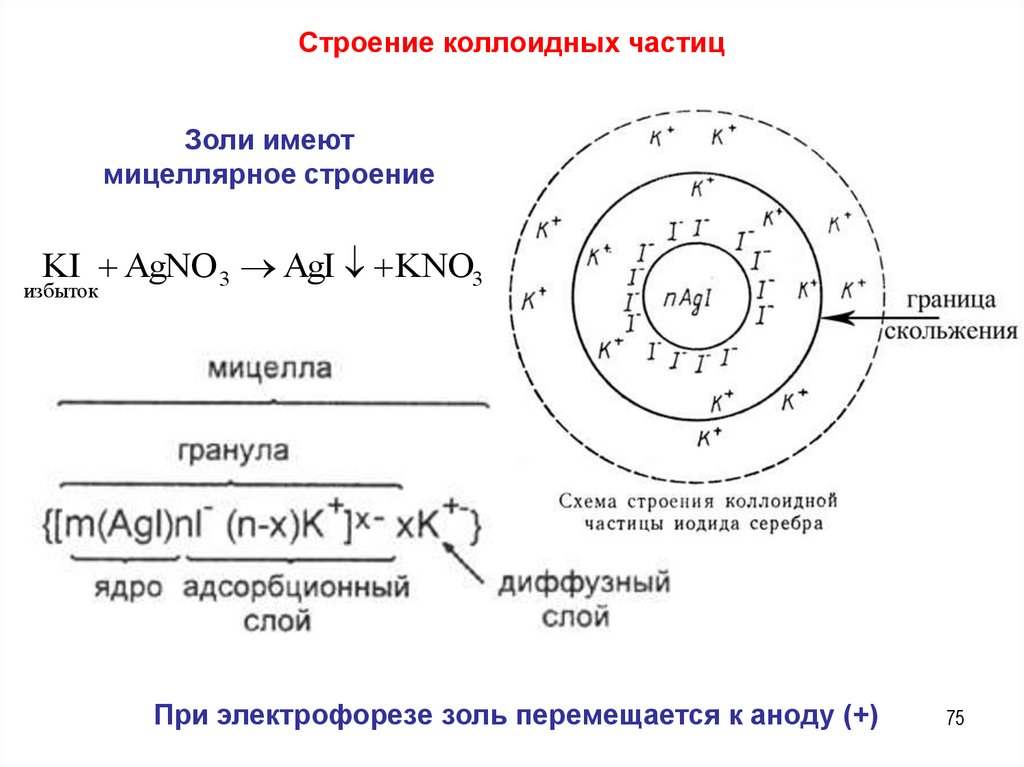
Строение коллоидных частицЗоли имеют
мицеллярное строение
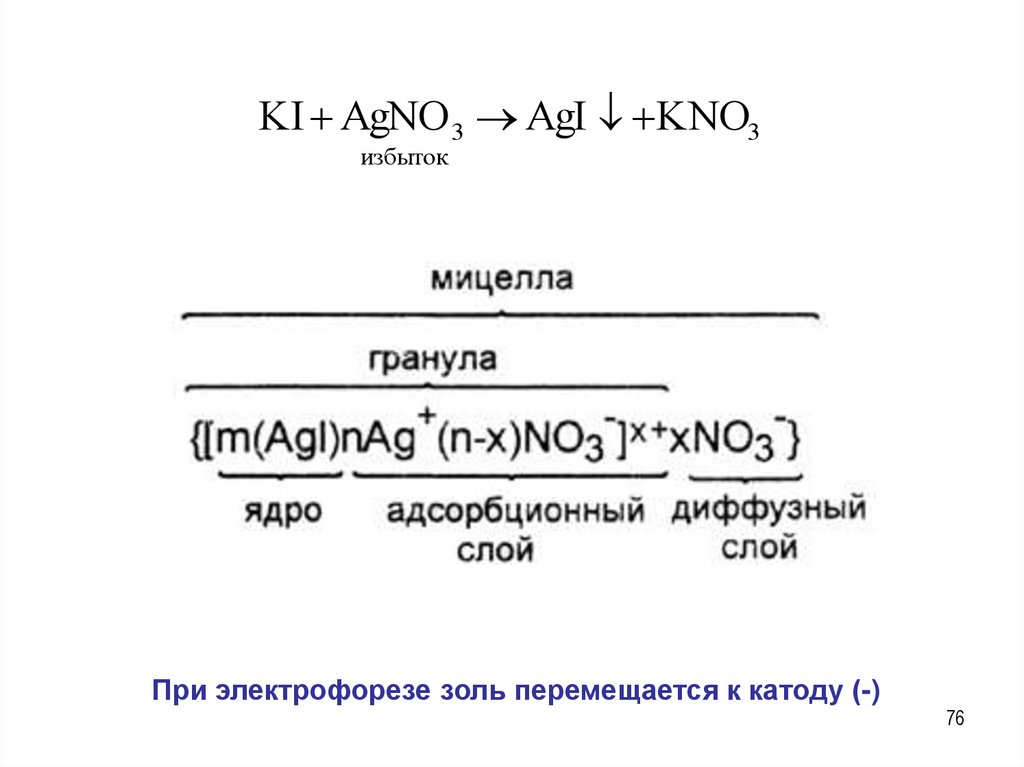
KI AgNO 3 AgI KNO3
избыток
При электрофорезе золь перемещается к аноду (+)
75
76.
KI AgNO 3 AgI KNO3избыток
При электрофорезе золь перемещается к катоду (-)
76
77.
Схема мицеллы золя гидроксида железаFeO+ - потенциалопределяющие ионы
Cl- - противоионы
...
поверхность скольжения
77
78.
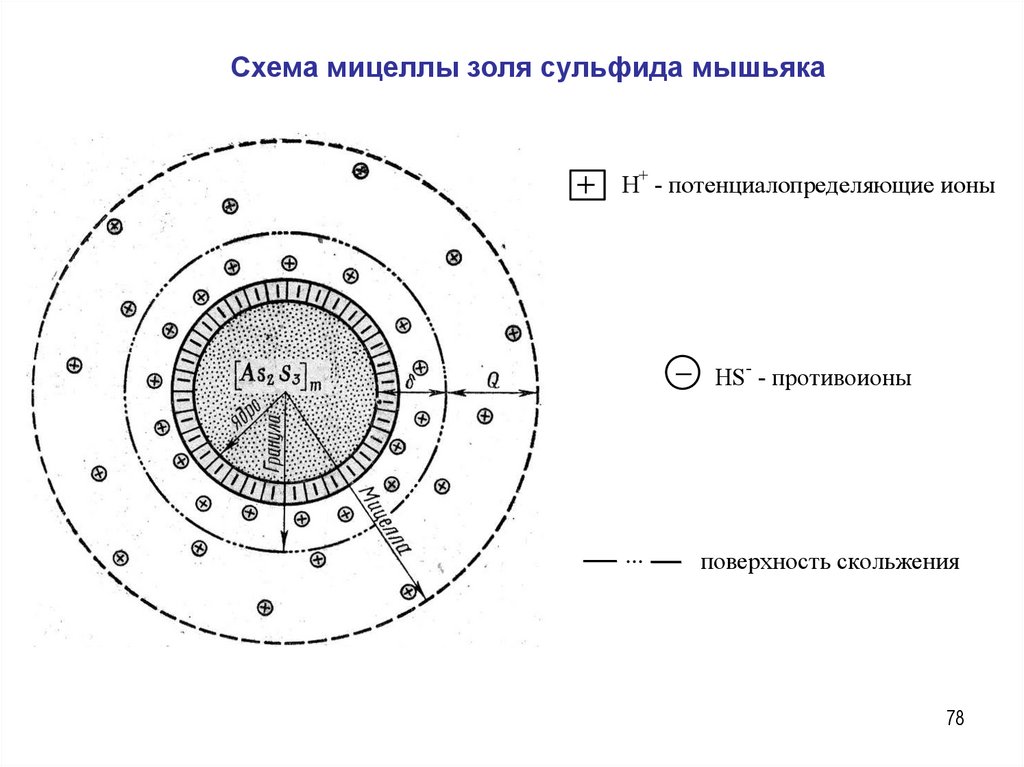
Схема мицеллы золя сульфида мышьякаH+ - потенциалопределяющие ионы
HS- - противоионы
...
поверхность скольжения
78
79.
Значение коллоидных растворовНе случайно Оствальд назвал коллоидные системы «миром
обойденных величин» — в его время коллоидные растворы
были мало изучены и плохо использовались человеком.
В широком смысле слова коллоидами являются все живые
и растительные организмы.
Большую
состоянии.
часть
пищи
мы
принимаем
в
коллоидном
79
80.
Коллоиды — это разнообразные строительные материалы,многие лекарства, краски.
Штамповка печатной краской, которая представляет собой
коллоидную систему.
80
81.
Использование коллоидов в промышленности:пищевой, текстильной, резиновой, кожевенной, лакокрасочной,
керамической, строительных материалов (цемент, бетон,
пенобетон,
вяжущие
растворы),
угольной,
торфяной,
горнорудной и нефтяной (брикеты угольной и торфяной пыли,
суспензии и пены на обогатительных фабриках, нефтяные
эмульсии и промывочные растворы при бурении скважин).
Обогащение полезных ископаемых
(процессы дробления и измельчения, флотации )
81
82.
Разрушение горных пород.При образовании дымовых завес, распылении
химикатов токсичных дымов и туманов
При очистке воздуха (построена на закономерностях,
установленных при исследовании аэрозолей)
В технологии фотографических процессов, искусственного
волокна, пластических масс, смазочных и горючих материалов
При приготовлении дезинфицирующих растворов.
82
83.
При механической и термической обработке металлов и ихсплавов.
При очистке питьевой воды (основана на процессах
адсорбции и взаимной коагуляции)
Коллоидам принадлежит решающая роль в плодородии почв
83
84.
Медико-биологическое значение1. Коллоидные растворы способствуют усвоению пищи
Хлеб, молоко, масло - коллоидные системы. Тонко
раздробленный жир в молоке и сливочном масле усваивается
организмом лучше, чем жир в сплошной массе, например, сало.
84
85.
2. Внутривенное вливание жировых эмульсийна основе хлопкового, соевого и оливкового масел
применяются для энергетического обеспечения голодающего
или ослабленного организма.
Прямые эмульсии – среда полярна, фаза неполярна (масло/вода)
Обратные эмульсии - среда неполярна, фаза полярна (вода/масло)
Помним, что при введении эмульсионных лекарственных препаратов в
организм через кожу используют обратные эмульсии (вода/масло)
При введении эмульсионных лекарственных препаратов в организм
перорально используют прямые эмульсии (масло/вода)
85
86.
3. Применение антибиотиков в качестве аэрозолей при леченииинфекционных и аллергических заболеваний дыхательных путей
и легких.
4. Использование лекарственных веществ в виде суспензий,
эмульсий, мазей, кремов , паст.
Сильно раздробленные вещества легче проникают через поры
кожи, эффективнее действуют на организм
86
87.
6. Биологические жидкости- кровь, плазма, лимфа,спинномозговая жидкость представляют собой
коллоидные системы, в которых ряд веществ - белки,
холестерин, гликоген и многие другие находятся в
коллоидном состоянии.
"Человек –
бродячий коллоид"
87











![Название КС катионного типа […]+ Название КС катионного типа […]+](https://cf5.ppt-online.org/files5/slide/j/Jkma2vGDhP5BwpgOxFWMUAyq9tZ7bKTe8jcI03/slide-14.jpg)
![Название КС анионного типа […]- Название КС анионного типа […]-](https://cf5.ppt-online.org/files5/slide/j/Jkma2vGDhP5BwpgOxFWMUAyq9tZ7bKTe8jcI03/slide-15.jpg)
![Название внутрикомплексных солей […]0 Название внутрикомплексных солей […]0](https://cf5.ppt-online.org/files5/slide/j/Jkma2vGDhP5BwpgOxFWMUAyq9tZ7bKTe8jcI03/slide-16.jpg)














































 Химия
Химия








