Похожие презентации:
Трансдермальные препараты
1. Трансдермальные лекарственные препараты
2. Отличия от медицинских изделий (пластыри)
Трансдермальные пластыри содержат лекарственноесредство, которое проникает через кожу в кровь для
достижения системного эффекта, а
обычные пластыри (медицинские изделия) используются
для физического покрытия раны или для фиксации чеголибо.
3. Пластырь ЕВРА
ЕВРА - это трансдермальный контрацептивный препарат, содержащий норэлгестромин иэтинилэстрадиол, который выделяется в кровоток в течение 24 часов, предотвращая
овуляцию и беременность.
Пластырь трансдермальный квадратный, с бежевой матовой подложкой, закругленными
углами, перфорацией по линии отрыва, бесцветным клеевым (адгезивным) слоем и
прозрачной защитной пленкой; на подложке выдавлена надпись "EVRA"; размер пластыря
трансдермального по длине и ширине (вместе с защитной пленкой) составляет (51.0±1.0)
мм × (51.0±1.0) мм.
В Беларуси не продаётся, в России продаётся в ценовом диапазоне: от 1342 р. до 1683 р.
Предприятие-производитель - LTS Lohmann Therapie-Systeme (Германия)
Упаковка и выпускающий контроль качества - Gedeon Richter (Венгрия) – он же и владелец
регистрационного удостоверения
4. Препараты аналоги
Препаратов-аналогов с такой же лекарственнойформой не существует, есть лишь в виде
таблеток:
Они содержат этинилэстрадиол – один из главных
компонентов пластыря ЕВРА.
5. Показатели качества
Описание: Квадратная трансдермальная система с матовой телесного цвета основой,закруглёнными углами, прозрачной удаляемой плёнкой и бесцветным клеевым
(адгезивным) слоем. Система упакована в непрозрачный белый пакет, на который нанесена
соответствующая маркировка.
Идентификация: а) ВЭЖХ (Время удерживания пиков syn и anti изомеров
норэлгестромина и пика этинилэстрадиола на хроматограммах испытуемых растворов
должно соответствовать времени удерживания соответствующих пиков на хроматограммах
стандартных растворов), б) ТСХ (Пятна изомеров норэлгестромина syn и anti, пятно
этинилэстрадиола на хроматограмме испытуемого раствора по положению, окраске и
размерам должны соответствовать пятнам на хроматограмме стандартного раствора)
Количественное определение (ВЭЖХ): Норэлгестромин – 90%-110%, Этинилэстрадиол
90% - 110%.
Однородность дозированных единиц: Норэлгестромин AV < 15.0, Этинилэстрадиол
AV<15.0
6. Показатели качества
Примеси (ВЭЖХ): Норгестрел < 1,0%, Другие продукты распада норэлгестромина(отдельно и суммарно) < 1,0%, Продукты распада этинилэстрадиола (отдельно) < 1,0%,
Продукты распада этинилэстрадиола (суммарно) < 2,0%, Неидентифицируемые (отдельно
и суммарно) < 0,5%.
Лаурил лактат (ГХ): 3,0% - 4,5%.
Растворение (ВЭЖХ):Норэлгестромин: 0,5 ч – 12%-22%, 2,0 – 31%-49%, 8,0 ч – 50%-83%.
Этинилэстрадиол: 0,5 ч – 13%-25%, 2,0 ч – 34%-53%, 8,0 ч – 50%-83%.
Остаточные растворители (ГХ): n-Гексан < 0,2%, Этилацетат < 0,1%, Изопропиловый
спирт < 0,6%.
Усилие отрыва: < 100 сН/пластырь (сН – сантиньютон – 0,01 от Ньютона).
Сила адгезии: 3,0 Н/пластырь – 20,0 Н/пластырь.
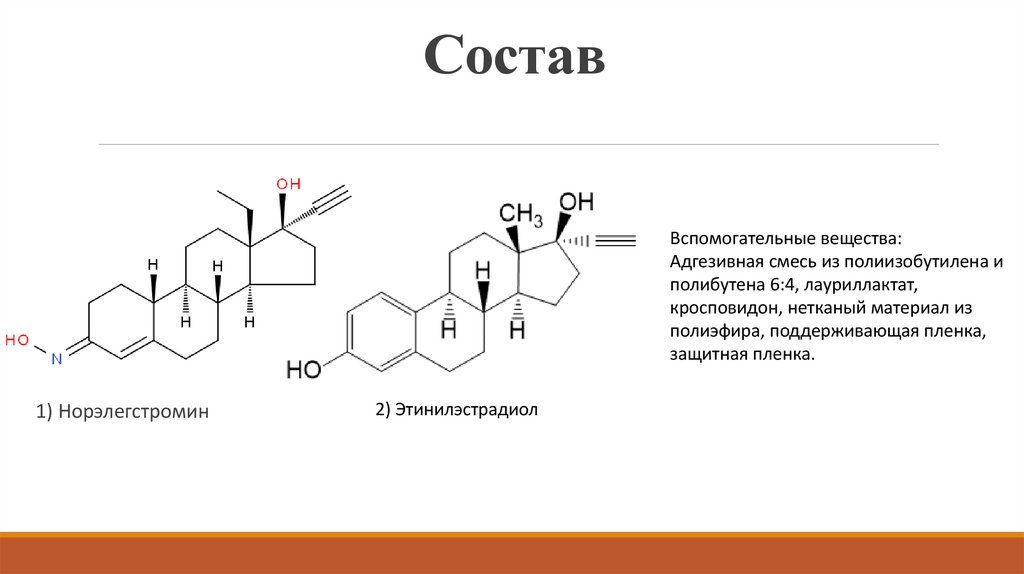
7. Состав
Вспомогательные вещества:Адгезивная смесь из полиизобутилена и
полибутена 6:4, лауриллактат,
кросповидон, нетканый материал из
полиэфира, поддерживающая пленка,
защитная пленка.
1) Норэлегстромин
2) Этинилэстрадиол
8. Фармакологическое действие
Механизм действия пластыря трансдермального Евра® основан на угнетении гонадотропной функциигипофиза под влиянием входящих в его состав эстрогена этинилэстрадиола и прогестагена
норэлгестромина. Основной механизм действия заключается в подавлении овуляции. Эффективность
препарата усиливается за счет повышения вязкости секрета шейки матки и изменения свойств
эндометрия.
На фоне применения высокодозированных КГК (50 мкг этинилэстрадиола) снижается риск развития
рака эндометрия и рака яичников. Справедливость этого утверждения в отношении
низкодозированных КГК не подтверждена.
В стандартных доклинических исследованиях фармакологической безопасности, токсичности при
многократном применении, генотоксичности и канцерогенного потенциала особых опасностей для
человека выявлено не было. В исследованиях репродуктивной токсичности норэлгестромин проявлял
фетотоксичность у кроликов, однако запас безопасности для этого действия был весьма высок.
Исследования, в которых оценивалось влияние пластыря трансдермального Евра® на кожу, показали,
что пластырь не вызывает аллергических реакций и вызывает лишь незначительное раздражение
кожи кроликов в месте аппликации.
9. Побочное действие
Наиболее частыми нежелательными реакциями (НР), наблюдаемыми в клиническихисследованиях, были головная боль (21.0%), тошнота (16.6%) и болезненность молочных
желез (15.9%). НР, которые могут возникнуть в начале применения пластыря, но обычно
проходят после первых 3 циклов применения, включают в себя болезненность молочных
желез и тошноту.
У женщин, применяющих КГК, наблюдается повышенный риск развития артериальных и
венозных тромботических и тромбоэмболических осложнений, в т.ч. инфаркта миокарда,
инсульта, транзиторной ишемической атаки, венозного тромбоза и ТЭЛА.
10. Технологический процесс
Подготовка сырья• Контроль качества: Все входящие
материалы (АФИ – норэлгестромин и
этинилэстрадиол, полимерные адгезивы,
пленки-основы, защитные лайнеры,
растворители) проходят входной
контроль согласно спецификациям
Приготовление
адгезивной
массы:
Растворение/Диспергирование полимеров: Полимерная основа
растворяется или диспергируется в подходящем органическом
растворителе
в
реакторе.
• Введение АФИ: Активные вещества (норэлгестромин и
этинилэстрадиол) добавляются в полимерный раствор.
• Смешивание: Масса тщательно перемешивается в течение
заданного времени при контролируемой температуре и скорости,
чтобы обеспечить полную гомогенность и равномерное
распределение АФИ в растворе
Нанесение покрытия
• Выбор подложки: В зависимости
от технологии, адгезивная масса
может наноситься либо на
защитный лайнер (Release Liner),
либо на пленку-основу (Backing
Film). В случае ЕВРА, чаще всего
покрытие наносится на
силиконизированный лайнер.
• Процесс нанесения: Используется
высокоточный метод нанесения
покрытия (например, Slot Die
Coating или Knife-over-Roll Coating),
который обеспечивает равномерную
толщину слоя и, соответственно,
точную дозировку АФИ на единицу
площади.
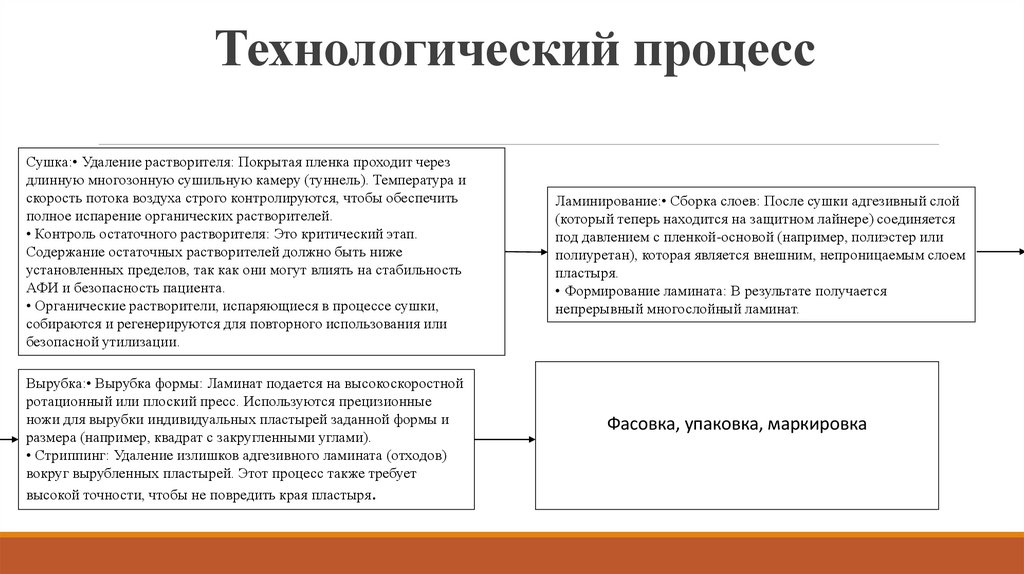
11. Технологический процесс
Сушка:• Удаление растворителя: Покрытая пленка проходит черездлинную многозонную сушильную камеру (туннель). Температура и
скорость потока воздуха строго контролируются, чтобы обеспечить
полное испарение органических растворителей.
• Контроль остаточного растворителя: Это критический этап.
Содержание остаточных растворителей должно быть ниже
установленных пределов, так как они могут влиять на стабильность
АФИ и безопасность пациента.
• Органические растворители, испаряющиеся в процессе сушки,
собираются и регенерируются для повторного использования или
безопасной утилизации.
Вырубка:• Вырубка формы: Ламинат подается на высокоскоростной
ротационный или плоский пресс. Используются прецизионные
ножи для вырубки индивидуальных пластырей заданной формы и
размера (например, квадрат с закругленными углами).
• Стриппинг: Удаление излишков адгезивного ламината (отходов)
вокруг вырубленных пластырей. Этот процесс также требует
высокой точности, чтобы не повредить края пластыря.
Ламинирование:• Сборка слоев: После сушки адгезивный слой
(который теперь находится на защитном лайнере) соединяется
под давлением с пленкой-основой (например, полиэстер или
полиуретан), которая является внешним, непроницаемым слоем
пластыря.
• Формирование ламината: В результате получается
непрерывный многослойный ламинат.
Фасовка, упаковка, маркировка