Похожие презентации:
Пороки
1. Врожденные пороки сердца
2. Врожденные пороки сердца
Врожденные пороки сердца – группа заболеваний,объединенных наличием анатомических дефектов сердца, его
клапанного аппарата или сосудов, возникших во внутриутробном
периоде, приводящих к изменению внутрисердечной и системной
гемодинамики.
Этиология врожденных пороков сердца может быть обусловлена хромосомными нарушениями (5%), генной
мутацией (2-3%), влиянием факторов среды (1-2%), полигенно-мультифакториальной предрасположенностью
(90%).
3. ЭТИОЛОГИЯ ВПС
• Среди причин врожденных пороков сердца можно выделить следующие:1. Хромосомные нарушения – 5% ; при различных хромосомных перестройках
(аберрациях) возникают количественные и структурные мутации хромосом. Пороки сердца,
ассоциируются с хромосомными аномалиями.
2. Мутация одного гена 2-3 %;
3. Факторы среды 1-2%; (алкоголизм родителей, перенесенная во время беременности
краснуха, воздействие рентгеновского излучения на организм женщины в первом триместре,
лекарственные препараты и т.д.)
Помимо этиологических факторов, следует выделить и другие факторы такие как, которыми являются:
1. Возраст матери,
2. эндокринные заболевания у супругов,
3. Токсикозы, мертворождение в анамнезе, прием женщиной эндокринных препаратов для сохранения
беременности.
4.
Внутриутробное поражение плода вирусом краснухи наиболее частовызывает триаду аномалий – глаукому или катаракту, глухоту, врожденные
пороки сердца (тетраду Фалло, транспозицию магистральных сосудов,
открытый артериальный проток, общий артериальный ствол, клапанные
пороки, стеноз легочной артерии, ДМЖП и др.). Также обычно имеют место
микроцефалия, нарушение развития костей черепа и скелета, отставание в
умственном и физическом развитии.
Кроме краснухи беременной, опасность для плода в плане развития
врожденных пороков сердца представляют ветряная оспа, простой герпес,
аденовирусные инфекции, сывороточный гепатит, цитомегалия, микоплазмоз,
токсоплазмоз, сифилис, туберкулез и др.
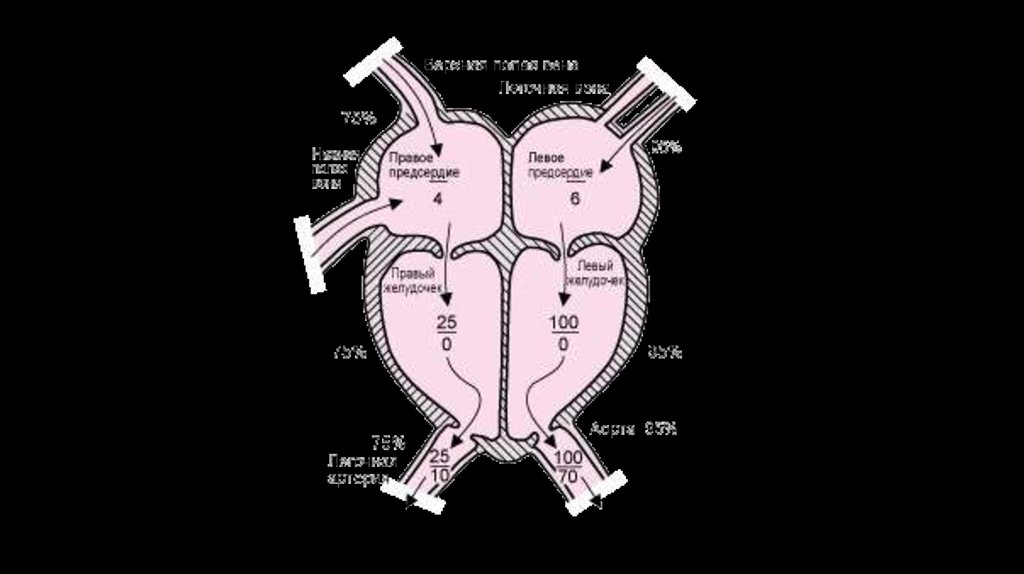
5. Классификация ВПС
Врожденные пороки сердца делятся на три группы;1 . ВПС бледного типа с артерио-венозным шунтом (дефект межжелудочковой перегородки (ДМЖП),
дефект межпредсердной перегородки (ДМПП), открытый артериальный проток (ОАП (Баталлов проток))
и т. д.
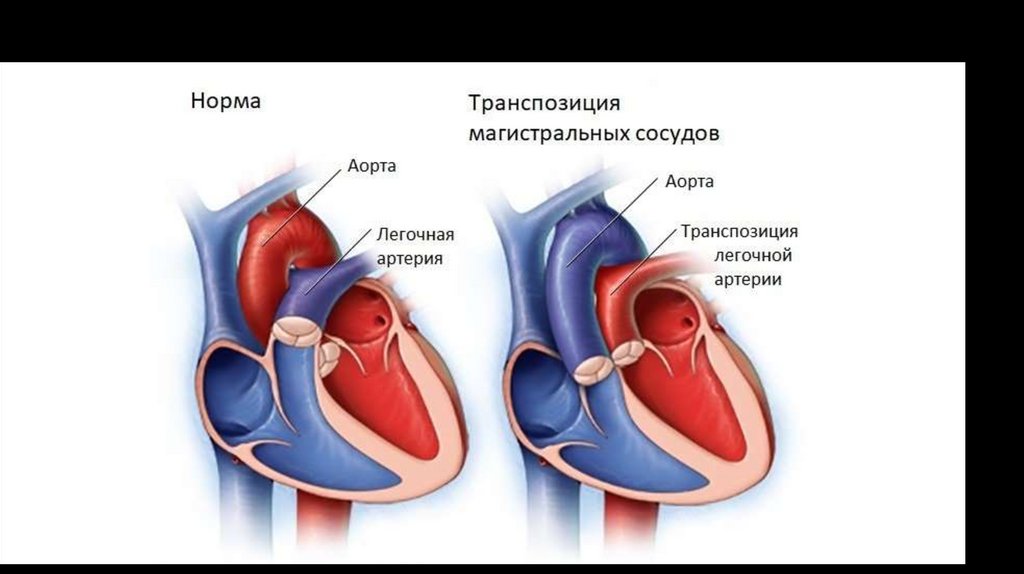
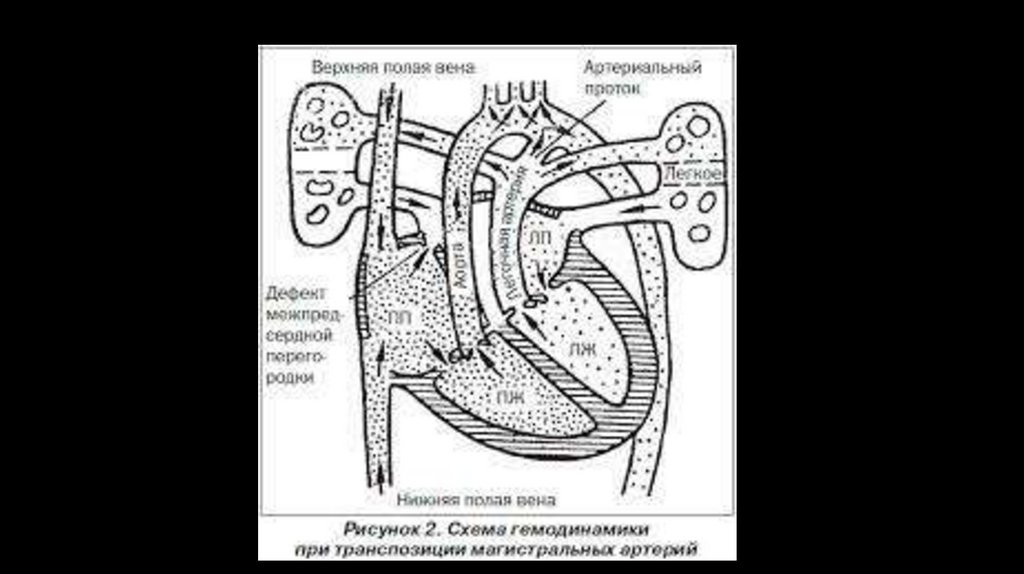
2. ВПС синего типа с веноартериальным сбросом (тетрада Фалло, Транспозиция магистральных сосудов
(ТМС), атрезия трехстворчатого клапана, единственный желудочек.
3. ВПС без сброса, но с препятствием выбросу крови из желудочков ( стенозы легочной артерии, аорты и
т.д.)
6.
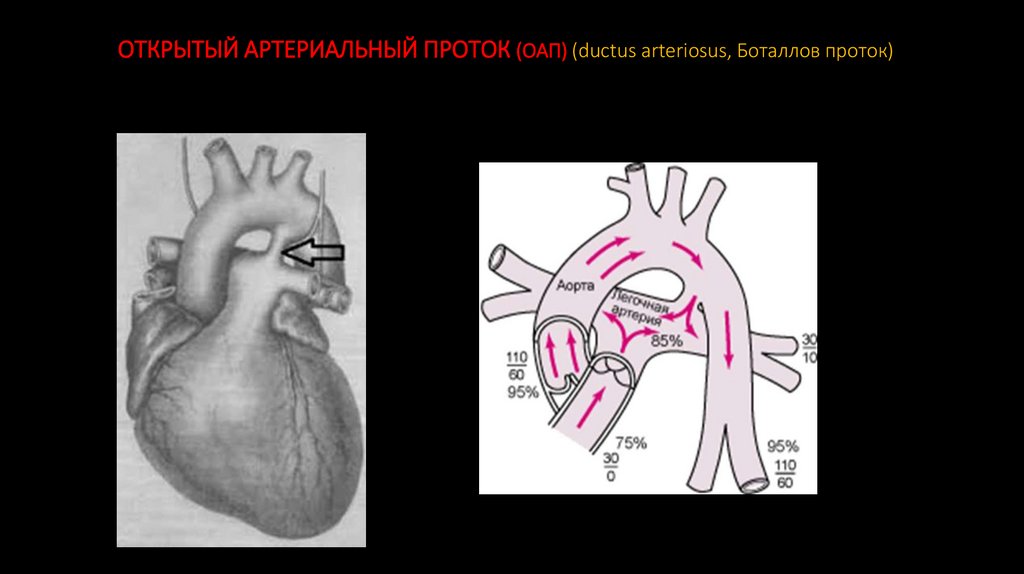
7. ОТКРЫТЫЙ АРТЕРИАЛЬНЫЙ ПРОТОК (ОАП) (ductus arteriosus, Боталлов проток)
8.
Закрытие артериального протока в нормеУ развивающегося плода артериальный проток соединяет лёгочную артерию и аорту, что позволяет
снабжать наполненные жидкостью сжатые лёгкие плода оксигенированной кровью из правого
желудочка и при этом не перегружать его. В период внутриутробного развития, этот шунт защищает
правый желудочек от перегрузок путём сброса избыточной крови (которая не может пройти в легочные
артерии из-за высокого сопротивления в сжатых лёгких) в аорту в обход малого круга кровообращения.
Внутриутробное закрытие этого протока может привести к правожелудочковой недостаточности.
Когда новорождённый делает свой первый вдох, лёгкие расправляются и сопротивление сосудов
лёгких уменьшается. После рождения лёгкие высвобождают брадикинин, который сокращает гладкие
мышцы стенок артериального протока и уменьшает кровоток через него. Артериальный проток обычно
сужается и полностью зарастает в течение 15-20 часов жизни, но не более 2-8 недель (в редких случаях
до 15 недель при положительной динамике закрытия). Основной стимул закрытия протока —
увеличение содержания кислорода в крови новорождённых. Выделение материнских циркулирующих
простагландинов препятствует закрытию протока. В современной практике препараты,
тормозящие образование простагландинов, используются как терапевтические средства для закрытия
артериального протока у новорожденных при врожденном дефекте его закрытия. Рубец из фиброзных
остатков артериального протока называют артериальной связкой, которая остаётся в нормальном
сердце взрослого человека.
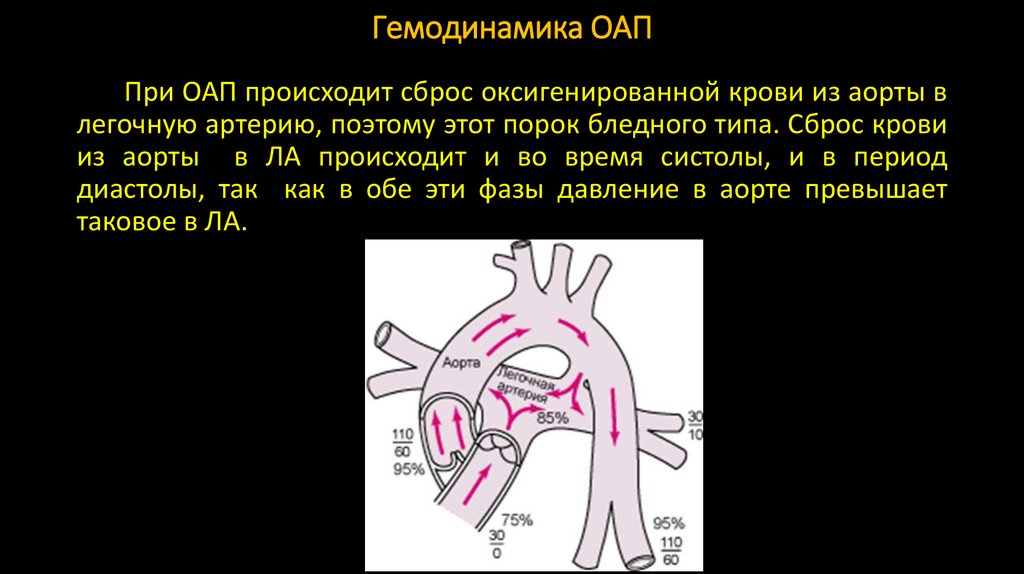
9. Гемодинамика ОАП
При ОАП происходит сброс оксигенированной крови из аорты влегочную артерию, поэтому этот порок бледного типа. Сброс крови
из аорты в ЛА происходит и во время систолы, и в период
диастолы, так как в обе эти фазы давление в аорте превышает
таковое в ЛА.
10.
Клинически тяжесть течения ОАП определяетсяразмерами протока и величиной общелегочного
сопротивления.
Гемодинамические нарушения при ОАП
обуславливают расширение левых отделов сердца.
При развитии легочной гипертензии преобладает
дилятация и гипертрофия правого желудочка
11.
Клиническая картинаОбщие симптомы:
1. Признаки сердечной недостаточности (тахикардия, одышка);
2. Деформация грудной клетки, за счет увеличение размеров
сердца (сердечный горб);
3. Определяется
непрерывный
систолодиастолический
«машинный» шум, выслушиваемый во втором-третьем
межреберье слева от грудины, акцент 2 тона над легочной
артерией у детей с легочной гипертензией;
4. Высокое пульсовое давление;
5. Замедленный рост и развитие;
12.
Диагноз открытого артериального протокаустанавливается на основании обследования:
1. при перкусии расширены границы сердца;
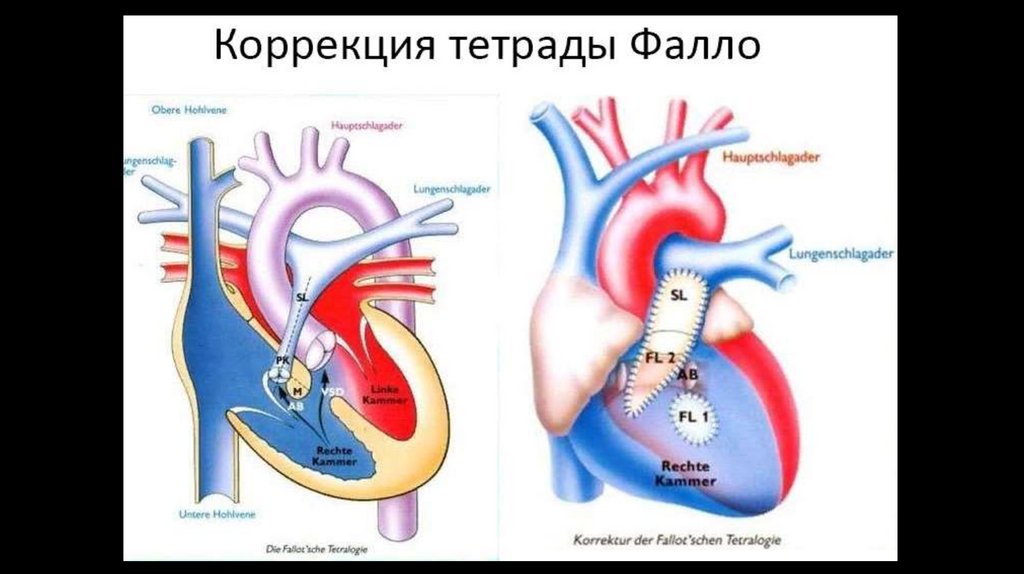
2. при аускультации выслушивается характерный для этого заболевания грубый, так называемый
«машинный» систоло-диастолический шум;
3. на электрокардиограмме не бывает изменений, заставляющих заподозрить открытый
артериальный проток;
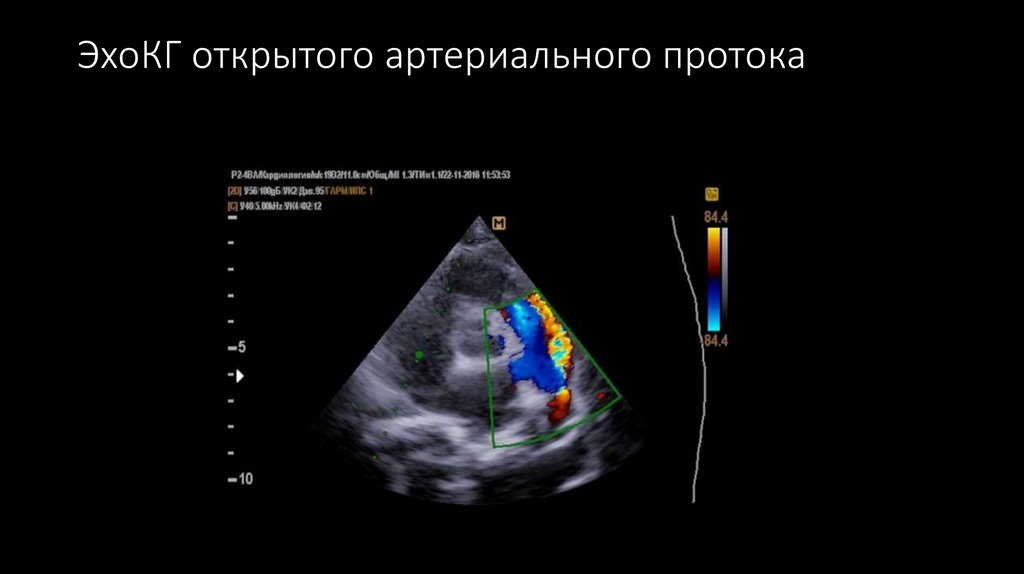
4. эхокардиографически обнаруживается наличие характерного потока крови в типичном месте
между аортой и легочной артерией по направлению от аорты к легочной артерии ;
5. по рентгеновским снимкам легких судят о степени изменений легочной ткан
6. При ангиокардиографии определяют давление в легочной артерии, правом желудочке и выявляют
заброс контрастного вещества из дуги аорты в легочную артерию;
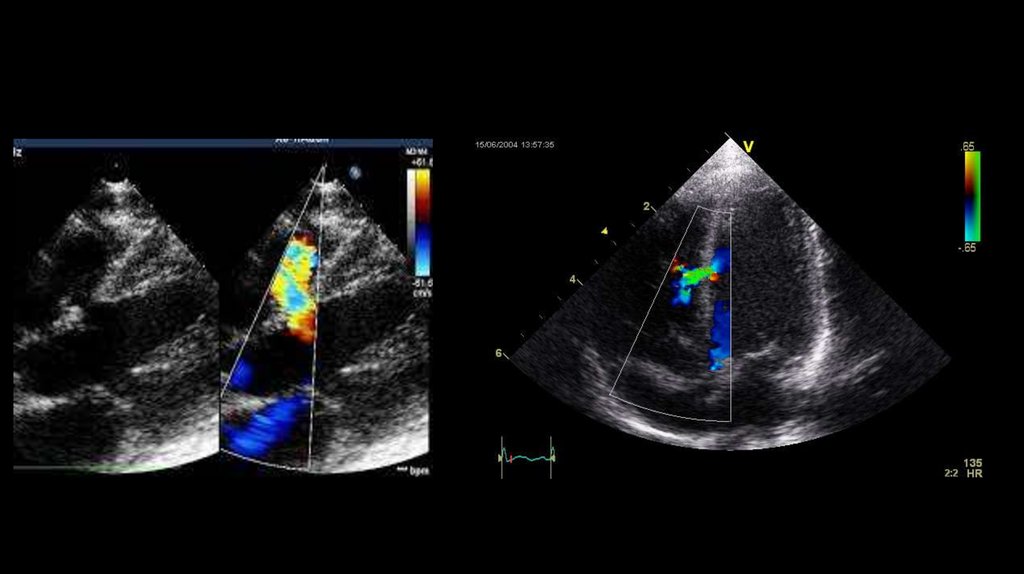
13. ЭхоКГ открытого артериального протока
14.
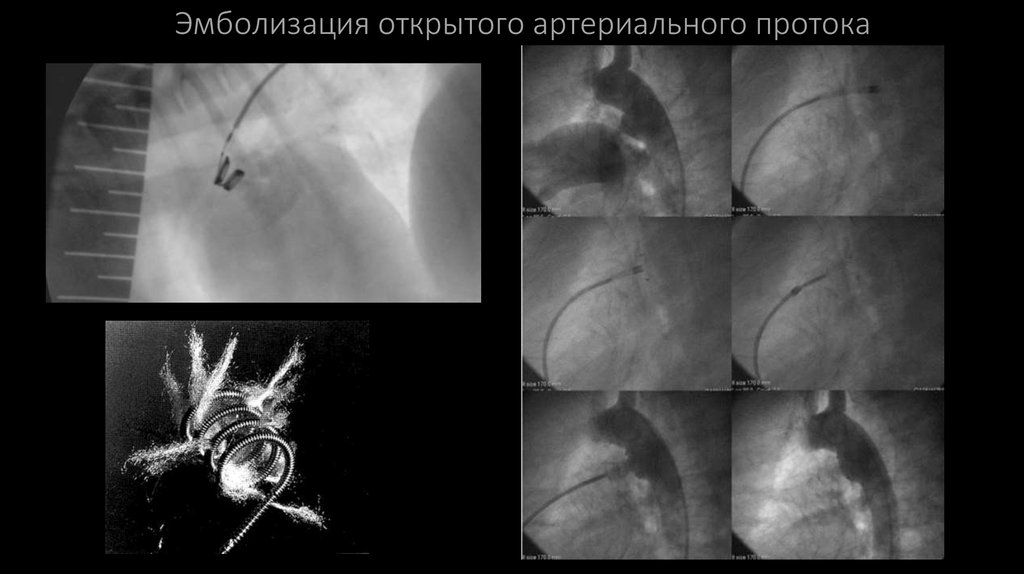
Лечение открытого артериального протокаВ настоящее время развитие медицинских технологий позволяет в большинстве случаев (97%) устранить
артериальный проток, не прибегая к торакотомии, а выполнить операцию пункционно, через бедренные
сосуды (эмболизация).
При артериальном протоке диаметром не более 3.0 мм возможна имплантация небольшой спирали, а
при диаметре от 3 до 20 мм — проток закрывают специальными механическими окклюдерами.
Продолжительность операции составляет 15-25 минут и выполняется под внутривенной анестезией, что
позволяет сразу после операции перевести ребенка в палату к маме и на следующий день выписать из
госпиталя. О проведенном оперативном лечении будет напоминать спираль или окклюдер выявляемый
каждый раз, когда ребенку будет выполняться рентгенография грудной клетки. Шрамов и следов
операции на теле ребенка не остается. Имплантируемые спирали и окклюдеры полностью МРТсовместимы и позволяют путешествовать по всему миру, свободно проходя через рамки
металлодетекторов.
15. Эмболизация открытого артериального протока
16.
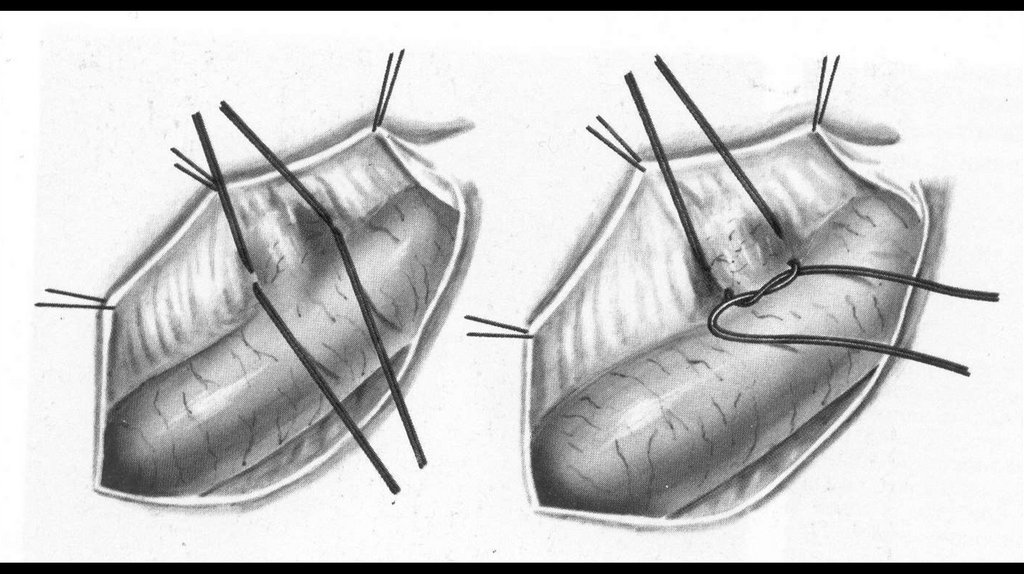
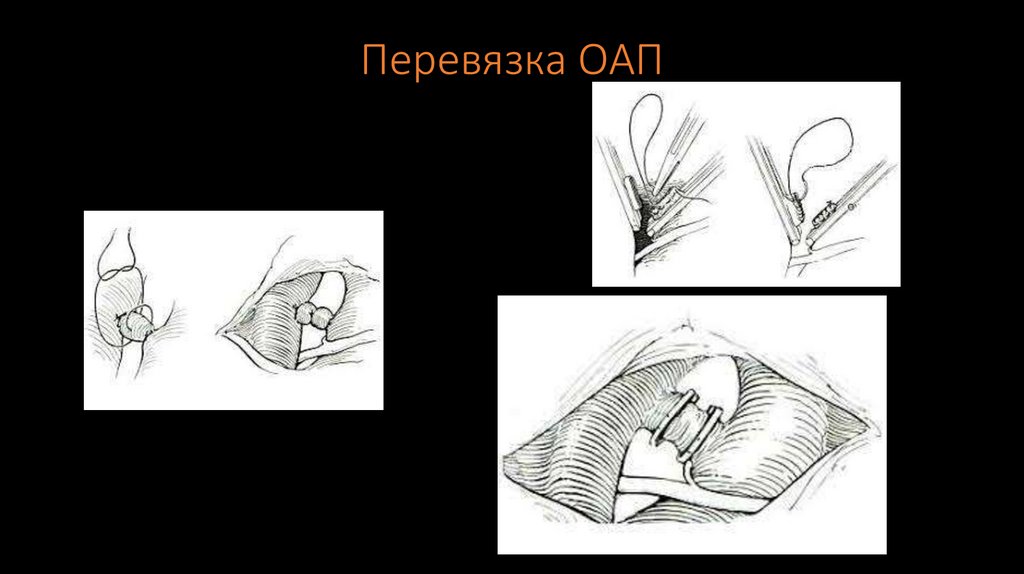
17. Перевязка ОАП
18.
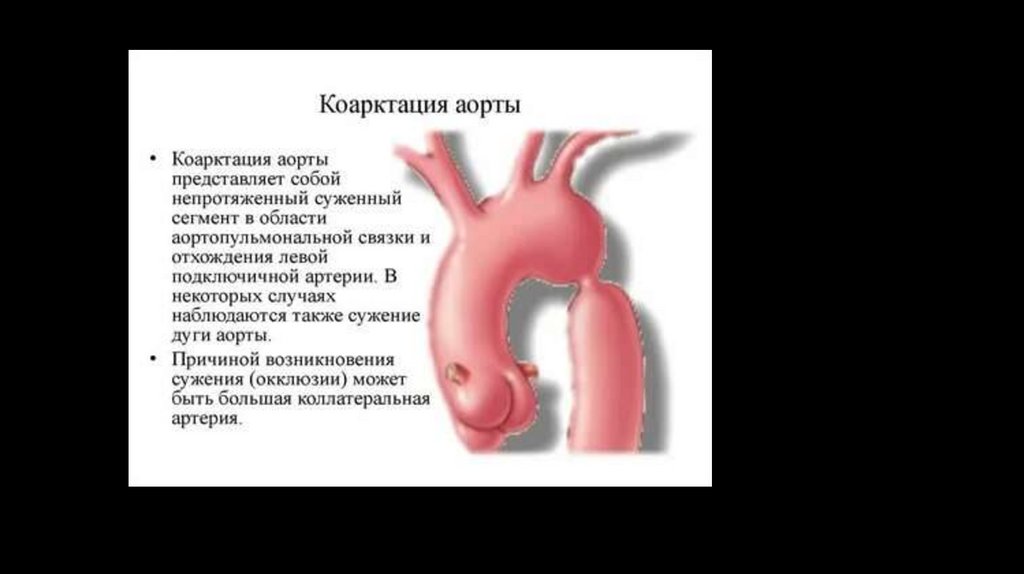
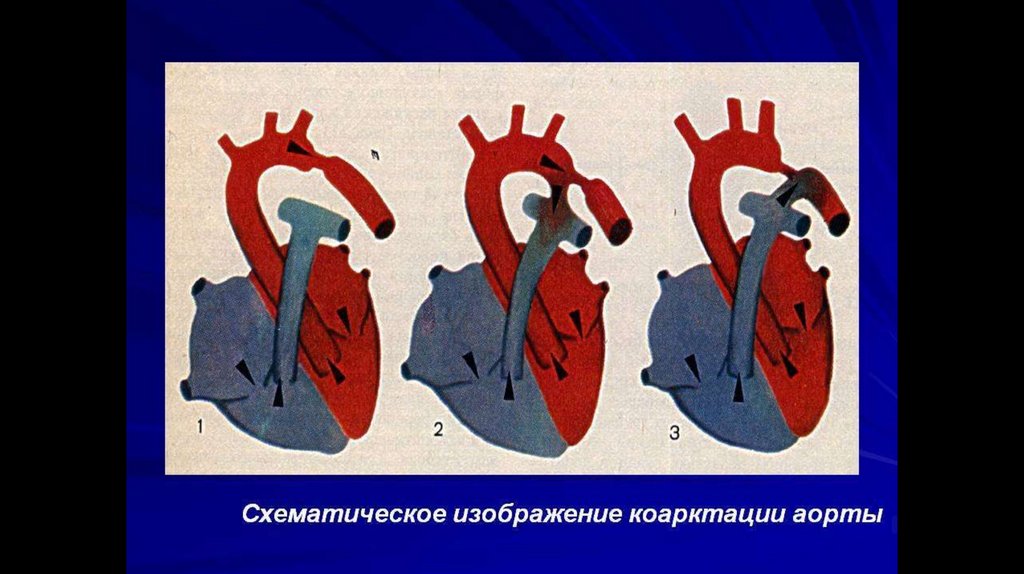
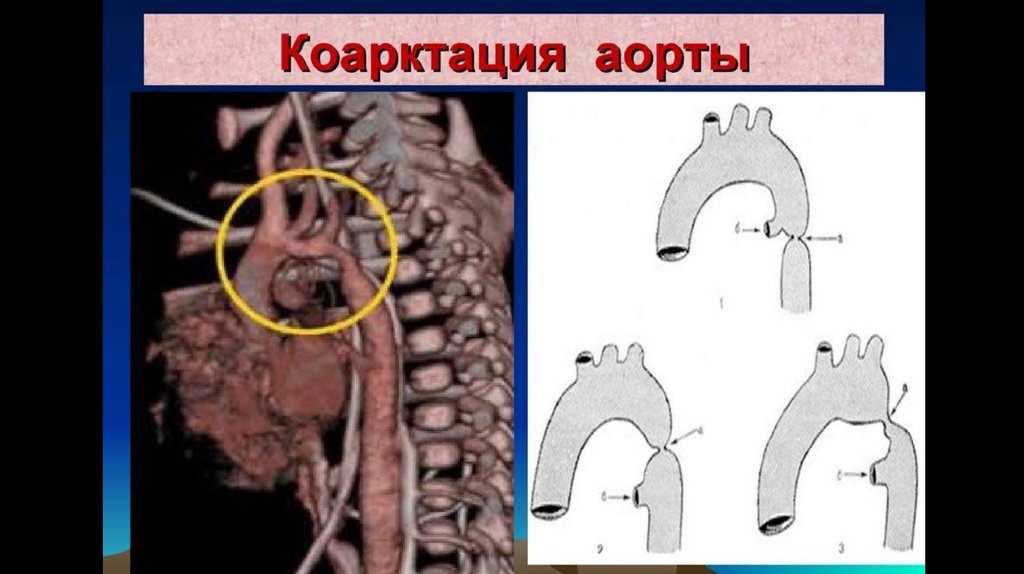
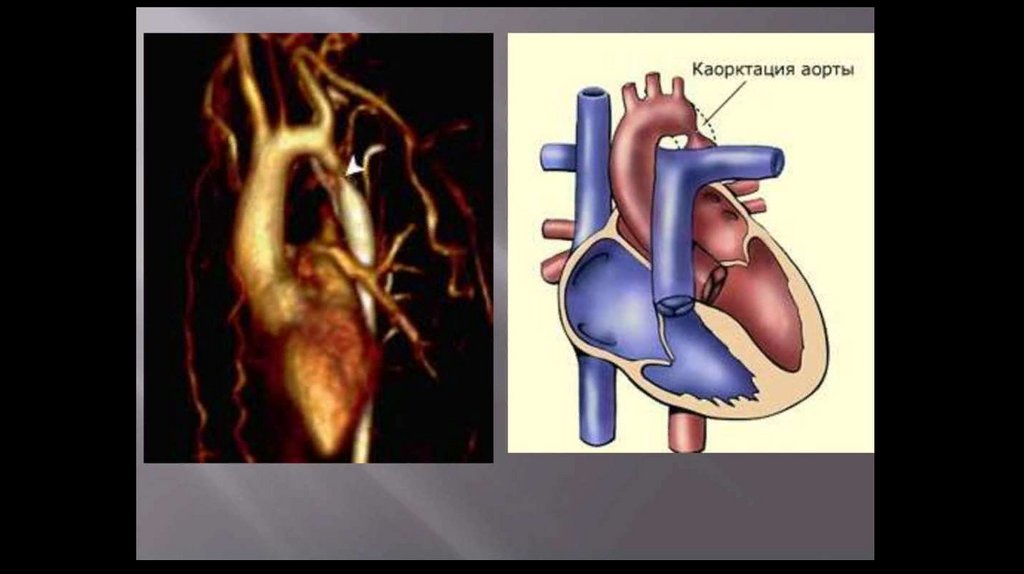
Коарктация аорты – врожденный сегментарный стеноз (или полнаяатрезия) аорты в области перешейка - перехода дуги в нисходящую часть; реже – в
нисходящем, восходящем или брюшном отделах
Типичным местом расположения стеноза служит терминальный отдел дуги аорты между
артериальным протоком и устьем левой подключичной артерии (область перешейка аорты). В этом
месте коарктация аорты выявляется у 90-98% больных.
Снаружи сужение может иметь вид песочных часов или перетяжки с нормальным диаметром аорты
в проксимальном и дистальном отделах. Протяженность коарктации аорты может составлять от
нескольких мм до 10 и более см, однако чаще ограничивается 1-2 см.
19.
Причины коарктации аортыВ кардиохирургии рассматривается несколько теорий формирования
коарктации аорты.
• Принято считать, что в основе порока лежит нарушение слияния аортальных дуг в периоде
эмбриогенеза.
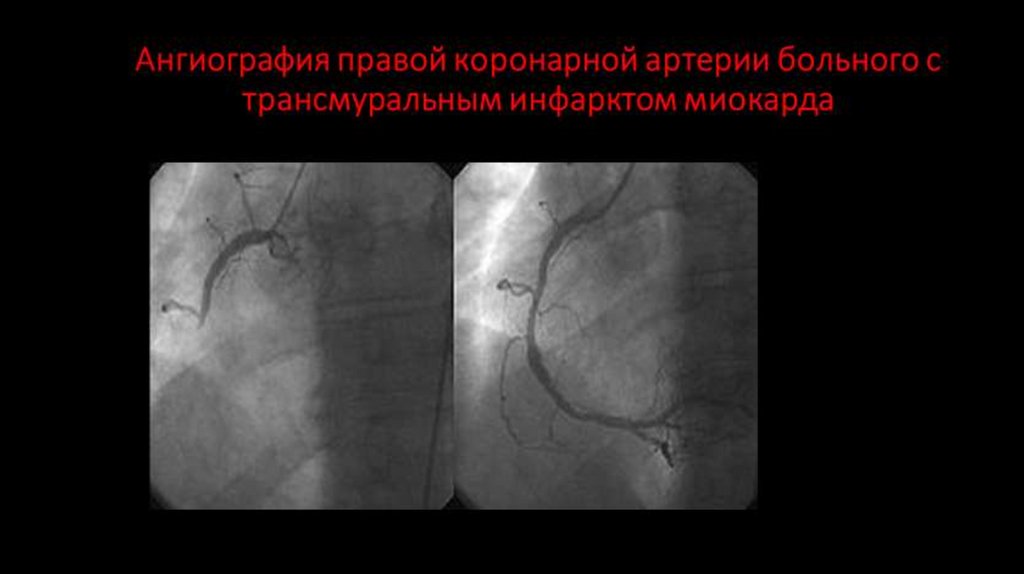
• Согласно теории Шкоды, коарктации аорты формируется вследствие закрытия открытого
артериального протока (ОАП) с одновременным вовлечением прилегающей части аорты, при
этом происходит ее сужение или полное заращение просвета на определенном участке.
• По теории Андерсона–Беккера причиной коарктации может служить наличие серповидной
связки аорты, которая обусловливает сужение перешейка при облитерации ОАП в области ее
расположения.
20.
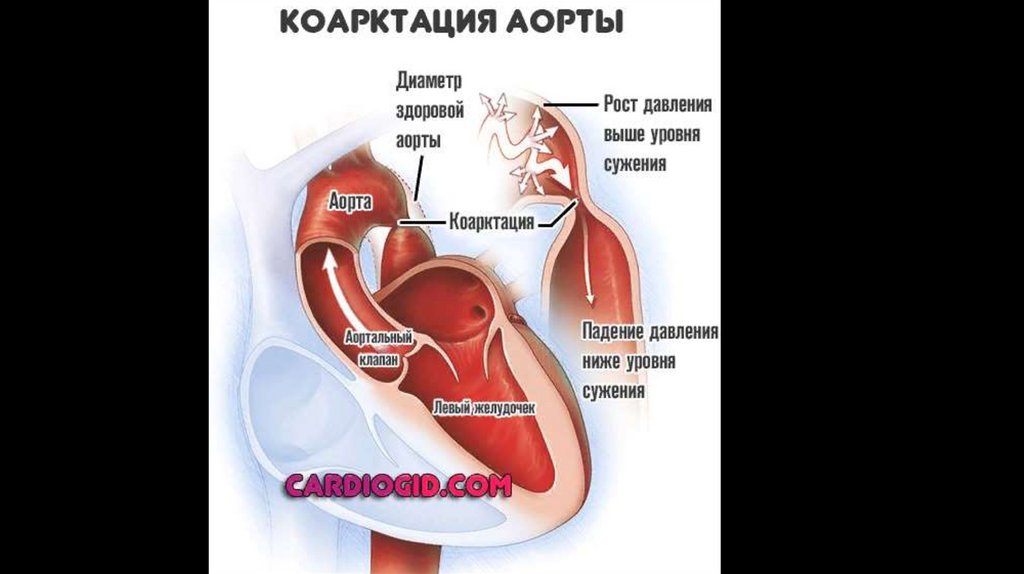
21. Гемодинамика коарктации аорты
• Стенотическое изменение аорты в месте перехода ее дуги в нисходящую частьобусловливает развитие двух режимов кровообращения в большом круге: проксимальнее
места препятствия кровотоку имеется артериальная гипертензия, дистальнее – гипотензия.
В связи с имеющимися гемодинамическими нарушениями у больных с коарктацией аорты
включаются компенсаторные механизмы – развивается гипертрофия миокарда левого
желудочка, увеличивается ударный и минутный объем, расширяется диаметр восходящей
аорты и ветвей ее дуги, расширяется сеть коллатералей. У детей старше 10 лет в аорте и
сосудах уже отмечаются атеросклеротические изменения.
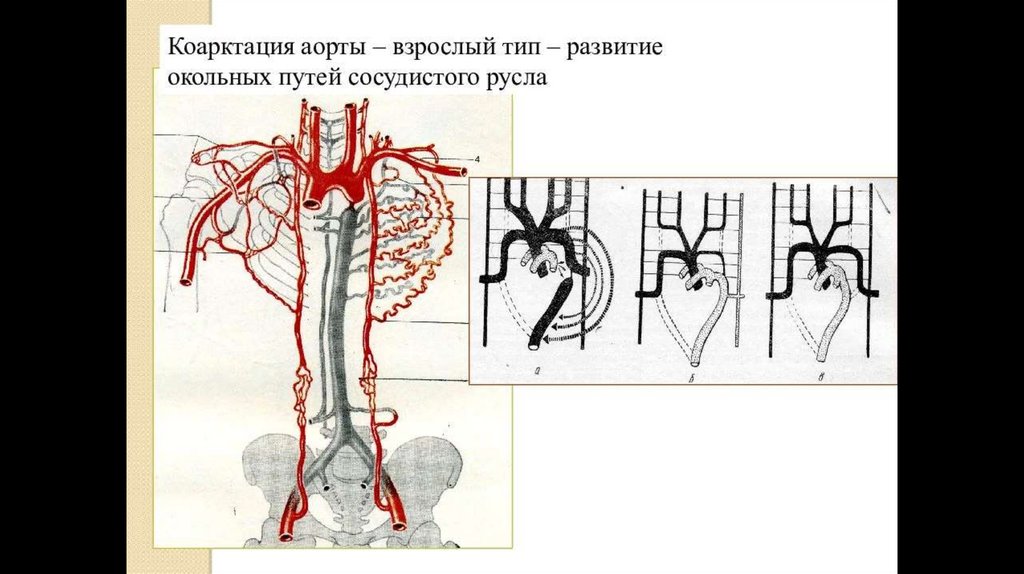
• На особенности гемодинамики при коарктации аорты значительное влияние оказывают
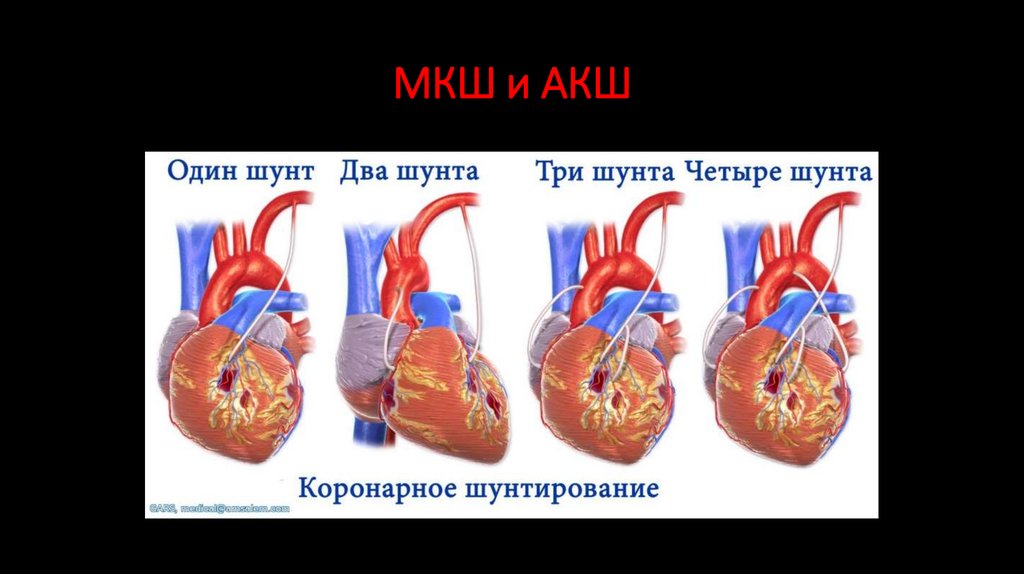
сопутствующие врожденные пороки сердца и сосудов. Со временем в артериях,
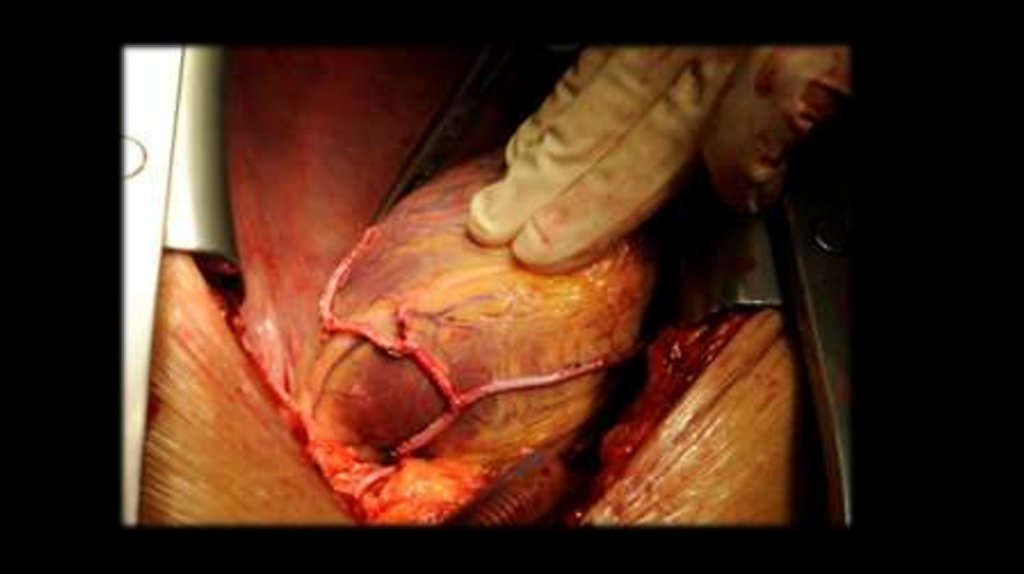
задействованных в коллатеральном кровообращении, (межреберных, внутренних грудных,
боковых грудных, лопаточных, эпигастральных и т.д.), происходят изменения: их стенки
истончаются, а диаметр увеличивается, предрасполагая к формированию престенотических
и постстенотических аневризм аорты, аневризм артерий головного мозга и др. Обычно
аневризматическое расширение сосудов наблюдается у больных старше 20 лет.
• Давление извитых и расширенных межреберных артерий на ребра способствует
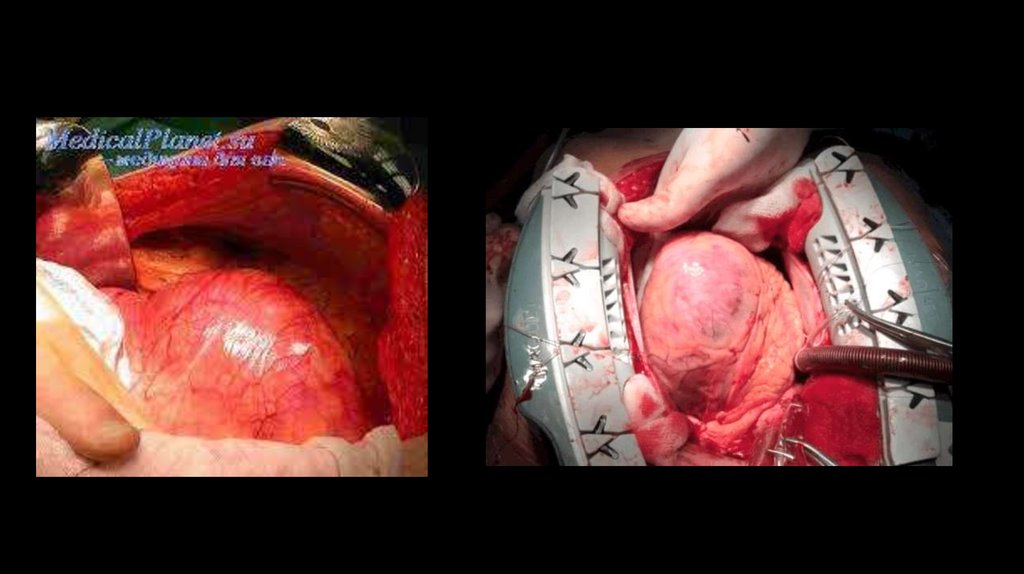
образованию узур (зазубрин) на нижних краях ребер. Данные изменения появляются у
пациентов с коарктацией аорты в возрасте старше 15 лет.
22.
23.
24.
Классификация коарктации аортыС учетом локализации патологического сужения различают коарктацию :
1.
2.
3.
4.
5.
В области перешейка;
Восходящей аорты;
Нисходящей аорты;
Грудной аорты;
Брюшной аорты;
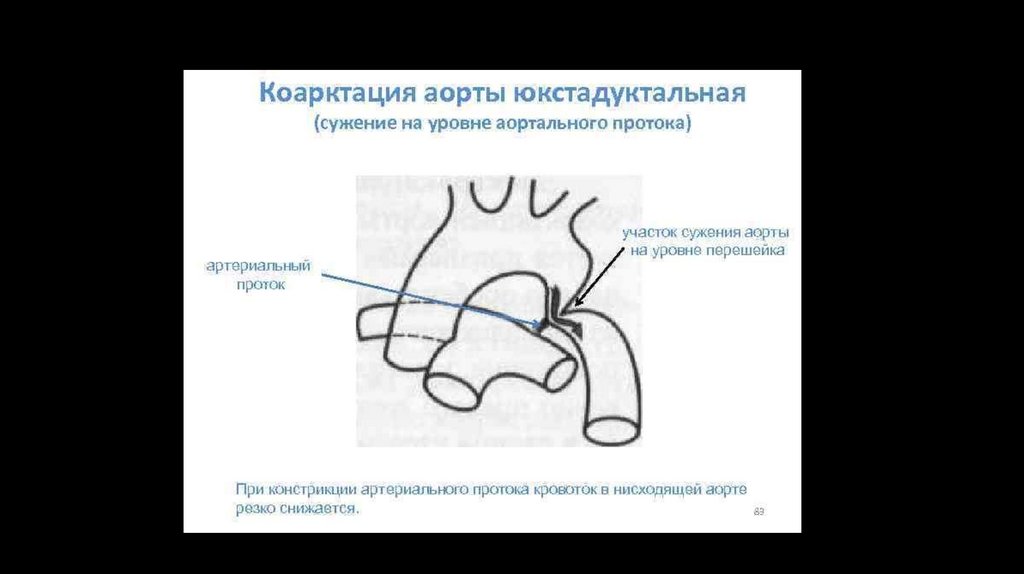
Выделяют следующие анатомические варианты порока:
- Предуктальный стеноз (сужение аорты проксимальнее впадения ОАП);
- Юкстадуктальный стеноз ( сужение аорты в области впадения ОАП);
- Постдуктальный стеноз (сужение аорты дисталтнее впадения ОАП):
По критерию множественности аномалий сердца и сосудов классифицирует 3 типа коарктации
аорты:
•1 тип - изолированная коарктация аорты (73%);
•2 тип – сочетание коарктации аорты с ОАП; с артериальным или венозным сбросом крови (5%);
•3 тип – сочетание коарктации аорты с другими гемодинамически значимыми аномалиями сосудов и ВПС
(12%).
25.
26.
27.
Симптомы коарктации аортыКлиническая картина коарктации аорты представлена множеством симптомов; проявления и их выраженность
зависят от периода течения порока и сопутствующих аномалий, влияющих на внутрисердечную и системную
гемодинамику.
У детей раннего возраста с коарктацией аорты могут отмечаться задержка роста и увеличения массы верхней
части тела. Преобладают симптомы левожелудочковой недостаточности: ортопноэ, одышка, сердечная астма,
отек легких.
В более старшем возрасте, в связи с развитием легочной гипертензии, характерны жалобы на головокружение,
головную боль, сердцебиение, шум в ушах, снижение остроты зрения.
При коарктации аорты нередки носовые кровотечения, обмороки, кровохарканье, чувство онемения и зябкости,
перемежающаяся хромота, судороги в нижних конечностях, абдоминальные боли, обусловленные ишемией
кишечника.
Средняя продолжительность жизни пациентов с коарктацией аорты составляет 30-35 лет, около 40% больных
умирают в критическом периоде (возрасте до 1 года). Наиболее частыми причинами летального исхода в
периоде декомпенсации служат сердечная недостаточность, септический эндокардит, разрывы аневризм аорты,
геморрагический инсульт.
28.
Диагностика коарктации аортыПри осмотре обращает внимание наличие:
атлетического типа телосложения (преимущественное развитие плечевого пояса при худых
нижних конечностях);
усиление пульсации сонных и межреберных артерий, ослабление или отсутствие
пульсации на бедренных артериях;
повышенное АД на верхних конечностях при снижении АД на нижних конечностях;
систолический шум над верхушкой и основанием сердца, на сонных артериях и т. д.;
29.
В диагностике коарктации аорты решающую роль играютинструментальные исследования:
ЭКГ, ЭхоКГ, аортография, рентгенография грудной клетки и рентгенография сердца с контрастированием
пищевода, зондирование полостей сердца, вентрикулография и др.
Электрокардиографические данные свидетельствуют за перегрузку и гипертрофию левых и/или правых отделов
сердца, ишемические изменения миокарда.
Рентгенологическая картина характеризуется кардиомегалией, выбуханием дуги легочной артерии, изменением
конфигурации тени дуги аорты, узурацией ребер.
Эхокардиография позволяет непосредственно визуализировать коарктацию аорты и определить степень стеноза.
При катетеризации полостей сердца определяется престенотическая гипертензия и постстенотическая гипотензия,
снижение парциального давления кислорода в постстенотическом отделе аорты.
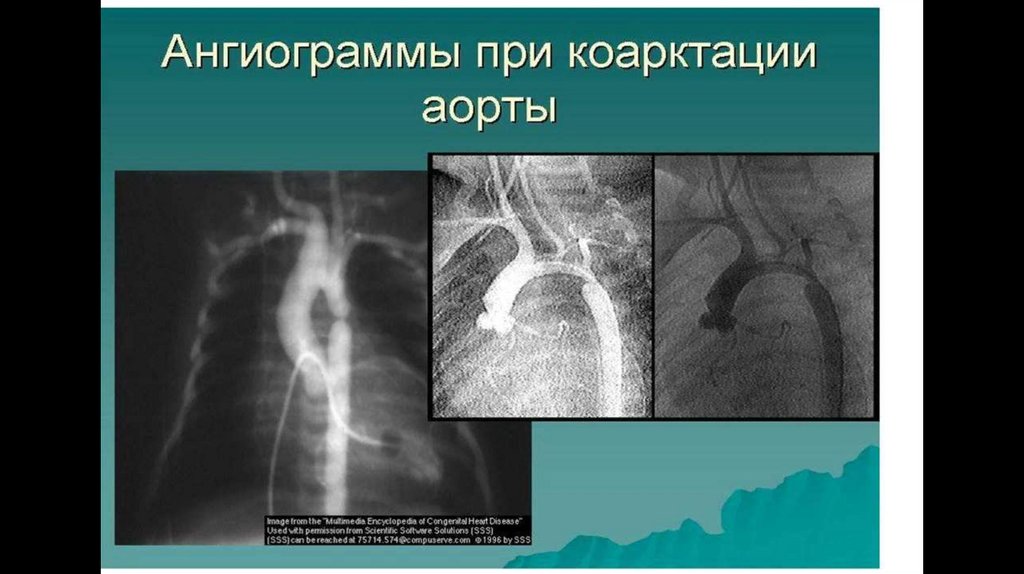
Аортографии и левой вентрикулографии обнаруживается стеноз, оценивается его степень и анатомический вариант.
30.
31.
32.
33.
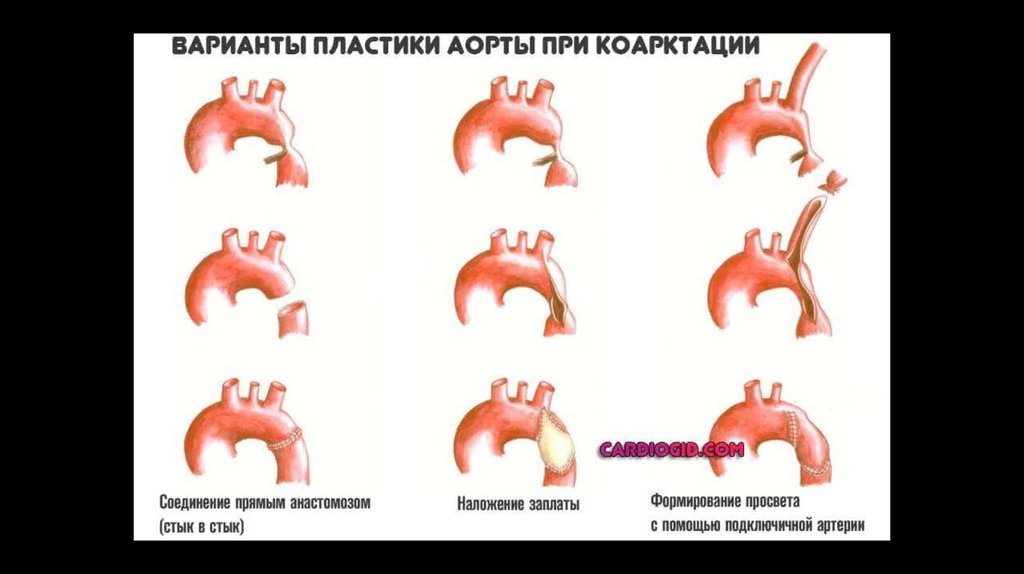
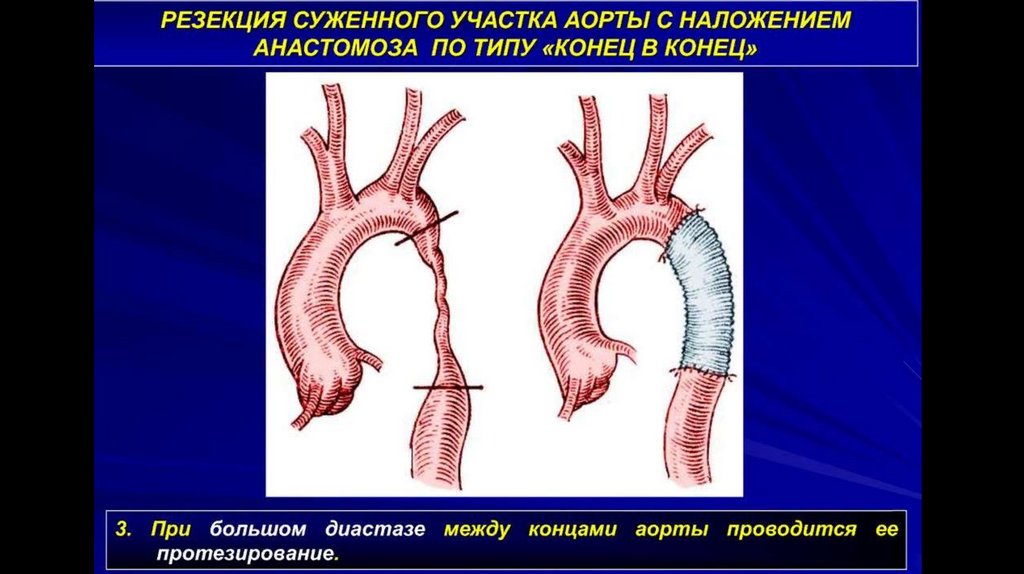
Для лечения коарктации аорты в настоящее времяпредложено следующие типы открытых операций:
I.
Местно-пластическая реконструкция аорты:
1. резекция стенозированного участка аорты с наложением анастомоза «конец в конец;
2. прямая истмопластика с продольным рассечением стеноза и сшиванием аорты в поперечном
направлении;
3. непрямая истмопластика (с использованием лоскута из левой подключичной артерии или синтетической
заплаты, с наложением сонно-подключичного анастомоза);
II. Резекция коарктации аорты с протезированием: с замещением дефекта артериальным гомотрансплантатом
или синтетическим протезом.
III. Создание обходных анастомозов: обходное шунтирование с использованием левой подключичной артерии,
селезеночной артерии или гофрированного сосудистого протеза.
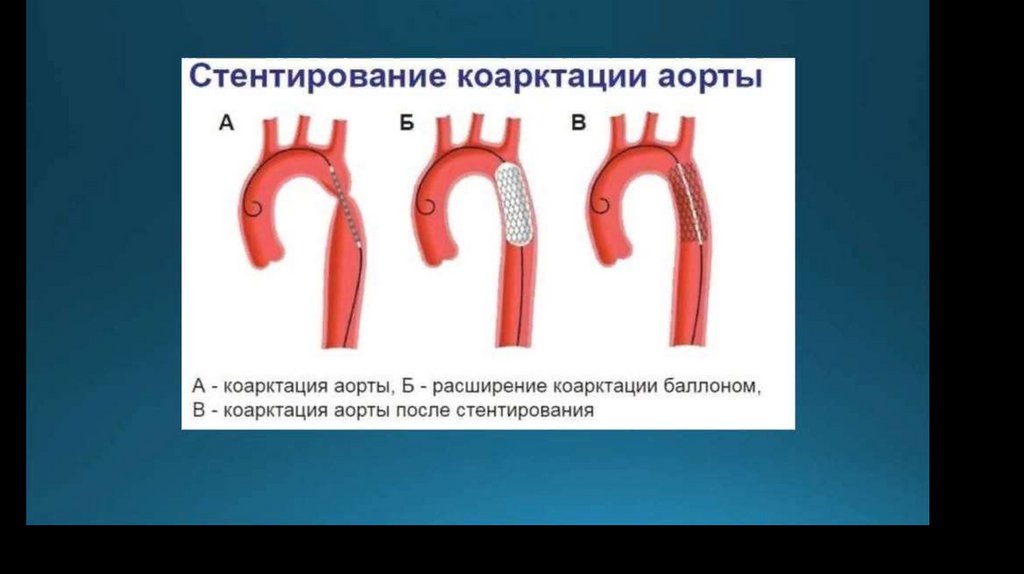
VI. Баллоная дилятация со стентированием КА
34.
35.
36.
37.
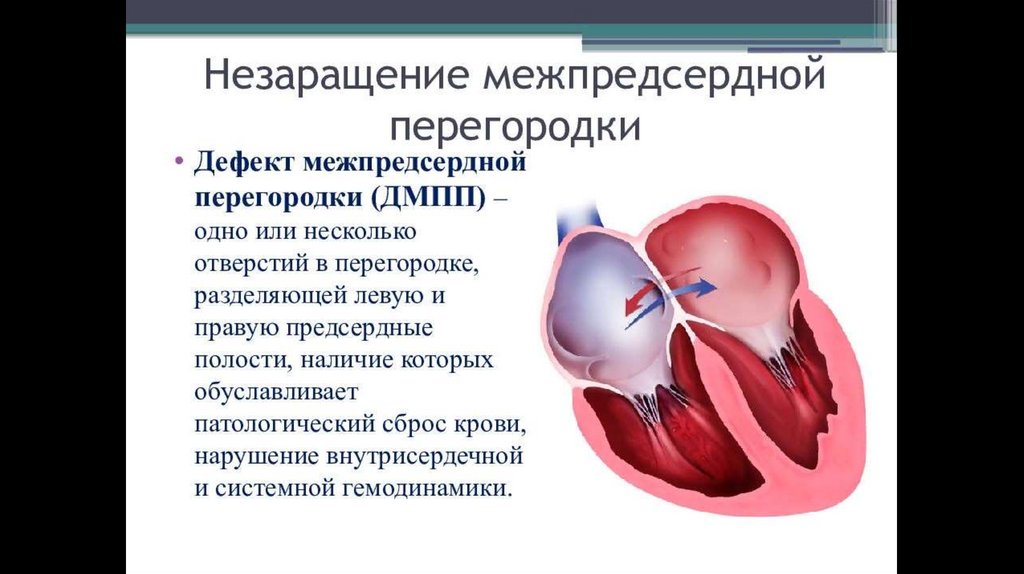
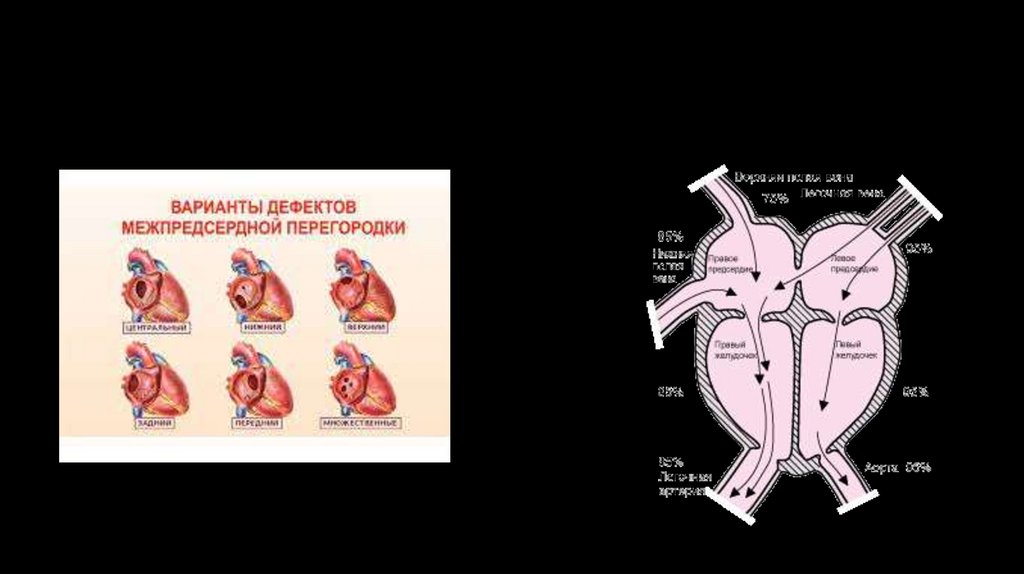
38. Дефект межпредсердной перегородки
• Дефект межпредсердной перегородки - один из самых частых врожденныхпороков сердца, который характеризуется наличием патологического сообщения
между предсердиями. Выражаясь простыми словами, это отверстие в
межпредсердной перегородке, которого в норме там быть не должно. Частота его
по клиническим данным составляет 6-21%
• При наличии отверстия кровь из левого предсердия во время сокращения частично
попадает в правое, что приводит к переполнению сосудов легких кровью.
• Новорожденные, грудные дети и дети раннего возраста в большинстве своем
растут и развиваются абсолютно нормально, но могут быть склонны к частым
простудам, быстро устают.
• Симптомы заболевания, как правило, проявляются в подростковом возрасте или
после 20 лет. Одышка, повышенная утомляемость, перебои сердечного ритма,
которые постепенно становятся все чаще и приводят к неспособности выполнять
обычные физические нагрузки. У части пациентов симптомы отсутствуют.
39.
Распространенность и тип наследованияЧастота встречаемости дефектов межпредсердной перегородки составляет
30–40 % от всех врождённых пороков сердца. Предполагаемая
распространённость заболевания среди населения составляет 1 на 25 000
человек, но нередко оно остается не диагностированным. У женщин ДМПП
встречается чаще, чем у мужчин .
40.
41.
Этиология и патогенез заболевания (ДМПП),Формирование дефекта связано с недоразвитием первичной и вторичной межпредсердной
перегородки и эндокардиальных подушечек в эмбриональном периоде. К нарушению
органогенеза приводят генетические, физические, экологические и инфекционные факторы.
ДМПП характеризуется патологическим кровотоком из ЛП в ПП. Факторами,
определяющими сброс крови слева направо, является большая «растяжимость» ПЖ,
анатомическое расположение предсердий и, хоть незначительно, но более высокое
давление в ЛП. Объем патологического сброса зависит от «растяжимости» ПЖ и размера
дефекта. Дилатация ПЖ, вследствие его объемной перегрузки, может сопровождаться
развитием недостаточности ТК. Постоянный лево-правый сброс крови приводит к
гиперволемии малого круга кровообращения и легочной гипертензией.
42. Гемодинамика ДМПП
• Нарушение гемодинамики при ДМПП связано с тем, что давление в правом предсердиинесколько ниже (3-5 мм.рт.ст.), чем в левом предсердии (10 мм.рт.ст.). В результате этого
через ДМПП происходит сброс крови слева направо, артериальная кровь смешивается с
венозной.
• Склеротические изменения в легочных сосудах и развивающуюся легочную гипертензию,
как ответ на объёмную перегрузку дополняют дополнительную перегрузку ПЖ, в результате
чего возрастает гипертрофия миокарда, повышается конечно-диастолическое давление в
правом предсердии, сброс крови на уровне предсердий уменьшается и становится
обрастным (синдром Эйзенменгера)
43.
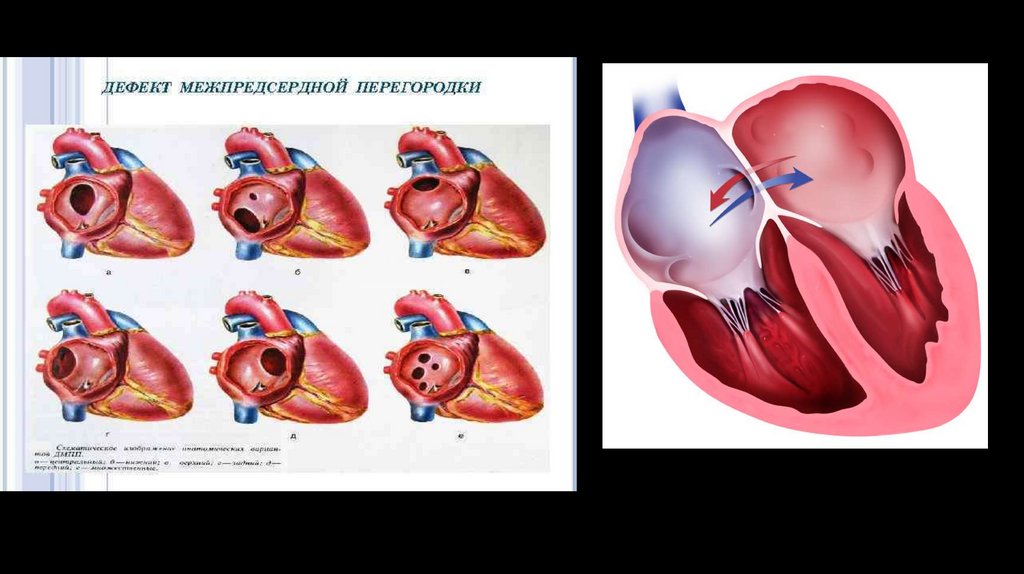
Классификация ДМПП :• первичный дефект межпредсердной перегородки (15% всех ДМПП);
• вторичный дефект межпредсердной перегородки (80% всех ДМПП);
• общее предсердие;
• дефект венозного синуса:
- верхний;
- нижний.
44.
45.
46.
47. Клиническая картина ДМПП
• ДМПП может проявляться быстрой утомляемостью, одышкой, потливостью,частыми простудными заболеваниями, особенно в раннем детском
возрасте. При прослушивании сердца могут быть замечены добавочные
шумы. Клинические проявления порока, выраженные жалобы обычно
наблюдаются во втором десятилетии жизни, когда появляются расширения
полостей сердца, нарушения ритма сердца, значительно повышается
давление в легочной артерии.
• Аускультативная картина ДМПП бедна. Проявляется она систолическим
шумом небольшой интенсивности с эпицентром 2-3 м.р. Слева от грудины, 2
тон над легочной артерией усилен Природа этого шума связано с
функциональным стенозом легочной артерии, возникающим из-за
увличения полости правого желудочка при неизменном диаметре кольца
легочной артерии
48. Дефект межпредсердной перегородки
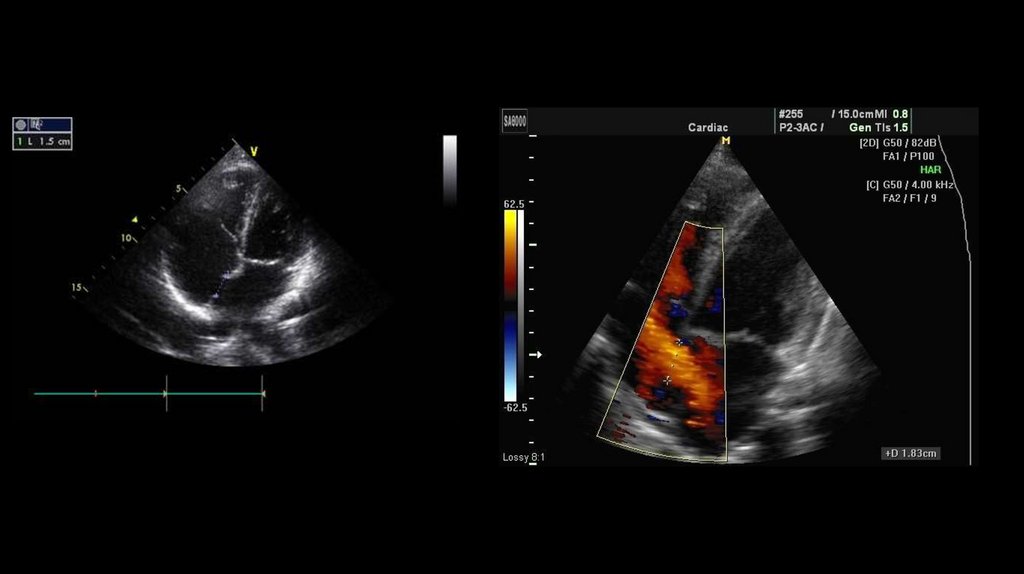
ДиагностикаДиагностировать у ребенка ДМПП можно несколькими методами.
• Эхокардиография (ЭхоКГ) дает исчерпывающие данные о состоянии сердца. Она
позволяет визуализировать дефект и вторичное изменение геометрии сердца,
визуализировать сброс с помощью цветной допплерографии, подсчитать
отношение легочного кровотока к системному, оценить систолическое давление в
правом желудочке, диагностировать сопутствующие пороки сердца.
• Рентгенография органов грудной полости: усиление легочного рисунка, расширение
правого желудочка и легочного ствола.
• ЭКГ – отклонение ЭОС вправо, гипертрофия правого предсердия и правого
желудочка. Неполная блокада правой ножки пучка Гиса.
49.
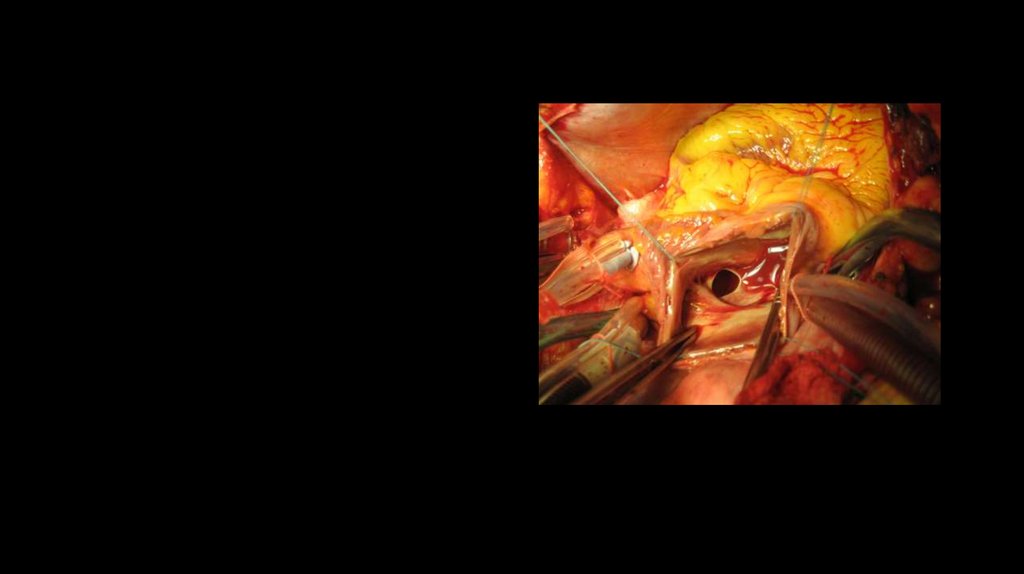
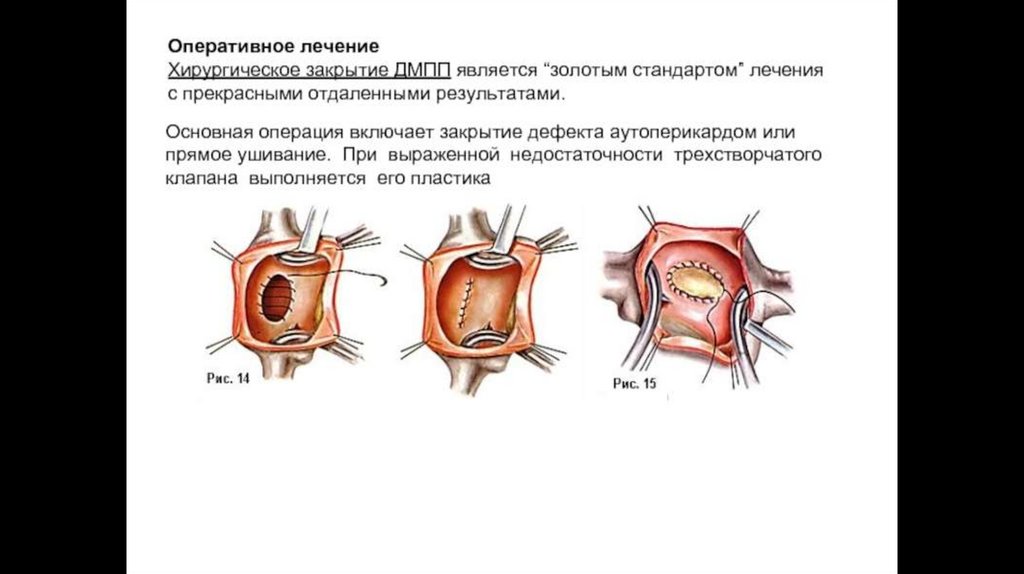
50. Хирургическое лечение ДМПП
Коррекция порока заключается в закрытии дефекта, что может быть выполнено различнымипутями:
) Классический метод - открытая операция с выполнением срединной стернотомии, подключением аппарата искусственного
кровообращения. В то время, как сердце на время выключается из кровообращения, выполняется ушивание дефекта или его
закрытие заплатой (чаще всего из бычьего перикарда).
1
• 2) Миниинвазивная операция - применяется в качестве альтернативы классическому методу. Отличием является применение
щадящего хирургического доступа на правой половине грудной клетки (разрез 4-6 см) и более быстрая активизация и выписка
пациента из стационара. При приведенной к телу правой руке рубец в послеоперационном периоде практически незаметен.
• 3) Роботассистированное торакоскопическое вмешательство - операция производится через несколько проколов в правой
половине грудной клетки с использованием хирургического комплекса Da Vinci. При этом также необходимо искусственное
кровообращение и временная остановка сердца. Эта методика также позволяет максимально быстро восстановиться после
операции.
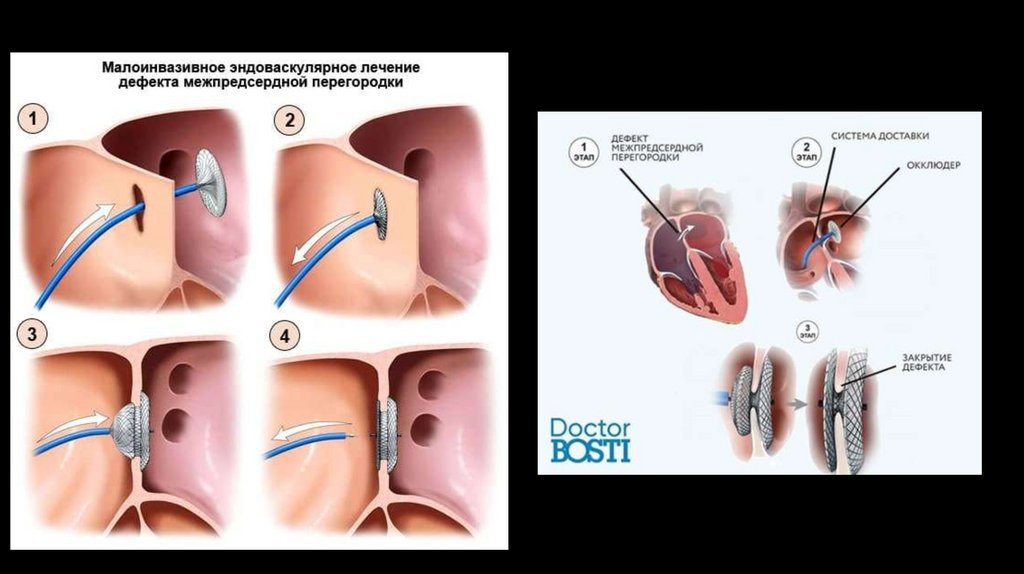
• 4) Эндоваскулярное вмешательство - через прокол в бедренной вене через систему специальных катетеров производится доставка
и установка в дефект специального устройства - окклюдера. Это выполняется под рентгенологическим контролем.
• Выбор метода коррекции зависит от анатомии порока у каждого конкретного пациента, его роста, веса, а также необходимости
дополнительных вмешательств на вне- и внутрисердечных структурах.
51.
52.
53.
54.
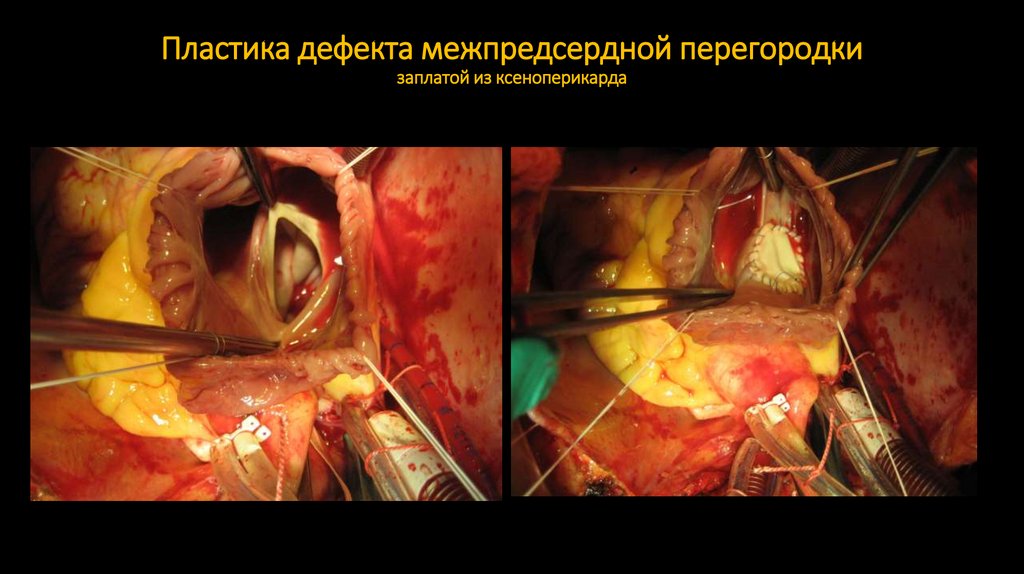
55. Пластика дефекта межпредсердной перегородки заплатой из ксеноперикарда
56.
дефектмежжелудочковой
перегородки
(ДМЖП) – врожденный порок сердца, при котором наблюдается нарушение
целостности перегородки между правым и левым желудочками. В результате кровь
из одного желудочка попадает в другой и нарушает нормальную работу сердца и
кровообращения в организме. Иногда перегородка отсутствует вовсе. ДМЖП
образуется в результате нарушения эмбрионального развития в утробе матери. Часто
заболевание сопровождается другими сердечными пороками. ДМЖП у взрослых
может появиться при разрыве межжелудочковой перегородки при остром инфаркте
миокарда.
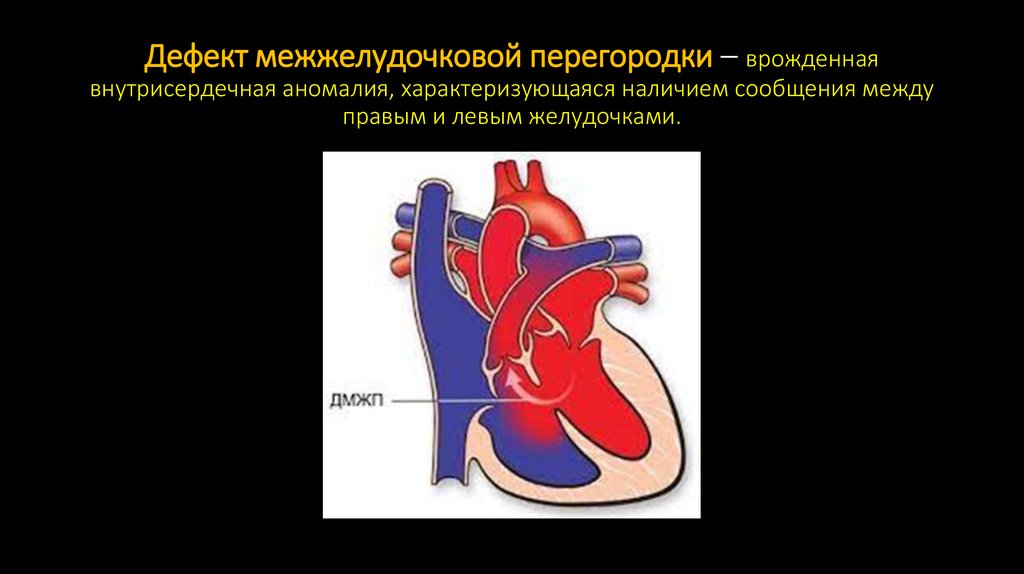
57. Дефект межжелудочковой перегородки – врожденная внутрисердечная аномалия, характеризующаяся наличием сообщения между правым и
левым желудочками.58.
59.
60.
Этиология ДМЖПЧаще всего дефект межжелудочковой перегородки является следствием нарушения эмбрионального развития и
формируется у плода при нарушениях закладки органов. Поэтому дефекту межжелудочковой перегородки часто
сопутствуют другие сердечные пороки: открытый артериальный проток (20%), дефект межпредсердной перегородки
(20%), коарктация аорты (12%), стеноз устья аорты (5%), аортальная недостаточность (2,5—4,5%), недостаточность
митрального клапана.
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод
в I триместре: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная
интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза
самопроизвольного прерывания беременности и пр.).
61.
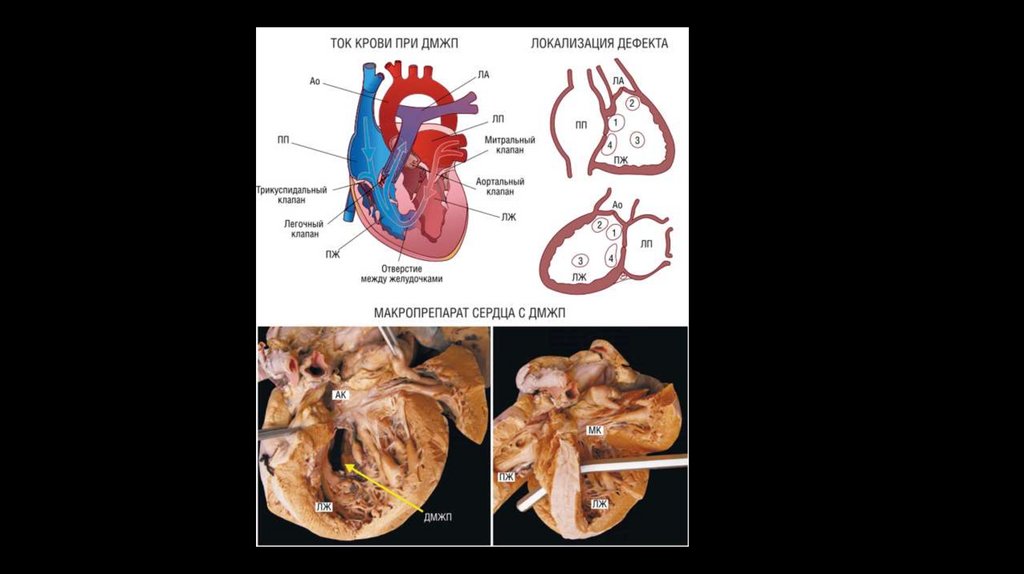
Особенности гемодинамики ДМЖПМежжелудочковая перегородка представлена мембранозным и мышечным компонентами. В свою очередь,
мышечный отдел состоит из 3-х частей - приточной, трабекулярной и отточной (инфундибулярной).
У плода она полностью формируется к 4-5-ой неделе эмбрионального развития. Если этого по каким-либо причинам
не происходит, в межжелудочковой перегородке остается дефект. Нарушения гемодинамики при дефекте
межжелудочковой перегородки обусловлены сообщением левого желудочка с высоким давлением и правого
желудочка с низким давлением (в норме в период систолы давление в левом желудочке в 4 - 5 раз выше, чем в
правом).
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта
межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия.
При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается
нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг
кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка
желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой
перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления
взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что
приводит к артериальной гипоксемии (синдром Эйзенменгера).
62.
КлассификацияРазмер дефекта межжелудочковой перегородки оценивается исходя из его абсолютной величины и
сопоставления с диаметром аортального отверстия:
1. маленький дефект составляет 1-3 мм (болезнь Толочинова–Роже),
2. средний – равен примерно 1/2 диаметра аортального отверстия,
3. большой – равен или превышает его диаметр.
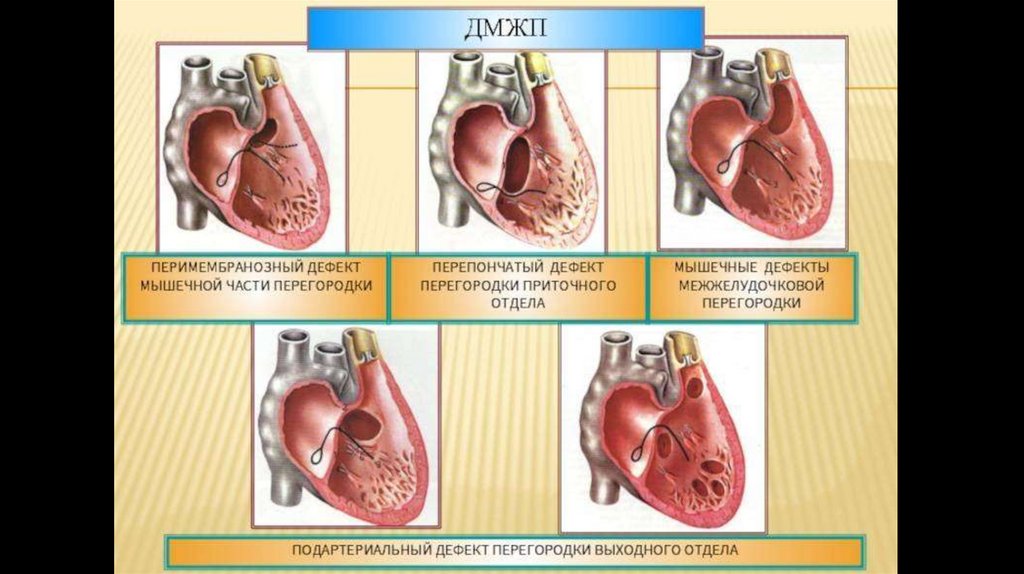
С учетом анатомического расположения дефекта выделяют:
перимембранозные дефекты межжелудочковой перегородки - 75% (приточные, трабекулярные,
инфундибулярные) расположены в верхней части перегородки под аортальным клапаном, могут закрываться
самопроизвольно;
мышечные дефекты межжелудочковой перегородки – 10% (приточные, трабекулярные) - расположены в
мышечном отделе перегородки, на значительном удалении от клапанной и проводящей систем;
надгребневые дефекты межжелудочковой перегородки - 5% - расположены выше наджелудочкового гребня
(мышечного пучка, отделяющего полость правого желудочка от его выносящего тракта), самопроизвольно не
закрываются.
63.
Симптомы дефекта межжелудочковой перегородкиотсутствие аппетита, вялое сосание с частыми перерывами;
медленный набор веса;
быстрая утомляемость (дети много спят);
появление одышки;
отечность на ногах и в области живота;
тахикардия.
ухудшение работоспособности;
утомляемость.
При небольших дефектах внешние симптомы могут не проявляться и обнаруживаются только при выслушивании
сердца.
Патология может не давать знать о себе до взрослого возраста. Симптоматика у зрелого человека практически
такая же, как и у ребенка. Дополнительно могут быть жалобы на:
64.
Симптомы ДМЖПКлинические проявления больших и малых изолированных дефектов межжелудочковой перегородки различны. Малые дефекты
межжелудочковой перегородки (болезнь Толочинова—Роже) имеют диаметр менее 1 см и встречаются в 25-40% от числа всех ДМЖП
Проявляются нерезко выраженной утомляемостью и одышкой при нагрузке. Физическое развитие детей, как правило, не нарушено.
Иногда у них определяется слабо выраженное куполообразное выпячивание грудной клетки в области сердца - «сердечный горб».
Характерным клиническим признаком малых дефектов межжелудочковой перегородки служит аускультативно выявляемое наличие
грубого систолического шума над областью сердца, который фиксируется уже на первой неделе жизни.
Большие дефекты межжелудочковой перегородки, имеющие размеры более 1/2 диаметра устья аорты или более 1 см, проявляются
симптоматически уже в первые 3 месяца жизни новорожденных, приводя в 25-30% случаев к развитию критического состояния. При
больших дефектах межжелудочковой перегородки отмечается гипотрофия, одышка при физической нагрузке или в покое,
повышенная утомляемость. Характерны затруднения при кормлении: прерывистое сосание, частые отрывы от груди, одышка и
бледность, потливость, пероральный цианоз. В анамнезе у большинства детей с дефектом межжелудочковой перегородки - частые
респираторные инфекции, затяжные и рецидивирующие бронхиты и пневмонии.
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в
области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и
акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии
указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ
сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких
выслушиваются застойные хрипы.
65. Диагностика
• УЗИ сердца дупплексным исследованием (исследованиемкровотока);
• рентгенография грудной клетки;
• пульсоксиметрия – измерение концентрации кислорода в крови;
• МРТ сердца.
• ЭКГ;
• ЭХОКГ;
• катетеризация сердца – введение катетера с
рентгеноконтрастным веществом.
66.
67.
68. Лечение дефекта межжелудочковой перегородки
• Первый метод эндоваскулярная коррекция ДМЖП, считается наиболее безопасной ималотравматичной. Через катетер к сердечной мышце проводят специальное
приспособление (окклюдер), которое перекрывает место нарушения заплаткой, со
временем дефект зарастает. После проведения коррекции пациента переводят в отделение
интенсивной терапии на 24 часа для наблюдения, на следующий день отпускают домой.
Постоперационной реабилитации не требуется - быстрое восстановление и возвращение к
обычной жизни.
• Второй метод – пластика дефекта. Операция проводится на открытом сердце с помощью
вскрытия грудной клетки. Перед началом процедуры пациента подключают к аппарату
искусственного кровообращения. Сердце разрезают и ушивают дефект с помощью заплаты
из искусственной или собственного перикарда, который фиксируют швами по краям
дефекта. Метод более травматичный и требует более длительной реабилитации около
месяца.
• Операция Мюллера ( сужение ствола ЛА).
69.
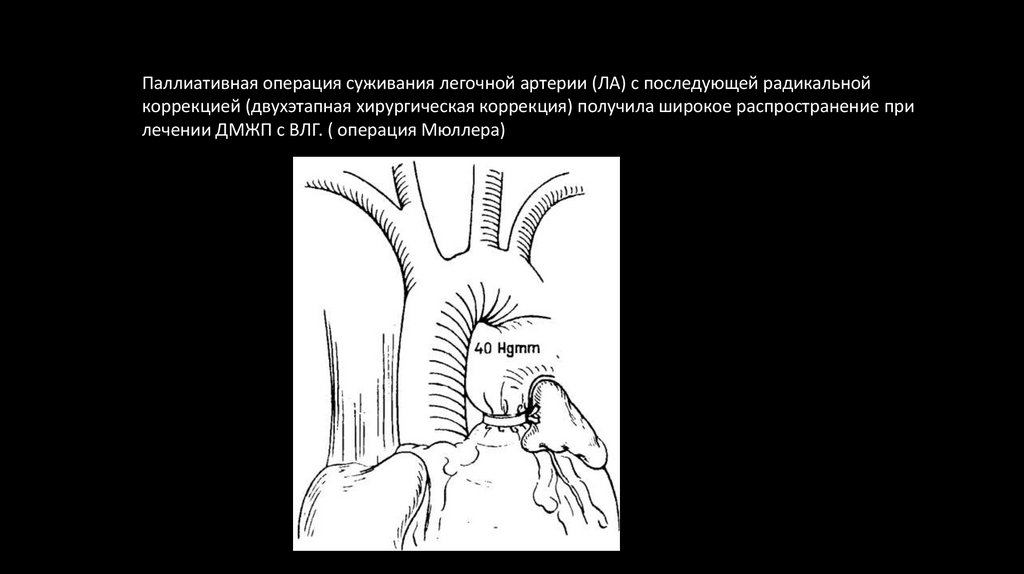
Паллиативная операция суживания легочной артерии (ЛА) с последующей радикальнойкоррекцией (двухэтапная хирургическая коррекция) получила широкое распространение при
лечении ДМЖП с ВЛГ. ( операция Мюллера)
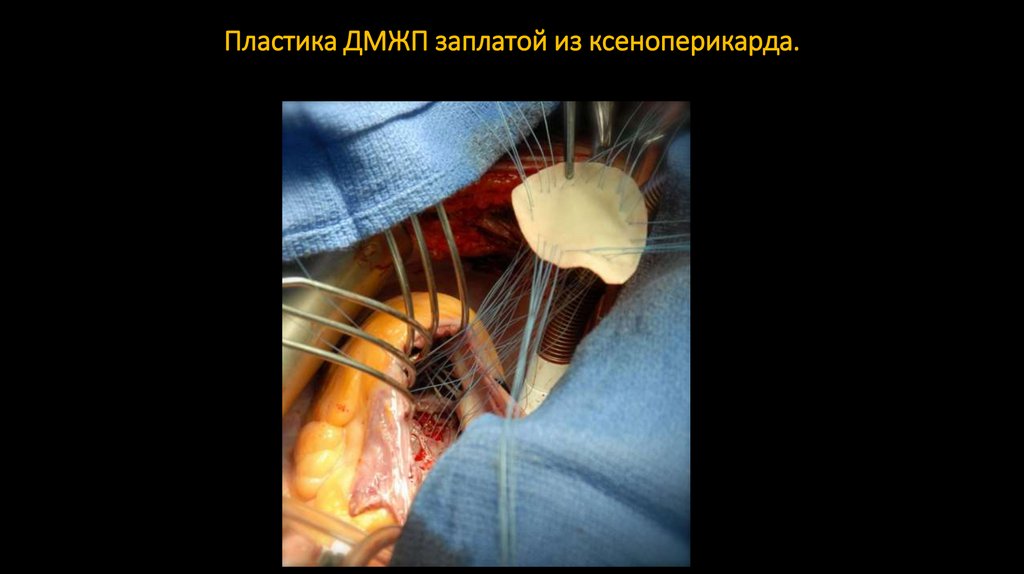
70. Пластика ДМЖП заплатой из ксеноперикарда.
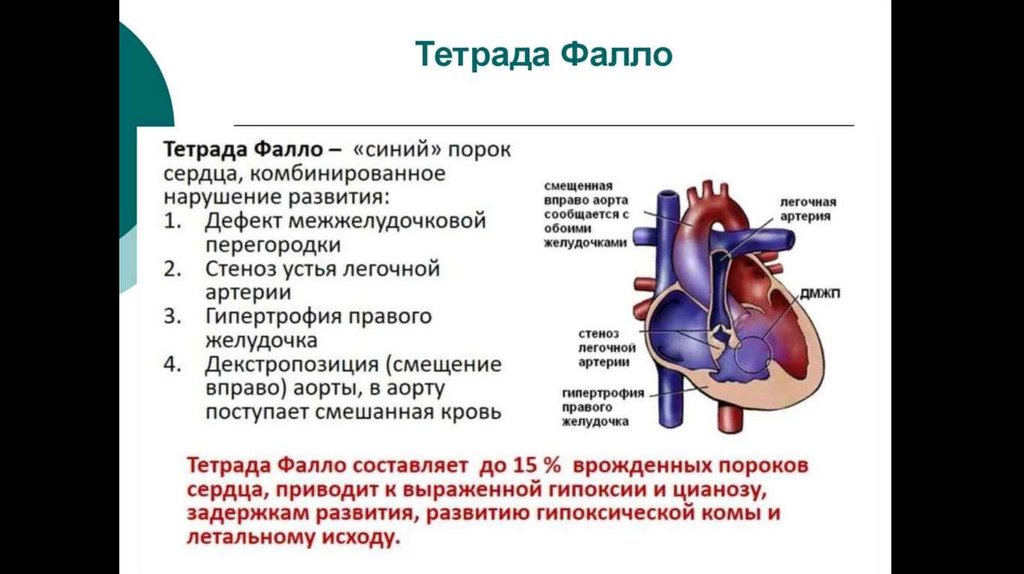
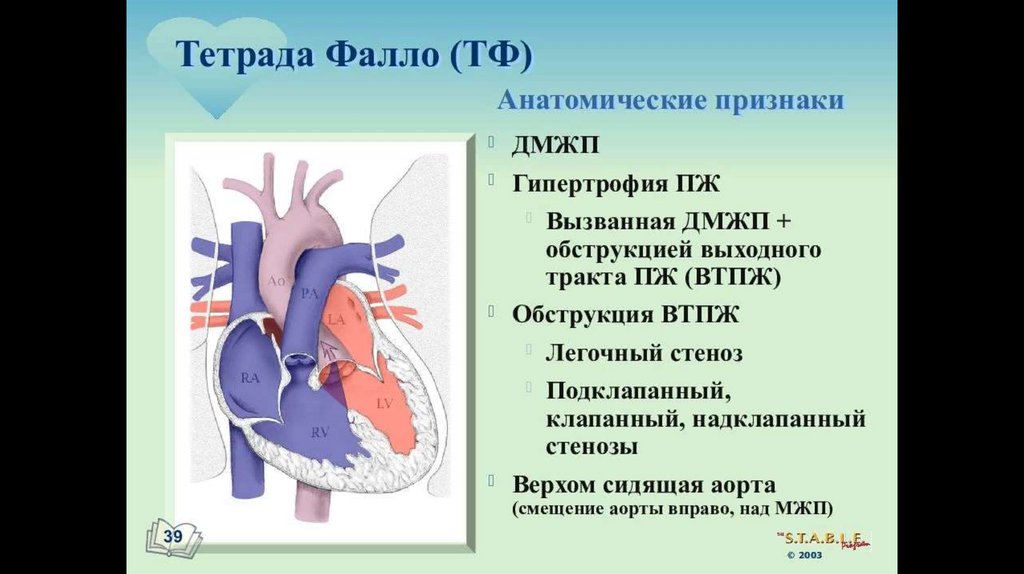
71. Тетрада Фалло
72.
1846Английский врач Томас Пикок (англ. Thomas Bevill Peacock) при аутопсии пациента писал:
В этом случае выраженное сужение устья лёгочной артерии, в сочетании с дефектом межпредсердной
перегородки, и аортой, которая частично отходит от правого желудочка…
Сердце было взято у ребёнка в возрасте 2 лет 5 месяцев, с выраженными симптомами цианоза, который
появился через 3 месяца после рождения.
1888
Французский врач Этьен-Луи Фалло (фр. Étienne-Louis Arthur Fallot) впервые детально описал
«синюшную болезнь». Он показал, что она может быть диагностирована лишь после смерти больного,
при сочетании четырех анатомических компонентов порока.
1944 Американский хирург Альфред Блейлок (англ. Alfred Blalock) в тесном сотрудничестве с
американским кардиологом Хелен Брук Тауссиг (англ. Helen Brooke Taussig) провёл первую в мире
успешную паллиативную кардиохирургическую операцию 15-месячной девочке с тетрадой Фалло,
присоединив левую подключичную артерию к левой лёгочной артерии при помощи анастомоза
«конец в конец» (end-to-end), тем самым заставив кровь от левого желудочка поступать в малый круг
кровообращения. Операцию позже назвали анастомозом Блейлока — Тауссиг.
1962
Немецкий врач Вернер Клиннер (нем. Werner Klinner) предложил протезный кондуит между
правой подключичной артерией и правой лёгочной артерией. Операцию позже назвали
модифицированный анастомоз Блейлока — Тауссиг.
73.
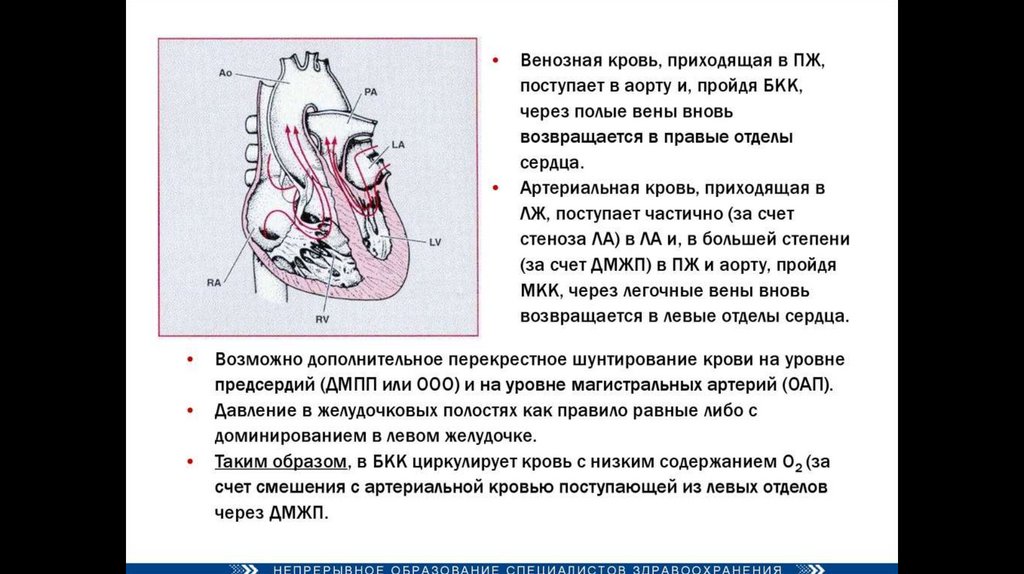
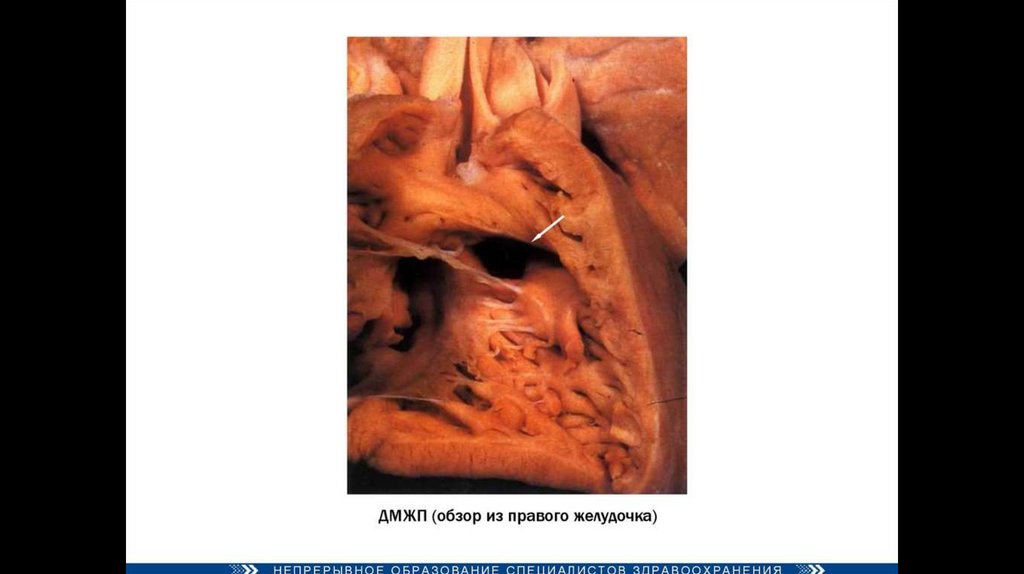
Четыре анатомических компонента:Вентрикулосептальный дефект — дефект межжелудочковой перегородки (ДМЖП) — соединяет между собой
правые и левые отделы сердца. ДМЖП при тетраде Фалло всегда большой и нерестриктивный. Как правило,
это перимембранозный ДМЖП (англ. perimembranous VSD), мышечный ДМЖП (англ. muscular VSD), или
юкстаартериальный (околоартериальный; лат. juxta — около, подле, рядом) ДМЖП (англ. juxtaarterial VSD).
Обструкция исходящего отдела правого желудочка — происходит за счёт одной из перечисленных или
комбинации анатомических компонентов. К ним относятся инфундибулярный (подклапанный) стеноз
исходящего отдела правого желудочка, клапанный стеноз лёгочной артерии, обструкция за счёт
гипертрофированного миокарда правого желудочка, гипоплазия ствола и/или ветвей лёгочной артерии.
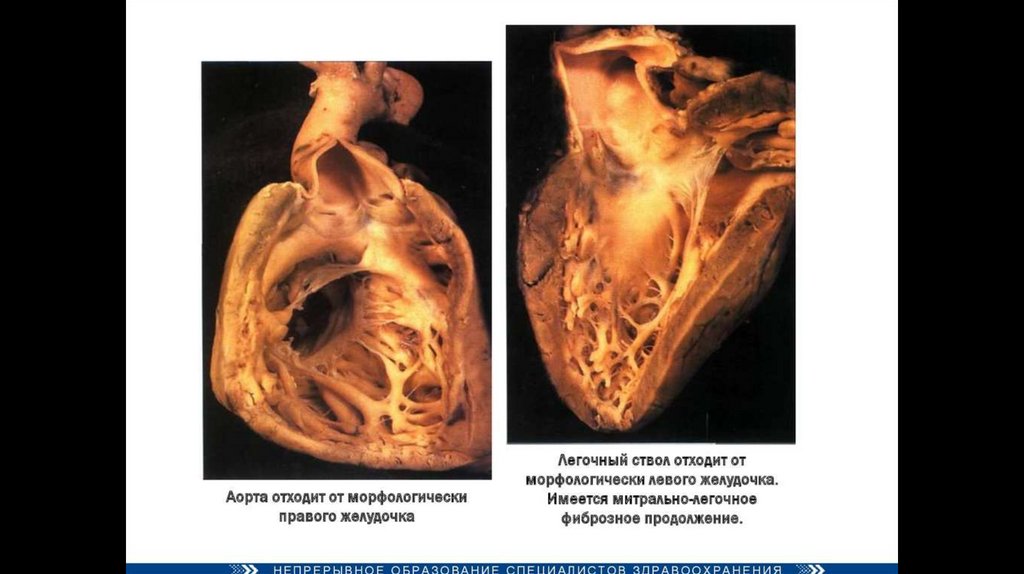
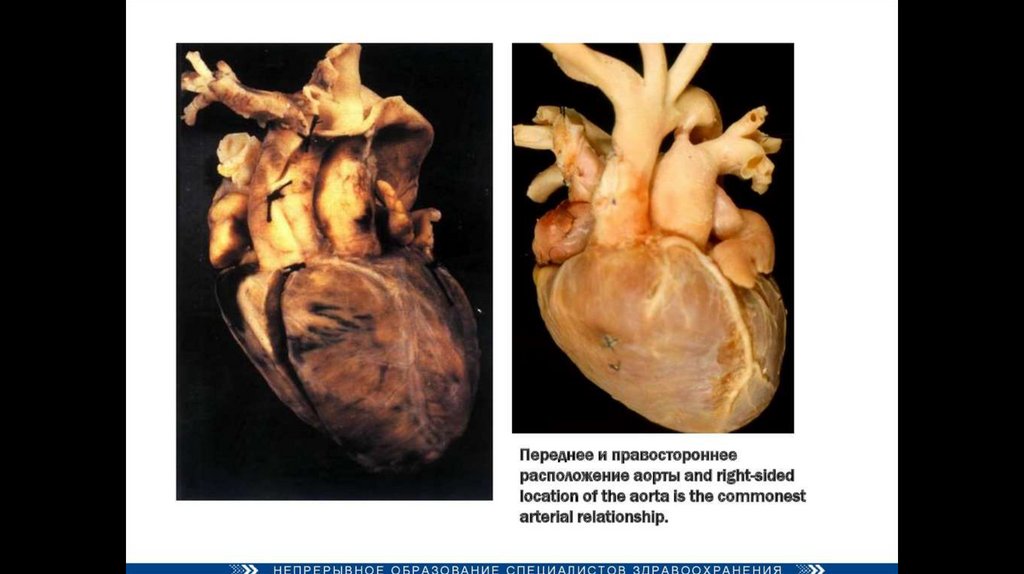
Декстропозиция аорты — аорта отходит частично от правого желудочка или кровоток в ней поддерживается
доминантно за счёт работы левого желудочка.
Гипертрофия правого желудочка сердца — гипертрофия мышечного компонента правого желудочка
развивается с возрастом.
74.
75.
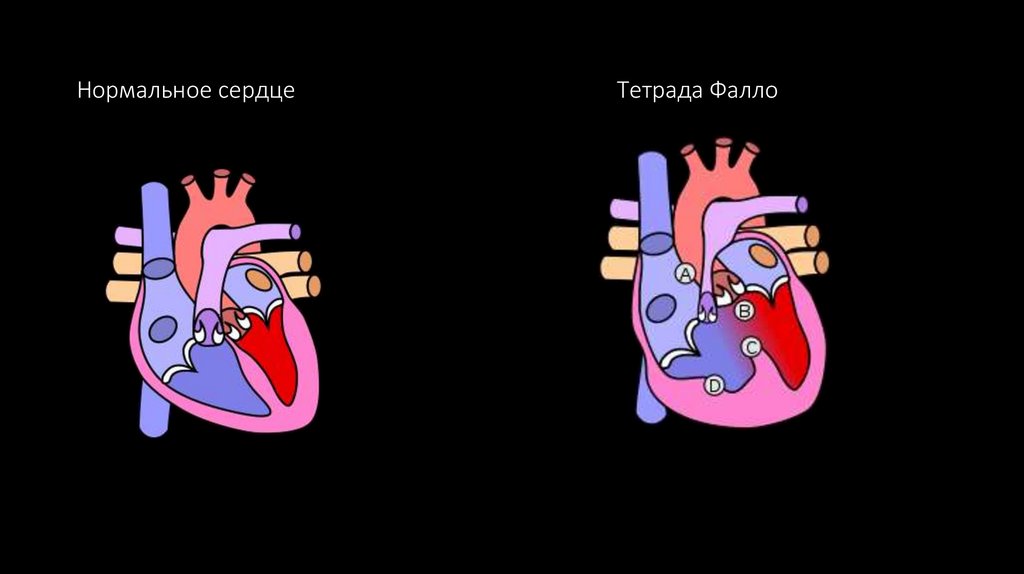
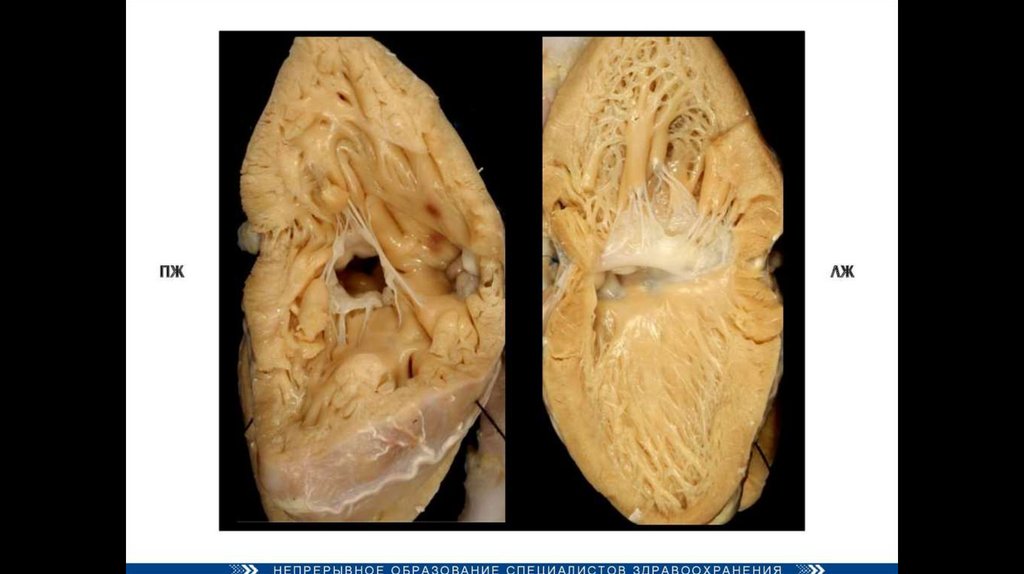
76. Нормальное сердце Тетрада Фалло
77.
Клиническая картинаЦианоз — основной симптом тетрады Фалло. Степень цианоза и время его появления зависят от выраженности стеноза лёгочной
артерии. У детей первых дней жизни по признаку цианоза диагностируются только тяжелые формы порока — «крайняя» форма
тетрады Фалло. В основном характерно постепенное развитие цианоза (к 3 мес. — 1 году), имеющего различные оттенки (от нежноголубоватого до сине-малинового или чугунно-синего): сначала возникает цианоз губ, затем слизистых оболочек, кончиков пальцев,
кожи лица, конечностей и туловища. Цианоз нарастает с ростом активности ребёнка. Рано развиваются «барабанные палочки» и
«часовые стекла».
Постоянным признаком является одышка по типу диспноэ (углублённое аритмичное дыхание без выраженного увеличения частоты
дыхания), отмечающаяся в покое и резко возрастающая при малейшей физической нагрузке. Постепенно развивается задержка
физического развития. Практически с рождения выслушивается грубый систолический шум вдоль левого края грудины. Грозным
клиническим симптомом при тетраде Фалло, обусловливающим тяжесть состояния больных, являются одышечно-цианотические
приступы. Возникают они, как правило, в возрасте от 6 до 24 месяцев на фоне абсолютной или релятивной анемии. Патогенез
возникновения приступа связан с резким спазмом инфундибулярного отдела правого желудочка, в результате чего вся венозная
кровь поступает в аорту, вызывая резчайшую гипоксию ЦНС. Насыщение крови кислородом во время приступа падает до 35%[7].
Интенсивность шума при этом резко уменьшается вплоть до полного исчезновения. Ребёнок становится беспокойным, выражение
лица испуганное, зрачки расширены, одышка и цианоз нарастают, конечности холодные; затем следуют потеря сознания, судороги,
возможны развитие гипоксической комы и летальный исход. Приступы различны по тяжести и продолжительности (от 10–15 с до 2–3
мин). В послеприступном периоде больные длительно остаются вялыми и адинамичными. Иногда отмечается развитие гемипарезов
и тяжёлых форм нарушения мозгового кровообращения. К 4–6 годам частота возникновения и интенсивность приступов значительно
уменьшаются или они исчезают. Связано это с развитием коллатералей.
78.
В зависимости от особенностей клиники выделяют трифазы течения порока
I фаза — относительного благополучия (от 0 до 6 месяцев), когда
состояние пациента относительно удовлетворительное, нет
отставания в физическом развитии;
II фаза — одышечно-цианотических приступов (6–24 мес), для
которой характерно большое число мозговых осложнений и
летальных исходов;
III фаза — переходная, когда клиническая картина порока начинает
принимать взрослые черты.
79.
ДиагностикаПри физикальном обследовании у больных с тетрадой Фалло грудная клетка чаще уплощена. Не характерны
формирование сердечного горба и кардиомегалия. Во II–III межреберьях слева от грудины может определяться
систолическое дрожание. Аускультативно I тон не изменён, II — значительно ослаблен над лёгочной артерией,
что связано с гиповолемией малого круга кровообращения. Во II–III межреберьях слева выслушивается грубый
скребущий систолический шум стеноза лёгочной артерии. При инфундибулярном или сочетанном стенозе шум
выслушивается в III–IV межреберьях, проводится на сосуды шеи и на спину в межлопаточное пространство. Шум
ДМЖП может быть очень умеренным или не прослушиваться вовсе из-за небольшого градиента давления
между желудочками или его отсутствия. На спине в межлопаточном пространстве выслушивается систолодиастолический шум средней интенсивности вследствие функционирования открытого артериального протока
и/или коллатералей[8].
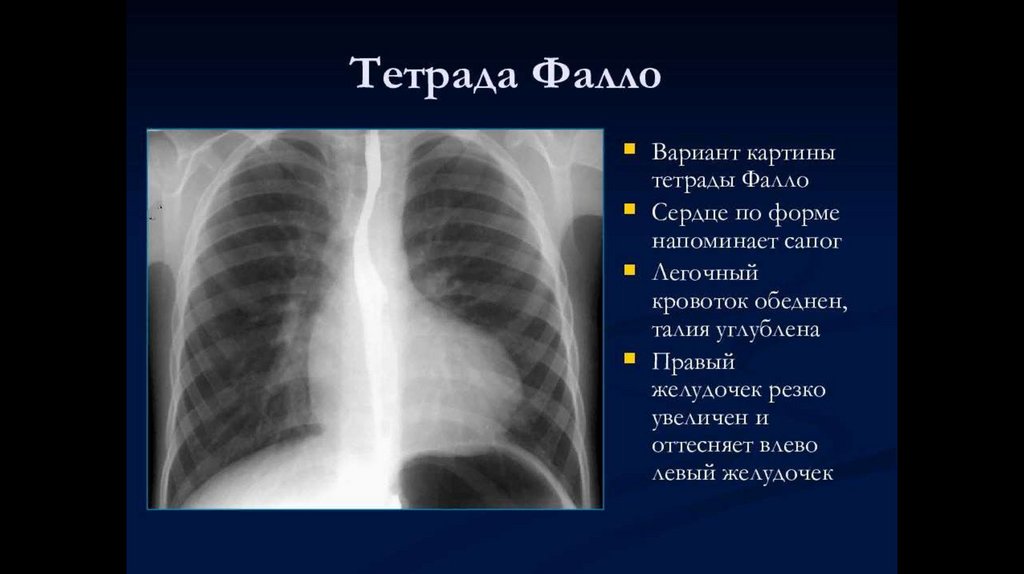
Рентгенологическое исследование органов грудной полости позволяет выявить характерную для этого порока
картину: лёгочный рисунок обеднён, форма сердечной тени, не увеличенной в размерах, носит название
«голландского башмачка», «сапожка», «валенка», «сабо», с выраженной талией сердца и приподнятой над
диафрагмой верхушкой.[8]
Наиболее типичным признаком на ЭКГ является существенное отклонение электрической оси сердца (ЭОС)
вправо (120–180°). Имеют место признаки гипертрофии правого желудочка, правого предсердия, нарушения
проводимости по типу неполной блокады правой ножки пучка Гиса
80.
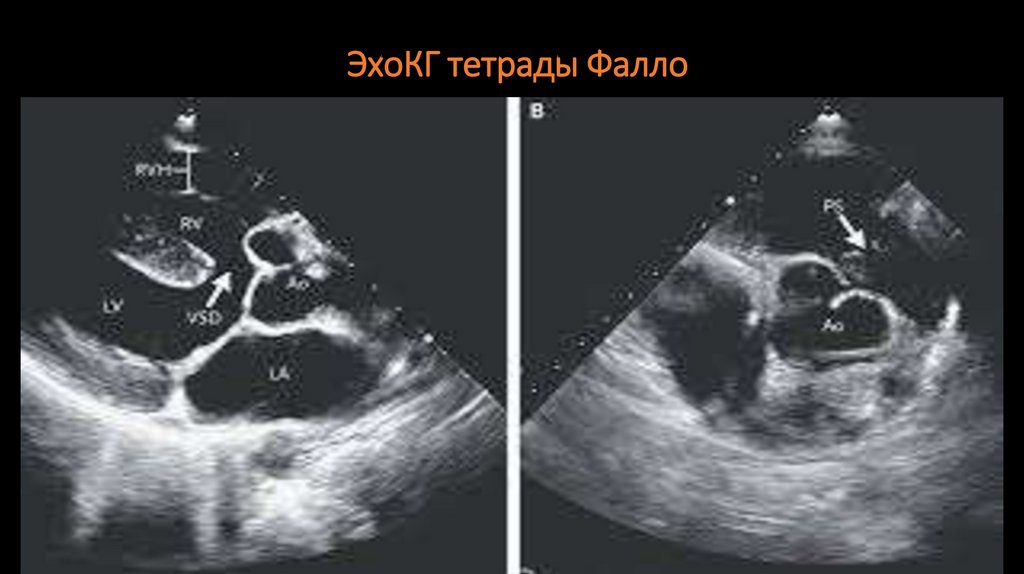
81. ЭхоКГ тетрады Фалло
82.
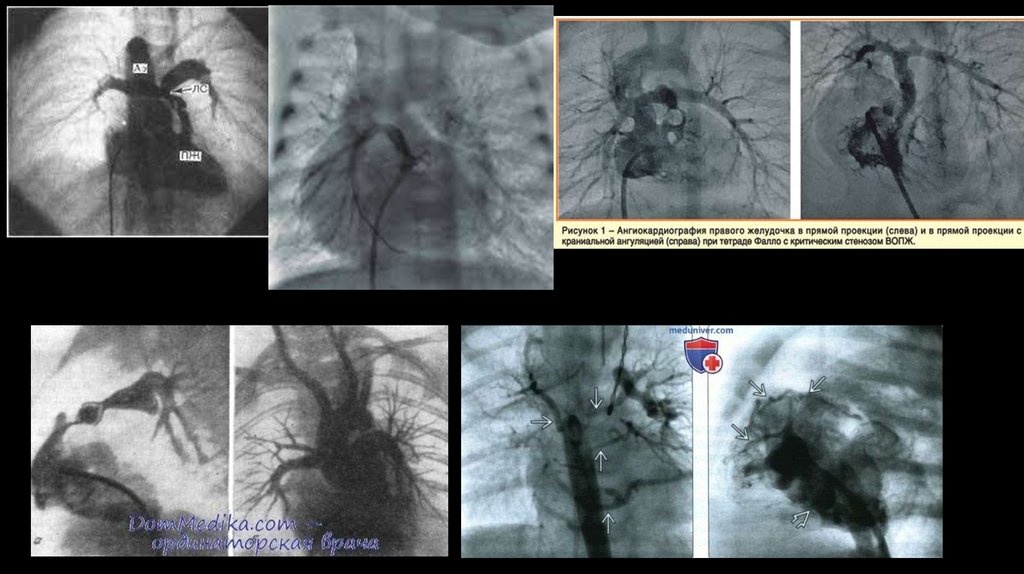
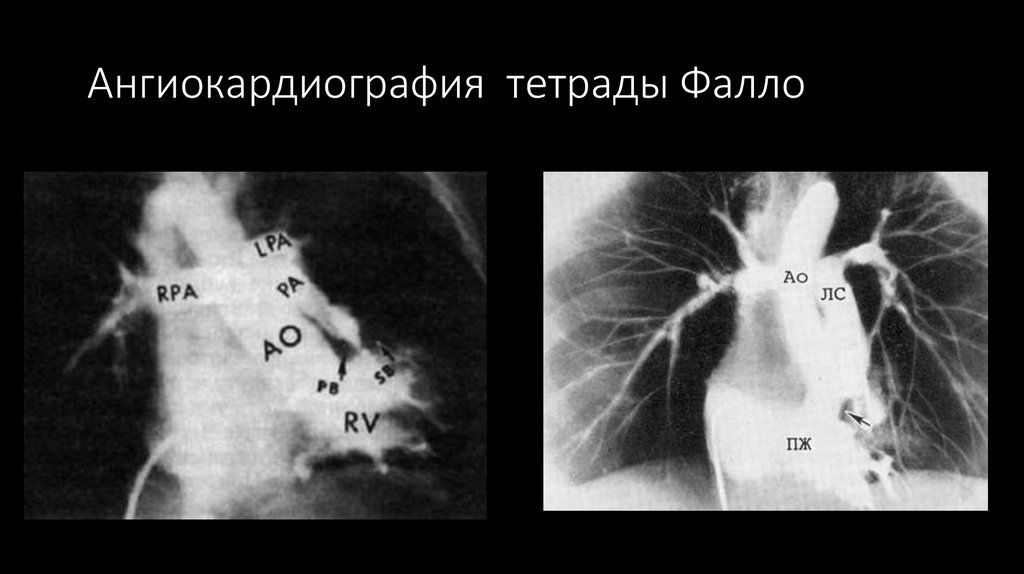
83. Ангиокардиография тетрады Фалло
84.
85.
Оперативное лечениеПоказания к операции носят абсолютный характер. Во многих странах большинство хирургов придерживаются
этапного хирургического метода лечения детей с тетрадой Фалло.
Первый этап
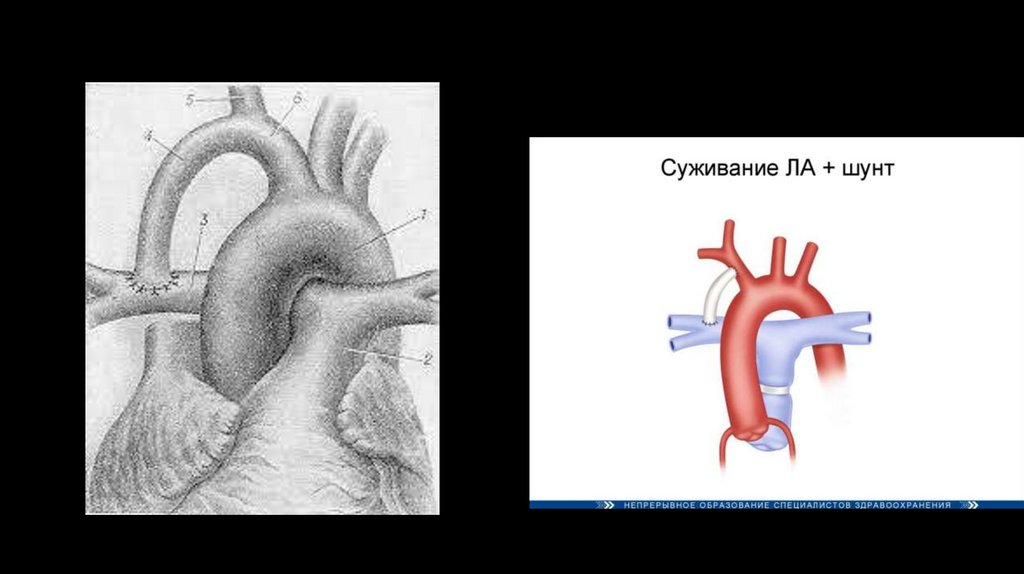
До трех лет выполняются паллиативные операции, существенно облегчающие жизнь больных. Цель выполнения
паллиативных операций — увеличить приток крови в малый круг кровообращения.
1. Внутрисердечные оперативные вмешательства:
лёгочная вальвулотомия — рассечение створок с помощью вальвулотома, введённого через лёгочный ствол через
бессосудистый участок правого желудочка;
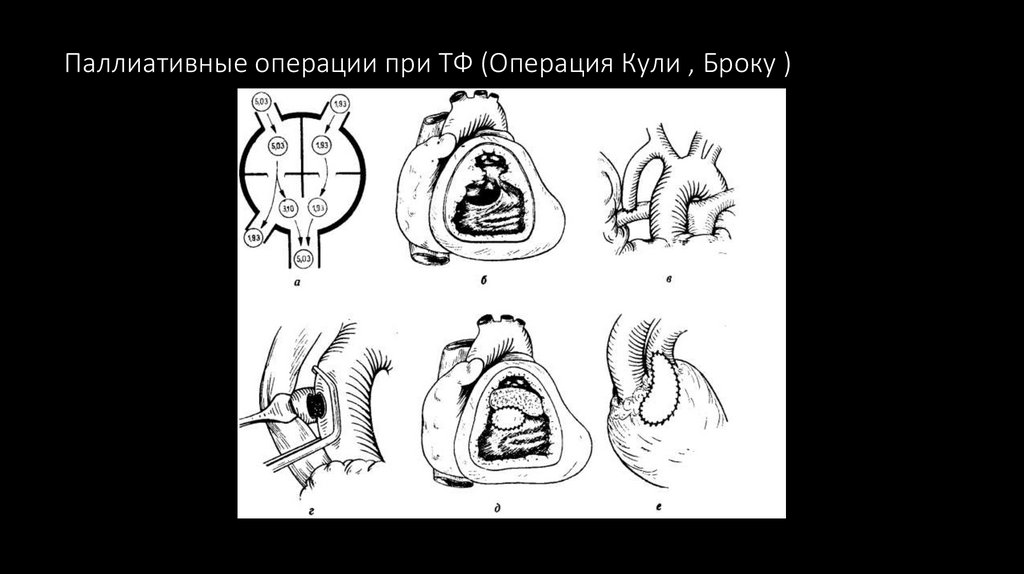
инфундибулярная резекция по Броку (R. Brock, 1948), иссечение мышечного валика при подклапанном стенозе с
помощью резектора Брока.
2. Внесердечные вмешательства — создание сосудистых анастомозов — шунтов для увеличения притока крови в
малый круг кровообращения:
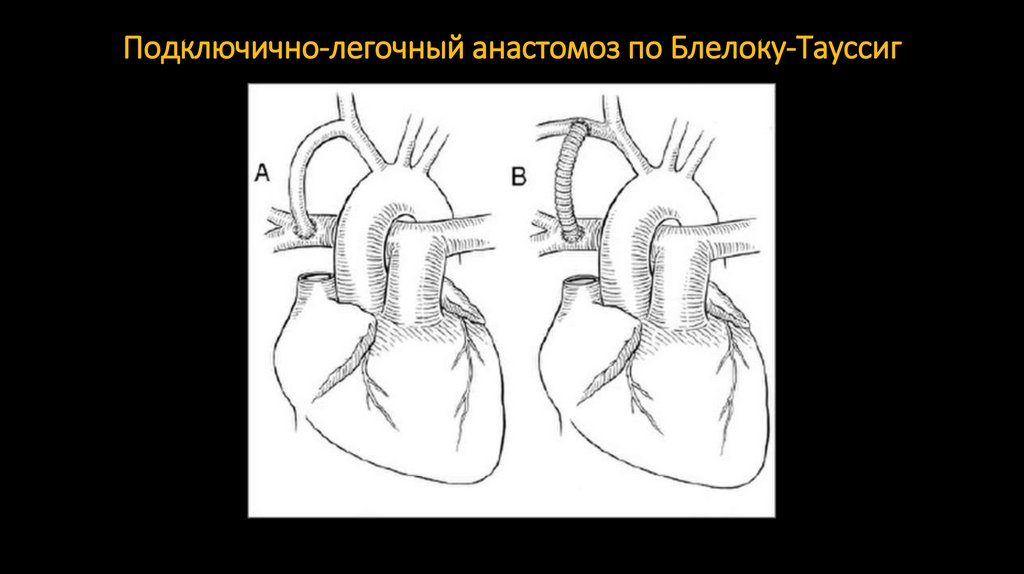
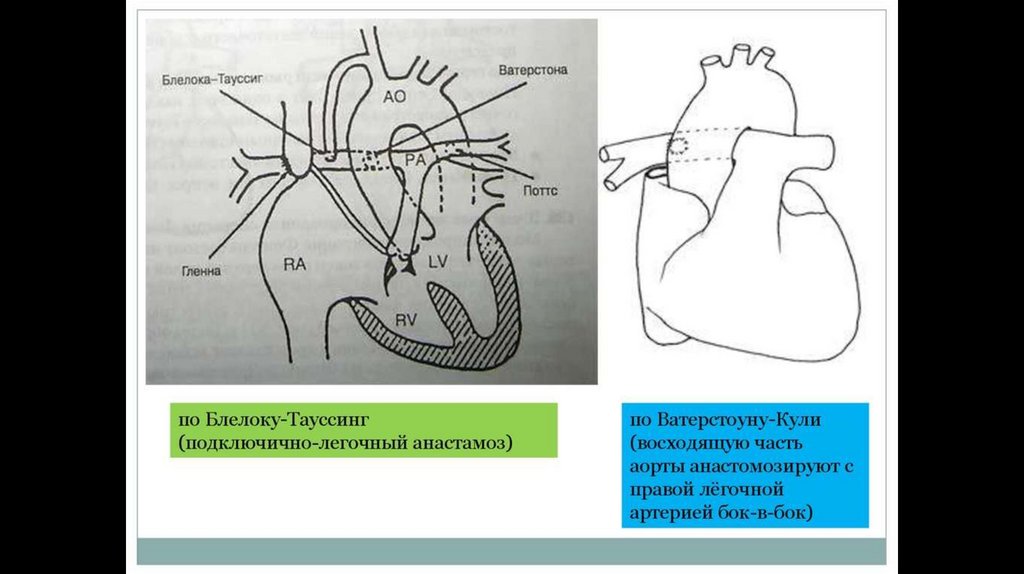
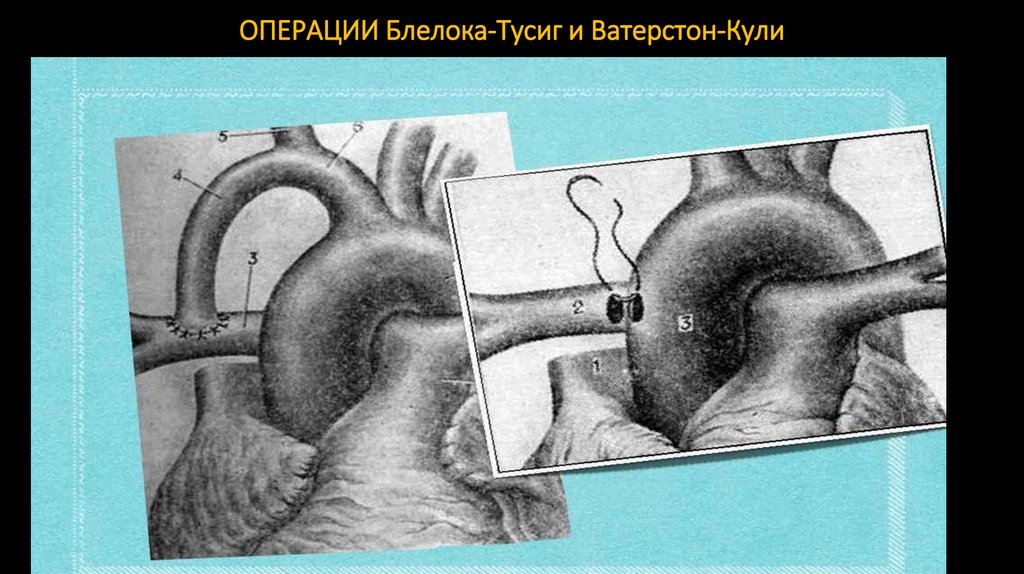
лёгочно-подключичный шунт по Блейлоку — Тауссиг (1945, правую подключичную артерию вшивают в бок правой
лёгочной артерии);
артериально-лёгочный шунт по Уотерстоуну — Кули (восходящую часть аорты анастомозируют с правой лёгочной
артерией бок-в-бок из передне-боковой торакотомии в IV межреберье справа);
аорто-лёгочный шунт по Поттс-Смиту (анастомоз бок-в-бок между нисходящей аортой и левой лёгочной артерией из
левосторонней передне-боковой торакотомии);
аорто-лёгочное шунтирование протезом из политетрафторэтилена.
86.
87. Подключично-легочный анастомоз по Блелоку-Тауссиг
88.
89. Паллиативные операции при ТФ (Операция Кули , Броку )
90.
91.
Второй этапПроводится через 2–4–6 месяцев после первого. Радикальная операция
выполняется в условиях искусственного кровообращения (ИК) с
тщательной кардиоплегией. Перфузию начинают охлаждённым до 10–
12°С перфузатом в аппарате ИК. Общая гипотермия при температуре
21,6°С. После пережатия аорты вскрывают полость правого желудочка и в
зависимости от характера стеноза под контролем зрения выполняют
оперативные приемы по устранению стеноза выходного отдела правого
желудочка.
Дефект
межжелудочковой
перегородки
устраняют
подшиванием заплаты П-образными швами. В переднюю поверхность
правого желудочка вшивают заплату для увеличения ширины выходного
отдела правого желудочка.
92.
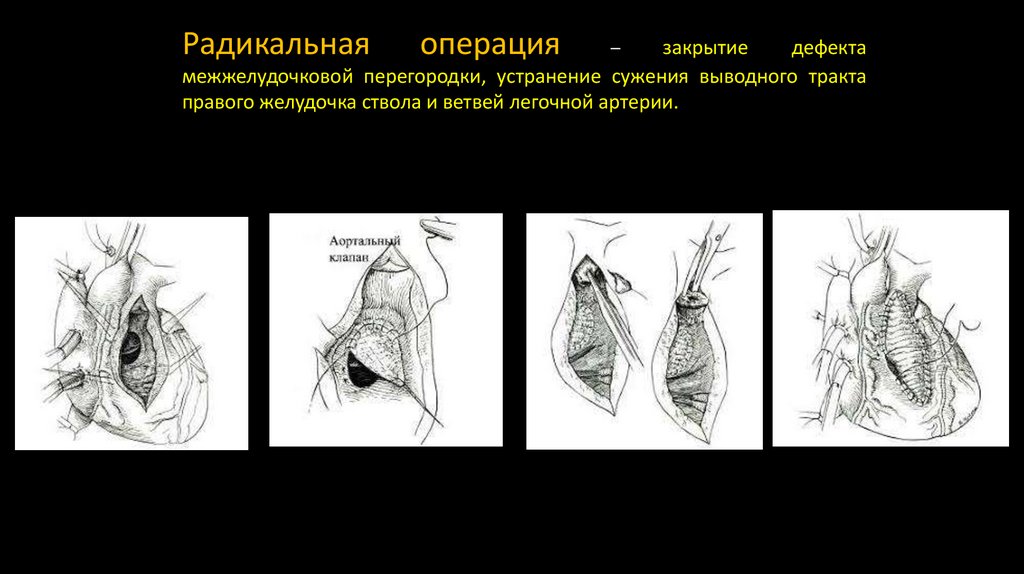
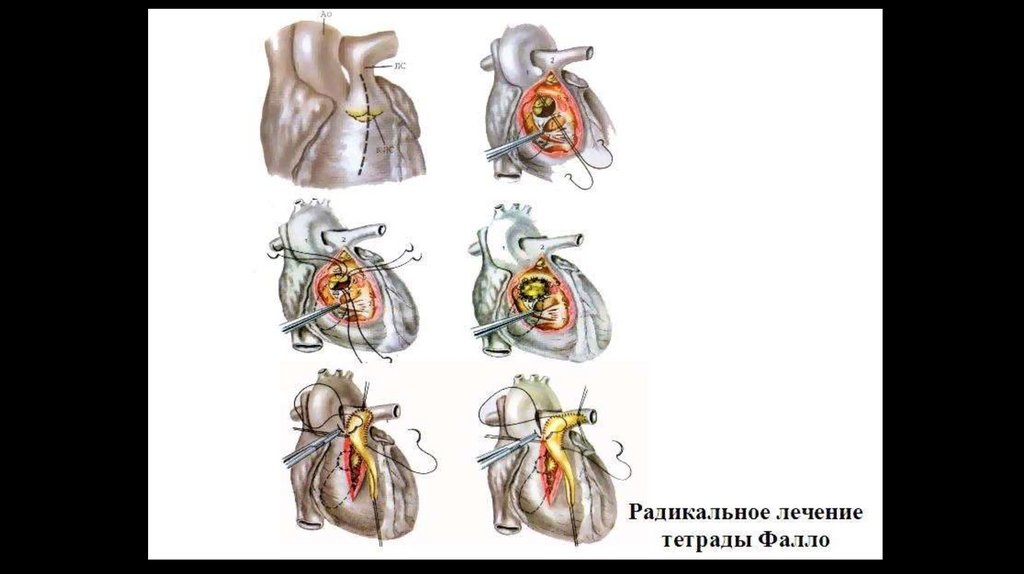
Радикальнаяоперация
закрытие
дефекта
межжелудочковой перегородки, устранение сужения выводного тракта
правого желудочка ствола и ветвей легочной артерии.
–
93.
94.
95.
96.
97.
98.
99.
100.
101.
102.
103.
104.
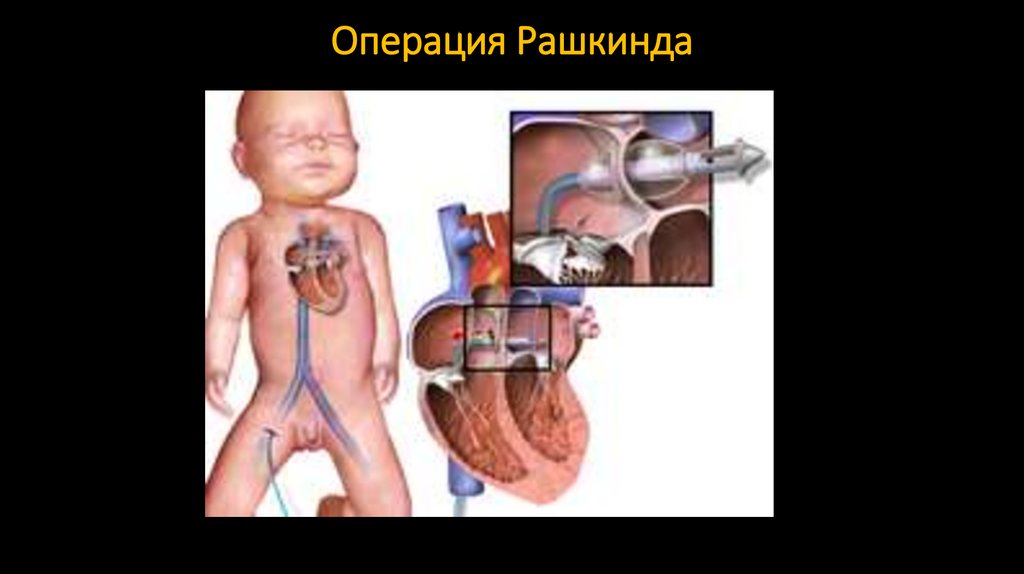
105. Операция Рашкинда
106.
107.
108.
109. ОПЕРАЦИИ Блелока-Тусиг и Ватерстон-Кули
110.
111.
112.
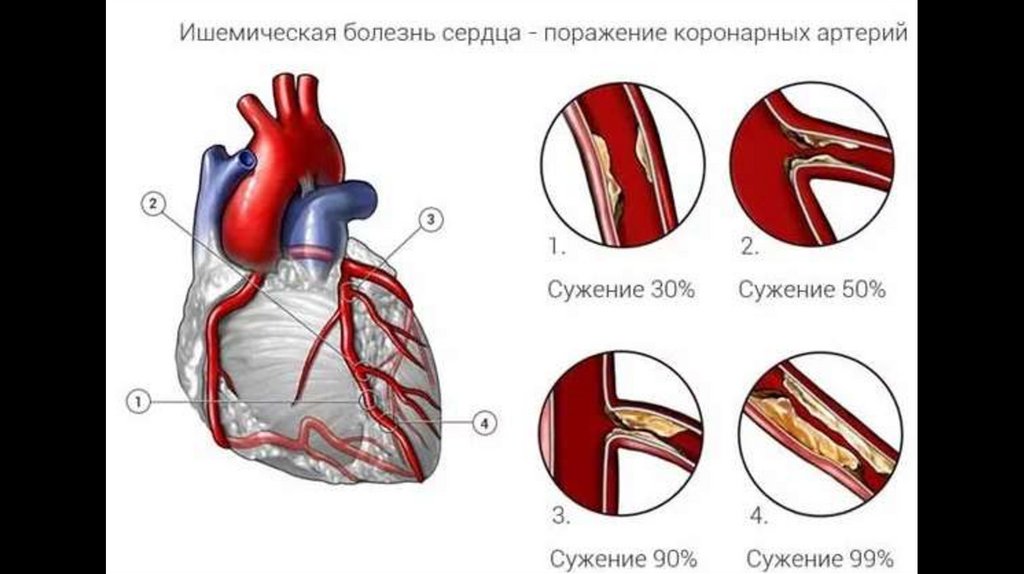
113. ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
114.
115.
Ишемическая болезнь сердца –заболевание, обусловленное несоответствием между
потребностью миокарда в кислороде и его доставкой;
характеризуется нарушением просвета коронарных артерий
сердца (наиболее часто вследствие атеросклероза).
116.
Причины возникновения ИБС• Гиперлипидемия. Повышение уровня холестерина в 2-5 раз увеличивает риск
развития атеросклероза и, как следствие, ишемии сердца
• Артериальная гипертензия. Пациенты с систолическим давлением 180 мм. рт. ст. и
более имеют повышенный риск возникновения болезни по сравнению с людьми с
нормальным давлением
• Сахарный диабет. Данное заболевание также относится к факторам,
провоцирующим возникновение ишемической болезни, и способствует увеличению
риска в 2-4 раза
• Малоподвижный образ жизни. Низкая двигательная активность увеличивает в три
раза риск развития этой сердечной патологии для человека. При наличии лишнего
веса данный риск еще более возрастает
• Зависимость от табака. Курение ухудшает состояние сосудов и увеличивает риск
развития ИБС, который у курильщиков выше в 1,5-6 раз по сравнению с теми, кто не
имеет такой привычки
Дополнительные факторы, влияющие на возникновение болезни – это наследственность, пожилой возраст и мужской
пол.
117.
Немодифицируемые факторы риска ИБС1.
2.
3.
Пожилой возраст (преобладающий возраст возникновения ИМ 40-70 лет)
Мужской пол
Наследственность
Модифицируемые факторы риска ИБС
1.
2.
3.
4.
5.
в 60- годы XX века:
В начале XXI века
1. Курение
2.Артериальная гипертония
3.Гиперлипидемия
4. Ожирение
5.Гиподинамия
1. Дислипидеми
2.Курение
3.Депрессия
4.Сахарный диабет
5.Артериальная гипертония
6.Ожирение
118. Ишемическая болезнь сердца — состояние, вызываемое хроническим недостаточным снабжением клеток сердечной мышцы кислородом
(гипоксия) ипитательными веществами
Выделяют основные причины развития болезни:
• Атеросклероз коронарных артерий. Патология заключается в образовании
бляшек на внутренних стенках сосудов, которые могут как немного сужать
просвет артерии, так и полностью ее перекрывать
• Тромбоэмболия. Представляет собой закупорку артерии внезапно
оторвавшимся тромбом, в результате чего кровь перестает поступать в
сердечную мышцу
• Спазм венечных артерий. Внезапное спазмирование возникает у пациентов
с уже имеющимися поражениями венечных артерий
• «Ныряющие» в толщу миокарда коронарные артерии.
• Недостаточное количество ветвей коронарных артерий отходящих от
основных стволов КА.
• Атеросклеротическое поражение ветвей , при не пораженном стволе
коронарной артерии, от которой они берут свое начало
119.
120.
121.
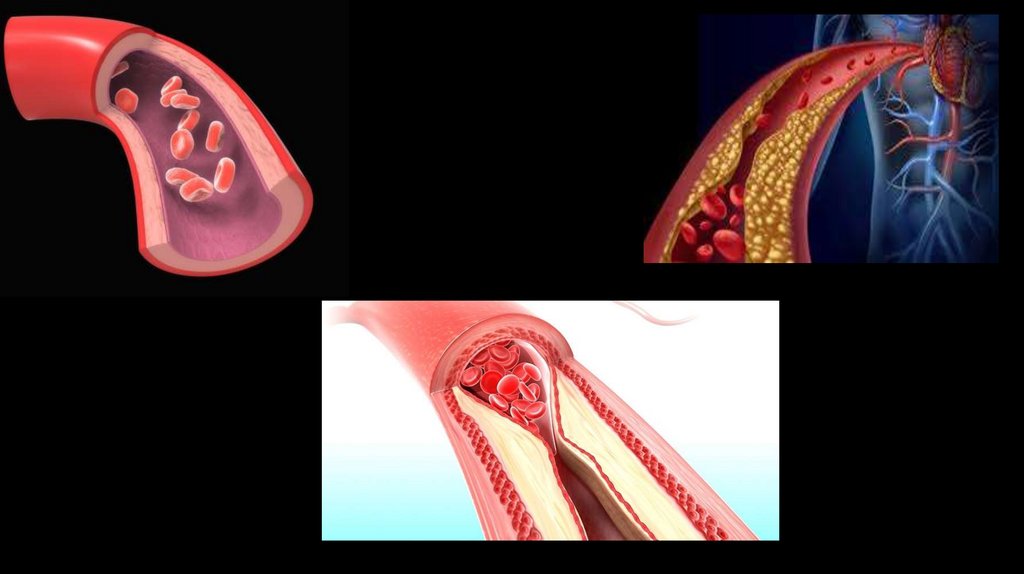
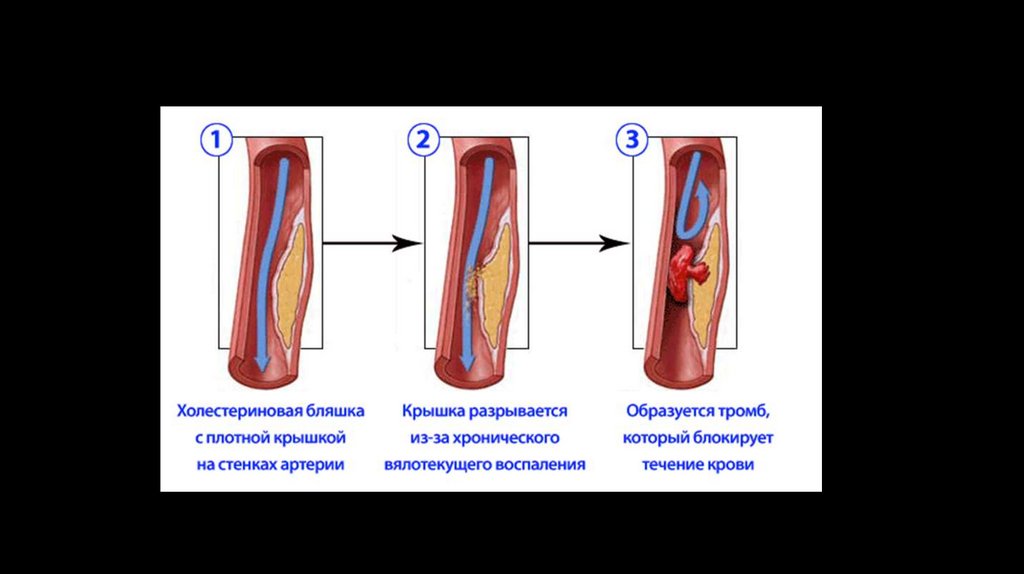
Механизм развития ИБСИшемическая болезнь сердца часто развивается в течение десятилетий, прежде чем симптомы станут достаточно ярко
выраженными. Основной причиной развития ишемической болезни сердца является атеросклероз. Повреждения
внутренних слоев (эндотелия) коронарных артерий и другие факторы, такие как высокий уровень холестерина
(особенного «плохого», ЛПНП) и диабет. Первоначально бляшка растет вне просвета сосуда, вызывая лишь увеличение
его диаметра, поэтому клинических проявлений может не быть. Однако атеросклеротические бляшки постепенно
сужают просвет сосуда, что приводит к ишемической болезни сердца — состоянию, когда сердечная мышца не
получает достаточного количества богатой кислородом артериальной крови из-за замедления или даже остановки
кровотока. На поздних стадиях развития атеросклероза возникают более серьёзные нарушения в свертывающей
системе крови. На поверхности бляшек появляются мелкие разрывы, к которым активно прикрепляются тромбоциты,
из-за чего со временем могут образоваться тромбы, полностью закупоривающие просвет сосуда, что может привести к
сердечному приступу (инфаркту).
Не всегда значительная или даже полная закупорка артерии приводит к инфаркту: регулярно повторяющиеся
ишемические состояния могут создать так называемое коллатеральное кровообращение (увеличение кровотока через
боковые и более мелкие ветви артерий в обход основной), что смягчает последствия ограничения кровотока в
основной артерии. Ишемическая болезнь сердца часто развивается в течение десятилетий, прежде чем симптомы
станут достаточно ярко выраженными. (Вирхов)
Осложнения ишемической болезни могут быть опасны для жизни или привести к инвалидности. К таким осложнениям
относятся острый коронарный синдром (включая стенокардию и инфаркт миокарда), аритмия, сердечная
недостаточность, кардиогенный шок и внезапная остановка сердца.
122.
123. Основные формы ишемической болезни сердца
• «стенокардия напряжения» (если боли возникают при физическихнагрузках);
• «немая стенокардия» (происходит во сне и протекает почти без симптомов;
• микроваскулярная стенокардия или «синдром Х» , когда крупные
коронарные артерии человека не затронуты, в отличие от мелких сосудов.
Примечательно, что именно этим видом ИБС чаще всего страдают женщины
в пременопаузе;
• также существует «нестабильная» стенокардия . Проявляется внезапным
сердечным приступом с нарастающей болью: этот вид является
предынфарктным состоянием.
• Вариантная стенокардия, также называемая стенокардия Принцметала,
возникает в результате спазма коронарной артерии, которая временно
сужается. Это сужение снижает кровоснабжение сердца, вызывая боль в
грудной клетке. Вариантная стенокардия может возникать даже в покое и
как правило является интенсивной. Может лечиться медикаментозно.
124. Симптомы ишемической болезни сердца
• боль или жжение в области груди, под лопаткой, в спине, вверхних отделах живота;
• чувство тяжести в груди;
• ощущение неровного биения сердца, неправильной работы
сердца, сердцебиение;
• чувство замирания сердца;
• одышку;
• слабость;
• тошноту;
• головокружение и обмороки;
• потливость.
125.
Осложнения ишемической болезни сердцаПо мере развития патологических изменений в сердечной мышце возникают нарушения, которые
становятся причиной осложнений данного заболевания.
Нарушение функций миокарда
ОИМ
Острый коронарный синдром
Развитие кардиосклероза, при котором количество клеток миокарда сокращается и замещается
соединительной тканью
• Нарушение энергетического обмена в клетках миокарда
• Преходящие нарушения сократимости левого желудочка сердца
Все эти изменения ухудшают коронарное кровообращение и приводят к развитию сердечной
недостаточности. При этом способность миокарда сокращаться ослабевает, и сердце не может
полноценно обеспечивать потребности организма в перекачивании крови. Человек ощущает слабость,
быструю утомляемость. Риск смертельного исхода возрастает.
126.
Диагностика ишемической болезни сердцаДля установления диагноза требуется провести ряд лабораторных и инструментальных
исследований:
1.
2.
3.
4.
5.
6.
Измерение артериального давления. Пациент ведет обычный образ жизни, а специальный
прибор с определенной частотой замеряет и фиксирует артериальное давление
Электрокардиограмма (холтеровское мониторирование). Снимается в покое, а также может
сниматься на протяжении суток и долее
Анализ крови. Сердечные ферменты, такие как CK и тропонин, предоставляют информацию об
остром ишемическом событии.
УЗИ сердца. Данный метод позволяет оценить состояние сердечной мышцы
Тест с нагрузкой. (стресс ЭхоКГ) Во время теста сердце искусственно подвергается нагрузке, и, если
у пациента наблюдаются определенные аномальные изменения на ЭКГ в сегментах ST или
появляются симптомы стенокардии, в этот момент тест прерывается и диагностируется
ишемическая болезнь сердца.
Коронарная ангиография. На сегодняшний день это наиболее точный диагностический метод,
при котором в кровь пациента вводится контрастное вещество и выполняется рентген-снимок
127. Подъем ST при инфаркте миокарда
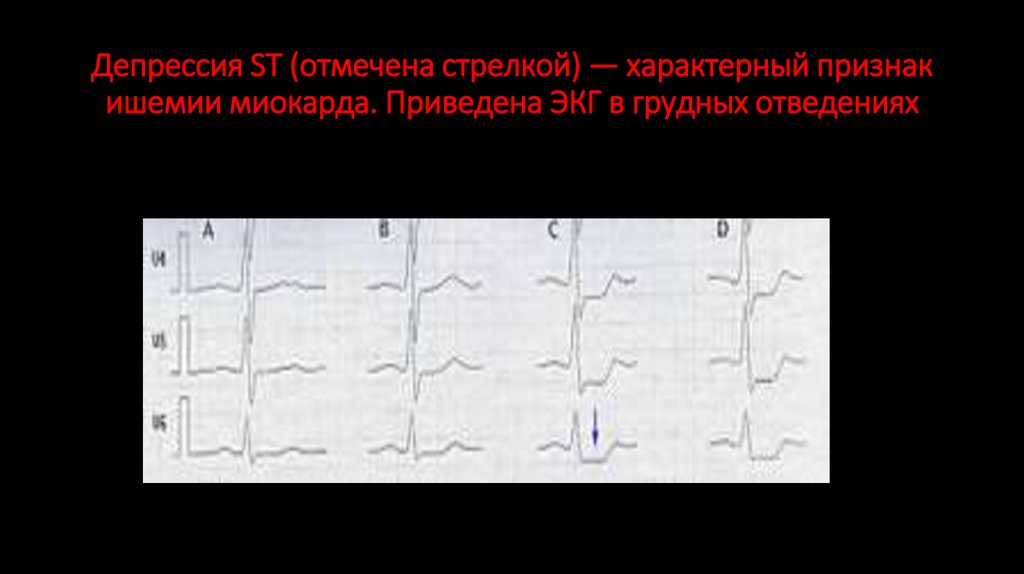
128. Депрессия ST (отмечена стрелкой) — характерный признак ишемии миокарда. Приведена ЭКГ в грудных отведениях
129. Тест с нагрузкой
130.
«Золотым стандартом» в диагностике ИБС являетсякоронароангиография — рентгеноконтрастное исследование
сосудов сердца, которое с большой точностью позволяет определить характер,
место и степень сужения коронарной артерии.
Основные показания для проведения коронароангиографии (КАГ):
- обострение ИБС, ОКС (острый коронарный синдром) и ИМ;
- нестабильная стенокардия;
- тяжелая форма стабильной стенокардии III-IV функционального
классов.
131.
Коронароангиография(КАГ)
является самым
информативным методом диагностики коронарного
атеросклероза, который позволяет получить информацию
об анатомическом состоянии коронарных артерий, выбрать
метод лечения и определить прогноз.
При КАГ делают прокол лучевой или бедренной артерии и
через специальные катетеры в коронарные артерии вводят
контрастное
вещество.
Рентгеновское
изображение
коронарных артерий отображает просвет магистральных
артерий и их ответвлений, что позволяет точно определить
локализацию, характер и степень их поражения.
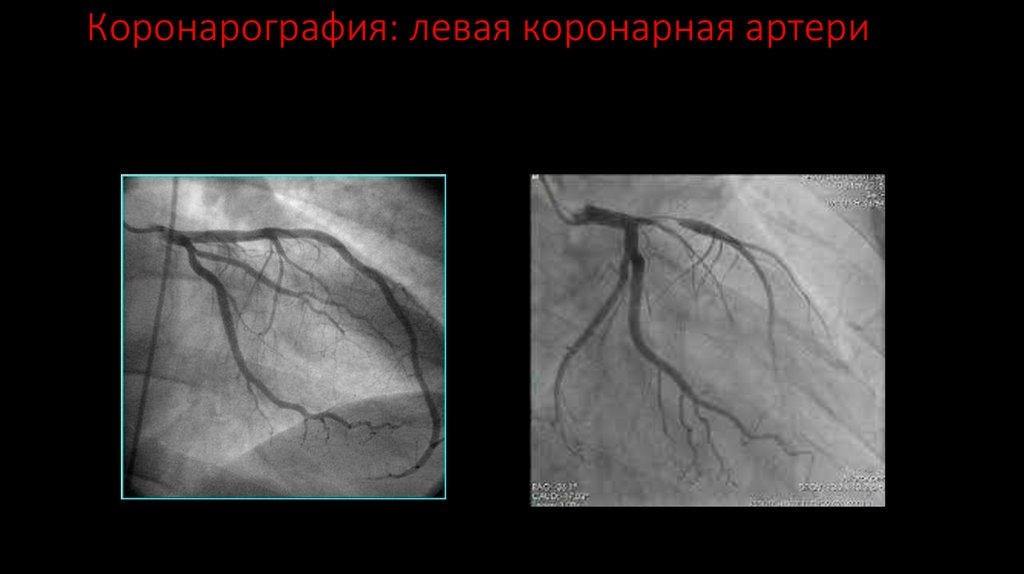
132. Коронарография: левая коронарная артери
133.
134.
В некоторых случаях могут быть рекомендованы более детальныеи дорогостоящие исследования:
1. Магнитно-резонансная томография (МРТ) сердца выявляет повреждения тканей
или проблемы с кровотоком в сердце или коронарных артериях, а также в
микрососудистые изменения. Метод может быть применим для дополнительной
диагностики ИБС (особенно необструктивной, бессимптомной) и микрососудистых
патологий. Как правило, МРТ сердца назначают для уточнения результатов других
визуализирующих исследований, таких как рентген грудной клетки или
компьютерная томография.
2. Сердечная позитронно-эмиссионная томография (ПЭТ) позволяет оценить кровоток
через мелкие коронарные кровеносные сосуды и в тканях сердца, также
используется для диагностики микроваскулярной стенокардии (синдром Х) и
других патологий, связанных с сосудами малого диаметра.
3. Компьютерная томография (КТ) сердца позволяет обнаружить затвердение и
сужение крупных артерий, а также визуализировать кальциевые отложения на
стенках, что может являться ранним признаком вероятной ишемической болезни
сердца. Очевидным преимуществом является неинвазивность метода, по
сравнению с обычной контрастной ангиографией
135.
Лечение ишемической болезни сердцаЛечение ИБС имеет свои особенности. В первую очередь врач порекомендует скорректировать образ
жизни, важными компонентами которого должны стать следующие моменты:
1.
Больше движения. Регулярная двигательная активность должна стать нормой жизни. Полезны
кардионагрузки – плаванье, ходьба, гимнастика, упражнения на тренажерах. Интенсивность нагрузок
следует согласовывать со своим лечащим врачом
2.
Соблюдение диеты. Из меню стоит исключить жирную и соленую пищу, а вот количество овощей,
рыбы, фруктов, зелени, зерновых – увеличить
3.
Питьевой режим. Уменьшить употребление воды до 1,2 л в сутки, чтобы снизить нагрузку на сердце
при сердечной недостаточности
4.
Психологический покой. Важно избегать стрессов, нервного напряжения, поддерживать свое
эмоциональное здоровье
136.
Первая помощь при приступе стенокардии1. Прекратить физическую нагрузку. Обеспечить приток свежего воздуха.
2. Измерить артериальное давление (АД). При подъеме АД до 160–180/100 мм рт.
ст. 1 таблетку коринфара (10 мг) или капотена (25 мг), чтобы больной разжевал.
3. Если это уже не первый приступ и есть рекомендации врача, то дать 1 таблетку
нитроглицерина под язык или ингаляцию нитроспрея. Если боль не проходит через
3 – 5 мин., то повторить прием 1 табл. нитроглицерина под язык или ингаляцию
нитроспрея.
4. Если приступ загрудинных болей не удается снять в течение 20 минут, то надо
немедленно разжевать 1 таблетку (0,5 г) аспирина (нельзя исключить инфаркт
миокарда) и срочно вызвать «Скорую помощь»!
137.
Тромболетическая терапияОсновным патогенетическим методом лечения ИМ является восстановление проходимости окклюзированной
коронарной артерии. Чаще всего для достижения этого используют либо тромболитическую терапию, либо
механическое разрушение тромба при транслюминальной коронарной ангиопластике. Для большинства клиник
нашей страны наиболее реалистично сегодня применение первого способа.
Процесс некроза развивается у человека крайне быстро и в основном заканчивается, как правило, уже через 6–
12 ч от начала ангинозного приступа, поэтому чем быстрее и полноценнее удается восстановить кровоток по
тромбированной артерии, тем более сохранной будет функциональная способность миокарда левого желудочка и
в конечном итоге меньше летальность. Оптимальным считается начало введения тромболитических препаратов
через 2–4 ч от начала болезни.
Начало тромболитической терапии на догоспитальном этапе позволяет добиться выигрыша во времени, в
среднем около 2,5 ч. Такой способ тромболитической терапии, если он проводится врачами специализированной
бригады кардиологической помощи, является относительно безопасным. При отсутствии противопоказаний
тромболитическую терапию целесообразно проводить всем больным в первые 12 ч болезни.
Сегодня основным путем введения тромболитических препаратов является внутривенный. Все используемые
препараты, тромболитики первого поколения, такие как стрептокиназа (1 500 000 ЕД в течение 1 ч) – урокиназа (3
000 000 ЕД в течение 1 ч), второго поколения – тканевой активатор плазминогена (100 мг болюсом плюс инфузия),
проурокиназа (80 мг болюсом плюс инфузия 1 ч) – являются высокоэффективными тромболитиками.
138.
Лечение ишемической болезни сердцаОдних лишь здоровых привычек недостаточно, чтобы справиться с недугом. Лечение хронической
ишемической болезни сердца, согласно современным протоколам, может включать прием следующих
лекарственных препаратов.
Антиагреганты. Эти препараты уменьшают вязкость крови, благодаря чему сердцу становится проще ее перекачивать
(аспирин, ривароксабан, клопидогрель и другие)
Антиишемические препараты. Лекарства данной группы улучшают доступ кислорода к сердечной мышце ( нитраты)
Бета-блокаторы. Задача этих препаратов – снять сердечную боль, расширить сосуды, уменьшить сердцебиение
(атенолол, бисопролол, конкор и другие)
Антагонисты кальция. Уменьшают сердцебиение, препятствуют проникновению кальция в мышечную ткань сердца
и сосуды (амлодипин, верапамил, дилтиазем) — расслабляют мышцы, расширяют артерии, снижают давление.
Препараты, снижающие уровень холестерина в крови. Положительно влияют на липидный обмен
Ингибиторы ангиотензинпревращающего фермента. Эта группа препаратов способствует
артериального давления
Антиаритмические препараты.
Диуретики.
уменьшению
139.
хирургическое вмешательствоЗадача этих процедур улучшить приток крови к сердцу, убрать болевой синдром и
снизить риск осложнений, например, сердечного приступа.
В 50 годах прошлого столетия профессор Мыш А.Н. предлагал засыпать в полость перикарда
стерильный тальк, таким образом вызвав асептическое воспаление в результате которого
формируются мелкие сосуды на сердце.
В 60 годы выполнялись операции по окутыванию сердца большим сальником из брюшной
полости, который богат сосудами
Чрескожное коронарное вмешательство, или коронарная ангиопластика, позволяет открыть
заблокированные или суженные коронарные артерии. Иногда в артерию помещают небольшую
сетчатую трубку (стент), чтобы сохранять её открытой. Процедура проводится как с целью
предотвращения потенциального инфаркта, так и в качестве экстренного лечения во время
сердечного приступа.
Аортокоронарное шунтирование — здоровые сосуды из других частей тела используются, чтобы
«заменить» или «обойти» суженные коронарные артерии.
Трансмиокардиальная лазерная реваскуляризация миокарда – у больных с диффузно пораженными
атеросклерозом коронарных артерий.
Пересадка донорского сердца — крайняя мера, в случае, когда сердечная мышца сильно
повреждена, а лекарства и другие методы воздействия неэффективны
140.
При неэффективности терапевтического лечения ИБС и сужении диаметра однойили нескольких коронарных артерий на 70 % и более назначается
реваскуляризация коронарных сосудов (восстановление просвета артерии,
пораженной атеросклерозом) с использованием метода ангиопластики со
стентированием.
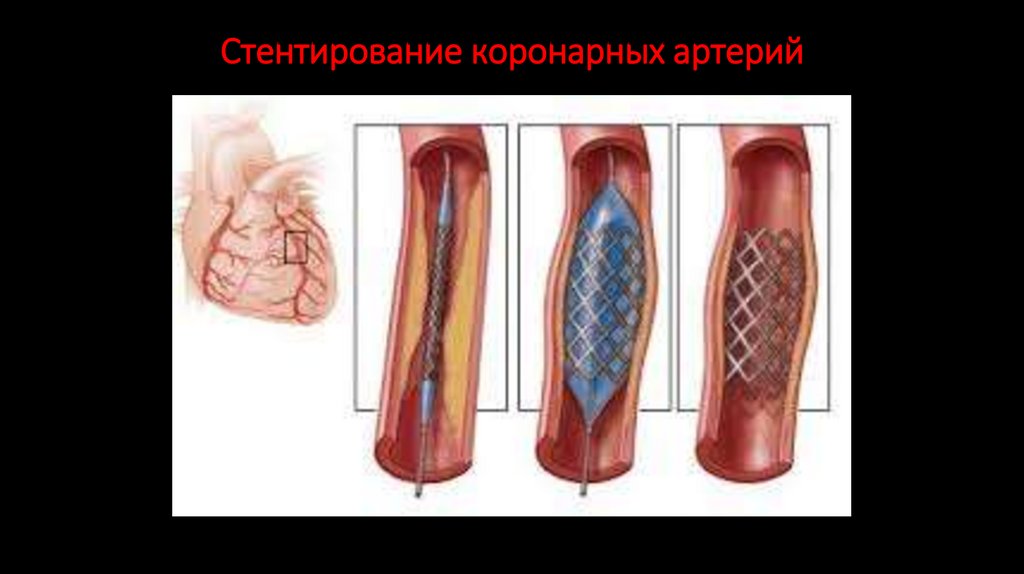
СТЕНТИРОВАНИЕ КОРОНАРНЫХ АРТЕРИЙ
Ангиопластика со стентированием — малоинвазивный способ восстановления
внутреннего просвета стенозированных артерий сердца с помощью
эндоваскулярных приспособлений — баллонных катетеров и стентов.
141.
хирургическое вмешательство, направленное на реваскуляризациюмиокарда (восстановление нормального кровотока к сердечной мышце)
стентирование
пораженных
артерий
сердца–
внутрисосудистая операция. Под местной анестезией через лучевую (на
предплечье) или реже через бедренную (в паху) артерию вводят катетер,
по которому в артерии сердца проводят специальное устройство. В
место сужения сосуда с помощью баллона устанавливают специальную
металлическую каркасную конструкцию, покрытую лекарственными
препаратами. В месте сужения баллон раскрывается под давлением и
«раздавливает» атеросклеротическую бляшку, расширяя артерию и
расправляя стент. В результате чего стент прижимает холестериновую
бляшку к стенкам сосуда и восстанавливает его проходимость;
142. Стентирование коронарных артерий
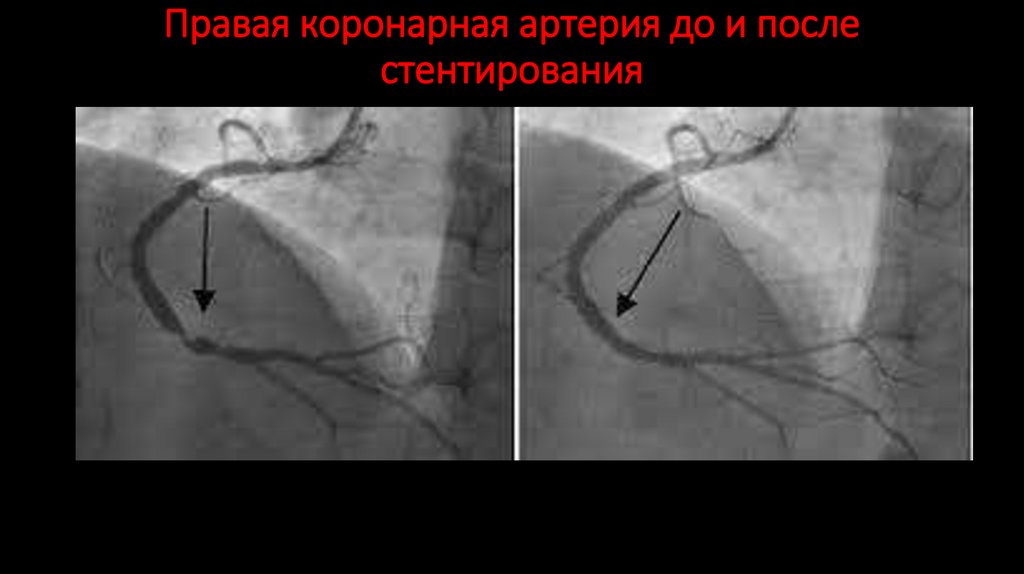
143. Правая коронарная артерия до и после стентирования
144.
Медикаментозное лечение после стентирования коронарных артерийВсе пациенты после стентирования коронарных артерий должны принимать
следующие группы препаратов. − Антитромбоцитарные препараты
Ацетилсалициловая кислота: аспирин (75-100 мг) утром — неопределенно долго.
Регулярный прием аспирина при отсутствии противопоказаний (язва желудка, 12перстной кишки, гиперчувствительность к аспирину и др.) при ишемической болезни
сердца снижает риск развития инфаркта миокарда в среднем на 25–30 %.
Тикагрелор (90 мг 2 раза в сутки) или клопидогрел (75 мг в сутки) утром — принимать не
менее 1 года. Плавикс
145.
Медикаментозное лечение после стентированиякоронарных артерий
Гиполипидемические препараты, понижающие уровень холестерина крови
Статины: розувастатин, аторвастатин — 1 раз вечером. Положительное влияние статинов на
продолжительность жизни больных ИБС отмечается через 1,5 – 2 года, а первые благоприятные
сдвиги — через 3 – 6 мес. Статины назначаются однократно, вечером, поскольку синтез
холестерина наиболее активен ночью. Доза статина определяется врачом в зависимости от
уровней липидного профиля (целевой уровень холестерина ЛПНП < 1,8 ммоль/л)
Бета-адреноблокаторы
Метопролол, бисопролол, небиволол — дозы по назначению врача
Нитраты
Для купирования приступов стенокардии необходим прием препаратов из группы нитратов
(нитроглицерин, нитроспрей), для профилактики приступов — изосорбит-5 мононитрат.
146.
коронарное шунтирование – операция на открытом сердце, цельюкоторой является восстановление полноценного кровоснабжения. Проводится
методом обхода места сужения сосуда с помощью шунтов (сосудистых протезов),
которые перенаправляют ток крови с забившихся участков артерий на здоровые. В
качестве коронарных шунтов чаще всего используются собственные артерии
(мамарокоронарное шунтирование (МКШ)) и вены пациента (аортокоронарное
шунтирование (АКШ)). При этом артериальные шунты имеют значительное
преимущество с точки зрения длительного улучшения прогноза и освобождения от
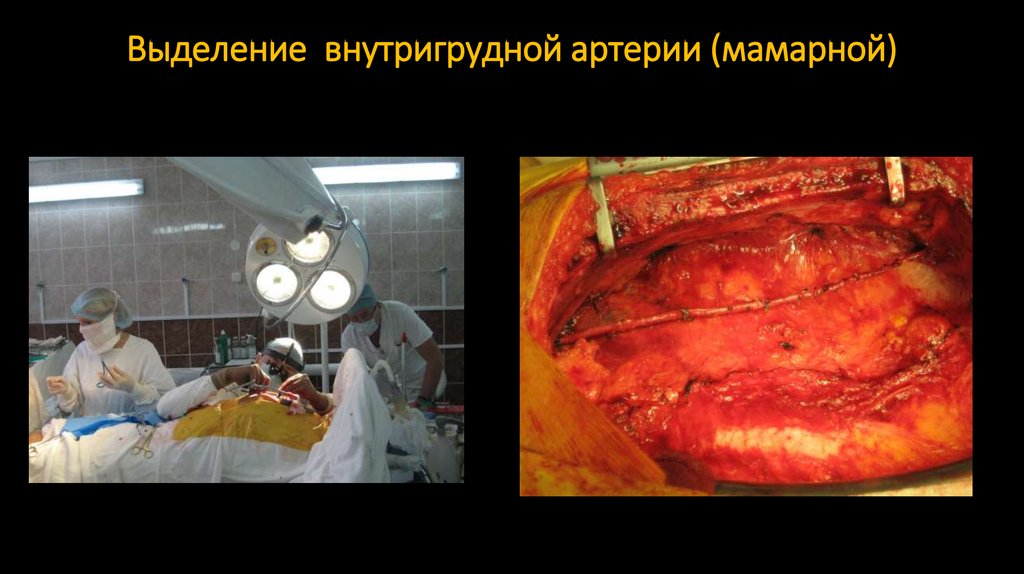
боли в результате операции. В нашем отделении кардиохирургии операция
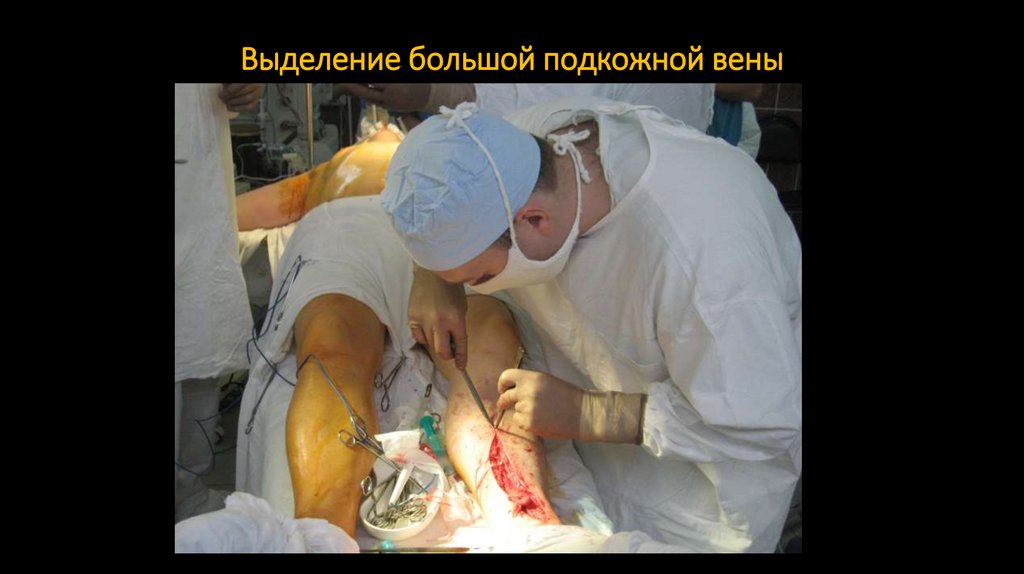
выполняется как с помощью подключения искусственного кровообращения, так и
НА РАБОТАЮЩЕМ СЕРДЦЕ (off pump).
147. Выделение большой подкожной вены
148. Выделение внутригрудной артерии (мамарной)
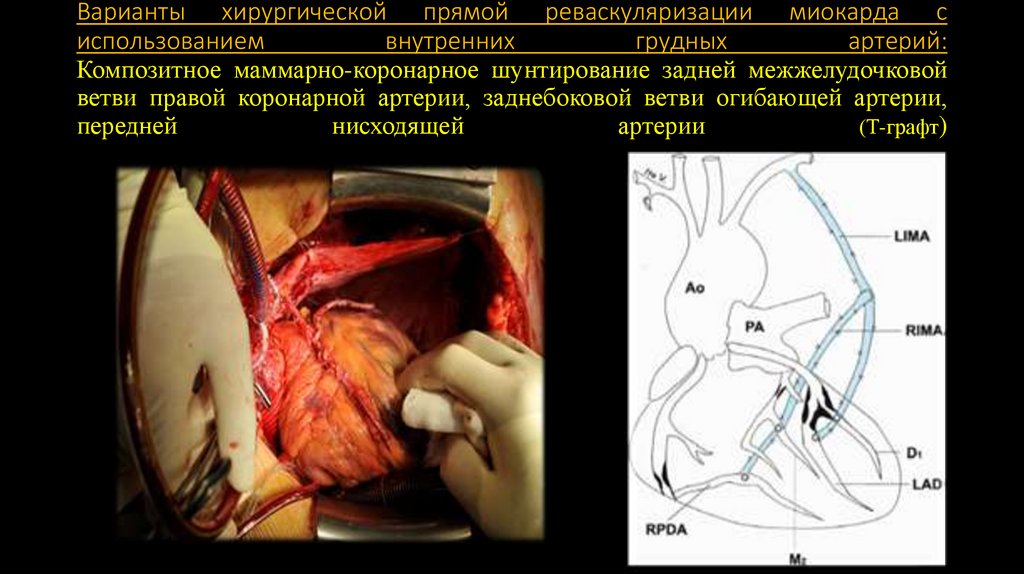
149. Варианты хирургической прямой реваскуляризации миокарда с использованием внутренних грудных артерий: Композитное
маммарно-коронарное шунтирование задней межжелудочковойветви правой коронарной артерии, заднебоковой ветви огибающей артерии,
передней
нисходящей
артерии
(Т-графт)
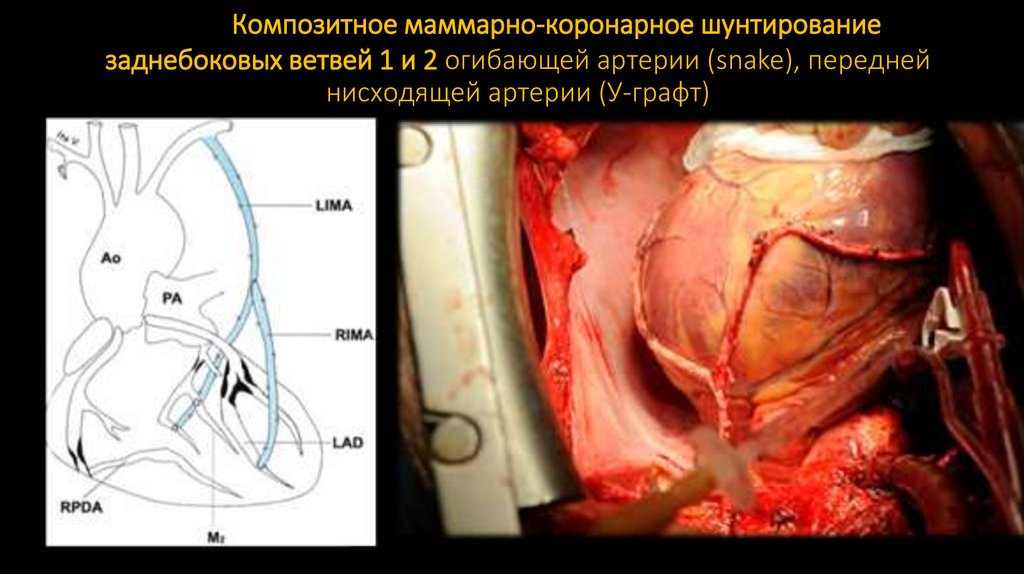
150. Композитное маммарно-коронарное шунтирование заднебоковых ветвей 1 и 2 огибающей артерии (snake), передней нисходящей артерии
(У-графт)151.
152. МКШ и АКШ
153. Аневризма левого желудочка
Аневризма левого желудочка сердца — это тяжелоеосложнение перенесенного инфаркта миокарда, представляющее
собою участок истонченной сердечной мышцы. Поврежденный
участок мышечной ткани, принявший на себя давление крови во
время приступа, продолжает испытывать давление, не в силах
принять первоначальное положения.
В результате ткань истончается
и растягивается,
образуя
выпячивание- аневризму. Чаще всего поражается левый желудочек
в передней верхней части.
154.
155.
Симптоматически наличие аневризмы левого желудочка сердцаопределить невозможно, но поскольку она вызывает нарушения работы
сердца то и, соответственно, вызывает общие признаки расстройства
сердечной деятельности.
Среди них:
1.
2.
3.
4.
5.
6.
7.
болезненные ощущения в области сердца;
сердечные боли после физических и эмоциональных нагрузок;
дискомфорт области груди;
одышка и учащенное сердцебиение;
частые головокружения обморочные состояния;
отечность конечностей;
признаки удушья, нехватки воздуха и другие симптомы.
156. Методы диагностики
• ЭКГ — позволяет выявить признаки обширного инфаркта, дажеперенесенного ранее.
• МРТ — предоставляет данные о локализации аневризмы и ее
размеры.
• УЗИ — позволяет визуально осмотреть зоны выпячивания ткани
сердца, определить форму аневризмы.
• ЭхоКг — определяет структуру выпячивания (истинное, ложное,
функциональное), обнаруживает тромбы в полости сердца, при
их наличии.
• Левая вентрикулография — помогает определить не только
локализацию и размер аневризмы, но и, что более важно,
наличие или отсутствие сокращений в аневризме, и их характер.














































































 Медицина
Медицина








