Похожие презентации:
b92d4f6526ee40faa93b89cc550427d5
1. Проверим знания по теме «Кислород»
2.
Химический элементХимический знак – O
Положение в ПС – 2 период, VI А группа
Аr (O) =
16
Валентность =
порядковый номер №8
II
Соединения элементов с кислородом–
оксиды
3.
Простое веществоХимическая формула – O2
Модель молекулы:
Mr (O2) =
32
Строение:
молекулярное
4.
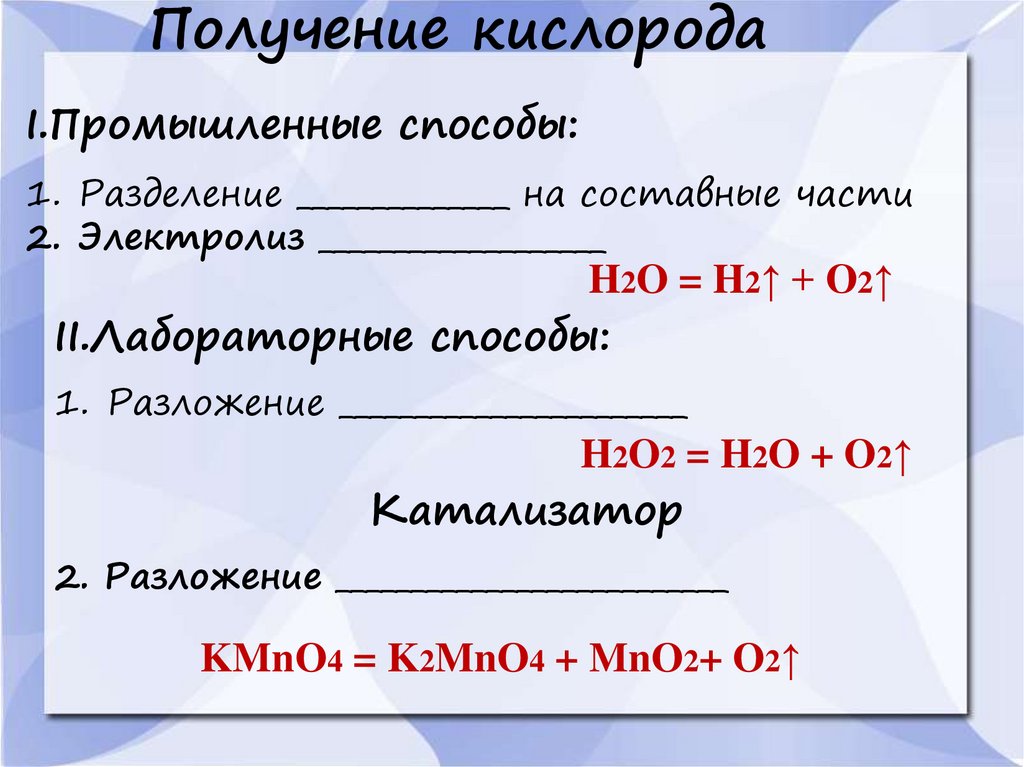
Получение кислородаI.Промышленные способы:
1. Разделение ______________ на составные части
2. Электролиз ___________________
H2O = H2↑ + O2↑
II.Лабораторные способы:
1. Разложение _______________________
H2O2 = H2O + O2↑
Катализатор
2. Разложение __________________________
KMnO4 = K2MnO4 + MnO2+ O2↑
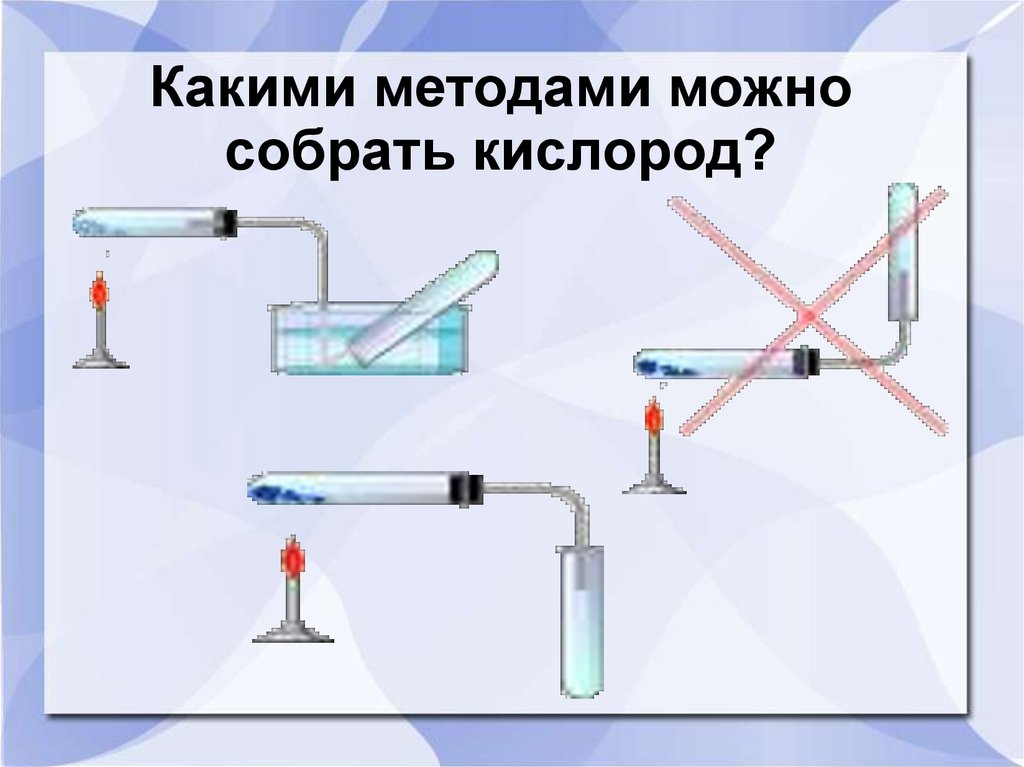
5. Какими методами можно собрать кислород?
6. Химические свойства О2
1. -----------------Мg + O2 –
Al + O2-
2. -----------------
3. ----------------CH4 + O2 –
H2S + O2 -
C+ O2 –
N2 + O2 -
7. Применение О2
8. Тепловой эффект химической реакции, понятие о термохимическом уравнении, экзо- и эндотермических реакциях
9. «Зимняя ночь» Б.Пастернак
Мело, мело по всей землеВо все пределы.
Свеча горела на столе,
Свеча горела.
10.
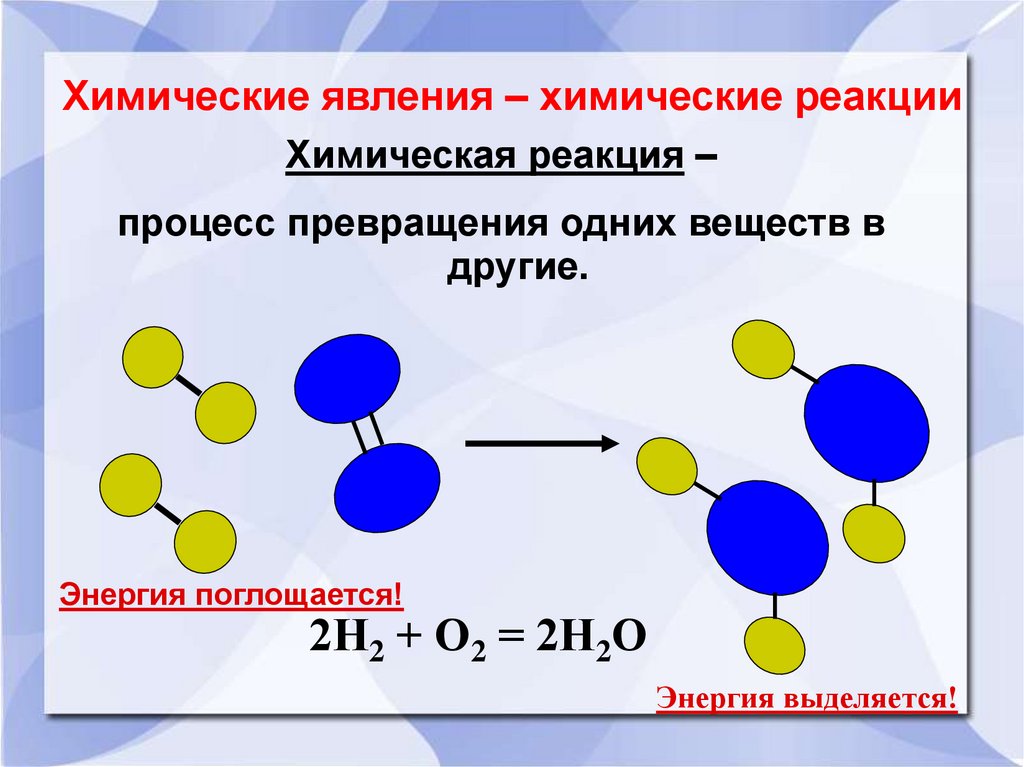
Химические явления – химические реакцииХимическая реакция –
процесс превращения одних веществ в
другие.
Энергия поглощается!
2Н2 + О2 = 2Н2О
Энергия выделяется!
11.
Признаки химических реакцийИзменение цвета
Выделение газа
Образование или растворение осадка
Появление или исчезновение запаха
Выделение или поглощение света и тепла
12.
Закон сохраненияэнергии
Энергия не возникает из
ничего и не исчезает
бесследно, а только
переходит из одной
формы в другую.
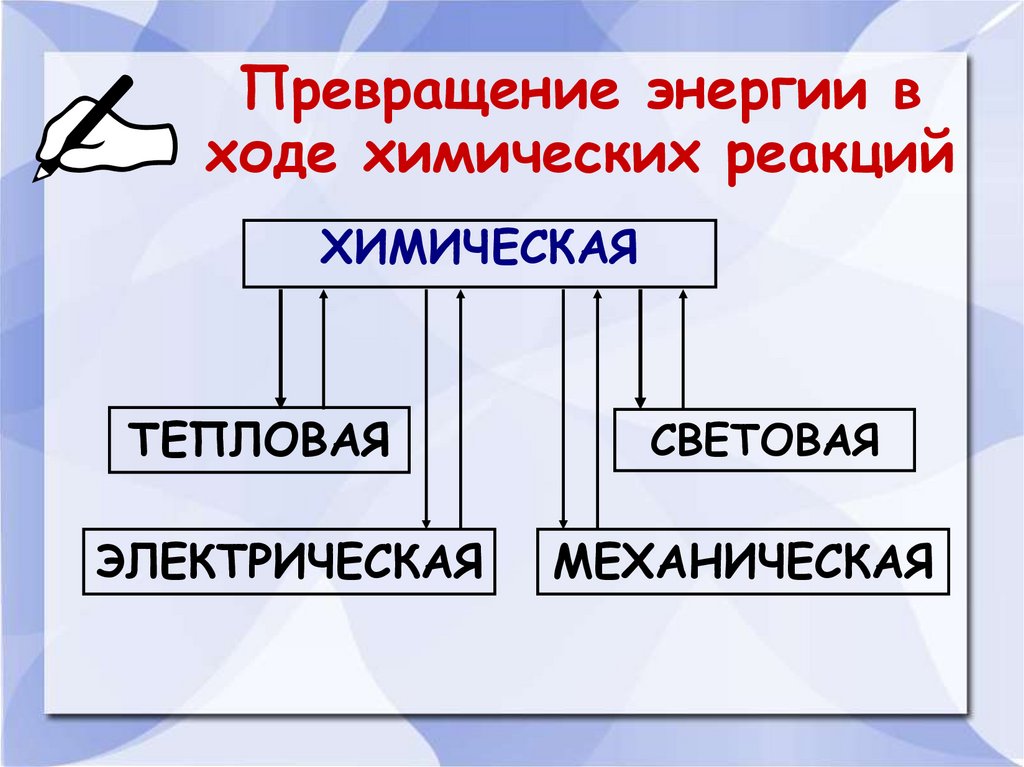
13. Превращение энергии в ходе химических реакций
ХИМИЧЕСКАЯТЕПЛОВАЯ
ЭЛЕКТРИЧЕСКАЯ
СВЕТОВАЯ
МЕХАНИЧЕСКАЯ
14.
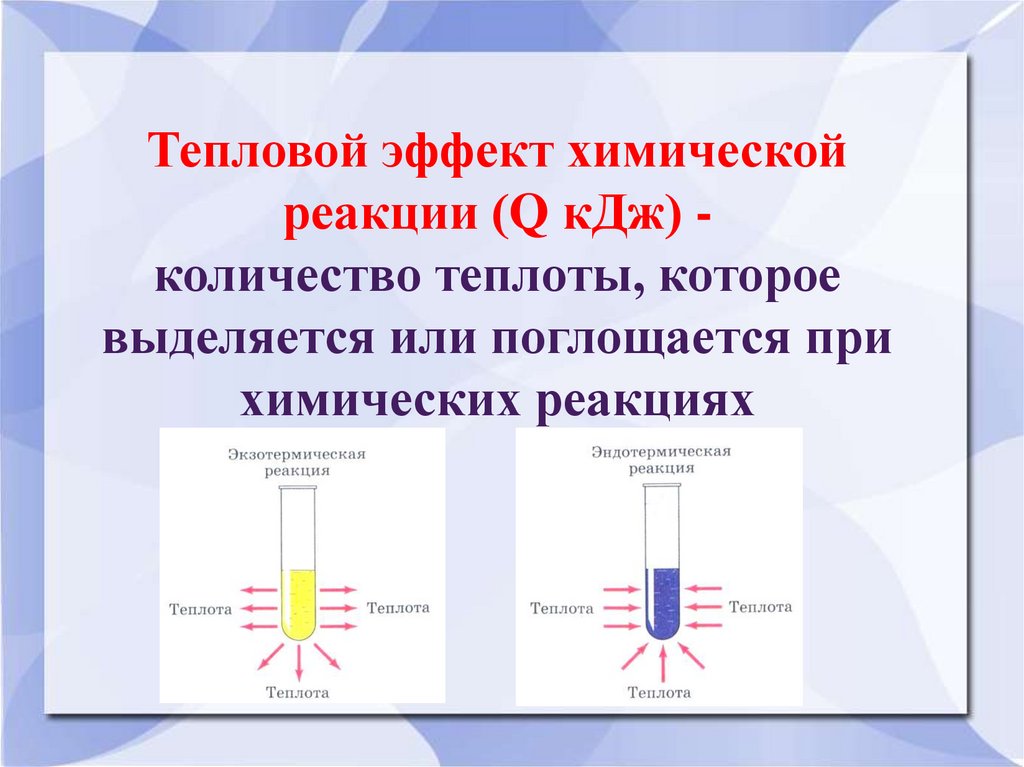
Тепловой эффект химическойреакции (Q кДж) количество теплоты, которое
выделяется или поглощается при
химических реакциях
15.
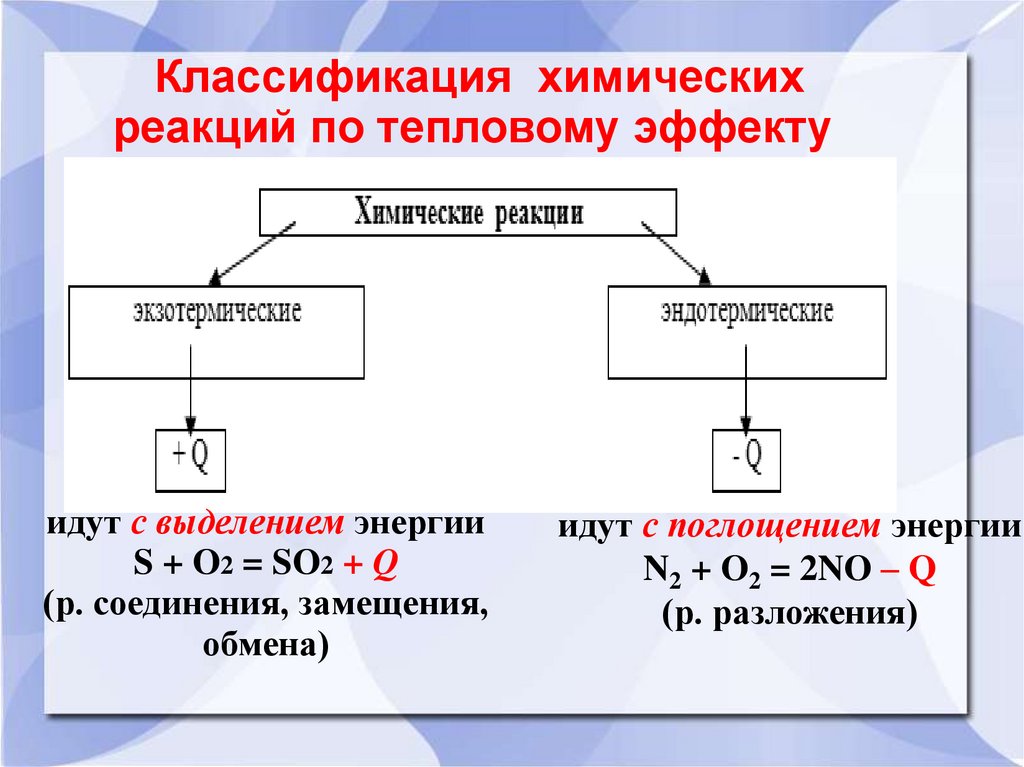
Классификация химическихреакций по тепловому эффекту
идут с выделением энергии
S + O2 = SO2 + Q
(р. соединения, замещения,
обмена)
идут с поглощением энергии
N2 + O2 = 2NO – Q
(р. разложения)
16.
Термохимические уравнения –уравнения, в которых указывается
тепловой эффект хим. реакции
2HgO —> 2Hg + O2 – 180 кДж,
С(тв) + O2(г) —> СO2(г) + 394 кДж
17. Алгоритм решения задач по термохимическому уравнению
Кратко записать условия задачи (“дано”).Записать термохимическое уравнение реакции
(ТХУ), одной чертой в уравнении реакции
подчеркнуть то, что известно и то, что необходимо
определить.
Провести вспомогательные вычисления. m=M*v
Составить пропорцию, используя вспомогательные
вычисления и условия задачи, и решить ее.
Записать ответ.
18. Дано: n(Cu)=4 моль Найти: Q - ? кДж
19. Дано: m(Mg)=3 моль Q = 75, 15кДж Найти: Q (реакции)- ? кДж
Задача 21.
Дано:
m(Mg)=3 моль
Q = 75, 15кДж
Найти:
Q (реакции)- ?
кДж
2.
20.
21. 1. Вычислите массу разложившегося мела (СаСО3), если известно, что на его разложение затрачено 1570 кДж.
22. 1. Вычислите массу разложившегося мела (СаСО3), если известно, что на его разложение затрачено 1570 кДж.
23.
1. Заполни пропускиРеакции, протекающие с выделением теплоты и света, называют реакциями …. Это
реакции ….
Выберите пропущенные слова (укажи буквы, соответствующие по смыслу пропускам):
а) разложения;
б) горения;
в) эндотермические;
г) экзотермические.
2. Какие схемы можно назвать термохимическими уравнениями реакций?
а) 2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
б) 2 H2 + O2 = 2 H2О + 572 кДж
в) 2 H2(г) + O2(г) = 2 H2О(ж)
г) H2 + O2 —> H2О + 572 кДж
3. Какая запись, соответствует эндотермической реакции?
а) С(тв) + O2(г) = СO2(г) + 394 кДж
б) СаСO3 = СO2 + СаО – 310 кДж
г) Н2 + I2 = 2HI – 52 кДж
д) 3Fe + O2 = Fe3O4 + 118 кДж
4. Установите соответствие между схемой реакции и её типом:
А) СH4(г) + 2 O2(г) = СO2(г) + 2 H2О(ж) + 890 кДж
Б) 2 H2О = 2 H2 + О2 – 572 кДж
1. Эндотермическая реакция
2. Экзотермическая реакция
5. Приведены уравнения реакций:
А. СаО + Н2О = Са(ОН)2
Б. 2HgO = 2Hg + O2
Определите тип, к которому относятся данные реакции.
1) обе реакции экзотермические
3) А – эндотермическая, а Б – экзотермическая
2) обе реакции эндотермические
4) А – экзотермическая, а Б – эндотермическая
24.
Домашнее заданиеучить конспект
Задача
Определите количество теплоты,
которое выделится при образовании 120
г MgO в результате реакции горения
магния, с помощью термохимического
уравнения:
2 Mg + O2 = 2MgO + 1204 кДж


















 Химия
Химия








