Похожие презентации:
https___authedu.mosreg.ru_ej_attachments_files_050_024_301_original__D0_9A_D0_B8_D1_81_D0_BB_D0_BE_D1_80_D0_BE_D0_B4_20_D0_B8_20_D0_BE_D0_B7_D0_BE_D0_BD_202
1. Кислород
2. Химический элемент
2 период VIА группа8О (характеристика элемента)
Изотопы О-16(99,759%), О-17(0, 037%) О-18(0,204%)
В связанном состоянии 85,5%
в свободном состоянии 23,15%
с.о. -2 оксиды
-1 перекиси Н ─ О ─ О ─ Н
0 простые вещества
+1 О2 F2
+2 О F2
3.
Аллотропныемодификации
кислорода
Аллотропы – простые вещества, имеющие одинаковый качественный,
одинаковый или разный количественный состав, разное строение и ,
поэтому, разные свойства.
4.
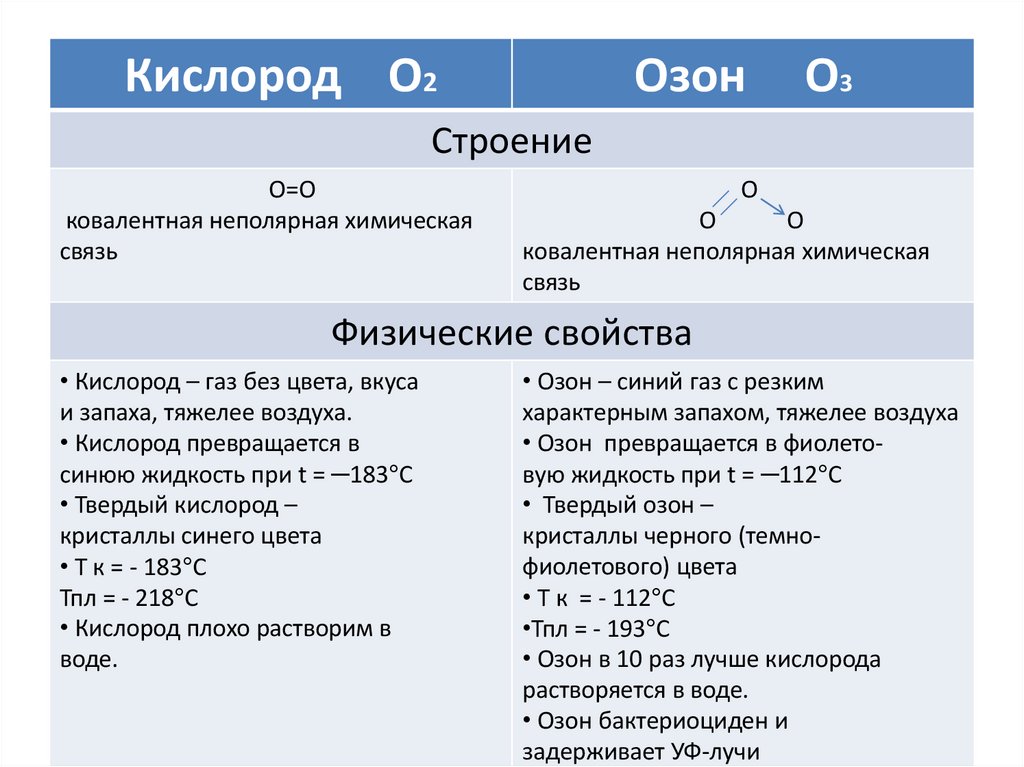
Кислород О2Озон
О3
Строение
О=О
ковалентная неполярная химическая
связь
О
О
О
ковалентная неполярная химическая
связь
Физические свойства
• Кислород – газ без цвета, вкуса
и запаха, тяжелее воздуха.
• Кислород превращается в
синюю жидкость при t = ─183°С
• Твердый кислород –
кристаллы синего цвета
• Т к = - 183°С
Тпл = - 218°С
• Кислород плохо растворим в
воде.
• Озон – синий газ с резким
характерным запахом, тяжелее воздуха
• Озон превращается в фиолетовую жидкость при t = ─112°С
• Твердый озон –
кристаллы черного (темнофиолетового) цвета
• Т к = - 112°С
•Тпл = - 193°С
• Озон в 10 раз лучше кислорода
растворяется в воде.
• Озон бактериоциден и
задерживает УФ-лучи
5. Получение кислорода
а) в промышленности кислород получают ректификацией(фракционной перегонкой) жидкого воздуха, из которого
вначале испаряется более легкокипящий азот (t = -196°С) и
остается в основном кислород.
б) в лаборатории кислород получают разложением:
1)перманганата калия;
2)пероксида водорода.
2KMnO4 = K2MnO4+MnO2+O2
6.
Озон. Получение, свойства.Получение озона:
3О2
2О3
Разрушение красителей
под действием озона.
Качественно озон определяют c помощью реакции:
O3+ 2KI +H2O = I2+ 2KOH +O2
7. Обнаружение
Кислород О21) Воспламенение тлеющей лучины
Озон
О3
Посинение влажной йодокрахмальной
бумаги
O3+ 2KI +H2O = I2+ 2KOH +O2
8. Химические свойства
Кислород О21) Взаимодействие с простыми
веществами:
А) металлами 3Fe + 2O2 = Fe3O4
Озон
О3
Очень сильный окислитель (в реакциях
с озоном всегда выделяется кислород)
2Ag + O3 = Ag2O + O2
Б) неметаллами
4Р0+5О20=2Р2+5О52─
2) Взаимодействие со сложными
веществами
СН4 + 2О2 = СО2 + 2Н2О
2CuS + 3О2 = 2 CuO + 2SО2
O3+ 2KI +H2O = I2+ 2KOH +O2
9. Содержание в природе.
Кислород О2Свободный кислород атмосферы
возник, и уровень его
поддерживается, благодаря
фотосинтезу, осуществляемому
зелеными растениями суши и
Мирового океана.
Взрослый человек за сутки
потребляет 420 л О2 и выделяет 420
л СО2. Примерно за 2000 лет весь
атмосферный кислород проходит
через живые организмы.
Реактивный самолет за 8 ч полета
расходует на сжигание топлива 70–
75 т О2 — столько, сколько за это же
время его могут воспроизвести 25–
50 тыс. га леса. Промышленно
развитые страны уже сейчас
потребляют больше кислорода, чем
получают в результате фотосинтеза.
Озон
О3
Озон составляет 0,000001 % объема
воздуха; 90 % его сосредоточено на
высоте 10–50 км. Общее содержание
О3 в атмосфере составляет 3–4 млрд. т.,
толщина слоя в среднем 2–3 мм (у
экватора около 2, у полюсов около 3
мм). В верхней стратосфере
О3 образуется в основном в
экваториальной зоне, откуда
переносится атмосферными потоками к
полюсам, где накапливается особенно
интенсивно зимой, достигая
максимума к весне; летом содержание
О3 уменьшается, минимум приходится
на осень.
Образование О3 происходит в
результате фотохимических реакций.
10. Действие на человека
Кислород О2Пороговая концентрация кислорода
при кислородной терапии 25–40 %
при атмосферном давлении.
Острые интоксикации могут развиться
при ингаляции дыхательных смесей
с высоким содержанием О2 или
чистого О2. Так, вдыхание смеси c
70–80 % в течение 55 мин вызывало
чувство стеснения в груди,
снижение жизненной емкости
легких. Ингаляция чистого О2 в
течение 15 мин может в отдельных
случаях вызывать головокружение и
рвоту, 6–24 ч — ощущение
стеснения в груди, может
развиваться поражение легких.
Наиболее чувствительны курящие.
Озон
О3
ПДК 0,1мг/м3 - 1й класс опасности.
При воздействии 0,2 мг/м3 и более
наблюдается раздражение слизистой
оболочки глаз; могут развиваться
головные боли, головокружения,
нарушение зрения, чувство сдавления в
груди, загрудинные боли, поражение
органов дыхания
0,2 мг/м3 -настораживание
0,8 мг/м3 - предостережение
1,0 мг/м3 - чрезвычайное положение
1,2 мг/м3 - наносящий значимый
ущерб
11. Применение
Кислород О21. В металлургии для интенсификации
доменных и
сталеплавильных процессов при
выплавке металлов.
2. Для жизнеобеспечения экипажей
космических кораблей
3. Жидкий кислород используют в
качестве окислителя
ракетного топлива
4. Для резки и сварки металлов.
5. В медицине - кислородные
подушки.
6. Взрывные работы
Озон
О3
1. Обеззараживание питьевой воды.
2. Очистка сточных вод.
3. Дезодорации газообразных
выбросов промышленных
предприятий.
4. Для отбеливания тканей и бумаги.
5. В виноделии — для ускорения
старения алкогольных напитков.
6. В медицине — для стерилизации
инструментов и белья и в очень
небольших концентрациях — для
дезодорации и дезинфекции воздуха.
7. Озон также является компонентом
реактивных топлив.
12.
Тест1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
газ, без цвета , запаха и вкуса;
Плохо растворим в воде:
синий газ, с резким запахом;
ядовит;
тяжелее воздуха;
в твердом состоянии имеет синий цвет;
в твердом состоянии – черно-фиолетовый;
образуется при фотосинтезе;
образуется при электрическом разряде;
в лаборатории его получают в озонаторах;
в лаборатории его можно получить разложением марганцовки;
его определяют с помощью тлеющей лучины;
его определяют с помощью йодокрахмальной бумаги;
его в воздухе 21%;
его в воздухе 0,000001%;
является веществом первого класса опасности;
до 40% не опасен для человека. В больших количествах вызывает
интоксикацию.
13. Проверь себя
Кислород: 1, 2, 5, 6, 8, 11, 12, 14, 17.Озон : 3, 4, 5, 7, 9, 10, 13, 15,16.












 Химия
Химия








