Похожие презентации:
Игорь Васьков 2ТЭ24С (1)
1. Презентация по физике на тему: Агрегатное состояние вещества
ИГОРЬ ВАСЬКОВ 2ТЭ24С2. Что такое агрегатное состояние?
Агрегатное состояние вещества — это его физическоесостояние, которое определяется
сочетанием температуры и давления.
От агрегатного состояния зависят ключевые свойства
вещества:
порядок расположения частиц (молекул, атомов, ионов);
характер их движения;
силы взаимодействия между ними;
макроскопические параметры (форма, объём, плотность).
3. Четыре основных состояния:
1.Твёрдое — сохраняет форму и объём (лёд, металл).
2.
Жидкое — сохраняет объём, но принимает форму сосуда (вода, масло).
3.
Газообразное — не сохраняет ни форму, ни объём, заполняет
пространство (воздух, пар).
4.
Плазма — ионизированный газ с свободными зарядами (Солнце, неоновая
лампа).
Важно: одно и то же вещество может переходить из одного агрегатного
состояния в другое при изменении температуры или давления (например,
вода: лёд → вода → пар).
4. Твёрдое состояние: особенности
сохраняет форму и объём;частицы образуют упорядоченную структуру
(кристаллическую решётку) или расположены
хаотично (аморфные тела);
сильные межмолекулярные связи;
частицы лишь колеблются около фиксированных
положений;
почти не сжимается;
имеет температуру плавления (для кристаллов) или
размягчается постепенно (для аморфных тел);
обладает твёрдостью, прочностью, упругостью.
5. Типы твёрдых тел:
1) Кристаллические:имеют упорядоченную структуру — кристаллическую решётку;
частицы расположены регулярно, на определённых расстояниях;
делятся на:
монокристаллы (единый кристалл: алмаз, рубин);
поликристаллы (множество сросшихся мелких кристаллов: гранит, большинство металлов).
2) Аморфные:
нет строгой кристаллической решётки;
частицы расположены хаотично;
нет чёткой температуры плавления (размягчаются постепенно);
примеры: стекло, смола, парафин.
3) Композитные (композиты):
искусственно созданные материалы;
состоят из жёсткой матрицы и кристаллического наполнителя;
позволяют комбинировать свойства (прочность, гибкость и др.).
4) Жидкие кристаллы:
сочетают свойства кристаллов (упорядоченность) и жидкостей (текучесть);
обладают оптической анизотропией (разное прохождение света по направлениям);
типы: нематики, смектики, холестерики.
6. Жидкое состояние: особенности:
1.2.
Не сохраняет форму — принимает форму сосуда, течёт под действием даже малой
силы.
Сохраняет объём — практически не сжимается (мало свободного пространства между
молекулами).
3.
Частицы близко, но без строгого порядка — могут перемещаться, сохраняя близость
друг к другу.
4.
Умеренные силы притяжения — достаточно сильные, чтобы удерживать молекулы рядом,
но слабые, чтобы фиксировать их на месте.
5.
Текучесть — способность свободно менять форму при воздействии силы.
6.
Вязкость — внутреннее сопротивление течению (трение между слоями).
7.
Поверхностное натяжение — «упругая плёнка» на границе с газом (например, капли).
8.
Смачивание — взаимодействие с твёрдыми поверхностями (растекание или
отталкивание).
9.
Определённый температурный интервал существования — при охлаждении
затвердевает, при нагревании испаряется (границы зависят от давления).
7. Свойства жидкостей:
Текучесть — способность принимать форму сосуда и течь поддействием даже малой силы.
Сохранение объёма — практически не сжимается, имеет определённый
объём при заданных условиях.
Малая сжимаемость — из-за плотного расположения молекул.
Вязкость — сопротивление течению (внутреннее трение между слоями).
Поверхностное натяжение — «упругая плёнка» на границе с газом
(например, капли).
Смачивание — взаимодействие с твёрдыми поверхностями (растекание
или отталкивание).
Диффузия — постепенное смешивание с другими жидкостями при
контакте.
Испарение — переход в газообразное состояние с поверхности при
любой температуре.
Зависимость от температуры — расширяется при нагревании,
сжимается при охлаждении (с исключениями, например, вода
от 0 до 4 °C).
Передача давления — по закону Паскаля: давление передаётся во все
точки объёма без изменений.
8. Газообразное состояние: особенности
Газообразное состояние: особенностиНе сохраняет форму и объём — заполняет всё доступное
пространство.
Слабые силы притяжения между частицами — молекулы почти не
взаимодействуют.
Хаотичное движение частиц — молекулы движутся с большими
скоростями, сталкиваются и меняют направление.
Высокая сжимаемость — объём легко уменьшается под
давлением.
Способность к расширению — неограниченно расширяется при
отсутствии ограничений.
Низкая плотность — частицы расположены далеко друг от друга.
Быстрое смешивание — газы легко диффундируют друг в друга.
Отсутствие поверхности — нет границы раздела с окружающим
пространством.
Зависимость от температуры и давления — свойства резко
меняются при изменении T и p (уравнение состояния идеального
газа: pV=M/mRT).
Высокая скорость диффузии — быстрое распространение частиц
по объёму.
9. Идеальный газ: модель
Идеальный газ — упрощённая теоретическая модель реального газа, в которой пренебрегают:размерами молекул (считают их материальными точками);
потенциальной энергией взаимодействия между молекулами;
силами притяжения/отталкивания на расстоянии.
Основные допущения:
Молекулы взаимодействуют только при столкновениях (друг с другом и со стенками сосуда).
Столкновения абсолютно упругие (нет потерь энергии).
Движение молекул подчиняется законам классической механики (Ньютона).
Молекулы движутся хаотично, со скоростями, распределёнными по закону Максвелла.
Количество молекул велико, что позволяет использовать статистические средние (например, среднюю
квадратичную скорость).
Ключевые следствия:
подчиняется уравнению состояния: pV=M/mRT;
хорошо описывает реальные газы при умеренных давлениях и температурах (например, воздух при
нормальных условиях);
не применим при очень высоких давлениях (когда газ сжимается до жидкости) и очень высоких температурах
(когда начинается ионизация).
Зачем нужна модель?
Позволяет:
аналитически решать задачи термодинамики и кинетики;
выводить простые соотношения между давлением, объёмом, температурой и числом частиц;
прогнозировать поведение газов в технических системах (двигатели, компрессоры и др.).
10. Плазма: определение:
Плазма: определение:Плазма — четвёртое агрегатное состояние вещества: полностью или
частично ионизованный газ, состоящий из свободных электронов и
ионов.
Ключевые признаки:
электрически нейтральна в целом (квазинейтральность: суммарный
положительный заряд ионов равен суммарному отрицательному
заряду электронов);
проводит электрический ток;
реагирует на магнитные и электрические поля;
образуется при высоких температурах или под действием сильного
электрического поля (ионизация).
Примеры в природе и технике:
звёзды (включая Солнце);
молния;
ионосфера Земли;
неоновые лампы и плазменные экраны;
плазмотроны и термоядерные установки.
11. Примеры плазмы:
В природе:Солнце и другие звёзды (термоядерная плазма);
молнии и искры статического электричества;
полярные сияния;
ионосфера Земли;
солнечный ветер;
хвосты комет;
межзвёздные туманности и межзвёздная среда.
В технике и быту:
неоновые и люминесцентные лампы;
плазменные экраны (телевизоры, мониторы);
сварочные дуги и плазмотроны (резка/сварка металлов);
газоразрядные лампы и рекламные вывески;
плазменные ракетные двигатели;
установки для термоядерного синтеза (например, ITER);
газовые лазеры (CO₂, гелий-неоновые и др.).
Дополнительно:
пламя огня (низкотемпературная плазма);
огненный шар ядерного взрыва;
плазменные генераторы озона.
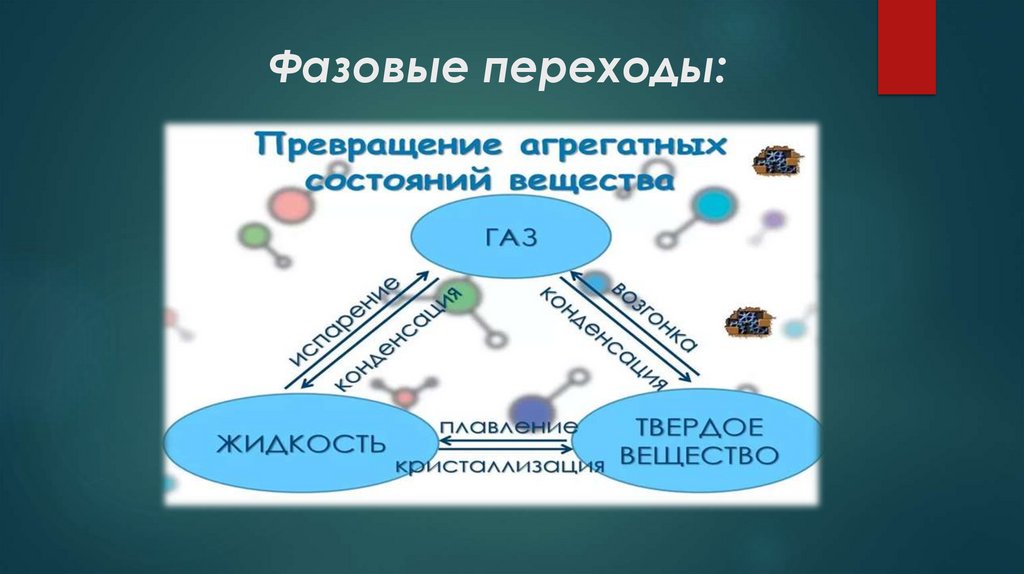
12. Фазовые переходы:
Фазовые переходы:13. Плавление и кристаллизация:
ПлавлениеПереход вещества из твёрдого состояния в жидкое.
Происходит при определённой температуре плавления (зависит от вещества).
Сопровождается поглощением теплоты (энергия идёт на разрушение кристаллической решётки).
Температура вещества не меняется во время процесса.
Формула для расчёта теплоты: Q=λm, где λ — удельная теплота плавления, m — масса.
Кристаллизация (отвердевание)
Переход вещества из жидкого состояния в твёрдое.
Происходит при температуре кристаллизации (равна температуре плавления для данного вещества).
Сопровождается выделением теплоты (энергия высвобождается при образовании кристаллической решётки).
Температура вещества не меняется во время процесса.
Количество выделенной теплоты: Q=−λm (по модулю равно теплоте плавления).
Важно:
Оба процесса — фазовые переходы первого рода (с резким изменением свойств).
Температура остаётся постоянной, пока весь объём вещества не перейдёт в новое состояние.
14. Испарение и конденсация:
Испарение:Переход вещества из жидкого состояния в газообразное (пар) с
поверхности жидкости.
Происходит при любой температуре (не требует достижения точки кипения).
Сопровождается поглощением теплоты (энергия уходит на отрыв молекул
от поверхности).
Приводит к охлаждению жидкости (самые быстрые молекулы уходят,
средняя кинетическая энергия оставшихся падает).
Скорость зависит от: температуры, площади поверхности, влажности
воздуха, ветра.
Примеры: высыхание лужи, испарение пота с кожи, уменьшение уровня воды в
открытом сосуде.
Конденсация
Переход вещества из газообразного состояния в жидкое (пар → жидкость).
Происходит при охлаждении пара или повышении его давления.
Сопровождается выделением теплоты (энергия, затраченная на
испарение, возвращается в окружающую среду).
Протекает на поверхностях или в объёме пара при достижении точки росы.
Примеры: образование росы на траве, капель на холодном стакане, облаков в
атмосфере, запотевание окон
15. Кипение:
Что это:Интенсивный переход жидкости в пар по всему объёму (а не только с поверхности),
сопровождающийся образованием и ростом пузырьков пара.
Ключевые признаки:
происходит при определённой температуре (температуре кипения) для данного вещества и
давления;
температура жидкости не меняется в процессе кипения (энергия идёт на парообразование);
сопровождается образованием пузырьков пара внутри жидкости, которые поднимаются и
лопаются на поверхности.
Отличия от испарения:
кипение — по всему объёму, испарение — только с поверхности;
кипение — только при температуре кипения, испарение — при любой температуре выше
плавления.
Зависимость от давления:
при повышении давления температура кипения растёт;
при понижении давления — снижается (например, в горах вода кипит ниже 100 °C).
Примеры температур кипения (при нормальном давлении):
вода — 100 °C;
спирт — 78 °C;
ртуть — 357 °C.
Формула для расчёта теплоты:
Q=L⋅m,
где Q — количество теплоты, L — удельная теплота парообразования, m — масса жидкости.
16. Сублимация и десублимация:
Сублимация (возгонка)Переход вещества из твёрдого состояния в газообразное минуя жидкую фазу.
Происходит при определённых температуре и давлении (ниже тройной точки вещества).
Сопровождается поглощением теплоты (энергия идёт на преодоление межмолекулярных сил).
Примеры:
сухой лёд (CO₂) превращается в газ при −78,5 °C;
кристаллы йода (I₂) дают фиолетовые пары;
испарение снега и льда при температуре ниже 0 °C.
Десублимация (осаждение, обратная сублимация)
Переход вещества из газообразного состояния в твёрдое без промежуточной жидкой фазы.
Происходит при охлаждении пара или повышении давления.
Сопровождается выделением теплоты.
Примеры:
образование инея на траве и ветках;
морозные узоры на окнах;
выпадение изморози на проводах.
Ключевые особенности обоих процессов:
относятся к фазовым переходам первого рода (с тепловым эффектом);
протекают при условиях, когда вещество находится ниже своей тройной точки (где сосуществуют твёрдая, жидкая и газообразная фазы);
широко применяются в технике и промышленности (сублимационная сушка, очистка веществ, нанесение покрытий).
17. Энергия при фазовых переходах:
Энергия при фазовых переходах:При фазовых переходах вещество поглощает или выделяет энергию (теплоту) без изменения температуры —
энергия идёт на изменение потенциальной энергии частиц (разрыв или образование межмолекулярных связей).
Основные процессы:
Плавление (твёрдое → жидкое)
поглощает теплоту;
энергия идёт на разрушение кристаллической решётки;
количество теплоты: Q=λm, где λ — удельная теплота плавления, m — масса.
Кристаллизация (жидкое → твёрдое)
выделяет теплоту;
энергия высвобождается при образовании решётки;
Q=−λm (по модулю равно теплоте плавления).
Парообразование (кипение/испарение: жидкое → газообразное)
поглощает теплоту;
энергия идёт на преодоление сил сцепления и переход в газ;
количество теплоты: Q=Lm, где L — удельная теплота парообразования.
Конденсация (газообразное → жидкое)
выделяет теплоту;
энергия возвращается в окружающую среду при образовании жидкости;
Q=−Lm (по модулю равно теплоте парообразования).
Сублимация (твёрдое → газообразное)
поглощает теплоту (например, сухой лёд CO₂);
энергия идёт на прямой переход, минуя жидкую фазу.
Десублимация (газообразное → твёрдое) выделяет теплоту (например, образование инея); прямой переход в
твёрдое состояние.
18. Диаграмма состояний:
Диаграмма состояний — графическая модель, показывающая, как объектменяет состояния в ответ на события.
Основные элементы:
Состояние — период жизненного цикла объекта (скруглённый
прямоугольник).
Начальное состояние — старт (сплошной кружок).
Конечное состояние — завершение (кружок в окружности).
Переход — стрелка между состояниями (с указанием события/условия).
Составное состояние — сложное состояние с вложенными
подсостояниями.
Для чего нужна:
описать жизненный цикл объекта (например, заказа, устройства);
показать реакцию на внешние события;
смоделировать поведение системы.
Ключевая особенность: описывает динамику одного объекта.
19. Вода: аномалии:
Расширение при замерзании:лёд менее плотный, чем вода (при 4 °C);
водоёмы не промерзают до дна — лёд «плавает».
Вода: аномалии:
Высокая теплоёмкость:
медленно нагревается и остывает;
стабилизирует климат и температуру организмов.
Высокая теплота испарения:
требует много энергии для перехода в пар;
обеспечивает эффективное охлаждение (например, при потоотделении).
Высокое поверхностное натяжение:
одно из самых высоких среди жидкостей (после ртути);
позволяет воде подниматься по капиллярам (питание растений).
Необычная температурная зависимость плотности:
максимальная плотность при +4 °C;
при охлаждении ниже 4 °C вода расширяется.
Высокая диэлектрическая проницаемость:
отличный растворитель для полярных веществ и солей.
Наличие водородных связей:
объясняет высокие температуры кипения и плавления (по сравнению с аналогами вроде H₂S);
формирует «кластерную» структуру жидкости.
Аномальная вязкость при давлении:
при температурах ниже 30 °C вязкость имеет параболическую зависимость от давления.
Парадокс Мпембы:
нагретая вода иногда замерзает быстрее охлаждённой (не имеет однозначного объяснения).
Высокая теплопроводность:
эффективнее передаёт тепло, чем большинство жидкостей.
20. Примеры фазовых переходов в природе:
Плавление — таяние льда и снега весной.Кристаллизация — образование льда на водоёмах зимой.
Испарение — переход воды с поверхности водоёмов в пар.
Конденсация — образование облаков, росы, запотевание поверхностей.
Кипение — парообразование в гейзерах и горячих источниках.
Сублимация — испарение льда/снега на морозе без таяния; превращение
«сухого льда» (CO₂) в газ.
Десублимация — образование инея, изморози, снежинок из водяного пара.
Ионизация — возникновение молний и полярных сияний (переход в плазму).
Рекомбинация — затухание молниевого канала (возврат из плазмы в газ).
21. Применение в технике
Холодильные установки и кондиционерыиспарение и конденсация хладагента (фреона) для переноса тепла.
Паровые турбины и ТЭЦ
кипение воды → пар → вращение турбины → выработка электроэнергии.
Системы отопления
конденсация пара в радиаторах отдаёт тепло помещению.
Сублимационная сушка (лиофилизация)
удаление влаги из продуктов/фармацевтики через сублимацию льда (сохраняет структуру и питательные вещества).
Тепловые трубки и системы охлаждения электроники
испарение жидкости на горячем конце, конденсация на холодном — эффективный отвод тепла.
Парогенераторы и котлы
контролируемое кипение воды для технологических нужд (стерилизация, нагрев).
Системы кондиционирования воздуха
конденсация влаги из воздуха (осушение).
Криогенные технологии
сжижение газов (азот, кислород) при низких температурах для хранения и транспортировки.
Термостаты и датчики
использование фазовых переходов веществ для контроля температуры (например, воск в терморегуляторах).
3D-печать и литейные процессы
плавление пластика/металла → формирование изделия → кристаллизация.
22. Металлургия и обработка материалов:
Основные процессы:плавление (извлечение металла из руды);
кристаллизация (затвердевание отливок);
обжиг (подготовка руды).
Способы получения металлов:
пирометаллургия (высокотемпературные процессы);
гидрометаллургия (извлечение из растворов);
электролиз (получение чистых металлов).
Методы обработки:
прокатка (листы, профили, трубы);
ковка и штамповка (придание формы);
волочение (проволока);
термическая обработка (закалка, отжиг).
Ключевые продукты:
чёрные металлы (чугун, сталь);
цветные металлы (Al, Cu, Ni, Ti);
сплавы с заданными свойствами.
Цели:
повышение прочности и износостойкости;
улучшение коррозионной стойкости;
очистка от примесей;
получение нужной формы и размеров.
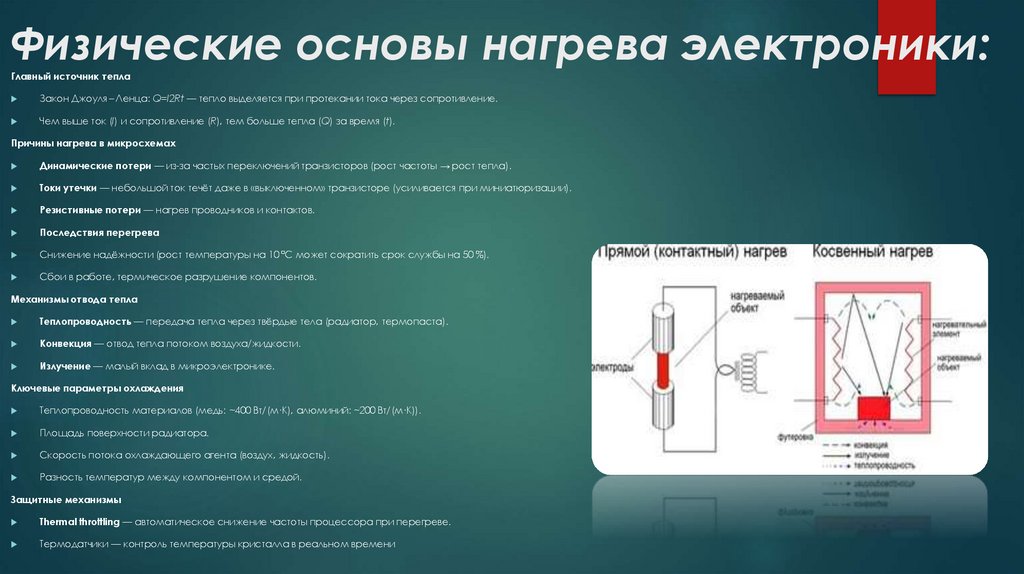
23. Физические основы нагрева электроники:
Главный источник теплаЗакон Джоуля – Ленца: Q=I2Rt — тепло выделяется при протекании тока через сопротивление.
Чем выше ток (I) и сопротивление (R), тем больше тепла (Q) за время (t).
Причины нагрева в микросхемах
Динамические потери — из-за частых переключений транзисторов (рост частоты → рост тепла).
Токи утечки — небольшой ток течёт даже в «выключенном» транзисторе (усиливается при миниатюризации).
Резистивные потери — нагрев проводников и контактов.
Последствия перегрева
Снижение надёжности (рост температуры на 10 °C может сократить срок службы на 50 %).
Сбои в работе, термическое разрушение компонентов.
Механизмы отвода тепла
Теплопроводность — передача тепла через твёрдые тела (радиатор, термопаста).
Конвекция — отвод тепла потоком воздуха/жидкости.
Излучение — малый вклад в микроэлектронике.
Ключевые параметры охлаждения
Теплопроводность материалов (медь: ~400 Вт/(м·К), алюминий: ~200 Вт/(м·К)).
Площадь поверхности радиатора.
Скорость потока охлаждающего агента (воздух, жидкость).
Разность температур между компонентом и средой.
Защитные механизмы
Thermal throttling — автоматическое снижение частоты процессора при перегреве.
Термодатчики — контроль температуры кристалла в реальном времени
24. Микроскопическая картина агрегатных состояний
Твёрдое тело:частицы в узлах кристаллической/аморфной сетки;
сильные связи, малые колебания;
дальний порядок (кристаллы) или ближний (аморфные).
Жидкость:
частицы близко, но без строгой сетки;
слабые временные связи, перескоки;
ближний порядок сохраняется.
частицы далеко, движутся хаотично;
почти нет взаимодействий между столкновениями;
заполняет любой объём.
Газ:
Плазма:
ионизованные частицы (ионы + электроны);
коллективное взаимодействие, проводимость;
светится при рекомбинации.
25. Необычные фазовые явления
Сверхкритические флюиды (выше критической точки):свойства газа и жидкости одновременно;
высокая растворяющая способность;
применение: экстракция кофеина, очистка микросхем.
Жидкие кристаллы:
промежуточное состояние между жидкостью и кристаллом;
анизотропия свойств (зависит от направления);
основа ЖК-дисплеев.
Квантовые конденсаты (при ~nK):
Бозе-Эйнштейновский конденсат — все частицы в одном квантовом состоянии;
сверхтекучесть гелия-4 (нулевое вязкость).
26. Кинетика фазовых переходов:
Скорость перехода зависит от:перепада температур (градиент);
площади поверхности (например, испарение с плёнки);
наличия примесей/центров кристаллизации.
Гистерезис — задержка перехода (например, переохлаждённая вода
остаётся жидкой ниже 0 °C).
Зародышеобразование — старт кристаллизации/конденсации на
дефектах или частицах.
Метастабильные состояния:
перегретая жидкость (не кипит выше 100 °C при чистом нагреве);
переохлаждённый пар (не конденсируется при высокой влажности).
Практическое значение: управление кристаллизацией в металлургии,
предотвращение обледенения.
27. Заключение:
Главное о фазовых переходах:Это изменения агрегатного состояния вещества (твёрдое ⇄ жидкое ⇄ газообразное ⇄ плазма) при изменении температуры
и давления.
В момент перехода температура постоянна: энергия идёт на перестройку связей, а не на нагрев.
Каждый переход описывается точными физическими законами и формулами (например, Q=λm для плавления).
Почему это важно:
В природе — объясняют круговорот воды, образование облаков, молнии, процессы в звёздах.
В технике — лежат в основе работы:
холодильных установок и кондиционеров;
паровых турбин и электростанций;
систем охлаждения электроники;
технологий сублимационной сушки и ректификации.
Что даёт знание о фазовых переходах:
возможность прогнозировать поведение веществ в разных условиях;
проектирование эффективных технологических процессов;
создание новых материалов и устройств (например, жидких кристаллов, сверхкритических флюидов);
повышение энергоэффективности и надёжности техники.
Итог:
Фазовые переходы — фундаментальное явление, связывающее фундаментальную физику и прикладные технологии.
Понимание их механизмов позволяет управлять материей и развивать современные отрасли науки и промышленности.

























 Физика
Физика








