Похожие презентации:
Хим. теңдік 2020
1. Химиялық тепе-теңдік
Ле-Шателье қағидасы2. Жоспар
Қайтымды және қайтымсыз реакцияларХимиялық тепе-теңдік және оның
константасы
Химиялық тепе-теңдіктің ығысуы
Ле-Шателье қағидасы
3.
Химиялық кинетикаХимиялық кинетика – химиялық реакцияның жылдамдығын,
реакцияның жүру механизмін және оған әртүрлі факторлардың
әсерін зерттейтін ғылым саласы
4. Химиялық реакцияның жылдамдығы
Химиялықреакцияның
жылдамдығы
дегеніміз - белгілі бір уақытта әрекеттесетін
заттар мөлшерінің өзгеруін айтады.
5. Қайтымды және қайтымсыз реакциялар
Қайтымды реакциялар – бір мезгілдеқарама- қарсы екі бағытта орындалатын
реакциялар.
Қайтымсыз реакциялар – реакцияға
түсуші заттардың біреуі толық әрекеттесіп,
бір ғана бағытта орындалатын реакциялар.
6. Қайтымды және қайтымсыз реакциялар
Қайтымсыз реакциялардың нәтижесінде:- тұнба түседі;
- газ бөлінеді;
- әлсіз электролит түзіледі;
- көп мөлшерде энергия бөлінеді;
- комплексті қосылыс пайда болады.
7. Қайтымды және қайтымсыз реакциялар
8.
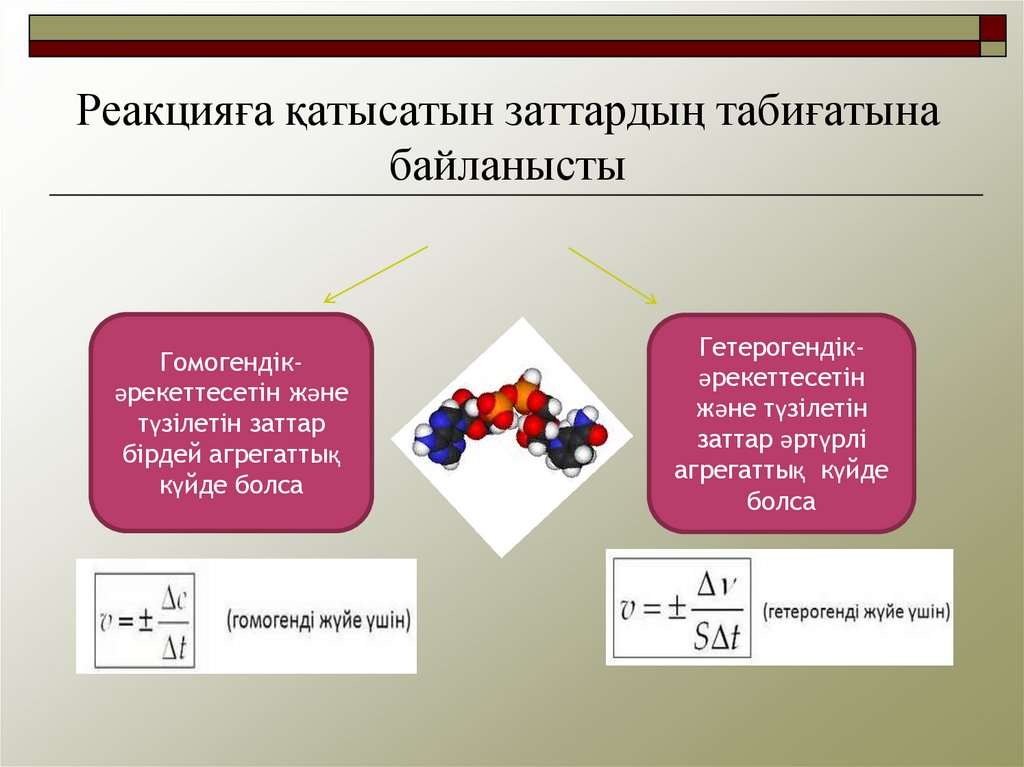
Реакцияға қатысатын заттардың табиғатынабайланысты
Гомогендікәрекеттесетін және
түзілетін заттар
бірдей агрегаттық
күйде болса
Гетерогендікәрекеттесетін
және түзілетін
заттар әртүрлі
агрегаттық күйде
болса
9. Әсер ететін факторлар
10. Әрекеттесуші заттардың табиғаты
11. Концентрацияның әсері
Химиялық реакциялар тез жүруі үшін түйісетін молекулалар саны көп болуыкерек, яғни концентрацияны өсіру керек. Реакцияның жылдамдығына
әрекеттесуші заттардың концентрацияларының әсерін зерттеген Норвегияның екі
ғалымы Гульдберг және Вааге 1868 жылы мынадай қорытындыға келген:
химиялық
реакцияның
жылдамдығы
реакцияласушы
заттардың
концентрацияларының көбейтіндісіне тура пропорционал болады, оны
әрекеттесуші массалар заңы деп атайды.
aA + вВ = сС + dD реакциясы үшін
V= k[A]a[B] b тура реакция
V= k[C]c [D]d кері реакция
k–жылдамдық константасы, олар әсер етуші заттар табиғатына, температураға тәуелді,
бірақ концентрацияға тәуелді емес. Егер [А] = [В] = 1, онда V=K жылдамдық
константаға тең болады. Екі теңдеу де бірдей химиялық реакция жылдамдығы теңдеуі,
сондықтан кинетикалық теңдеу деп аталады.
V= k[A]a[B] b = k[C]c [D]d
мұнда V - химиялық реакция жылдамдығы;
[A]a = [B]b=[C]c =[D]d-реагенттер және өнімдер концентрациялары;
12.
Нақты мысалдар қарастырайық:а) гомогендік жүйе, фаза бір агрегаттық күйде болса
N2 (г) + 3H2 (г) = 2NH3 (г); V=k [N2][H2]3.
Заттардың агрегаттық күйін белгілеу:
қ, к –қатты, кристалл;
г – газ тәрізді;
с – сұйық;
п – плазмалы.
б) гетерогендік жүйе, фазасы әртүрлі агрегаттық күйде болса:
CaO(к)+CO2(г)=CaCO3(к);
V= KCO2;
немесе
V=K[CO2]
Егер жүйеде қатты зат болса, олардың концентрациялары
химиялық реакциялар жылдамдығы тұрақтысына (К) есептеледі де,
жылдамдық теңдеуінде жазылмайды, ал сұйық зат және газдардың
концентрациясы жазылады да, олардың коэффициенттері дәреже
түрінде жазылады.
13. Химиялық тепе-теңдік және оның константасы
Химиялық тепе-теңдік – бір мезгілдетура және кері бағытта орындалатын
реакция жылдамдықтарының теңесуі.
Химиялық динамикалық тепе-теңдік –
тура және кері бағыттағы реакциялар
тоқтамайды.
Химиялық тепе-теңдіктің константасы
– химиялық тепе-теңдіктің сандық
сипаттамасы.
14. Химиялық тепе-теңдіктің константасы
15. Температураның әсері
16.
17. Қысымның әсері
Қысымды 3-есе арттырсақ жылдамдыққалай өзгереді?
V= k [3CO]2 * [3O2]
V= 27 есе артады.
қ
Қысымды 5 есе арттырсақ
жылдамдық қаалй өзгереді?
V= k [Р]4 * [3O2]5
V= 243 есе артады.
18. Катализатордың әсері
Катализатор деп, реакция жылдамдығын өзгертетін және реакциянәтижесінде өзгеріссіз қалатын заттарды атайды.
Егер катализатор реакция жылдамдығын арттыратын болса, оны
оң, ал баяулататын болса теріс катализатор деп атайды.
Егер катализатор реакция барысында түзілсе, оны автокатализ деп
атайды.
Кейбір заттар катализатордың әсер етуіне кедергі жасайды, ондай
заттарды ингибиторлар немесе катализатор улары дейді.
Ал кейбір заттар өздері катализатор болмаса да, катализатордың
активтілігін арттырады, ондай заттарды активаторлар дейді
19. Химиялық тепе-теңдікке әсер ететін факторлар
Әрекеттесуші заттар мен өнімдердіңконцентрациясы;
Температура;
Қысым
20. Химиялық тепе-теңдіктің ығысуы
Ле-Шателье қағидасы:Егер тепе-теңдіктегі жүйеге сырттан әсер
жасалатын болса (конц., температура,
қысым өзгеретін болса), тепе-теңдік осы
әсерді жоятын жаққа қарай ығысады.
заттардың концентрациясы;
температура;
қысым.
21. Химиялық тепе-теңдікке концентрацияның әсері
Әрекеттесуші заттардың концентрациясыкөбейетін болса, тепе-теңдік өнімдерге
қарай ығысады, ал азаятын болса, тепетеңдік әрекеттесуші заттардың өздеріне
қарай ығысады;
Өнімдердің
концентрациясы көбейетін
болса, тепе-теңдік әрекеттесуші заттарға
қарай ығысады, ал азаятын болса, тепетеңдік
өнімдердің
өздеріне
қарай
ығысады;
22. Химиялық тепе-теңдікке температураның әсері
Температура жоғарылайтын болса, тепетеңдік энергияны сіңіре жүретінэндотермиялық процеске қарай ығысады;
Температура төмендейтін болса, тепетеңдік энергияны бөле жүретін
экзотермиялық процеске қарай ығысады;
23. Химиялық тепе-теңдікке қысымның әсері
Жүйеде қысым жоғарылайтын болса, тепетеңдік көлем аз жаққа қарай ығысады;Жүйеде қысым төмендейтін болса, тепетеңдік көлем көп жаққа қарай ығысады.
24. Мысалы:
N2 + 3H2 ⇆ 2NH3 - ∆Н[N2], [H2] жоғарыласа, оңға қарай, төмендесе,
солға қарай ығысады;
[NH3] жоғарыласа, солға қарай,
төмендесе, оңға қарай ығысады;
Температура жоғарыласа, солға қарай,
төмендесе, оңға қарай ығысады;
Қысым жоғарласа, оңға қарай (4V→2V),
төмендесе, солға қарай (4V←2V) ығысады;
25. Қысымның әсерін есептеу
N2 + 3H2 ⇆ 2NH3 - ∆Н1моль + 3моль ⇆ 2моль
4 моль ⇆ 2 моль
4V → 2V
26. Ұсынылатын әдебиеттер
.Бірімжанов Б. Нұрахметов Жалпы химия.- Алматы, 2012.
1
2.
Глинка Н.Л. Общая химия. -Л., 2005.
3.
Ахметов Н.С. Неорганическая химия. – М., 2005.
4.
Некрасов Б.В. Учебник общей химии. – М. 12002.
5.
Глинка Н.Л. Задачи и упражнения по общей химии. – Л., 2007.
6.
Коровин Н.В. Лабораторные работы по химии. – М., 2001. – 256 с.
7.
Жакупова А.С. Жалпы химия бойынша практикум, К: ҚарМТУ-2010ж.
8.
Угай Я.А. Общая и неорганическая химия. – М., 2000. – 528 с.
9.
Паничев С.А. Химия. Основные понятия и термины. – М., 2000. – 544 с.
10. Коровин Н.В. Общая химия. – М., 2000. – 560 с.
11. Химия. Справочное издание. – М., 2000. – 648 с.
12. Хомченко И.Г. Общая химия. – М., 1999.

























 Химия
Химия








