Похожие презентации:
электролиз 2022
1.
Қарағанды ТехникалықУниверситеті
Пәні: «Химия»
Тақырыбы: Электрлі-химиялық процестер
Дайындаған: Аға оқытушы Карилхан А.
2022 ж Қарағанды
2. Жоспар
1.Электрхимия түсінігі;2. Электролиз
3. Қатты электролиттердің электрліхимиясы;
4.Катодта жүретін процестер;
5.Анодта жүретін процестер;
6.Электролиз заңдары;
7.Электрхимия қолданылуы, осы саладағы қазіргі
кездегі теориялық және қолданбалы жетістіктері.
3. Электрохимия электрохимиялық процестерді зерттейтін химия ғылымының бір саласы
Электрохимия жаңа дамып жатқан ғылым. Тек екі ғасыр бұрын электр тогыныңтұздардың сулы ерітінділері арқылы өткен кезде жаңа заттар пайда болатын
химиялық алмасулар жүретіні анықталды.
Электрохимия ғылым ретінде ХVIII және XIX ғасырларда шет елдерде қалыптасты.
Тек сол кезде шешімі электрохимия теориясын жаңа дәрежеге көтерген болатын
проблемалар туындады. 1799 ж итальян физигі А.Вольттің «вольттік
бағанасының»- адамзат тарихындағы бірінші тоқ көзінің пайда болуы және итальян
физиологы Л.Гальванидің тәжірибелері электрохимияның ғылым ретінде дамуына
бастапқы түрткі болды.
Тек өткен ғасырдың басында ғана заттардың ерітінділері мен балқымаларында
болатын электрохимиялық процестерді зерттеудің ғылымдық бағытыэлектрохимия пайда болды.
Электрохимияны 70-ші жылдардың соңында ғана екі бөлімге бөле бастады: ионика
және электродика. Ионика- электр өрісінің әсерінен зарядталған бөлшектердің
жүрісін және электрөткізгіштік құбылысын зерттейтін бөлім, ал электродика
электрод ерітінді (балқыма) шегі арқылы өтетін электр тогының электродтар
бетінде жүретін құбылыстарды зерттейді.
3
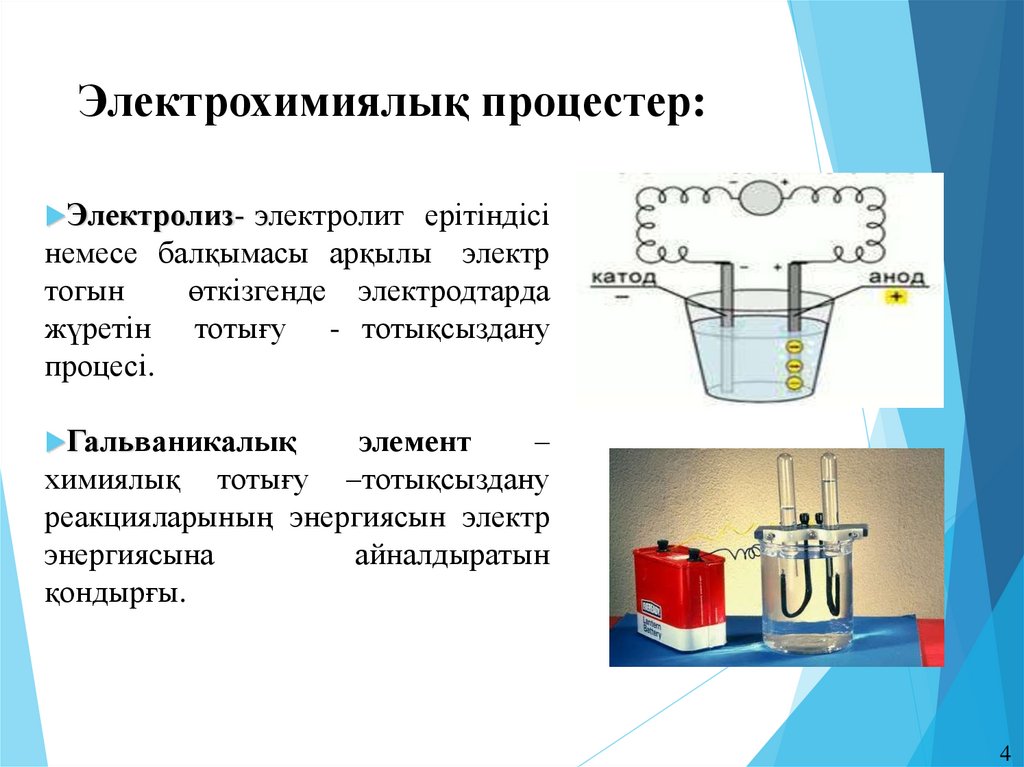
4. Электрохимиялық процестер:
Электролиз- электролитерітіндісі
немесе балқымасы арқылы электр
тогын
өткізгенде электродтарда
жүретін тотығу - тотықсыздану
процесі.
Гальваникалық
элемент
–
химиялық тотығу –тотықсыздану
реакцияларының энергиясын электр
энергиясына
айналдыратын
қондырғы.
4
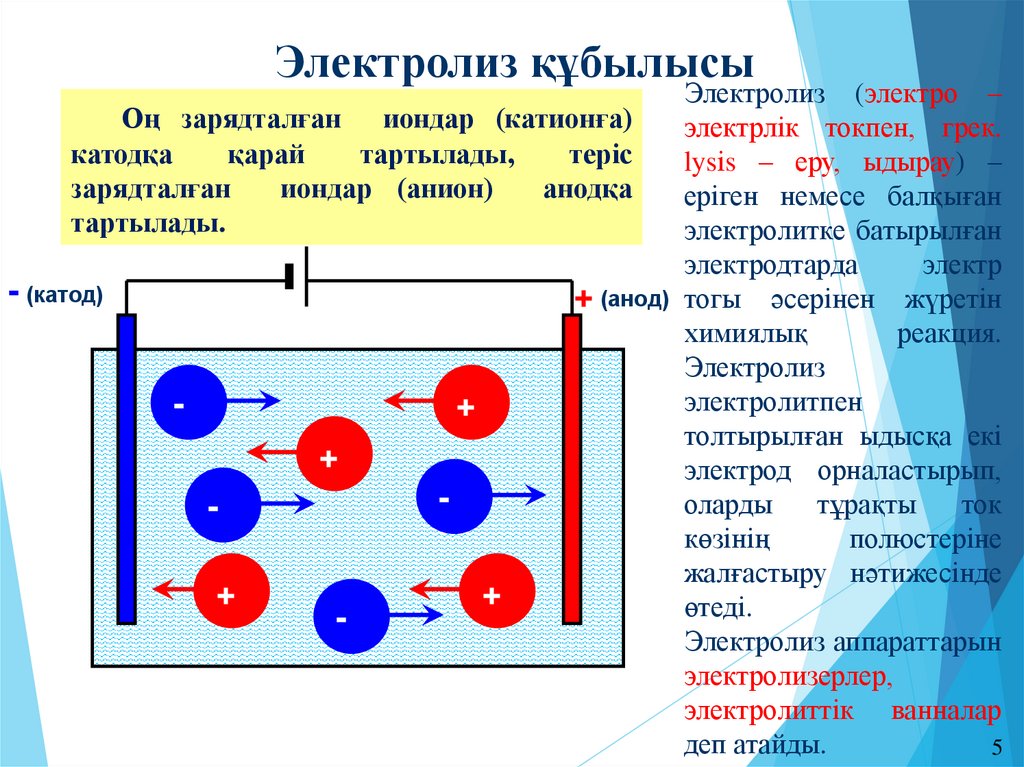
5.
Электролиз құбылысыЭлектролиз (электро –
Оң зарядталған иондар (катионға)
электрлік токпен, грек.
катодқа
қарай
тартылады,
теріс
lysіs – еру, ыдырау) –
зарядталған
иондар (анион)
анодқа
еріген немесе балқыған
тартылады.
электролитке батырылған
электродтарда
электр
- (катод)
+ (анод) тогы әсерінен жүретін
химиялық
реакция.
Электролиз
электролитпен
+
толтырылған ыдысқа екі
+
электрод орналастырып,
оларды
тұрақты
ток
көзінің
полюстеріне
жалғастыру нәтижесінде
+
+
өтеді.
Электролиз аппараттарын
электролизерлер,
электролиттік ванналар
деп атайды.
5
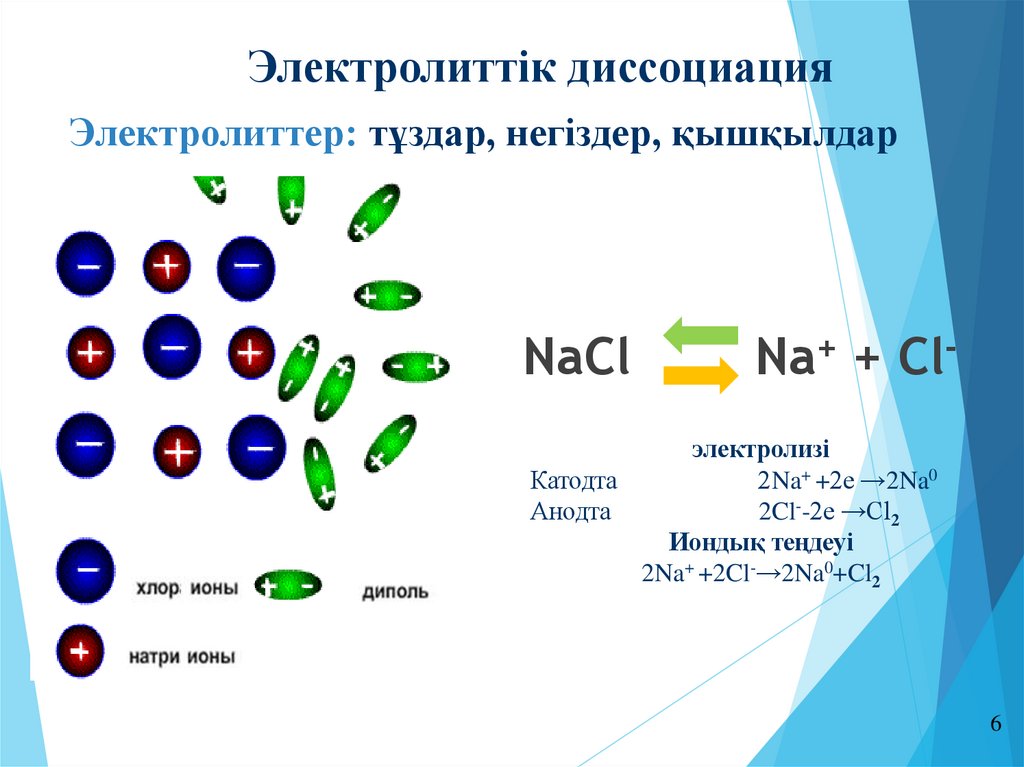
6.
Электролиттік диссоциацияЭлектролиттер: тұздар, негіздер, қышқылдар
NaCl
Na+ + Cl-
электролизі
Катодта
2Na+ +2е →2Na0
Анодта
2Cl--2е →Cl2
Иондық теңдеуі
2Na+ +2Cl-→2Na0+Cl2
6
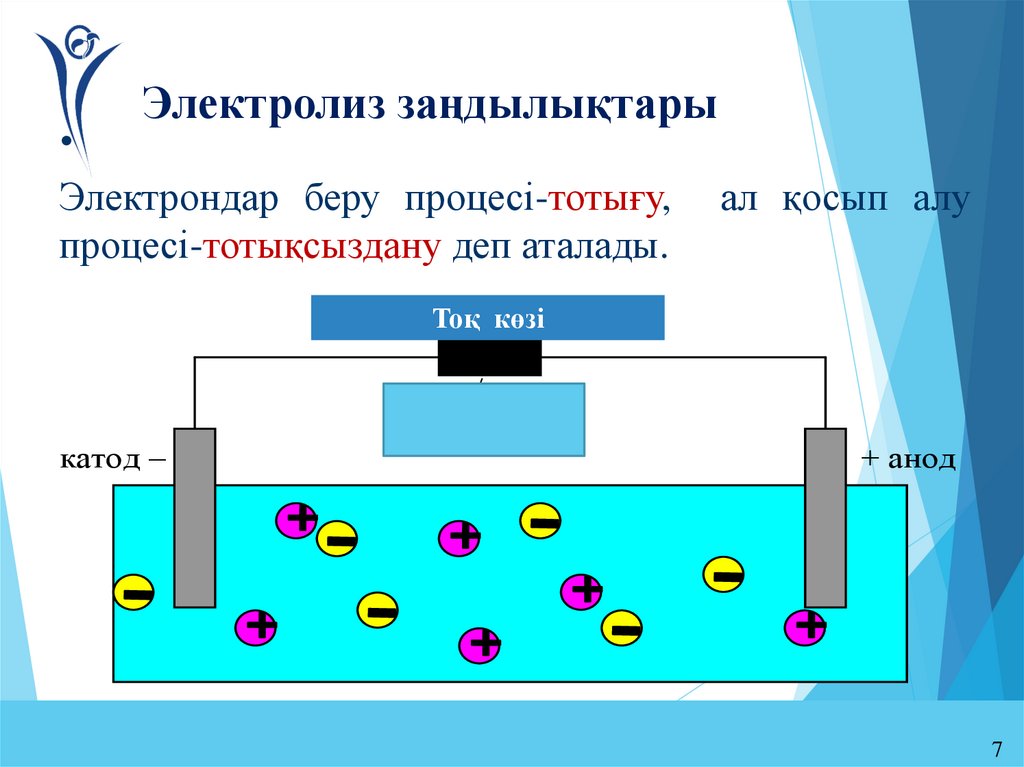
7. Электролиз заңдылықтары
Электрондар беру процесі-тотығу,
процесі-тотықсыздану деп аталады.
ал қосып алу
Тоқ көзі
источник
тока
вкл/выкл
катод –
+ анод
7
8.
Электролиздің бірінші заңыЭлектролиз кезінде электродтарда
бөлінетін заттардың массасы
электролит арқылы өткен ток
мөлшеріне тура пропорционал.
m kQ Q It
Майкл Фарадей (1791 – 1867)
1834 жылы ағылшын
ғалымы Майкл Фарадей
электролизді зерттеп, оның
заңдылықтарын ашты.
«Электролит», «электрод»,
«анод», «катод» терминдерін
енгізді.
Э
K
F
m k I t
k – заттың электрохимиялық
эквиваленті
(электролит арқылы 1Кл заряд
өткен кезде бөлініп шыққан
заттың массасына тең)
Ғ-Фарадей тұрақтысы, 96500К.
8
9.
Электролиздің екінші заңыЭлектр тогының бірдей мөлшерінде (электролит арқылы өткен электр
заряды) электролиз кезінде бөлінген заттардың массасы оның химиялық
эквиваленттеріне тура пропорционалды болады.
M1 M 2
m1 : m2 k1 : k 2
:
z1 z 2
M – бөлінген заттың массасы
k – электрохимиялық эквивалент
М – заттың молярлық массасы
z –заттың валенттілігі
Барлық электролиттер үшін бірдей 1 моль затты бөлуге
арналған заряд. Ол F Фарадей саны деп аталады.
F N A e 9.65 104 Кл / моль
Электрохимиялық эквивалент пен
Фарадей саны бір-бірімен байланысты.
M
k
zF
9
10.
Тұздар балқымасының электролизіKNO3→K++NO3К(-): К+ +1е→К0
A(+): 2NO3-→2NO2 +O2
___________________
2KNO3→2K0+2NO2 +O2
Na2 SO4 →2Na++SO42К(-): 2Na+ +2е→2Na0
A(+): 2SO42- →2SO30 +O2
_________________________________
2Na2 SO4 →4Na0+ 2SO30 +O2
10
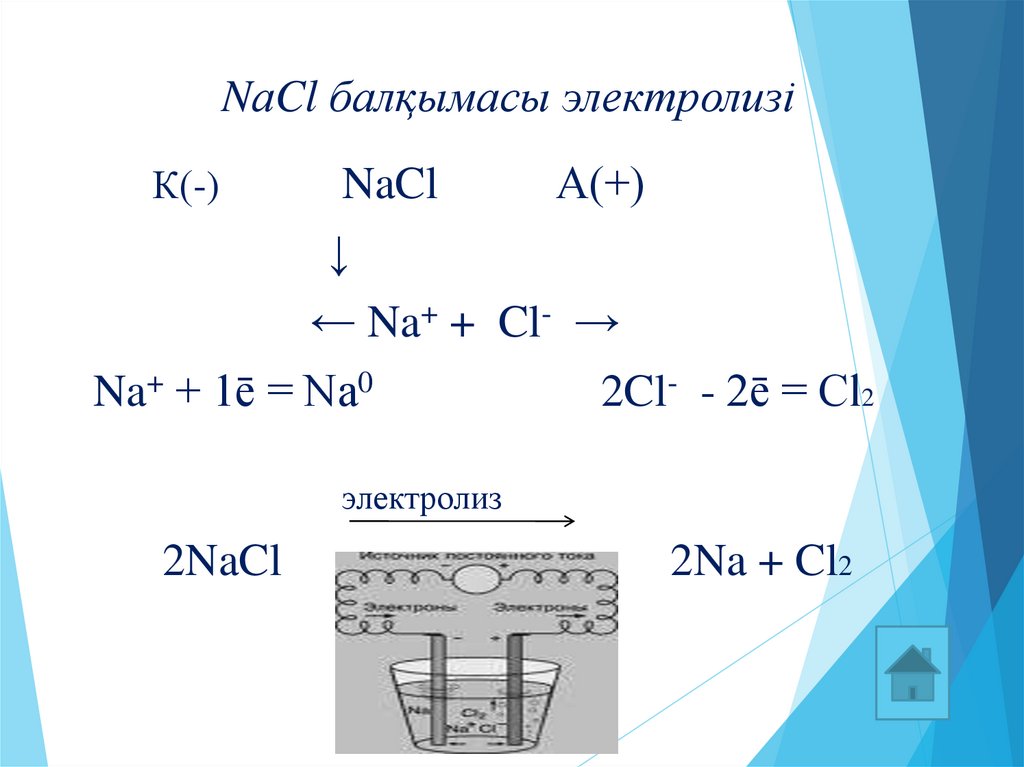
11. NаCl балқымасы электролизі
К(-)NaCl
А(+)
↓
← Na+ + Cl- →
Na+ + 1ē = Na0
2Cl- - 2ē = Cl2
электролиз
2NaCl
2Na + Cl2
11
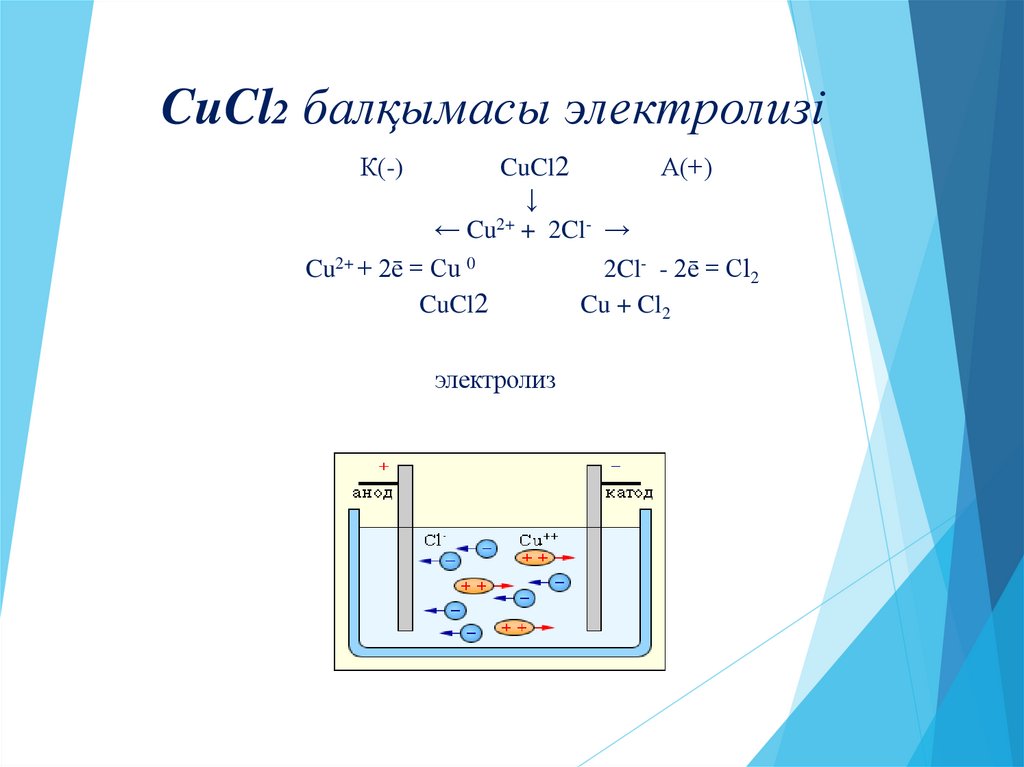
12. CuCl2 балқымасы электролизі
К(-)CuCl2
↓
← Cu2+ + 2Cl- →
Cu2+ + 2ē = Cu 0
CuCl2
А(+)
2Cl- - 2ē = Cl2
Cu + Cl2
электролиз
12
13. Сулы ерітінділердегі электролиттердің катодтағы процестері
Металдардың электрохимиялық кернеу қатарыLi, K, Ba, Ca, Na,
Mg, Al
Mn, Zn, Cr, Fe,
Cd, Co, Ni
Су молекуласының
тотықсыздануы:
2H2O + 2e- = Н2↑+
ОН-
Екі процесс:
1) Men+ + ne- = Me0
2) 2H2O + 2e- = Н2↑ + 2ОН-
Н Cu, Hg, Ag, Pt, Au
Металл
катионының
тотықсыздануы:
Men+ + ne- = Me0
14. Сулы ерітінділердегі электролиттердің анодтағы процестері
Қышқыл қалдығы анионы АmОттексіз- 2-.
(Cl , Br , I , S .т.б.,
F басқа)
Оттекті
2( ОН , SO4 , NO3 ,
2CO3 ..т.б.) және F
Анионның тотығуы
(фторидтен басқа)
Қышқыл және бейтарап
ортадағы – су молекуласының
тотығуы:
2H2O – 4e- = O2↑ + 4H+
Сілті ортада:
4OH- - 4e- = O2↑ + 2H2O
Аm- - me- = А0
15. Аниондардың тотықсыздандыру белсенділігінің өзгеруі
Аниондар тотығу қабілетіне қарай келесі ретпенорналасады:
I-, Br-, S2-, Cl-, OH-, SO42-, NO3-, FТотықсыздандыру белсенділігі төмендейді
16. Мыс хлориді (II) ерітіндісінің электролизі
CuCl2(-)Катод
Анод(+)
тотығу:
2Cl- - 2е- = Cl2↑
Cu2+ + 2Cl-
тотықсыздану:
Cu2+ +2е- = Сu0
қосынды: CuCl2
Электр . ток
Сu + Cl2
Қорытынды: осы тұз ерітіндісінің электролизі оның балқымасының
электролизінен ерекшеленбейді.
17. Мыс сульфаты (II) ерітіндісінің электролизі
CuSO4
(-)Катод
Cu2+ + SO42-
Анод(+)
мыс ионының
су молекуласының
тотықсыздануы:
H2SO4
тотығуы:
Cu2+ + 2е- = Сu0
2H2O – 4e- = O2↑ + 4H+
Коэффициенттерді таңдау үшін электронды-иондық баланс әдісін
қолданамыз:
К(-) Cu2+ + 2е- = Сu0
2
А(+) 2H2O – 4e- = O2↑ + 4H+ 1
Қосынды: 2CuSO4 + 2H2O электр. ток 2Cu + O2↑ + 2H2SO4
18. Кали иодиді ерітіндісінің электролизі
KI(-)Катод
K+
+
I-
Анод(+)
KOH
су молекуласының тотықсыздануы
2H2O + 2e- = Н2↑ + 2ОН-
иодид анионының тотығуы
I- - e- = I0 ; 2I = I2
Коэффициенттерді таңдау үшін электронды-иондық баланс әдісін қолданамыз:
К(-) 2H2O + 2e- = Н2↑ + 2ОН- 1
А(+) 2I- - 2e- = I20 ;
1
Қосынды: : 2KI + 2H2O электр. ток Н2↑ + I2 + 2KOH
19. Натрий сульфаты(II) ерітіндісінің электролизі
Na SO2
(-)Катод
4
2Na+ + SO42-
су молекуласының
тотықсыздануы
су молекуласының
тотығуы
2H2O + 2e- = Н2↑ + 2ОНсреда
Анод(+)
2H2O – 4e- = O2↑ + 4H+
сілтілік ортада
кқышқылдық орта
электр. ток
Қорытынды: 2H2O
2H2↑ + O2↑
Қорытынды: бұл тұздың электролизі судың ыдырауына дейін азаяды;
электр өткізгіштігін арттыру үшін тұз қажет, өйткені таза су өте әлсіз
электролит болып табылады.
20.
Қатты электролиттерҚатты электролиттердің жіктелуі
Тбалқу < 500 К
Органикалық тұздардың төмен
температурадағы балқымалары
Бейорганикалық тұздардың
орташа температурадағы
балқымалары
500 К < Тбалқу < 1300 К
Оксидтердің жоғарғы
температурадағы балқымалары
1300 К < Тбалқу < 2300 К
11
21.
Төмен температурадағы балқымаларИондық сұйықтықтар
Мысалы: алюминий хлориді және органикалық
хлоридтер қоспасы
AlCI3 + RCI3
R+ - органикалық катион
AlCI3 + CI- →AlCI4RCI → R+ + CI-
12
22.
Орташа температурадағы балқымаларБейорганикалық тұздарды балқытқанда көлемі
белгілі бір мөлшерде ұлғаяды, бірақ түзілген
балқымадағы ион аралық арақашықтық қатты
тұздардан қарағанда аз болады.
а) идеальды кристалл торы;
б) сәйкес балқыма торы.
13
23.
Орташа температурадағы балқымаларБейорганикалық тұздардың электрөткізгіштігі
және химиялық байланыс типі.
Иондық байланыспен байланысқан тұздар:
электрөткізгіштігі жоғары
Мысалы, сілтілік және жер сілтілік металдар
хлоридтері;
Ковалентті байланыспен байланысқан тұздар:
электрөткізгіштігі өте төмен
Мысалы, бейметалдар хлоридтері.
14
24.
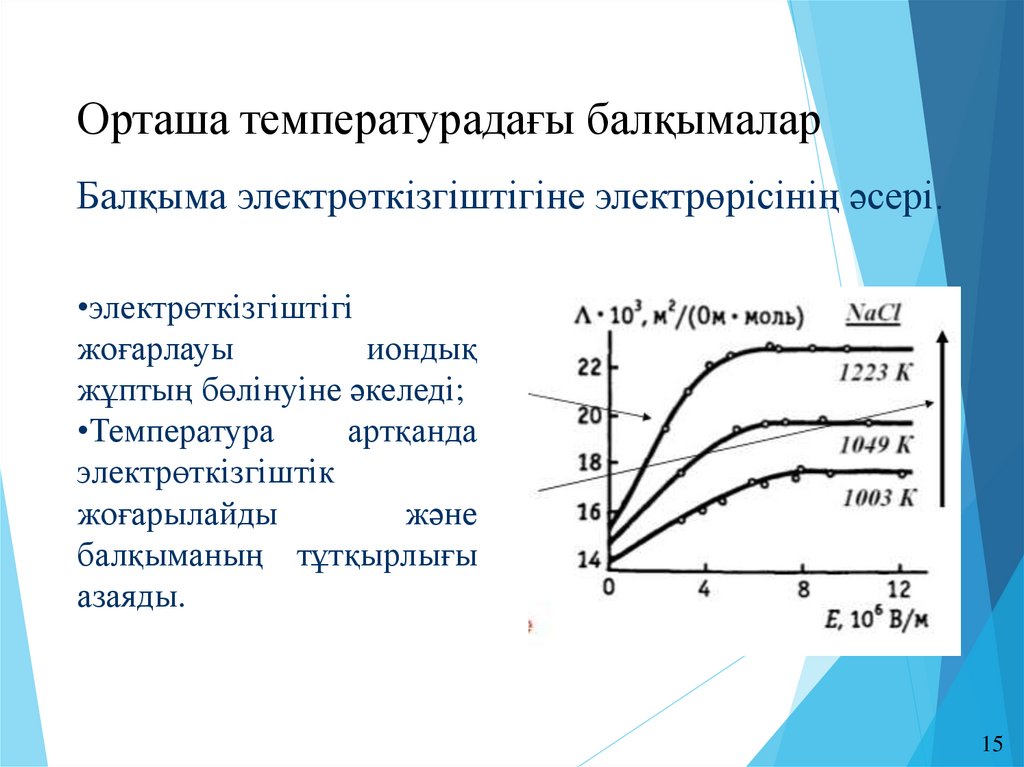
Орташа температурадағы балқымаларБалқыма электрөткізгіштігіне электрөрісінің әсері.
•электрөткізгіштігі
жоғарлауы
иондық
жұптың бөлінуіне әкеледі;
•Температура
артқанда
электрөткізгіштік
жоғарылайды
және
балқыманың тұтқырлығы
азаяды.
15
25.
Жоғарғы температурадағы балқымалар• Кең таралғандары –силикатты жүйелер МхОу, SipОq
• Дискретті полианионды құрылым гипотезасы
Берік үшөлшемді құрылым –
өте нашар электрөткізгіштік
және жоғарғы тұтқырлық
үшөлшемді құрылымның
бұзылуы, силикатты
полианион түзіледі,
SipОq2жоғары электрөткізгіштік
16
26.
Қатты электролиттер• Иондық кристалдар
• Эффект: Температура артқанда иондық және
коваленттік байланысты қатты кристалдық
заттардың электрөткізгіштік күрт жоғарылайды.
• Себебі: кристалл дефектілігінің өсуі.
17
27.
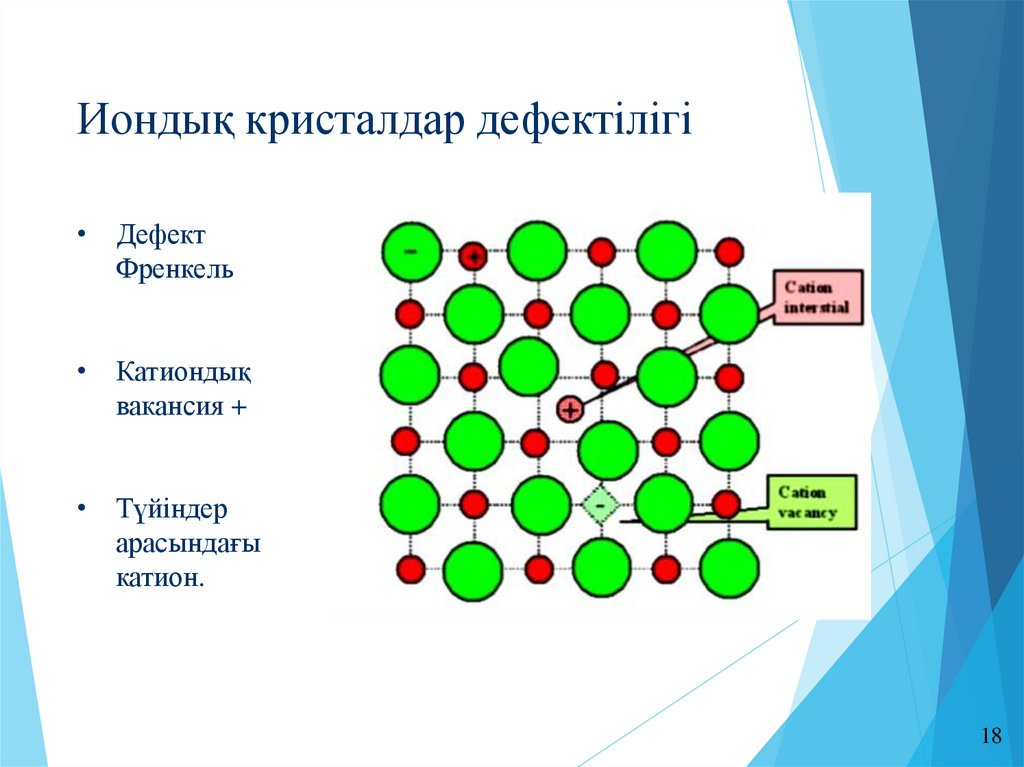
Иондық кристалдар дефектілігі• Дефект
Френкель
• Катиондық
вакансия +
• Түйіндер
арасындағы
катион.
18
28.
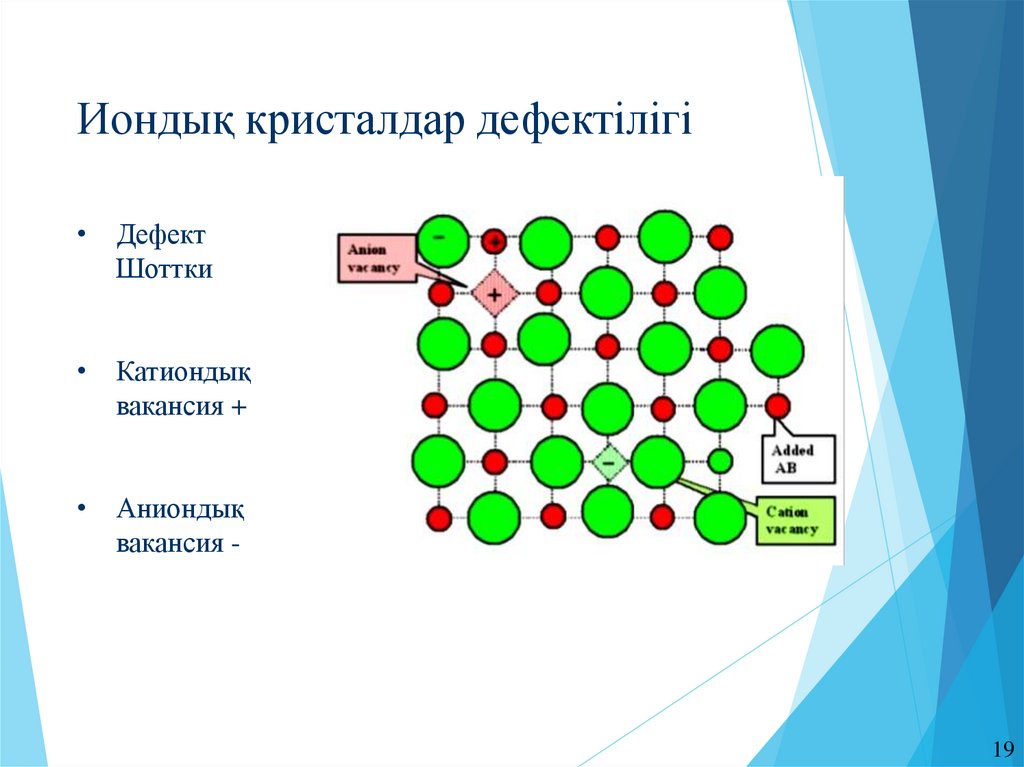
Иондық кристалдар дефектілігі• Дефект
Шоттки
• Катиондық
вакансия +
• Аниондық
вакансия -
19
29.
Қоспалы қатты электролиттерТұзды
NaCI+ MnCI2
Бірзарядты иондардың Na+
бөлігі тор түйіндерінде екі
зарядты Mn2+ ионына
алмасады.
Оксидті
ZrO2 + CaO
Төртзарядты иондардың Zr4+
бөлігі тор түйіндерінде екі
2+
зарядты Са ионына
алмасады.
Кристалл электронейтральды Кристалл электронейтральды
болады
болады
Катиондық вакансия түзіледі Аниондық вакансия түзіледі
23
30.
Суперионды өткізгіштерЖоғарғы өткізгіштігі кристалдық
құрылымдарына байланысты.
24
31.
Қатты электролиттердің қолданылуыХимиялық ток көздері - Лекланше батареялары жылына
миллиондаған дана (қазір миллиард) шығарып, бүкіл
әлемде кеңінен қолданылады.
Химиялық аккумуляторлық батареялар (негізінен
қорғасын-қышқыл) көп өндірілуде. Қатты электролит
батареялары жоғары электролитті өткізгіштігін талап
етеді, яғни олар суперионикалы өткізгіштерге тиесілі
болуы керек.
26
32.
Электролиз қолданылуытаза
металдарды
алу
(Алюминий, магний, натрий,
кадмий тек электролиз арқылы
алынады)
26
33.
Қатты электролиттердің қолданылуыҚазіргі уақытта супериондық өткізгіштік қасиеттері бар ондаған қоспа,
атап айтқанда, кейбір тұздар мен күрделі қосылыстар күміс (α-AgI,
RbAgI5 және т.б.) және оксидтер (Na3Se2(PО4)3; NaMSi4O12;
LiAlSiO4 және т.б.) белгілі. Бұл бинарлы қосылыстар және көп
компонентті кристалдар, стакандар және полимерлер,
стехиометриялық, стехиометриялық қоспалар және қатты ерітінділер.
Сутегі, литий, натрий, калий, рубидиум, цезий, мыс, күміс, магний,
кальций, стронций, барий, қорғасын, оттегі, фтор, хлор, бром және йод
сияқты иондардың қозғалғыштығына байланысты ионөткізгіштігі бар
фазалар бар.
Қатты электролиттер 10 ф / см3 дейін жоғары қуатты сыйымдылығы бар
төмен жиілікті конденсаторлар үшін де қажет. Жоғарыионды өткізгіштер
электр сигналдарын көрнекі көрсету үшін қолданылатын электрохромдық
дисплей элементтерінде де қолданылады.
27
34.
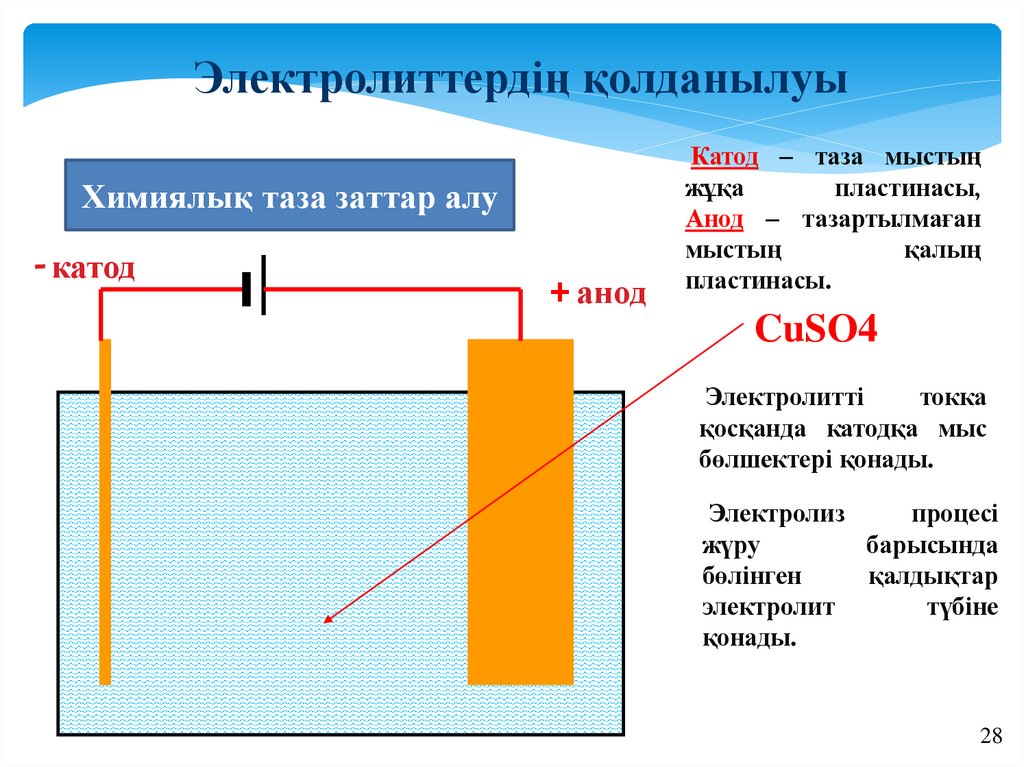
Электролиттердің қолданылуыХимиялық таза заттар алу
- катод
+ анод
Катод – таза мыстың
жұқа
пластинасы,
Анод – тазартылмаған
мыстың
қалың
пластинасы.
CuSO4
Электролитті
токка
қосқанда катодқа мыс
бөлшектері қонады.
Электролиз
процесі
жүру
барысында
бөлінген
қалдықтар
электролит
түбіне
қонады.
28
35.
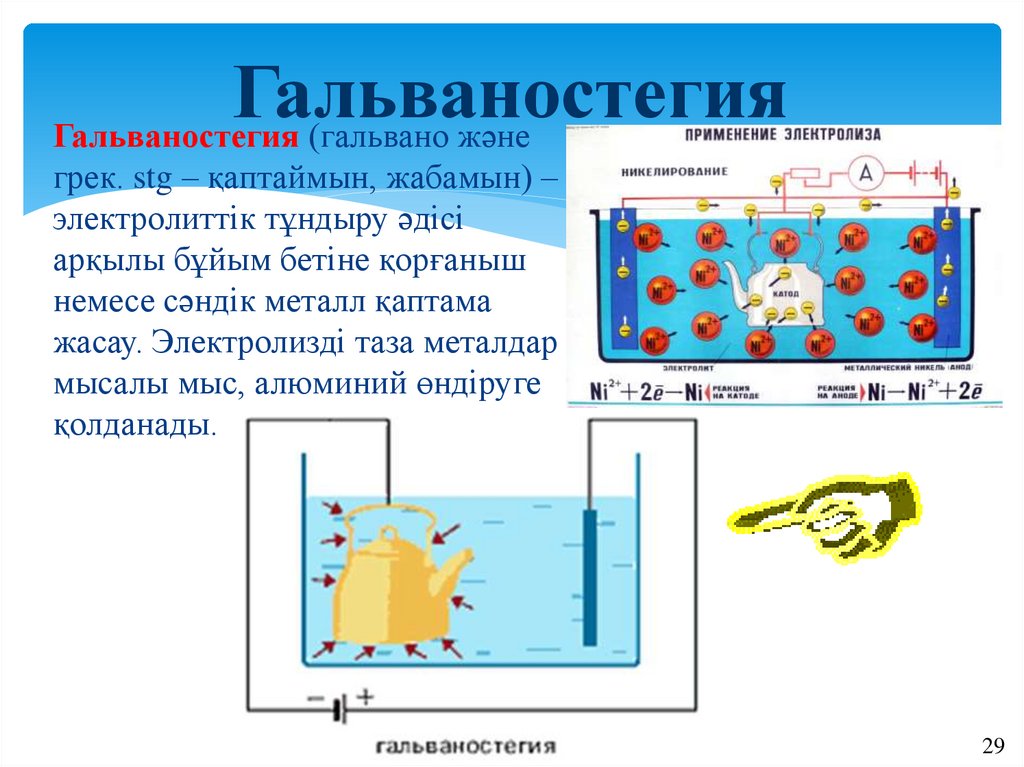
ГальваностегияГальваностегия (гальвано және
грек. stg – қаптаймын, жабамын) –
электролиттік тұндыру әдісі
арқылы бұйым бетіне қорғаныш
немесе сәндік металл қаптама
жасау. Электролизді таза металдар
мысалы мыс, алюминий өндіруге
қолданады.
29
36. Гальванопластика
Электрлік әдіспенқалың
қабатты
(бірнеше
миллиметрге дейін)
көшірмелер алу.
Гальванопластика
әдісімен алынған
барельефа, көшірмесі
30
37. Гальванопластика
Электролизге қандай зат ұшырайды?а-кальций оксиді Б-парафин в-глюкоза г-азот
2. Хлор алу үшін электролиз?
а – хлорлы су Б-калий хлоратының ерітіндісі в-калий хлоридінің балқуы
г-хлор электролиз алмайды
3. Натрий бромиді ерітіндісінің электролизі кезіндегі катод маңындағы кеңістіктегі
лакмустың түсі а-таңқурай б-күлгін в-қызыл г-Көк
4. Ас тұзы ерітіндісін электролиздеу кезінде қандай зат алуға болмайды?
а – Na
б – H2
в – Cl2
г – NaOH
5. Мырыш сульфаты ерітіндісінің анодта инертті электродтармен электролизі
кезінде
а – Zn
б – O2
в – H2
г – SO2
6. Мыс(II) нитратының ерітіндісін анодта мыс электродтарымен электролиздеу
кезінде
а – NO2 б – Си в – O2
г-анодтың еруі
30
38. Қолданылған әдебиеттер
1.Жайлау С.Ж. Физикалық және коллоидтық химия: оқу құралы /С.Ж. Жайлау.- 2-ші бас.- Алматы, 2004.- 225 б.
2.Физикалық химия: оқулық / Х.Қ. Оспанов, Д.Х. Қамыспаева, Е.Х.
Абланова, Г.Х Шәбікова.- Өскемен: ШҚМУ, 1997.- 576 б.
3.Эткинс П. Физикалық химия. Т.1. Тепе- теңдік термодинамика:
оқулық / П. Эткинс, Дж. де Палуа; қаз.тіліне ауд. Шабикова Г.Х.
Тусупбекова А.Г.- Алматы: Полиграфкомбинат, 2012.- 593 б.
4.Қоқанбаев Ә.Қ. Физикалық және коллоидтық химия: оқулық / Ә.Қ.
Қоқанбаев; ҚР білім ж/е ғылым м-гі.- Алматы: Дәуір, 2011.- 488 б.
5.Физикалық химия: оқулық / Х.Қ. Оспанов, Д.Х. Қамыспаева, Е.Х.
Абланова, Г.Х Шәбікова.- Алматы: Қазақ у., 2002.- 689 б.
6.Gray F.M. Solid Polymer Electrolytes: Fundamental and Technological
Applications // VCH Publ. Inc. N.Y., 1991. 215 p.
7. Hillman A.R. Polymer Modified Electrodes: Preparation
andCharacterisation, in: Electrochemical Science and Technology of
Polymers-1 // Elsevier Applied Science, London, N.Y., 1990, P. 102–240.