Похожие презентации:
Бейорганикалық қосылыстардың негізгі кластары
1. Лекция 1 Бейорганикалық қосылыстардың негізгі кластары
2.
Бейорганикалық заттардыңклассификациясы
Негіздер
Оксидтер
Қышқылдар
Тұздар
3.
Негіздер– Бір металл атомы бір немесебірнеше гидроксо топпен байланысқан
күрделі заттар. (Электролиттік
диссоциация теориясы бойынша
негіздер – суда еріткенде металл
катионына ( немесе NH4+) және
гидроксид анионына (OH)
диссоциацияланатын күрделі заттар
4. Классификация
Суда еріитін (сілтілер) and ерімейтін.Амфотерлі негіздкер әлсіз
қышқылдардың қасиеттерін көрсетеді.
5. Алынуы
1. Белсенді металдардың (сілтілік және сілтілік жерметалдарының) сумен әрекеттесу реакциясы
2Na + 2H2O →→ 2NaOH + H2
Ca + 2H2O =Ca(OH)2 + H2
2. Белсенді металл оксидтерінің сумен әрекеттесуі
BaO + H2O = Ba(OH)2
3.Тұздардың сулы ерітіндісінің электролизі
2NaCl + 2H2O = 2NaOH + H2 + Cl2
6. Химиялық қасиеттері
СілтілерСуда ерімейтін негіздер
1.
Индикаторларға әсері
Лакмус -көк
Метилоранж - сары
Фенолфталейн - таңқурай
––
Қышқылдық оксидтерге әсері
2.
2KOH + CO2 = K2CO3 + H2O
KOH + CO2 = KHCO3
3.
––
Қышқылдармен реакциясы (бейтараптану реакциясы)
NaOH + HNO3= NaNO3 + H2O
4.
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Тұздармен алмасу реакциясы
Ba(OH)2 + K2SO4 = 2KOH + BaSO4↓
3KOH + Fe(NO3)3 = Fe(OH)3↓+ 3KNO3
5.
––
––
Термиялық ыдырау реакциясы
t°
Cu(OH) =CuO + H O
7. Оксидтер – Екі элементтен құралып біреуі оттек болып келетін күрделі заттар.
Тұз түзбейтін(CO, N2O, NO)
Тұз түзетін
Негіздік Метдың төмен тотығу дәрежелерін көрсететін оксидтері
+1, +2
Na2O; MgO; CuO
Амфотерлі
(Металдармен оксидтері +3, +4).
Гидрат ретінде амфотериялық гидроксиді оған сәйкес
келеді ZnO; Al2O3; Cr2O3; SnO2
ҚышқылдықОл бейметалдардың оксидтері және металдардың жоғары
тотығу дәрежесін көрсететін оксидтері +5 тен +7.
SO2; SO3; P2O5; Mn2O7; CrO3
8. Алынуы
1. Жәй және көрделі заттардың оттегімен әрекеттесуінен:2Mg + O2 = 2MgO
4P + 5O2 = 2P2O5
S + O2 = SO2
2CO + O2 = 2CO2
2CuS + 3O2 = 2CuO + 2SO2
CH4 + 2O2= CO2 + 2H2O
cat. 4NH3 + 5O2=4NO + 6H2O2.
2. Құрамында оттегі бар күрделі заттардың қыздырған
кезде ыдырауынан түзіледі (негіздердің,
қышқылдардың, тұздардың) :
Cu(OH)2 = CuO + H2O
(CuOH)2CO3 = 2CuO + CO2 + H2O
2Pb(NO3)2 = 2PbO + 4NO2 + O2
2HMnO4 = Mn2O7 + H2O
9.
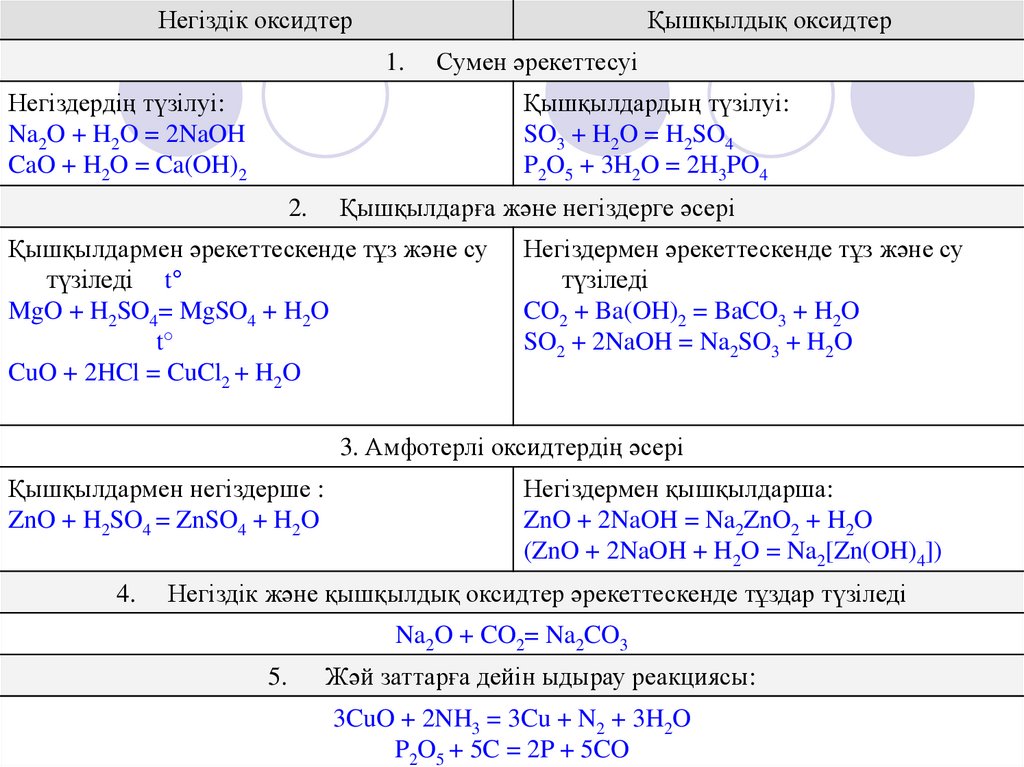
Негіздік оксидтерҚышқылдық оксидтер
1.
Сумен әрекеттесуі
Негіздердің түзілуі:
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
Қышқылдардың түзілуі:
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
2.
Қышқылдарға және негіздерге әсері
Қышқылдармен әрекеттескенде тұз және су
түзіледі t°
MgO + H2SO4= MgSO4 + H2O
t°
CuO + 2HCl = CuCl2 + H2O
Негіздермен әрекеттескенде тұз және су
түзіледі
CO2 + Ba(OH)2 = BaCO3 + H2O
SO2 + 2NaOH = Na2SO3 + H2O
3. Амфотерлі оксидтердің әсері
Қышқылдармен негіздерше :
ZnO + H2SO4 = ZnSO4 + H2O
4.
Негіздермен қышқылдарша:
ZnO + 2NaOH = Na2ZnO2 + H2O
(ZnO + 2NaOH + H2O = Na2[Zn(OH)4])
Негіздік және қышқылдық оксидтер әрекеттескенде тұздар түзіледі
Na2O + CO2= Na2CO3
5.
Жәй заттарға дейін ыдырау реакциясы:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
P2O5 + 5C = 2P + 5CO
10. Acids – Сутек атомсынан және қышқыл қалдық радикалынан құралған күрделі заттар. (Электролиттік диссоциация теориясыбойынша
диссоциацияланғанкезде H+ катионына қышқыл қалдық
анионына ыдырайтын күрделі зат
11.
Оттексіз:Тұздың атауы:
HCl – тұз қышқылы (хлор сутек қышқылы)
Бір негізді
хлорид
HBr –бром сутек қышқылы
Бір негізді
бромид
HI –иод сутек қышқылы
Бір негізді
иодит
HF – Фтор сутек
Бір негізді
фторит
H2S – күкірт сутек
Екі негізді
сульфид
HNO3– азот
Бір негізді
нитрат
H2SO3 – күкіртті
Екі негізді
сульфит
H2SO4 – күкірт
Екі негізді
сульфат
H2CO3 – көмір
Екі негізді
карбонат
H2SiO3 – кремний
Екі негізді
Силикат
H3PO4 – фосфор
Үш негізді
Ортофосфор
Оттекті:
12. Алынуы
1.2.
3.
Қышқылдық оксидтің сумен әрекеттесуі
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
Сутектің бейметалдармен әрекеттесуі.
H2 + Cl2 = 2HCl
H2 + S = H2S
Тұз бен қышқылдың арасындағы алмасу реакциясы
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
4. Әлсіз, Ұшпа немесе аз еритін қышқылды
оның тұздарын күшті қышқылдармен әрекеттестіру арқылы.
Na2SiO3 + 2HCl = H2SiO3↓+ 2NaCl
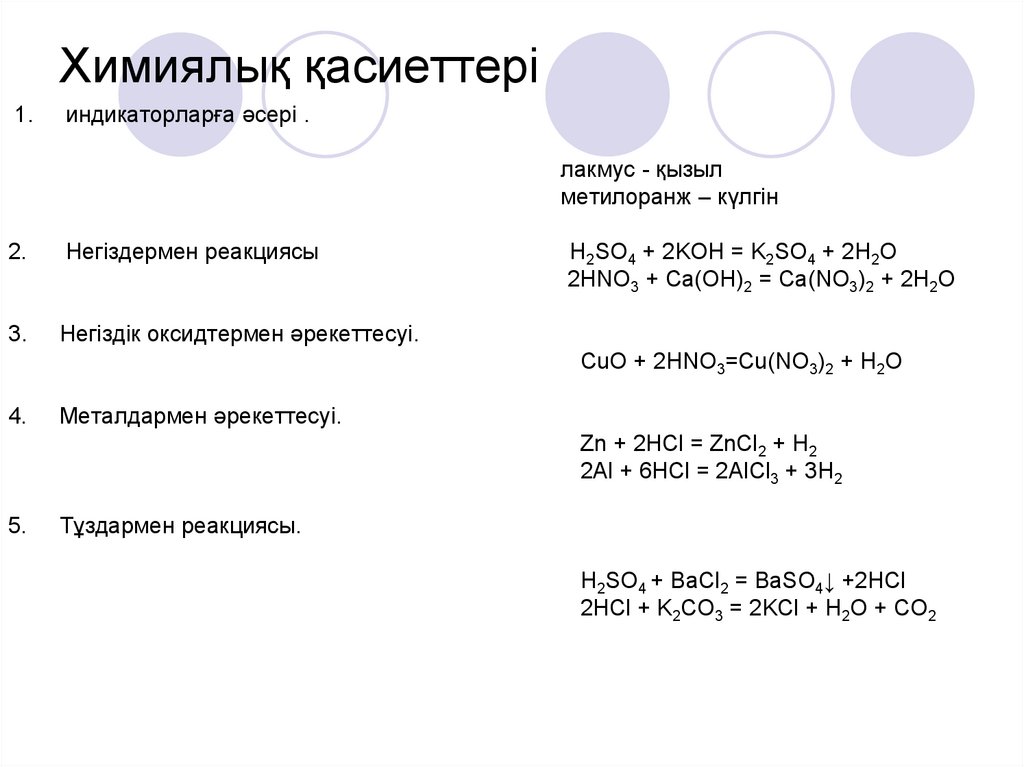
13. Химиялық қасиеттері
1.индикаторларға әсері .
лакмус - қызыл
метилоранж – күлгін
2.
Негіздермен реакциясы
3.
Негіздік оксидтермен әрекеттесуі.
H2SO4 + 2KOH = K2SO4 + 2H2O
2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O
CuO + 2HNO3=Cu(NO3)2 + H2O
4.
Металдармен әрекеттесуі.
Zn + 2HCl = ZnCl2 + H2
2Al + 6HCl = 2AlCl3 + 3H2
5.
Тұздармен реакциясы.
H2SO4 + BaCl2 = BaSO4↓ +2HCl
2HCl + K2CO3 = 2KCl + H2O + CO2
14. Тұздар- Металл атомы мен қышқыл қалдығынан құралған күрделі заттар.
ТұздарОрта тұздар
Қышқыл
негіз
Қос
Аралас
Кешенді
15.
Орта тұздар. Диссоциацияланғаникезде тек метал катионымен қышқыл қалдық анионына диссоциацияланатын
күрделі зат:
Na2SO4= 2Na+ +SO42CaCl2=Ca2+ + 2ClҚышқыл тұздар. Диссоциацияланған кезде метал катионымен
қатр сутек катионына және қышқыл қалдық анионына
диссоциацияланатын күрделі заттар:
NaHCO3= Na+ + HCO3-= Na+ + H+ + CO32Негіз тұздар. Диссоциацияланған кезде тек метал катионына
және ОН анионы мен қышқыл қалдық анионына
диссоциацияланатыникүрделі заттар:
Zn(OH)Cl= [Zn(OH)]+ + Cl-=Zn2+ + OH- + Cl-
16.
Қос тұздар.Диссоциацияланған кезде екі метал катионына және
қышқыл қалдық анионына ыдырайтын күрделі
заттар:
KAl(SO4)2 = K+ + Al3+ + 2SO42-
Аралас тұз.
Бір катионнан екі анионнан құралған тұз:
CaOCl2 = Ca2+ + Cl- + OClКешенді тұздар . Комплексті катионнан және
анионнан құралған тұз:
[Ag(NH3)2]Br = [Ag(NH3)2]+ + Br Na[Ag(CN)2] = Na+ + [Ag(CN)2]-
17.
Medium saltsPreparation
1)
Metal with non-metal:
2Na + Cl2= 2NaCl
2)
Metal with acid:
Zn + 2HCl = ZnCl2 + H2
3)
Metal with solution of salt of less active metal:
Fe + CuSO4= FeSO4 + Cu
4)
Basic oxide with the acid oxide:
MgO + CO2= MgCO3
18.
5)Basic oxide with acid:
CuO + H2SO4=CuSO4 + H2O
6)
Bases with acid oxide:
Ba(OH)2 + CO2= BaCO3↓ + H2O
7)
Bases with acid:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
8)
Salts with the acid:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 ↓ + 2HCl
9)
Bases solution with salt solution:
Ba(OH)2 + Na2SO4= 2NaOH + BaSO4↓
10) Solutions of two salts:
3CaCl2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaCl
19.
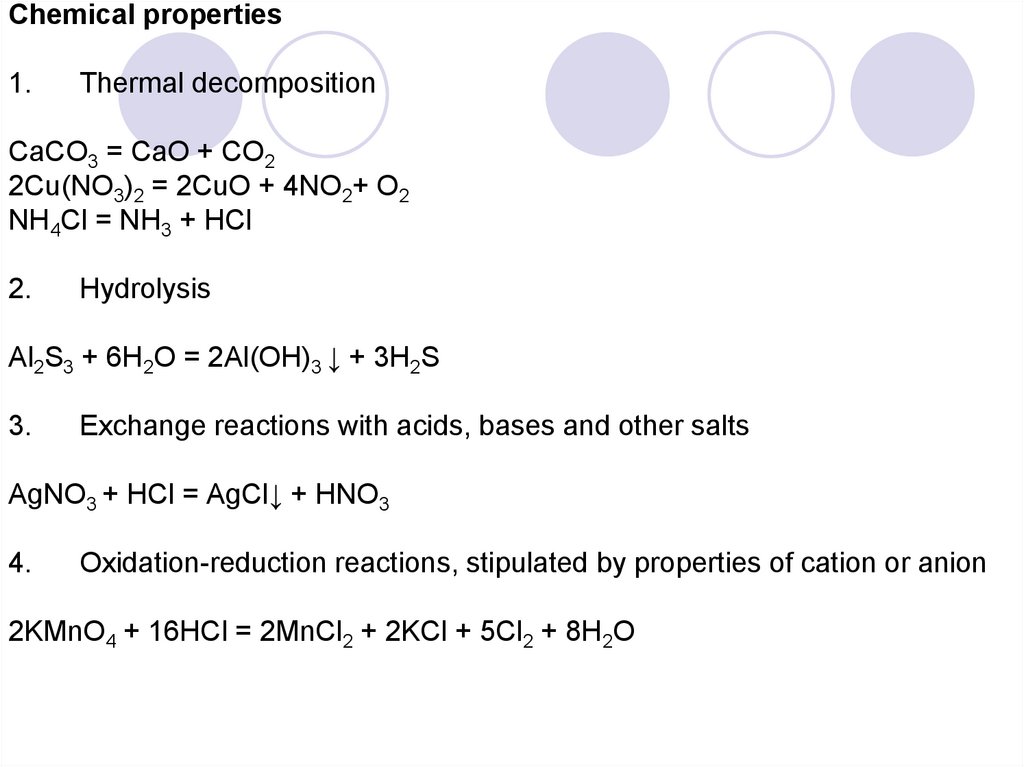
Chemical properties1.
Thermal decomposition
CaCO3 = CaO + CO2
2Cu(NO3)2 = 2CuO + 4NO2+ O2
NH4Cl = NH3 + HCl
2.
Hydrolysis
Al2S3 + 6H2O = 2Al(OH)3 ↓ + 3H2S
3.
Exchange reactions with acids, bases and other salts
AgNO3 + HCl = AgCl↓ + HNO3
4.
Oxidation-reduction reactions, stipulated by properties of cation or anion
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2O
20.
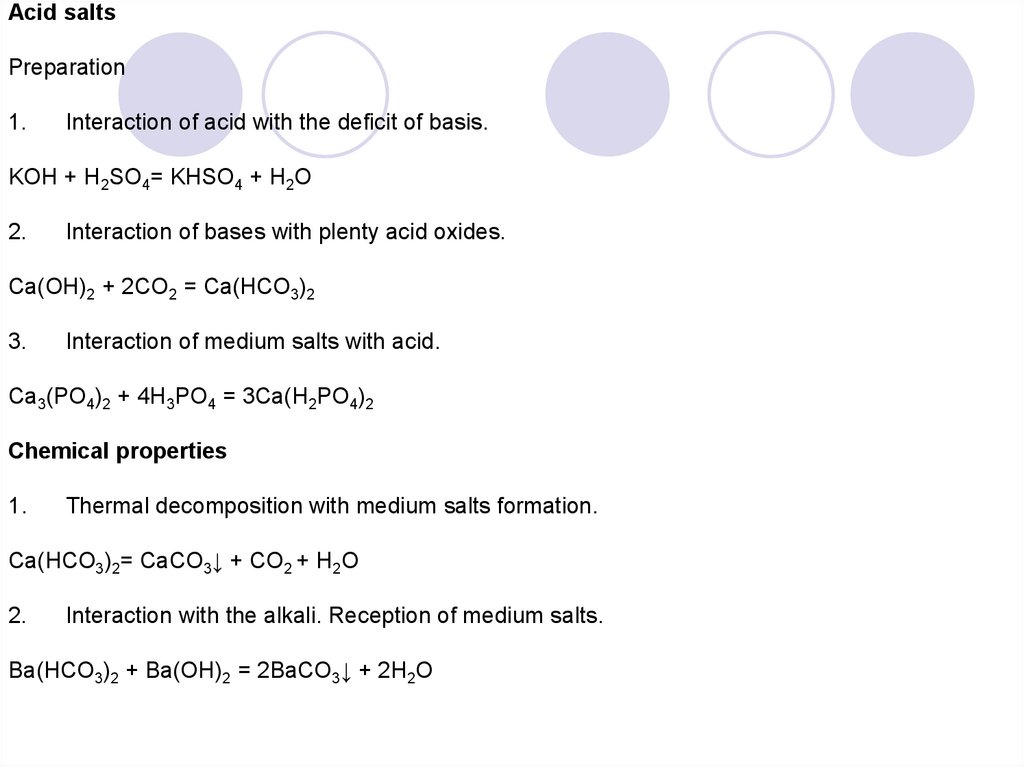
Acid saltsPreparation
1.
Interaction of acid with the deficit of basis.
KOH + H2SO4= KHSO4 + H2O
2.
Interaction of bases with plenty acid oxides.
Ca(OH)2 + 2CO2 = Ca(HCO3)2
3.
Interaction of medium salts with acid.
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Chemical properties
1.
Thermal decomposition with medium salts formation.
Ca(HCO3)2= CaCO3↓ + CO2 + H2O
2.
Interaction with the alkali. Reception of medium salts.
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3↓ + 2H2O
21.
Basic saltsPreparation
1.
Hydrolysis of salts, formed by weak base and strong acid.
ZnCl2 + H2O = [Zn(OH)]Cl + HCl
2.
Addition (by drops) a small quantities of alkalis to solutions of medium salts of metals.
AlCl3 + 2NaOH = [Al(OH)2]Cl + 2NaCl
3.
Interaction of weak acids salts with medium salts.
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Chemical properties
1.
Thermal decomposition.
[Cu(OH)]2CO3= 2CuO + CO2 + H2O
2.
Interaction with the acid: formation of medium salts.
Sn(OH)Cl + HCl = SnCl2 + H2O
22.
Genetic relationship between different classesof compounds
1.
2.
3.
4.
5.
6.
7.
metal; non-metal – salt
basic oxide; acid oxide – salt
basic; acid – salt
metal – basic oxide
non-metal – acid oxide
basic oxide – bases
acid oxide – acid


















 Химия
Химия








