Похожие презентации:
Кинетика провер
1. Кинетика
2. План
1. Скорость и константа скорости.2. Молекулярность и порядок реакции.
3. Кинетика реакций в статических условиях.
4. Методы определения порядка химической реакции.
3.
Химическаякинетика
устанавливает
законы,
определяющие скорость химических процессов, и выясняет
роль различных факторов, влияющих на скорость и механизм
реакций.
Зная законы кинетики и механизм реакций можно
управлять химическими процессами.
4. Скорость и константа скорости
Если реакция протекает в одну стадию, её называютэлементарной химической реакцией.
Рассмотрим элементарную реакцию, идущую в закрытой
системе:
ν1А1+ν2А2=ν3А3+ν4А4
где ν1, ν2- стехиометрические коэффициенты исходных веществ;
ν3, ν4- стехиометрические коэффициенты продуктов реакции.
5.
6.
7.
8.
Скорость реакции зависит от:1. Природы реагирующих веществ.
2. Концентрации.
3. Температуры.
4. Наличие катализатора и других факторов.
9.
10. Природа реагирующих веществ
Например:• Н2 + Cl2 = 2HCl
медленно
• Н2 + F2 = 2HF
взрыв
• NaOH + HCl = NaCl + H2O
OH- + H+ = H2O
• Ржавление железа
быстро
медленно
11. Влияние концентрации (или давления) на скорость химической реакции
12.
13. Влияние температуры на скорость реакции
14.
Даже небольшое повышение температуры вызывает резкоеувеличение скорости реакции. Причины этого объясняет теория
активных столкновений (теория активации). Согласно данной
теории, в реакции могут участвовать только те молекулы, энергия
которых больше средней энергии молекул на какую-то
определённую величину. Эта избыточная энергия называется
энергией активации. Она необходима для разрыва или ослабления
химической связей в молекулах исходных веществ. Молекулы,
избыточная энергия которых больше энергии активации,
называют активными молекулами. Чем больше число активных
молекул, тем больше скорость реакции. При повышении
температуры число активных молекул резко увеличивается.
15.
16.
17. Присутствие катализатора
Катализатор – вещество, которое изменяет скорость реакции,но не расходуется в результате реакции.
Явление изменения скорости реакции в присутствии
катализатора называется катализом. Реакции, которые
протекают
с
участием
катализаторов,
называются
каталитическими. Различают гомогенный и гетерогенный
катализ.
Если реагенты и катализатор находятся в одном агрегатном
состоянии (обычно газообразном) или являются компонентами
одного раствора, то такой катализ называется гомогенным.
18.
В случае гетерогенного катализа реагенты и катализаторнаходятся в различных агрегатных состояниях (катализатор
обычно является твёрдым веществом, а реагенты – жидкими
или газообразными веществами).
Например,
гомогенный катализ
гетерогенный катализ
19.
Механизм действия катализаторов сложен. Существуетпредположение об образовании промежуточных соединений при
взаимодействии катализатора и реагента.
А + В = АВ без К – катализ идёт медленно.
Полагают:
А + К = АК
Это промежуточное соединение с большой скоростью реагирует с
исходным веществом В, при этом образуется конечный продукт
реакции АВ, а катализатор выделяется в свободном состоянии:
АК + В = АВ + К
Вещества, замедляющие реакции, называют ингибиторами.
Все биохимические процессы протекают с участием
биологических катализаторов – ферментов (энзимов). По своей
химической природе ферменты являются белками.
20. Молекулярность и порядок реакции
Молекулярность химической реакции определяется числоммолекул (частиц), участвующих в элементарном акте реакции.
По
молекулярности
различают
одномолекулярные,
двухмолекулярные и трехмолекулярные реакции.
К одномолекулярным реакциям типа А В или А В + С
относятся процессы распада (радикального распада) молекул на
более составные части:
21.
Двухмолекулярные А + В = 2С или 2А = B + D:H2 + I2 = 2HI
Реже встречаются трехмолекулярные реакции: А + 2В = С или
3А = В:
2NO + O2 = 2NO2
2Na + O2 = Na2O2
4KClO3 = KCl + 3KClO4 (редко).
22.
23.
Дробный порядок характерен для сложных реакций,протекающих через промежуточные стадии (например цепные
реакции). Нулевой порядок наблюдается в таких гетерогенных
реакциях, в которых скорость подвода вещества больше скорости
его расходования.
24.
MgO (т) + 2HCl (раствор) = MgCl2 (раствор) + H2OCaCO3 (т) = CaO (т) + CO2 (г)
25. Причины несовпадения порядка и молекулярности реакций
Причинынесовпадения порядка
реакций
и
молекулярности
26.
27. Кинетика реакций в статических условиях
28. Реакция нулевого порядка
29. Реакция первого порядка
30. Реакция второго порядка
31. Реакция третьего порядка
32. Методы определения порядка химических реакций
Определение порядка реакции способствует выяснению еёмеханизма.
Различают частный и общий порядок реакции.
Частным называют порядок, характеризующийся изменением
концентрации одного из веществ, вступающих в реакцию. Чтобы
определить порядок по данному веществу, необходимо создать также
условия, чтобы в процессе реакции изменялась концентрация только
данного вещества. Для этого концентрации всех остальных
участников должны быть взяты в большом избытке.
Сумма частных порядков даёт общий порядок реакции.
33.
Для определения порядка реакций используют в основном двегруппы методов:
Интегральные
Дифференциальные
Метод подстановки
Метод Вант – Гоффа
Графический метод
Метод изоляции (избытка)
По периоду
полупревращения
Метод Нойеса - Оствальда
34. Интегральные. Метод подстановки
Он заключается в экспериментальном определенииконцентрации вещества в различные моменты времени от начала
реакции:
τ, мин
0
3
с, моль/л 0,01 0,007
5
0,006
7
10
15
20
0,005 0,0045 0,035 0,0025
35.
По полученным данным производят расчёт константскоростей, используя уравнения. Выясняют, по какому уравнению
расчёт даёт практически постоянную величину константы с
небольшими отклонениями разных знаков ±∆ (10%). Этому порядку
подчиняется исследуемая реакция.
36.
Если же рассчитанные значения константы скоростисистематически возрастают или убывают, то расчёт повторяют для
другого порядка. Если ни одно из кинетических уравнений не даёт
удовлетворительного результата, т.е. порядок реакции не является
целым, это означает, что реакция описывается более сложным
кинетическим уравнением. Метод подстановки даёт надёжные
результаты для больших значений степени превращения.
37. Графический метод
Заключается в представлении экспериментальных данныхв соответствующих координатах для целых порядков.
Нулевого порядка
Первого порядка
Второго порядка
Третьего порядка
38.
39. Определение порядка реакции по периоду полупревращений
Метод Оставльда – Нойеса40. Метод Оставльда – Нойеса
Определение порядка реакции по периодуполупревращений
Для определения порядка реакции необходимо
экспериментально определить время полупревращения для
нескольких начальных концентраций и установить, какая
зависимость существует между ними.
41. Дифференциальные методы. Метод Вант-Гоффа.
42.
43.
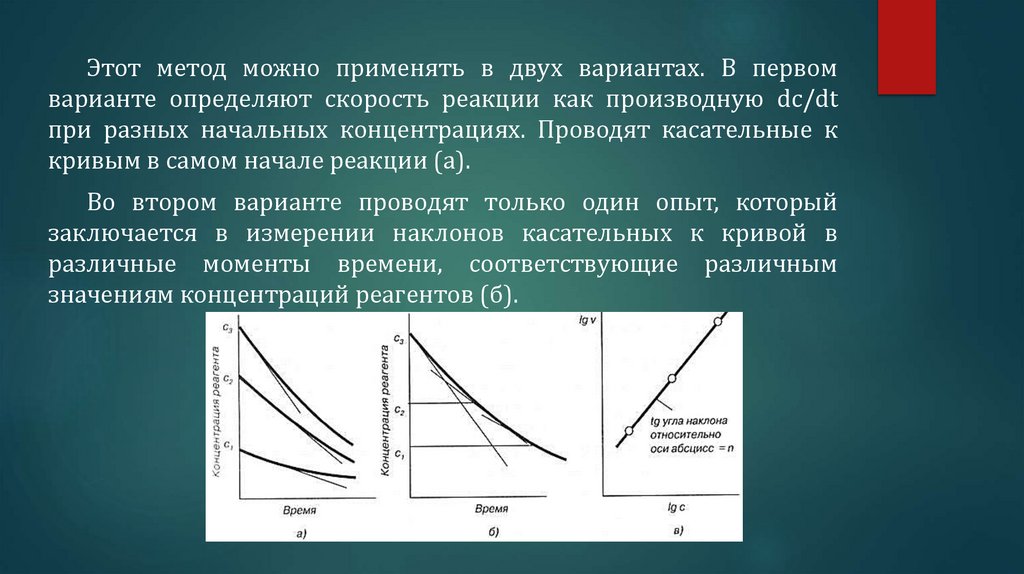
Этот метод можно применять в двух вариантах. В первомварианте определяют скорость реакции как производную dc/dt
при разных начальных концентрациях. Проводят касательные к
кривым в самом начале реакции (а).
Во втором варианте проводят только один опыт, который
заключается в измерении наклонов касательных к кривой в
различные моменты времени, соответствующие различным
значениям концентраций реагентов (б).
44.
Результаты, полученные в том и другом варианте, используютсядля построения логарифмической зависимости скоростей от
концентрации реагентов (в). Порядок реакции, найденный по
первому варианту, называют концентрационным. Порядок реакции,
найденный по второму варианту и называется временным.
Если временный порядок выше концентрационного, то реакция
ингибируется промежуточными продуктами. Если, наоборот,
временный порядок меньше концентрационного, то реакция
автокатализируется промежуточными продуктами.












































 Химия
Химия








