Похожие презентации:
https___school.mos.ru_ej_attachments_files_220_031_617_original_%D0%9E%D0%BA%D1%81%D0%B8%D0%B4%D1%8B
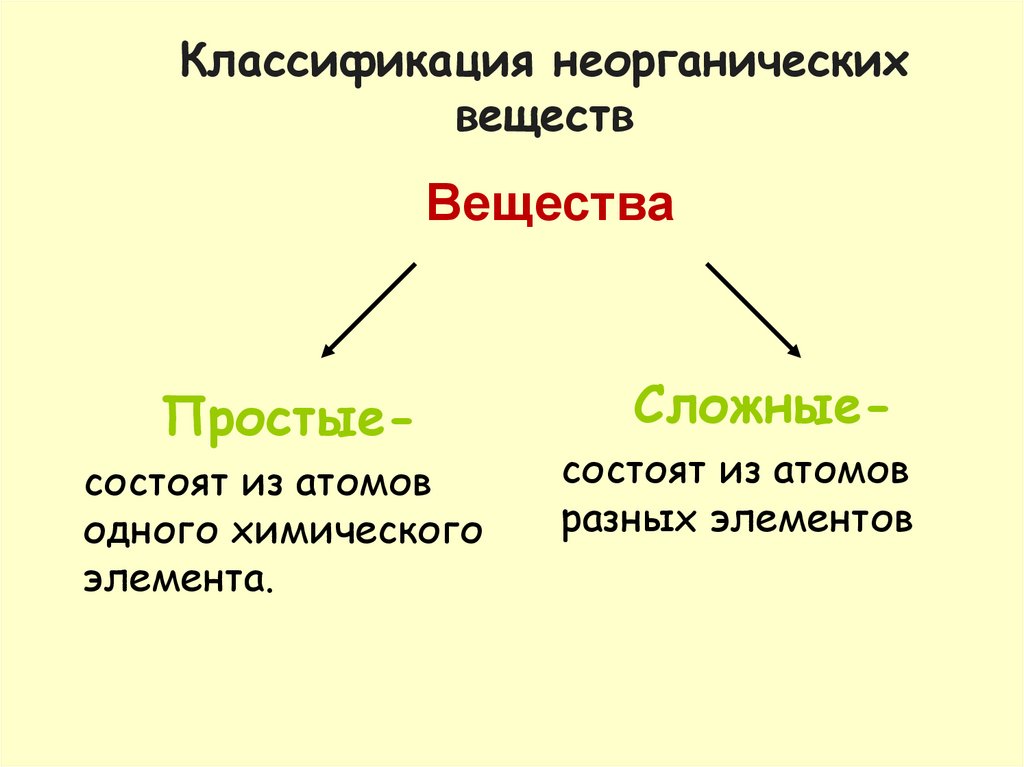
1. Классификация неорганических веществ
ВеществаПростыесостоят из атомов
одного химического
элемента.
Сложныесостоят из атомов
разных элементов
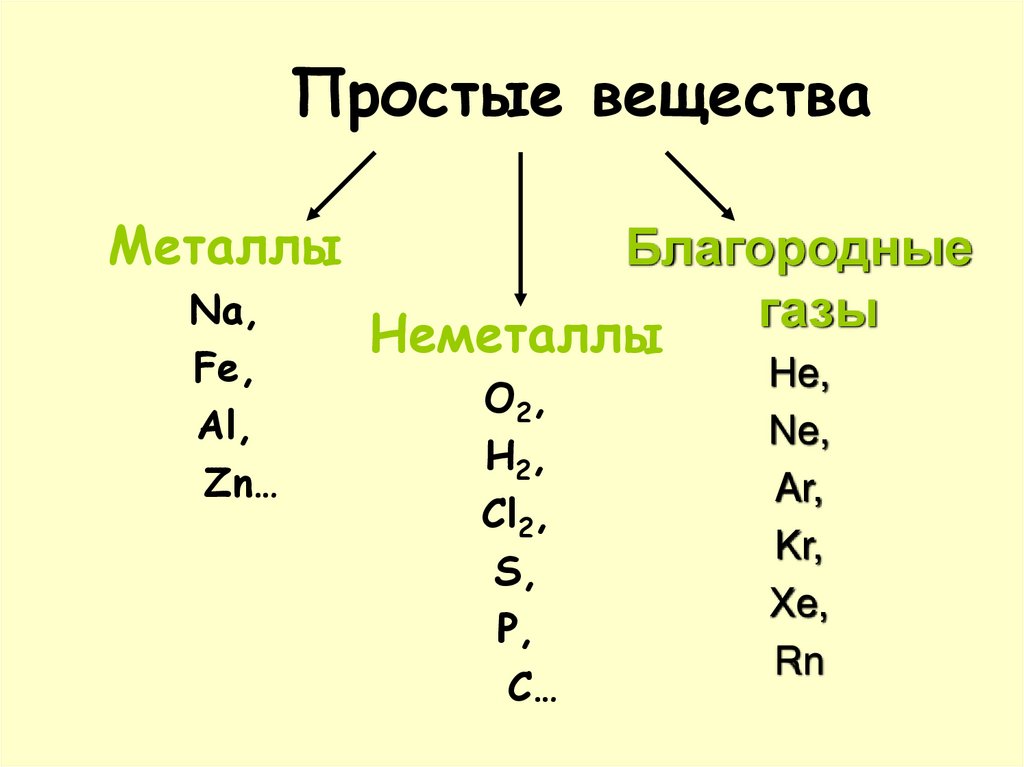
2. Простые вещества
МеталлыNa,
Fe,
Al,
Zn…
Благородные
газы
Неметаллы
O2,
H2,
Cl2,
S,
P,
C…
He,
Ne,
Ar,
Kr,
Xe,
Rn
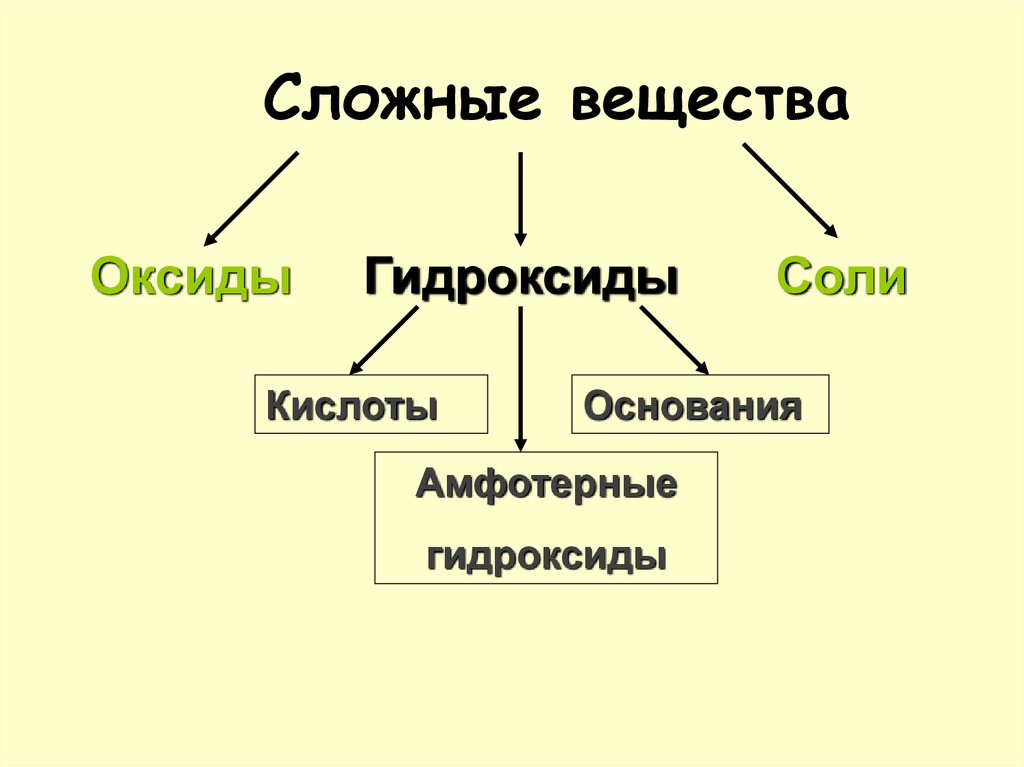
3. Сложные вещества
ОксидыГидроксиды
Кислоты
Соли
Основания
Амфотерные
гидроксиды
4.
Оксиды. Определение,состав, номенклатура и
классификация
5. Оксиды. Определение, состав, номенклатура, классификация и структурные формулы
Оксиды – это соединения, состоящие из атомовдвух элементов, одним из которых является
кислород в валентности II.
Состав оксидов выражается общей формулой:
Эх О у
где х – число атомов элемента, у – число атомов кислорода.
Примеры оксидов: СаО, Fe2O3,ZnO, BeO, NO2,
P2O5
6. Название оксидов
• В названиях оксидов вначале указывают словооксид (в именительном падеже), а затем – в
родительном падеже название элемента:
• ZnO – оксид цинка,
• СаО – оксид кальция.
• Если элемент образует несколько оксидов, то
после названия элемента в скобках римской
цифрой указывают численную величину его
валентности:
• Fe2O3 – оксид железа (III) (читается: «оксид железа три»),
• P2O5 – оксид фосфора (V) (читается: «оксид фосфора пять»)
7. ВНИМАНИЕ!!!!!!!!!!!!!!
Постоянную валентность,которая не указывается в
названии оксидов, имеют:
• - элементы I и II группы
главной подгруппы;
• - алюминий, цинк,
бериллий
8. Классификация
• По агрегатному состоянию оксиды неметалловразделяются на:
• твердые – Р2О5, SiO2, N2O5 и др.,
• газообразные – СО2, SО2, NО и др.,
• жидкие - Н2О, SO3, N2O3.
• Все оксиды металлов – твердые вещества
9. Оксиды в природе
10. Вода Н2О – оксид водорода
Агрегатные состояния:
твёрдое — лед
жидкое — вода
газообразное — водяной пар.
В атмосфере нашей планеты вода находится в
виде капель малого размера, в облаках и тумане,
а также в виде пара. При конденсации выводится
из атмосферы в виде атмосферных осадков
(дождь, снег, град, роса). В совокупности жидкая
водная оболочка Земли называется гидросферой.
Вода является важнейшим веществом всех живых
организмов на Земле. Предположительно,
зарождение жизни на Земле произошло в водной
среде.
Вода способна растворять в себе много веществ,
приобретая тот или иной вкус.
В природе происходит непрерывный круговорот
воды.
11. Углекислый газ (диоксид углерода) СО2 – оксид углерода (IV)
Углекислый газ (диоксид углерода) СО2 – оксид углерода
(IV)
Углекислый газ формируется при соединении
двух элементов: углерода и кислорода. Он
образуется в процессе сжигания угля
или углеводородных соединений, при гниении
растительных и животных остатков, а также как
продукт дыхания людей и животных.
В небольших количествах он содержится
и в атмосфере, откуда он ассимилируется
растениями, которые, в свою очередь,
производят кислород.
Углекислый газ бесцветен и тяжелее воздуха.
Он не пригоден для поддержания жизни.
Углекислый газ замерзает при температуре
−78.5°C с образованием снега, состоящего
из двуокиси углерода.
В виде водного раствора он образует угольную
кислоту, однако она не обладает достаточной
стабильностью.
12. Оксид кремния (IV) SiО2
Диоксид кремния применяют в производстве
стекла, керамики, бетонных изделий, для
получения кремния, как наполнитель в
производстве резин, при производстве
кремнезёмистых огнеупоров и др.
Диоксид кремния — главный компонент почти
всех земных горных пород. Из кремнезёма и
силикатов состоит 87% массы литосферы.
Аморфный непористый диоксид кремния
применяется в пищевой промышленности в
качестве вспомогательного вещества E551,
препятствующего слёживанию и комкованию,
фармацевтике (зубные пасты), а также пищевой
добавки или лекарственного препарата.
Искусственно полученные плёнки диоксида
кремния используются в качестве изолятора при
производстве микросхем и других электронных
компонентов.
Также используется для производства
волоконно-оптических кабелей. Используется
чистый плавленый диоксид кремния с добавкой
в него некоторых специальных ингредиентов.
13. Домашнее задание
• Параграф 20 повторить. Параграф 21 учить. Знатьназвания оксидов и уметь строить молекулярные формулы.
Диктант по оксидам. Выполнить письменно в тетради
следующие задания:
• 1) В каком из оксидов массовая доля кислорода больше?
Ответ рассчитайте.
• 1) H2О; 2) Li2O
• 2) Из приведенного перечня веществ выпишите только
формулы оксидов и дайте им названия. В формулах
веществ расставьте валентности у каждого элемента:
CaO, HNO3, SiO2, KOH, H2SO4, P2O5, MgO, CaCO3, HF,
HNO3, Al(OH)3, B2O3.
• 3) Составьте молекулярные формулы указанных оксидов:
• а) оксид калия,
• б) оксид бария,
• в) оксид серы (VI).
14. Оксиды, их классификация
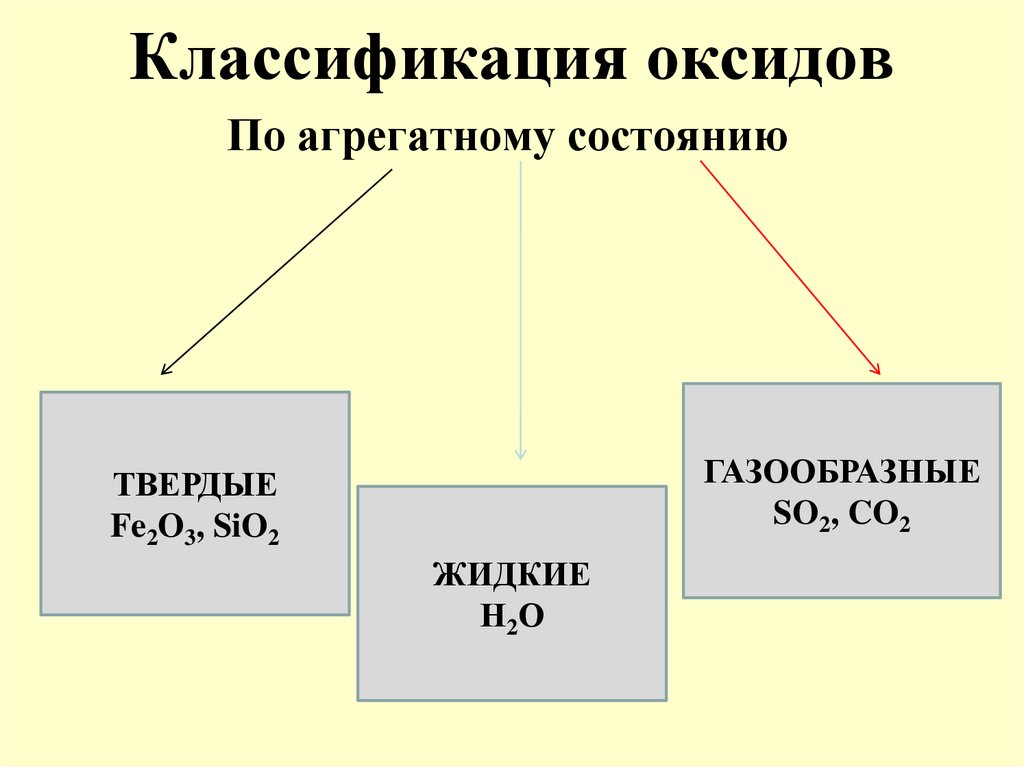
15. Классификация оксидов
По агрегатному состояниюГАЗООБРАЗНЫЕ
SO2, CO2
ТВЕРДЫЕ
Fe2O3, SiO2
ЖИДКИЕ
Н2О
16. Пример твердого оксида
Песок – диоксид кремния SiO2 с небольшимколичеством примесей.
17. Пример жидкого оксида
Вода – оксид водорода Н2O.18. Классификация оксидов
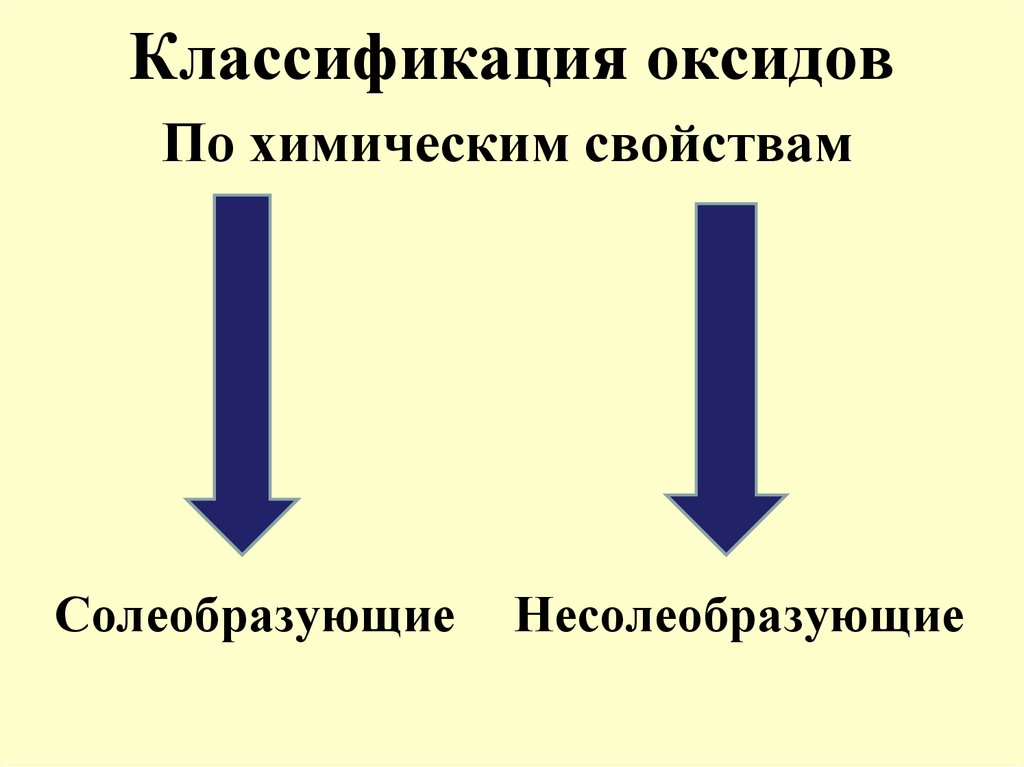
По химическим свойствамСолеобразующие
Несолеобразующие
19. Классификация оксидов
Несолеобразующие оксиды – такие оксиды,которые не взаимодействуют ни с кислотами,
ни с щелочами и не образуют солей.
Например:
oксиды азота (I), (II) - N2O, NO
oксид углерода (II) – СО
20. Классификация оксидов
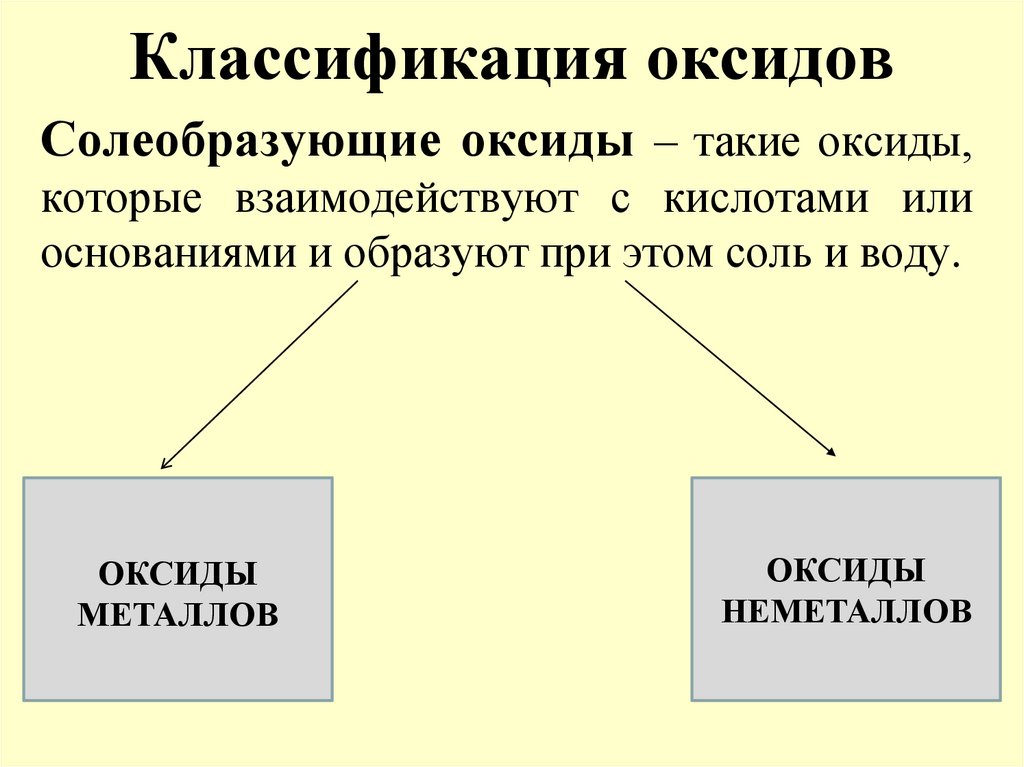
Солеобразующие оксиды – такие оксиды,которые взаимодействуют с кислотами или
основаниями и образуют при этом соль и воду.
ОКСИДЫ
МЕТАЛЛОВ
ОКСИДЫ
НЕМЕТАЛЛОВ
21. ОКСИДЫ МЕТАЛЛОВ
Оксиды металлов – это бинарныесоединение кислорода с металлами.
1. оксид меди(II) CuO
2. оксид железа(III) Fe2O3
3. оксид кальция CaO
Оксиды металлов являются твёрдыми
кристаллическими веществами.
22. ОКСИДЫ НЕМЕТАЛЛОВ
Оксиды неметаллов – это бинарныесоединение кислорода с неметаллами.
1. оксид кремния(IV) SiO2, оксид фосфора(V)
P2O5 и оксид серы(VI) SO3 – твёрдые
вещества.
2. оксид водорода или вода H2O – жидкое
вещество.
3. SO2 оксид серы (IV), NO2 (оксид азота (IV),
CO2 (оксид углерода (IV).
23. Цвет оксидов
• Цвет оксидов может быть самымразнообразным.
SiO2 - бесцветный, например, является в
виде кварца или горного хрусталя.
• Большинство газообразных оксидов
также не имеет окраски, но оксид
азота(IV) NO2 — газообразное
вещество бурого цвета.
24. Цвет оксидов
• Оксид железа(III) Fe2O3 — веществокрасно-коричневого цвета:
25. Цвет оксидов
• Оксид меди(II) CuO чёрного цвета:26. Цвет оксидов
• Оксид магния MgO белого цвета:27. Цвет оксидов
• Оксид хрома(III) Cr2O3 тёмнозелёного цвета::28. Риски, связанные с воздействием оксидов на организм
• Самый ядовитый из оксидов — оксидуглерода(II), или угарный газ CO.
Его молекулы связываются гемоглобином крови
намного прочнее, чем молекулы кислорода.
Поэтому при наличии даже незначительной
примеси этого вещества в воздухе человек может
погибнуть от удушья.
• Ядовитыми также являются диоксид серы SO2
и диоксид азота NO2.
29.
Домашнее заданиеПараграф 21-22 учить.
1) Уравняйте реакции с помощью коэффициентов.
Дайте названия всем веществам:
а) Al + O2 = Al2O3
б) SO2 + O2 = SO3
в) BaO + H2O = Ba(OH)2
г) P2O5 + H2O = H3PO4
2) Решите задачу:
К 200 г 20%-ного раствора щелочи добавили 50 г воды
и 25 г твердой щелочи. Вычислите массовую долю
вещества в образовавшемся растворе.























 Химия
Химия