Похожие презентации:
Водород
1. Водород
*Водород2. ПЛАН
*ПЛАН*1. Положение в ПС, характеристика элемента.
*2. Нахождение в природе.
*3. История открытия.
*4. Физические свойства.
*5. Химические свойства.
*6. Способы получения.
*7. Применение.
3. Характеристика элемента
*Характеристикаэлемента
*Элемент: Н
*Порядковый №:1
*№ периода: I(малый)
*№ группы, подгруппа: I (А)
*Ar (Н):1
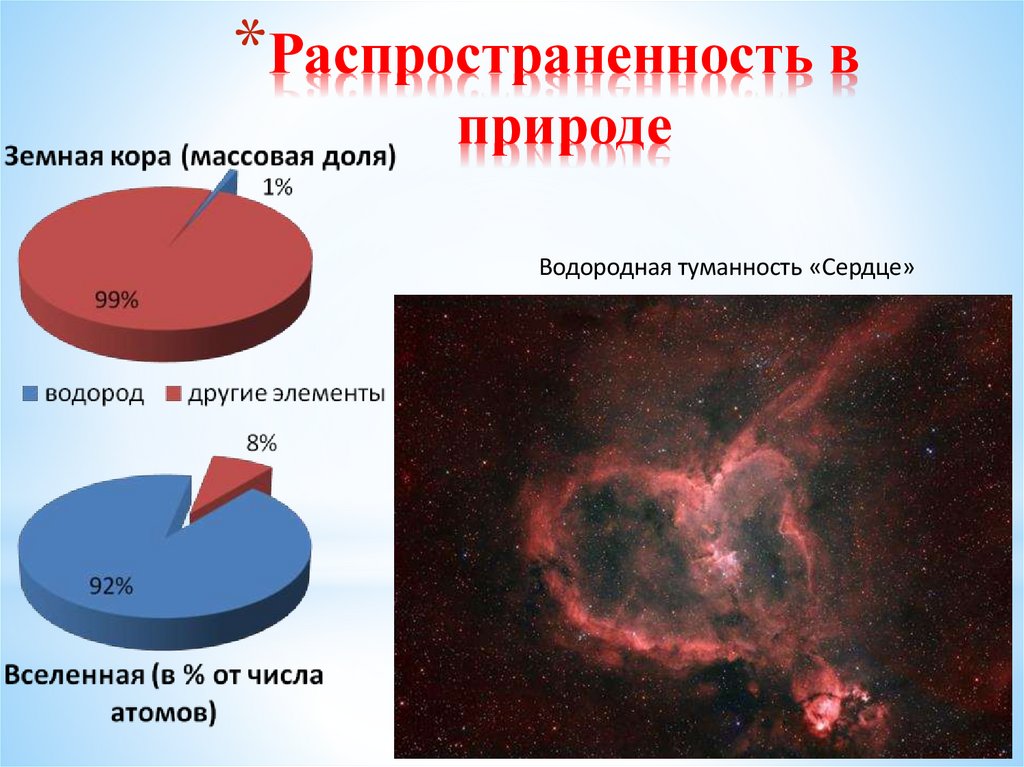
4. Распространенность в природе
*Распространенность вприроде
Водородная туманность «Сердце»
5. Историческая справка
*Историческаясправка
1766 г. – водород открыл Г. Кавендиш
1784 г. – А. Лавуазье назвал водород
hydrogene (др.-греч. hydro genes порождающий воду)
6. Физические свойства
*Физические свойства1. Газ без цвета, вкуса и запаха.
2. Легче воздуха в 14,5 раз.
3. Плохо растворим в воде.
4. Хорошо растворим в некоторых
металлах (например, Pd).
5. Самая высокая
теплопроводность среди
газообразных веществ (в 7 раз
выше теплопроводности
воздуха).
7. Химические свойства
*Химические свойства1) Взаимодействие с металлами:
Ca + H2 = CaH2
2) Взаимодействие с неметаллами
H2 + F2 = 2HF
t
2H2 + C = CH4
2H2 + O2 = 2H2O
3) Восстановление металлов из оксидов:
t
Fe2O3 + 3H2 = 2Fe + 3H2O
8. Способы получения
*Способы полученияI.
В промышленности – конверсией водяных паров с углем
или метаном:t
С + H2O = CO + H2
CH4 + H2O = CO + 3H2
9.
II. В лаборатории:1) действием разбавленных кислот (кроме HNO3)
на металлы:
Zn + 2HCl = ZnCl2 + H2
2) электролизом воды:
эл.ток
2H2O = 2H2 + O2
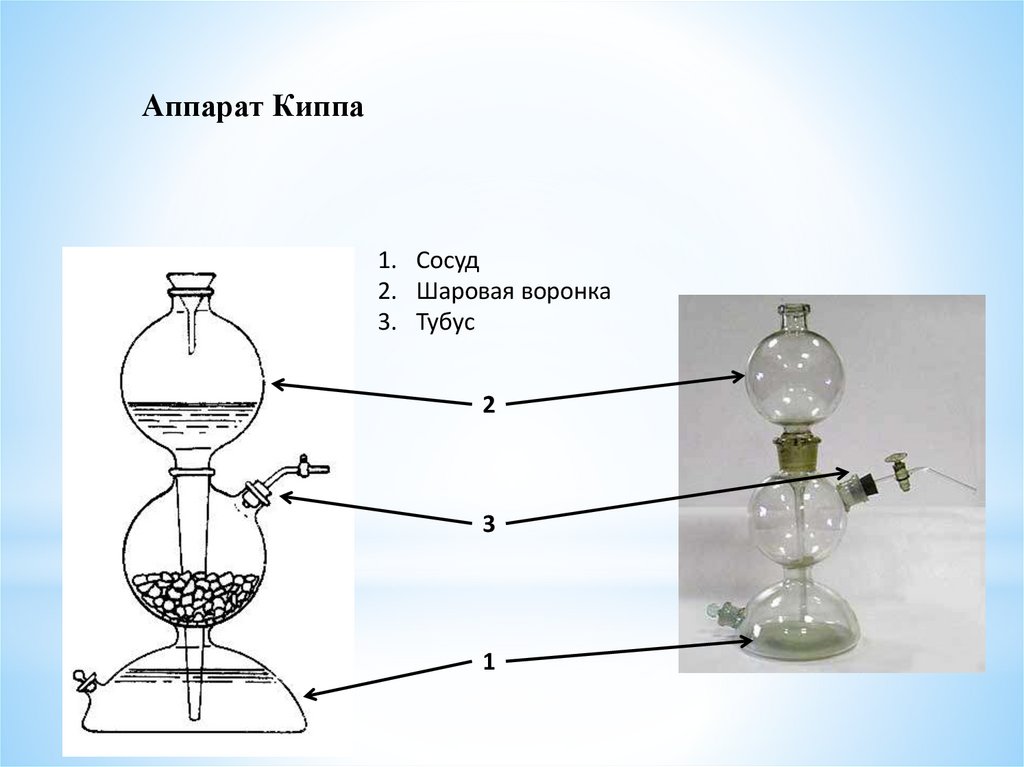
10.
Аппарат Киппа1. Сосуд
2. Шаровая воронка
3. Тубус
2
3
1
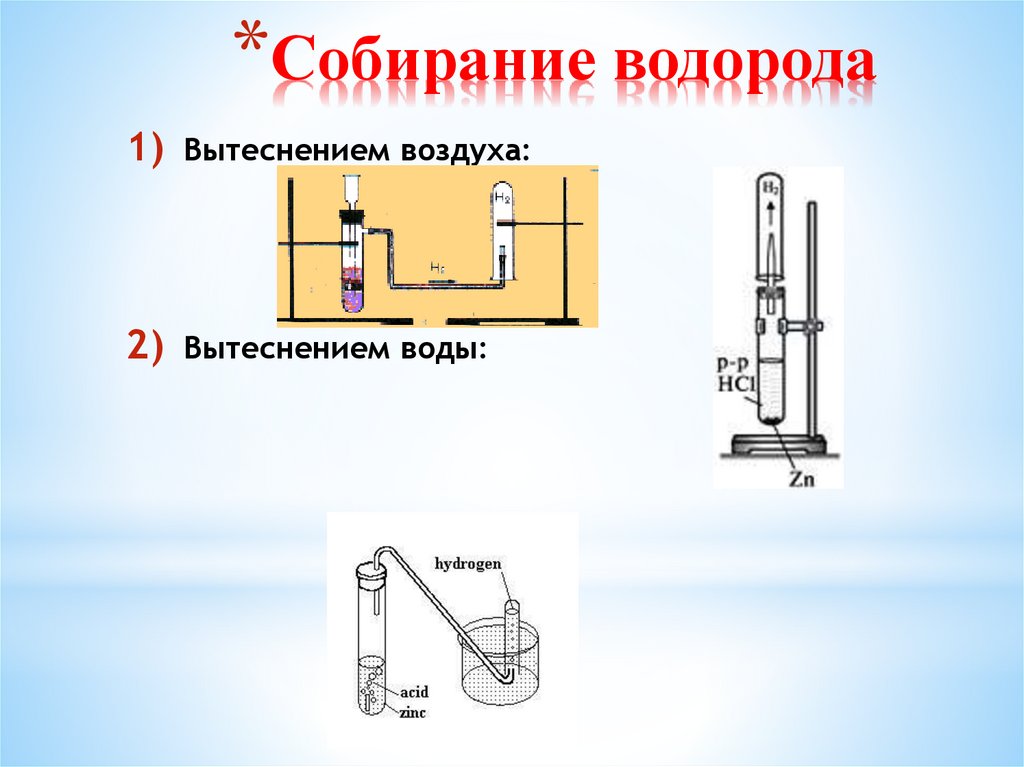
11. Собирание водорода
*Собирание водорода1) Вытеснением воздуха:
2) Вытеснением воды:
12. Применение
*Применение1) Химическая промышленность: получение аммиака,
метанола, мыла, пластмасс и др.
13.
2) Пищевая промышленность:а) производство маргарина
б) пищевая добавка Е949 (упаковочный газ)
14.
3) Топливо (ракетное, машинное)15.
4) Военная промышленность (производствоводородных бомб)
16.
5) Резка и сварка металловПламенем водородной горелки
можно резать и сваривать металлы














 Химия
Химия








