Похожие презентации:
1. Термодинамика (2)
1. Термодинамика химических процессов
Термодинамикаизучает
обмен
энергией между системой и внешней
средой и в частности, превращение
тепловой энергии в другие формы энергий.
Химическая термодинамика изучает
энергетические эффекты, сопровождающие
химические процессы, а также направление
их самопроизвольного протекания в данных
условиях.
При химических реакциях происходят
глубокие качественные изменения в системе,
рвутся связи в исходных веществах и
возникают новые в конечных продуктах. Эти
изменения сопровождаются поглощением
или выделением энергии.
2.
Термохимия - раздел термодинамики,изучающий
тепловые
эффекты
химической реакции.
Тепловой эффект реакции
обозначается ±Q [кДж].
Экзотермические
реакции
сопровождаются выделением теплоты,
тепловой эффект таких реакций носит
положительные значения:
А+В=С + Q кДж
Эндотермические
реакции
сопровождаются
поглощением
теплоты, тепловой эффект таких
реакции
имеет
отрицательные
значения:
А+В=С - Q кДж
3. Почему реакции выделяют или поглощают тепло?
Разрыв исходных связейДля разрушения химических связей в молекулах реагентов
всегда требуется затрата энергии. Эта энергия называется
энергией диссоциации связи и всегда положительна. Чем
прочнее связь, тем больше энергии необходимо для ее
разрыва.
Образование новых связей
При формировании химических связей в молекулах
продуктов всегда выделяется энергия. Эта энергия
называется энергией образования связи и всегда
отрицательна. Более прочные связи выделяют больше
энергии при образовании.
Энергетический баланс
Тепловой эффект реакции определяется разностью между
энергией образования и энергией разрыва связей:
ΔH = Σ(энергии разрыва) - Σ(энергии образования)
4.
Термодинамическая система – это часть пространства, выделенная для теоретического иэкспериментального изучения с позиций энергообмена и массообмена с внешней средой.
Система может быть отделена от внешней среды реальной или воображаемой границей.
Типы термодинамических систем
Изолированная система
Закрытая система
Открытая система
Это
система,
которая
не
обменивается ни энергией, ни
веществом с окружением. Она
полностью автономна и независима
от внешних воздействий.
Хотя идеально
изолированных
систем в
реальности не
существует, термос
является хорошим
приближением.
Система, которая обменивается
энергией, но не веществом с
окружением. Её масса остаётся
постоянной, но теплообмен и
работа могут происходить через
границы. Поршень, движущийся в
закрытом цилиндре, запаянная
ампула, грелка и др.
Эта
система
свободно
обменивается и энергией, и
веществом с окружением. Она
постоянно
взаимодействует
с
внешней средой. Примером такой
системы является кипящий чайник,
из которого выходят пар и тепло.
5.
Гомогенные и гетерогенные системыСтруктурная классификация
Термодинамические системы также классифицируются
по однородности их внутренней структуры. Это
разделение критически важно для выбора правильных
методов анализа и применения соответствующих
уравнений состояния.
Гомогенная система
Однородна по составу и свойствам во всех точках.
Физические и химические свойства не изменяются
при переходе от одной части системы к другой.
Описывается единым уравнением состояния.
Примеры: чистая вода, воздух, раствор соли в воде
Гетерогенная система
Состоит из нескольких фаз с различными
свойствами, разделённых чёткими границами
раздела. Каждая фаза характеризуется своими
параметрами состояния.
Примеры: вода и лёд, нефть и вода, газ и жидкость
Важно: Понимание типа системы
определяет выбор математических
моделей
и
методов
расчёта
термодинамических
процессов.
Гетерогенные системы требуют
учёта межфазных взаимодействий.
6.
Термодинамические процессыТермодинамический
процесс
представляет
собой
изменение состояния системы при взаимодействии с
окружением.
Каждый
процесс
характеризуется
определёнными условиями и ограничениями.
Изотермический процесс
Температура постоянна (T = const). Происходит
при хорошем тепловом контакте с термостатом.
Пример: медленное сжатие газа в цилиндре,
погружённом в ледяную воду.
Адиабатный процесс
Отсутствует теплообмен с окружением (Q = 0).
Происходит быстро или в теплоизолированной
системе. Пример: быстрое сжатие воздуха в
велосипедном насосе.
Изобарный процесс
Давление постоянно (P = const). Типичен для
процессов
в
открытых
сосудах
под
атмосферным давлением. Пример: нагревание
воздуха в цилиндре с подвижным поршнем.
Изохорный процесс
Объём постоянен (V = const). Происходит в
жёстких замкнутых сосудах. Пример: нагревание
газа в закрытом металлическом баллоне.
7.
Энергия химической реакции возникает за счет изменения в системевнутренней энергии U, либо энтальпии Н.
Внутренняя энергия системы U - это общий ее запас, включающий энергию
поступательного
и
вращательного
движения
молекул,
энергию
внутримолекулярных колебаний атомов и атомных трупп, энергию движения
электронов, внутриядерную энергию и т. д.
Величины, позволяющие определить состояние системы, называются
параметрами состояния. В химии чаще всего используются следующие
параметры состояния: давление, температура, объем, состав системы.
Химические реакции обычно протекают при постоянном давлении –
изобарные процессы – p = const или при постоянном объеме изохорные
процессы – V = const.
8.
Первый закон термодинамики:в любом процессе приращение внутренней энергии системы ∆U равно
количеству сообщаемой системе теплоты Q минус количество работы А,
совершаемой системой
∆U = Q - А
Так как большинство химических реакций проходит при постоянном давлении,
то для изобарно-изотермического процесса (р = const, Т = const) теплота Qp
будет равна:
Q = ∆U + p∆V;
Q = (U2 - U1) + p(V2 – V1);
Q = (U2 + pV2) - (U1+ pV1).
Сумму U + pV обозначим через Н, тогда Q = Н2 – Н1 = ∆H.
Теплота реакции в изобарно-изотермическом процессе Qp равна
изменению энтальпии системы ∆H (если единственным видом работы
является работа расширения) Qp = ∆H.
9.
ΔН0 – стандартная энтальпия образования вещества – это энтальпияобразования 1 моля сложного вещества из простых веществ.
Энтальпия образования сложного вещества
для стандартных условий обозначается Н0обр. (или
латинский вариант Н0f, где f – первая буква
слова formation образование) и называется
стандартной энтальпией.
За стандартные условия принимают давление
101, 325 кПа и температуру 298 K (25 оС).
Т(ст.у.)= 25 оС + 273 = 298 К
Для устойчивой формы простого вещества
(например, O₂ (газ), N₂ (газ), C (графит), I₂
(твёрдый)) энтальпия образования равна нулю.
Для других модификаций того же элемента
(например, O₃ (озон), алмаз вместо графита,
газообразный йод вместо твёрдого) – энтальпия
образования ≠ 0, так как они образуются из
устойчивой формы с затратами энергии.
10.
Закон Гессатепловой эффект (энтальпия) реакции
зависит от природы и физического
состояния
исходных
веществ
и
конечных продуктов, но не зависит от
пути реакции, т.е. от числа и характера
промежуточных стадий.
Следствия из закона Гесса позволяют теоретически рассчитывать энтальпию
химических реакций.
Следствие 1.
Энтальпия образования и энтальпия разложения одного моля сложного
вещества равны по абсолютной величине, но противоположны по знаку:
Н0образ. = - Н0разлож
Следствие 2.
Энтальпия химической реакции ∆Н0 x.p. (при стандартных условиях) равна
разности между энтальпиями образования продуктов реакции ( Н0обр.прод.) и
энтальпиями образования исходных веществ ( Н0обр.исх..) с учетом их
стехиометрических коэффициентов
Но реак. = Н0 обр.прод. Н0 обр.исх.
где - условное обозначение суммы
11.
Пример применения: образование CO₂Рассмотрим классический пример, демонстрирующий закон Гесса на реакции образования
углекислого газа из графита и кислорода. Этот процесс можно осуществить двумя
различными путями:
Путь 1: Прямая реакция
C (графит) + O₂ → CO₂
ΔH₁ = -393 кДж/моль
Прямое сжигание графита в избытке кислорода даёт углекислый газ с
выделением 393 кДж энергии на моль углерода.
Путь 2: Через промежуточный CO
Стадия 1: C + ½ O₂ → CO, ΔH₂ = -111 кДж/моль
Стадия 2: CO + ½ O₂ → CO₂, ΔH₃ = -282 кДж/моль
Сначала неполное сгорание графита до моноксида углерода, затем
окисление CO до CO₂.
Проверка закона
ΔH₁ = ΔH₂ + ΔH₃
-393 = -111 + (-282)
-393 = -393 ✓
Этот результат подтверждает закон Гесса:
независимо от того, сжигаем ли мы графит
напрямую до CO₂ или проводим процесс в две
стадии через образование CO, общий тепловой
эффект остаётся одинаковым.
12.
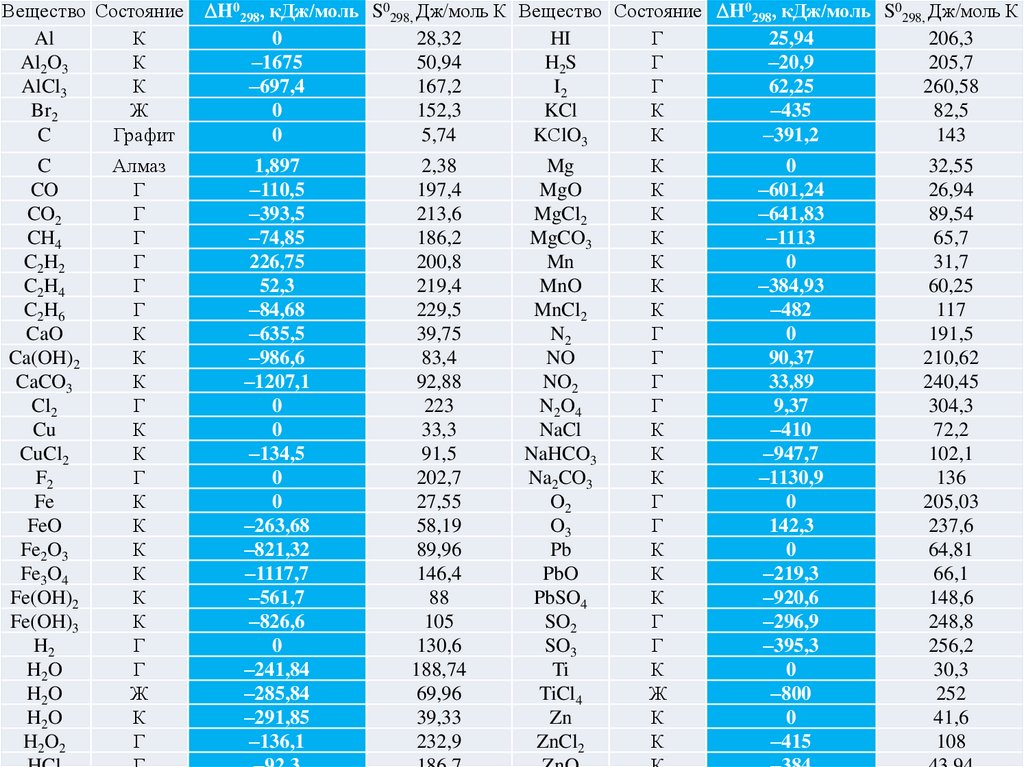
Вещество СостояниеAl
К
Al2O3
К
AlCl3
К
Br2
Ж
C
Графит
C
CO
CO2
CH4
C2H2
C2H4
C2H6
CaO
Ca(OH)2
CaCO3
Cl2
Cu
CuCl2
F2
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
H2
H2O
H2O
H2O
H2O2
Алмаз
Г
Г
Г
Г
Г
Г
К
К
К
Г
К
К
Г
К
К
К
К
К
К
Г
Г
Ж
К
Г
H0298, кДж/моль S0298, Дж/моль К Вещество Состояние H0298, кДж/моль S0298, Дж/моль К
0
28,32
HI
Г
25,94
206,3
–1675
50,94
H2S
Г
–20,9
205,7
–697,4
167,2
I2
Г
62,25
260,58
0
152,3
KCl
К
–435
82,5
0
5,74
KСlO3
К
–391,2
143
1,897
–110,5
–393,5
–74,85
226,75
52,3
–84,68
–635,5
–986,6
–1207,1
0
0
–134,5
0
0
–263,68
–821,32
–1117,7
–561,7
–826,6
0
–241,84
–285,84
–291,85
–136,1
2,38
197,4
213,6
186,2
200,8
219,4
229,5
39,75
83,4
92,88
223
33,3
91,5
202,7
27,55
58,19
89,96
146,4
88
105
130,6
188,74
69,96
39,33
232,9
Mg
MgO
MgCl2
MgCO3
Mn
MnO
MnCl2
N2
NO
NO2
N2O4
NaCl
NaHCO3
Na2CO3
O2
O3
Pb
PbO
PbSO4
SO2
SO3
Ti
TiCl4
Zn
ZnCl2
К
К
К
К
К
К
К
Г
Г
Г
Г
К
К
К
Г
Г
К
К
К
Г
Г
К
Ж
К
К
0
–601,24
–641,83
–1113
0
–384,93
–482
0
90,37
33,89
9,37
–410
–947,7
–1130,9
0
142,3
0
–219,3
–920,6
–296,9
–395,3
0
–800
0
–415
32,55
26,94
89,54
65,7
31,7
60,25
117
191,5
210,62
240,45
304,3
72,2
102,1
136
205,03
237,6
64,81
66,1
148,6
248,8
256,2
30,3
252
41,6
108
13.
Например, для реакции:аА + bВ сС + dD
Н0реак. = (c Н0 обр.C + d Н0 обр.D) (a Н0 обр.A + b Н0 обр.B),
где А, В и С, D - реагенты и продукты реакции, соответственно;
а, b, с, d - соответствующие стехиометрические коэффициенты при реагентах и
продуктах реакции;
Н0обр.A, Н0обр.B, Н0обр.C, Н0обр.D – энтальпии образования реагентов и продуктов
реакции.
Пример. Вычислить изменение энтальпии реакции (при стандартных условиях)
СH4(г) + СО2(г) ↔ 2СО(г) + 2Н2(г).
Решение:
Но реак. = i Но обр.прод. - i Но обр.реаг.
∆Н0x.p = (2 ·∆Н0 CO + 2· 0) – (∆Н0 CH4 + ∆Н0 CO2);
∆Н0x.p = (2 × ( 110,5) + 2 × 0) – ( 74,85 +(– 393,5)) = 247,5 кДж
Так как ∆Ноx.p>0 реакция является эндотермической, сопровождается
поглощением теплоты.
При экзотермических реакциях энтальпия системы уменьшается и ∆H<О,
Q > 0 ∆H < О
При эндотермических - увеличивается и ∆H>О.
Q < 0 ∆H > О
14.
Энтропия. Второй закон термодинамикиЭнтропия (S) – это термодинамическая функция, которая служит мерой
неупорядоченности системы.
Энтропия вещества в стандартном состоянии называется абсолютной
стандартной энтропией S0.
В справочниках обычно приводится стандартная энтропия S0298 при 298К.
Второй закон термодинамики (для изолированных
систем):
в изолированных системах самопроизвольно идут
только такие процессы, которые сопровождаются
возрастанием энтропии (∆ S≥О).
Равновесие характеризуется максимумом энтропии.
15.
Энтропия фазовых переходов:Sтв. < S ж. < S газ.
Пример. Изменение энтропии в случае перехода льда в жидкое состояние:
∆S0 ф.п = S0 H2O(ж) - S0 H2O(к);
∆S0 ф.п = 69,96 - 39,33 = 30,63 Дж/моль ·град.
Энтропия - есть мера неупорядоченности состояния вещества. Лед имеет
кристаллическую структуру, в которой молекулы воды расположены упорядоченно
и могут находиться лишь в определенных точках пространства. Так как степень
беспорядка в жидком состоянии возрастает, изменение энтропии ∆S0 ф.п также
является положительной величиной, т. е. (∆S0 ф.п > 0).
16.
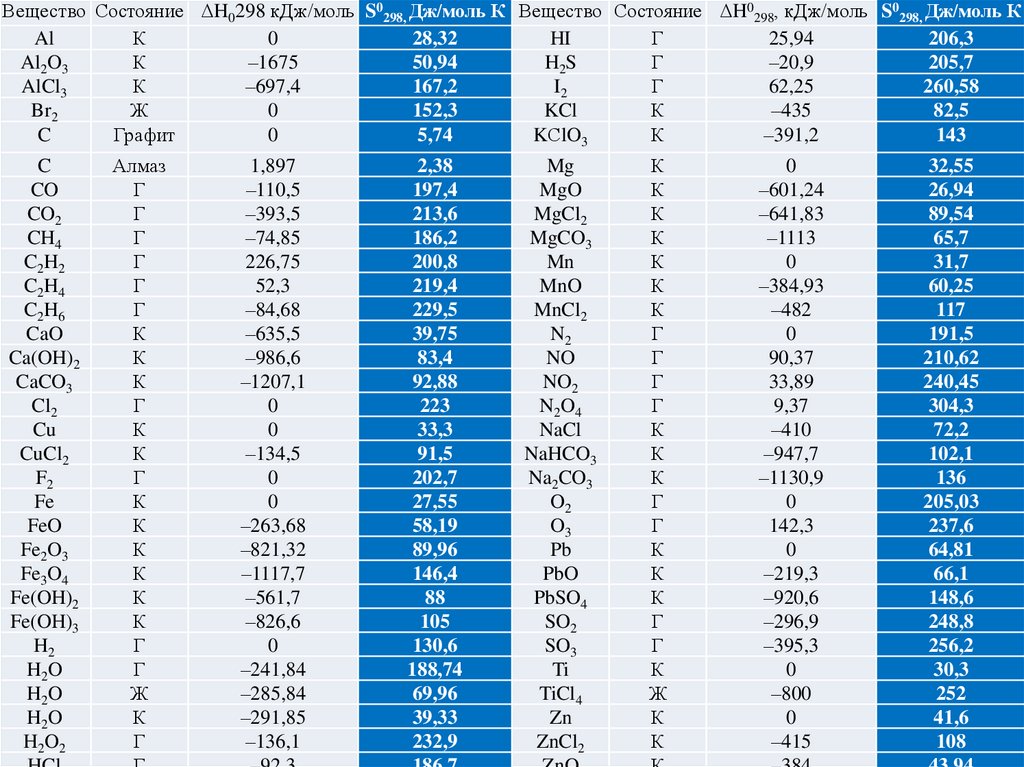
Вещество Состояние H0298 кДж/моль S0298, Дж/моль К Вещество Состояние H0298, кДж/моль S0298, Дж/моль КAl
К
0
28,32
HI
Г
25,94
206,3
Al2O3
К
–1675
50,94
H2S
Г
–20,9
205,7
AlCl3
К
–697,4
167,2
I2
Г
62,25
260,58
Br2
Ж
0
152,3
KCl
К
–435
82,5
C
Графит
0
5,74
KСlO3
К
–391,2
143
C
CO
CO2
CH4
C2H2
C2H4
C2H6
CaO
Ca(OH)2
CaCO3
Cl2
Cu
CuCl2
F2
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
H2
H2O
H2O
H2O
H2O2
Алмаз
Г
Г
Г
Г
Г
Г
К
К
К
Г
К
К
Г
К
К
К
К
К
К
Г
Г
Ж
К
Г
1,897
–110,5
–393,5
–74,85
226,75
52,3
–84,68
–635,5
–986,6
–1207,1
0
0
–134,5
0
0
–263,68
–821,32
–1117,7
–561,7
–826,6
0
–241,84
–285,84
–291,85
–136,1
2,38
197,4
213,6
186,2
200,8
219,4
229,5
39,75
83,4
92,88
223
33,3
91,5
202,7
27,55
58,19
89,96
146,4
88
105
130,6
188,74
69,96
39,33
232,9
Mg
MgO
MgCl2
MgCO3
Mn
MnO
MnCl2
N2
NO
NO2
N2O4
NaCl
NaHCO3
Na2CO3
O2
O3
Pb
PbO
PbSO4
SO2
SO3
Ti
TiCl4
Zn
ZnCl2
К
К
К
К
К
К
К
Г
Г
Г
Г
К
К
К
Г
Г
К
К
К
Г
Г
К
Ж
К
К
0
–601,24
–641,83
–1113
0
–384,93
–482
0
90,37
33,89
9,37
–410
–947,7
–1130,9
0
142,3
0
–219,3
–920,6
–296,9
–395,3
0
–800
0
–415
32,55
26,94
89,54
65,7
31,7
60,25
117
191,5
210,62
240,45
304,3
72,2
102,1
136
205,03
237,6
64,81
66,1
148,6
248,8
256,2
30,3
252
41,6
108
17.
Изменение энтропии химической реакции равно разности суммы энтропийпродуктов реакции и исходных веществ с учетом стехиометрических
коэффициентов:
∆S x.p = ∑ S0 прод - ∑S0 исх
Так в стандартных условиях для реакции:
aA + bB = сС + dD
S0p =(cS0C+ dS0D) - (aS0А+ bS0В),
где S0p – изменение энтропии для данной реакции, Дж/К;
S0А, S0В, S0C, S0D, – стандартные значения энтропий веществ, участвующих в
реакции, Дж/моль·К.
Пример. Вычислить изменение энтропии реакции (при стандартных условиях)
СH4(г) + СО2(г) ↔ 2СО(г) + 2Н2(г).
Решение.
∆S0 x.p = ∑S0 прод ∑S0 исх.веществ;
∆S0 x.p = (2 S0CO + 2 S0 H2) – (S0CH4 + S0CO2);
∆S0 x.p = ((2 × 197,4) + (2 × 130,6)) (186,2 + 213,65) =256,2 Дж/моль • град или
0,2562 кДж/ моль • град.
Как видно, энтропия системы в результате реакции возросла (энтропия реакции
положительная) ∆S0 x.p > 0.
18.
СВОБОДНАЯ ЭНЕРГИЯ ГИББСАЭнтальпийный и энтропийный факторы, взятые по отдельности, не
могут быть критериями самопроизвольного течения химических
реакций.
На каждую из этих противоположных тенденций влияют и природа
веществ, и условия проведения реакции.
Учитывает эти противоположные тенденции предложенная
американским физико-химиком Д. Гиббсом функция состояния,
которая называется энергией Гиббса (свободная энергия):
GТ = H – T S
Характер изменения энергии Гиббса позволяет судить о
принципиальной возможности или невозможности осуществления
процесса.
19.
Самопроизвольно (спонтанно) протекают реакции, если энергия Гиббса висходном состоянии системы больше, чем в конечном: ∆G<0.
Увеличение энергии Гиббса (∆G>0) свидетельствует о невозможности
самопроизвольного осуществления процесса в данных условиях.
Если же ∆G=0, то система находится в состоянии химического равновесия.
В соответствии с уравнением ∆G = ∆Н T∆S самопроизвольному протеканию
процесса способствует уменьшение энтальпии и увеличение энтропии
системы, то есть когда ∆Н<0 и ∆S>0.
Энтальпийный фактор (ΔH): стремление системы к выделению тепла и
переходу в состояние с минимальной энергией. Если ΔH < 0 (экзотермичность) –
это «подталкивает» реакцию вперёд.
Энтропийный фактор (TΔS): стремление системы к увеличению беспорядка.
Если ΔS > 0 – тоже способствует самопроизвольности.
20.
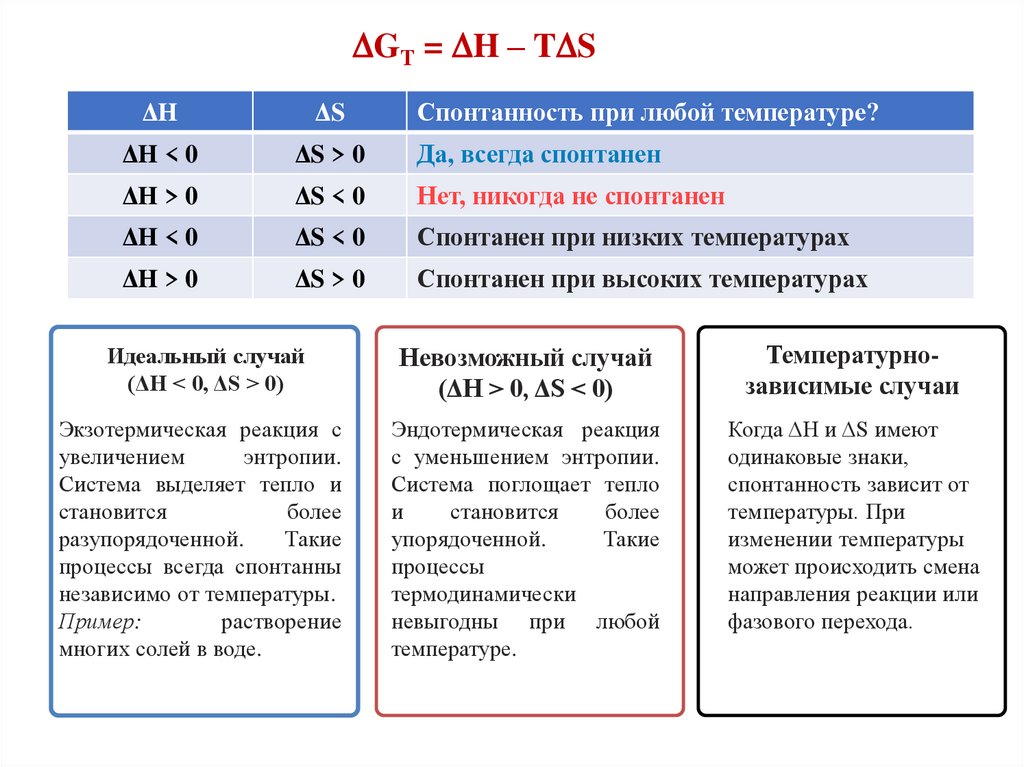
GТ = H – T SΔH
ΔS
Спонтанность при любой температуре?
ΔH < 0
ΔS > 0
Да, всегда спонтанен
ΔH > 0
ΔS < 0
Нет, никогда не спонтанен
ΔH < 0
ΔS < 0
Спонтанен при низких температурах
ΔH > 0
ΔS > 0
Спонтанен при высоких температурах
Идеальный случай
(ΔH < 0, ΔS > 0)
Невозможный случай
(ΔH > 0, ΔS < 0)
Температурнозависимые случаи
Экзотермическая реакция с
увеличением
энтропии.
Система выделяет тепло и
становится
более
разупорядоченной.
Такие
процессы всегда спонтанны
независимо от температуры.
Пример:
растворение
многих солей в воде.
Эндотермическая реакция
с уменьшением энтропии.
Система поглощает тепло
и
становится
более
упорядоченной.
Такие
процессы
термодинамически
невыгодны при любой
температуре.
Когда ΔH и ΔS имеют
одинаковые знаки,
спонтанность зависит от
температуры. При
изменении температуры
может происходить смена
направления реакции или
фазового перехода.
21.
Пример расчёта энергии ГиббсаУсловие задачи
Рассмотрим химическую реакцию при
стандартных условиях:
• Изменение энтальпии: ΔH = -234 кДж/моль
• Изменение энтропии: ΔS = -164 Дж/(К·моль)
• Температура: T = 25°C = 298 K
Приведение единиц к единообразию
Переводим энтропию из Дж в кДж для соответствия
единицам энтальпии:
ΔS = -164 Дж/(К·моль) = -0.164 кДж/(К·моль)
Применение формулы Гиббса
GТ = H – T S
ΔG = -234 - 298 × (-0.164)
ΔG = -234 + 48.9 = -185.1 кДж/моль
Интерпретация результата
Поскольку ΔG < 0, реакция спонтанна при 25°C.
Несмотря на уменьшение энтропии системы,
экзотермический характер реакции обеспечивает её
термодинамическую
выгодность
при
данной
температуре.
22. Вопросы для подготовки к защите лабораторной работы «Энергетика химических процессов»
1. Типы термодинамических систем (примеры).2. Тепловой эффект химической реакции. Типы химических реакций в
зависимости от теплового эффекта.
3. Определение теплового эффекта.
4. Понятие энтальпии. Стандартная энтальпия образования вещества
(определение).
5. Закон Гесса. Следствия закона Гесса. Расчеты.
6. Понятие энтропии. Стандартная энтропия вещества. Энтропия
фазовых переходов.
7. Второй закон термодинамики.
8. Свободная энергия Гиббса. Влияние энтальпийного и энтропийного
факторов.
23.
Тест для самоконтроля «Термодинамика химических процессов»1.Установить соответствие:
А. ΔH > 0
Б. ΔH < 0
В. ΔS > 0
Г. ΔS < 0
Д. ΔG < 0
Е. ΔG = 0
Ж. ΔG > 0
а) реакция протекает самопроизвольно
б) реакция экзотермическая
в) реакция не протекает самопроизвольно
г) реакция эндотермическая
д) в ходе реакции беспорядок в системе возрастает
е) в ходе реакции беспорядок в системе уменьшается
ж) в системе установилось химическое равновесие
з) нет правильного ответа
2. Предскажите знаки изменения энтропии в реакциях:
а) H₂O(ж) = H₂O(г)
б) 2H₂O(г) = 2H₂(г) + O₂(г)
в) H₂SO₄ + Ba(OH)₂ = BaSO₄(тв) + 2H₂O(ж)
3. Эндотермическая реакция,
стандартных условиях
А. H₂(г) + F₂(г) = 2HF(г)
Б. 2C(т) + 2H₂(г) = C₂H₄(г)
не
протекающая
ΔH⁰₂₉₈ = –537 кДж
ΔH⁰₂₉₈ = +52,2 кДж
самопроизвольно
при
24.
4. Установить соответствие. Укажите знаки изменения энтальпии и энтропии, еслистандартный тепловой эффект реакции при 298 K:
А. C₂H₂(г) + H₂(г) = C₂H₄(г), ΔH⁰₂₉₈ = –168.47 кДж/моль;
Б. Na(т) + 2H₂O(ж) = 2NaOH(ж) + H₂(г), ΔH⁰₂₉₈ = –368 кДж/моль.
а) ΔH>0; ΔS>0;
б) ΔH<0; ΔS<0;
в) ΔH<0; ΔS>0;
г) ΔH>0; ΔS<0.
5. Установить соответствие. Укажите, при каких температурах возможна реакция:
А. ΔH>0; ΔS>0
Б. ΔH>0; ΔS<0
В. ΔH<0; ΔS>0
Г. ΔH<0; ΔS<0
а) возможна при высоких температурах, ΔG<0;
б) возможна при низких температурах, ΔG<0;
в) возможна при любых температурах, ΔG<0;
г) невозможна при любых температурах, ΔG>0.
6. Установить соответствие. Установите тип системы:
А. изолированная
Б. закрытая (замкнутая)
В. открытая (незамкнутая)
а) термос со льдом
б) ампула с аргоном
в) пробирка с веществами Na₂CO₃ + HCl →
г) пробирка с веществами NaOH + CuCl₂ →




















 Химия
Химия








