Похожие презентации:
Лекция №6
1. Лекция №6
КВАНТОВОМЕХАНИЧЕСКИЕОСНОВЫ БИОЭНЕРГЕТИКИ
2.
3.
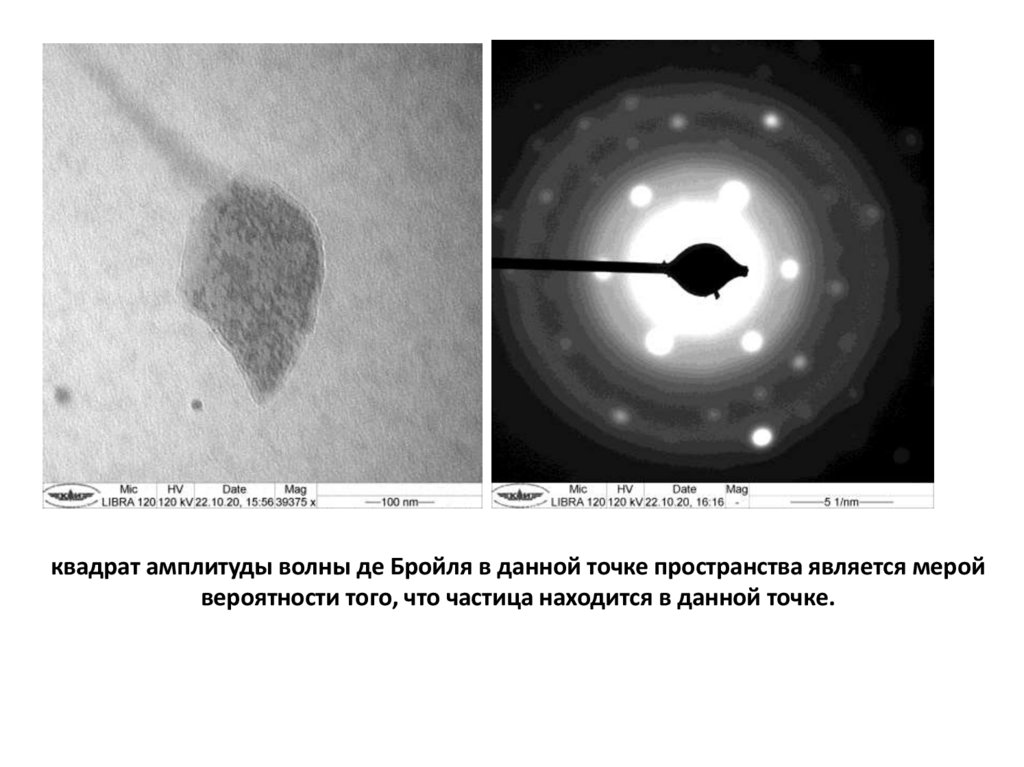
квадрат амплитуды волны де Бройля в данной точке пространства является меройвероятности того, что частица находится в данной точке.
4.
5.
6.
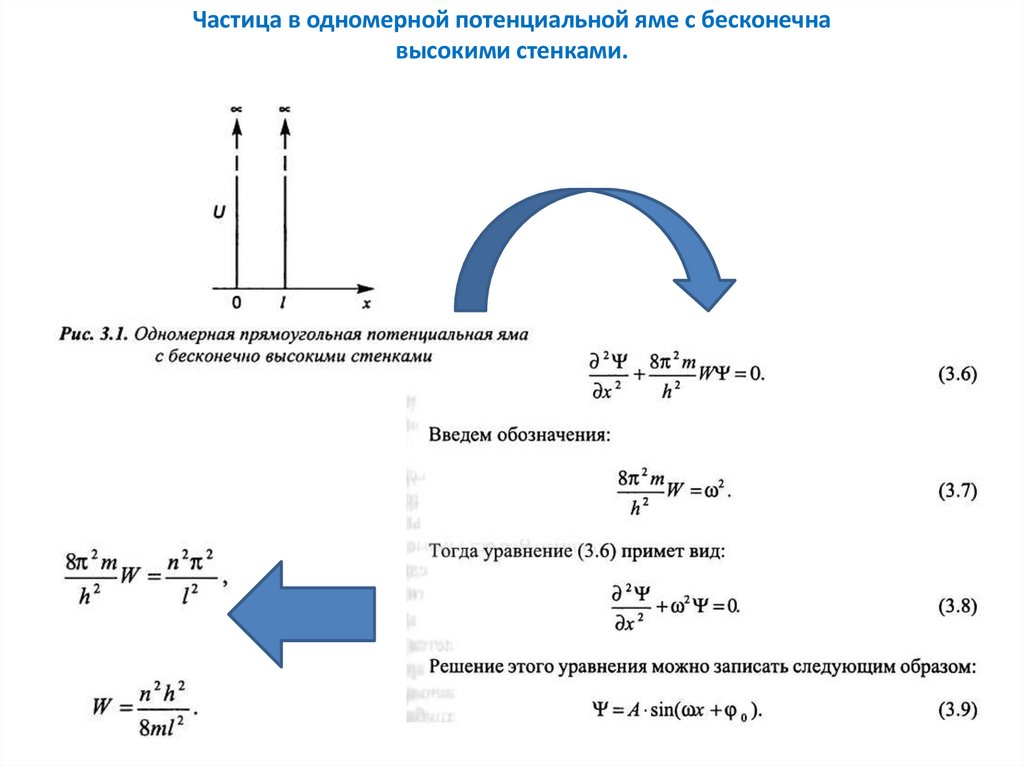
Частица в одномерной потенциальной яме с бесконечнавысокими стенками.
7.
Частица в одномерной потенциальной яме с бесконечнавысокими стенками.
8.
9.
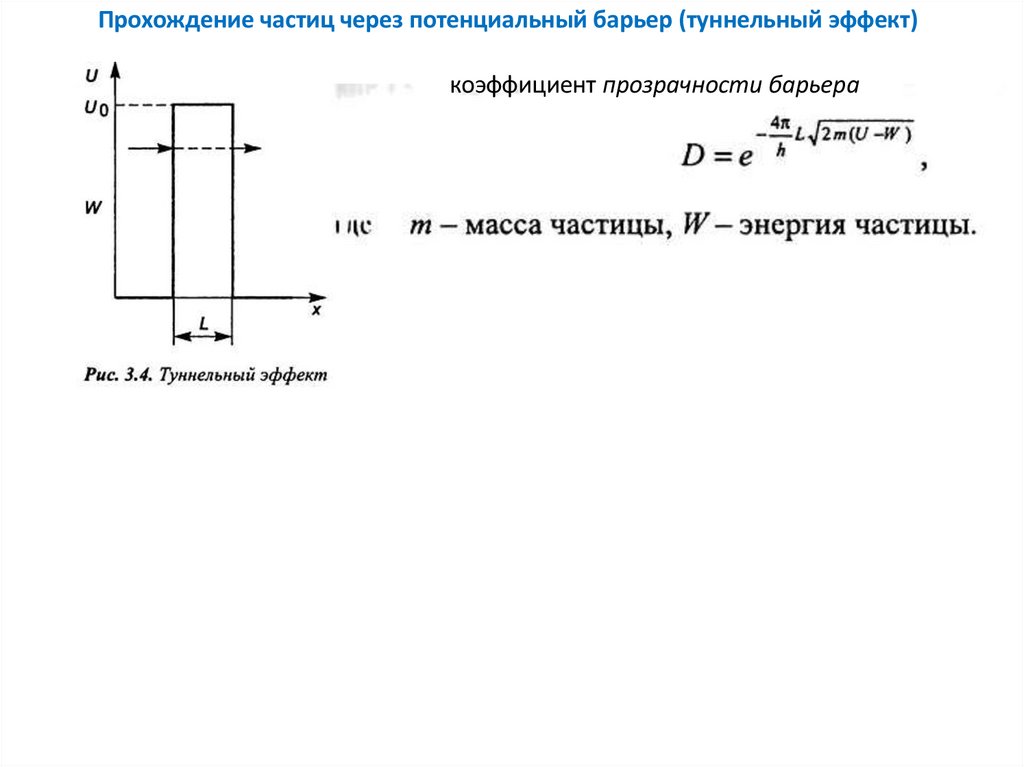
Прохождение частиц через потенциальный барьер (туннельный эффект)коэффициент прозрачности барьера
10.
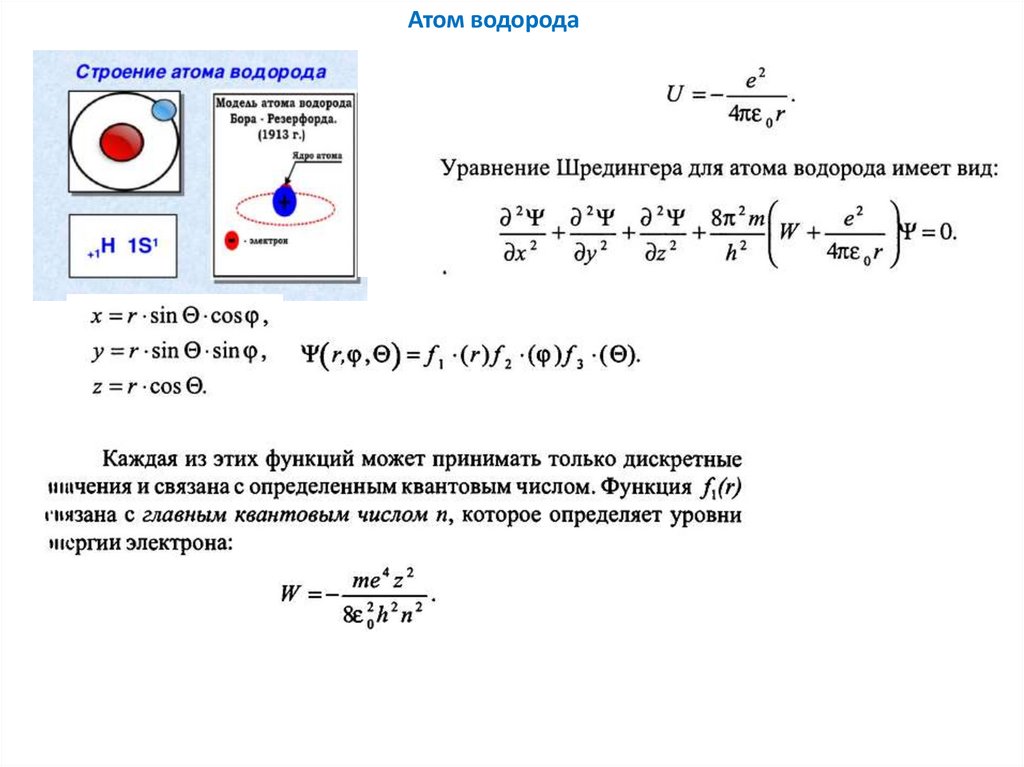
Атом водорода11.
12.
13.
Применение квантовой механики в биоэнергетике:Фотосинтез:
В процессе фотосинтеза растения преобразуют световую энергию в химическую
энергию с помощью молекул хлорофилла. Квантовые процессы здесь помогают
объяснить, как энергия фотона передается через светособирающие комплексы к
реакционному центру с высокой эффективностью.
Окислительное фосфорилирование:
В митохондриях клетки электроны переносятся через дыхательную цепь, создавая
градиент протонов, который используется для синтеза АТФ — основной
энергетической молекулы клетки. Здесь электроны могут перемещаться через
молекулы благодаря квантовому туннелированию.
Ферменты и катализ:
Некоторые ферменты ускоряют реакции на квантовом уровне, изменяя
энергетические барьеры или создавая условия для квантового туннелирования
субстратов через реакционный центр.
Восприятие света и магнитных полей:
В некоторых биологических системах, таких как глазной пигмент родопсин или
способность птиц ориентироваться по магнитному полю Земли, наблюдаются
квантовые эффекты при взаимодействии молекул с фотонами или магнитными
полями.
14.
Испускание и поглощение энергии атомами и молекулами15.
Спин электрона — это квантово-механическая характеристика, описывающая его внутренний угловой момент. Хотя вклассической физике спин можно было бы представить как вращение частицы вокруг своей оси, в квантовой
механике это более абстрактное понятие. Спин является одной из фундаментальных характеристик элементарных
частиц, таких как электрон.
Основные моменты о спине электрона:
Квантовое значение спина: Спин электрона может принимать только два возможных значения, которые условно
обозначаются как +1/2 (спин «вверх») и −1/2 (спин «вниз»). Эти значения отражают разные направления его спина
относительно внешнего магнитного поля или другой системы отсчета.
Фундаментальная природа: Спин не связан с реальным вращением электрона в пространстве. Электрон считается
точечной частицей без классической структуры, и его спин возникает из квантовой механики как внутренняя
характеристика.
Влияние на магнитные свойства: Электрон с ненулевым спином ведет себя как маленький магнит. Это связано с тем,
что движение заряда (в данном случае внутреннее движение, связанное со спином) порождает магнитное поле.
Именно благодаря спину электроны играют ключевую роль в возникновении магнетизма в материалах.
Принцип Паули: Спин электрона связан с одним из основополагающих принципов квантовой механики —
принципом запрета Паули. Этот принцип гласит, что два электрона не могут находиться в одном и том же квантовом
состоянии одновременно. То есть, если два электрона находятся в одной и той же орбитальной оболочке, их спины
должны быть противоположны.
16.
1. Правила отбора определяют возможные изменения квантовых чисел при переходе, посколькусостояния
атома
характеризуются
с
помощью
этих
чисел.
Так,
при
испускании или поглощении кванта света возможен только такой переход электрона с одного
уровня на другой, при котором орбитальное квантовое число изменяется на единицу: Δl = ±1.
Поэтому, электрон не может перейти с уровня s (/ = 0) на уровень d (I = 2), а может перейти на
уровень р (I = 1). Это правило отбора является следствием закона сохранения момента импульса.
Дело в том, что фотон имеет собственный момент импульса (спин), равный единице. При
испускании кванта фотон уносит из атома этот момент, а при поглощении его привносит.
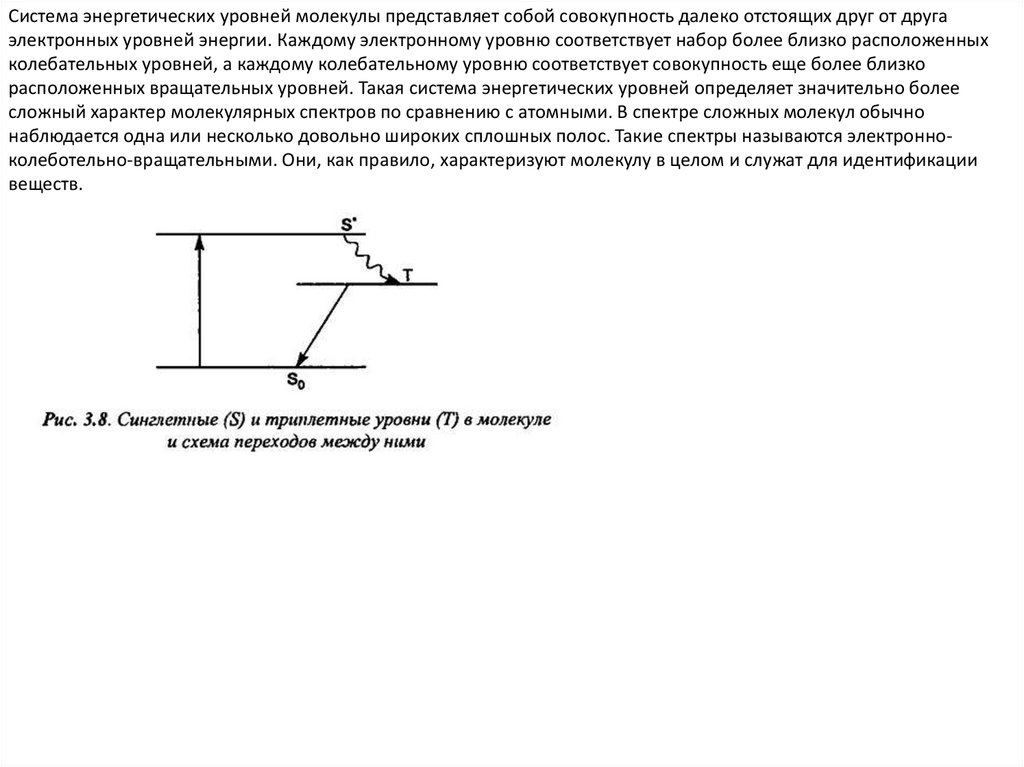
2. Разрешенными являются переходы, при которых общий спин атома не изменяется: Δs = 0. В
соответствии с этим правилом переход из синглетного состояния в триплетное (или наоборот)
является запрещенным. Однако этот запрет не является строгим, просто вероятность такого
перехода очень мала. Уровень, переход с которого на более низкие уровни имеет малую
вероятность (запрещен), называется метастабилъным. Вследствие малой вероятности перехода
в основное состояние атомы могут находиться в метастабильном со стоянии значительно дольше,
чем в любом другом возбужденном состоянии.
17.
Уровни энергии молекулУровни энергии молекул можно разделить на три основных типа, соответствующих различным видам движения и
взаимодействия внутри молекулы:
Электронные уровни энергии: Эти уровни связаны с энергетическими состояниями электронов в молекуле. Когда
молекула поглощает или излучает свет (фотоны), электроны могут переходить между этими энергетическими
уровнями. Электронные переходы сопровождаются большими изменениями в энергии и находятся в
ультрафиолетовом и видимом спектрах. Электронные состояния часто обозначаются буквами, например, S0
(основное состояние) или S1 (возбужденное состояние).
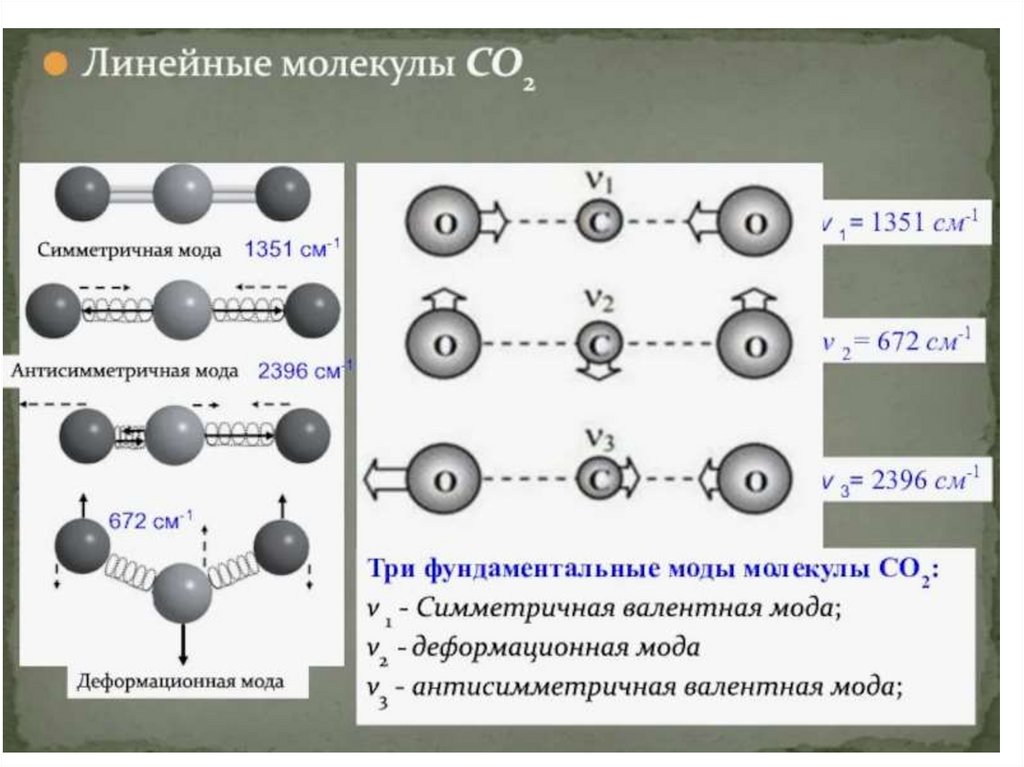
Колебательные уровни энергии: Вибрационные уровни энергии связаны с колебаниями атомов внутри молекулы.
Эти колебания могут быть растяжениями или изгибами химических связей. Различные колебательные состояния
описываются квантовыми числами, и переходы между ними находятся в инфракрасном диапазоне.
Вращательные уровни энергии: Эти уровни связаны с вращательным движением молекулы вокруг своих осей. Они
гораздо менее энергозатратны, чем вибрационные или электронные переходы, и обычно наблюдаются в
микроволновом диапазоне.
18.
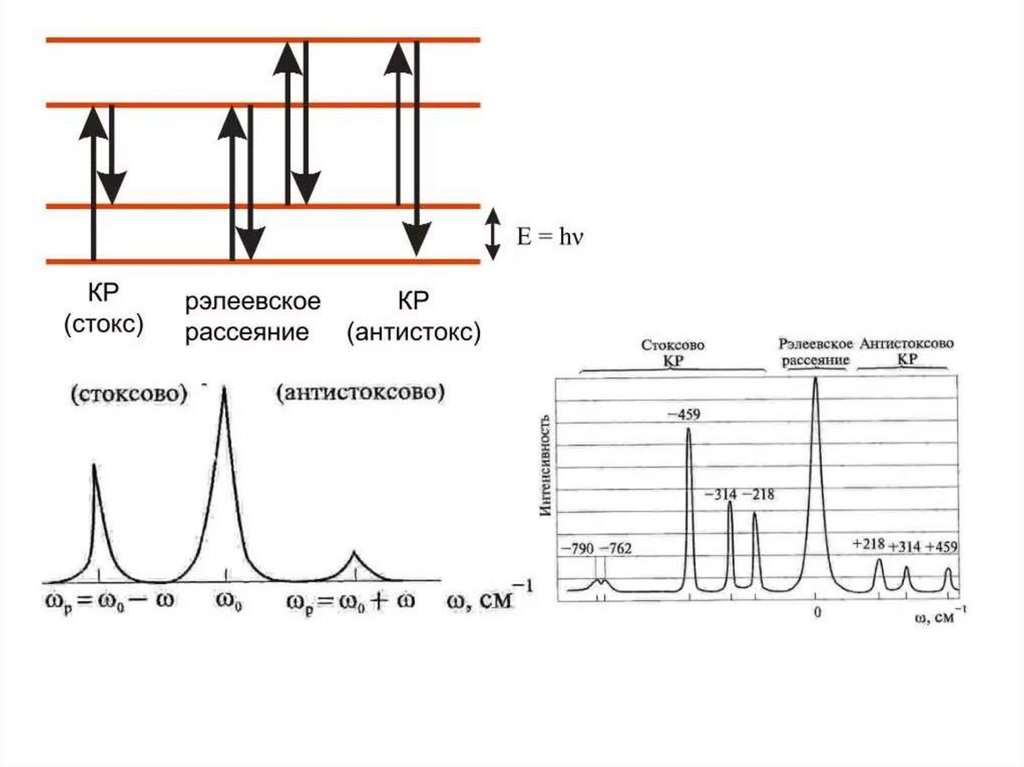
Система энергетических уровней молекулы представляет собой совокупность далеко отстоящих друг от другаэлектронных уровней энергии. Каждому электронному уровню соответствует набор более близко расположенных
колебательных уровней, а каждому колебательному уровню соответствует совокупность еще более близко
расположенных вращательных уровней. Такая система энергетических уровней определяет значительно более
сложный характер молекулярных спектров по сравнению с атомными. В спектре сложных молекул обычно
наблюдается одна или несколько довольно широких сплошных полос. Такие спектры называются электронноколеботельно-вращательными. Они, как правило, характеризуют молекулу в целом и служат для идентификации
веществ.
19.
20.
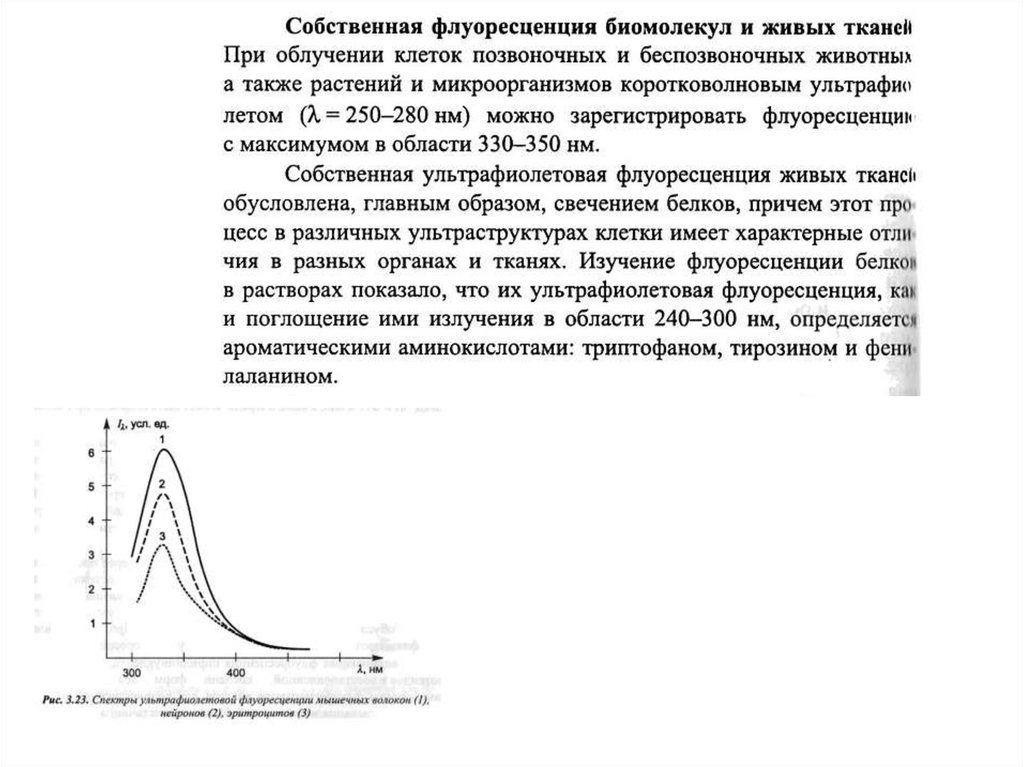
Время жизни возбужденного состояния21.
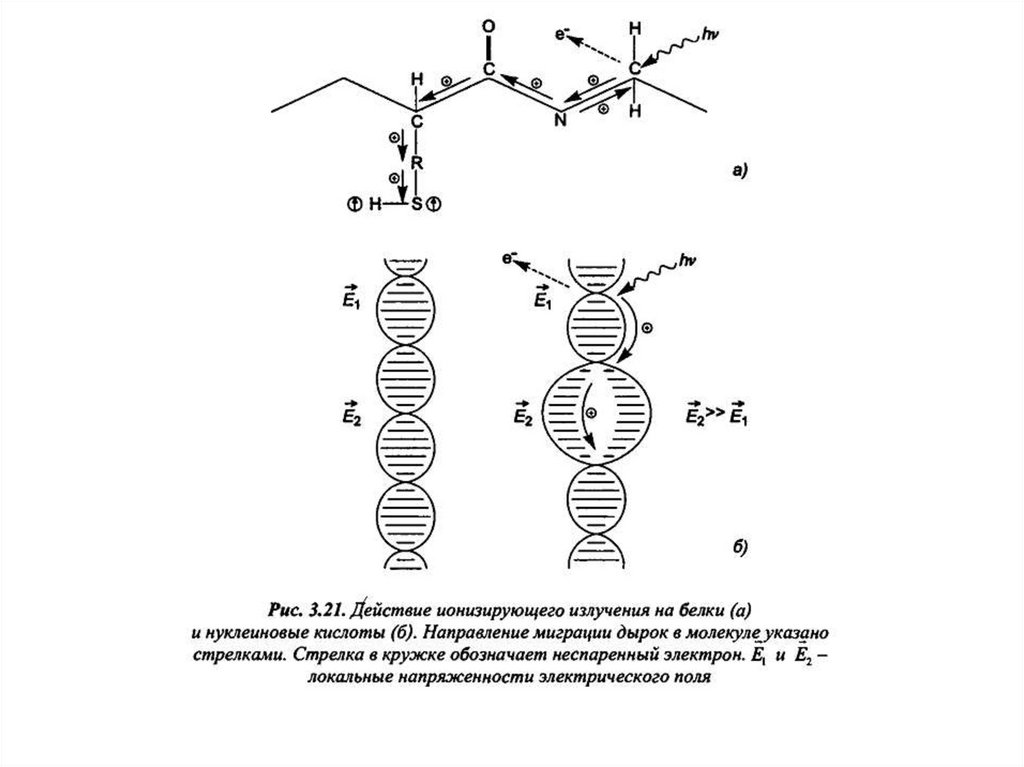
Квантовомеханические особенности строения биомолекул22.
23.
24.
25.
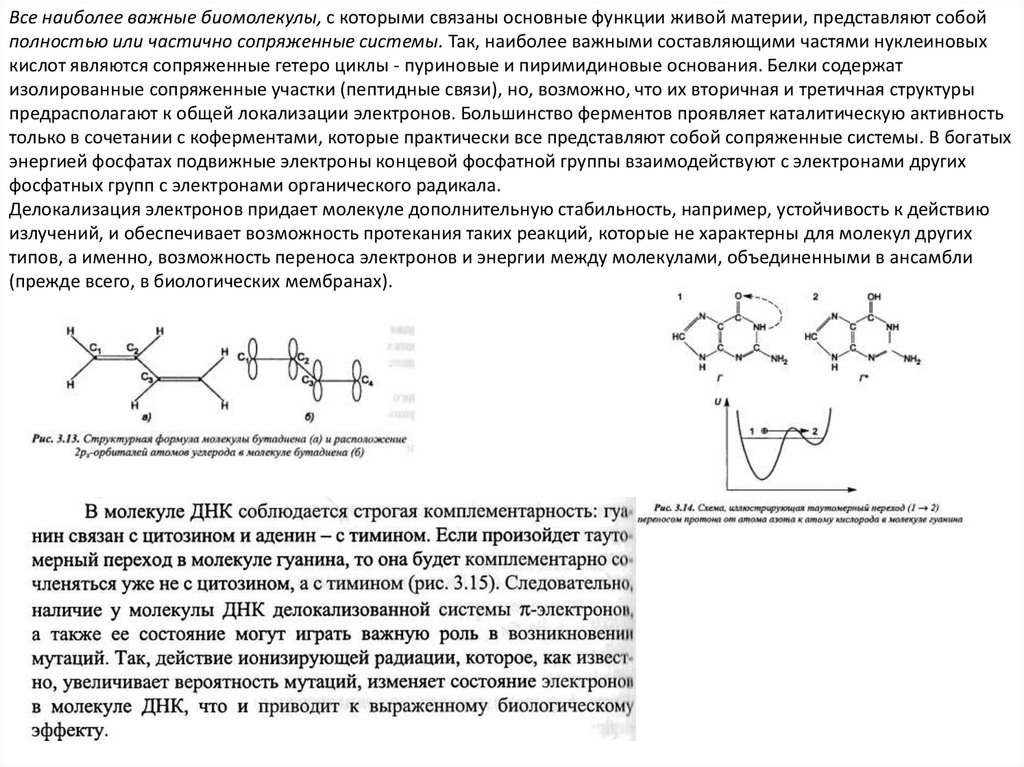
Все наиболее важные биомолекулы, с которыми связаны основные функции живой материи, представляют собойполностью или частично сопряженные системы. Так, наиболее важными составляющими частями нуклеиновых
кислот являются сопряженные гетеро циклы - пуриновые и пиримидиновые основания. Белки содержат
изолированные сопряженные участки (пептидные связи), но, возможно, что их вторичная и третичная структуры
предрасполагают к общей локализации электронов. Большинство ферментов проявляет каталитическую активность
только в сочетании с коферментами, которые практически все представляют собой сопряженные системы. В богатых
энергией фосфатах подвижные электроны концевой фосфатной группы взаимодействуют с электронами других
фосфатных групп с электронами органического радикала.
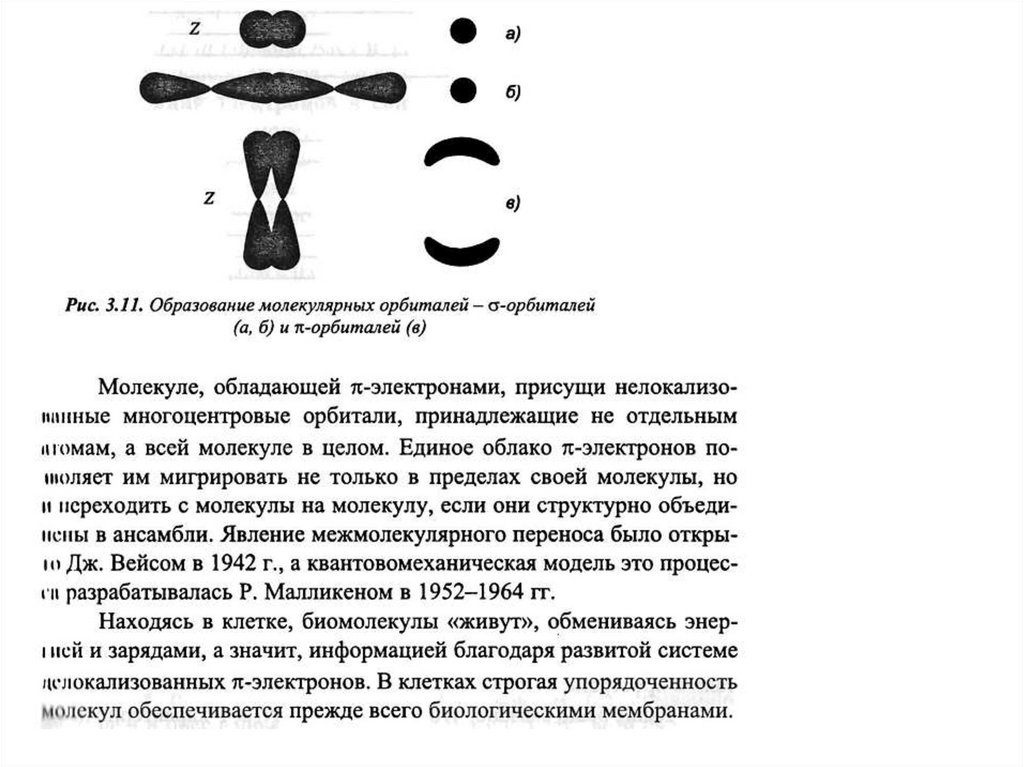
Делокализация электронов придает молекуле дополнительную стабильность, например, устойчивость к действию
излучений, и обеспечивает возможность протекания таких реакций, которые не характерны для молекул других
типов, а именно, возможность переноса электронов и энергии между молекулами, объединенными в ансамбли
(прежде всего, в биологических мембранах).
26.
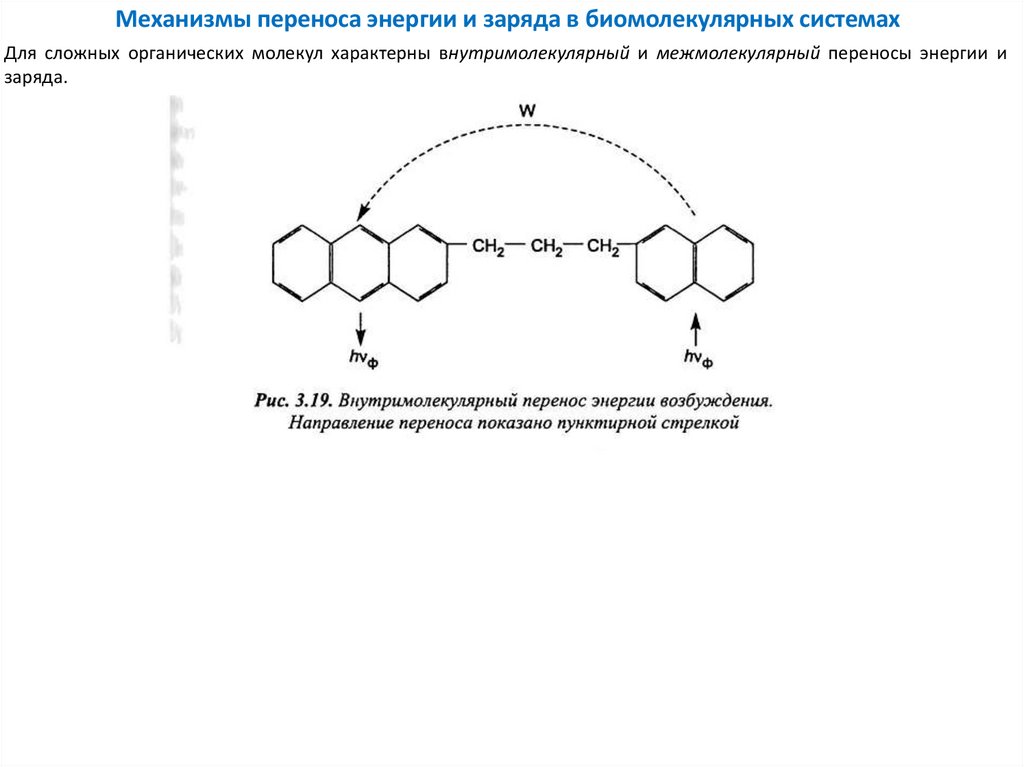
Механизмы переноса энергии и заряда в биомолекулярных системахДля сложных органических молекул характерны внутримолекулярный и межмолекулярный переносы энергии и
заряда.
27.
В биомолекулярных системах, таких как белки, нуклеиновые кислоты и мембраны, существуют различныемеханизмы переноса энергии и заряда. Эти механизмы играют ключевую роль в биологических процессах, таких
как фотосинтез, дыхание и клеточная сигнализация. Рассмотрим их подробно:
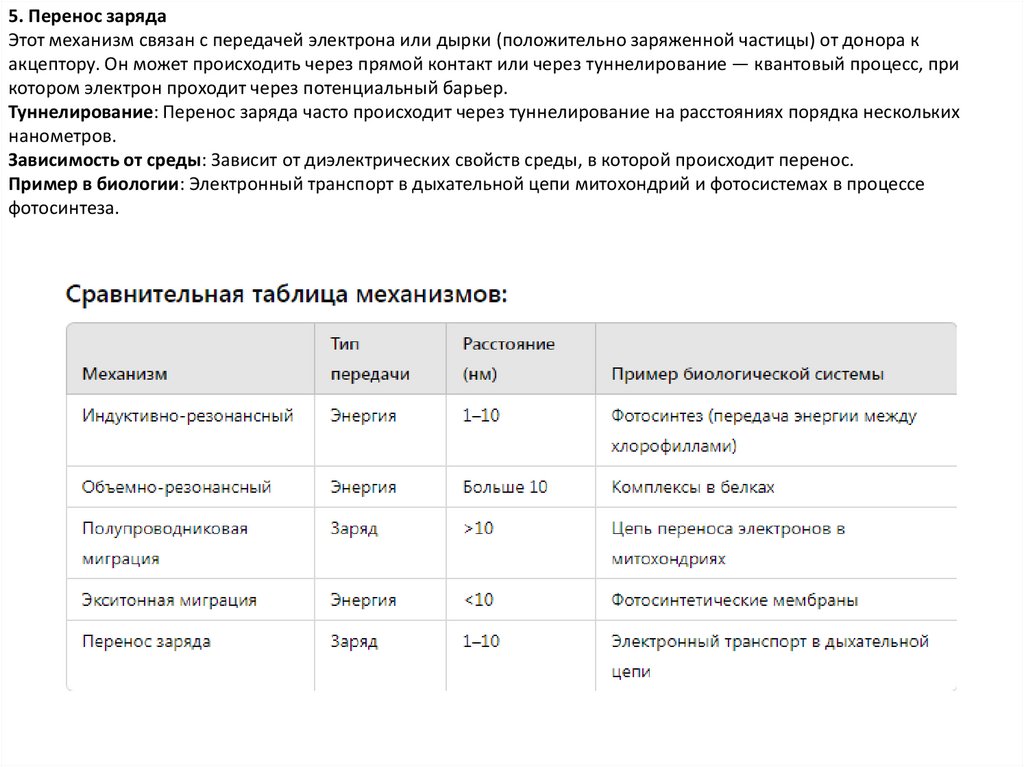
1. Индуктивно-резонансный перенос энергии (механизм Фёрстера)
Этот механизм основан на передаче энергии от одной молекулы (донора) к другой (акцептору) через резонансное
взаимодействие их колебательных и электронных уровней. Он происходит через безрадиационный
(нерентгеновский) процесс, то есть без испускания фотона. Основные характеристики:
Расстояние: Эффективен на расстояниях от 1 до 10 нм.
Зависимость от расстояния: Энергетический перенос имеет зависимость от расстояния между молекулами.
Пример в биологии: Передача энергии в процессе фотосинтеза в светособирающих комплексах, когда энергия
поглощённого света передается между хлорофиллами.
28.
2. Объемно-резонансный перенос энергии (вант-Гоффовский механизм)Этот механизм включает передачу энергии в молекулах, не только за счет резонансного взаимодействия
колебательных уровней, но также с участием среды. Энергия может передаваться через комплексные
взаимодействия, включающие деформации или ионные колебания в биомолекуле. Механизм предполагает
перенос энергии с участием различных мод молекулярных колебаний.
Расстояние: Может работать на более длинных расстояниях, чем индуктивно-резонансный механизм.
Зависимость от среды: Интенсивно зависит от взаимодействий с окружающей средой.
Пример в биологии: Энергетический перенос в крупных биомолекулярных системах с участием молекулярных
комплексов.
3. Полупроводниковая миграция
Этот механизм происходит, когда молекула или макромолекула ведет себя как полупроводник, где электроны могут
передаваться через цепь биомолекул, подобно переносу заряда в полупроводниках. Перенос происходит за счет
перескока электрона с одной молекулы на другую, в зависимости от их энергетических состояний.
Особенности: Похож на механизм переноса электронов в неорганических полупроводниках, но адаптирован к
биомолекулярным системам.
Пример в биологии: Примером может служить перенос электронов в цепи дыхательных комплексов митохондрий,
где электроны движутся через серию молекул, подобных белкам.
29.
4. Экситонная миграцияЭкситон — это квазичастица, которая представляет собой состояние связанной пары "электрон—дырка". Экситонная
миграция — это процесс переноса энергии от одной молекулы к другой, происходящий благодаря экситонам,
которые распространяются в молекулярной цепи.
Энергия: Переносится без перемещения заряда, только энергия.
Расстояние: Происходит на коротких расстояниях, часто в пределах одной молекулы или на границе нескольких
молекул.
Пример в биологии: Экситонный перенос наблюдается в фотосинтетических мембранах и светособирающих
комплексах растений.
30.
5. Перенос зарядаЭтот механизм связан с передачей электрона или дырки (положительно заряженной частицы) от донора к
акцептору. Он может происходить через прямой контакт или через туннелирование — квантовый процесс, при
котором электрон проходит через потенциальный барьер.
Туннелирование: Перенос заряда часто происходит через туннелирование на расстояниях порядка нескольких
нанометров.
Зависимость от среды: Зависит от диэлектрических свойств среды, в которой происходит перенос.
Пример в биологии: Электронный транспорт в дыхательной цепи митохондрий и фотосистемах в процессе
фотосинтеза.
31.
32.
33.
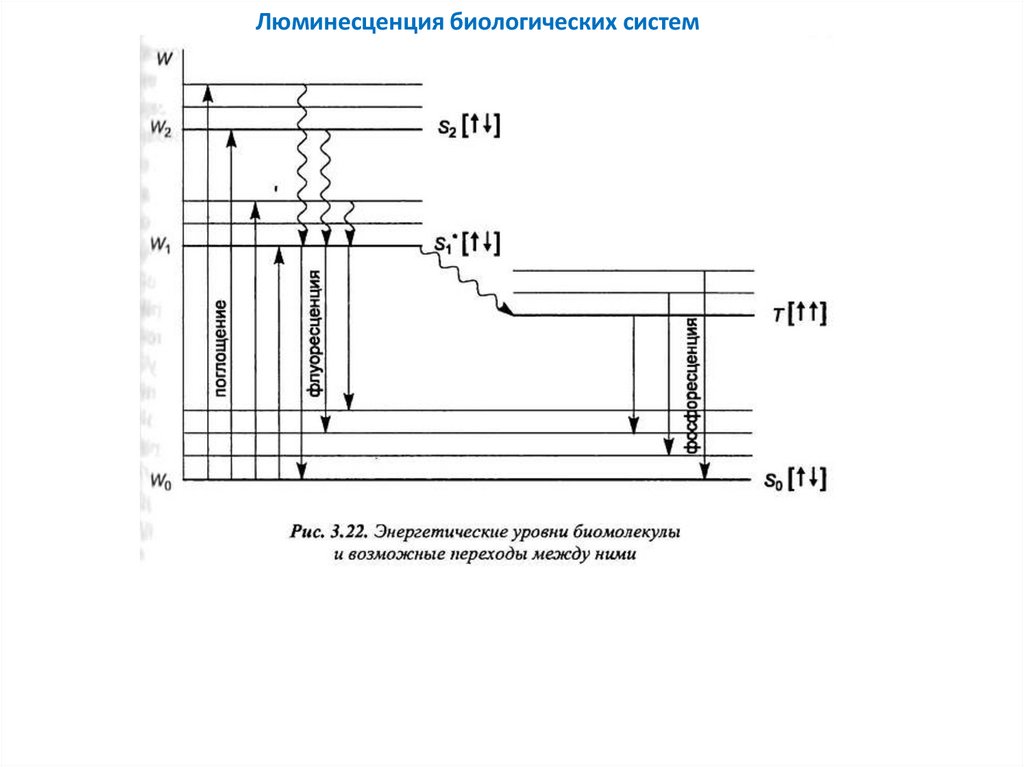
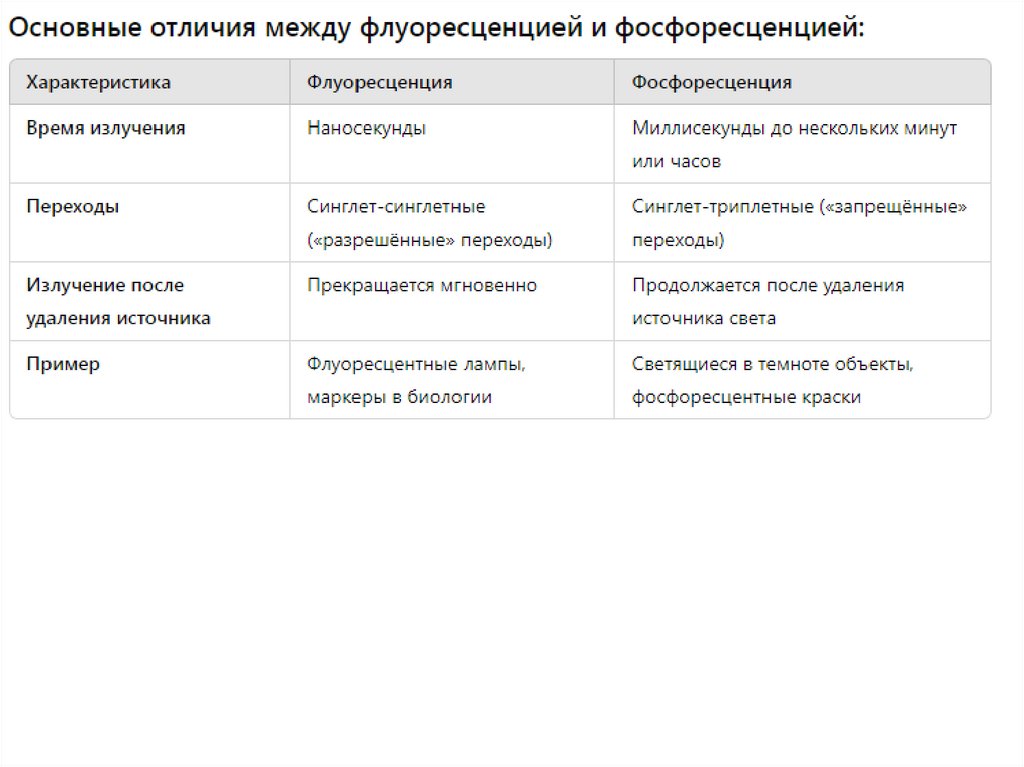
Люминесценция биологических систем34.
Флуоресценция и фосфоресценция — это два вида люминесценции, то есть процессов, при которых молекулы илиатомы вещества излучают свет после того, как поглощают энергию (например, от ультрафиолетового или видимого
света). Оба явления связаны с переходами электронов между энергетическими уровнями, но они различаются по
механизмам перехода и продолжительности излучения.
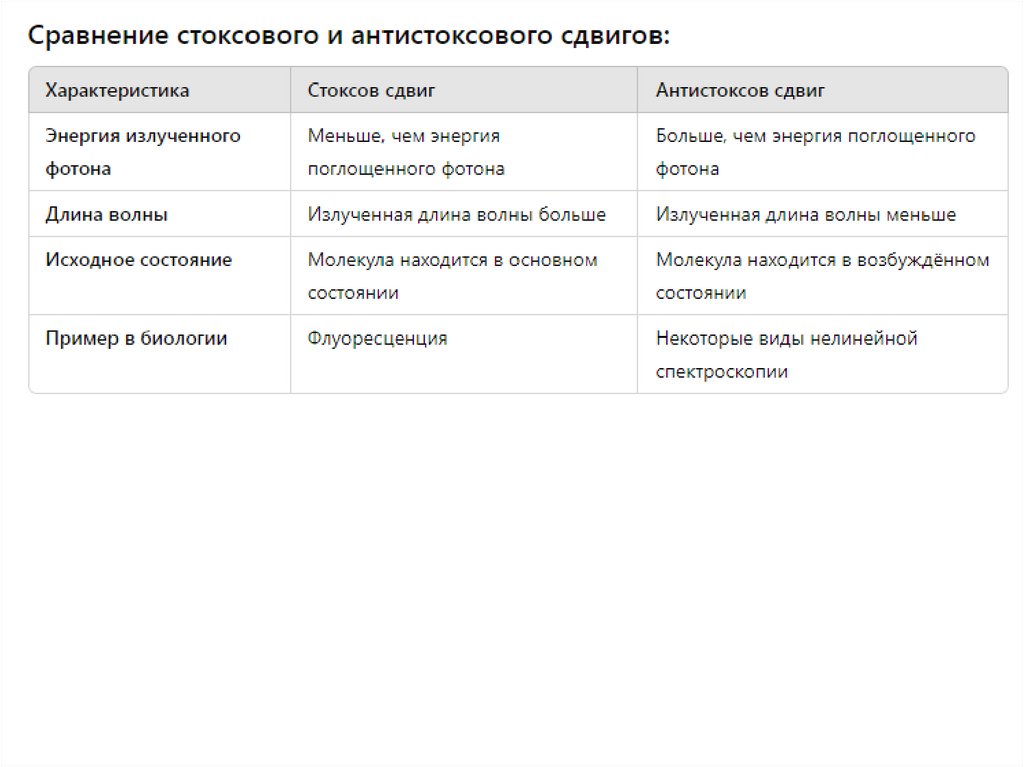
1. Флуоресценция
Флуоресценция — это быстрое излучение света молекулой после того, как она поглотила энергию в виде фотона.
Механизм флуоресценции можно описать следующим образом:
Поглощение энергии: Молекула поглощает фотон, что переводит электрон из основного электронного состояния
(наиболее низкое по энергии) в возбужденное электронное состояние (более высокое по энергии).
Излучение света: Электрон затем быстро возвращается обратно в основное состояние, излучая фотон с меньшей
энергией (обычно более длинная длина волны).
Продолжительность: Флуоресценция происходит очень быстро — в течение наносекунд.
Основные характеристики флуоресценции:
Быстрое излучение: Свет испускается сразу после поглощения энергии.
Квантовая механика: Процесс включает переходы между состояниями с одинаковыми спиновыми квантовыми
числами (так называемые «разрешённые» переходы).
2. Фосфоресценция
Фосфоресценция — это медленный процесс излучения света, который продолжается даже после того, как источник
возбуждения был удален. Это происходит из-за более сложных электронных переходов:
Поглощение энергии: Как и в случае флуоресценции, молекула поглощает фотон и переходит в возбужденное
электронное состояние.
Запрещенные переходы: Однако, в фосфоресценции электрон переходит из возбужденного синглетного состояния в
триплетное (с изменением спина), что является "запрещенным" переходом по квантово-механическим правилам.
Это приводит к тому, что возврат в основное состояние занимает больше времени.
Излучение света: Электрон медленно возвращается в основное состояние, излучая свет.
Продолжительность: Фосфоресценция может продолжаться от миллисекунд до часов после удаления источника
света.
Основные характеристики фосфоресценции:
Медленное излучение: Свет продолжается даже после окончания воздействия света.
Квантовая механика: Процесс включает переходы с изменением спина, что делает их квантово запрещёнными и
значительно замедляет излучение.
35.
36.
37.
38.
39.
40.
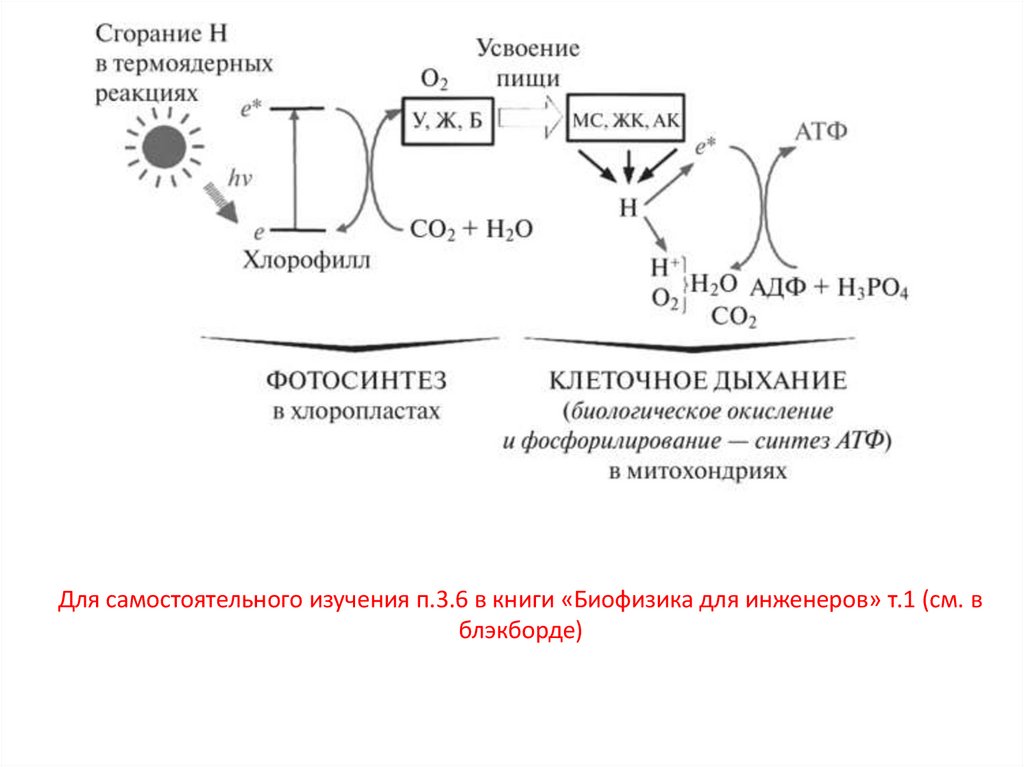
Для самостоятельного изучения п.3.6 в книги «Биофизика для инженеров» т.1 (см. вблэкборде)






















 Физика
Физика








