Похожие презентации:
протеомика 2 и 3
1.
Терминологический минимум:• Конформация – пространственная организация атомов
в молекуле белка (по сути, трехмерная структура)
• Нативная конформация – такая конформация, в
которой белок является функционально активным
(работает)
• Стабильность (устойчивость) – способность белка к
сохранению нативной конформация
Зачем? Вся регуляция работы белков сводится к их
конформационным изменениям…
2.
ФОЛДИНГПроцесс укладки
полипептидной цепи
3.
4.
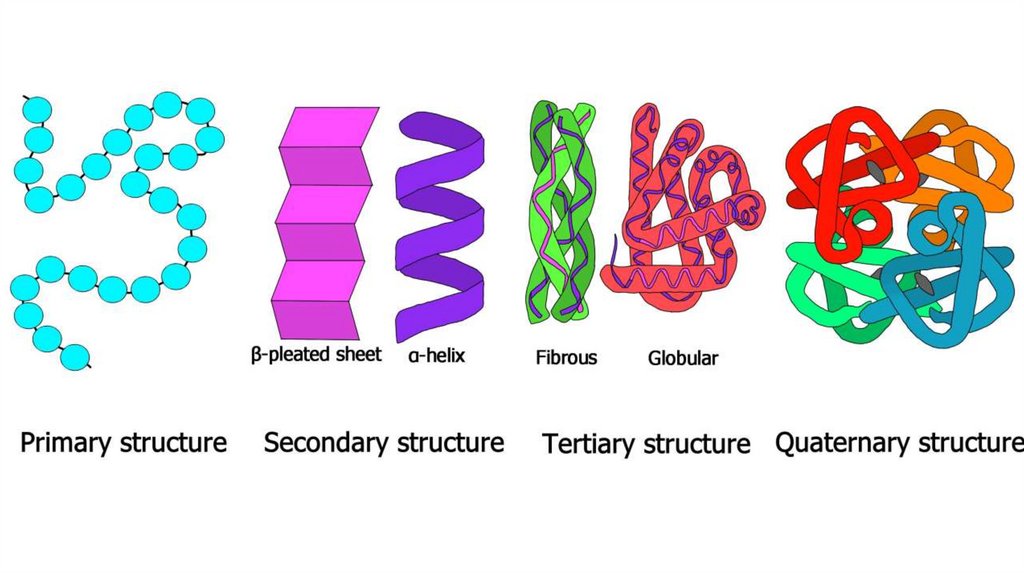
Первичная структура – ключ к пониманию функцийбелков
Собственно, первичная структура, это и есть первично
синтезированная полипептидная цепь
Стабилизация первичной структуры главным образом происходит
за счет пептидных связей
Функция белка зависит от аминокислотной
последовательности в первичной структуре
5.
Первичная структура – ключ к пониманию функцийбелков
Белки с различными функциями всегда различаются по
аминокислотной последовательности
Это имеет решающее значение в характеристике генетических
заболеваний
Однако 20-30% белков человека полиморфны, т.е. есть варианты
белков, отличающиеся по аминокислотной последовательности, но
по функциональной активности отличающиеся несущественно
6.
Первичная структура открыта и описана позже всехостальных…
В 1951 и 1952 годах определил полную
аминокислотную последовательностей обеих
цепей (A и B) бычьего инсулина
Совокупность методов, которые он использовал
для этого была чрезвычайно разнообразна
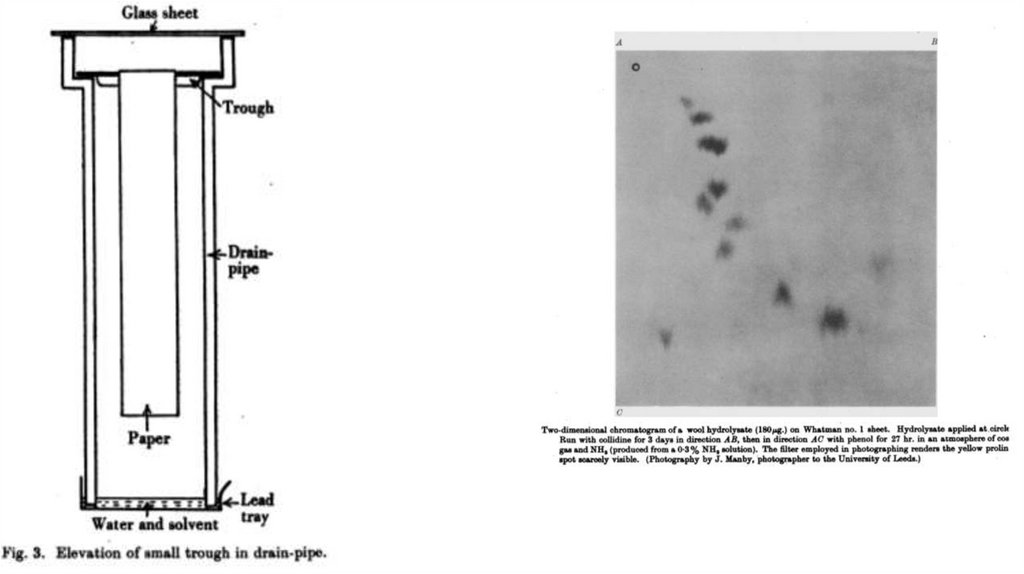
Сначала он усовершенствовал метод
распределительной хроматографии
Frederick Sanger
7.
8.
9.
10.
11.
12.
13.
14.
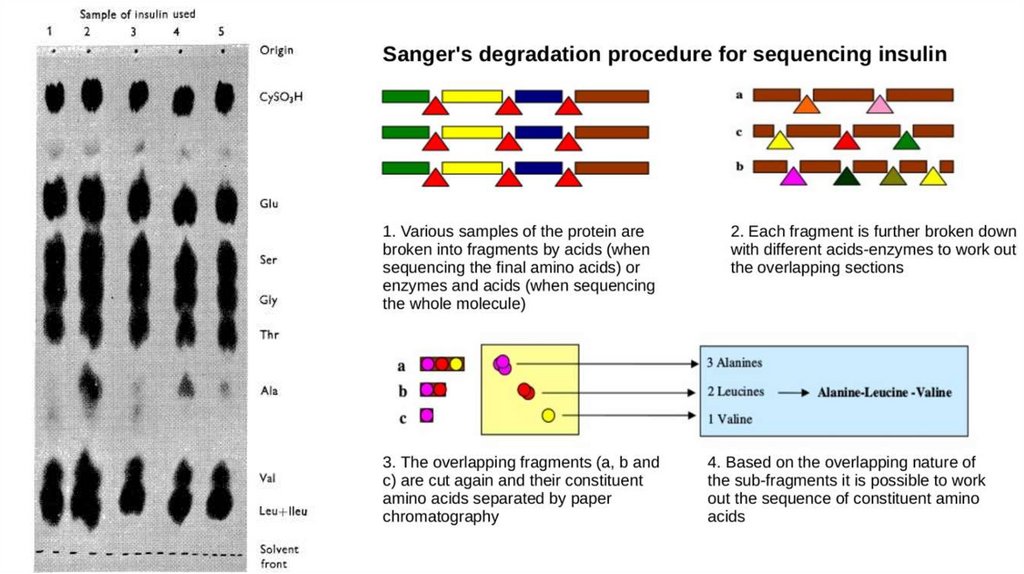
Комбинаторика в биохимии – секвенированиеСэнджер вывел биохимические методы на новый уровень:
• Разделение полипептидов на меньшие фрагменты
• Разделение небольших пептидов на аминокислоты
• Установление концевых аминокислот
• Сопоставление различных фрагментов
Повторение этих процедур для установление структуры
последовательности мономеров получило название секвенирования (от
английского sequence – последовательность)
Изначально секвенирование применялось в рамках протеомики, однако
таким образом можно установить последовательность любых полимеров, в
том числе молекулы ДНК
15.
16.
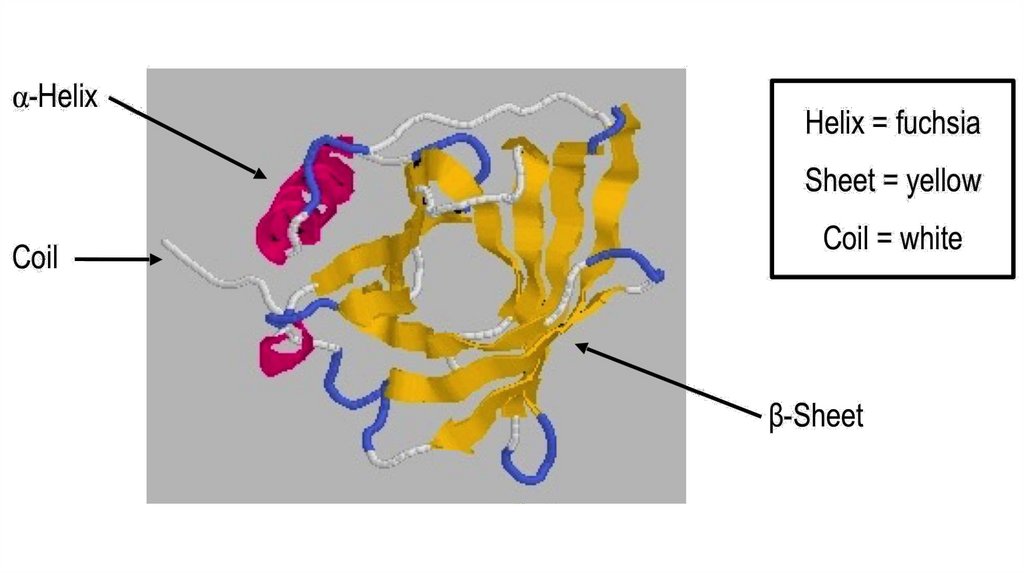
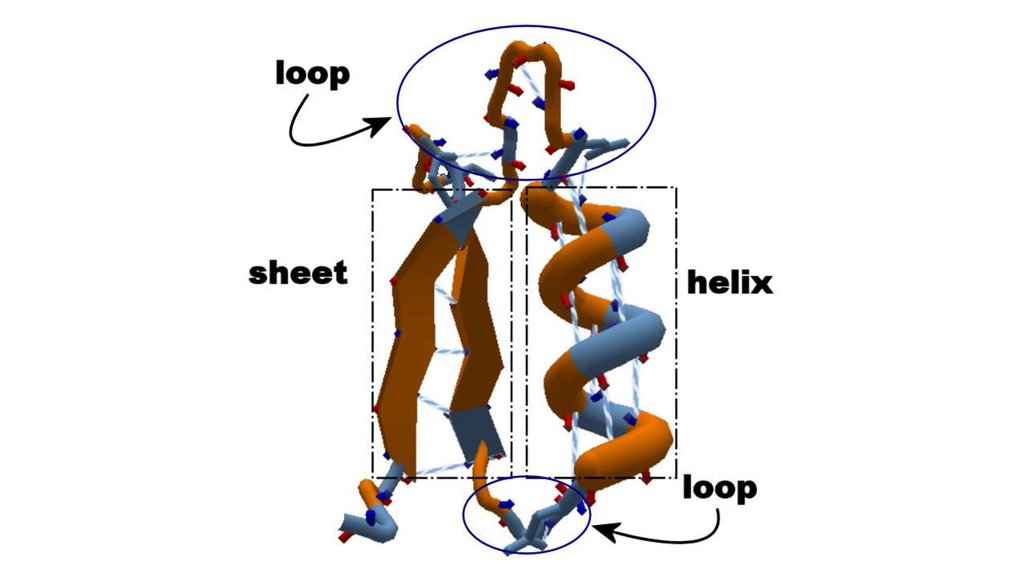
Вторичные структурыВторичная структура – пространственная укладка полипептидной
цепи, химически стабилизированная водородными связями между
атомами пептидной группировки в пределах одной цепи, или между
несколькими цепями
Существуют регулярные и нерегулярные вторичные структуры:
• К регулярным относят альфа-спирали и бета-складчатости
• К нерегулярным – все остальное, катушки (coils), петли (loops),
изгибы (bends)
17.
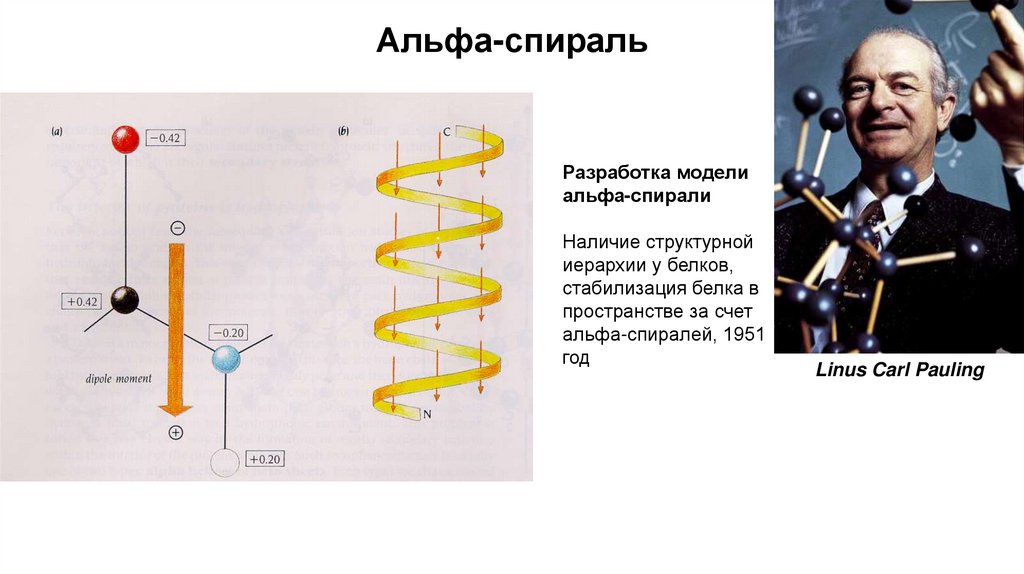
Альфа-спиральРазработка модели
альфа-спирали
Наличие структурной
иерархии у белков,
стабилизация белка в
пространстве за счет
альфа-спиралей, 1951
год
Linus Carl Pauling
18.
19.
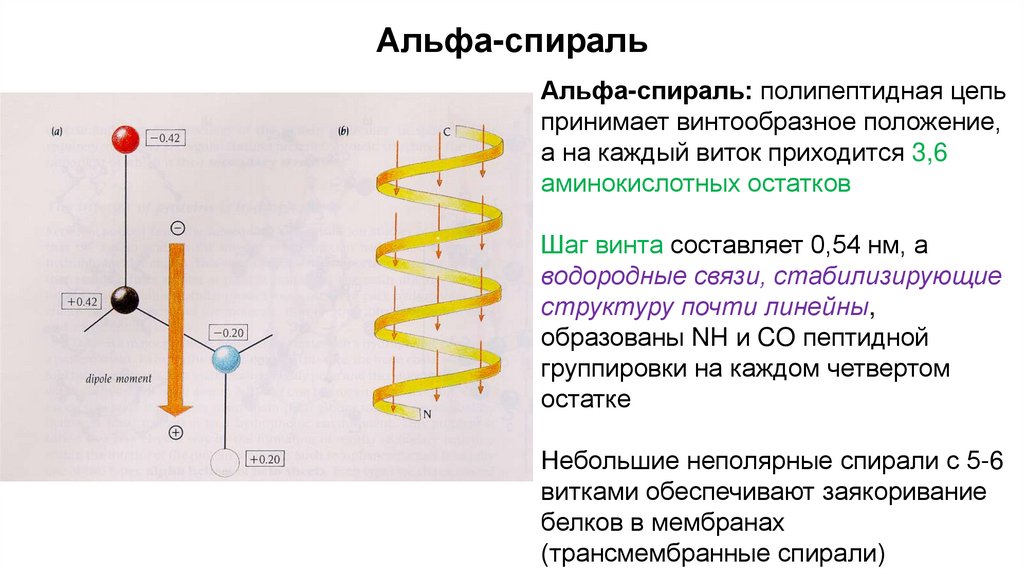
Альфа-спиральАльфа-спираль: полипептидная цепь
принимает винтообразное положение,
а на каждый виток приходится 3,6
аминокислотных остатков
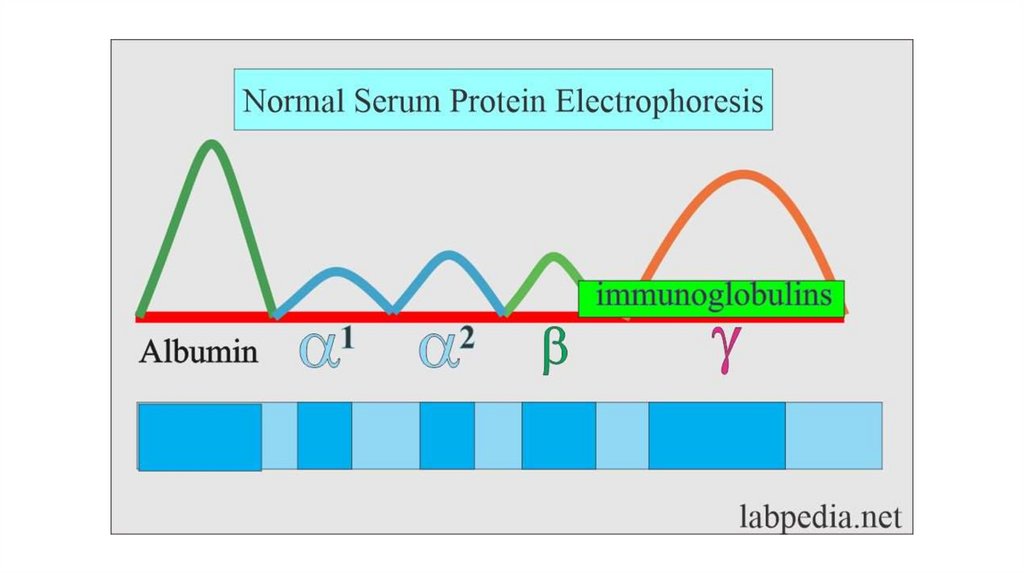
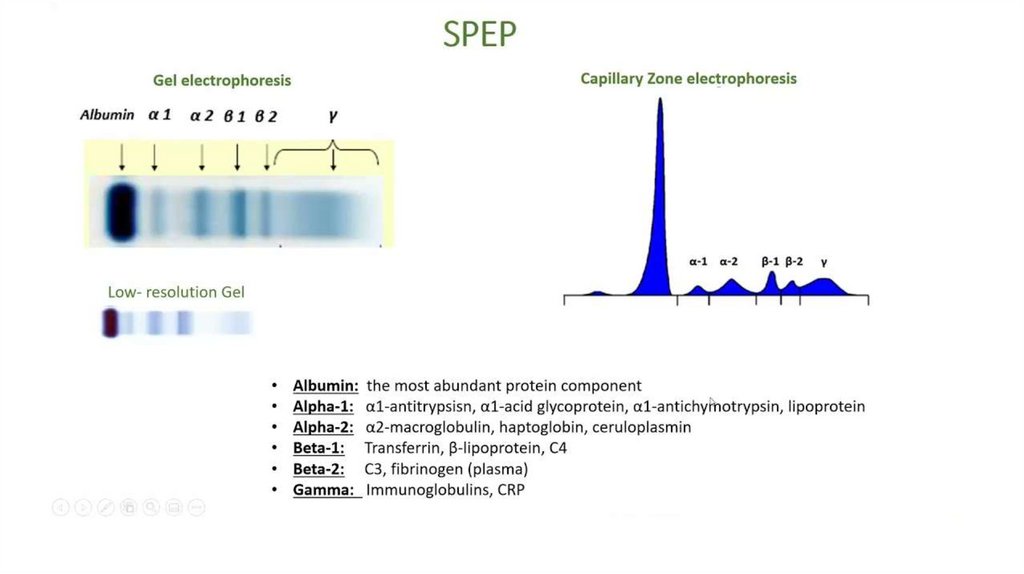
Шаг винта составляет 0,54 нм, а
водородные связи, стабилизирующие
структуру почти линейны,
образованы NH и CO пептидной
группировки на каждом четвертом
остатке
Небольшие неполярные спирали с 5-6
витками обеспечивают заякоривание
белков в мембранах
(трансмембранные спирали)
20.
21.
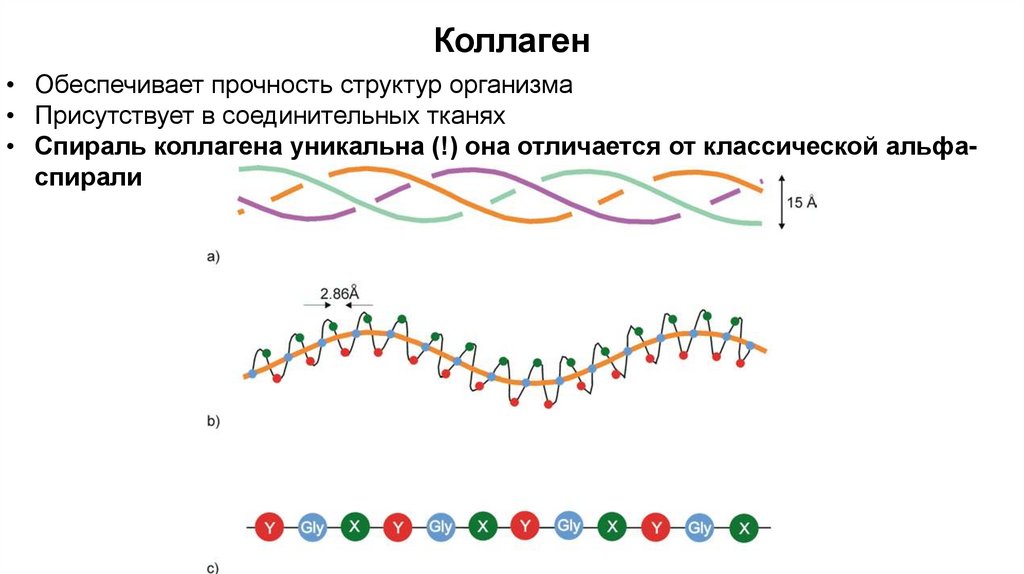
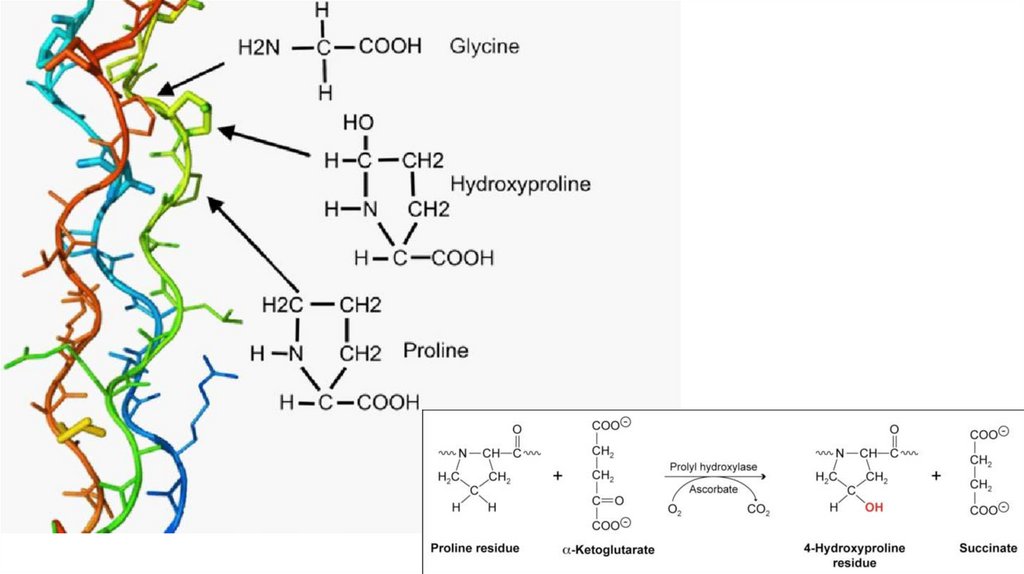
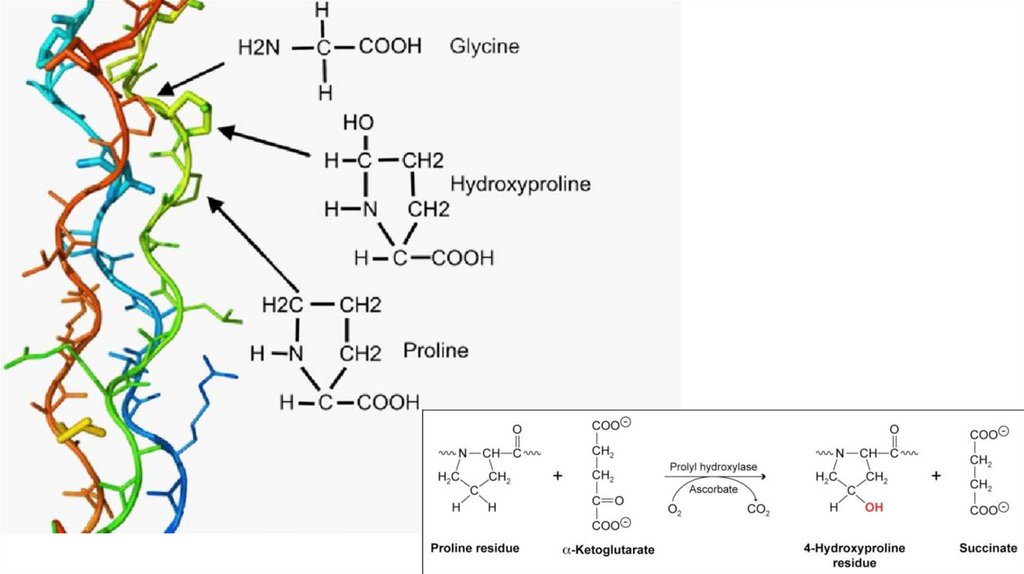
Коллаген• Обеспечивает прочность структур организма
• Присутствует в соединительных тканях
• Спираль коллагена уникальна (!) она отличается от классической альфаспирали
22.
Коллаген23.
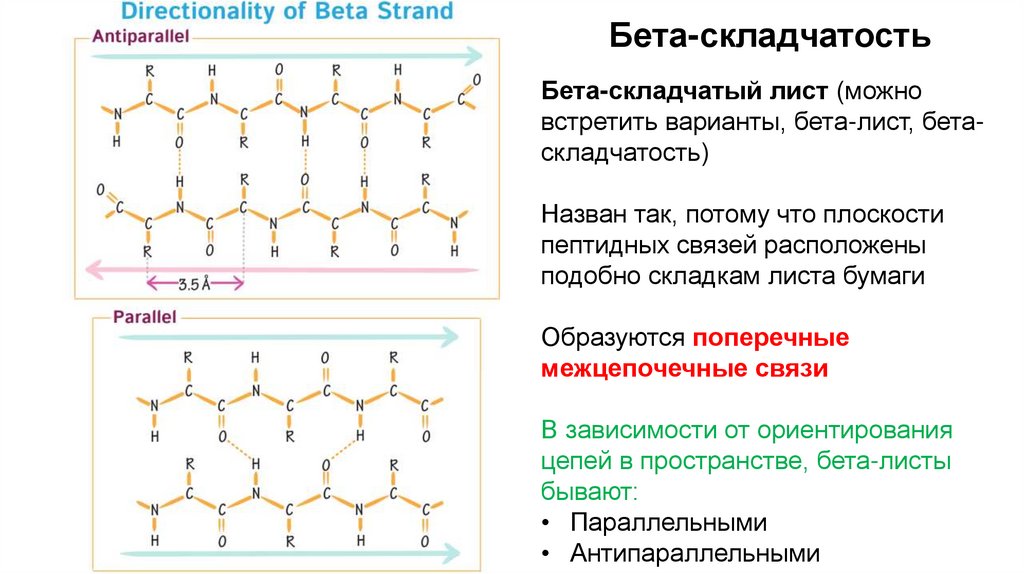
Бета-складчатостьБета-складчатый лист (можно
встретить варианты, бета-лист, бетаскладчатость)
Назван так, потому что плоскости
пептидных связей расположены
подобно складкам листа бумаги
Образуются поперечные
межцепочечные связи
В зависимости от ориентирования
цепей в пространстве, бета-листы
бывают:
• Параллельными
• Антипараллельными
24.
Robert B. CoreyСовместно с
Полингом
предложил модель
бета-структуры
25.
26.
27.
28.
Слева направо: Кёльнский собор, Страсбургский собор, СоборПарижской Богоматери, Вестминстерское аббатство
Что общего?
• Готическая архитектура
• Религиозные сооружения
• Построены в Западной Европе
• Построены в период Высокого и Позднего Средневековья
• Масштабные сооружения
• Длительный период возведения
29.
Мотив и доменМотив (музыка) – наименьший элемент композиции, единица мелодии
Мотив (архитектура) – составная часть архитектурного сооружения
Мотив (литература) – составная наименьшая часть сюжета
Мотивы повторяемы и узнаваемы, выполняют схожие функции
Домен (история) – средневековый термин, означает земельное владение
феодала
Домен (классификация живого) – самый верхний ранг систематики,
объединяет несколько царств, например, эукариоты
Домен (информатика) – часть адреса сервера
И мотивы, и домены, в протеомике являются повторяющимися
структурными элементами белка, критически важны для формирования
третичных структур
30.
Терминологический минимум:• Белковый мотив – структура белка, определяющая
устойчивое взаиморасположение определенных
элементов вторичной структуры и связующих их
последовательностей
• Домен – часть полипептидной цепи, которая стабильна
вне зависимости от остальной цепи или может
перемещаться относительно целого белка как
самостоятельная единица
Термины «белковый мотив» и «супервторичная
структура» равнозначны!!!
31.
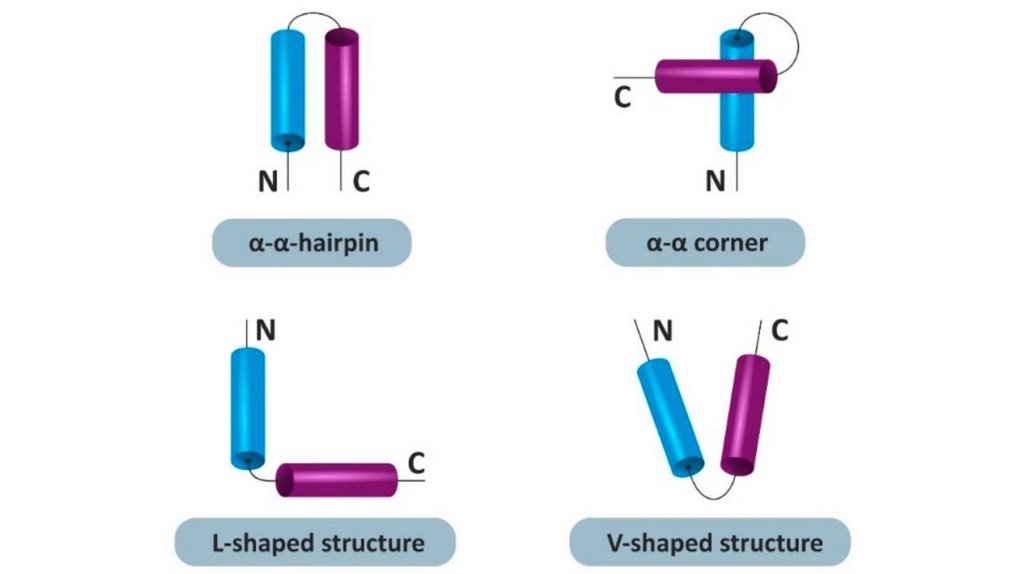
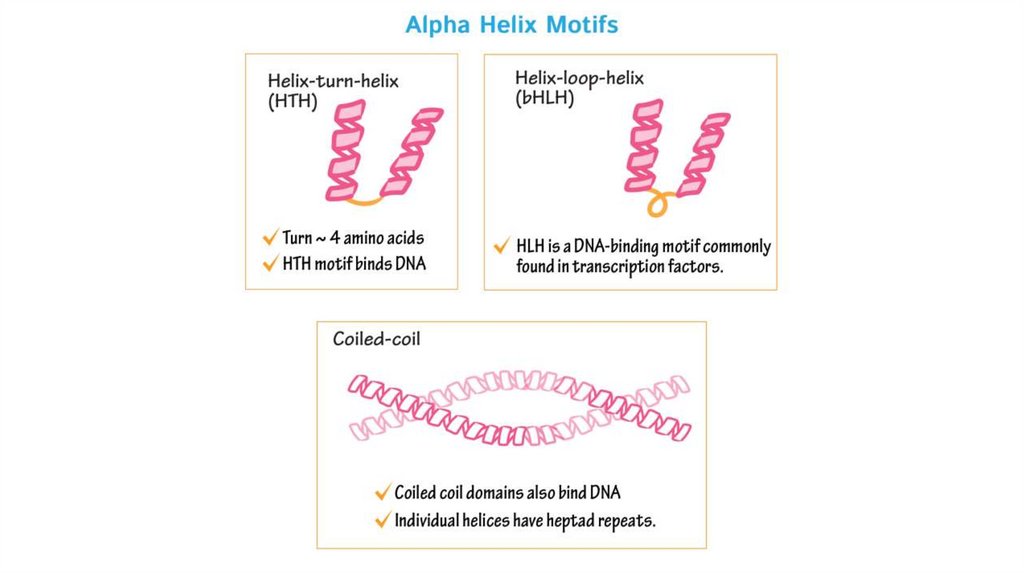
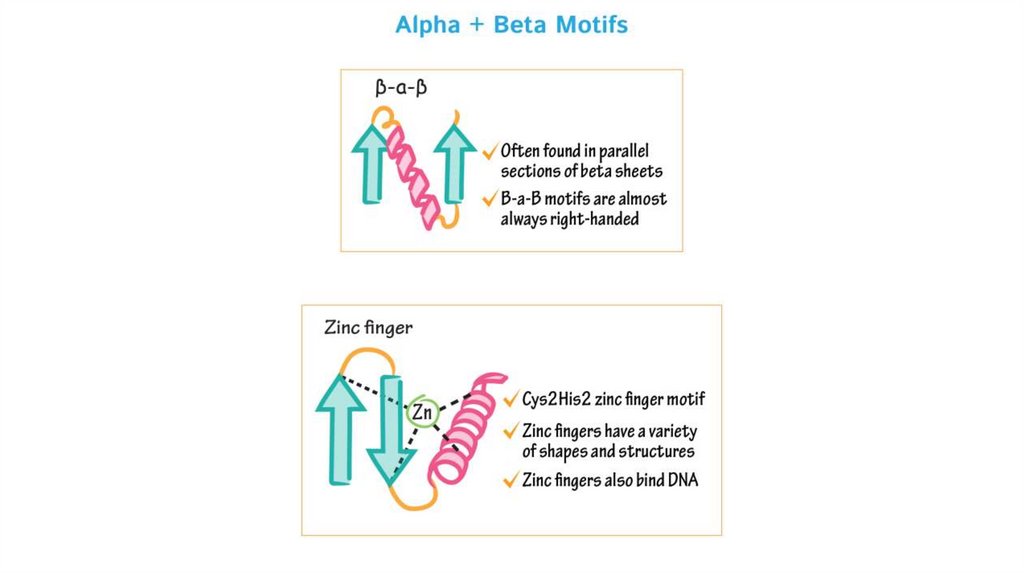
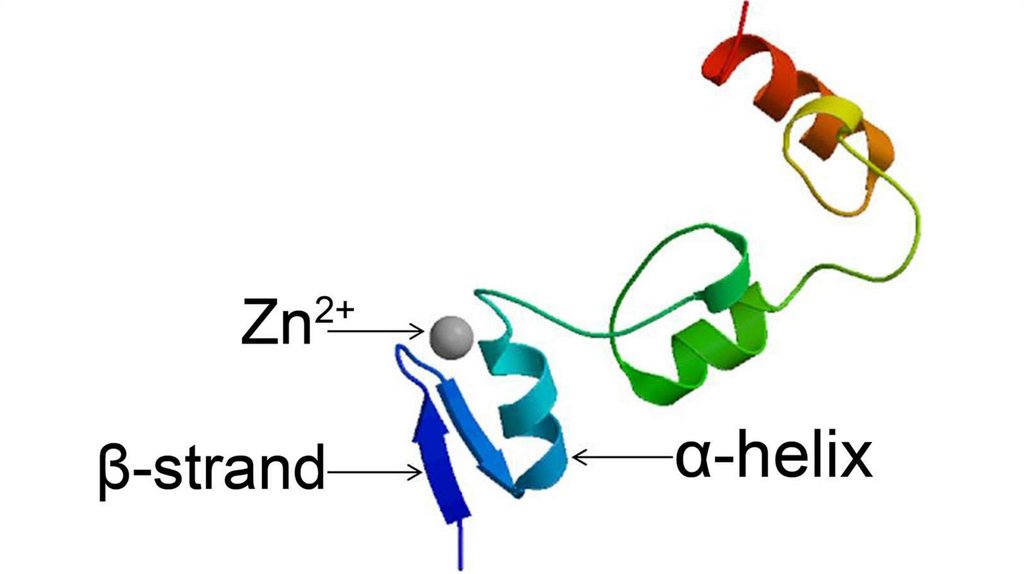
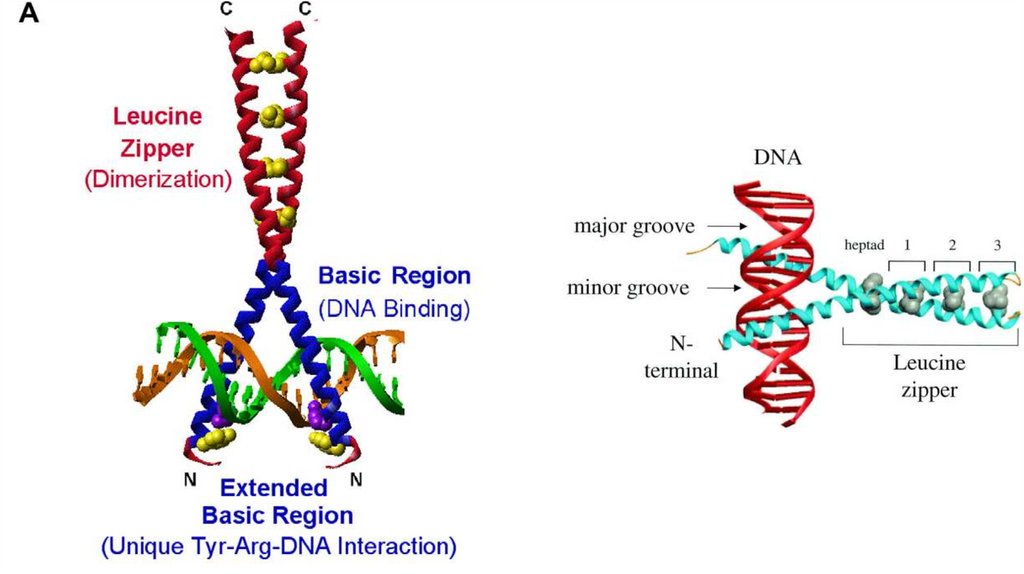
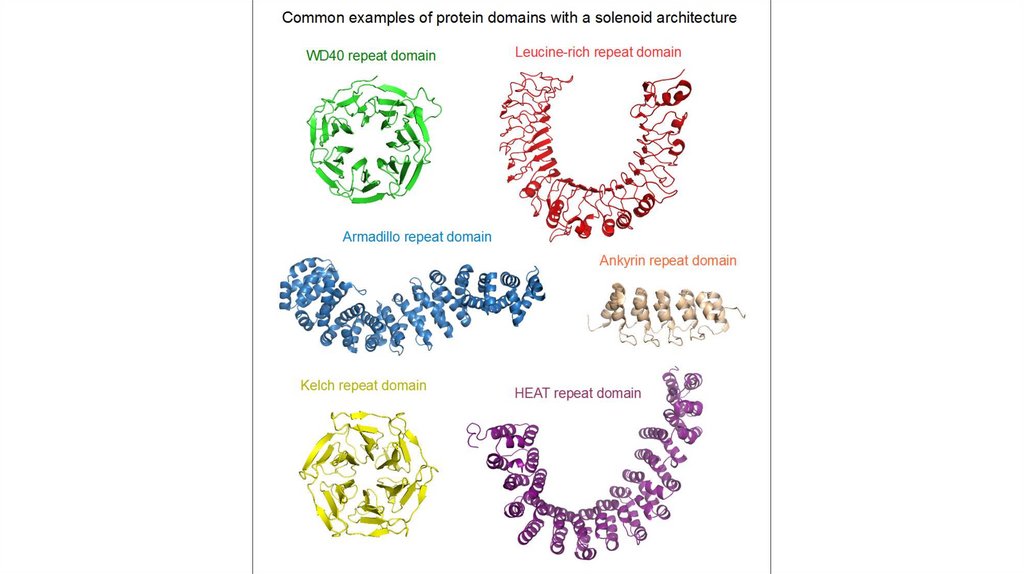
Супервторичные структуры1.Спиральные супервторичные структуры: спиральная
шпилька, спиральный угол, спираль-поворот,
спираль, спираль-петля-спираль, L-образная
структура, V-образная структура
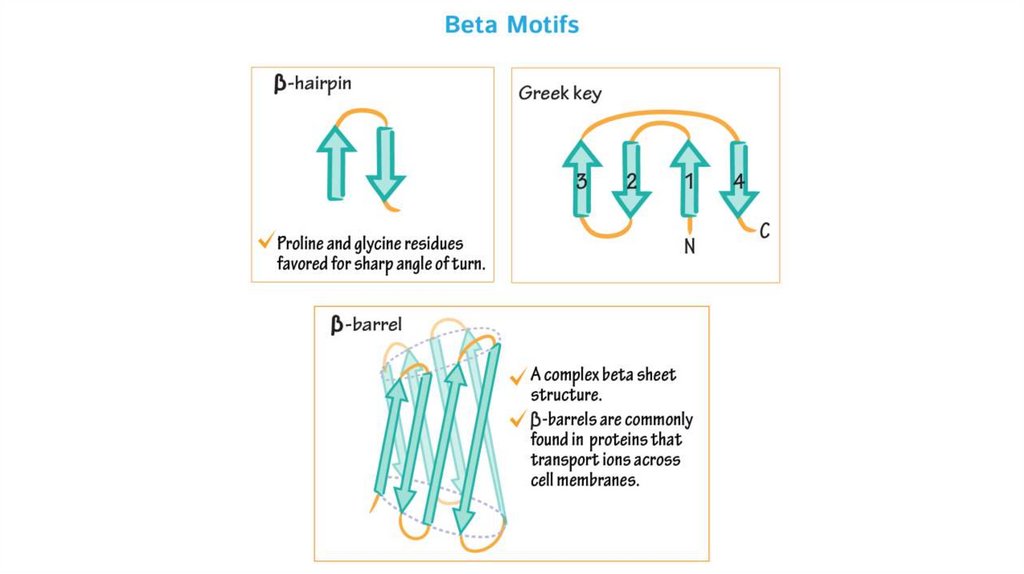
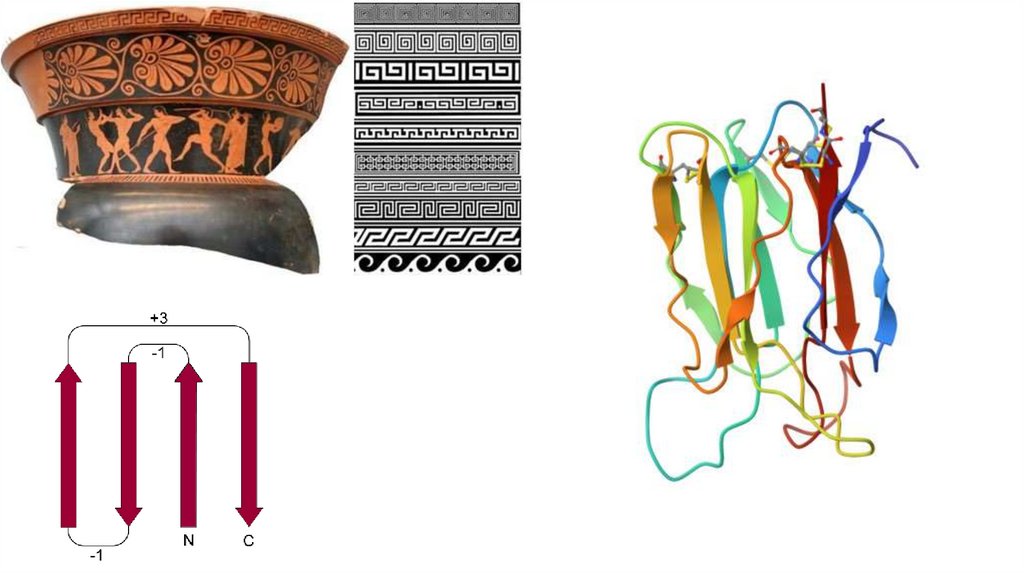
2.Бета-складчатые супервторичные структуры: бетаскладчатая шпилька, бета-угол, греческий ключ
3.Смешанные супервторичные структуры: бета-альфабета мотив, укладка Россмана
Не установлено четкой классификации белковых мотивов,
в целом к ним, при желании, можно отнести любые часто
встречающиеся комбинации вторичных структур
32.
33.
34.
35.
36.
37.
38.
39.
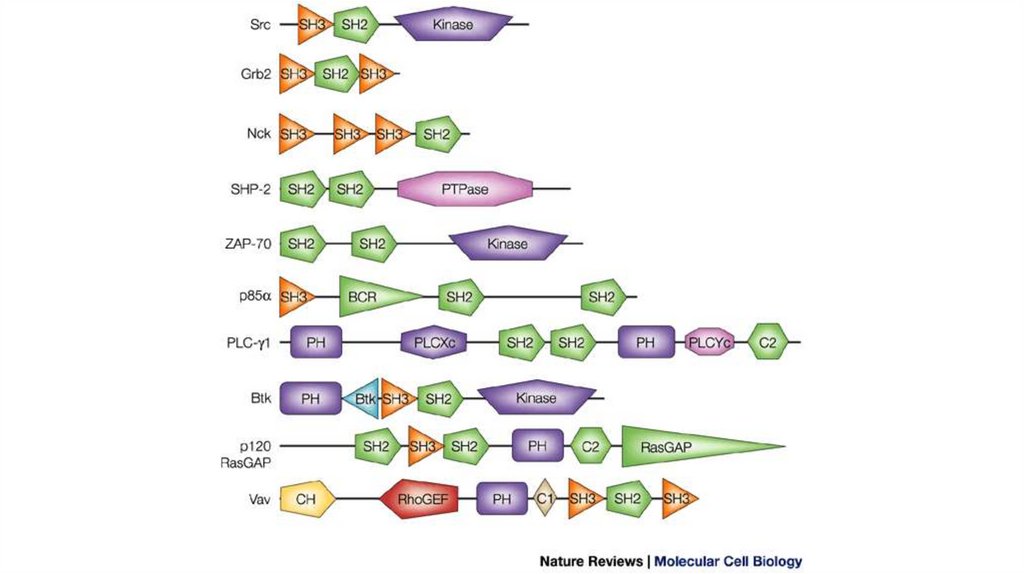
Отличительные свойства доменов1.Более трёхмерная структура, чем мотив
2.Обладает определённой функциональной ролью (мотив
обладает только структурной ролью)
3.Домен характеризует белок
4.Один белок может содержать несколько различных
доменов (как и один домен несколько различных
мотивов)
5.Мутация в одном домене не влияет на поведение другого
домена
6.Высококонсервативная структура
40.
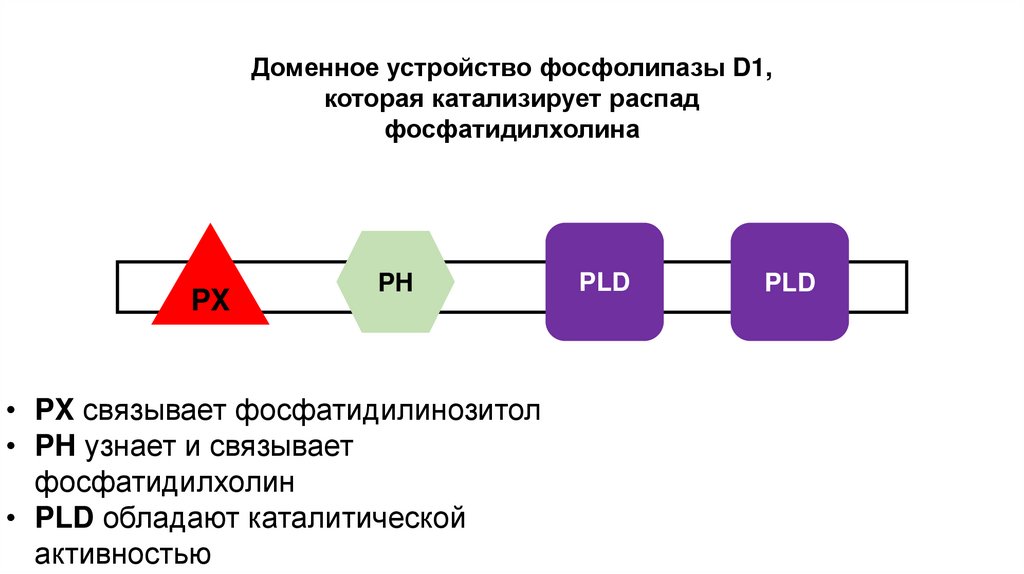
Доменное устройство фосфолипазы D1,которая катализирует распад
фосфатидилхолина
PX
PH
• PX связывает фосфатидилинозитол
• PH узнает и связывает
фосфатидилхолин
• PLD обладают каталитической
активностью
PLD
PLD
41.
42.
43.
44.
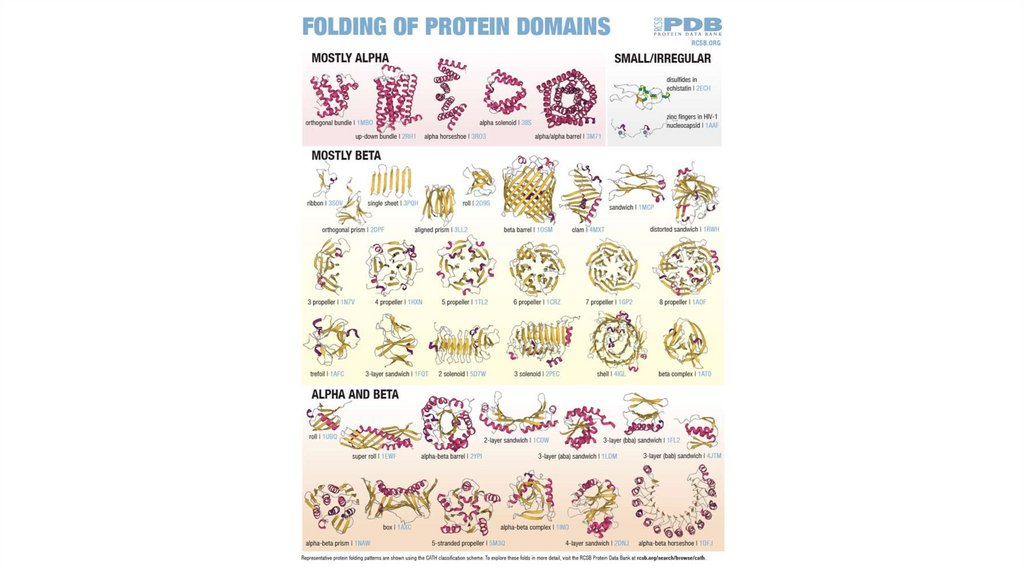
ТРЕТИЧНАЯСТРУКТУРА
БЕЛКА
45.
Гипотеза циклолов:Стабилизация
пространственной
структуры белка за счёт
гидрофобных
взаимодействий
Разработка
альфа-спирали
Dorothy Maud Wrinch
модели
Наличие
структурной
иерархии
у
белков,
стабилизация
белка
в
пространстве
за
счет
альфа-спиралей
Лайнус Полинг против
Дороти Ринч
Linus Carl Pauling
46.
47.
48.
John Cowdery Kendrew1957-1959 гг. – предсказал и установил
детальную модель миоглобина (оригинальная из
пластилина сверху и усовершенствованная
справа)
Он обнаружил, что миоглобин действительно
содержит в составе альфа-спирали, чем
подтвердил гипотезу Лайнуса Полинга 1951 года
49.
50.
ФОРМА ФУНКЦИЯПервичная структура определяет свойства белка
По мере синтеза белка, отдельные компоненты
вторичной структуры начинают
взаимодействовать, а аминокислоты, которые
не находятся рядом в первичной структуре –
начинают сближаться
51.
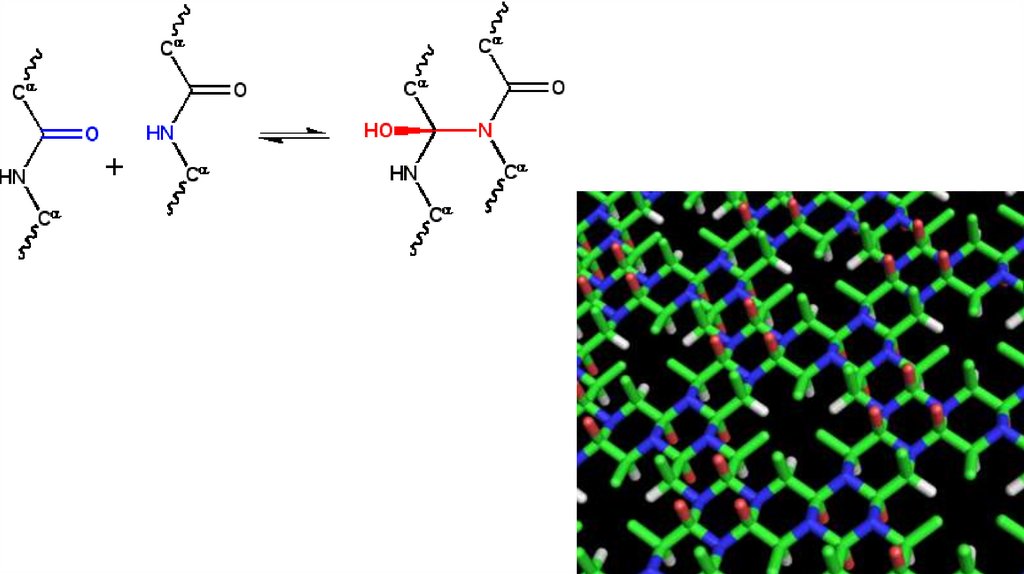
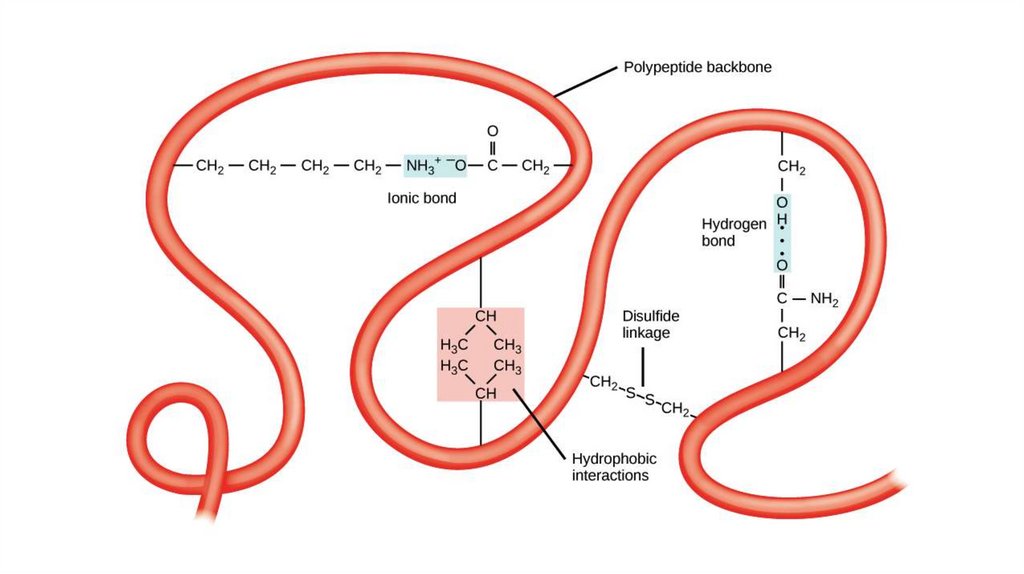
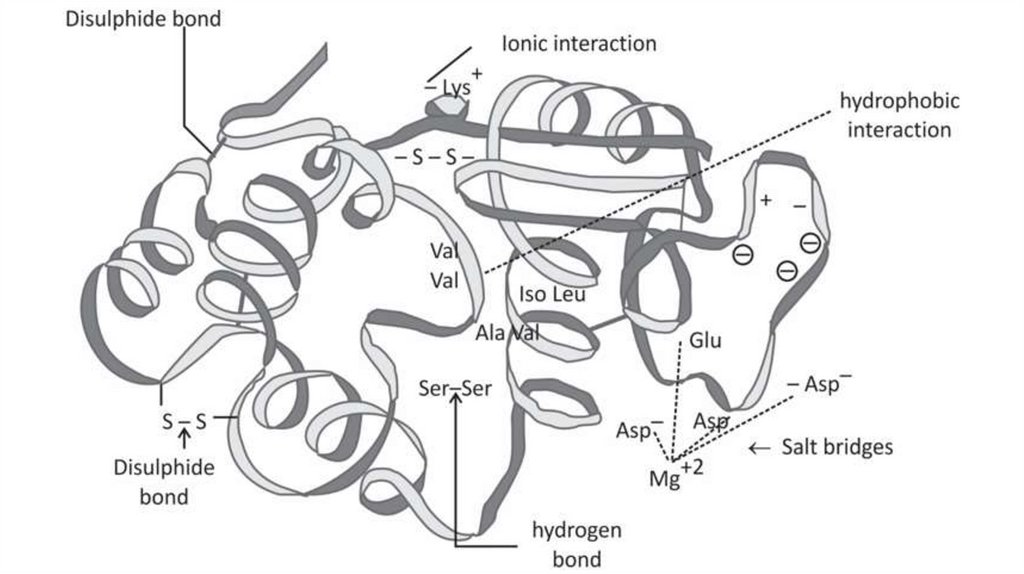
СТАБИЛИЗАЦИЯ ТРЕТИЧНЫХ СТРУКТУРВОДОРОДНЫЕ СВЯЗИ
ГИДРОФОБНЫЕ СИЛЫ
ИОННЫЕ ВЗАИМОДЕЙСТВИЯ
ДИСУЛЬФИДНЫЕ СВЯЗИ
52.
53.
54.
55.
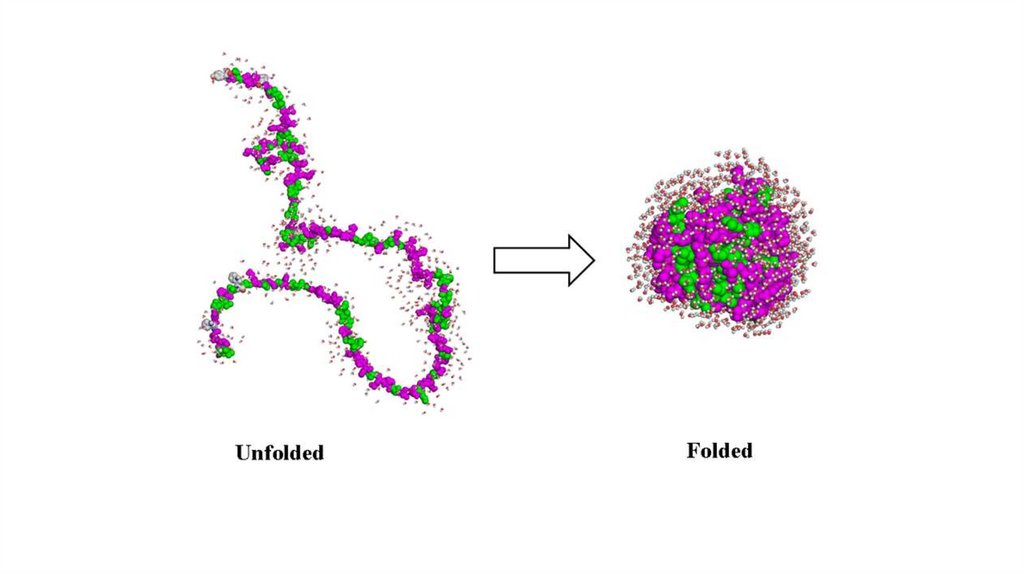
BLACK BOX56.
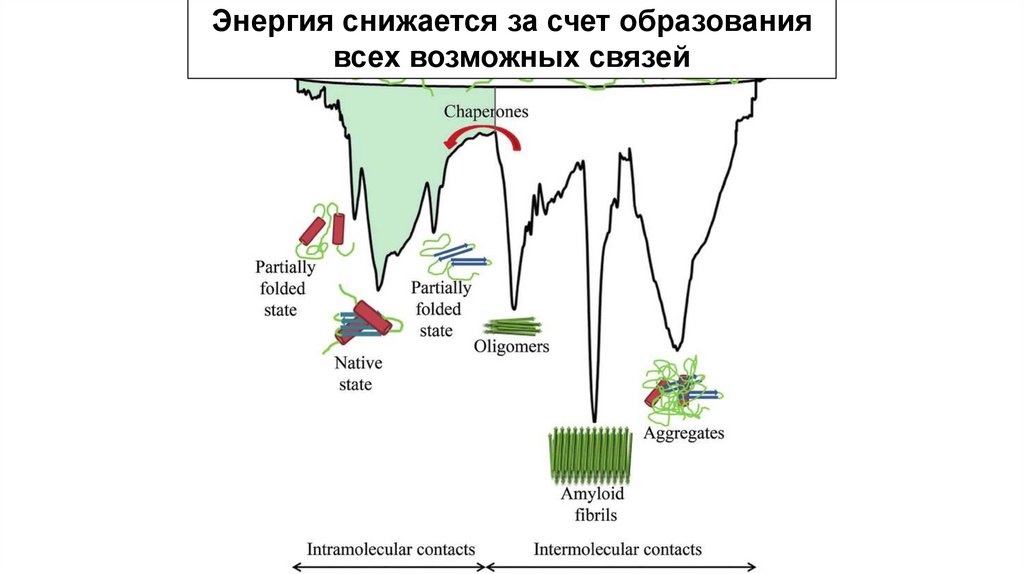
Фолдинг белка происходит в энергетическомландшафте «воронки фолдинга», в котором
нативная конформация белка достигается
соответствием минимальной свободной
энергии в условиях среды, в которой
растворен белок
Гипотеза воронки
фолдинга
57.
Энергия снижается за счет образованиявсех возможных связей
58.
Парадокс Левинталя:«промежуток времени, за который
полипептид приходит к своему
свёрнутому состоянию, на много
порядков меньше, чем если бы
полипептид просто перебирал все
возможные конфигурации»
59.
«Компьютерные программы очень хороши в прогнозированиивторичной
структуры,
основываясь
исключительно
на
аминокислотной последовательности, но испытывают трудности с
определением третичной структуры, используя ту же информацию»
Это отчасти связано с тем, что вторичные структуры имеют
повторяющиеся точки стабилизации, основанные на геометрии, и
любая регулярная вторичная структура (например, α-спираль) очень
мало варьируется от одной к другой
Однако складчатые структуры имеют огромное количество
возможных структур, как показано парадоксом Левинталя
60.
Правила фолдинга1. Гидрофобные взаимодействия вносят основной вклад в
стабилизацию структуры белка
2. Альфа-спирали и бета-складчатости располагаются в разных частях
структуры (водородные связи между альфа-спиралью и бетаскладчатостью образуются с трудом)
3. Полипептидные участки, расположенные рядом в
последовательности аминокислот, обычно оказываются по
соседству и после фолдинга
4. Связующие последовательности между элементами вторичной
структуры не пересекаются и не образуют узлов
5. Бета-конформация более устойчива, если ее отдельные участки
скручены вправо, это нужно, чтобы два параллельных бета-листа
перекрещивались
61.
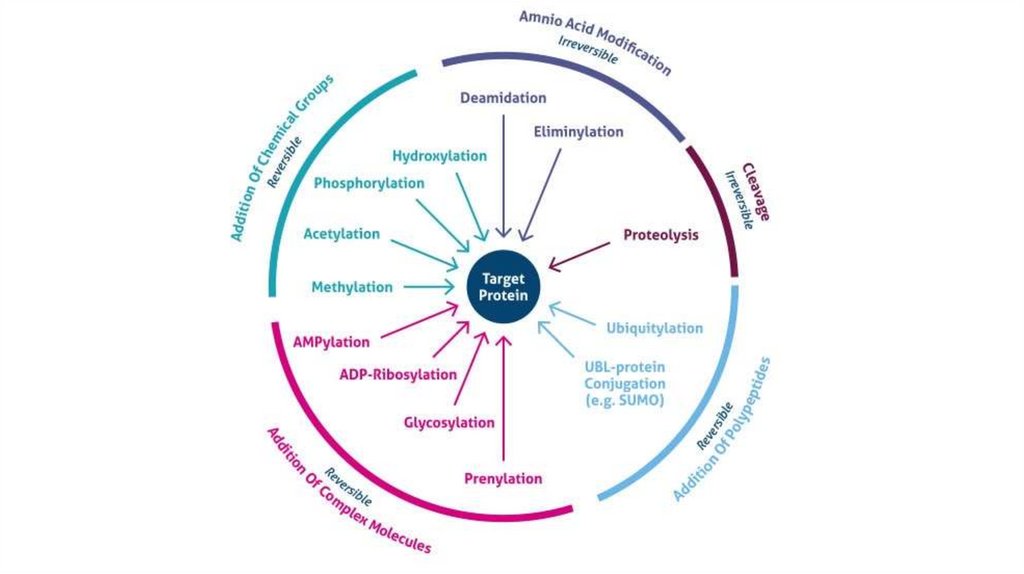
ПОСТТРАНСЛЯЦИОННАЯ МОДИФИКАЦИЯ БЕЛКАструктурные изменения в результате котрансляционных и
посттрансляционных модификаций
т.е. во время или после завершения их синтеза рибосомами
Описано более 100 различных посттрансляционных модификаций
белков
Большинство пострансляционных изменений белков регулируются
ферментами
62.
63.
64.
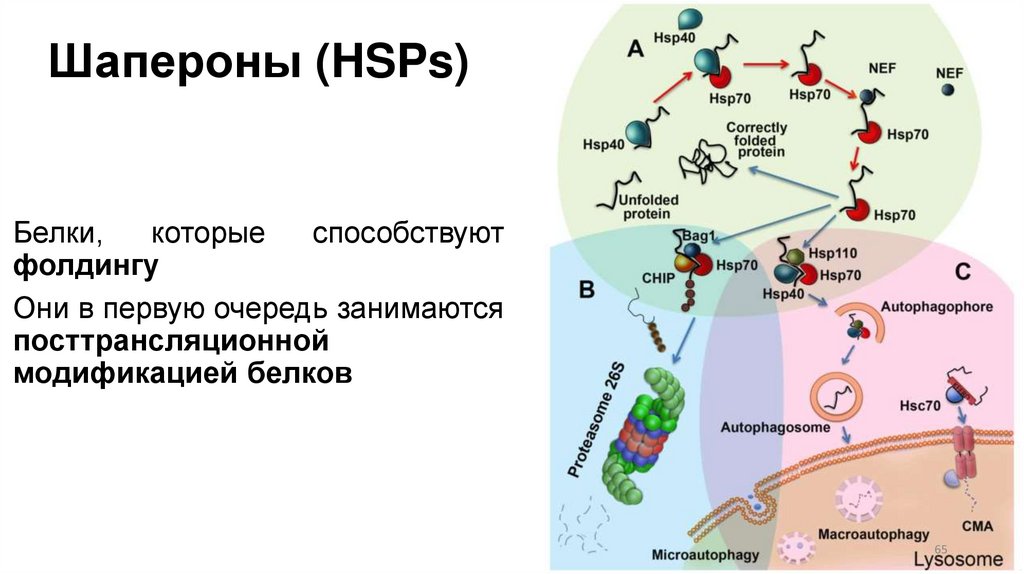
65. Шапероны (HSPs)
Белки,которые
способствуют
фолдингу
Они в первую очередь занимаются
посттрансляционной
модификацией белков
65
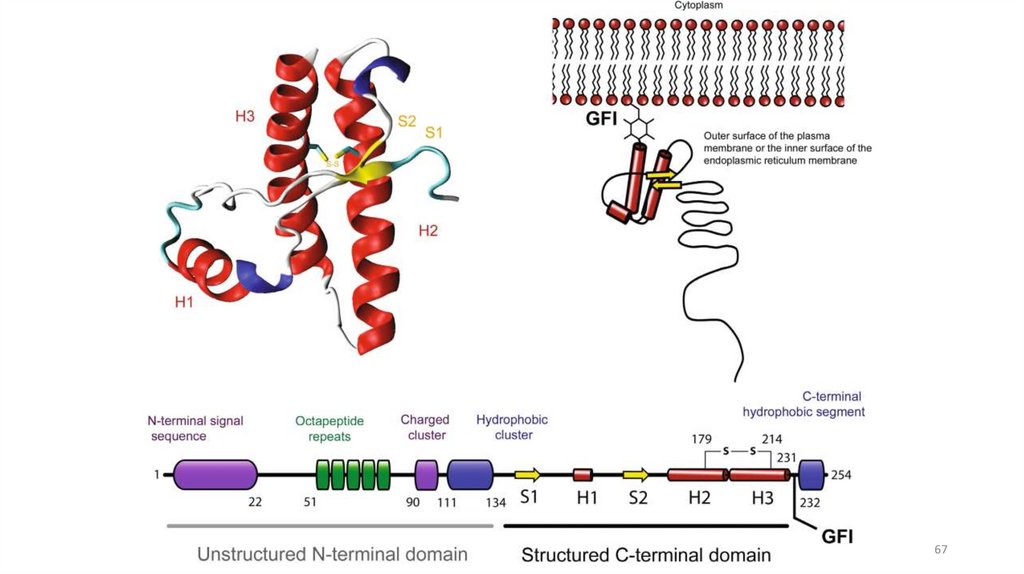
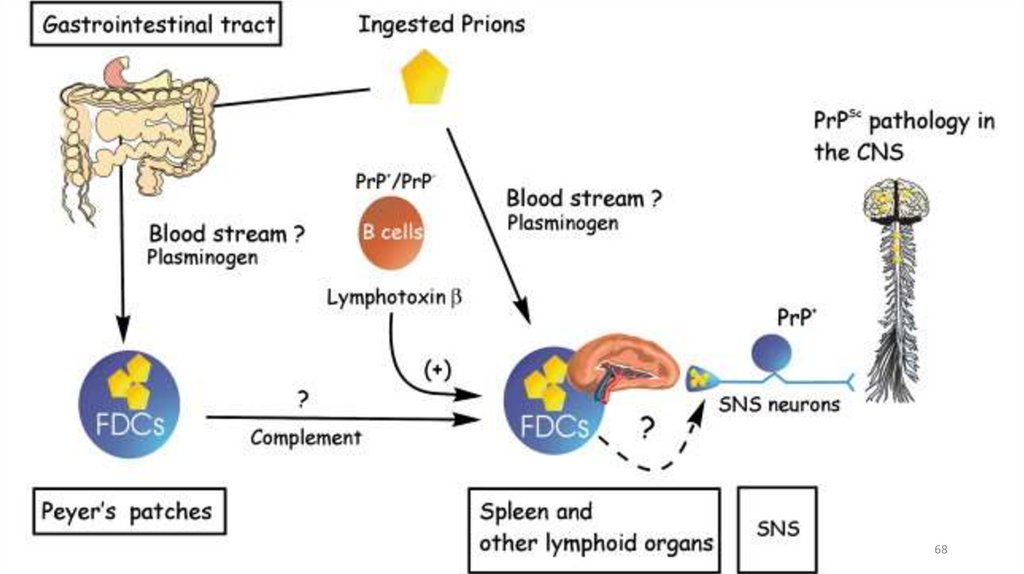
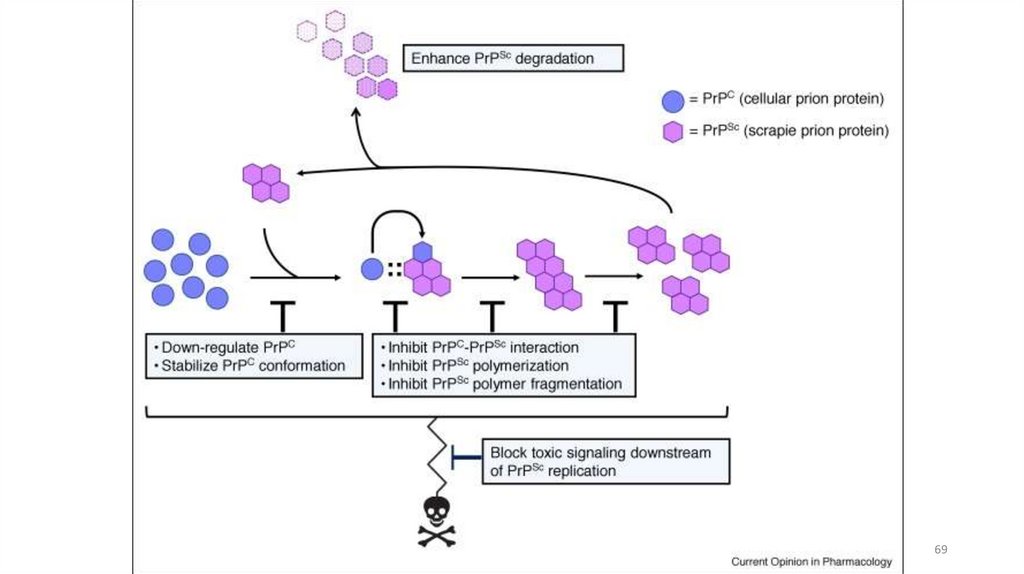
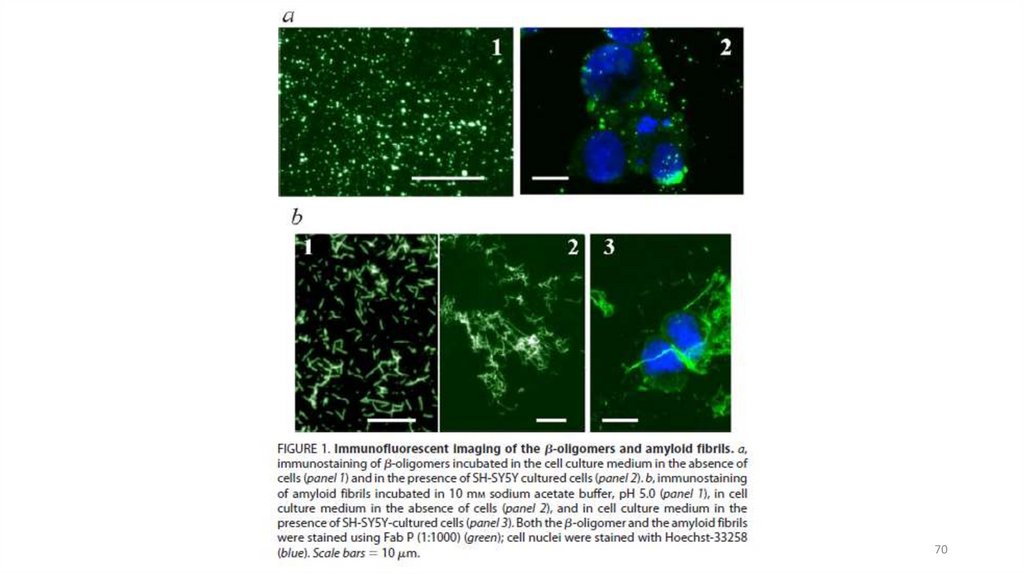
66. Прионы
Прионы — небольшие белки, 254 аминокислоты, относятся ксемейству
амилоидных
белков,
ассоциированы
с
нейродегенеративными заболеваниями. Имеют несколько
конформаций: растворимую форму и резистентную к
протеолизу (амилоидную) в виде фибрилл
Отличительное свойство: в отличие от других амилоидных
белков, прионы обладают способностью передаваться от
человека к человеку в качестве инфекционного агента
66
67.
6768.
6869.
6970.
7071. Прионы как анти-шапероны
Прионы, нарушая фолдинг нормальныхбелков, превращая их в прионные формы,
действуют по сути как анти-шапероны.
Если шапероны стараются
стабилизировать белковые структуры, то
прионы, напротив, стремятся к их
каскадной деградации.
71
72.
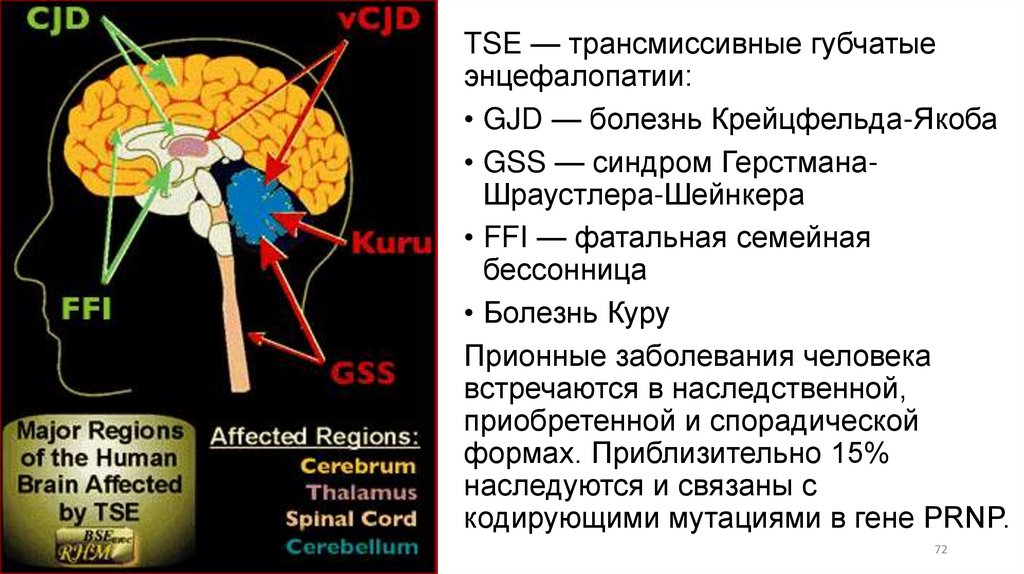
TSE — трансмиссивные губчатыеэнцефалопатии:
• GJD — болезнь Крейцфельда-Якоба
• GSS — синдром ГерстманаШраустлера-Шейнкера
• FFI — фатальная семейная
бессонница
• Болезнь Куру
Прионные заболевания человека
встречаются в наследственной,
приобретенной и спорадической
формах. Приблизительно 15%
наследуются и связаны с
кодирующими мутациями в гене PRNP.
72
73.
ЧЕТВЕРТИЧНАЯСТРУКТУРА
БЕЛКА
74.
75.
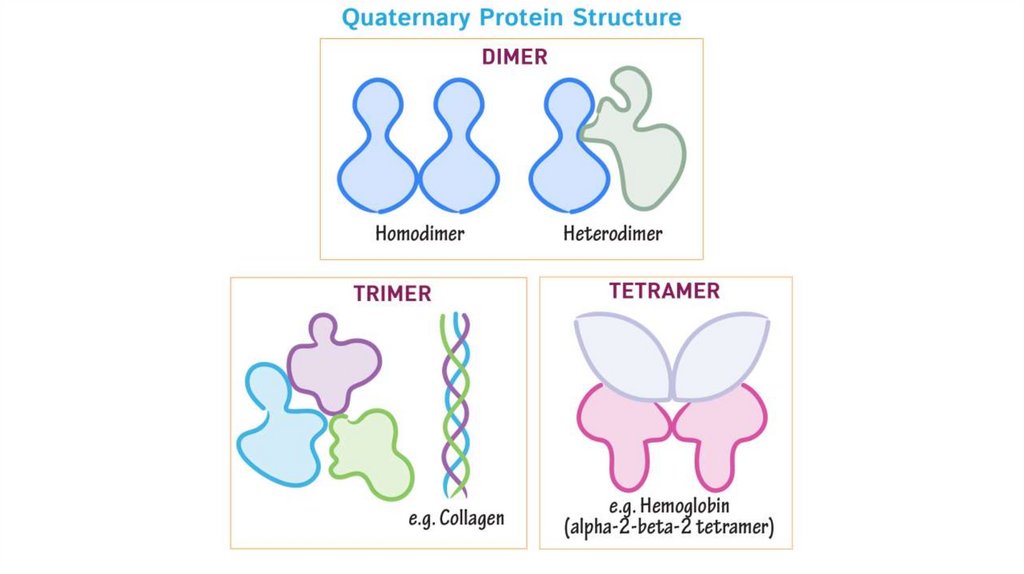
Четвертичные структурыВысший уровень организации белка (необязательный)
• Состоят из минимум двух полипептидных цепей, которые в
контексте структуру называют субъединицами
• Номенклатура белков строится из подсчета количества субъединиц
(от 1 до 22) и анализа их гомологичности (гомо- или гетеро-)
К примеру, если у белка три различные субъединицы, мы называем
его, гетеротример
• Регуляторные белки метаболических путей всегда будут иметь
четвертичную структуру
• Белки четвертичной структуры всегда подчиняются
аллостерической регуляции
76.
Четвертичные структурыСтабилизации четвертичной структуры уделяется незаслуженно
мало внимания:
Обычно четвертичные структуры белков стабилизируются, а
субъединицы
удерживаются
вместе
«слабыми»,
но
многочисленными
нековалентными
молекулярными
взаимодействиями, такими как водородные связи, Ван-дерВаальсовы, гидрофобные и ионные взаимодействия
Преимущественная стабилизация за счет гидрофобных
аминокислот и дисульфидных связей цистеина
77.
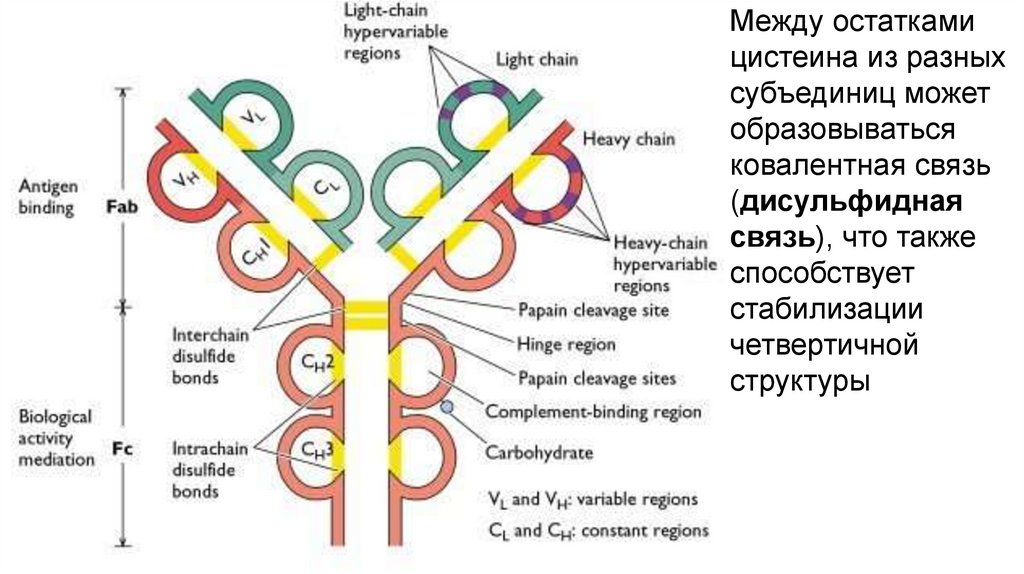
Между остаткамицистеина из разных
субъединиц может
образовываться
ковалентная связь
(дисульфидная
связь), что также
способствует
стабилизации
четвертичной
структуры
78.
79.
80.
81.
82.
83.
Классификациябелков, простые и
сложные белки
84. Пептиды
• Образуются путем лимитированного протеолиза из крупных белков –предшественников или внерибосомальным синтезом
• БАВ (действуют в концентрации 10-8-10-12 М)
• Естественные регуляторы, эндогенные «лекарства»
• Распадаются путем гидролиза до аминокислот, т.е. без образования
токсических веществ
• 1953г., В. Де Винью Искусственный синтез окситоцина. Началась эра
синтеза пептидов и белков, в частности для использования в качестве
лекарств.
85. Пептиды
• Эндорфины, энкефалины• Тафтсины
• Кейлоны
• Вазопрессин, окситоцин
• Ангиотензин
• Кинины
• Гастрин, секретин
86.
Химический составбелков:
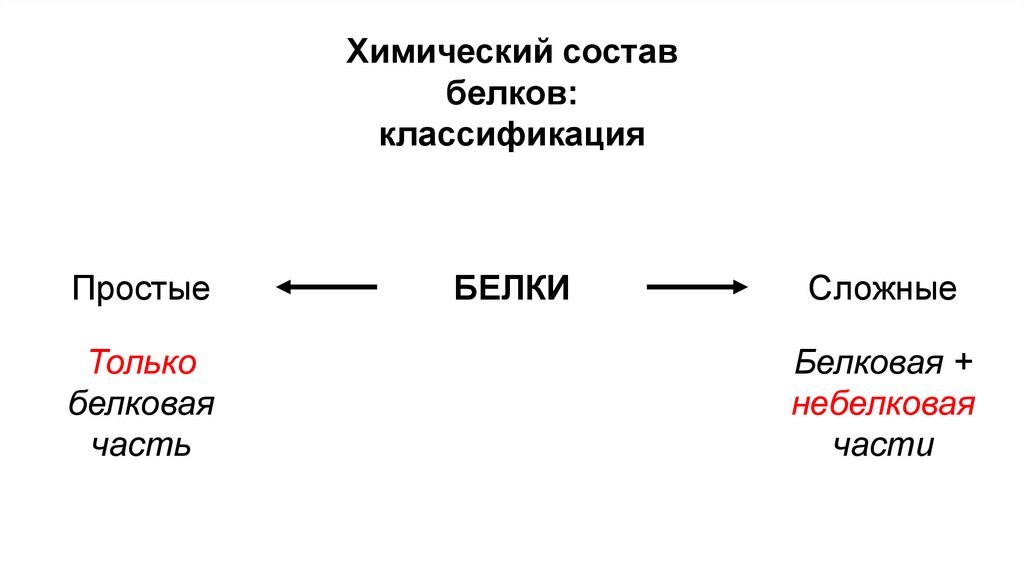
классификация
Простые
Только
белковая
часть
БЕЛКИ
Сложные
Белковая +
небелковая
части
87.
Простые белкиКлассический перечень простых белков в курсе общей
биохимии:
1. Глобулярные
А) Альбумины
Б) Глобулины
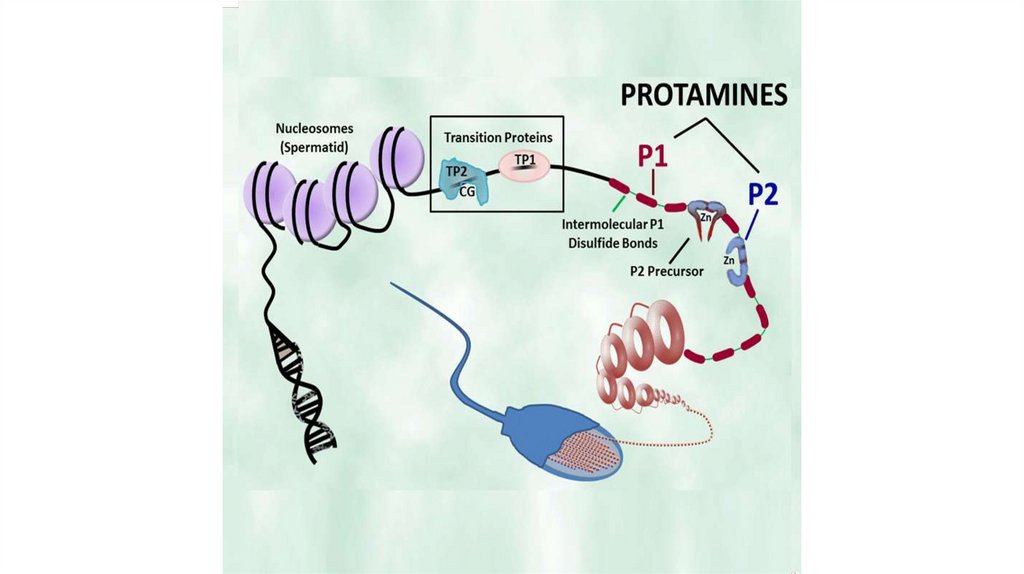
В) Гистоны
Г) Протамины
2. Фибриллярные
А) Коллаген
Б) Эластин
88.
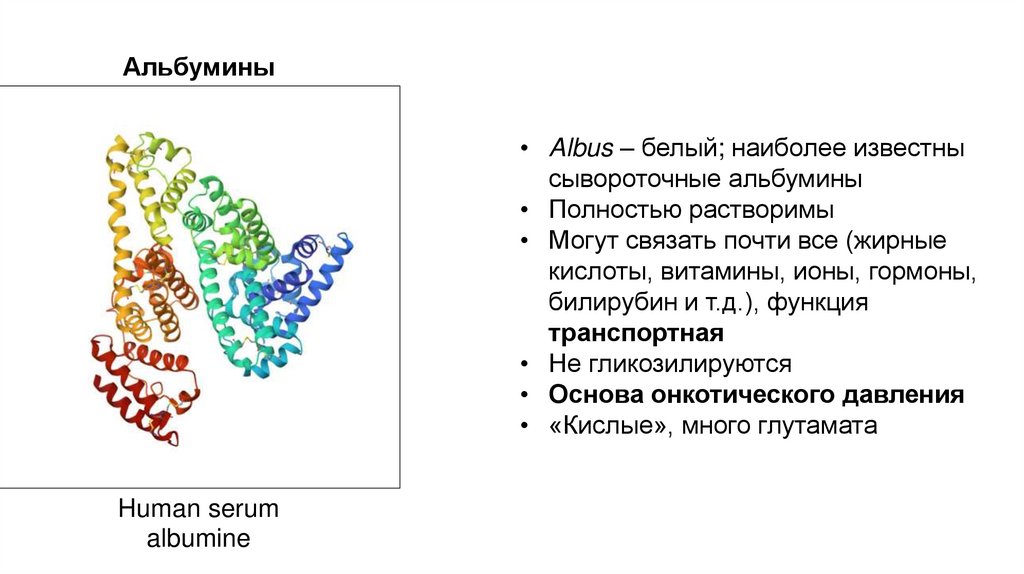
Альбумины• Albus – белый; наиболее известны
сывороточные альбумины
• Полностью растворимы
• Могут связать почти все (жирные
кислоты, витамины, ионы, гормоны,
билирубин и т.д.), функция
транспортная
• Не гликозилируются
• Основа онкотического давления
• «Кислые», много глутамата
Human serum
albumine
89.
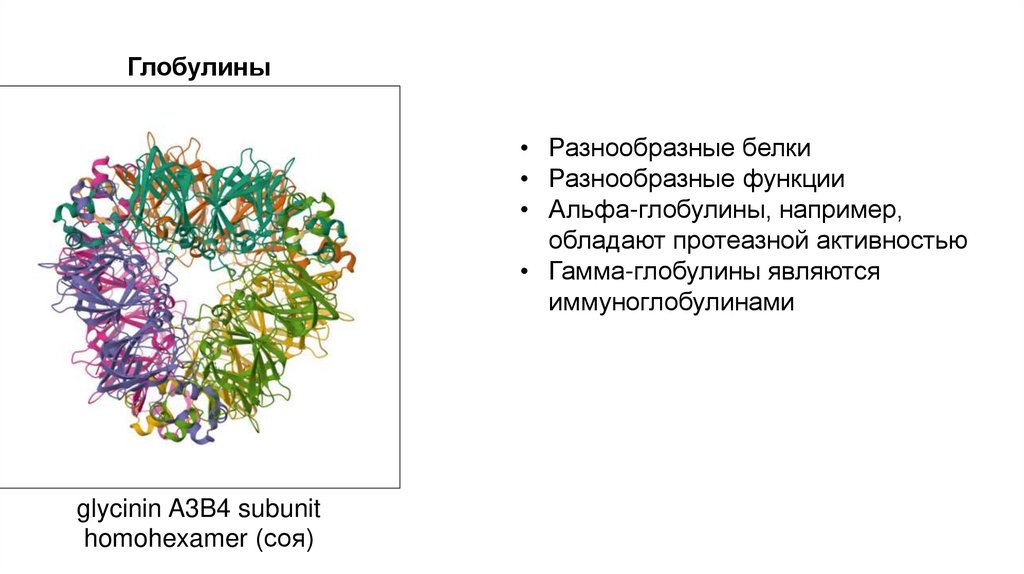
Глобулины• Разнообразные белки
• Разнообразные функции
• Альфа-глобулины, например,
обладают протеазной активностью
• Гамма-глобулины являются
иммуноглобулинами
glycinin A3B4 subunit
homohexamer (соя)
90.
91.
92.
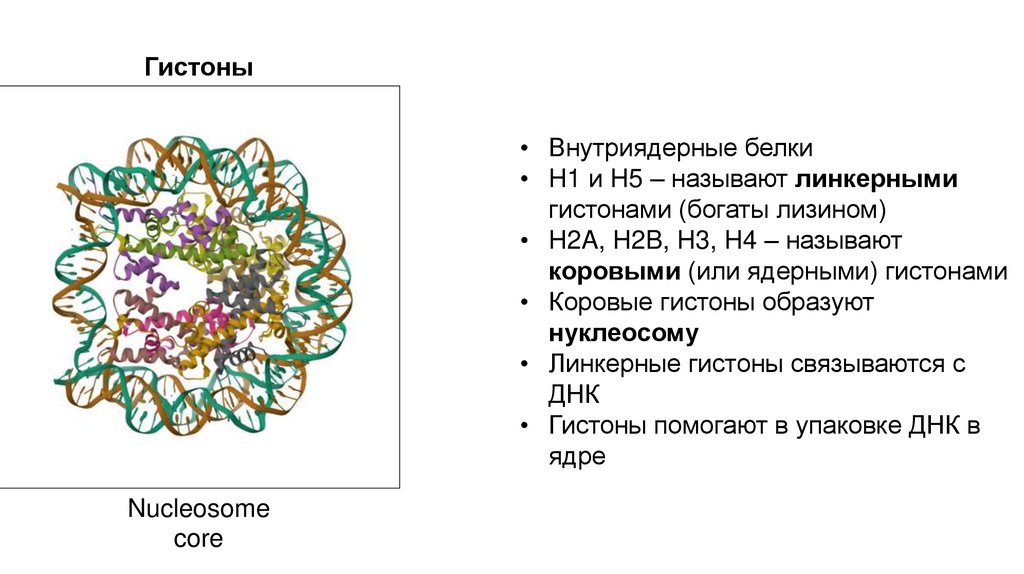
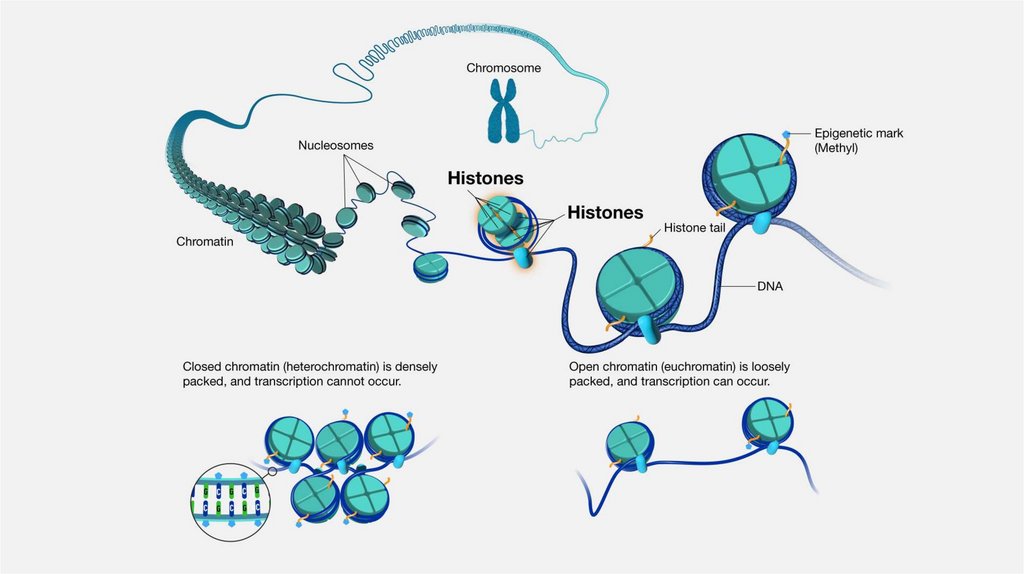
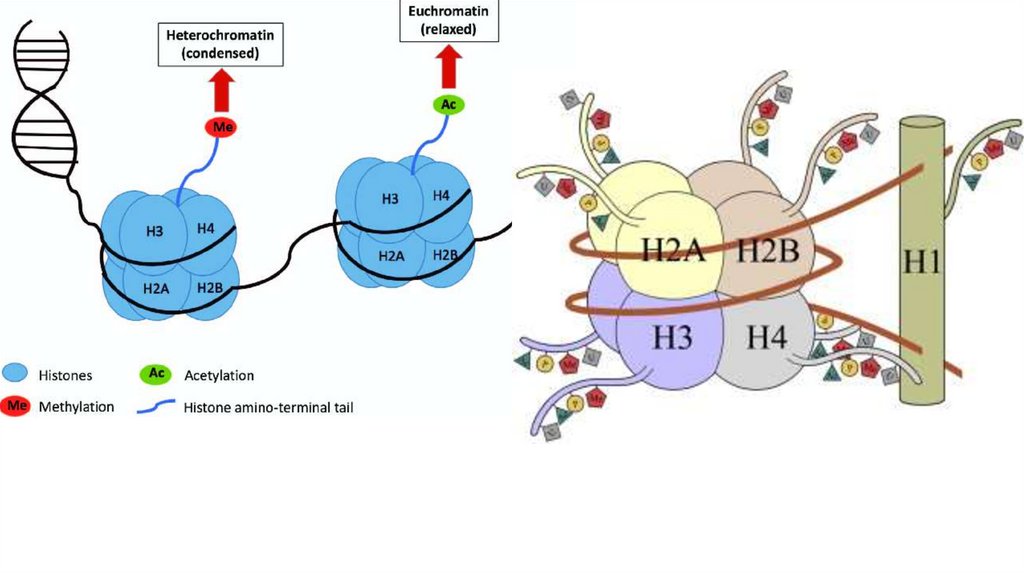
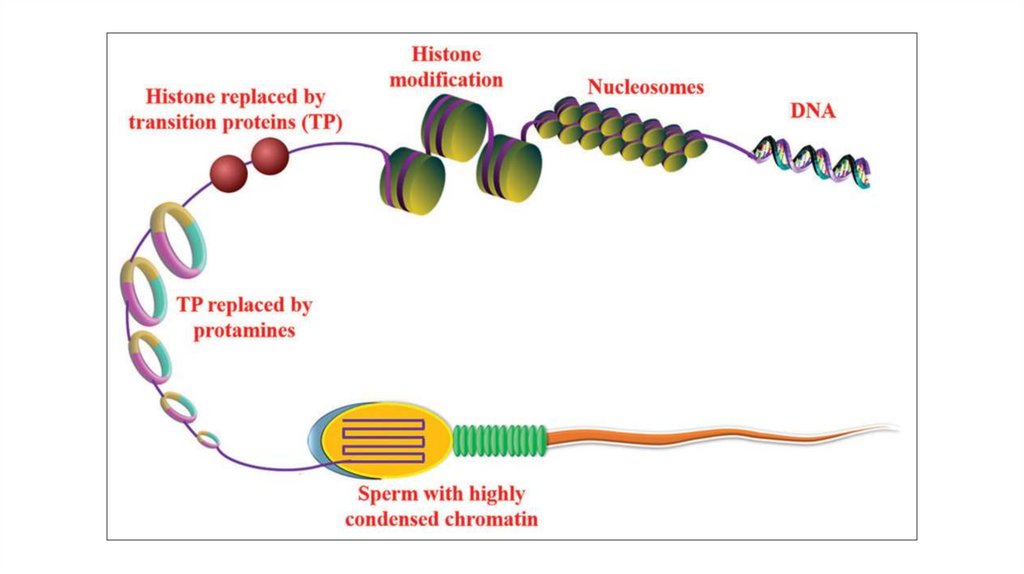
Гистоны• Внутриядерные белки
• H1 и H5 – называют линкерными
гистонами (богаты лизином)
• H2A, H2B, H3, H4 – называют
коровыми (или ядерными) гистонами
• Коровые гистоны образуют
нуклеосому
• Линкерные гистоны связываются с
ДНК
• Гистоны помогают в упаковке ДНК в
ядре
Nucleosome
core
93.
94.
95.
96.
97.
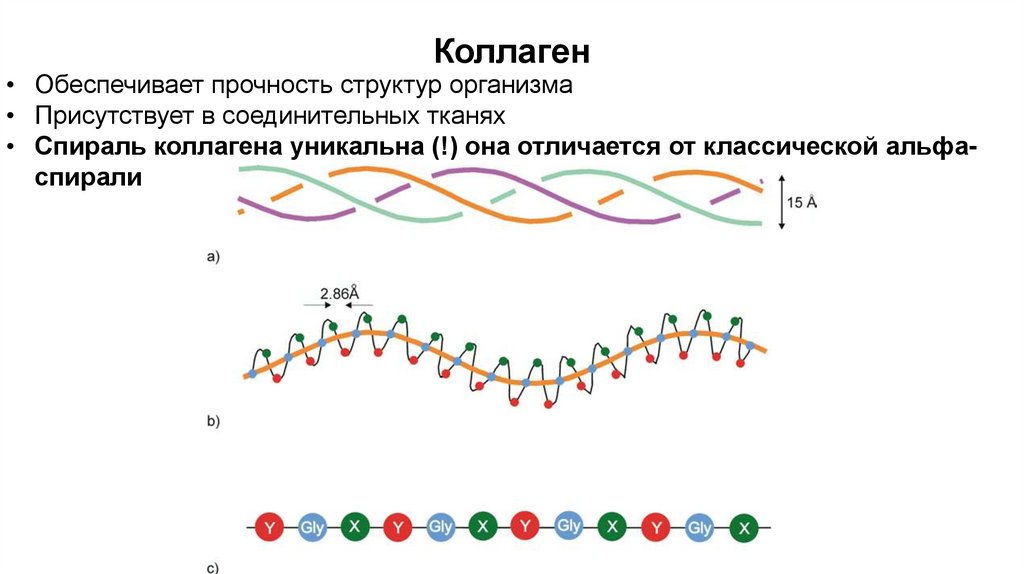
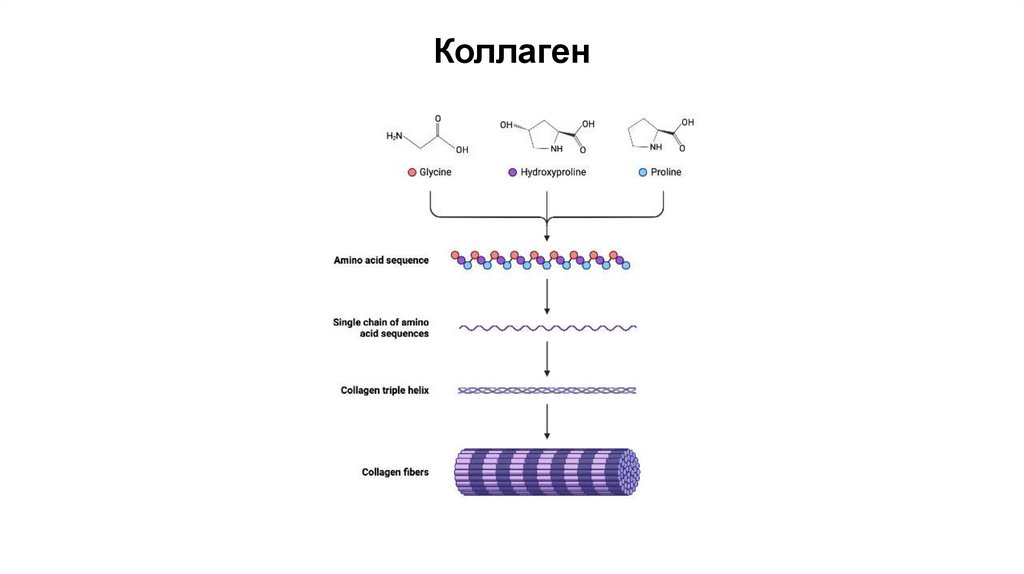
Коллаген• Обеспечивает прочность структур организма
• Присутствует в соединительных тканях
• Спираль коллагена уникальна (!) она отличается от классической альфаспирали
98.
Коллаген99.
Коллаген100.
101.
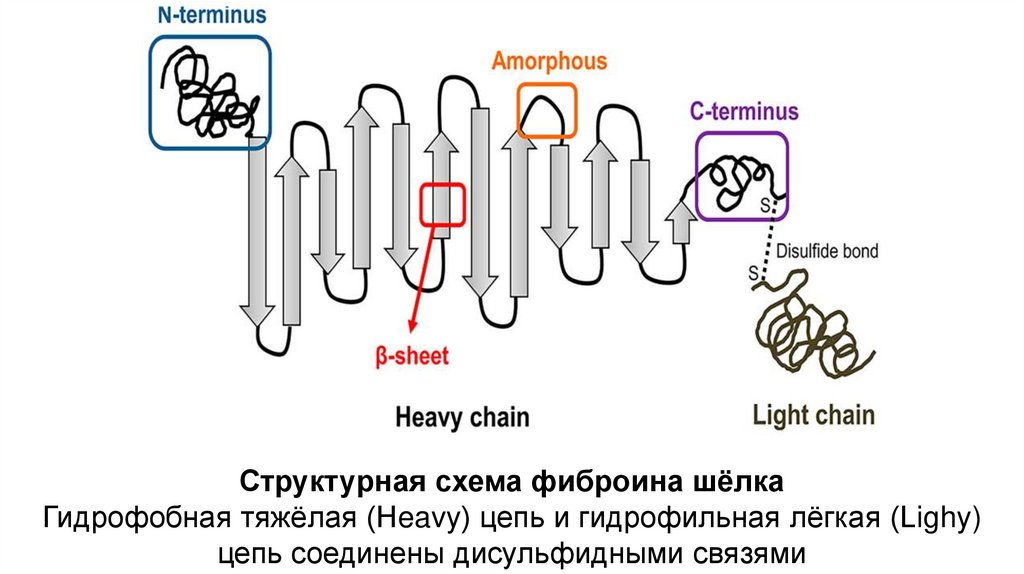
Структурная схема фиброина шёлкаГидрофобная тяжёлая (Heavy) цепь и гидрофильная лёгкая (Lighy)
цепь соединены дисульфидными связями
102.
103.
СЛОЖНЫЕБЕЛКИ
104.
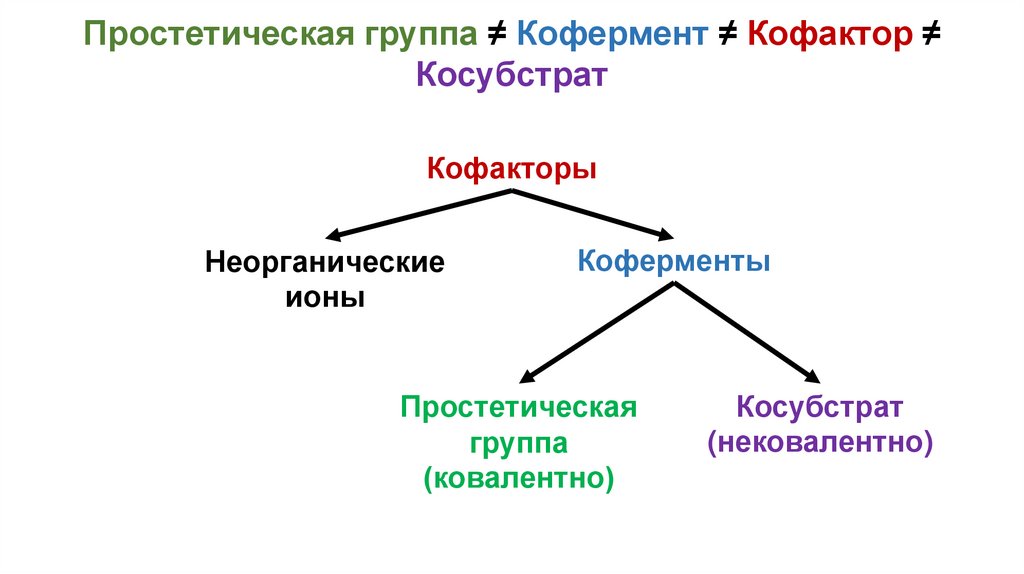
Простетическая группа ≠ Кофермент ≠ Кофактор ≠Косубстрат
• Кофактор – небелковая часть, принимающая участие в
функциональной активности белка
• Кофакторы бывают неорганическими и органическими
(коферменты)
• Коферменты делятся на две группы: простетические группы и
косубстраты
• Простетическая группа – связана ковалентно или, по крайней
мере, достаточно прочно с белковой частью
• Косубстрат способен же разъединяться с белковой частью и
спокойно присоединяться обратно (туда-сюда)
105.
Простетическая группа ≠ Кофермент ≠ Кофактор ≠Косубстрат
Кофакторы
Неорганические
ионы
Коферменты
Простетическая
группа
(ковалентно)
Косубстрат
(нековалентно)
106.
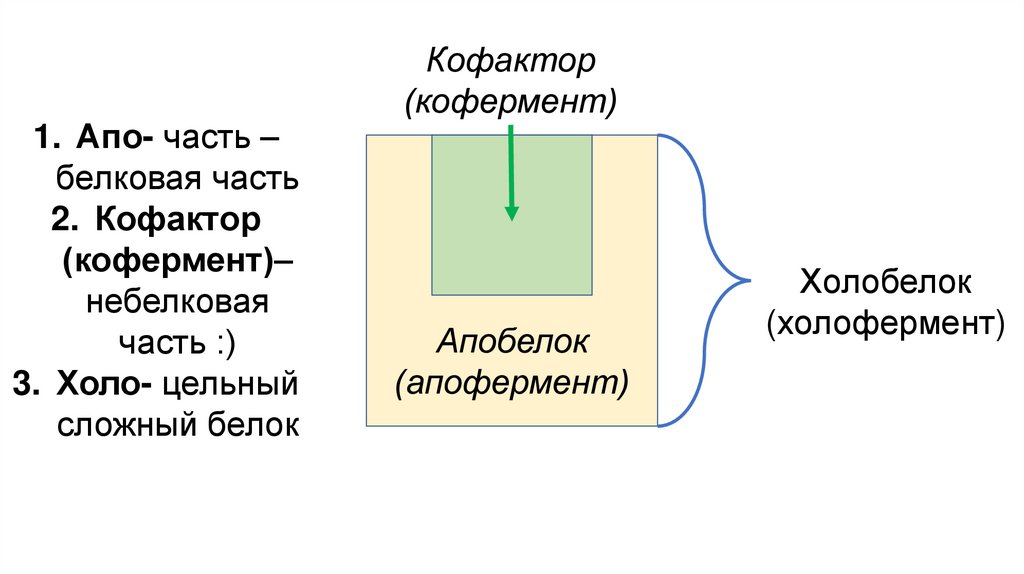
1. Апо- часть –белковая часть
2. Кофактор
(кофермент)–
небелковая
часть :)
3. Холо- цельный
сложный белок
Кофактор
(кофермент)
Апобелок
(апофермент)
Холобелок
(холофермент)
107.
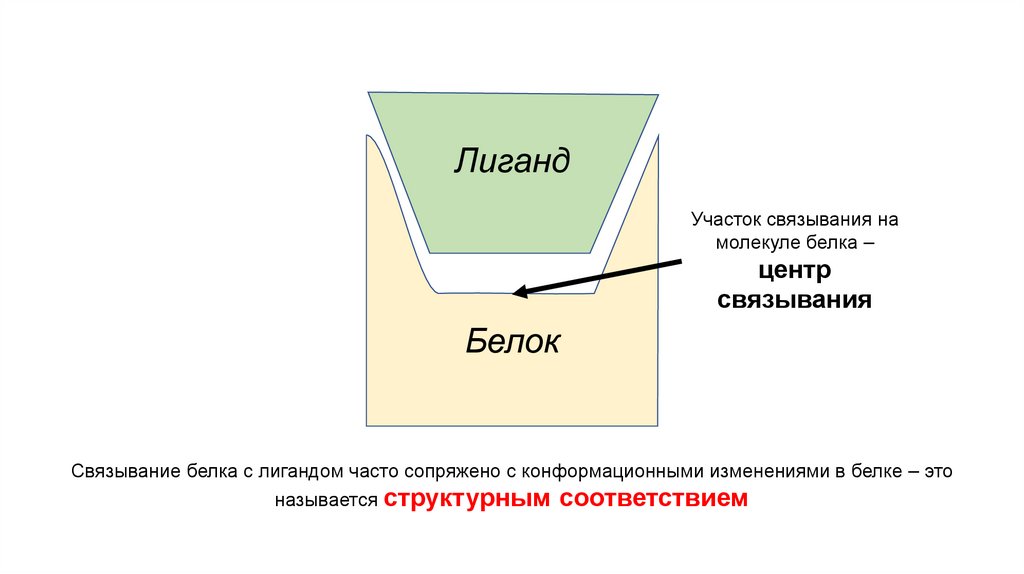
Что такое лиганд?Молекула, которая обратимо связывается с белков – это
лиганд
Лигандом может быть любая молекула, в том числе и
любой другой белок
Взаимодействие белка с лигандом носит краткосрочный
характер!
Лиганды помогают белка быстро реагировать на любые
внешние изменения
108.
ЛигандУчасток связывания на
молекуле белка –
центр
связывания
Белок
Связывание белка с лигандом часто сопряжено с конформационными изменениями в белке – это
называется структурным соответствием
109.
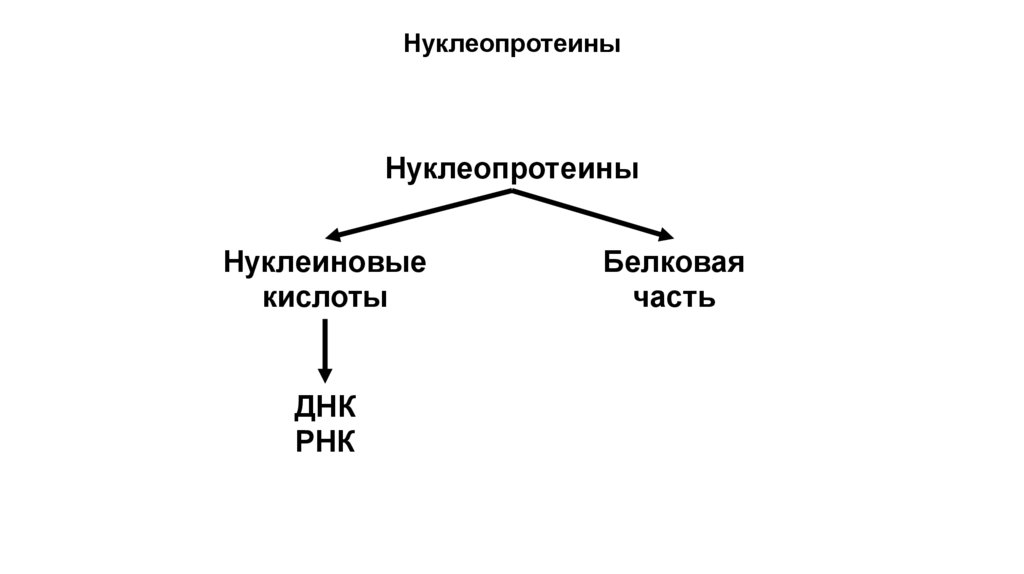
Сложные белкиПо небелковому компоненту:
1. Нуклеопротеины (нуклеиновые кислоты) – субъединицы
рибосом
2. Фосфопротеины (фосфатные группы) – гликогенсинтаза
3. Металлопротеины (ионы металлов) – цитохромоксидаза
4. Липопротеины (липиды) – хиломикроны
5. Хромопротеины (окрашенные простетические группы,
обычно гем и ретиналь) – гемоглобин
6. Гликопротеины (углеводы) – тиреоидный гормон
110.
НуклеопротеиныНуклеопротеины
Нуклеиновые
кислоты
ДНК
РНК
Белковая
часть
111.
112.
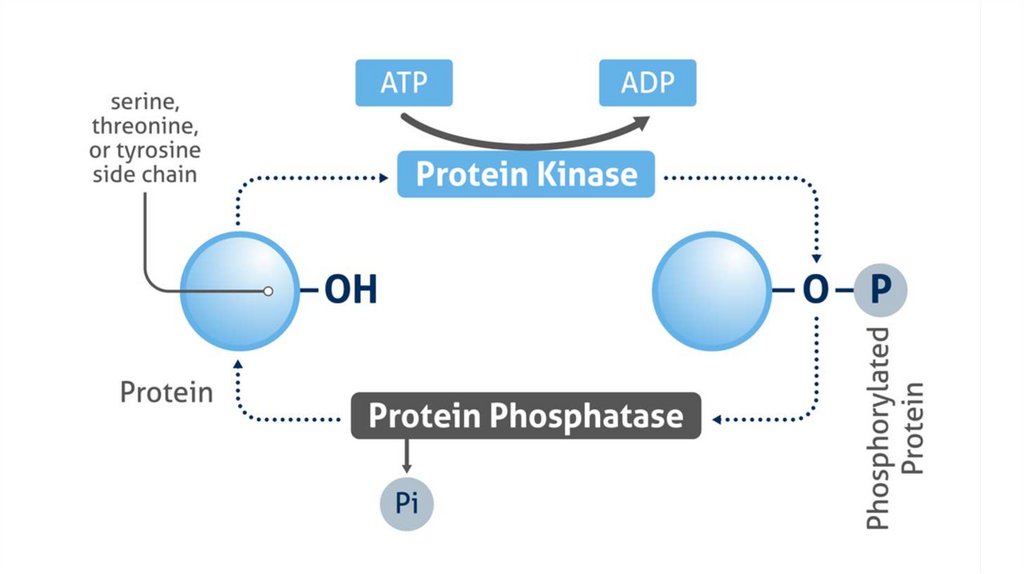
Фосфопротеины• Киназно-фосфатазное равновесие
• Белки могут фосфорилироваться, т.е. присоединять фосфат,
благодаря ферментам киназам
• Ферменты фосфатазы способы отсоединять фосфат
• Это один из классических механизмов регуляции работы
ферментов
• Источники фосфатов – обычно молекулы АТФ
• Участки способные присоединять фосфаты богаты OHсодержащими аминокислотами
113.
114.
115.
116.
117.
118.
119.
120.
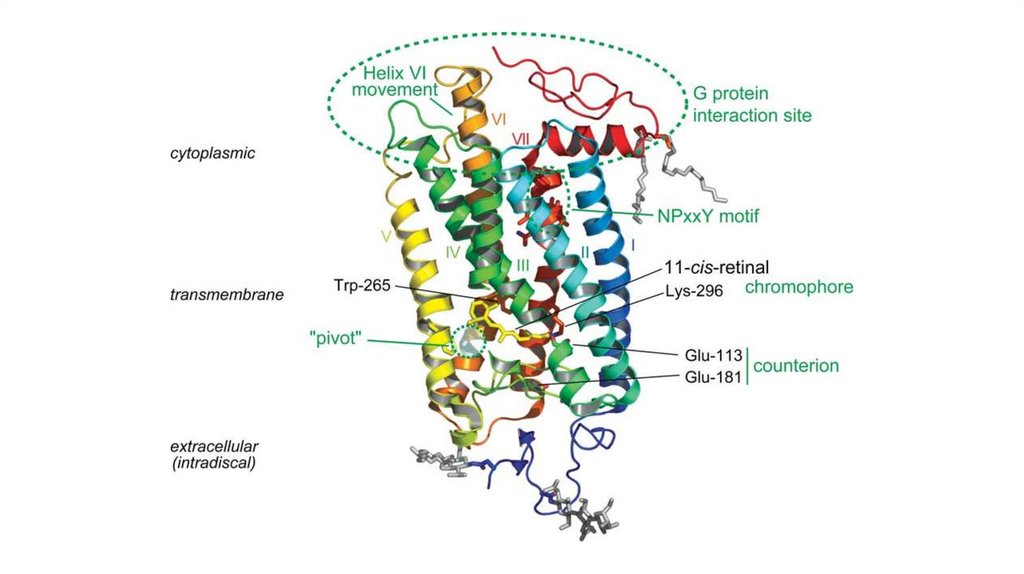
121. Липопротеины
• Общая структура – гидробофное ядро,гидрофильный слой на поверхности
Имеют жесткую структуру
Взаимодействуют с клеточными
рецепторами
Выступают в роли ферментов или
активаторов ферментов
• Липопротеины: хиломикроны (ХМ), очень низкой плотности (ЛПОНП),
низкой плотности (ЛПНП), высокой плотности (ЛПВП)
122.
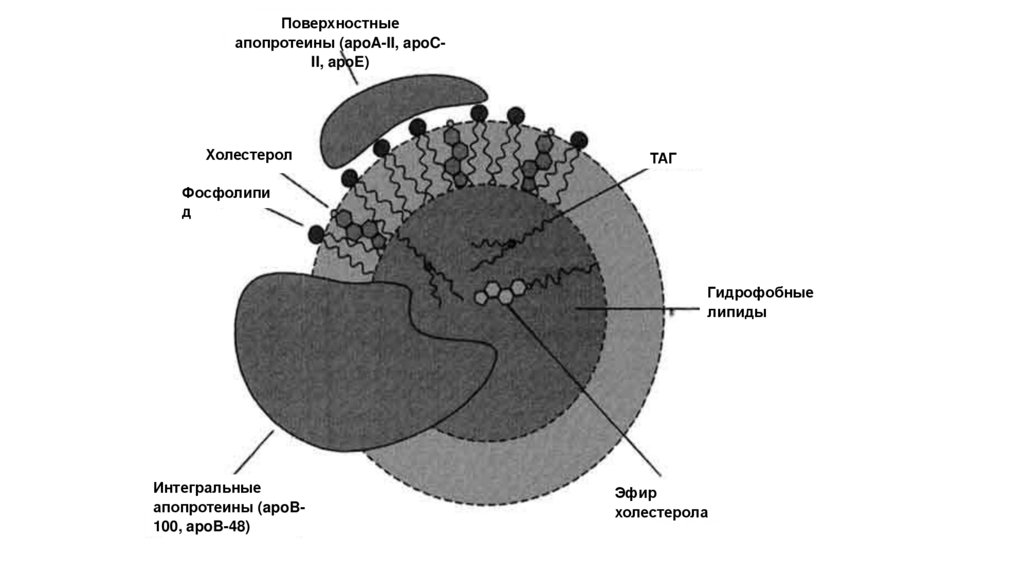
Поверхностныеапопротеины (apoA-II, apoCII, apoE)
Холестерол
ТАГ
Фосфолипи
д
Гидрофобные
липиды
Интегральные
апопротеины (apoB100, apoB-48)
Эфир
холестерола
123.
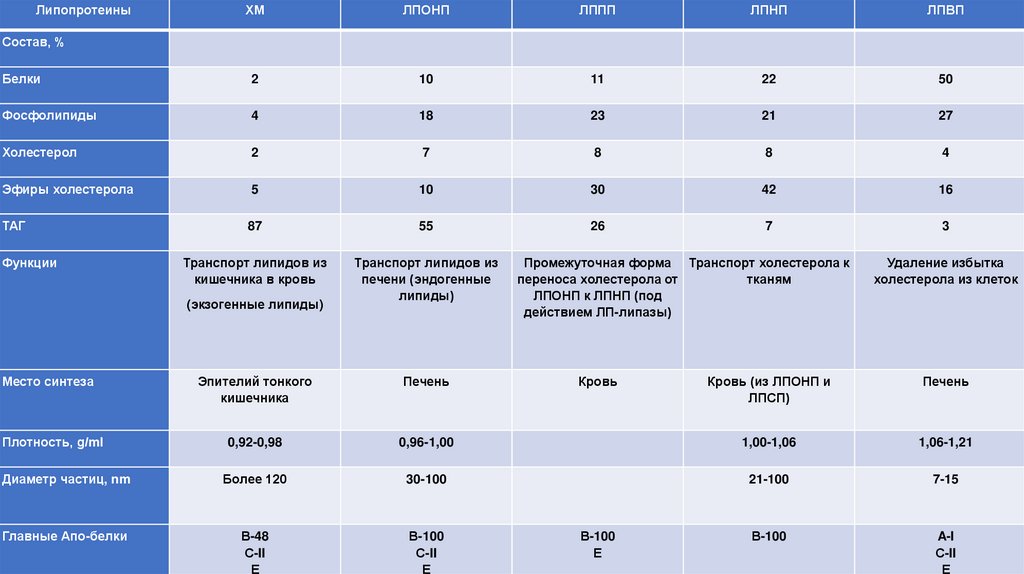
ЛипопротеиныХМ
ЛПОНП
ЛППП
ЛПНП
ЛПВП
Белки
2
10
11
22
50
Фосфолипиды
4
18
23
21
27
Холестерол
2
7
8
8
4
Эфиры холестерола
5
10
30
42
16
ТАГ
87
55
26
7
3
Транспорт липидов из
кишечника в кровь
Транспорт липидов из
печени (эндогенные
липиды)
Состав, %
Функции
(экзогенные липиды)
Место синтеза
Эпителий тонкого
кишечника
Печень
Плотность, g/ml
0,92-0,98
Диаметр частиц, nm
Главные Апо-белки
Промежуточная форма Транспорт холестерола к
переноса холестерола от
тканям
ЛПОНП к ЛПНП (под
действием ЛП-липазы)
Кровь
Удаление избытка
холестерола из клеток
Кровь (из ЛПОНП и
ЛПСП)
Печень
0,96-1,00
1,00-1,06
1,06-1,21
Более 120
30-100
21-100
7-15
В-48
С-II
Е
В-100
С-II
Е
В-100
A-I
С-II
Е
В-100
Е
124.
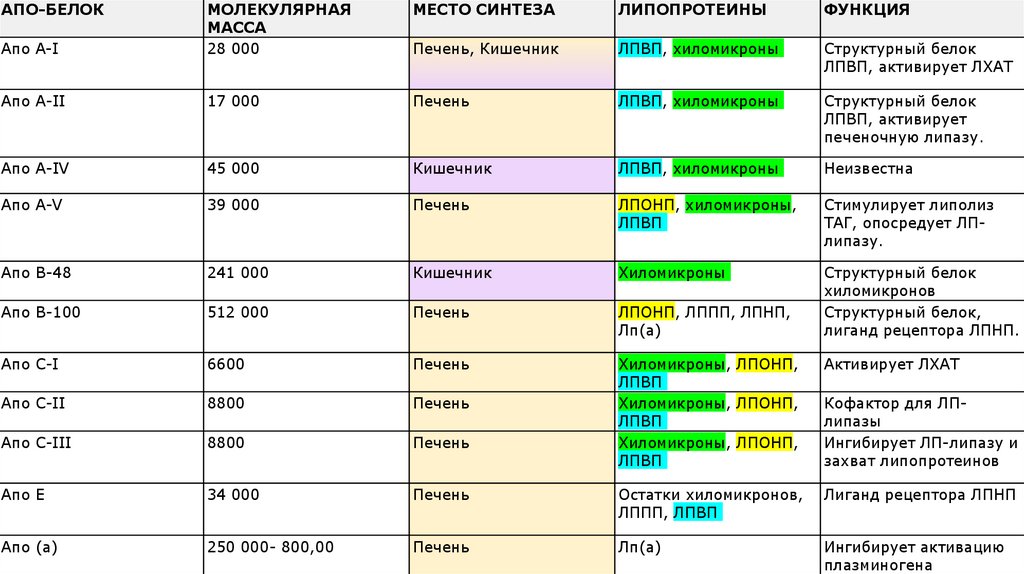
АПО-БЕЛОКМЕСТО СИНТЕЗА
ЛИПОПРОТЕИНЫ
ФУНКЦИЯ
Апо A-I
МОЛЕКУЛЯРНАЯ
МАССА
28 000
Печень, Кишечник
ЛПВП, хиломикроны
Структурный белок
ЛПВП, активирует ЛХАТ
Апо А-II
17 000
Печень
ЛПВП, хиломикроны
Структурный белок
ЛПВП, активирует
печеночную липазу.
Апо А-IV
45 000
Кишечник
ЛПВП, хиломикроны
Неизвестна
Апо А-V
39 000
Печень
ЛПОНП, хиломикроны,
ЛПВП
Стимулирует липолиз
ТАГ, опосредует ЛПлипазу.
Апо B-48
241 000
Кишечник
Хиломикроны
Апо B-100
512 000
Печень
ЛПОНП, ЛППП, ЛПНП,
Лп(а)
Структурный белок
хиломикронов
Структурный белок,
лиганд рецептора ЛПНП.
Апо C-I
6600
Печень
Активирует ЛХАТ
Апо C-II
8800
Печень
Апо C-III
8800
Печень
Хиломикроны, ЛПОНП,
ЛПВП
Хиломикроны, ЛПОНП,
ЛПВП
Хиломикроны, ЛПОНП,
ЛПВП
Апо Е
34 000
Печень
Остатки хиломикронов,
ЛППП, ЛПВП
Лиганд рецептора ЛПНП
Апо (а)
250 000- 800,00
Печень
Лп(а)
Ингибирует активацию
плазминогена
Кофактор для ЛПлипазы
Ингибирует ЛП-липазу и
захват липопротеинов
125.
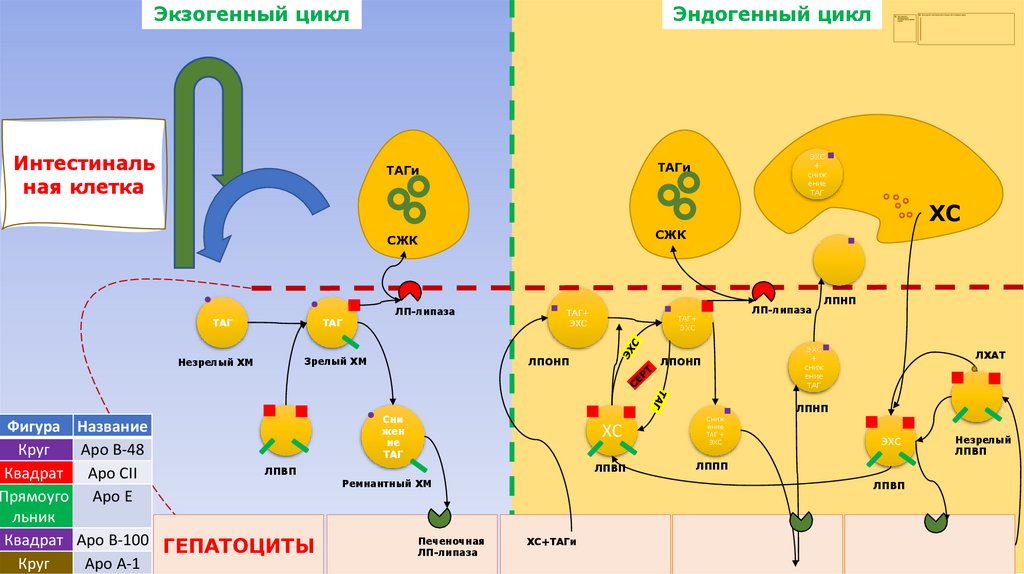
Экзогенный циклИнтестиналь
ная клетка
Эндогенный цикл
ЭХС
+
сниж
ение
ТАГ
ТАГи
ТАГи
ХС
СЖК
СЖК
ТАГ
Незрелый ХМ
ТАГ
ЛП-липаза
Зрелый ХМ
Фигура Название
Круг
Apo B-48
ЛПВП
Квадрат Apo CII
Прямоуго Apo E
льник
Квадрат Apo B-100 ГЕПАТОЦИТЫ
Круг
Apo A-1
ТАГ+
ЭХС
ЛП-липаза
ТАГ+
ЭХС
ЭХС
+
сниж
ение
ТАГ
ЛПОНП
ЛПОНП
ЛПНП
ЛХАТ
ЛПНП
Сни
жен
ие
ТАГ
Ремнантный ХМ
Печеночная
ЛП-липаза
ХС
Сниж
ение
ТАГ +
ЭХС
ЛПВП
ЛППП
ЭХС
ЛПВП
ХС+ТАГи
Незрелый
ЛПВП
126.
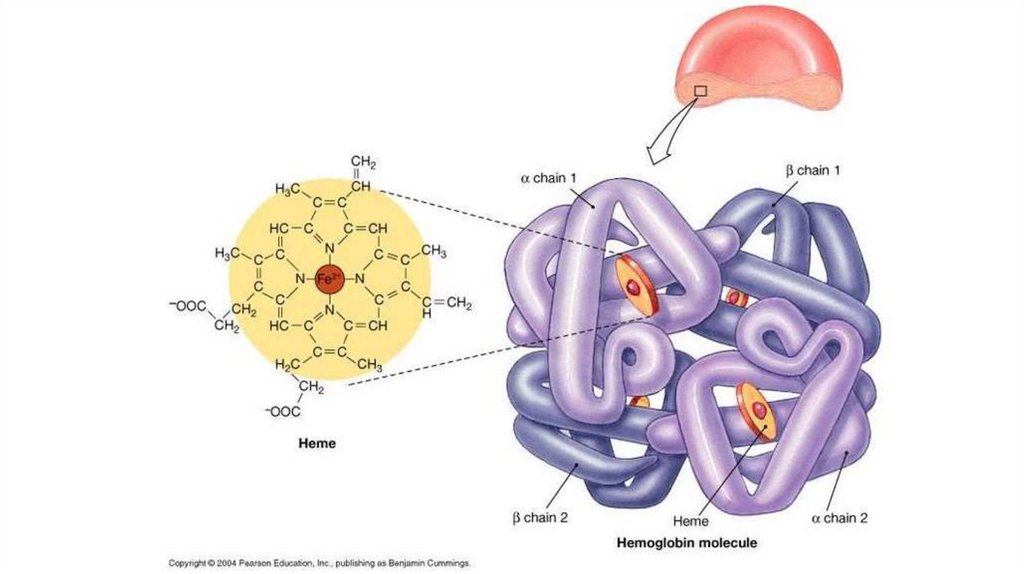
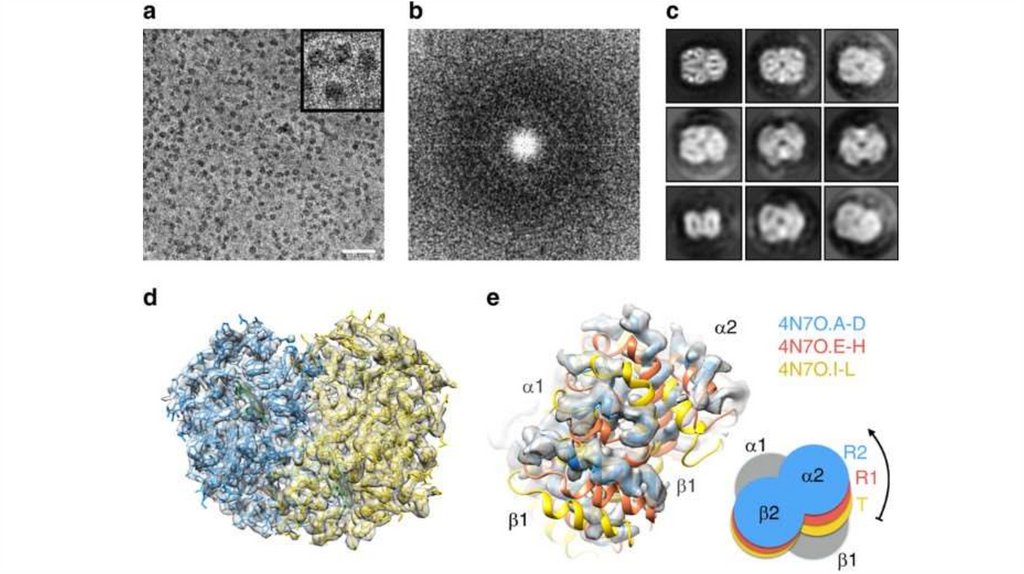
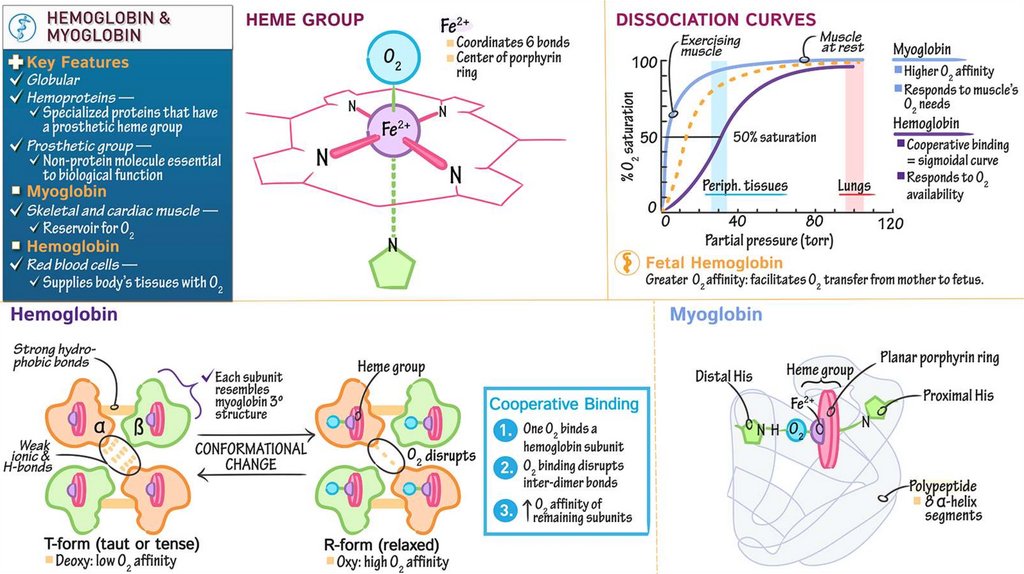
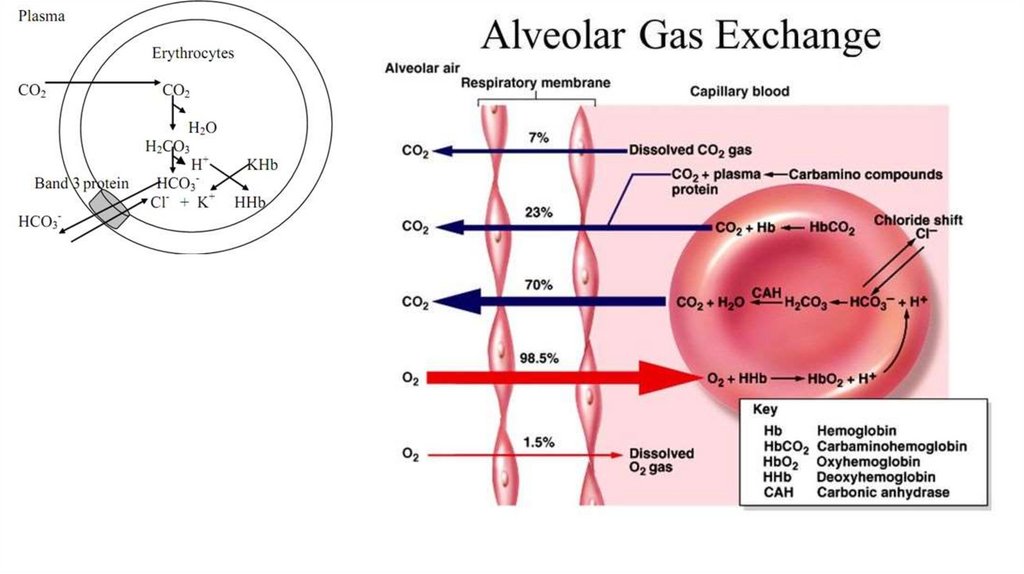
127. Гемоглобин
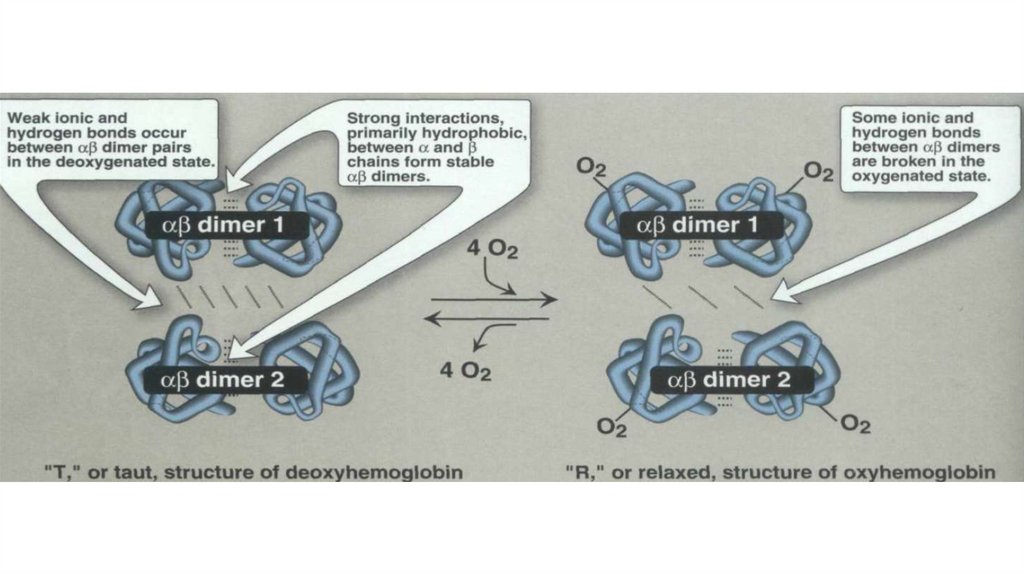
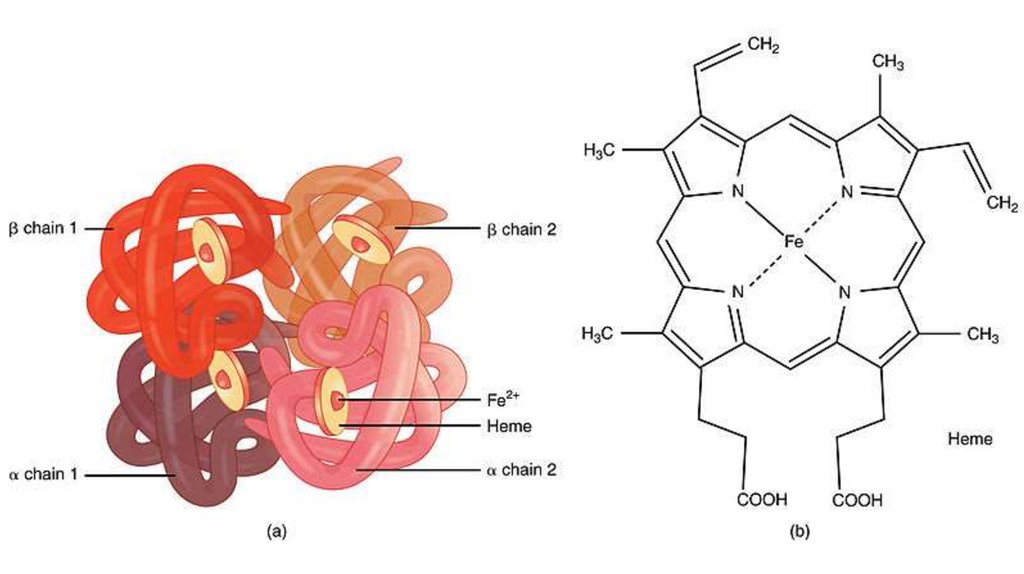
• 4 гема + 2 a- и 2 b- полипептидных цепи• Белок четвертичной структуры
• Субъединицы
проявляют
кооперативный
эффект
при
связывании с кислородом
• A- и b- цепи пространственно схожи с
полипептидной цепью
миоглобина
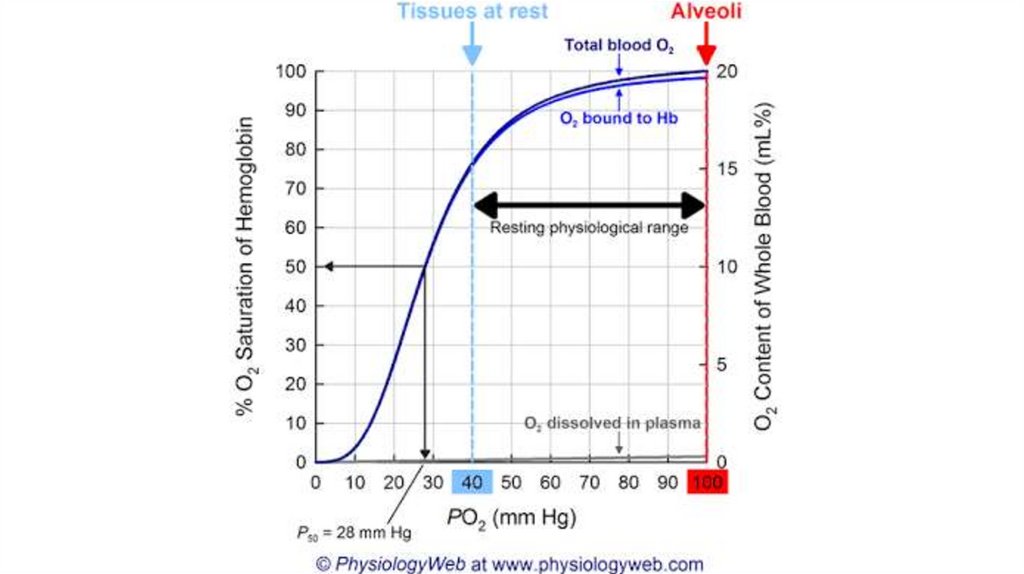
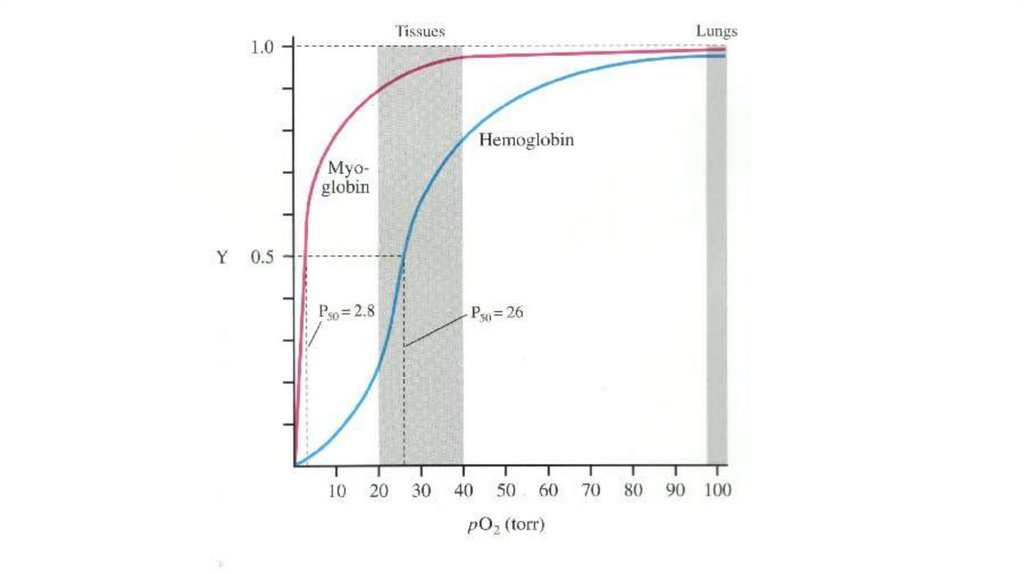
• Функционально мио- и гемоглобин различаются! Насыщаются
кислородом при разном давлении.
• Нb – аллостерический белок! Сродство к О2 зависит от рН среды,
парциального давления кислорода и углекислого газа, присутствия 2,3
дифосфоглицерата
128.
129.
130.
131.
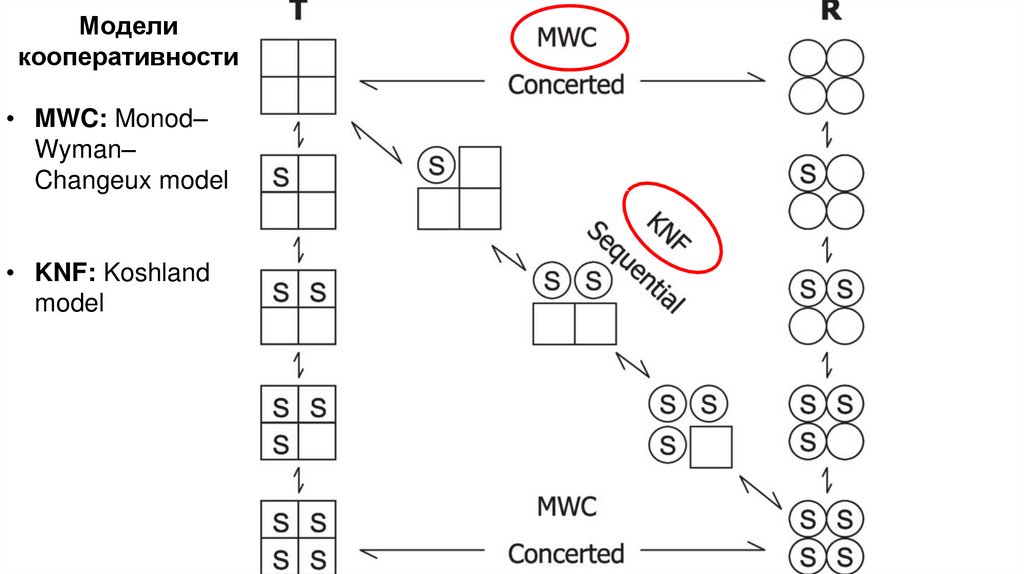
Моделикооперативности
• MWC: Monod–
Wyman–
Changeux model
• KNF: Koshland
model














































 Химия
Химия








