Похожие презентации:
Предмет и задачи биохимии. Белки. (Лекция 1)
1. Введение. Предмет и задачи биохимии. Белки.
1.2.
3.
4.
5.
6.
7.
Цели и задачи биологической химии.
Белки. Биологические функции.
Химический состав белков.
Конформация белков. Фолдинг. Шапероны.
Физико-химические свойства.
Классификация.
Методы разделения белков.
2. Цели и задачи биохимии
Биохимия – дословно «химия жизни»Цель: изучение химических ( т.е. молекулярных)
основ функционирования организма (т.е. основ
жизнедеятельности).
Термин «биохимия» введен Карлом Нейбергом в 1903 г.
Задачи:
1.
2.
3.
Изучение структуры биомолекул и биоактивных
веществ во взаимосвязи с функциями.
Изучение механизмов поступления веществ в
клетки.
Изучение механизмов превращения биомолекул в
клетках, механизмов высвобождения и
использования энергии, регуляция этих
превращений, т.е. метаболизм
3. Применение знаний биохимии в медицине:
• 1. Решение проблем сохранения здоровья, в томчисле проблем рационального питания;
профилактики заболеваний, в том числе
стоматологических.
• 2. Выяснение причин различных заболеваний и
изыскание путей их эффективного лечения.
(Диагностика и контроль за лечением)
При этом стоматолог всегда должен учитывать
взаимосвязь химических (метаболических)
процессов , происходящих в организме, и
состоянием тканей и секретов ротовой
полости.
4. Белки. Строение, свойства, функции
• Белки (синоним:протеины; от греч.protos-первый)• Белки-высокомолекулярные азотсодержащие
биополимеры или сополимеры, имеющие
трехмерную пространственную конфигурацию,
состоящие из мономеров - альфа-аминокислот,
соединенных в неразветвленную полимерную полипептидную цепь ковалентными пептидными
связями.
5. 1. Белки. Функции.
В организме человека содержится свыше 50000индивидуальных белков, выполняющих
жизненноважные функции.
Функции:
Специфические ( характерны только белкам,
благодаря их уникальной пространственной
конфигурации) - каталитическая, транспортная,
рецепторная, иммунной защиты, механохимическая, защита от кровопотери.
Неспецифические – пластическая, энергетическая,
регуляторная
Белки выполняют специфические функции
благодаря их уникальной пространственной
(трехмерной) конфигурации
6. Белки. Химический состав.
Мономер природного белка – альфа- аминокислоты.В составе белков человека – 20 протеиногенных ам-т.
Классификация аминокислот:
- по полярности радикала;
- способности синтезироваться в организме –
заменимые и незаменимые;
незаменимые: валин, лейцин, изолейцин, лизин,
метионин, треонин, триптофан, фенилаланин.
частично заменимые- гистидин, аргинин.
условно заменимые – синтезируются из незаменимыхцистеин, тирозин.
7. Альфа-аминокислота- мономер природных белков
Все α-аминокислотыразличаются строением
радикала.
R - CН - СООН
I
NН2
Химические группы радикалов
обладают разными свойствами и
определяют формирование
соответствующей
пространственной конформации
полипептидной цепи.
Гидрофобные группы – СН3 метильная, циклические;
Гидрофильные: ОН, СООН, NН2,
NН, SH, амидная – СО- NН2
8. Пространственная структура (конформация)
Все индивидуальные белки отличаются первичной структурой,конформацией, строением активного центра и функциями.
Молекулы белка - трехмерны. Имеют три уровня организации:
- первичная - полипептидная цепь, состоящая из аминокислот,
последовательно связанных ковалентными пептидными связями
- -СО-NН- ; аминокислотный состав и их последовательность
обусловлена генетическим кодом. Каждый из индивидуальных
белков имеет уникальную первичную структуру.
Первичная структура обусловливает пространственную
конформацию.
- вторичная - ( пространственно упорядоченная спираль,
обусловленная водородными связями между водородом и
кислородом групп, обеспечивающих пептидные связи); Два вида
структуры – альфа-спираль и бета-спираль.
- третичная – (энергетически выгодная упорядоченная структура,
обусловленная нековалентными связями между химическими
группа радикалов- водородные, ионные, дисульфидные,
гидрофобные взаимодействия.).
Третичная структура- обязательная для всех белков – энергетически
выгодная глобула. По геометрической форме глобулы белки
разделяют на глобулярные и фибриллярные. Большинство
белков – глобулярные. Они имеют компактную структуру,в которой
гидрофобные радикалы расположены внутри молекулы.
9. Пространственная структура (продолжение)
• Четвертичная (олигомерные белки) - ассоциациянескольких (четное кол-во) протомеров с
третичным уровнем (нековалентные связи).
Характерна для белков с высокой биологической
активностью, например - регуляторные
ферменты, гемоглобин, иммуноглобулины.
10. Структура белка. Домены
• Для высокомолекулярных белков вструктуре характерно наличие доменов.
• Домены- это участки полипептидной цепи,
которые имеют независимо от других
участков этой цепи конформацию глобулы
(третичную структуру).
11. Шапероны. Фолдинг
Шапероны. Фолдинг
Фолдинг – процесс формирования трехмерной
структуры при участии белков шаперонов
Шапероны (shaperon - с французского- няня)–
специализированные внутриклеточные белки,
ответственные за быстрое формирования
правильной пространственной структуры белка.
Шапероны также участвуют в защите клеточных
белков от денатурирующих воздействий
(температуры, гипоксии, инфекции, рН, тяжелых
металлов). Их количество возрастает при повышении
температуры, поэтому их также называют белками
теплового шока.
Болезни связанные с нарушением фолдинга –
амилоидозы (например, амилоидоз- нервной тканиболезнь Альцгеймера).
Амилоиды- нерастворимые субстанции белка в
клетке ( в связи с их несформированой нативной
пространственной структурой) .
12. УЧАСТИЕ ШАПЕРОНОВ В ФОЛДИНГЕ БЕЛКОВ
РИБОСОМАШАПЕРОНЫ 60
БЕЛОК
мРНК
синтезирован
ный белок
нативный
белок
ШАПЕРОНОВЫЙ
КОМПЛЕКС
13. Центр связывания (активный центр). Взаимодействие белка с лигандами
• Для осуществления своих функции – напр.каталитической,транспортной, рецепторной, иммуноглобулины - белок
связывается с другим веществом. Для этого в молекуле белка
имеется центр связывания (активный центр)- совокупность чаще
всего трех функциональных групп аминокислот.
• Лиганд- это вещество, с которым взаимодействует белок для
осуществления своих функций.
• Лиганд присоединяется к центру связывания по принципу
комплементарности.
• Комплементарность – это пространственное и химическое
сродство лиганда и активного центра
14. Физико-химические свойства белков.
1. Высокая молекулярная масса – варьирует в широкихпределах, т.к. варьирует кол-во в молекуле аминокисл.
остатков. Коротко цепочечные белки – называют
пептидами (также обладающие широким спектром
действия).
Растворы белка обладают свойствами коллоидных
растворов - осмотические свойства, высокая вязкость,
малая скорость диффузии
2. Термостабильность и термолабильность. В
основном белки термолабильные ( денатурируют)однако, есть очень малая группа термостабильных
белков ( напр. белок слюны муцин)
3. Растворимость и заряд белков. Способность белка
к растворению (гидратации) обусловлена наличием
на поверхности белка гидрофильных –заряженных
функциональных групп, способных удерживать
диполи воды.Зависит и от М.М.
Факторы устойчивости раствора белка- заряд и
гидратная облочка.
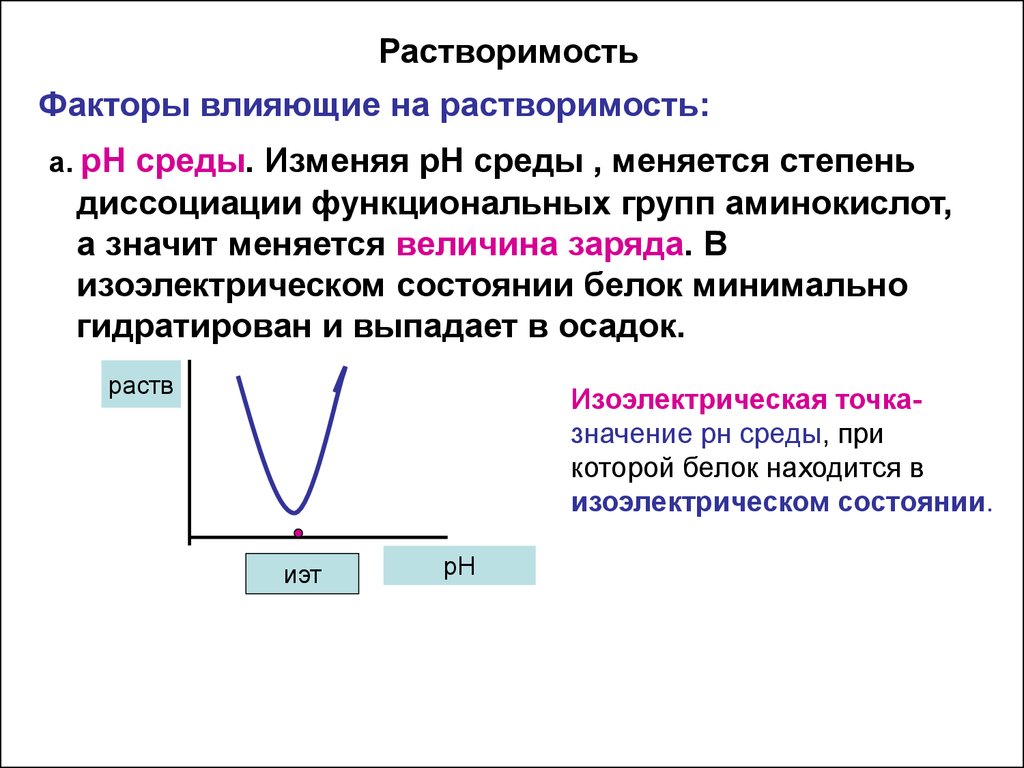
15. Растворимость
Факторы влияющие на растворимость:а. рН среды. Изменяя рН среды , меняется степень
диссоциации функциональных групп аминокислот,
а значит меняется величина заряда. В
изоэлектрическом состоянии белок минимально
гидратирован и выпадает в осадок.
раств
Изоэлектрическая точказначение рн среды, при
которой белок находится в
изоэлектрическом состоянии.
иэт
рН
16. Факторы, влияющие на растворимость
• б. ионная сила ( концентрация ионов в растворе):Степень
раствор.
Ионн. сила
Процесс осаждения белка под действием конц. солей щелочных
металлов – высаливание- обусловлено разрушением гидратной
оболочки.
Многие белки осаждаются в узкой области концентрациях солей, что
делает эту процедуру эффективным методом фракционирования.
17. Классификация.
Существуют классификации по молекулярной массе, по выполняемымфункциям, по локализации в клетке, по локализации в организме; по
схожим участкам первичной структуры и родственным функциям
(семейства белков, например, иммуноглобулины). Однако наиболее
приняты следующие принципы классификации:
Геометрическая форма белковой молекулы:
- глобулярные; Фибриллярные
- Глобулярные – белки, соотношение продольной и
поперечной осей глобулы не превышает 1:10; а чаще
1:3; 1:4. Большинство инд. белков глобулярные
Имеют компактную структуру и хорошо растворимы в
воде в зависимости от величины заряда; М.М. и
ионной силы растворителя.(см. выше).Функции
разнообразны. К ним относятся ферменты,
транспортные белки крови, иммуноглобулины,
факторы свертывания крови и др.
Фибриллярные – белки имеют вытянутую нитевидную
структуру, в которой соотношение осей более 1:10
Нерастворимы.
Коллаген, эластин, кератин структурные белки
18. Классификация (продолжение)
Принцип классификации:Наличие простетической ( небелковой группы):
простые белки – состоят только из альфа аминокислот;
сложные белки – в состав молекулы входит
небелковый компонент (простетическая
группа). Присоединение небелкового
компонента происходит или во время
трансляции (котрансляционная
модификация) или после завершения синтеза
белка на рибосомах (посттрансляционная
модификация).
Белковая часть – апобелок (апопротеин)
19. Простые белки
На основании условно выработанных критериев – м. м; ам.состав,растворимость, условиях осаждения – простые белки делят на
следующие группы:
Альбумины - локализованы в тканях и плазме крови, состоят из
одной полипептидной цепи (3 уровень организации);
небольшая м. м. (15-70 тыс Да), кислые, сильно гидратированные –
хорошо растворимы и осаждаются при насыщенных концентациях
водоотнимающих веществ.
Обуславливают осмотическое давление крови, универсальные
транспортные белки. Синтезируются преимущественно в печени
Глобулины – молекулярная масса в пределах 150 кДа, слабокислые
или нейтральные, специфические транспортные белки.
Осаждаются при полунасыщении водоотнимающих средств.
Среди них достаточно много сложных – (гликопротеионов).
Гистоны- тканевые белки, небольшая молекулярная масса 11-24 кДа,
щелочного характера (аргинин,лизин) Связаны с ДНК. Функцииструктурная – связаны с ДНК и участвуют в стабилизации
пространственной структуры ДНК, регуляторная –способны
блокировать передачу генетической информации от ДНК на РНК.
Протамины – низкомолекулярные м.м.-4-12 кДа,щелочные свойства
(аргинин). Функция структурная- связываются с ДНК, делая ее
молекулу компактной.
20. Простые белки ( продолжение)
• Проламины и глютелины – растительные белки.Особенность – не растворяются в воде. Содержатся в
клейковине пшеницы. В организме человека
расщепляются , но у некоторых людей возможно
недостаточность или отсутствие фермента,
расщеплящего глютелины. Возникает заболевание
целиакия – непереносимость растительных белов.
Прионы - особый класс белков, обладающих
инфекционными свойствами, Попадая в организм или
спонтанно образуясь в организме, изменяют
конформацию гомологичного ему нормального
клеточного белка, превращая его в себе подобный.
прионы- единственные инфекционные агенты,
размножение которых идет без участия нуклеиновых
кислот. Сопровождается разрушением головного мозга
–губчатые энцефалопатии - прионовые болезни.
Источник – мясо, костная мука животных.
21. Сложные белки (протеиды)
Сложные белки в зависимости от химической природынебелкового компонента делят на следующие классы
сложных белков: глико-, липо-, хромо-, нуклео-,
фосфопротеины.
Гликопротеины- простетическая группа -углеводы,
связанные чаще всего с белком гликозидной связью.
Белки плазмы крови - фибриноген,
иммуноглобулины, муцины-белки слюны, некоторые
ферменты и гормоны, коллаген, рецепторы клеток.
Хромопротеины- простетическая группа
разнонобразные окрашенные продукты, прежде
всего гем и флавин ( производное витамина В2).
Гемоглобин, миоглобин, цитохромы; ферменты
дегидрогеназы с коферментом ФАД.
22. Сложные белки (продолжение)
Нуклеопротеиды. Небелковый компонент – ДНК, РНК.Связь между положительно заряженными
аминокислотных остатков аргинина и лизина белка и
отрицательными фосфатными группами нуклеиновых
кислот. Знать формулы ДНК и РНК.
Липопротеины – небелковый компонент - липиды.
Наибольшее значение липопротеины – транспортные
формы липидов в крови. ЛПНП, ЛПВП, ЛПОНП, ХМ.
Фосфопротеиды – небелковый компонент фосфорная
кислота. Фосфорилирование ( связь чаще с
треонином и серином апобелка) белка
внутриклеточных белков процесс обратимый.
Процесс играет важную роль в регуляции
биологической активности белков





















 Биология
Биология Химия
Химия








