Похожие презентации:
профиль 11 класс металлы
1. МЕТАЛЛЫ Подготовка к ЕГЭ
2. Особенности металлов: - Все металлы восстановители - большой радиус - небольшое число валентных электронов - небольшое значение
Металлы- химические элементы,атомы которых легко отдают
валентные электроны, превращаясь в
катионы:М0 – ne
М+n
ОСОБЕННОСТИ МЕТАЛЛОВ:
- ВСЕ МЕТАЛЛЫ ВОССТАНОВИТЕЛИ
- БОЛЬШОЙ РАДИУС
- НЕБОЛЬШОЕ ЧИСЛО ВАЛЕНТНЫХ ЭЛЕКТРОНОВ
- НЕБОЛЬШОЕ ЗНАЧЕНИЕ ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ (0,7-1,9)
3. Закономерности изменения свойств металлов главных подгрупп
Усиление металлических свойствУсиление восстановительных свойств
Уменьшение электроотрицательности
Увеличение радиуса атома
Fr
У металлов побочных подгрупп определяющим
является заряд ядра, а не радиус.
С увеличением +Z притяжение к ядру электронов
увеличивается и восстановительная способность
уменьшается
4. Металлическая связь-связь, которая осуществляется в металлах или сплавах между атомами и катионами при помощи
свободнодвижущихся электроновМеталлическая
кристаллическая
решётка
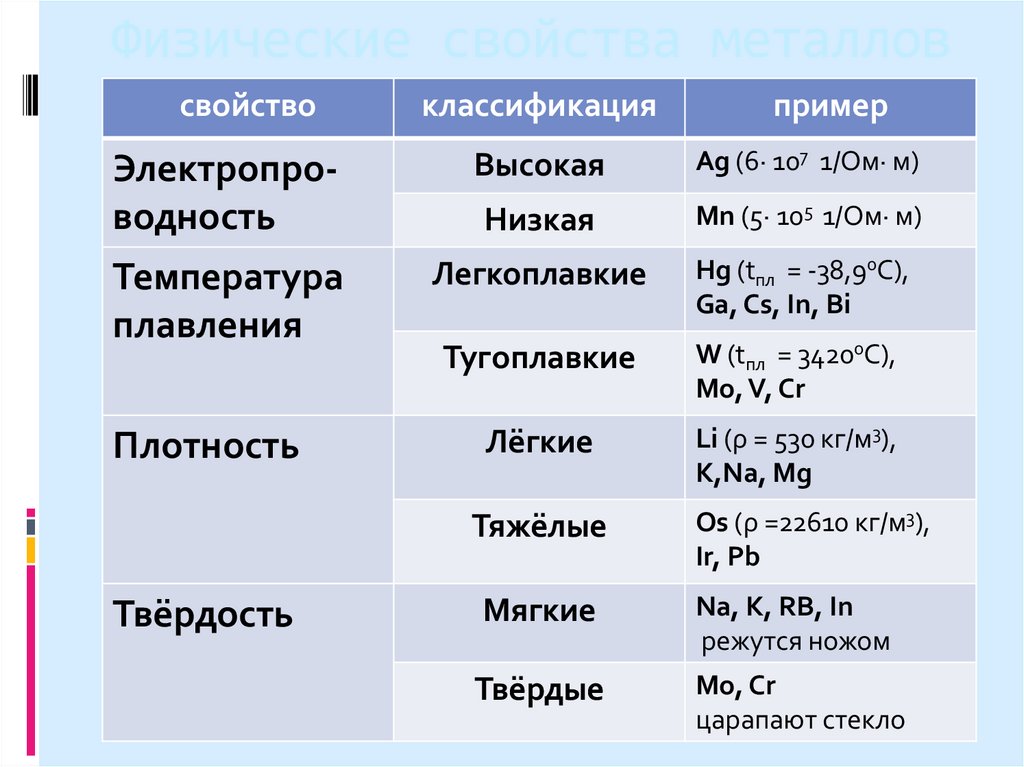
5. Физические свойства металлов:
Твёрдые (кроме ртути)Электропроводные
Теплопроводные
Ковкие и пластичные
Имеют металлический блеск
6. Физические свойства металлов
свойствоклассификация
Электропроводность
Высокая
Ag (6∙ 107 1/Oм∙ м)
Низкая
Mn (5∙ 105 1/Oм∙ м)
Температура
плавления
Легкоплавкие
Hg (tпл = -38,90C),
Ga, Cs, In, Bi
Тугоплавкие
W (tпл = 34200C),
Mo, V, Cr
Плотность
Лёгкие
Li (ρ = 530 кг/м3),
K,Na, Mg
Тяжёлые
Os (ρ =22610 кг/м3),
Ir, Pb
Мягкие
Na, K, RB, In
режутся ножом
Твёрдые
Mo, Cr
царапают стекло
Твёрдость
пример
7. Сплавы – материалы с характерными свойствами, состоящие из двух и более компонентов, из которых хотя бы один металл
СПЛАВЫЧЁРНЫЕ
1.Чугун (Fe + C)
2.Сталь (Fe + C)
ЦВЕТНЫЕ
1.бронза (Сu+ Sn)
2.латунь (Сu+ Zn)
3.мельхиор (Сu+ Ni)
4.дюраль
(Al + Cu+ Mn+ Ni)
8. Химические свойства
Электрохимический ряд металлов:Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Pb H Cu, Hg, Ag, Au
Ослабление восстановительных свойств, активности
9. 1.Взаимодействие с неметаллами
а) с кислородомM + O2 MO-2 – оксид
t
+2
+3
3Fe+ 2O2 Fe3O4 (FeO +Fe2O3)
смешанный оксид (железная окалина)
Au + O2
Исключение: Na и К образуют пероксид (М2О2-1)
Na + O2 Na2О2-1 -пероксид
Na2О2 + 2Na 2Na2О -оксид
б) с другими неметаллами (галогены, S, N2, P…)
степень окисления неметалла
2Al + 3S Al2 S3 определяется: №группы - 8
+3
-2
10. 1.Взаимодействие с неметаллами
а) с кислородомM + O2 MO-2 – оксид
t
+2
+3
3Fe+ 2O2 Fe3O4 (FeO +Fe2O3)
смешанный оксид (железная окалина)
Au + O2
Исключение: Na и К образуют пероксид (М2О2-1)
Na + O2 Na2О2-1 -пероксид
Na2О2 + 2Na 2Na2О -оксид
б) с другими неметаллами (галогены, S, N2, P…)
степень окисления неметалла
2Al + 3S Al2 S3 определяется: №группы - 8
+3
-2
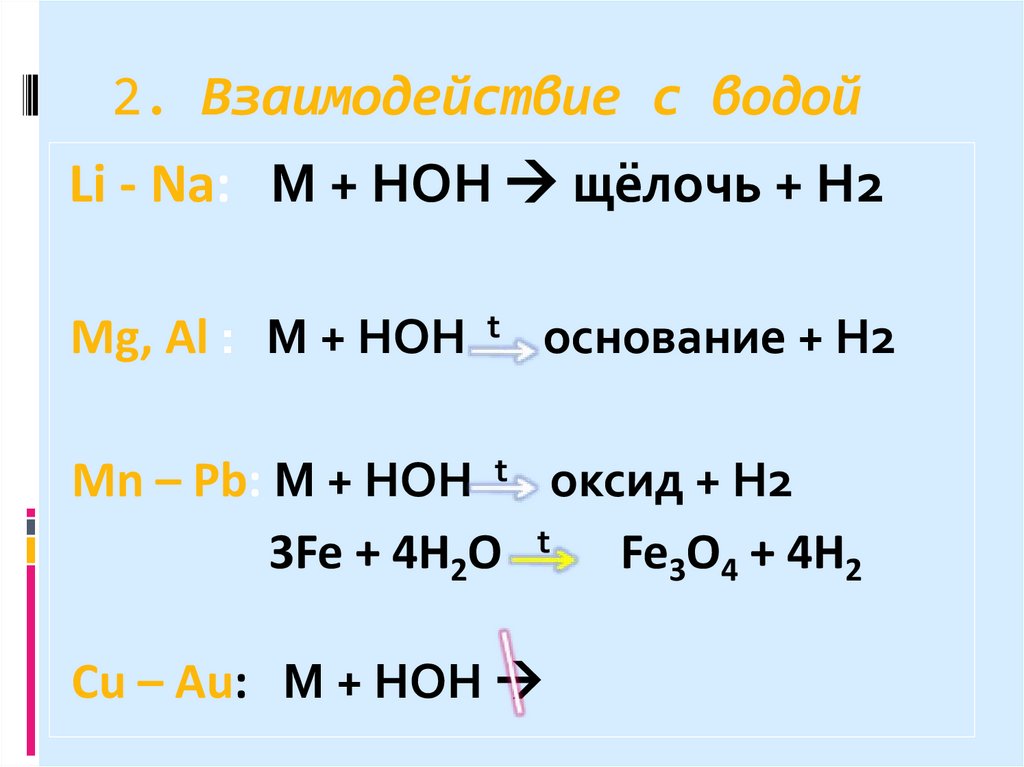
11. 2. Взаимодействие с водой
Li - Na: М + HOH щёлочь + H2Mg, Al : М + HOH t основание + H2
Mn – Pb: М + HOH t оксид + H2
3Fe + 4H2O t Fe3O4 + 4H2
Cu – Au: М + HOH
12. 3. Взаимодействие с растворами кислот
Только металлы, стоящие в э/х ряду до НMg, Al, Mn, Zn, Cr, Fe, Pb:
М + кислота → растворимая соль + Н2↑
С H2SO4 (к) и HNO3 :
все металлы, кроме Au, Pt, но Н2
НЕ выделяется !
Al, Fe пассивируются H2SO4 (к) и HNO3 при
обычных условиях
13. 4. Взаимодействие с солями
Ме взаимодействуют с солями, еслисвободный Ме активнее, чем Ме в
составе соли.
CuSO4 + Fe FeSO4 + Cu
FeSO4 + Cu
5. Взаимодействие с оксидами Ме
идёт реакция замещения:
2Al + 3CrO Al2O3 + 3Cr
14. 6.Взаимодействие переходных металлов: Ве, Al, Zn с растворами щелочей
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4]+ 3H2↑тетрагидроксоалюминат Na
Zn+ 2NaOH + 2H2O → Na2[Zn(OH)4]+ H2↑
тетрагидроксоцинкат Na
15. 7.Взаимодействие с органическими веществами
С галогеналканами (реакция Вюрца):2CH3Cl + 2Na→ C2H6 + 2NaCl
Со спиртами и фенолами:
2C2H5OH + 2Na→ 2C2H5ONa + H2↑
С алкинами-1:
CH ≡ CH + Ag2O → AgC ≡ CAg + H2↑
ацетиленид Ag
2CH ≡ CH + 2Na→ 2CH ≡ CNa + H2↑
моноацетиленид Na
16. СОЕДИНЕНИЯ МЕТАЛЛОВ
17.
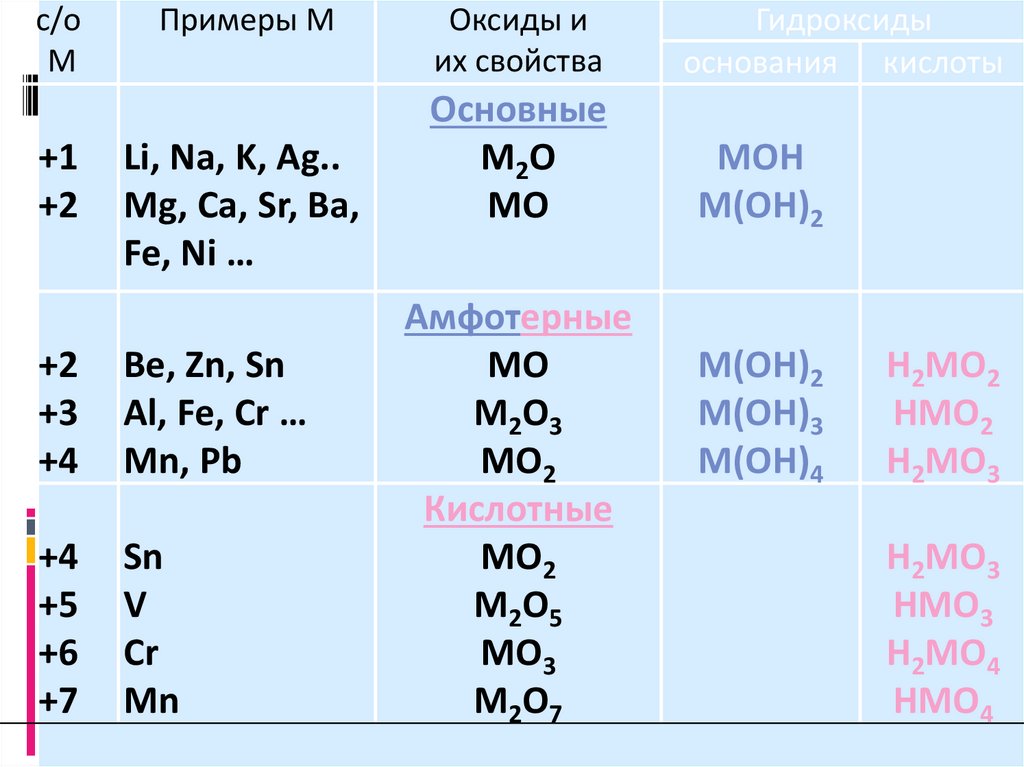
с/оМ
+1
+2
Примеры М
Li, Na, K, Ag..
Mg, Ca, Sr, Ba,
Fe, Ni …
+2
+3
+4
Be, Zn, Sn
Al, Fe, Cr …
Mn, Pb
+4
+5
+6
+7
Sn
V
Cr
Mn
Оксиды и
их свойства
Гидроксиды
основания кислоты
Основные
М2О
МО
МОН
М(ОН)2
Амфотерные
МО
М2О3
МО2
Кислотные
МО2
М2О5
МО3
М2О7
М(ОН)2
М(ОН)3
М(ОН)4
Н2МО2
НМО2
Н2МО3
Н2МО3
НМО3
Н2МО4
НМО4
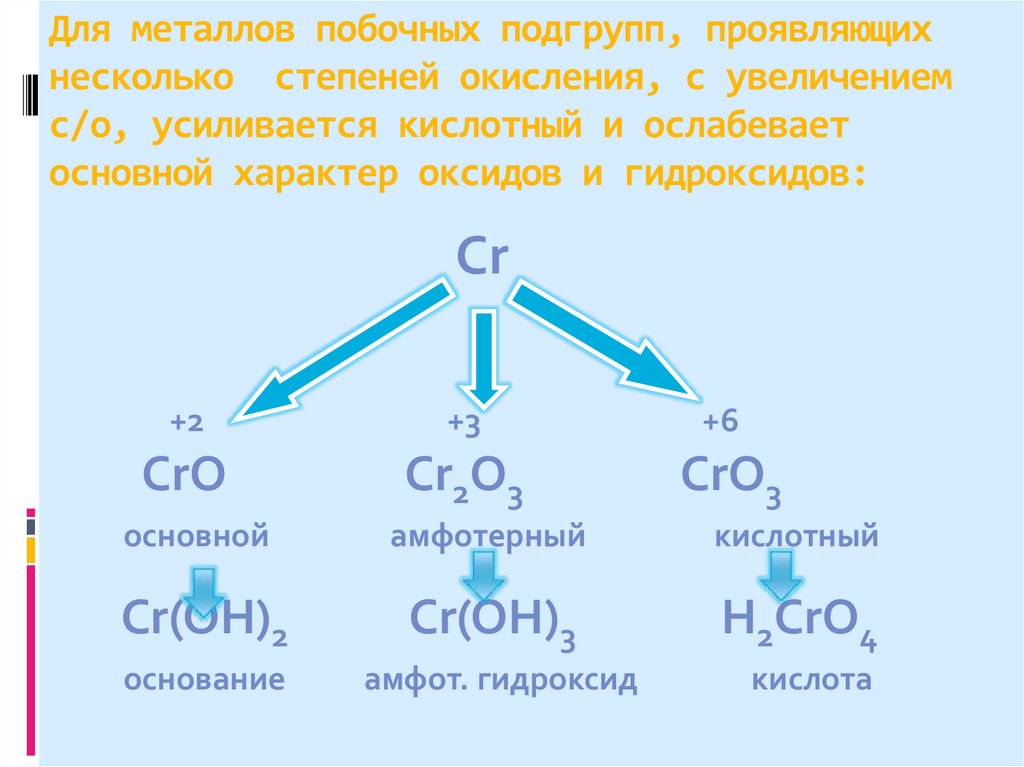
18. Для металлов побочных подгрупп, проявляющих несколько степеней окисления, с увеличением с/о, усиливается кислотный и ослабевает
основной характер оксидов и гидроксидов:Cr
+2
+3
+6
CrO
Cr2O3
CrO3
основной
амфотерный
кислотный
Cr(ОН)2
Cr(ОН)3
Н2CrО4
основание
амфот. гидроксид
кислота














 Химия
Химия








