Похожие презентации:
Лекция_2_Часть_2_Комплексные_соединения_Поток_2
1.
Комплексные соединения.Лигандообменные равновесия в
растворах комплексных соединений
2. Равновесия в водных растворах:
• кислотно-основныекислота
Н+ + основание
• окислительно-восстановительные
восстановитель
окислитель + nē
• лигандообменные –
в растворах комплексных соединений
• гетерогенные в растворах малорастворимых соединений
3. Комплексные структуры, в которых
Комплексные (координационные) соединения — устойчивыеструктуры, в которых можно выделить центральный атом/ион
(комплексообразователь), непосредственно связанный с ионами и/или
молекулами (лигандами).
По природе связь между комплексообразователем и лигандами —
ковалентная полярная, образованная по донорно-акцепторному
механизму.
А.Вернер
–
швейцарский
химикнеорганик предложил координационную
теорию, которая описывает структуру
комплексных соединений (1893 г.)
4. Термины координационной химии
• Комплексообразователь — центральный атом или ион, акцепторэлектронных пар.
• Лиганд – молекула или ион, донор одной или нескольких электронных пар,
связан с комплексообразователем.
• Внутренняя сфера — комплексообразователь вместе с лигандами.
• Внешняя сфера — ионы, заряд которых компенсирует заряд внутренней
сферы (в нейтральных комплексах отсутствует).
• Координационное число — количество связей комплексообразователя со
всеми лигандами (характеристика комплексообразователя).
• Дентатность — количество связей лиганда с комплексообразователем
(характеристика лиганда).
• Хелаты — устойчивые комплексы с полидентатными лигандами.
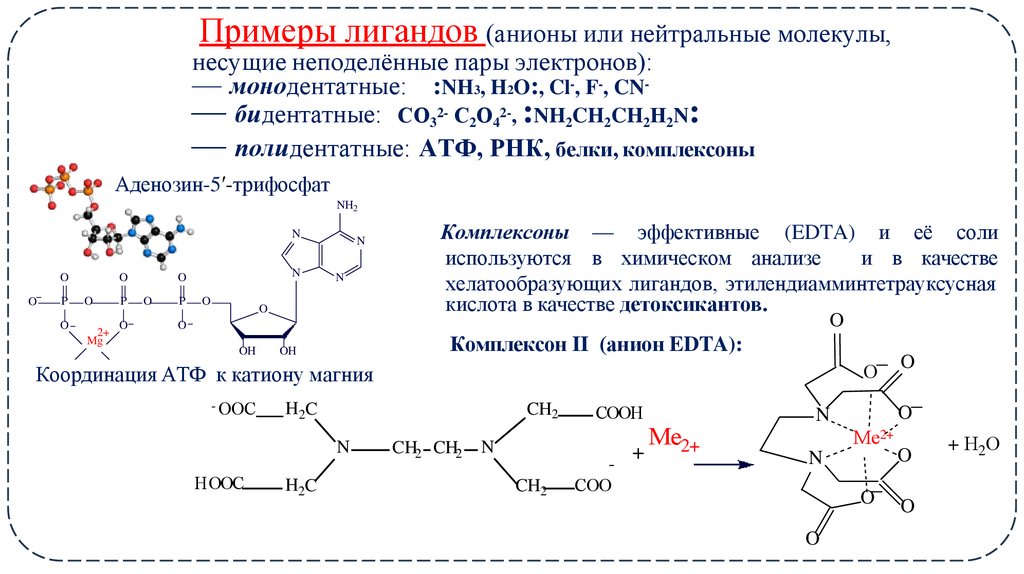
5. Примеры лигандов (анионы или нейтральные молекулы, несущие неподелённые пары электронов):
— монодентатные: :NH3, H2O:, Cl-, F-, CN— бидентатные: СО32- С2О42-, :NH2CH2CH2Н2N:— полидентатные: АТФ, РНК, белки, комплексоны
Аденозин-5ʹ-трифосфат
NH2
N
O
O
P
O
O
O
2+
Mg
P
O
N
O
O
P
O
N
N
O
Комплексоны — эффективные (EDTA) и её соли
используются в химическом анализе
и в качестве
хелатообразующих лигандов, этилендиамминтетрауксусная
кислота в качестве детоксикантов.
O
O
OH
Комплексон II (анион EDTA):
OH
О
Координация АТФ к катиону магния
- ООС
H2C
CH2
N
НООС
H2C
CH2 CH2
N
СООН
+
CH2
Ме2+
O
N
Ме2+
N
СОО
O
O
O
O
O
+ Н2О
6.
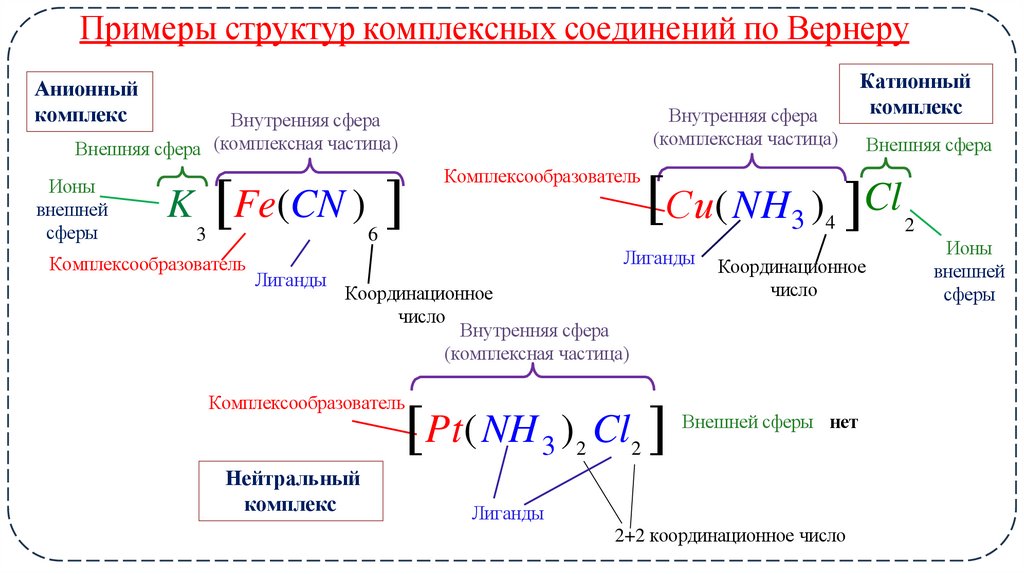
Примеры структур комплексных соединений по ВернеруАнионный
комплекс
Внутренняя сфера
(комплексная частица)
Внутренняя сфера
Внешняя сфера (комплексная частица)
Ионы
внешней
сферы
K Fe(CN )
3
Комплексообразователь
Лиганды
Лиганды
Координационное
число
Внутренняя сфера
(комплексная частица)
Координационное
число
Внешней сферы нет
Pt(
NH
)
Cl
3 2
2
Комплексообразователь
Нейтральный
комплекс
Внешняя сфера
Сu( NH3 ) Cl
4
6
Комплексообразователь
Катионный
комплекс
Лиганды
2+2 координационное число
2
Ионы
внешней
сферы
7. Номенклатура комплексных соединений
1. Названия нейтральных комплексов состоят из одного слова с русским корнем в именительномпадеже, анионных и катионных — из двух слов. По последним рекомендациям IUPAC на первое
место ставится катион, на второе — анион.
2. Нейтральные комплексы называют с русским корнем в именительном падеже, комплексный анион
называется с латинским корнем в именительной падеже с суффиксом — «ат», комплексный катион
— с русским корнем в родительном падеже.
3. Название комплексной частицы начинается с перечисления лигандов в алфавитном порядке с
указанием их количества — ди-, три-, тетра-, пента-, гекса- .
4. К названиям анионных лигандов добавляют окончание –о (для бескислородных анионов «ид»
заменяют на «о»), некоторые анионы имеют специальные названия:
Специальные названия некоторых анионов:
Н– — гидридо, NО2– — нитро, O22– — пероксо, S2– — тио, НS– — меркапто
5. К названиям катионных лигандов добавляют «ий» .
6. Нейтральные лиганды называются так же, как соответствующие молекулы (+см. исключения).
Исключения: Н2О — аква, NH3 — аммин, CO — карбонил, NO — нитрозил, CS — тиокарбонил
6. Переменную степень окисления металла указывают в скобках римскими цифрами (в
нейтральных комплексах не обязательно).
8. Состав комплексного соединения
K3[Fe(CN)6] – комплексное соединение – гексацианоферрат(III) калия• Fe3+ – комплексообразователь, координационное число 6;
• 6CN– – шесть монодентаных лигандов;
• [Fe(CN)6]3– – анион – внутренняя сфера;
• 3K+ – противоионы внешней сферы.
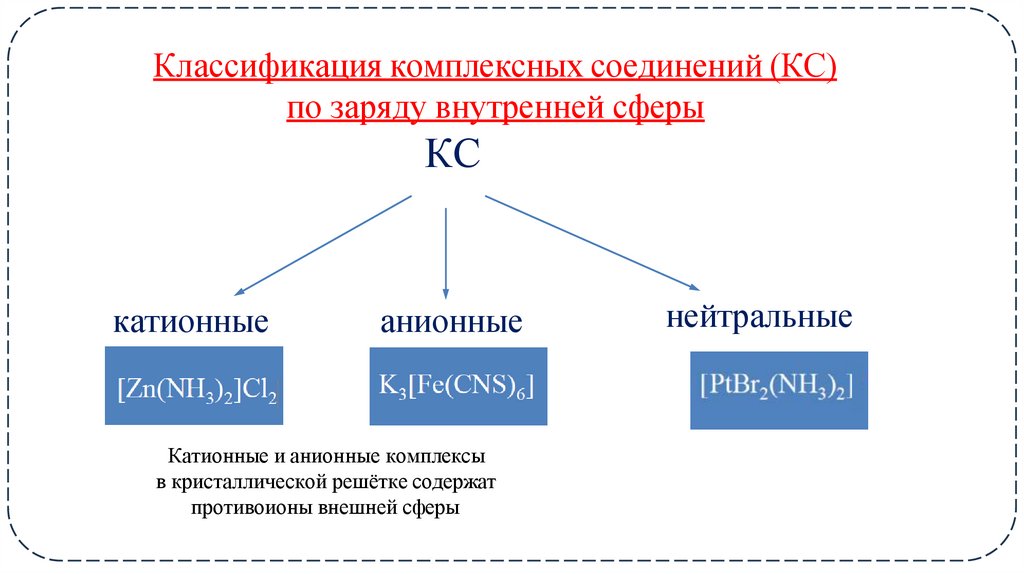
9. Классификация комплексных соединений (КС) по заряду внутренней сферы КС
катионныеанионные
Катионные и анионные комплексы
в кристаллической решётке содержат
противоионы внешней сферы
нейтральные
10.
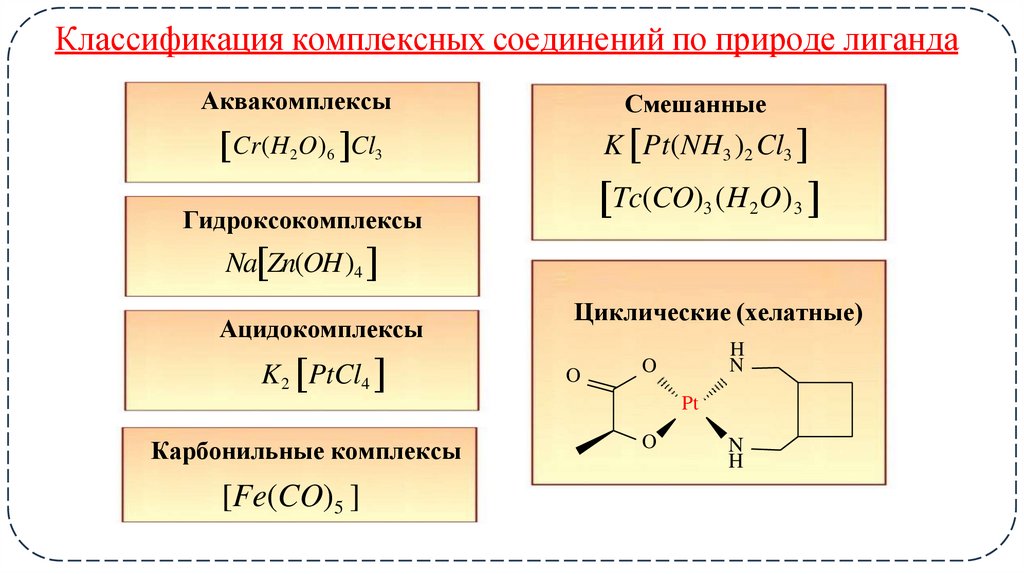
Классификация комплексных соединений по природе лигандаАквакомплексы
Смешанные
K Pt(NH3 )2 Cl3
Cr(H2O)6 Cl3
Tc(CO)3 (H2O)3
Гидроксокомплексы
Na Zn(OH)4
Ацидокомплексы
K 2 PtCl4
Циклические (хелатные)
O
H
N
O
Pt
Карбонильные комплексы
[Fe(CO)5 ]
O
N
H
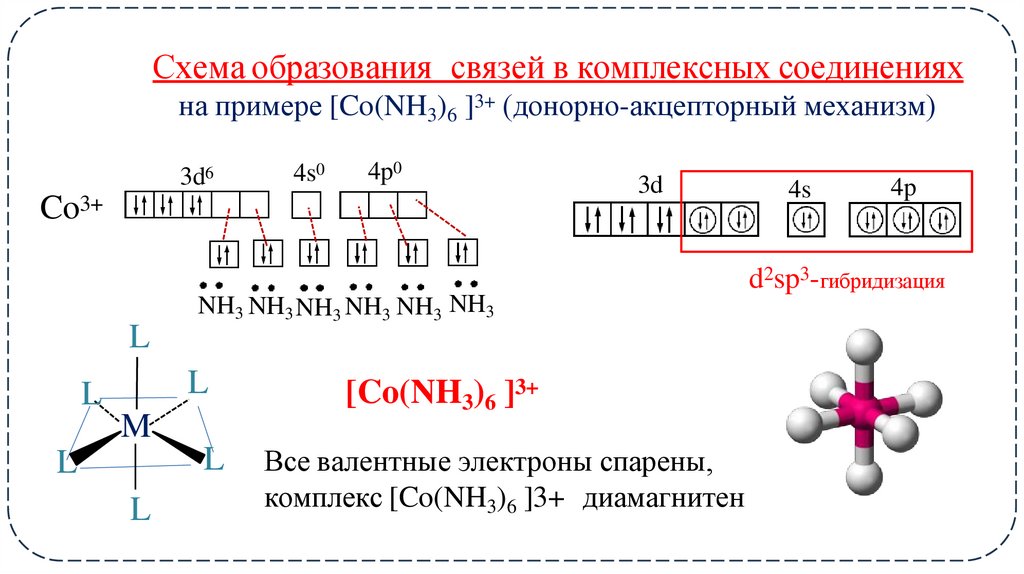
11. Схема образования связей в комплексных соединениях
на примере [Co(NH3)6 ]3+ (донорно-акцепторный механизм)3d6
4s0
4p0
Co3+
3d
4s
4p
d2sp3-гибридизация
L
NH3 NH3 NH3 NH3 NH3 NH3
L
L
M
L
L
L
[Co(NH3)6 ]3+
Все валентные электроны спарены,
комплекс [Co(NH3)6 ]3+ диамагнитен
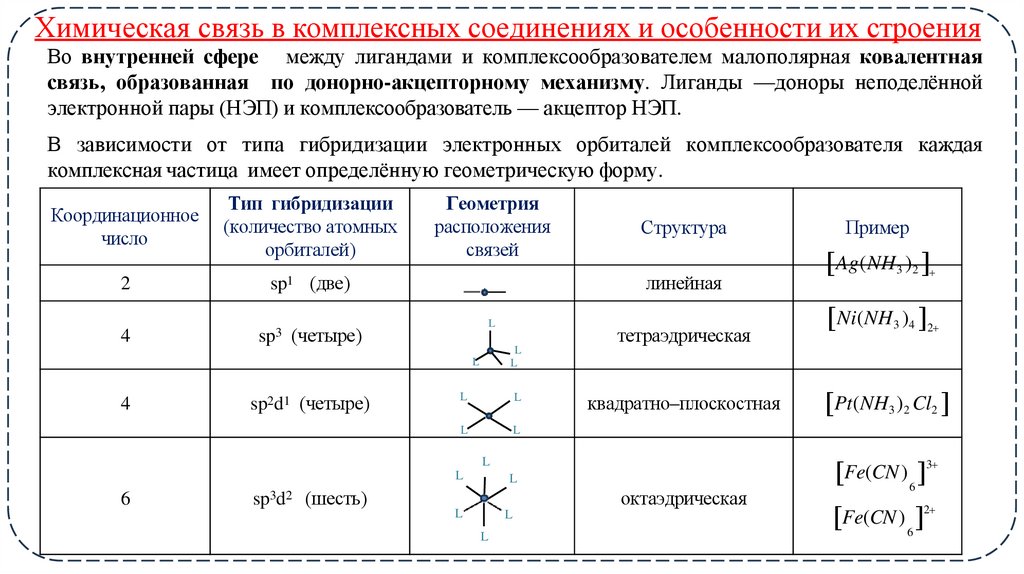
12. Химическая связь в комплексных соединениях и особенности их строения
Во внутренней сфере между лигандами и комплексообразователем малополярная ковалентнаясвязь, образованная по донорно-акцепторному механизму. Лиганды —доноры неподелённой
электронной пары (НЭП) и комплексообразователь — акцептор НЭП.
В зависимости от типа гибридизации электронных орбиталей комплексообразователя каждая
комплексная частица имеет определённую геометрическую форму.
Координационное
число
Тип гибридизации
(количество атомных
орбиталей)
2
sp1
4
sp3
Геометрия
расположения
связей
(две)
линейная
L
(четыре)
L
L
L
4
sp2d1 (четыре)
Структура
L
L
L
L
тетраэдрическая
квадратно–плоскостная
L
6
L
L
L
L
sp3d2 (шесть)
октаэдрическая
L
Пример
Ag(NH3 )2
Ni(NH3 )4 2
Pt(NH3 )2 Cl2
Fe(CN ) 6 3
Fe(CN ) 6 2
13.
Прочность связей комплексообразователей с лигандами в соответствии стеорией мягких и жёстких кислот и оснований Пирсона (кислота — акцептор
неподелённой пары электронов (НЭП), основание — донов НЭП)
Увеличение мягкости комплексобразователя
Na , K , Mg 2 , Ca2 , Mn2 , Fe2 , Co2 , Ni2 , Cu2 , Zn2 , Cd 2 , Pb2 , Hg 2
s металлы
"металлы жизни"
d металлы
токсиканты
F ,OH , H O,Cl , Br , I , RCOO , NR , RSH ,CN
2
3
Увеличение мягкости лиганда
Жёсткие кислоты координируются, как правило, с жёсткими
основаниями, а мягкие кислоты — с мягкими основаниями.
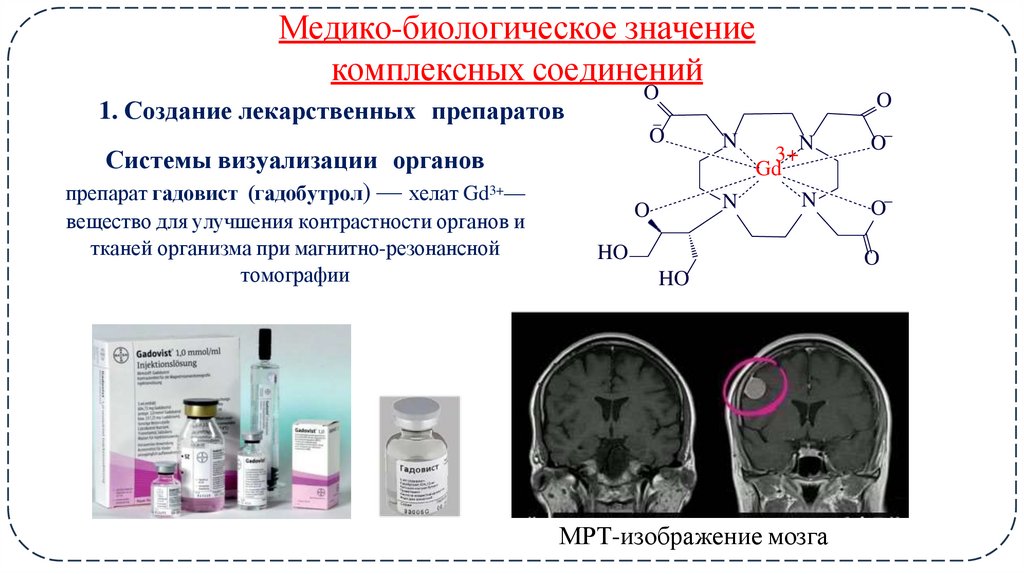
14. Медико-биологическое значение
комплексных соединенийO
1. Создание лекарственных препаратов
Системы визуализации органов
препарат гадовист (гадобутрол) — хелат Gd3+—
вещество для улучшения контрастности органов и
тканей организма при магнитно-резонансной
томографии
O
O
N
O
N
3+
Gd
N
O
N
O
HO
O
HO
МРТ-изображение мозга
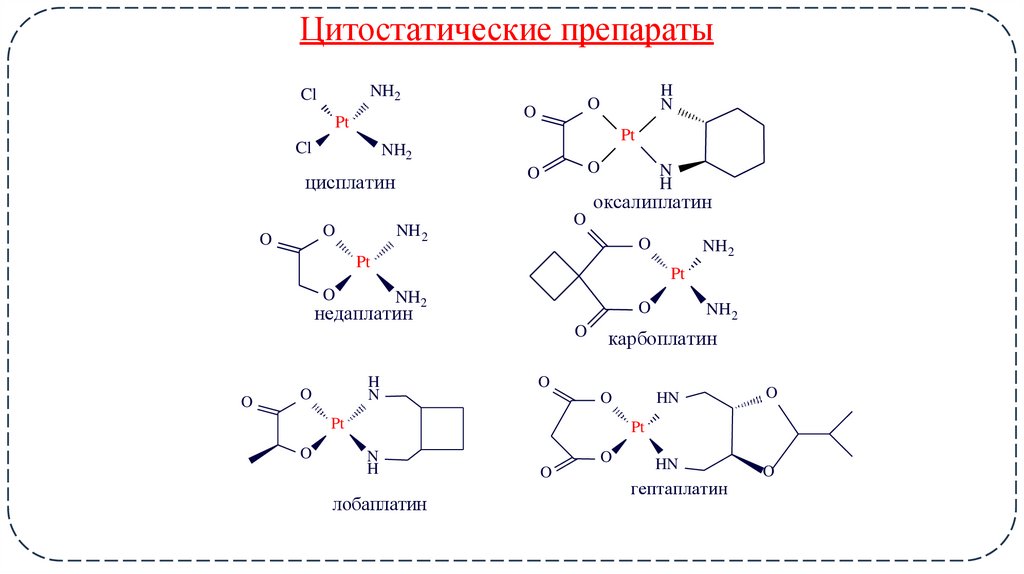
15. Цитостатические препараты
NH2Cl
O
Pt
Cl
O
O
Pt
NH2
O
O
цисплатин
H
N
O
N
H
оксалиплатин
O
NH 2
O
Pt
O
Pt
NH2
O
недаплатин
O
O
H
N
O
NH 2
карбоплатин
O
O
Pt
O
NH 2
HN
O
HN
O
Pt
N
H
лобаплатин
O
O
гептаплатин
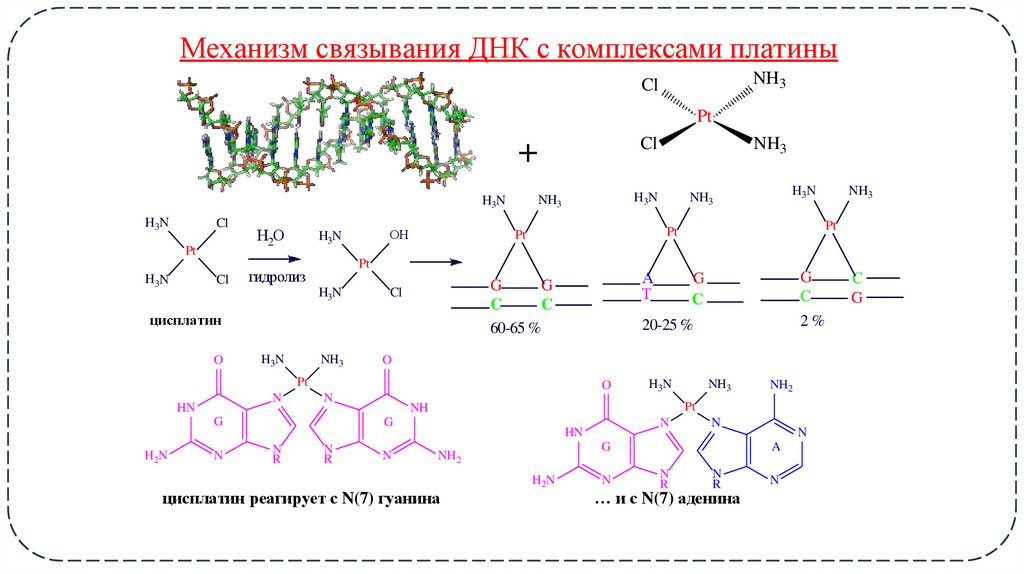
16. Механизм связывания ДНК с комплексами платины
NH3Cl
Pt
Cl
+
H3N
Cl
Pt
H3N
Cl
Н2О
ОН
H3N
цисплатин
H3N
NH3
А
Т
G
G
C
C
60-65 %
Cl
HN
O
G
H2N
N
N
R
H3N
2%
N
NH3
NH2
Pt
NH
G
N
R
G
C
G
C
O
N
N
HN
цисплатин реагирует с N(7) гуанина
N
G
NH2
H2N
N
N
A
N
R
NH3
Pt
20-25 %
Pt
N
H3N
NH3
Pt
Pt
Pt
гидролиз
H3N
O
H3N
NH3
H3N
NH3
N
R
… и с N(7) аденина
N
C
G
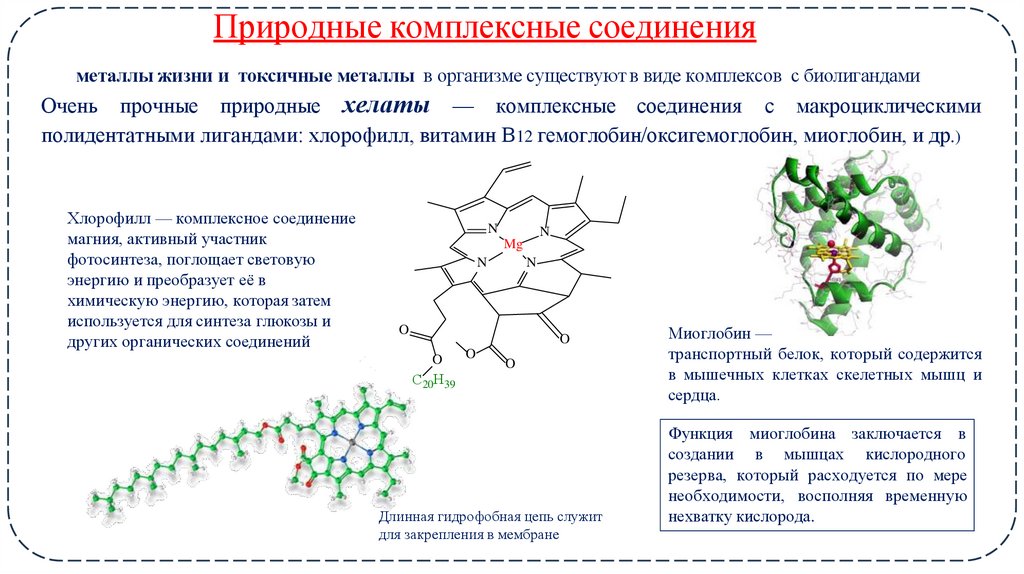
17. Природные комплексные соединения
металлы жизни и токсичные металлы в организме существуют в виде комплексов с биолигандамиОчень прочные природные хелаты — комплексные соединения с макроциклическими
полидентатными лигандами: хлорофилл, витамин В12 гемоглобин/оксигемоглобин, миоглобин, и др.)
Хлорофилл — комплексное соединение
магния, активный участник
фотосинтеза, поглощает световую
энергию и преобразует её в
химическую энергию, которая затем
используется для синтеза глюкозы и
других органических соединений
N
N
Mg
N
N
O
O
O
С20Н39
O
O
Длинная гидрофобная цепь служит
для закрепления в мембране
Миоглобин —
транспортный белок, который содержится
в мышечных клетках скелетных мышц и
сердца.
Функция миоглобина заключается в
создании в мышцах кислородного
резерва, который расходуется по мере
необходимости, восполняя временную
нехватку кислорода.
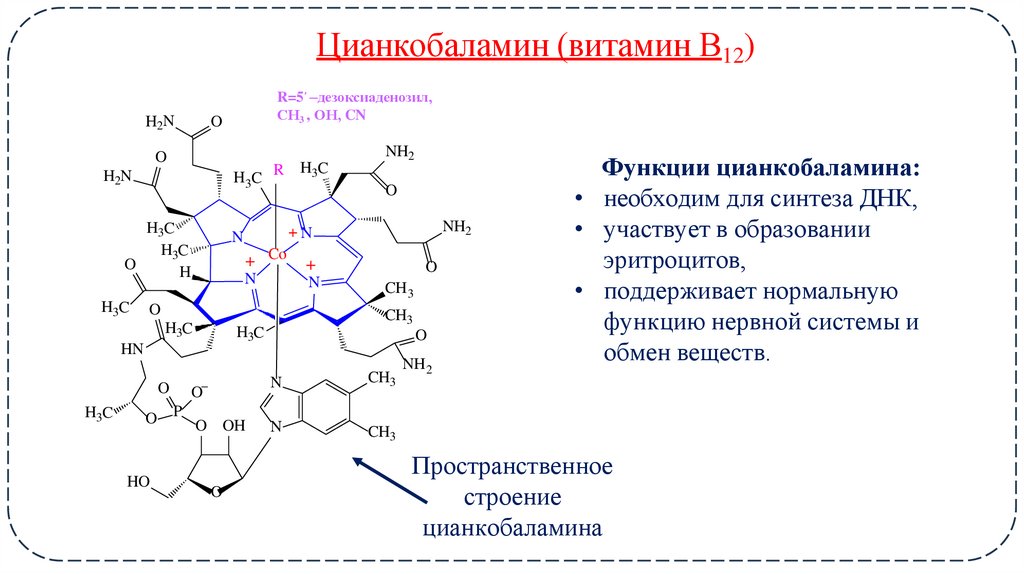
18. Цианкобаламин (витамин В12)
H2NR=5ʹ –дезоксиаденозил,
СН3 , ОН, CN
O
O
H2N
H3C
H3C
H3C
O
H
H3C
N
O
HO
P
O OH
O
O
CH 3
CH3
H3C
O
+
N
O
O
NH2
+N
+ Co
HN
H3C
O
N
H3C
H3C
R
NH2
O
N
CH3
N
CH3
NH 2
Функции цианкобаламина:
• необходим для синтеза ДНК,
• участвует в образовании
эритроцитов,
• поддерживает нормальную
функцию нервной системы и
обмен веществ.
Пространственное
строение
цианкобаламина
19. Строение гемоглобина
Молекула гемоглобина (HHb) состоит из 4 цепей белка глобина ичетырёх гемов (небелковой части).
Первичная структура глобина: две альфа-цепи (по 141 α–АК)
и две бета-цепи (по 146 α–АК).
Вторичная структура глобина — α-спираль и β-слои.
Третичная структура глобина — глобулярный белок.
Четвертичная структура глобина — четыре полипептидные цепи, уложенные
относительно друг друга:
α–цепь
β–цепь
гем
гем
β–цепь
α–цепь
К каждой из четырёх глобиновых субъединиц прикреплён гем с Fe2+
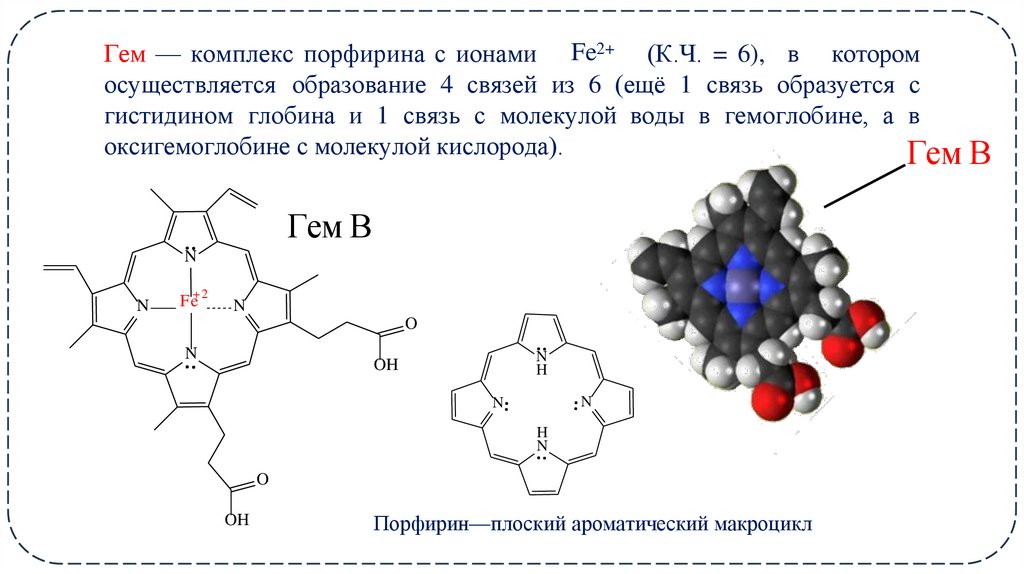
20. Fe2+
Гем — комплекс порфирина с ионами Fe2+ (К.Ч. = 6), в которомосуществляется образование 4 связей из 6 (ещё 1 связь образуется с
гистидином глобина и 1 связь с молекулой воды в гемоглобине, а в
оксигемоглобине с молекулой кислорода).
Гем В
Гем В
N
N
Fe+2
N
O
N
N
H
OH
N
N
H
N
O
OH
Порфирин—плоский ароматический макроцикл
21.
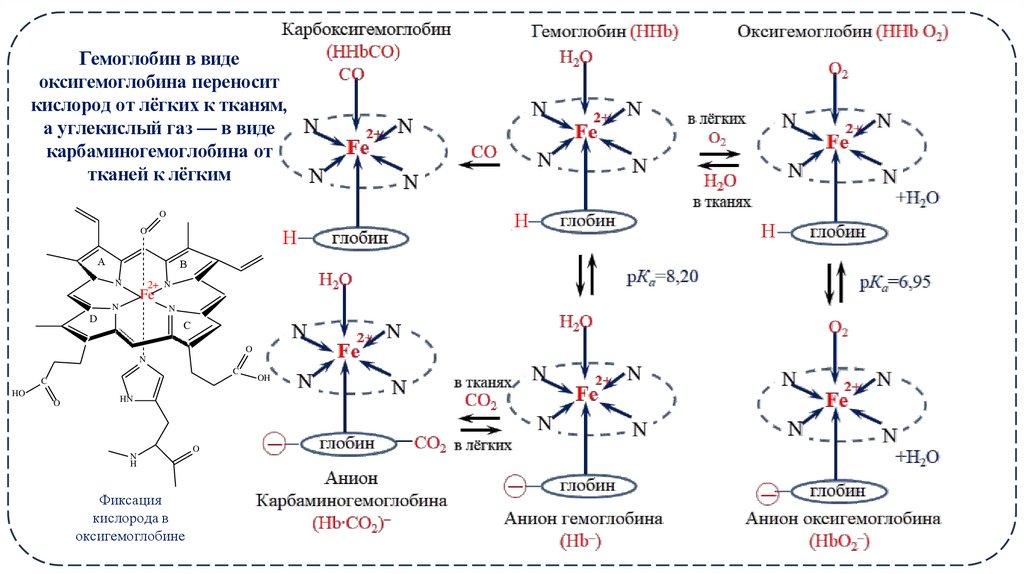
Гемоглобин в видеоксигемоглобина переносит
кислород от лёгких к тканям,
а углекислый газ — в виде
карбаминогемоглобина от
тканей к лёгким
O
Н
O
А
В
N
2+ N
Fe
N
N
D
C
O
N
C
C
HO
O
HN
N
H
Фиксация
кислорода в
оксигемоглобине
O
OH
Н
Н
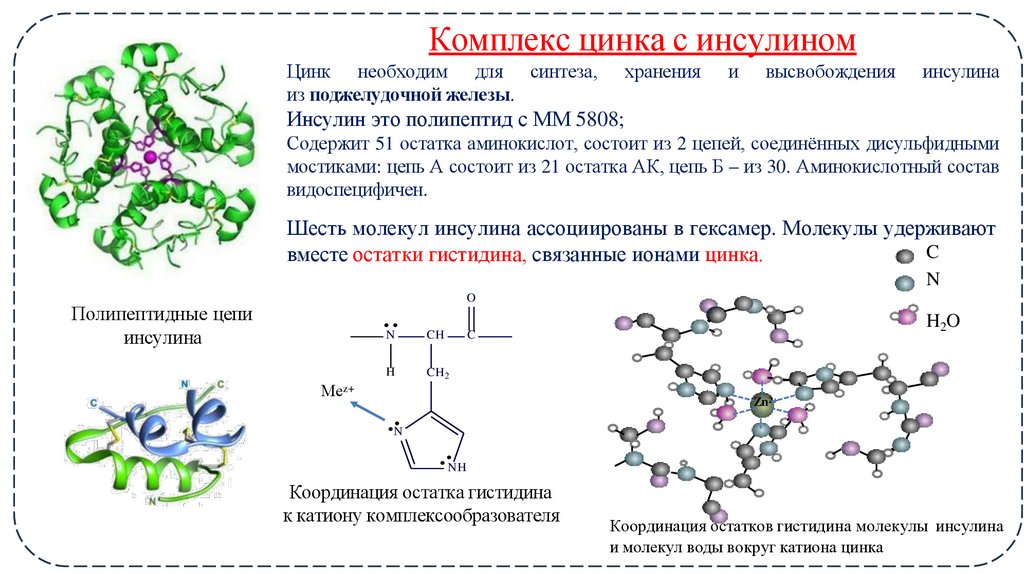
22. Комплекс цинка с инсулином
Цинк необходим для синтеза,из поджелудочной железы.
хранения
и
высвобождения
инсулина
Инсулин это полипептид с ММ 5808;
Содержит 51 остатка аминокислот, состоит из 2 цепей, соединённых дисульфидными
мостиками: цепь А состоит из 21 остатка АК, цепь Б – из 30. Аминокислотный состав
видоспецифичен.
Шесть молекул инсулина ассоциированы в гексамер. Молекулы удерживают
C
вместе остатки гистидина, связанные ионами цинка.
N
O
Полипептидные цепи
инсулина
N
CH
H
CH 2
H2O
C
Меz+
Zn2+
N
NH
Координация остатка гистидина
к катиону комплексообразователя
Координация остатков гистидина молекулы инсулина
и молекул воды вокруг катиона цинка
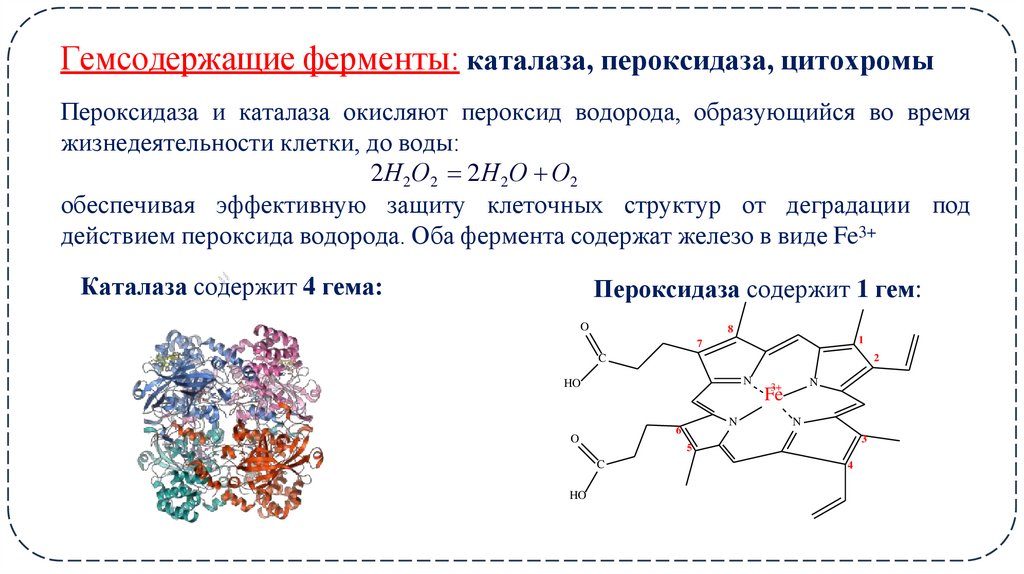
23. Гемсодержащие ферменты: каталаза, пероксидаза, цитохромы
Пероксидаза и каталаза окисляют пероксид водорода, образующийся во времяжизнедеятельности клетки, до воды:
2Н2О2 2Н 2 О О2
обеспечивая эффективную защиту клеточных структур от деградации под
действием пероксида водорода. Оба фермента содержат железо в виде Fe3+
Каталаза содержит 4 гема:
Пероксидаза содержит 1 гем:
O
8
1
7
C
2
N
HO
N
6
O
N
3
5
C
HO
N
3+
Fe
4
24. Комплексные соединения в водных растворах
I.Первичная диссоциация (по типу сильного электролита)
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl–
II. Вторичная диссоциация (по типу слабого электролита, ступенчато)
+
+
[NH 3]
[Ag(NH
)]
3
1. [Ag(NH3)2]
[AgNH3] + NH3
K
[Ag(NH3 )2 ]
[Ag ] [NH 3 ]
K2
[Ag(NH3 )]
1
2. [AgNH3]+
Ag+ + NH3
(В выражении Кн внутренние квадратные скобки можно не писать,
но наружные скобки, обозначающие концентрацию, ОБЯЗАТЕЛЬНЫ!)
суммарно:
Ag(NH3)2+
Ag+ + 2NH 3
общая константа нестойкости:
Kнобщ K1 K2
K
общ
н
[Ag ] [NH 3 ]2
[Ag(NH
)
]
3 2
Чем меньше Кн, тем прочнее комплекс и наоборот.
25. Задание Выберите верные утверждения, характеризующие процесс диссоциации комплексного соединения [Pt(NH3)2Cl2]:
1) Диссоциация происходит по типу сильного электролита2) В результате первичной диссоциации образуется Cl–
3) В результате диссоциации выделяется Cl2
4) Один из продуктов диссоциации NH3
5) На последней ступени диссоциации образуется Pt2+
26.
Задание.Расположите комплексы меди с аспарагином, аланином
и глицином в порядке увеличения их устойчивости
(ответ запишите в виде последовательности чисел).
Константы нестойкости соответственно равны:
1) 1,2 ·10-15
2) 4,0·10-18
3) 1,4·10-8
27. Задание.
Константы нестойкости комплексов токсичного свинца с биосубстратомв организме и с комплексоном соответственно равны 10–4 и 10–10.
Выберите верные утверждения.
1) Комплекс с биосубстратом более прочный.
2) Комплексон можно использовать для вывода свинца из организма.
3) В результате лигандообмена свинец будет переходить в комплекс с
биосубстратом.
4) Лигандообменное равновесие смещено в сторону комплекса с комплексоном.
28. Лигандообменные равновесия
• Образование комплексов:2+
2+
[Cu(H2O)4] + 4NH3 = [Cu(NH3)4] + 4H2O
• Разрушение комплексов:
2+ + 4Н+ = Cu2+ + NH
4+
[Cu(NH3)4]
Равновесие смещается в сторону более устойчивых комплексных
частиц.









![Задание Выберите верные утверждения, характеризующие процесс диссоциации комплексного соединения [Pt(NH3)2Cl2]: Задание Выберите верные утверждения, характеризующие процесс диссоциации комплексного соединения [Pt(NH3)2Cl2]:](https://cf5.ppt-online.org/files5/slide/b/bqSHZohdi7ecDwMgVEXy91v8Tn6GfaWUNls3jJ/slide-24.jpg)



 Химия
Химия








