Похожие презентации:
Комплексные соединения
1.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ2.
Комплексные соединения● Комплексные соединения
○ Образование ковалентнойсвязи
○ Координационная связь
○ Строение комплексныхсоединений
○ Гибридизация центрального атома и геометрия комплексов
○ Геометрическая изомерия комплексных соединений
3.
Комплексные соединения— это такие соединения, в узлах кристаллической решетки которых
находятся сложные ионы или нейтральные комплексы, способные
существовать как в растворах, так и в расплавах.
Реакции, в результате которых образуются комплексные
соединения, носят название реакций комплексообразования.
Первая теория Строения
комплексных соединений
была Разработана в 1893 г.
Альфредом Вернером.
4.
Классификация химических соединенийИонные
Ковалентные
Координационные
Совокупность ионов
Совокупность молекул или атомов
С внешней сферой
Кристаллы
Жидкости, газы
Без внешней сферы
Кристаллическая
решетка ионная
(прочная)
Внутримолекулярные
силы — прочны
(формульная
единица NaCl)
Межмолекулярные
силы — слабы
Высокие т. пл.,
растворимы в Н2О,
подвержены
электролизу
в растворе или
расплаве
Низкие т. пл. и т. кип. для
соединений с неполярной связью;
более высокие т. пл. и т. кип. для
соединений с полярной связью;
растворимость также определяется
полярностью связи в соединении
5.
Образование ковалентной связиа)
А
+
В
б)
D
+
A
донор
А
акцептор
В (обменный механизм)
D
A (донорно-акцепторный механизм)
пустая (вакантная) орбиталь
Донорно-акцепторная (координационная) связь –
ковалентная связь, образующаяся за счет электронной пары
одного из партнеров.
D
A
Схемы образования координационной связи
(с участием n-доноров и -доноров)
n-Доноры образуют координационную связь с участием
n-электронов (неподеленных пар электронов, не принимающих участия в образовании ковалентных связей).
NH3
CH3NH2
H O H
HO -
ROH
Cl -
6.
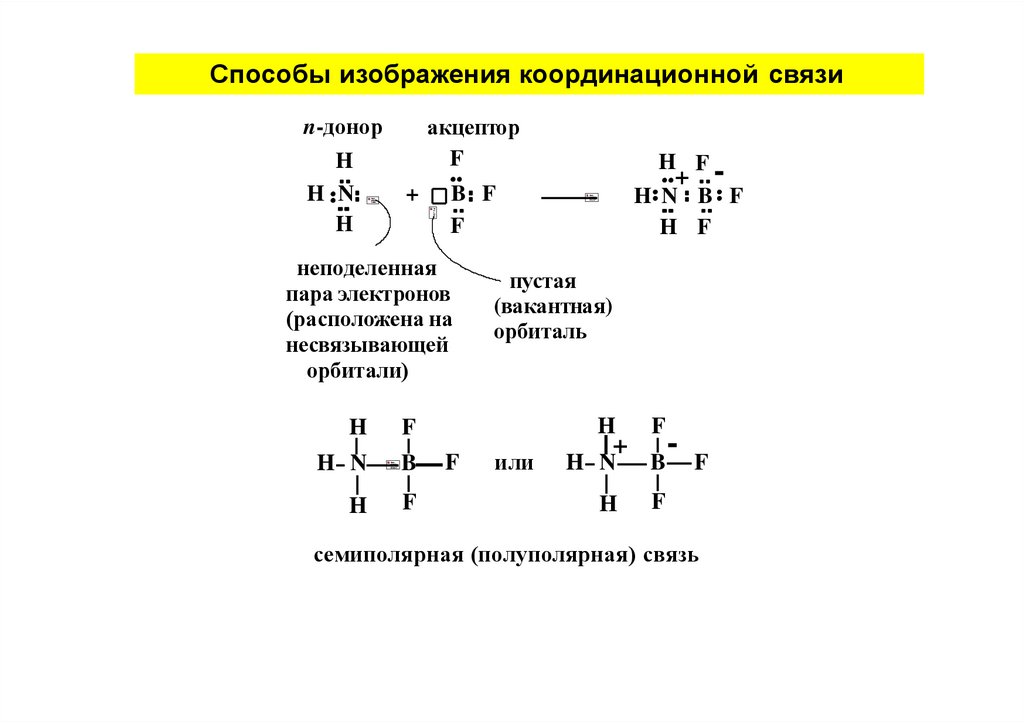
Способы изображения координационной связиакцептор
F
n-донор
H
H N
H
+
B F
F
неподеленная
пара электронов
(расположена на
несвязывающей
орбитали)
H
F
H N
B
H
F
H F
+ H N B F
H F
F
пустая
(вакантная)
орбиталь
или
H
F
H N
B
H
F
+
-
F
семиполярная (полуполярная) связь
7.
-Доноры образуют координационную связь за счетр-электронов -связи или ароматического кольца.
СН2 СН2
бензол
этилен
Примеры комплексов с этиленом
СН2 СН2
K[C2H4PtCl3]
Br+
-комплекс
Cl
K+
Pt
Cl
Cl
-
8.
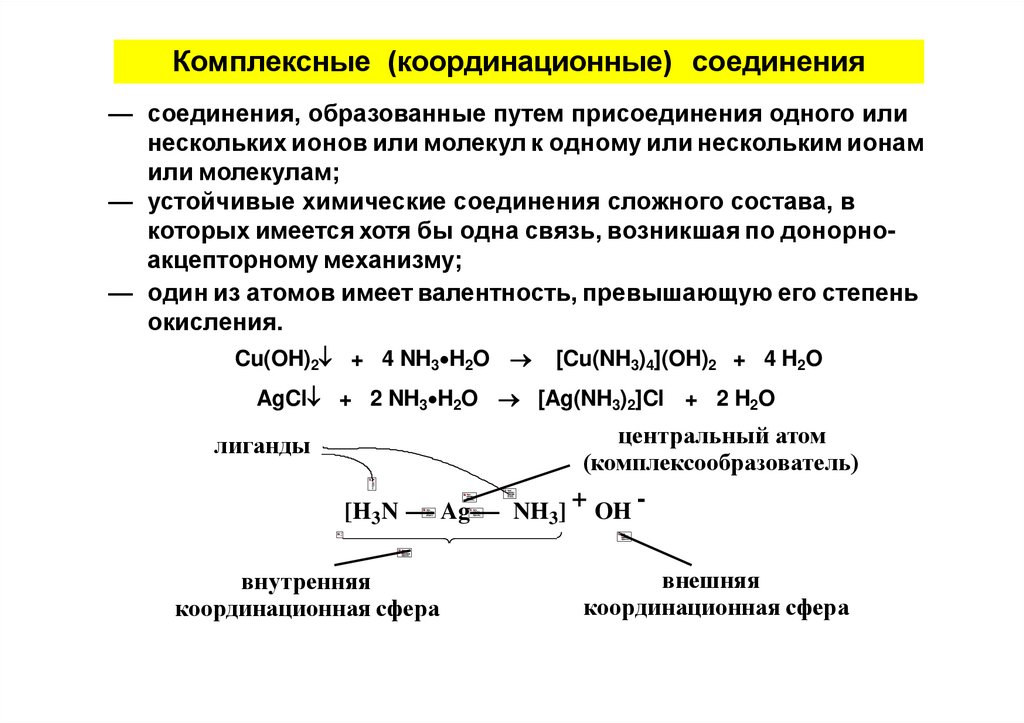
Комплексные (координационные) соединения— соединения, образованные путем присоединения одного или
нескольких ионов или молекул к одному или нескольким ионам
или молекулам;
— устойчивые химические соединения сложного состава, в
которых имеется хотя бы одна связь, возникшая по донорноакцепторному механизму;
— один из атомов имеет валентность, превышающую его степень
окисления.
Cu(OH)2 + 4 NH3 H2O
[Cu(NH3)4](OH)2 + 4 H2O
AgCl + 2 NH3 H2O [Ag(NH3)2]Cl + 2 H2O
центральный атом
(комплексообразователь)
лиганды
[H3N
внутренняя
координационная сфера
Ag
NH3]
+ OH внешняя
координационная сфера
9.
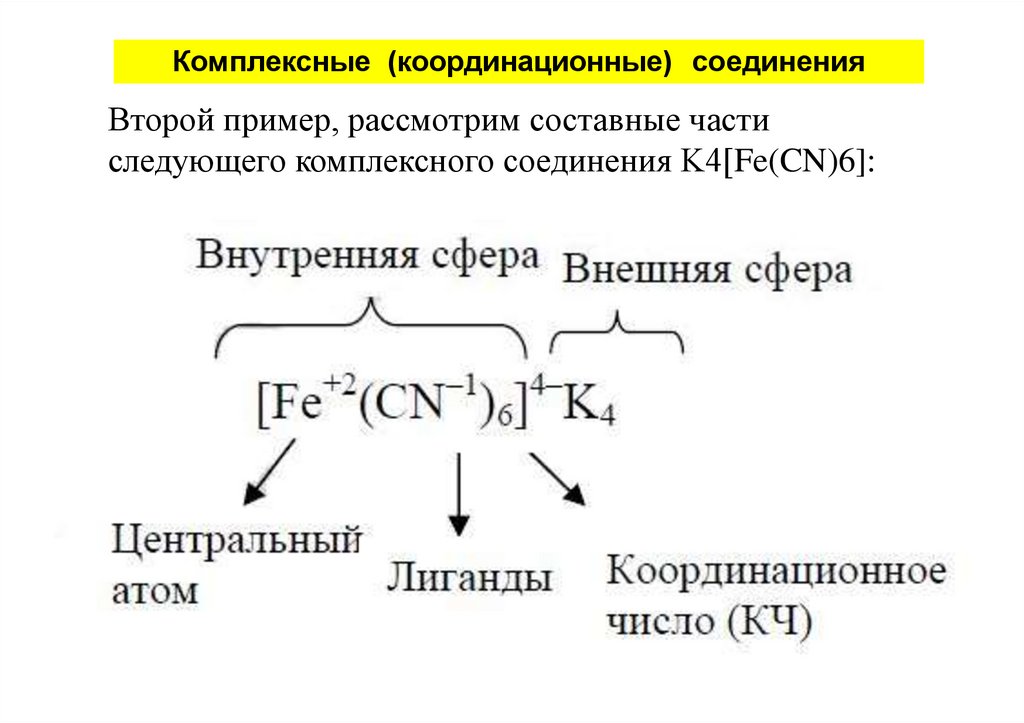
Комплексные (координационные) соединенияВторой пример, рассмотрим составные части
следующего комплексного соединения K4[Fe(CN)6]:
10.
Строение комплексных соединенийКомплексные соединения
с внешней сферой
K4+[Fe(CN)6]4–
[Cu(NH3)4]2+(OH–)2
гексацианоферрат(II)
калия
гидроксид
тетраамминмеди(II)
без внешней сферы
[PtCl2(NH3)2]
диамминдихлорплатина(II)
Комплексное соединение всегда включает:
центральный атом (комплексообразователь);
лиганды (комплексообразующие агенты).
11.
Центральный атом (комплексообразователь)— атом или ион, который является акцептором электронных
пар, предоставляя свободные атомные орбитали для
образования связи.
• Координационное число.
• Степень окисления.
o Координационное число — число атомов,непосредственно
присоединенных к центральному атому (2, 4, 5, 6 и т. д.).
12.
Центральный атом (комплексообразователь)— Степень окисления
—
заряд, которым обладал
бы атом элемента в химическом соединении, если
электроны в каждой его связи сместить к более
электроотрицательному атому.
FeCl2 — хлорид железа(II) — (Fe+2, Cl–1)
FeCl3 — хлорид железа(III) — (Fe+3, Cl–1)
NH4+ — аммоний-ион — (N–3, H+1)
K3[Fe(CN)6] — гексацианоферрат(III) калия — (K+, Fe+3, CN–)
K4[Fe(CN)6] — гексацианоферрат(II) калия — (K+, Fe+2, CN–)
Пример:
13.
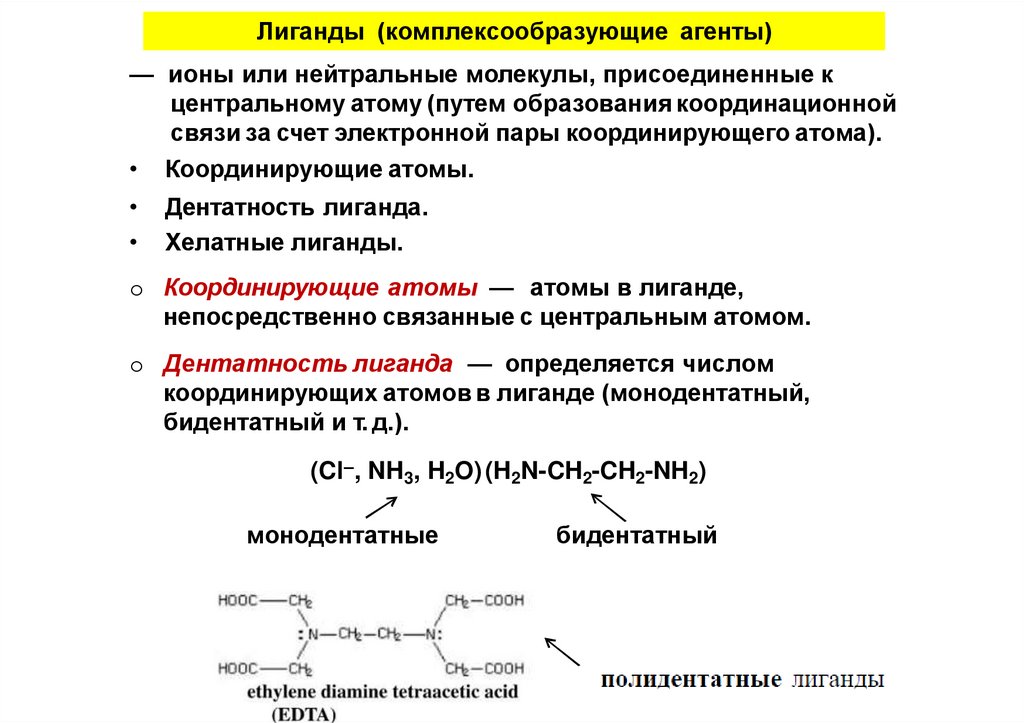
Лиганды (комплексообразующие агенты)— ионы или нейтральные молекулы, присоединенные к
центральному атому (путем образования координационной
связи за счет электронной пары координирующего атома).
• Координирующие атомы.
Дентатность лиганда.
Хелатные лиганды.
o Координирующие атомы — атомы в лиганде,
непосредственно связанные с центральным атомом.
o Дентатность лиганда — определяется числом
координирующих атомов в лиганде (монодентатный,
бидентатный и т. д.).
(Cl–, NH3, H2O) (H2N-CH2-CH2-NH2)
монодентатные
бидентатный
14.
15.
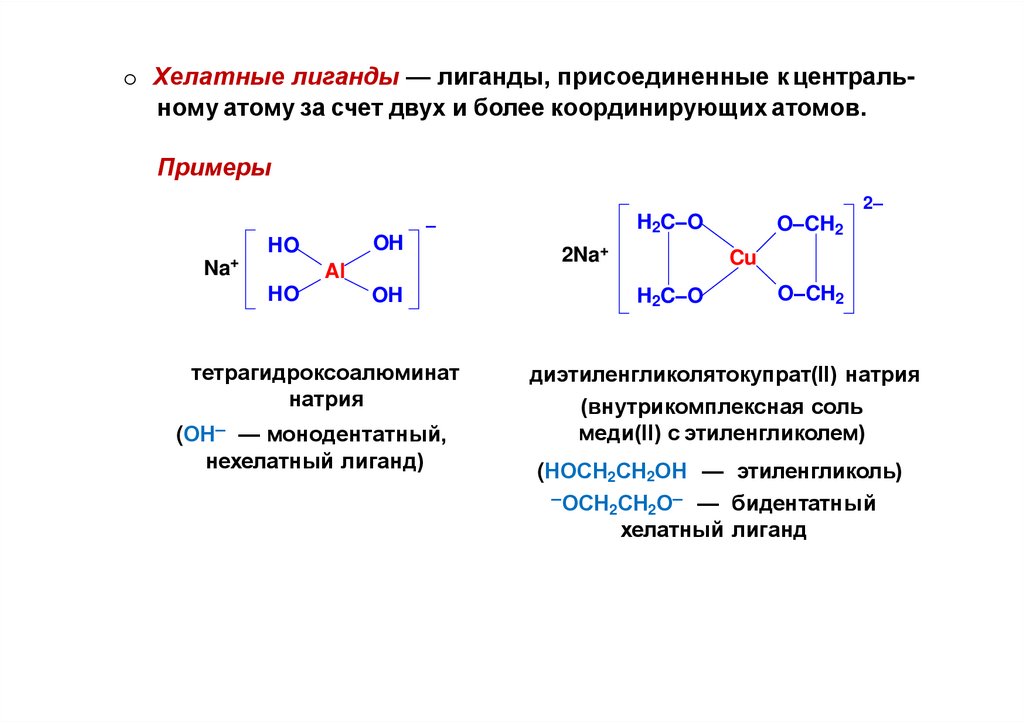
o Хелатные лиганды — лиганды, присоединенные к центральному атому за счет двух и более координирующих атомов.Примеры
2–
+
OH
HO
Na
Al
HO
H2C–O
–
OH
тетрагидроксоалюминат
натрия
(ОН– — монодентатный,
нехелатный лиганд)
2Na+
O–CH2
Cu
H2C–O
O–CH2
диэтиленгликолятокупрат(II) натрия
(внутрикомплексная соль
меди(II) с этиленгликолем)
(НОСН2СН2ОН — этиленгликоль)
–ОСН СН О– — бидентатный
2
2
хелатный лиганд
16.
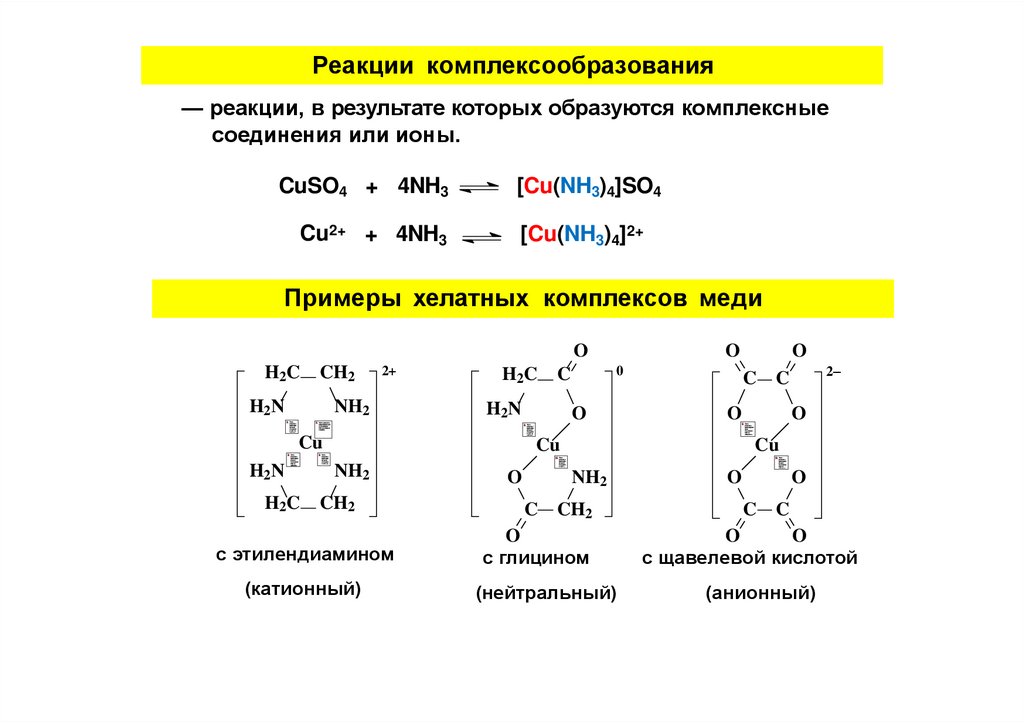
Реакции комплексообразования— реакции, в результате которых образуются комплексные
соединения или ионы.
CuSO4 + 4NH3
Cu2+ + 4NH3
[Cu(NH3)4]SO4
[Cu(NH3)4]2+
Примеры хелатных комплексов меди
O
H2C
CH2
H2N
2+
NH2
H2C
Cu
H2N
H2C
0
C
H2N
O
O
C
CH2
с этилендиамином
(катионный)
O
O
Cu
NH2
C
2–
C
O
Cu
NH2
O
CH2
O
с глицином
(нейтральный)
O
O
C
C
O
O
с щавелевой кислотой
(анионный)
17.
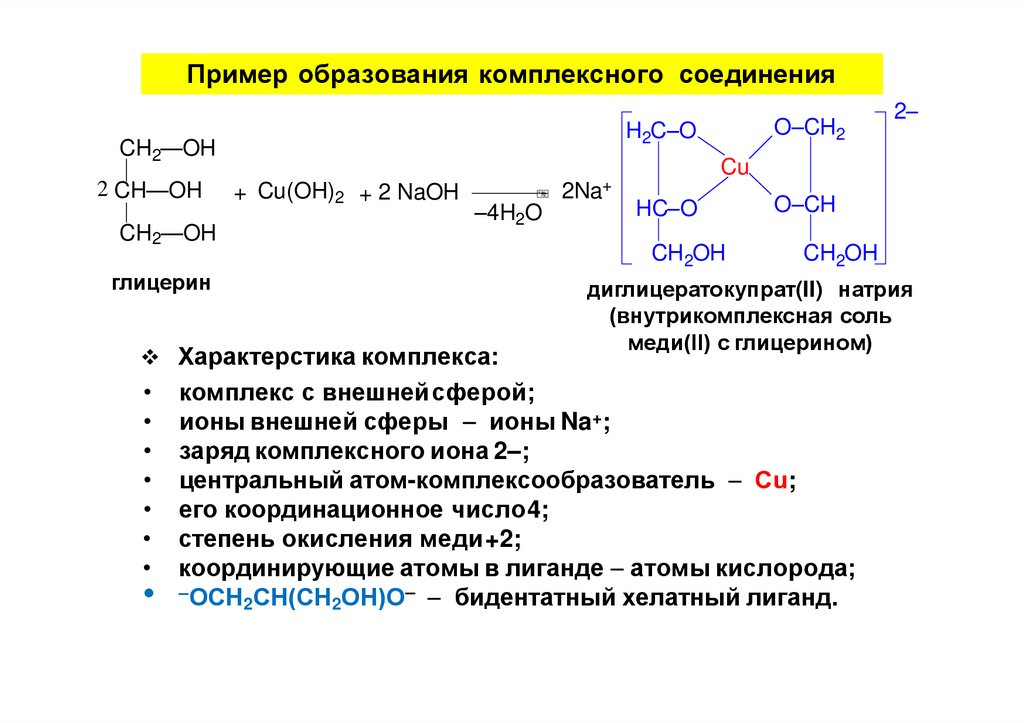
Пример образования комплексного соединенияH2C–O
CH2—OH
2 CH—OH
CH2—OH
+ Cu(OH)2 + 2 NaOH
–4H2O
глицерин
Характерстика комплекса:
O–CH2
2Na+
2–
Cu
HC–O
CH2OH
O–CH
CH2OH
диглицератокупрат(II) натрия
(внутрикомплексная соль
меди(II) с глицерином)
комплекс с внешнейсферой;
ионы внешней сферы ионы Na+;
заряд комплексного иона 2–;
центральный атом-комплексообразователь Сu;
его координационное число4;
степень окисления меди+2;
координирующие атомы в лиганде атомы кислорода;
–ОСН СН(СН ОН)О– бидентатный хелатный лиганд.
2
2
18.
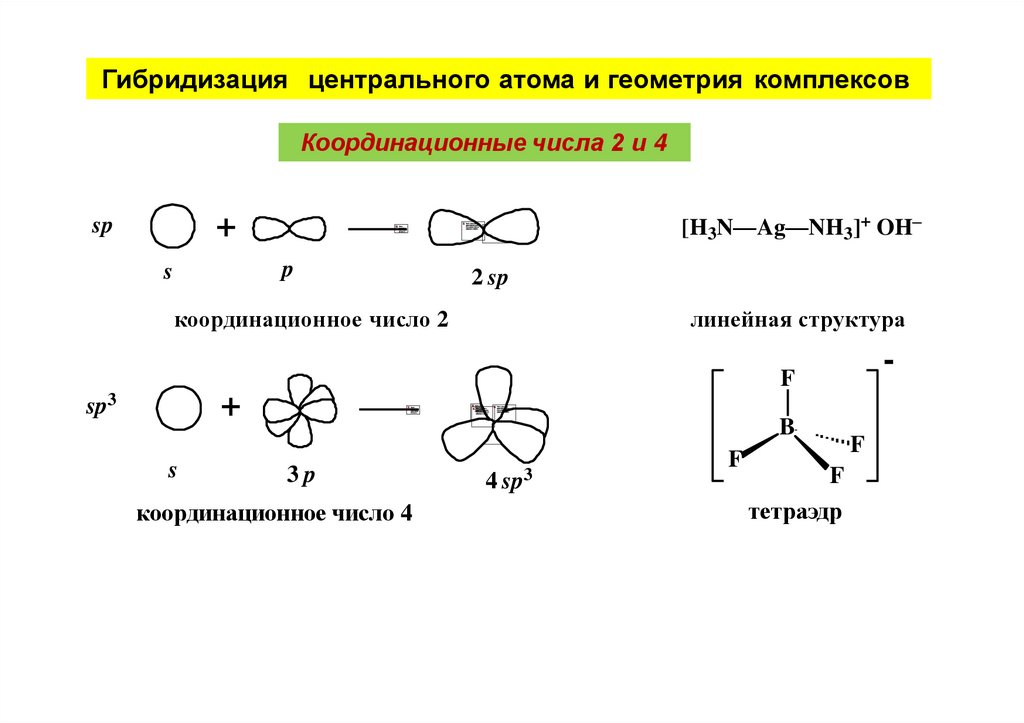
Гибридизация центрального атома и геометрия комплексовКоординационные числа 2 и 4
[H3N—Ag—NH3]+ OH–
+
sp
p
s
2 sp
координационное число 2
линейная структура
-
F
+
sp3
s
B
3p
координационное число 4
4 sp3
F
F
F
тетраэдр
19.
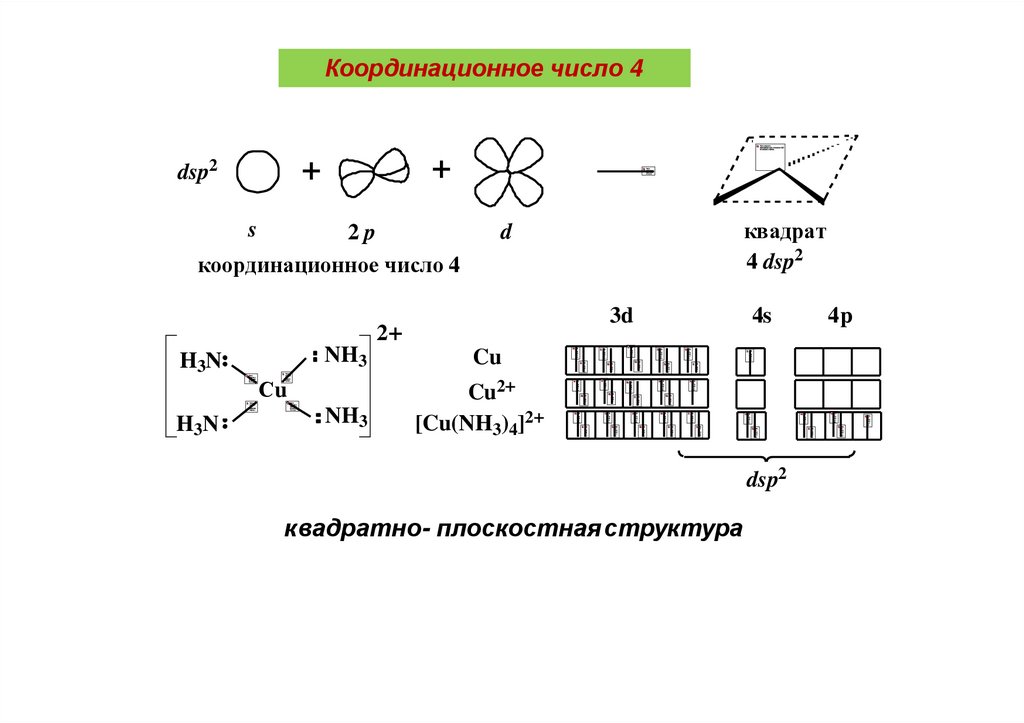
Координационное число 4+
+
dsp2
s
2p
координационное число 4
3d
2+
NH3
H3N
Сu
H3N
NH3
квадрат
4 dsp2
d
4s
Cu
Cu2+
[Cu(NH3)4]2+
dsp2
квадратно- плоскостная структура
4p
20.
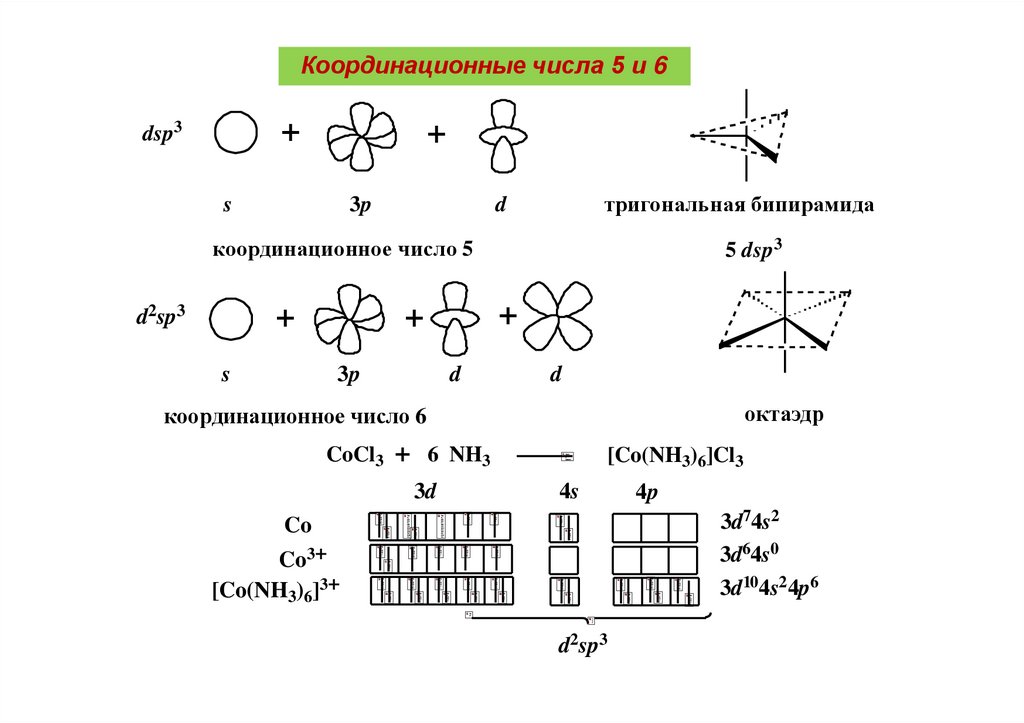
Координационные числа 5 и 6+
dsp3
+
s
3p
тригональная бипирамида
d
координационное число 5
s
+
+
+
d2sp3
5 dsp3
3p
d
d
октаэдр
координационное число 6
CoCl3
+
6 NH3
3d
[Co(NH3)6]Cl3
4s
4p
3d74s2
3d64s0
3d104s2 4p6
Co
Co3+
[Co(NH3)6]3+
d2sp3
21.
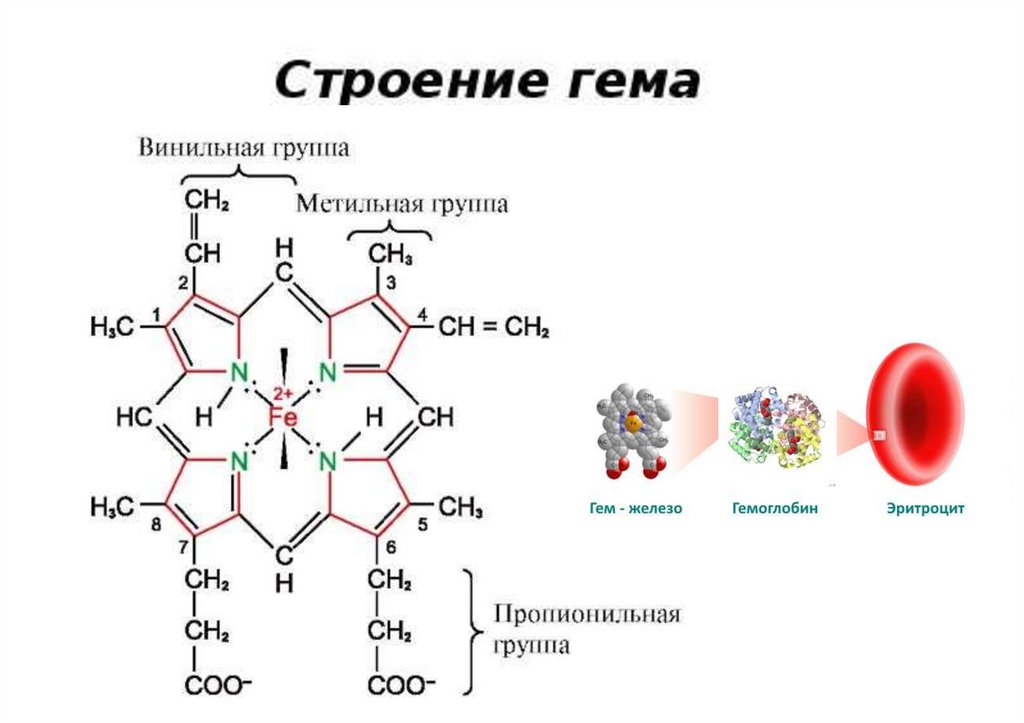
Биологически важные комплексы железаТип [Fe(L)4]
(dsp2)
СН2 СН
CH3
СН
CH CH2
CH3
N
СН
N
СН
Fe
N
N
CН3
CH3
CH2
СН
CH2COO–
Гем
CH2
CH2COO –
22.
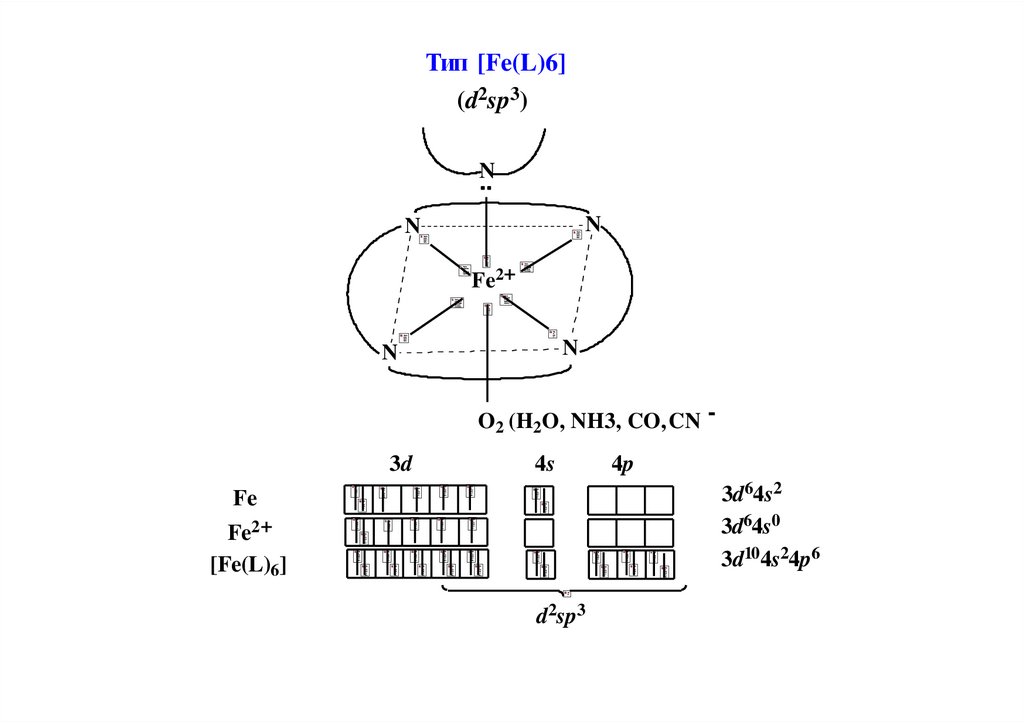
Тип [Fe(L)6](d2sp3)
N
N
N
Fe2+
N
O2 (H2O, NH3, CO,CN
3d
4s
-
N
4p
3d64s2
3d64s0
3d104s24p6
Fe
Fe2+
[Fe(L)6]
d2sp3
23.
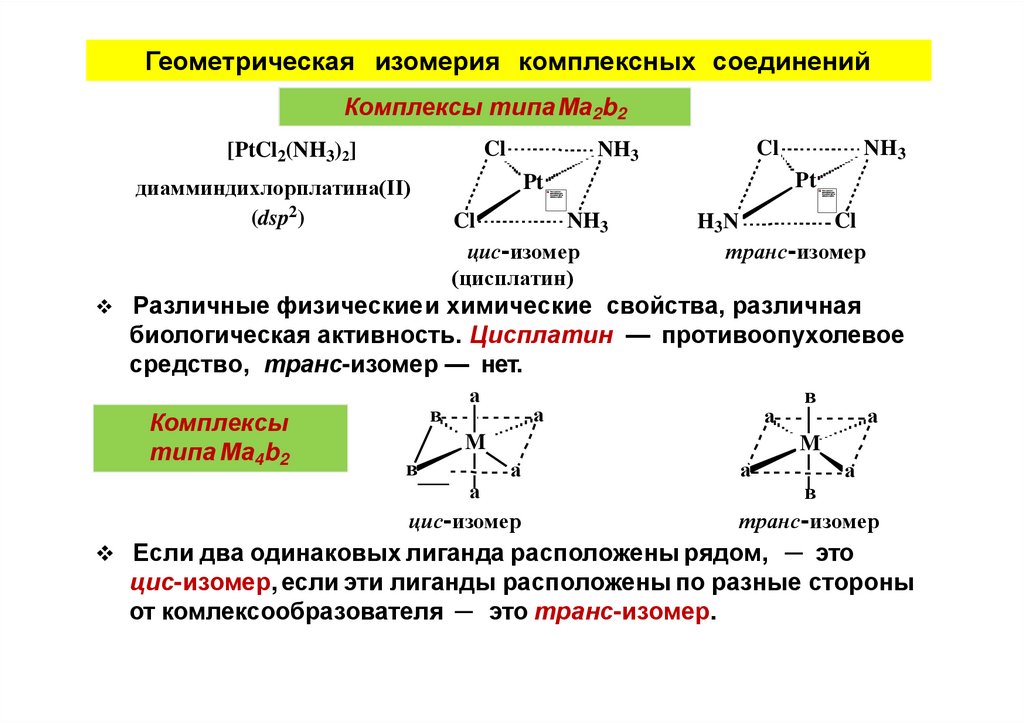
Геометрическая изомерия комплексных соединенийКомплексы типаМа2b2
Cl
[PtCl2(NH3)2]
Cl
NH3
цис-изомер
(цисплатин)
NH3
Pt
Pt
диамминдихлорплатина(II)
(dsp2)
Cl
NH3
Cl
H3N
транс-изомер
Различные физическиеи химические свойства, различная
биологическая активность. Цисплатин — противоопухолевое
средство, транс-изомер — нет.
Комплексы
типа Ма4b2
в
а
а
а
M
в
в
а
M
а
а
цис-изомер
а
а
в
транс-изомер
Если два одинаковых лиганда расположены рядом, ─ это
цис-изомер, если эти лиганды расположены по разные стороны
от комлексообразователя ─ это транс-изомер.
24.
Классификация комплексных соединенийКлассификация
комплексных
соединений
по заряду
комплекса
Катионные
[Cr(H2O)4]3+Cl3
по виду
лигандов
Аммиакаты
[Cu(NH3)4]SO4
по составу
внешней сферы
Ацидокомплексы
K2[PtCl4]
Кислоты
H2[PtCl6]
Анионные
Аквакомплексы
Гидроксокомплексы
K2[PtCl6]2-
[Co(H2O)6]Cl2
Na2[Zn(OH)4]
Катионно-анионные
[Cu(NH3)4]2+[PtCl4]2-
Карбонилы
Соли
[Fe(CO)5]
Na3[AlF6]
Нейтральные
[PtCl4(NH3)2]
Основания
[Ag(NH3)2]OH
Неэлектролиты
[Pt(NH3)2Cl2]
25.
Номенклатура комплексных соединений1)
В названии комплексного соединения первым указывают отрицательно
заряженную часть – анион, затем положительную часть – катион
2)
Название комплексной части начинают с указания состава внутренней сферы.
Во внутренней сфере прежде всего называют лиганды – анионы, прибавляя к
их латинскому названию окончание «о».
Например: Cl− – хлоро, CN− – циано, SCN− – тиоцианато, NO3− – нитрато, SO32− –
сульфито, OH− – гидроксо и т. д.
При этом пользуются терминами: для координированного аммиака – аммин,
для воды – аква, для оксида углерода(II) – карбонил
3)
Число монодентатных лигандов указывают греческими числительными: 1 –
моно (часто не приводится), 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса.
Для полидентатных лигандов (например, этилендиамин, оксалат) используют
бис-, трис-, тетракис- и т. д.
4)
Затем называют комплексообразователь, используя корень его латинского
названия и окончание -ат, после чего римскими цифрами указывают (в
скобках) степень окисления комплексообразователя
5)
После обозначения состава внутренней сферы называют внешнюю сферу
6)
В названии нейтральных комплексных частиц комплексообразователь
указывается в именительном падеже, а степень его не указывается, так как она
однозначно определяется, исходя из электронейтральности комплекса
26.
Номенклатура комплексных соединений[Cu(NH3)4]SO4
Сульфат тетраамминмеди (II)
Na3[Co(NO2)6]
Гексанитрокобальтат (III) натрия
[Pt(NH3)2Cl2]
Дихлородиамминплатина
[Cr(H2O)2(NH3)3 Cl]Br2
Бромид хлородиакватриамминхрома (III)
27.
Диссоциация комплексных соединений28.
Константы устойчивости и нестойкости29.
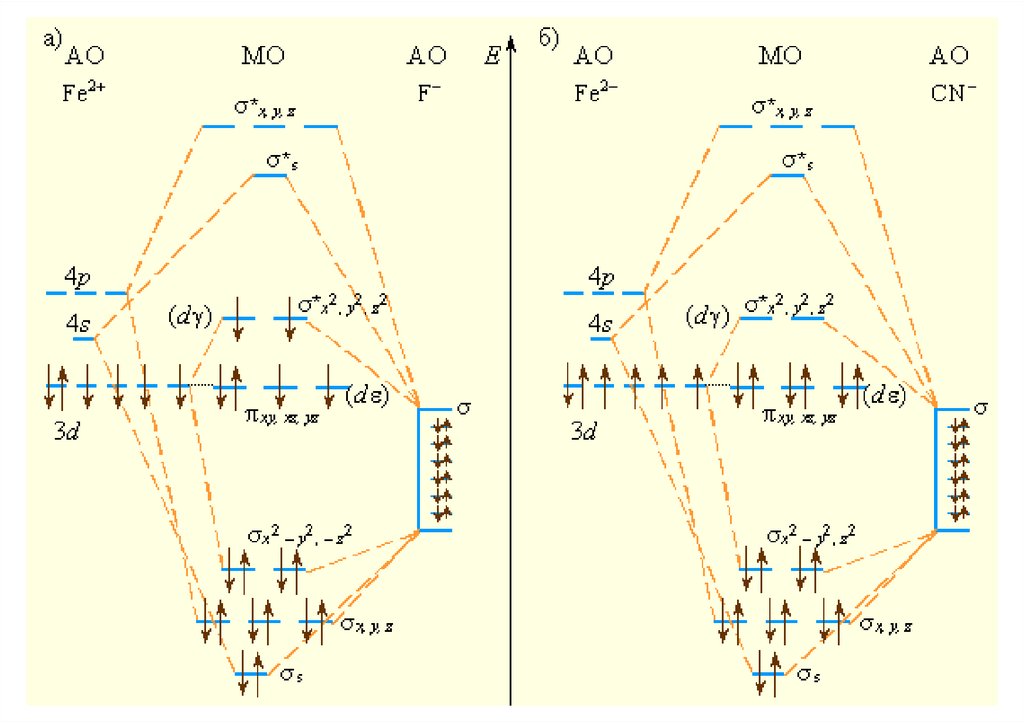
Химическая связь в комплексныхсоединениях
30.
Основные положения метода валентных связей31.
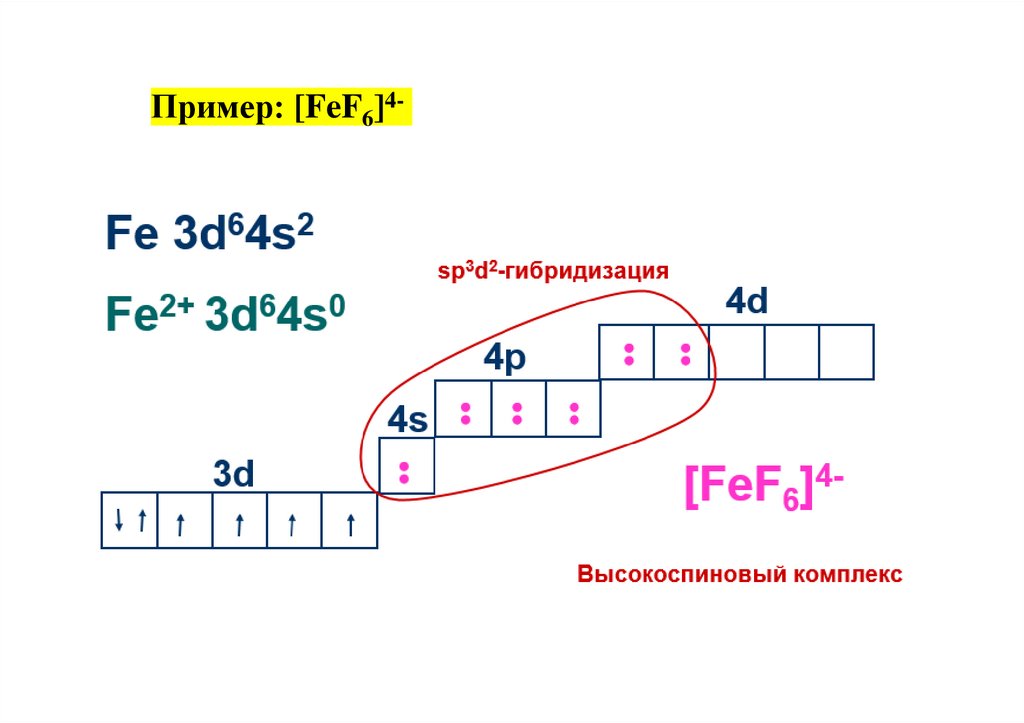
Пример: [FeF6]4-32.
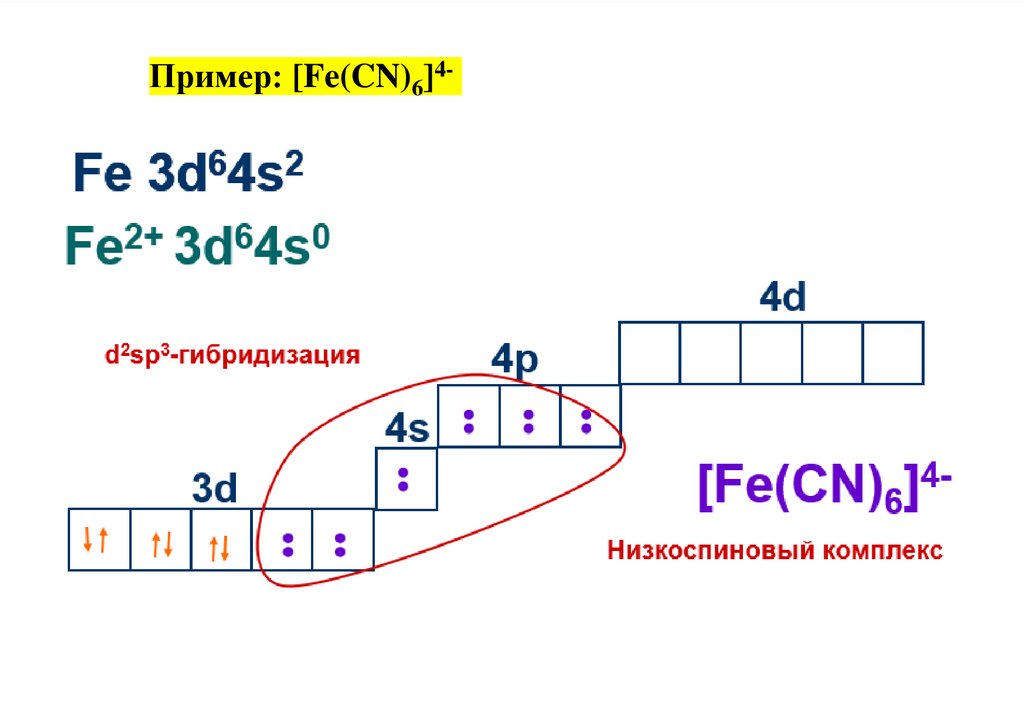
Пример: [Fe(CN)6]4-33.
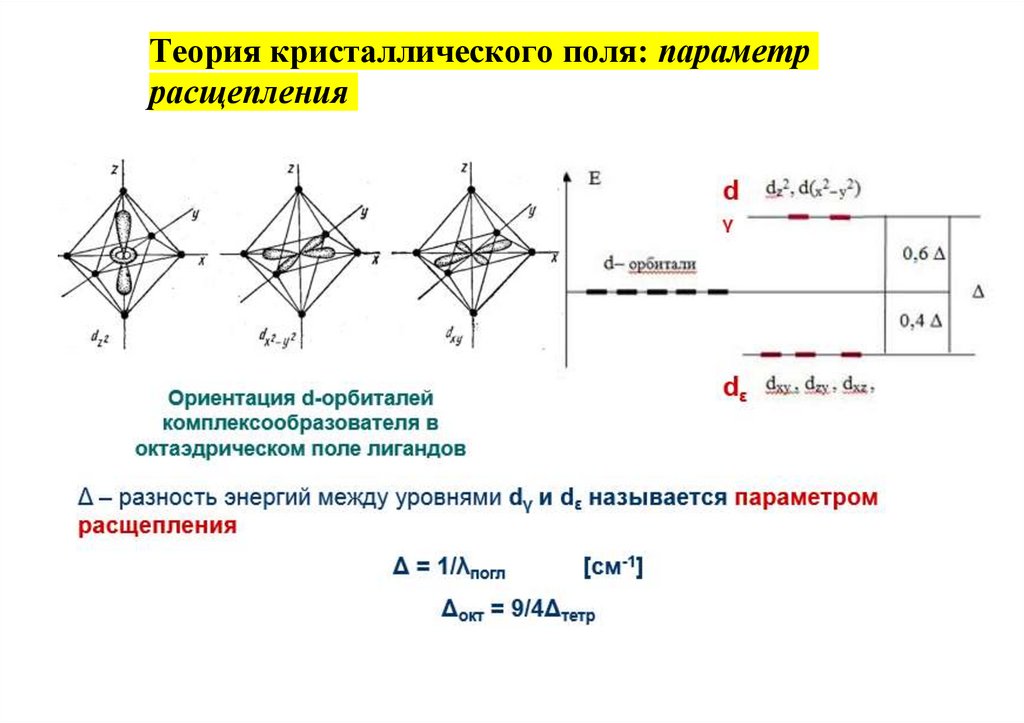
Теория кристаллического поля34.
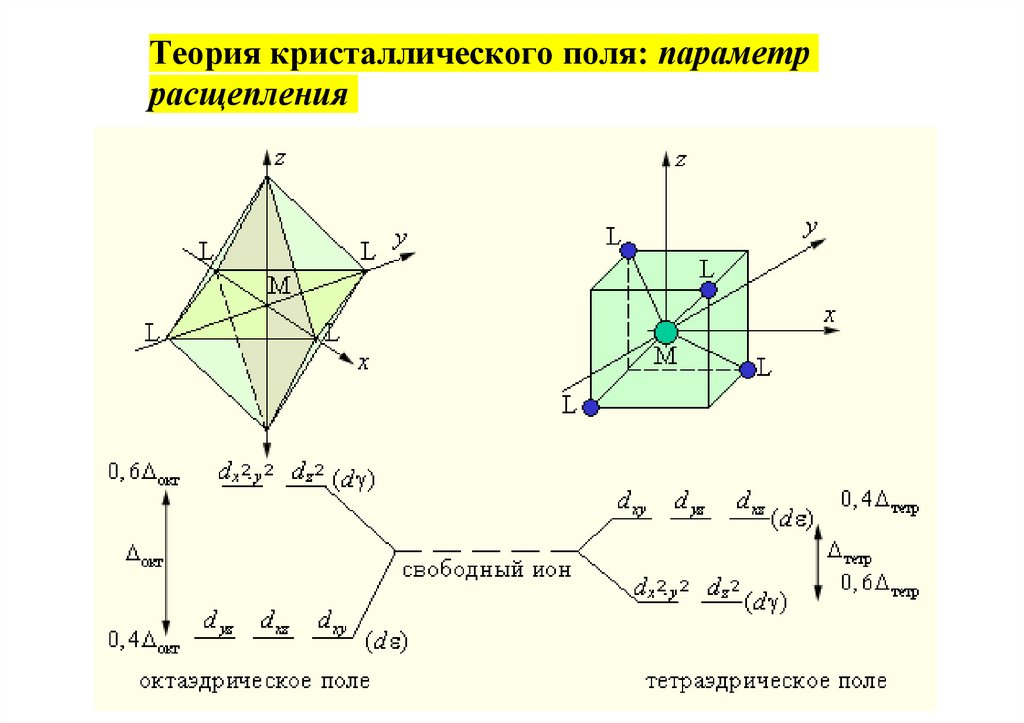
Теория кристаллического поля: параметррасщепления
35.
Теория кристаллического поля: параметррасщепления
36.
37.
Теория кристаллического поля: ЭСКП38.
39.
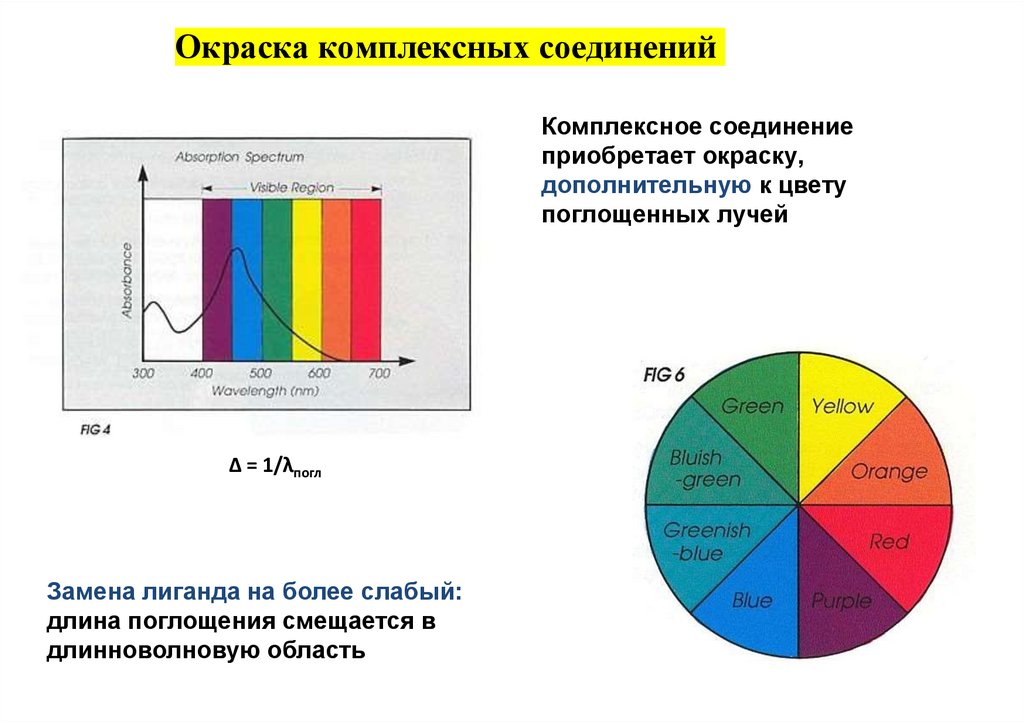
Окраска комплексных соединенийКомплексное соединение
приобретает окраску,
дополнительную к цвету
поглощенных лучей
Δ = 1/λпогл
Замена лиганда на более слабый:
длина поглощения смещается в
длинноволновую область
40.
41.
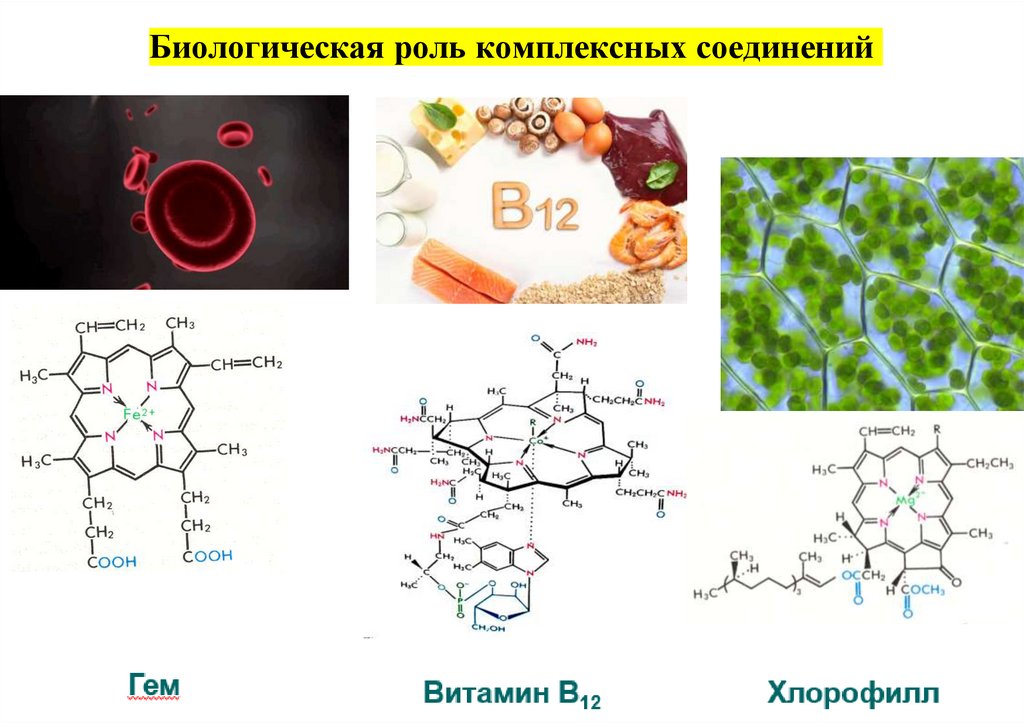
Значение комплексных соединений42.
Биологическая роль комплексных соединений43.
quisqueauditorio gradus
in futurum
























 Химия
Химия








