Похожие презентации:
Строение комплексных соединений. Классификация. Номенклатура. Устойчивость комплексных соединений. Изомерия
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙМЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
1. Строение комплексных соединений.
Классификация. Номенклатура.
2. Устойчивость комплексных соединений.
3. Изомерия.
4. Комплексоны. Хелаты. Краун-эфиры.
Лектор: Степанова Ирина Петровна, доктор
биологических наук, профессор, зав. кафедрой химии
2.
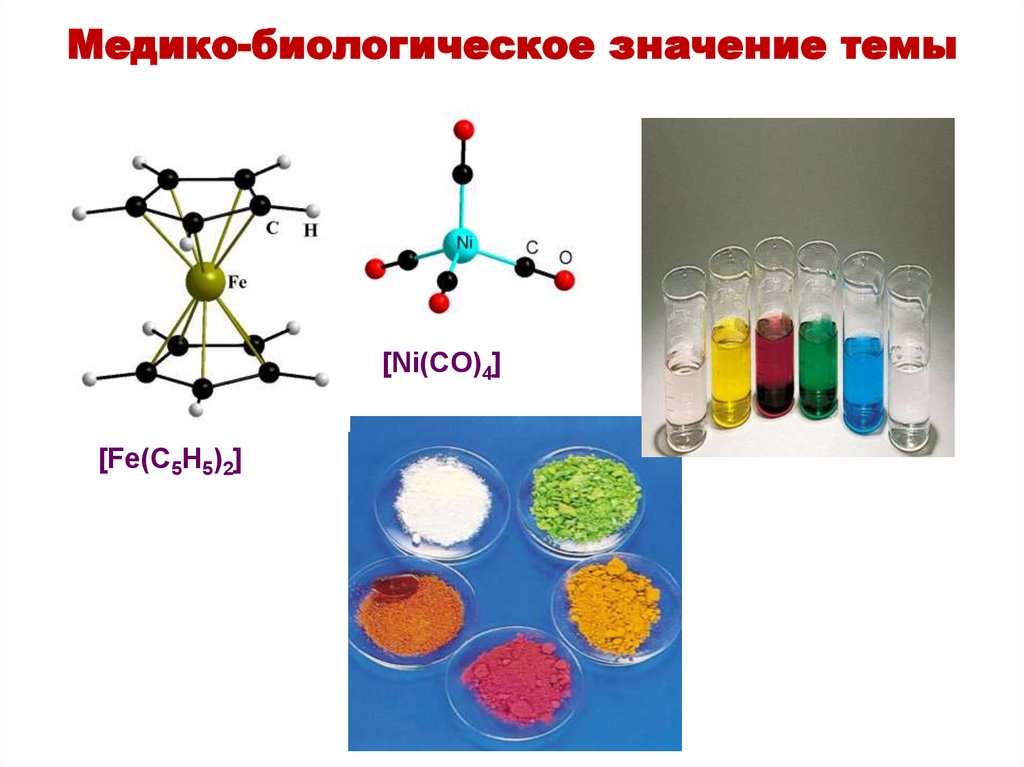
Медико-биологическое значение темы[Ni(CO)4]
[Fe(C5H5)2]
3.
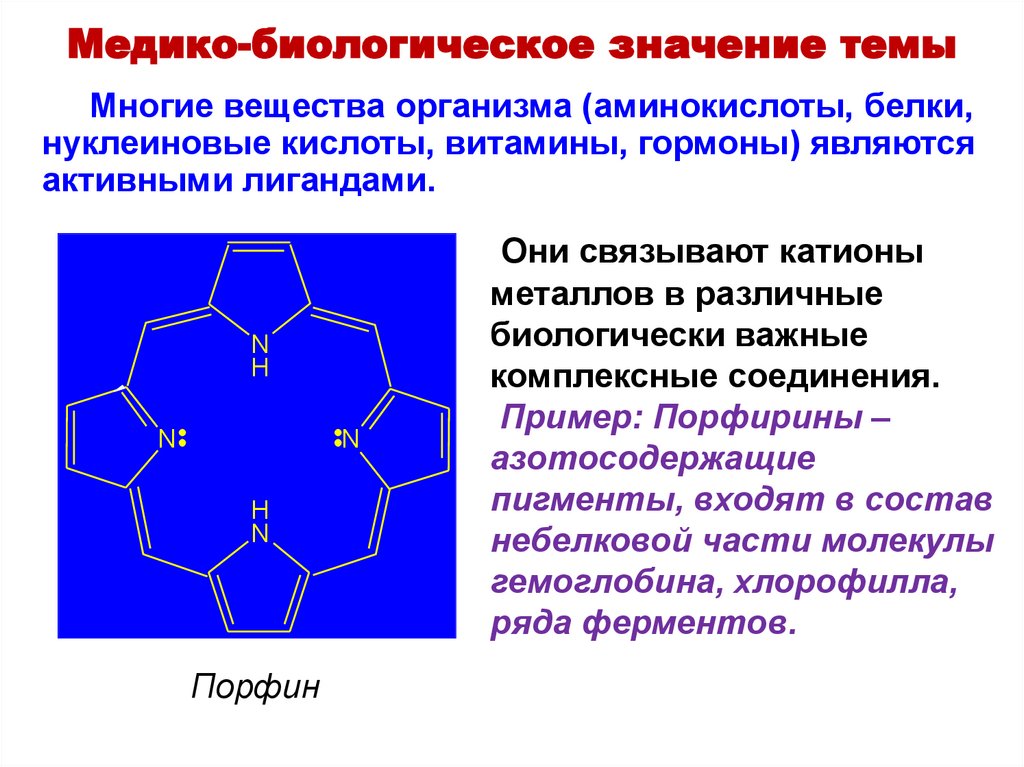
Медико-биологическое значение темыМногие вещества организма (аминокислоты, белки,
нуклеиновые кислоты, витамины, гормоны) являются
активными лигандами.
N
H
N
N
H
N
Порфин
Они связывают катионы
металлов в различные
биологически важные
комплексные соединения.
Пример: Порфирины –
азотосодержащие
пигменты, входят в состав
небелковой части молекулы
гемоглобина, хлорофилла,
ряда ферментов.
4.
Медико-биологическое значение темыH3C
CH=CH2
N
H3C
CH3
N
Mg
H2C
N
CH2-CH3
N
H2C
O
C
O
CH2
O
CH3
C
O-CH3
CH
H3C
C
CH2 3
CH
CH3
CH2 3
CH
CH3
хлорофилл
CH2 3
CH
CH3
CH3
5.
Медико-биологическое значение темыгем
глобин
Гемоглобин крови (HHb),
выполняющий функцию
переносчика кислорода,
содержит гем-хелатный
комплекс порфирина с
ионами Fe2+ (к.ч.=6), в
котором осуществляется
4 связи. Одну связь Fe2+
образует с белкомглобином.
6.
Медико-биологическое значение темыВ легких, где парциальное
давление O2 высоко, он
присоединяется к Fe(II) на
шестую координационную
связь, а в тканях, из-за
снижения парциального
давления, кислород
освобождается.
HHb + O2
гемоглобин
HHbO2
оксигемоглобин
7.
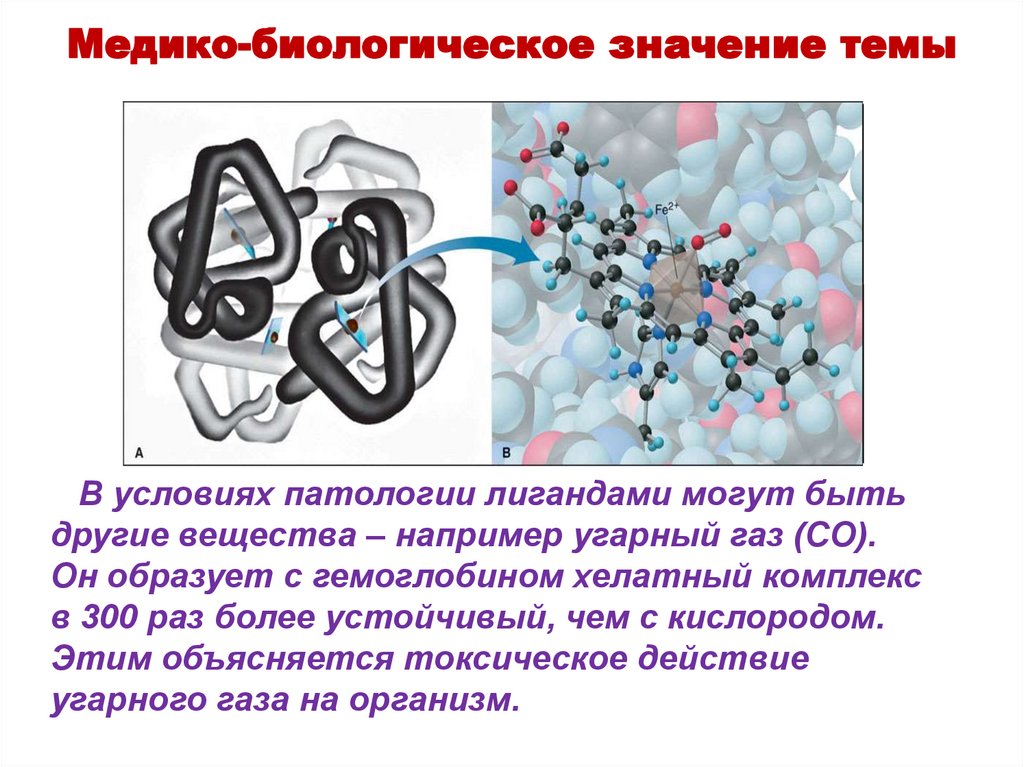
Медико-биологическое значение темыВ условиях патологии лигандами могут быть
другие вещества – например угарный газ (CO).
Он образует с гемоглобином хелатный комплекс
в 300 раз более устойчивый, чем с кислородом.
Этим объясняется токсическое действие
угарного газа на организм.
8.
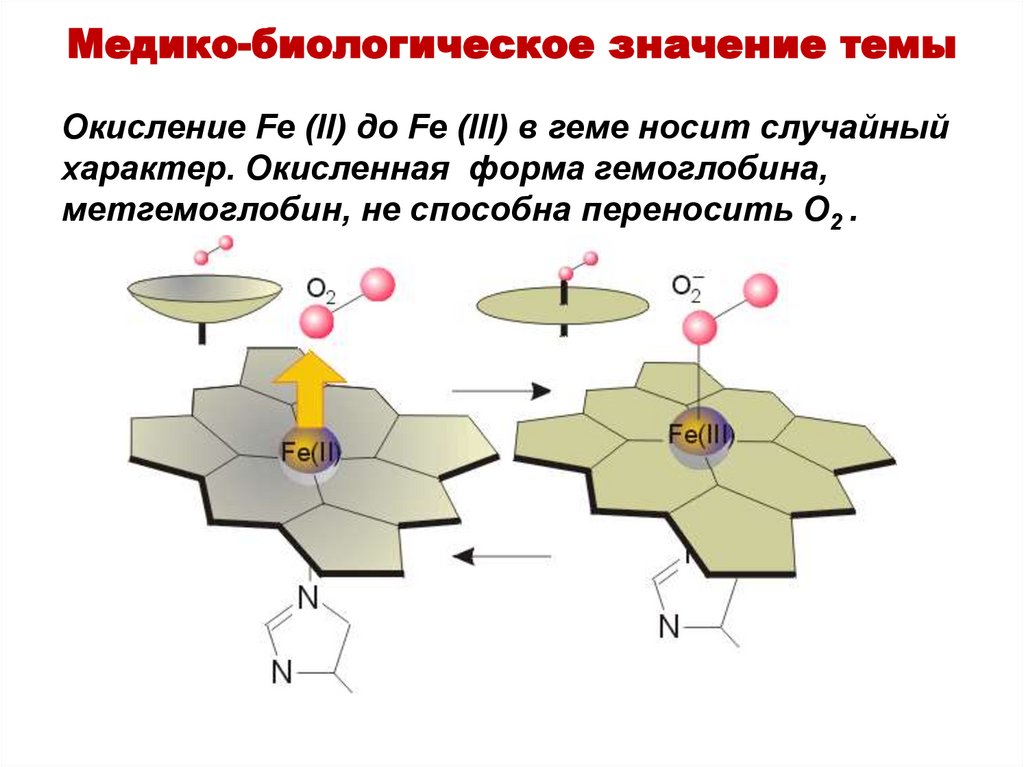
Медико-биологическое значение темыОкисление Fe (II) до Fe (III) в геме носит случайный
характер. Окисленная форма гемоглобина,
метгемоглобин, не способна переносить O2 .
9.
Медико-биологическое значение темыМиоглоби́н – железосодержащий
кислород-связывающий белок
скелетных мышц и мышцы
сердца.
миоглобин
10.
Медико-биологическое значение темыB12 – это хелат Co3+
c порфирином.
B12 (Co[C62H88N13O14P])CN
11.
Медико-биологическое значение темыМеталлоферменты – это комплексы металлов с
белками.
Цитохром с в своей структуре
содержит гем, является
компонентом дыхательной цепи
митохондрий.
12.
Медико-биологическое значение темыКарбоксипептидазы относятся к
Zn-металлоферментам.
13.
Медико-биологическое значение темыГормон инсулин – хелат Zn2+ c белком.
14.
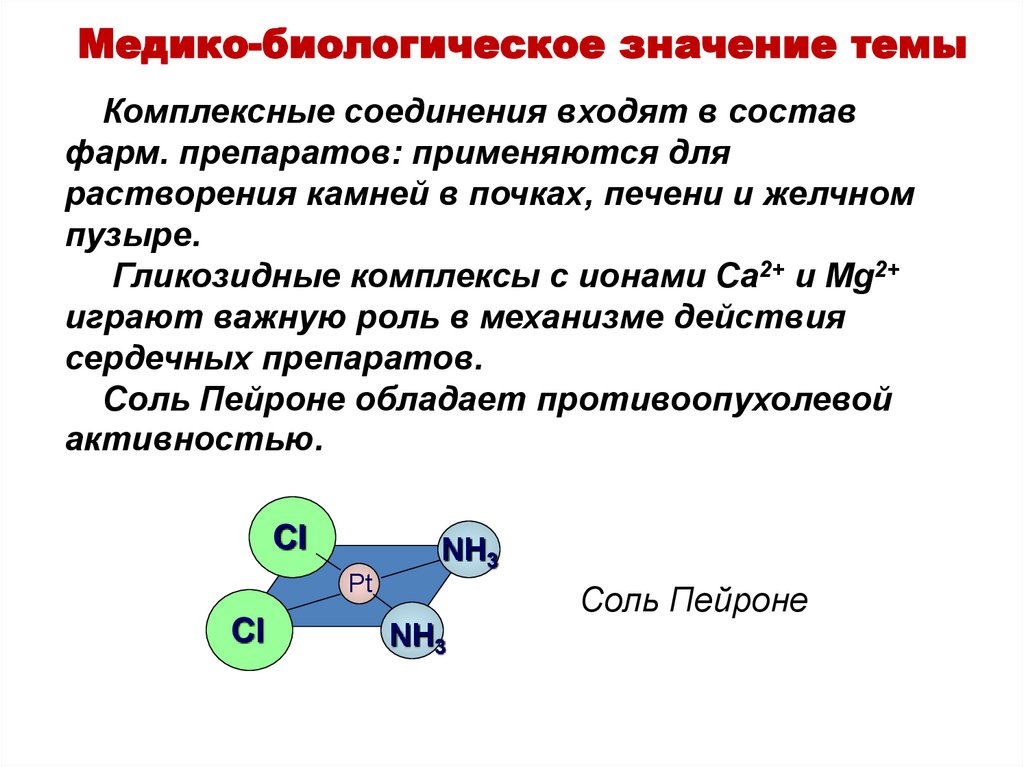
Медико-биологическое значение темыКомплексные соединения входят в состав
фарм. препаратов: применяются для
растворения камней в почках, печени и желчном
пузыре.
Гликозидные комплексы с ионами Ca2+ и Mg2+
играют важную роль в механизме действия
сердечных препаратов.
Соль Пейроне обладает противоопухолевой
активностью.
Cl
NH3
Pt
Cl
Соль Пейроне
NH3
15.
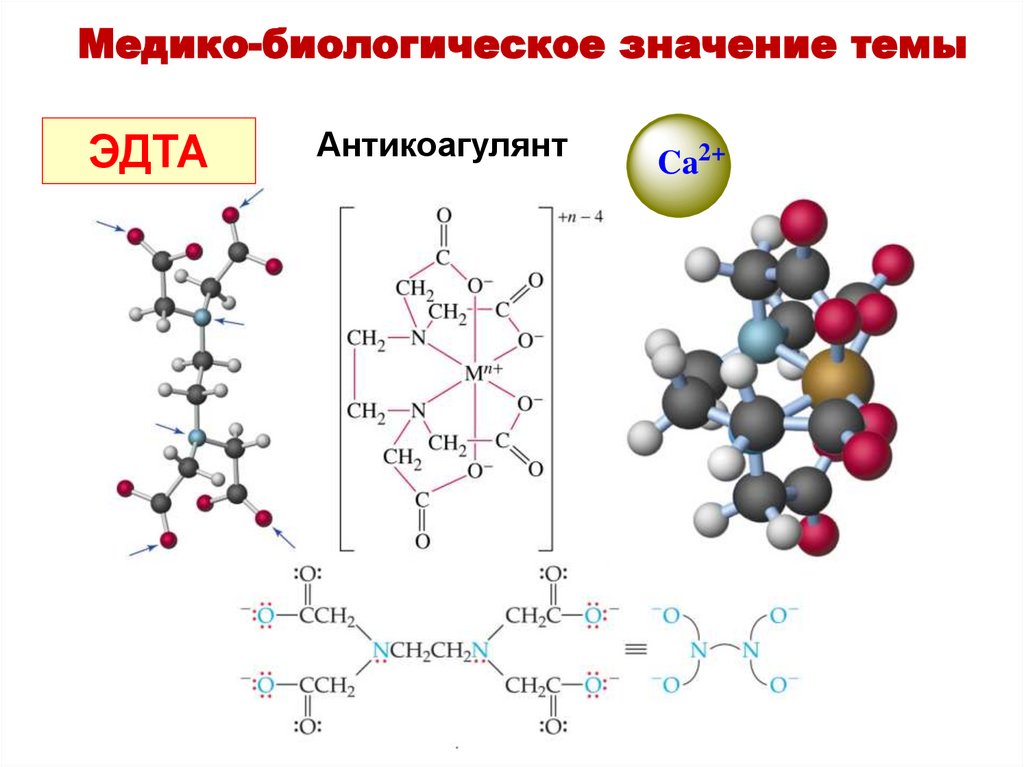
Медико-биологическое значение темыКомплексоны используются для маскировки
(связывания и обезвреживания) ионов металлов,
присутствующих в лекарственных препаратах в
виде загрязнений, а также для вывода из
организма токсических ионов.
ЭДТА
16.
Медико-биологическое значение темыЭДТА
Антикоагулянт
Ca2+
17.
MPUESTOS DE COORDINACIOМедико-биологическое значение темы
Комплексные соединения часто имеют яркую
окраску, поэтому их используют для
проведения качественных реакций
CuSO4 · 5 H2O
NiSO4 · 7 H2O
Co(NO3)2 · 7 H2O
INTRODUCCION
18.
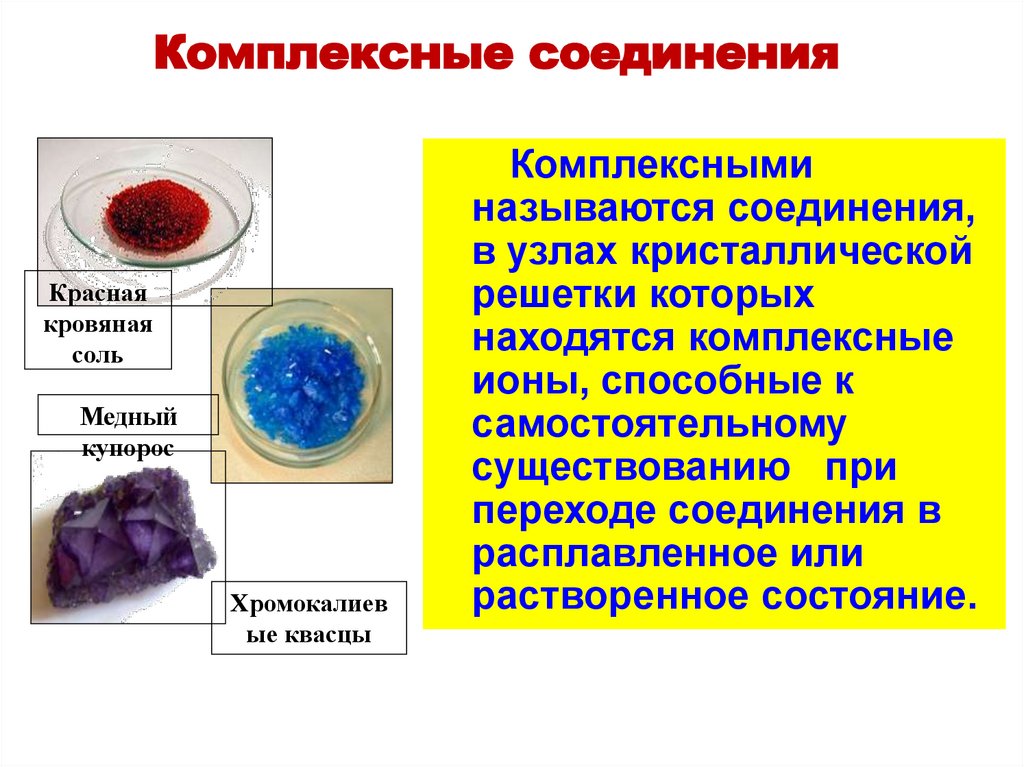
Комплексные соединенияКрасная
кровяная
соль
Медный
купорос
Хромокалиев
ые квасцы
Комплексными
называются соединения,
в узлах кристаллической
решетки которых
находятся комплексные
ионы, способные к
самостоятельному
существованию при
переходе соединения в
расплавленное или
растворенное состояние.
19.
Координационная теория А. Вернера(1893 г. )
"Меня часто охватывает
экстаз пред красотой
моей науки. Чем дальше я
погружаюсь в ее тайны,
тем более она кажется
мне огромной,
величественной, слишком
красивой для простого
смертного."
Альфред Вернер
(1866-1919),
швейцарский
химик
20.
Строение комплексных соединенийВнешняя
сфера
Внутренняя сфера
K3[Fe(CN)6]
ИонКоординационное
комплексочисло
образователь Лиганды
[Cu(NH3)4]Cl2
Внутренняя
сфера
Внешняя
сфера
21.
Строение комплексных соединений. Классификация. НоменклатураКомплекс – центральный атом или ион (чаще
всего металла), окруженный набором лигандов.
[Co(NH3)6]3+ – комплекс
[Co(NH3)6]Cl3 – комплексное
соединение.
[Fe(CO)5] – комплекс и
комплексное соединение
22.
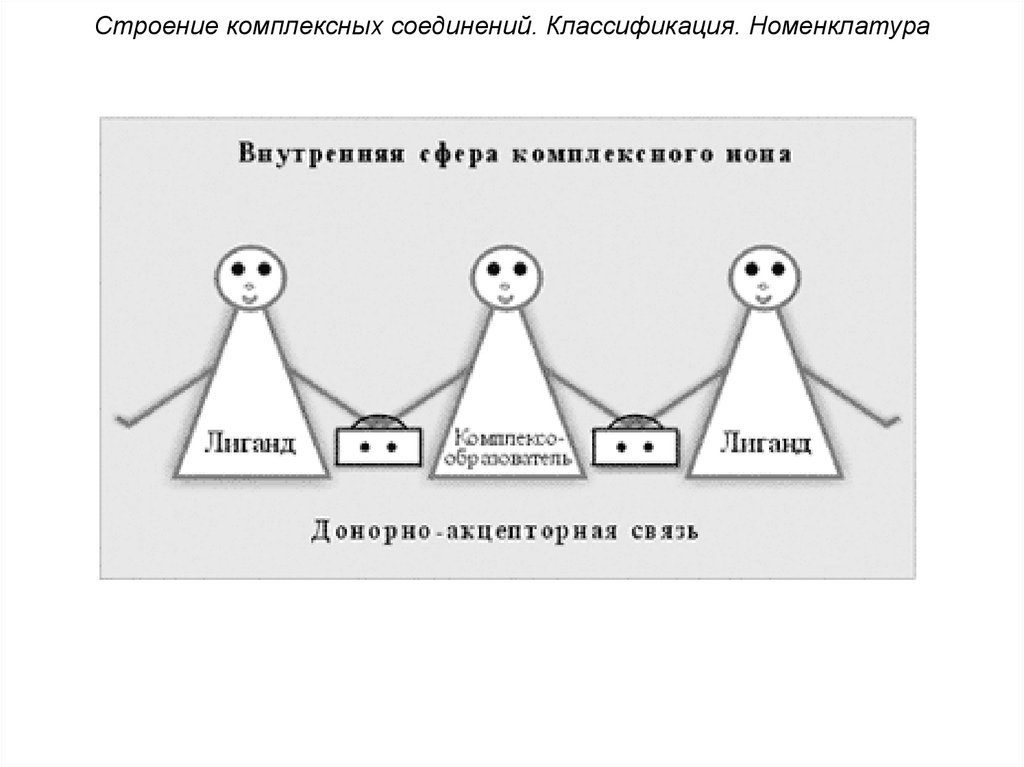
Основные положениякоординационной теории А. Вернера
1. Внутренняя сфера комплекса
включает центральный атом или ионкомплексообразователя, вокруг
которого находятся связанные с ним
лиганды – молекулы или ионы. При
записи формул внутреннюю сферу
выделяют квадратными скобками.
23.
Строение комплексных соединений. Классификация. Номенклатура2. Внешняя сфера – это совокупность
ионов, непосредственно не связанных
с центральным атомом или ионом
комплексообразователя и
удерживаемых около внутренней
сферы электростатическими силами.
24.
Строение комплексных соединений. Классификация. Номенклатура3. Комплексообразователями
являются атомы или ионы металлов,
имеющие свободные орбитали (чаще
металлы d-элементы Co3+, Cu2+, Cu+,
Fe3+, Pt2+ и др.), т.е. они являются
акцепторами электронов.
25.
Строение комплексных соединений. Классификация. НоменклатураПериодическая таблица
d-блок переходные элементы
f-блок переходные элементы
26.
Строение комплексных соединений. Классификация. Номенклатураd-Блок переходные элементы
VIIIB
IIIB
IVB
VB
VIB VIIB
Sc
Ti
V
Cr Mn Fe Co
Y
Zr
Nb Mo Tc Ru Rh Pd Ag Cd
La
Hf
Ta
W
Re Os
Ir
IB
IIB
Ni Cu Zn
Pt Au Hg
27.
Строение комплексных соединений. Классификация. НоменклатураЭлектронные конфигурации
Элемент
Sc
Ti
V
Cr
Mn
Конфигурация
[Ar]3d14s2
[Ar]3d24s2
[Ar]3d34s2
[Ar]3d54s1
[Ar]3d54s2
[Ar] = 1s22s22p63s23p6
28.
Строение комплексных соединений. Классификация. НоменклатураЭлектронные конфигурации
Элемент
Конфигурация
Fe
Co
Ni
Cu
Zn
[Ar] 3d64s2
[Ar] 3d74s2
[Ar] 3d84s2
[Ar]3d104s1
[Ar]3d104s2
[Ar] = 1s22s22p63s23p6
29.
Строение комплексных соединений. Классификация. Номенклатура30.
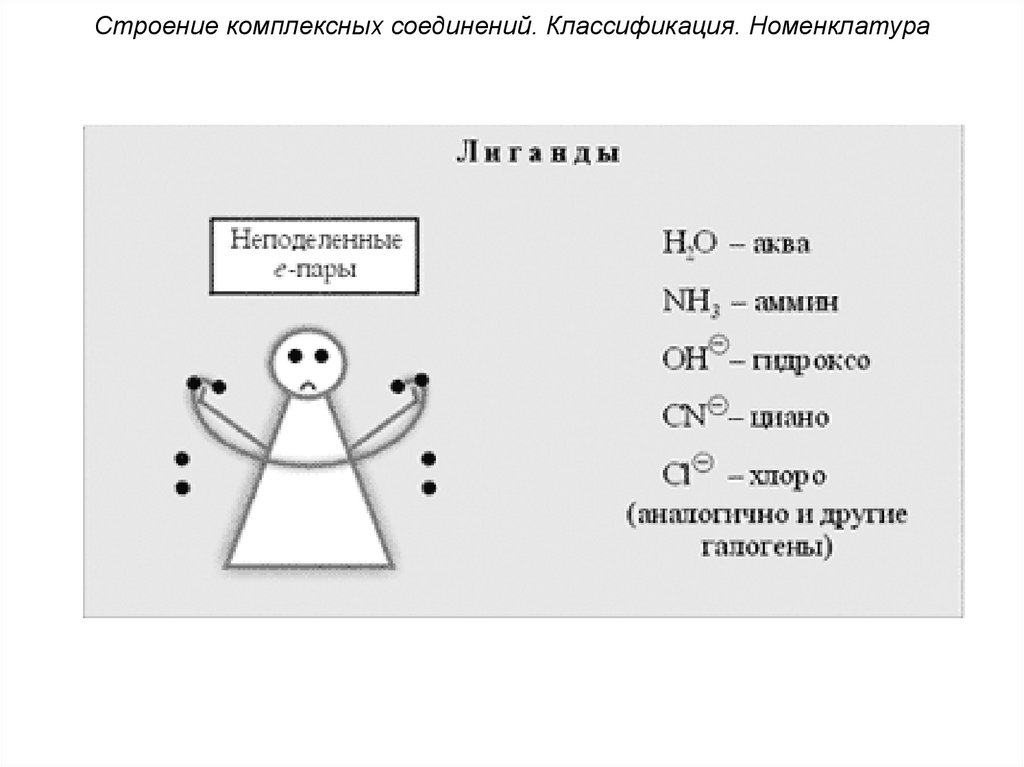
Строение комплексных соединений. Классификация. Номенклатура4. Лиганды (от лат. ligo – привязываю)
(или адденды) имеют неподеленные
электронные пары, т.е. являются
донорами электронов – гидроксо-группы
(OH-), кислотные остатки (Cl, Br-, I-, NO2-,
CN-, SO42- и др.), а также нейтральные
полярные молекулы (H2O, NH3, CO и др.).
31.
Строение комплексных соединений. Классификация. НоменклатураПримеры лигандов
Анионы бескислородных кислот
F-, Cl-, Br-, I- (фторо-лиганд и т.д.)
Остатки кислородсодержащих кислот
CH3COO- – ацетато-лиганд
CO32- – карбонато-лиганд
C2O42- – оксалато-лиганд
SO42- – сульфато-лиганд
32.
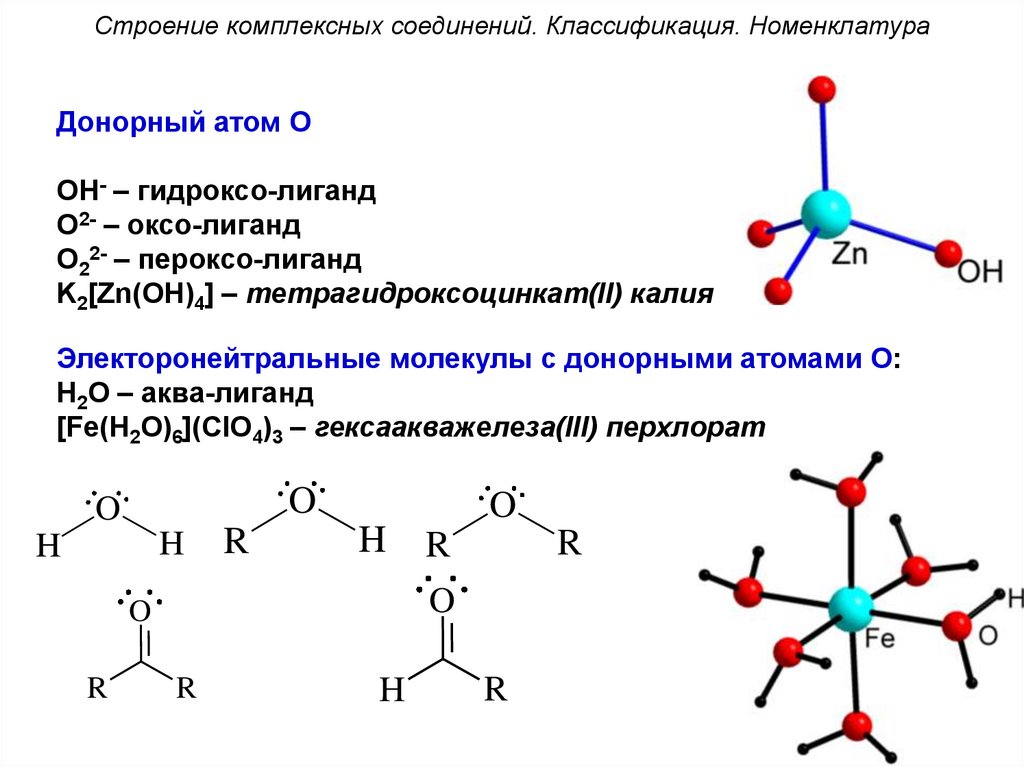
Строение комплексных соединений. Классификация. НоменклатураДонорный атом O
OH- – гидроксо-лиганд
O2- – оксо-лиганд
O22- – пероксо-лиганд
K2[Zn(OH)4] – тетрагидроксоцинкат(II) калия
Электоронейтральные молекулы с донорными атомами O:
H2O – аква-лиганд
[Fe(H2O)6](ClO4)3 – гексаакважелеза(III) перхлорат
O
O
H
H
R
O
H
O
R
R
H
R
R
O
R
33.
Строение комплексных соединений. Классификация. Номенклатура34.
Строение комплексных соединений. Классификация. Номенклатура5. Механизм комплексообразования
связан
с
межионным
и
межмолекулярным взаимодействиями,
но основной вклад в образование
внутренней сферы вносит донорноакцепторное взаимодействие.
35.
Строение комплексных соединений. Классификация. НоменклатураОрбитали иона (атома)
комплексообразователя всегда находятся в
гибридном состоянии. Тип гибридизации и
геометрическая форма комплексного иона
зависят, в первую очередь, от типа лигандов, их
дентатности и количества лигандов.
Второстепенно, тип гибридизации зависит от
самого комплексообразователя.
36.
Строение комплексных соединений. Классификация. Номенклатура[Al(OH)4]3d
3d
3d
3+
AlAl Al
3+
3p
3p
3p
3s
3s3s
OH
OH
OH
sp3-гибридизация
тетраэдр
OH
37.
Строение комплексных соединений. Классификация. Номенклатура[CoCl4 ]–2
3d
4s
4p
Co
Co2+
sp3-гибридизация
тетраэдр
38.
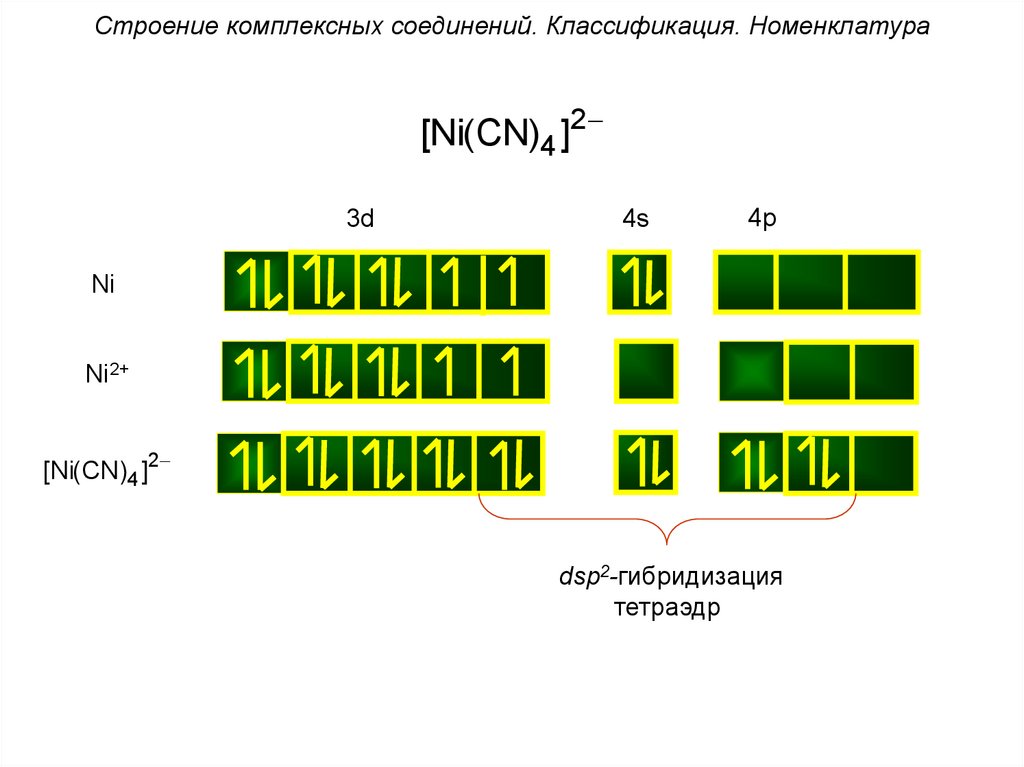
Строение комплексных соединений. Классификация. Номенклатура[Ni(CN)4 ]2
3d
4s
4p
Ni
Ni2+
[Ni(CN)4 ]2
dsp2-гибридизация
тетраэдр
39.
Строение комплексных соединений. Классификация. Номенклатура[Fe(C N) 6 ]3 –
3d
4s
4p
Fe+3
[Fe(C N) 6 ]3 –
d2sp3-гибридизация
октаэдр
40.
Строение комплексных соединений. Классификация. Номенклатура41.
Строение комплексных соединений. Классификация. НоменклатураЭлектростатическое взаимодействие внутри
комплекса (лиганды – нейтральные молекулы).
42.
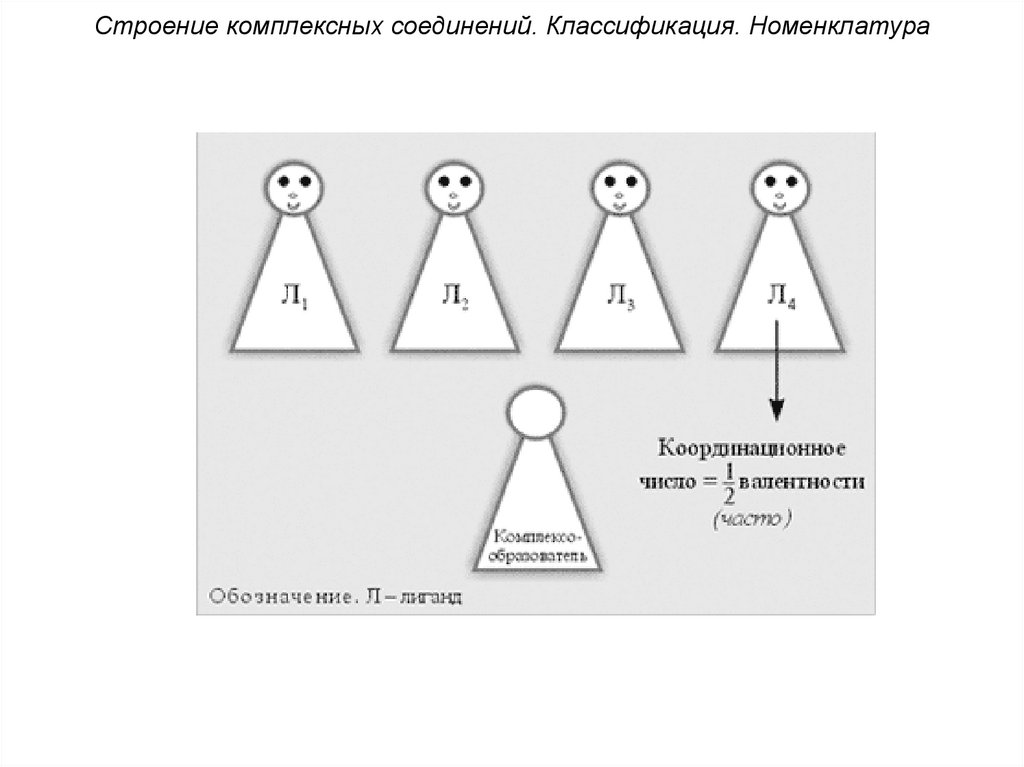
Строение комплексных соединений. Классификация. Номенклатура6. Координационное число (к. ч.)
комплексообразователя показывает,
сколько
связей
образует
комплексообразователь с лигандами.
Величина к.ч. зависит от природы
комплексообразователя, лигандов и
условий комплексообразования
(концентрации, рН, температуры и др.).
43.
Строение комплексных соединений. Классификация. Номенклатура44.
Строение комплексных соединений. Классификация. НоменклатураКоординационные числа наиболее
распространенных комплексообразователей
Комплексообразователь
К.ч.
Ag+ , Cu+
Cu2+ , Zn2+, Pt2+, Hg2+
Fe3+, Co3+, Fe2+, Ni2+, Al3+, Pt4+
2
4
6
45.
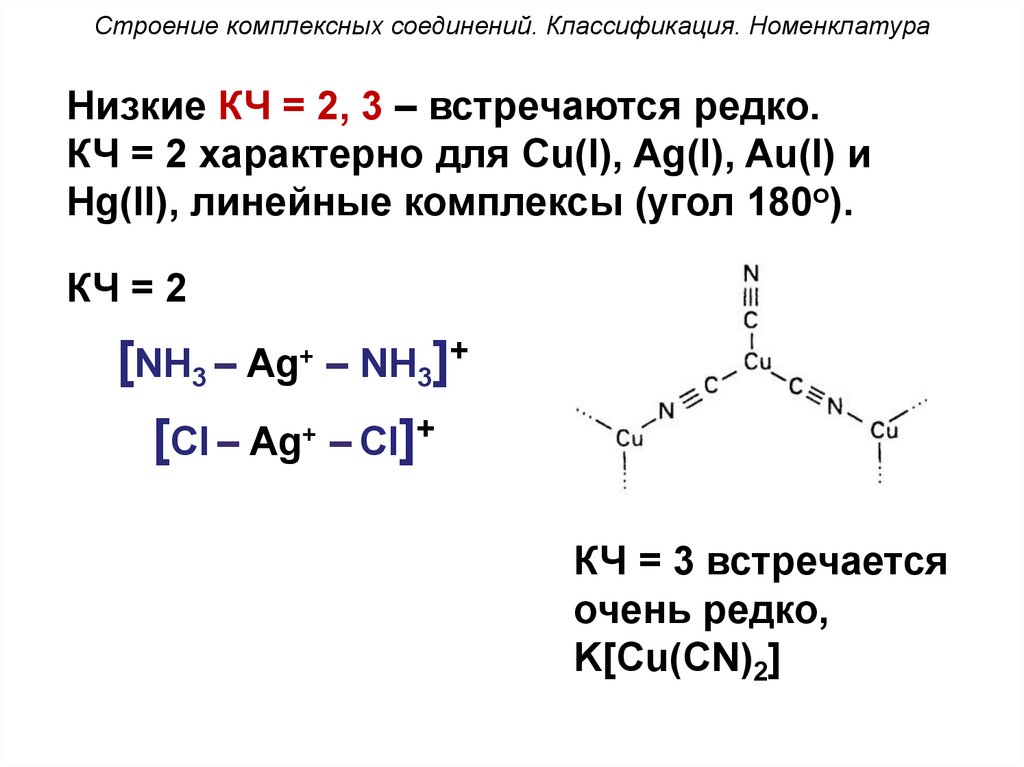
Строение комплексных соединений. Классификация. НоменклатураНизкие КЧ = 2, 3 – встречаются редко.
КЧ = 2 характерно для Cu(I), Ag(I), Au(I) и
Hg(II), линейные комплексы (угол 180о).
КЧ = 2
[NH3 – Ag+ – NH3]+
[Cl – Ag+ – Cl]+
КЧ = 3 встречается
очень редко,
K[Cu(CN)2]
46.
Строение комплексных соединений. Классификация. НоменклатураКЧ = 4 (тетраэдр и плоский квадрат).
[Ni(CO)4] 2+
тетраэдр
квадратный комплекс
[Pt2+(NH3)2Cl2]
47.
Строение комплексных соединений. Классификация. НоменклатураКЧ = 5 – менее распространено (квадратная
пирамида и тригональная бипирамида).
пентацианоникелят(II), [Ni(CN)5]3-
48.
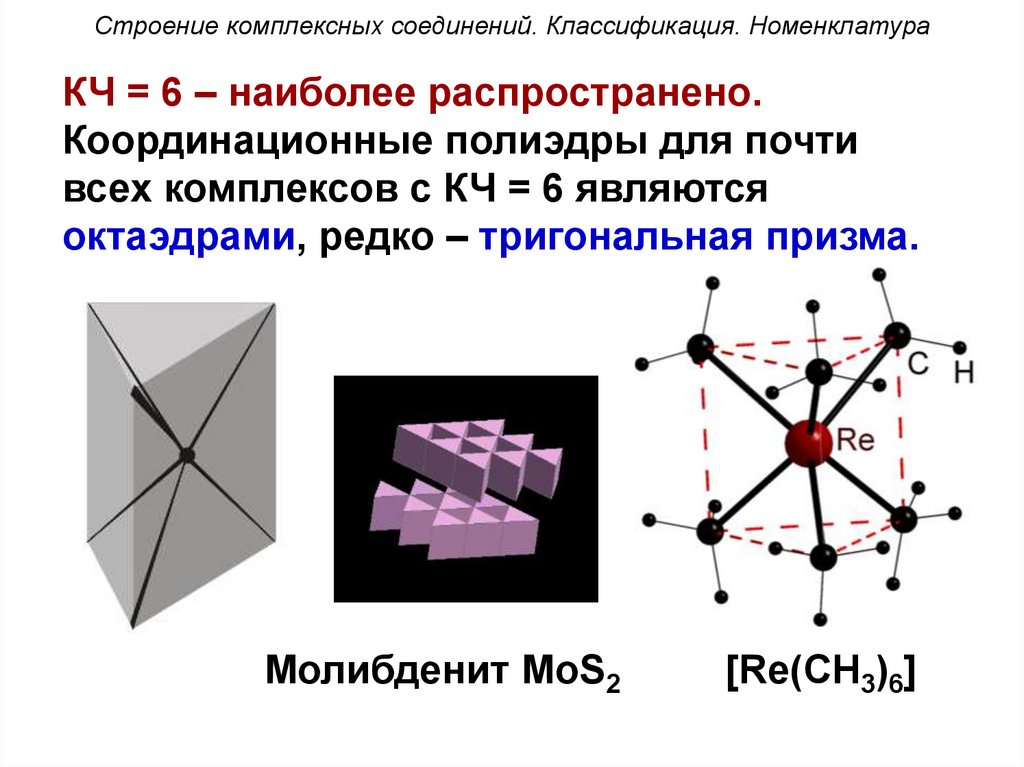
Строение комплексных соединений. Классификация. НоменклатураКЧ = 6 – наиболее распространено.
Координационные полиэдры для почти
всех комплексов с КЧ = 6 являются
октаэдрами, редко – тригональная призма.
Молибденит MoS2
[Re(CH3)6]
49.
Строение комплексных соединений. Классификация. НоменклатураКЧ = 6 – наиболее характерно для металлов
с электронной конфигурацией от d0 до d9.
Примеры: d0 – [Sc(H2O)6]3+; d3 – [Cr(H2O)6]3+;
d5 – [Fe(CN)6]3-; d6 – [RhCl6]3-.
50.
Строение комплексных соединений. Классификация. НоменклатураКЧ = 7
Пентагональная
бипирамида
[UO2(H2O)5]2+
Тригональная
призма с одной
шапкой [NbF7]2-
Октаэдр с одной
шапкой
[TaCl4(PMe3)3]
51.
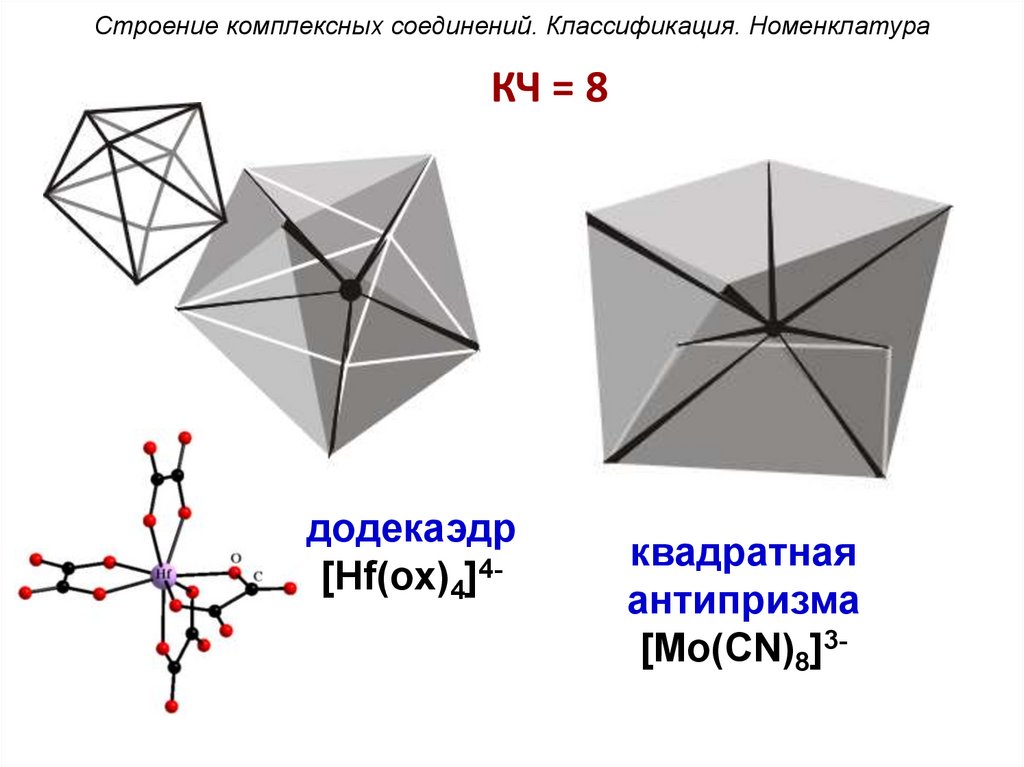
Строение комплексных соединений. Классификация. НоменклатураКЧ = 8
додекаэдр
[Hf(ox)4]4-
квадратная
антипризма
[Mo(CN)8]3-
52.
Строение комплексных соединений. Классификация. НоменклатураКЧ = 8, [СoF8]5- квадратная антипризма
53.
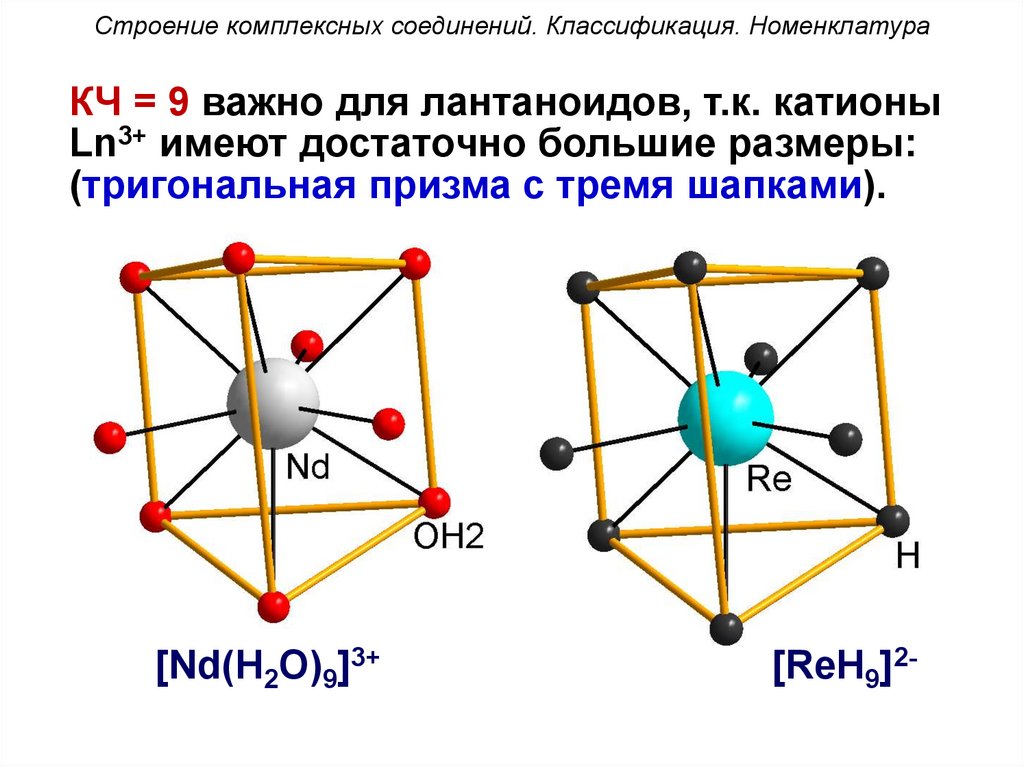
Строение комплексных соединений. Классификация. НоменклатураКЧ = 9 важно для лантаноидов, т.к. катионы
Ln3+ имеют достаточно большие размеры:
(тригональная призма с тремя шапками).
[Nd(H2O)9]3+
[ReH9]2-
54.
Строение комплексных соединений. Классификация. НоменклатураКЧ = 10, 12
КЧ=12,
[Ce(NO3)6]2-
КЧ = 10,
[Bi(NO3)5]2-
55.
Строение комплексных соединений. Классификация. НоменклатураПример: Заряд внутренней сферы
комплексного соединения Z равен
алгебраической сумме зарядов
комплексообразователя и лигандов.
56.
Строение комплексных соединений. Классификация. НоменклатураПример:
[Со+3(Сl-)4(Н2О)2]z
Комплексообразователь – Со3+
Лиганды – Сl-, Н2О
КЧ (Со3+) = 6
Z = 1 · (+3) + 4 ·(-1) + 2 · 0 = -1
[Со+3(Сl-)4(Н2О)2]Дописываем ионы внешней сферы:
К+[Со+3(Сl-)4(Н2О)2]-
57.
Классификация и номенклатуракомплексных соединений
По характеру заряда внутренней
сферы различают катионные, анионные и
нейтральные комплексы.
Например:
1) [Cu+2(H 2 О)4]2+ – катионный комплекс
2) [Fe+3(CN)6]3- – анионный комплекс
3) [Zn+2(ОН)2(NН3)(Н2О)]0 – нейтральный
комплекс
58.
Строение комплексных соединений. Классификация. НоменклатураНазвание комплекса:
Число лигандов – греч.
числит.
• 1 – (моно)
• 2 – ди
• 3 – три
• 4 – тетра
• 5 – пента
• 6 – гекса
• 7 – гепта …
число лигандов каждого
типа название
лигандов название
комплексообр. в нужной
форме
Число сложных лигандов: бис-, трис-,
тетракис-, пентакис- …
[M(En)4] – тетракис(этилендиамин)…
[M(SO42-)2] бис(сульфато-)…
59.
Номенклатура катионных комплексов• Греческим числительным называют число лигандов:
1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса
• Называют лиганды:
а) нейтральные молекулы (Н2О – аква; NH3 – аммин;
СО – карбонил;
NO – нитрозил.
б) лиганды-анионы называют с окончанием «-о»:
ОН- – гидроксо; CI- – хлоро; Br- – бромо; I- – иодо;
NO2- – нитро; NO3- – нитрато; SO42- – сульфато;
CN- – циано; SCN- – родано.
• Называют комплексообразователь русским
наименованием в родительном падеже.
• Отмечают валентность комплексообразователя
римской цифрой в скобках.
60.
Строение комплексных соединений. Классификация. НоменклатураПример:
II
[Cu(NH3)4]Cl2
Хлорид тетраамминмеди(II)
H2O – аква
NH3 – аммин
Cl- – хлороNO2- – нитро
CN- – цианоSCN- – родано-
1 – моно
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
61.
Строение комплексных соединений. Классификация. НоменклатураПримеры:
[AgI(NH3)2]OH – гидроксид
диамминсеребра(I);
[CoIII(NH3)6]Cl3 – хлорид
гексаамминкобальта(III);
[Cr2III(OH)2(NH3)9]Cl4 – хлорид
нонаамминдигидроксодихрома(III).
62.
Номенклатура анионных комплексов• Греческим числительным называют число
лигандов.
• Называют лиганды.
• Называют комплексообразователь латинским
наименованием с суффиксом «-ат».
• Отмечают валентность
комплексообразователя римской цифрой в
скобках.
63.
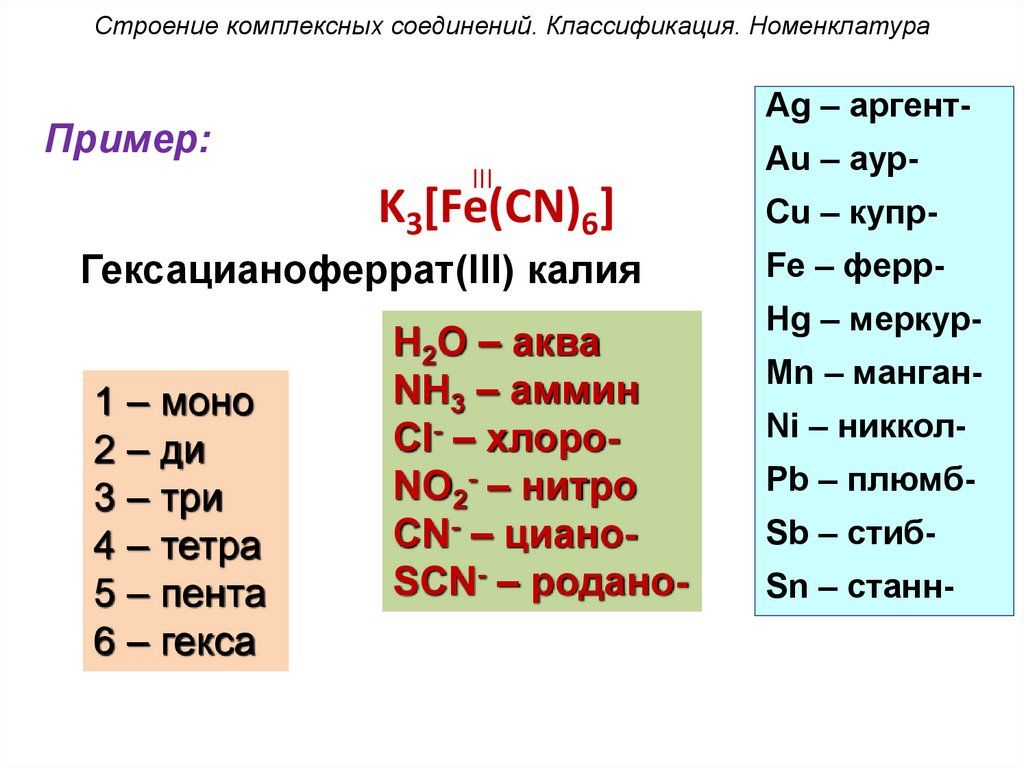
Строение комплексных соединений. Классификация. НоменклатураAg – аргент-
Пример:
III
K3[Fe(CN)6]
Гексацианоферрат(III) калия
1 – моно
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
H2O – аква
NH3 – аммин
Cl- – хлороNO2- – нитро
CN- – цианоSCN- – родано-
Au – аурCu – купрFe – ферр-
Hg – меркурMn – манганNi – никкол-
Pb – плюмбSb – стибSn – станн-
64.
Строение комплексных соединений. Классификация. НоменклатураПримеры:
[Ag(CN)2]– – дицианоаргентат(I)-ион
Ag – аргентAu – аурCu – купр-
K2[HgI4] – тетраиодомеркурат(II)
калия
Fe – ферр-
K2[PtCl6] – гексахлороплатинат(IV)
калия
Mn – манган-
Hg – меркурNi – никкол-
Pb – плюмбSb – стибSn – станн-
65.
Номенклатура нейтральных комплексов• Греческим числительным называют
число лигандов.
• Называют лиганды.
• Называют комплексообразователь
русским наименованием в именительном
падеже.
• Валентность комплексообразователя не
указывают.
66.
Строение комплексных соединений. Классификация. НоменклатураПример:
0
[Ni(CO)4]
Гексацианоферрат(III) калия
H2O – аква
NH3 – аммин
Cl- – хлороNO2- – нитро
CN- – цианоSCN- – родано-
1 – моно
2 – ди
3 – три
4 – тетра
5 – пента
6 – гекса
67.
Строение комплексных соединений. Классификация. НоменклатураПримеры:
[Co2(CO)8] – октакарбонилдикобальт;
[Al2Cl6] – гексахлородиалюминий;
[CoIIICl3(NH3)3] – триамминтрихлорокобальт;
[CoII(NO2)2(H2O)4] – тетрааквадинитрокобальт.
68.
Типы комплексныхсоединений
1. Аквакомплексы
В водных растворах:
• [Be(H2O)4]2+
• [Al(H2O)6]3+
• [Cr(H2O)6]3+ …
Кристаллогидраты:
• [Be(H2O)4]SO4
• [Al(H2O)6]Cl3
• [K(H2O)6][Cr(H2O)6](SO4)2
• [Cu(H2O)4]SO4·H2O
• [Ni(H2O)6]SO4·H2O
M
: OH2
69.
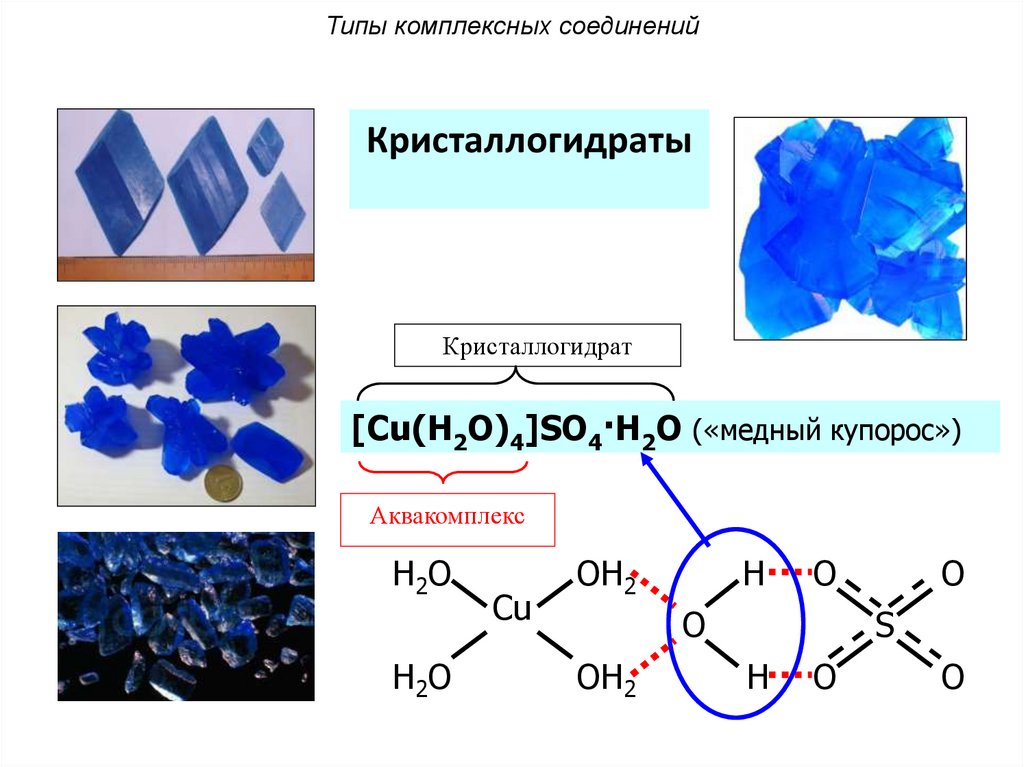
Типы комплексных соединенийАквакомплексы
Кристаллогидраты
Кристаллогидрат
[Cu(H2O)4]SO4·H2O («медный купорос»)
Аквакомплекс
H2 O
H2 O
Cu
OH2
H
O
O
OH2
O
S
H
O
O
70.
Типы комплексных соединенийАквакомплексы
Кристаллогидрат
[Fe(H2O)6]SO4·H2O («железный купорос»)
Аквакомплекс
H2O
H2 O
H2 O
Fe
OH2
OH2
H
O
O
OH2
O
S
H
O
O
71.
Типы комплексных соединений2. Гидроксокомплексы
[Zn(OH)4]2–
M
: OH–
72.
Типы комплексных соединений3. Аммины (аммиакаты)
[Ag(NH3)2]+
[Cu(NH3)4](OH)2
M
: NH3
[Ni(NH3)6]Cl2
73.
Типы комплексных соединенийаммиакаты
74.
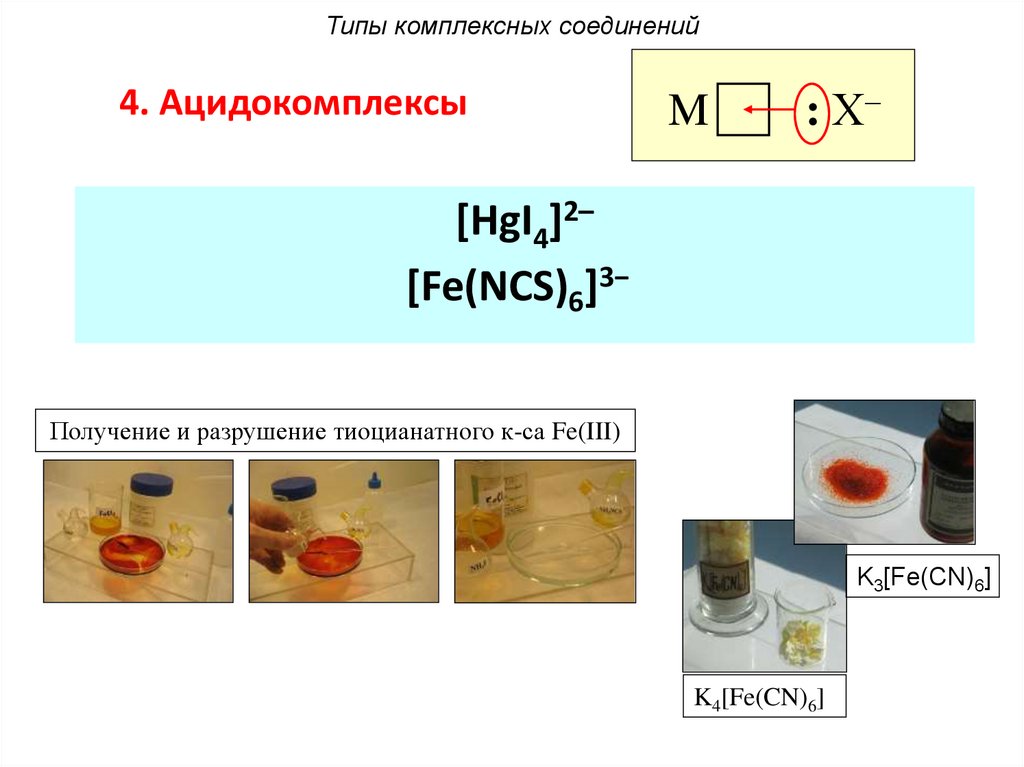
Типы комплексных соединений4. Ацидокомплексы
M
: Х–
[HgI4]2–
[Fe(NCS)6]3−
Получение и разрушение тиоцианатного к-са Fe(III)
K3[Fe(CN)6]
K4[Fe(CN)6]
75.
Типы комплексных соединений5. Гидридокомплексы
M
: H–
Na[BH4]
Al[BH4]3
Li[AlH4]
Na[BH4]
76.
Устойчивость комплексных соединенийРазличают первичную и вторичную диссоциацию
комплексных соединений.
а) Первичная диссоциация – это диссоциация
комплексной соли на внутреннюю сферу и
ионы внешней сферы.
Идет легко по принципу сильных электролитов:
[Ag(NH3)2]Cl
[Ag(NH3)2]+ + Cl-
77.
Устойчивость комплексных соединенийб) Вторичная диссоциация – диссоциация
внутренней сферы:
[Ag(NH3)2]+
[Ag(NH3)]+
[Ag(NH3)]+ + NH3
Ag+ + NH3
[Ag(NH3)2]+
Ag+ + 2NH3
Она протекает незначительно.
78.
Устойчивость комплексных соединенийУстойчивость комплексных ионов
характеризуется константой нестойкости (Кн),
которая определяется на основании закона
действующих масс.
[Ag+] [NH3]2
= 5,89.10-8
KH =
[ [Ag(NH3)2]+]
79.
Константы нестойкости некоторых комплексовКомплексный ион
[Fe(CN)6]3[Fe(CN)6]4[Co(NH3)6]2+
[Ag(NH3)2]+
[Cu(NH3)4]2+
[Zn(OH)4]2–
Константа нестойкости
1,0 . 10–31
1,0 . 10–36
7,75 . 10–6
9,31 . 10–8
2,14 . 10–13
3,6 . 10–16
80.
Устойчивость комплексных соединенийКонстанта нестойкости характеризует
термодинамическую устойчивость комплекса,
которая зависит от прочности связей между
центральным атомом и лигандами.
Чем меньше значение Кн, тем более
прочен комплекс, тем он устойчивее, и
наоборот.
81.
Устойчивость комплексных соединенийМерой прочности комплекса является
энергия разрыва связей, величина которой
характеризуется изменением энергии Гиббса
(∆G) в результате вторичной диссоциации.
Уравнение изотермы:
G RT ln Kнест.
0
G 2,303RT lg Kнест. , где:
0
R = 8,314 Дж · моль-1 · К-1
T – температура, К
ln К = 2,303 . Lg К
82.
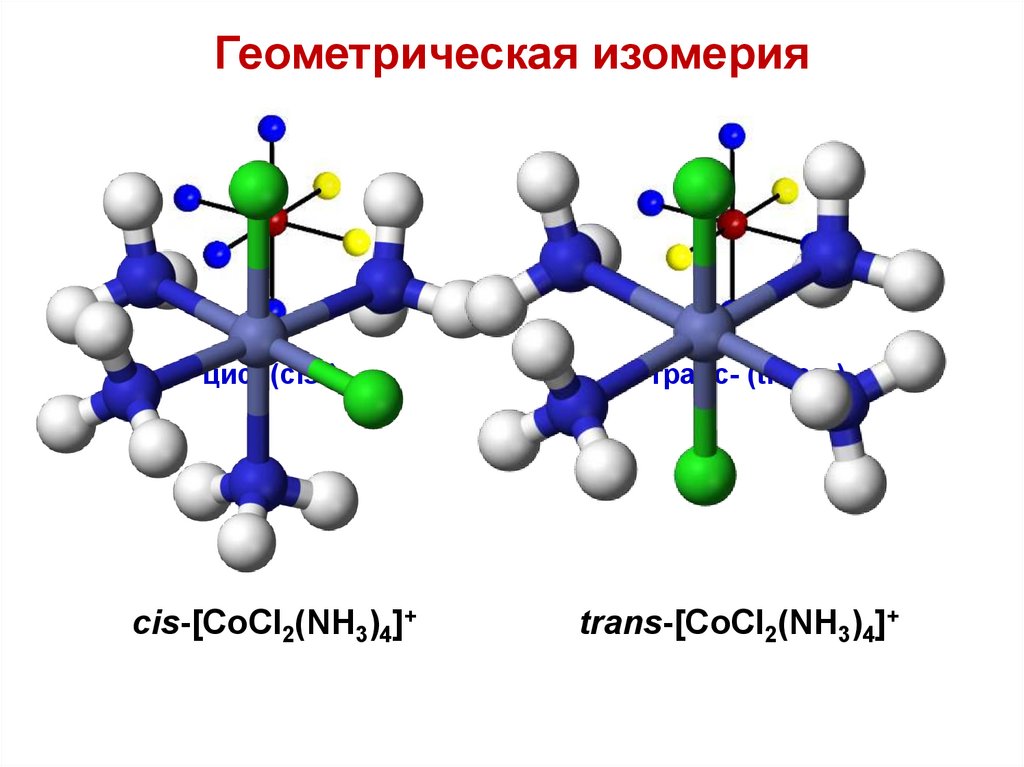
Изомерия комплексных соединенийДля комплексных соединений характерны
следующие виды изомерии: сольватная (в
водных средах гидратная), ионизационная,
координационная, геометрическая,
оптическая (зеркальная).
При изучении химиотерапии особое
место занимает геометрическая изомерия
или изомерия положения у комплексов,
содержащих не менее двух разных
лигандов.
83.
Геометрическая изомерияцис- (cis-)
транс- (trans-)
cis-[CoCl2(NH3)4]+
trans-[CoCl2(NH3)4]+
84.
Геометрическая изомерияНапример:
[PtCl2(NH3)2] диамминдихлороплатина
Соль Пейроне
Хлорид второго основания Рейзе
1844 г. М. Пейроне
Cl
NH3
Cl
Pt
Cl
NH3
Pt
NH3
NH3
Cl
Цис-изомер
Транс-изомер
Оранжево-желтый
Светло-желтый
Противоопухолевая активность!
85.
Сольватная изомерия[Cr(H2O)6]Cl3
Фиолетовый
[CrCl(H2O)5]Cl2
Светло-зеленый
[CrCl2(H2O)4]Cl
Темно-зеленый
86.
Оптическая изомерияОтражение
Отражение
[Co(En)2]3+
87.
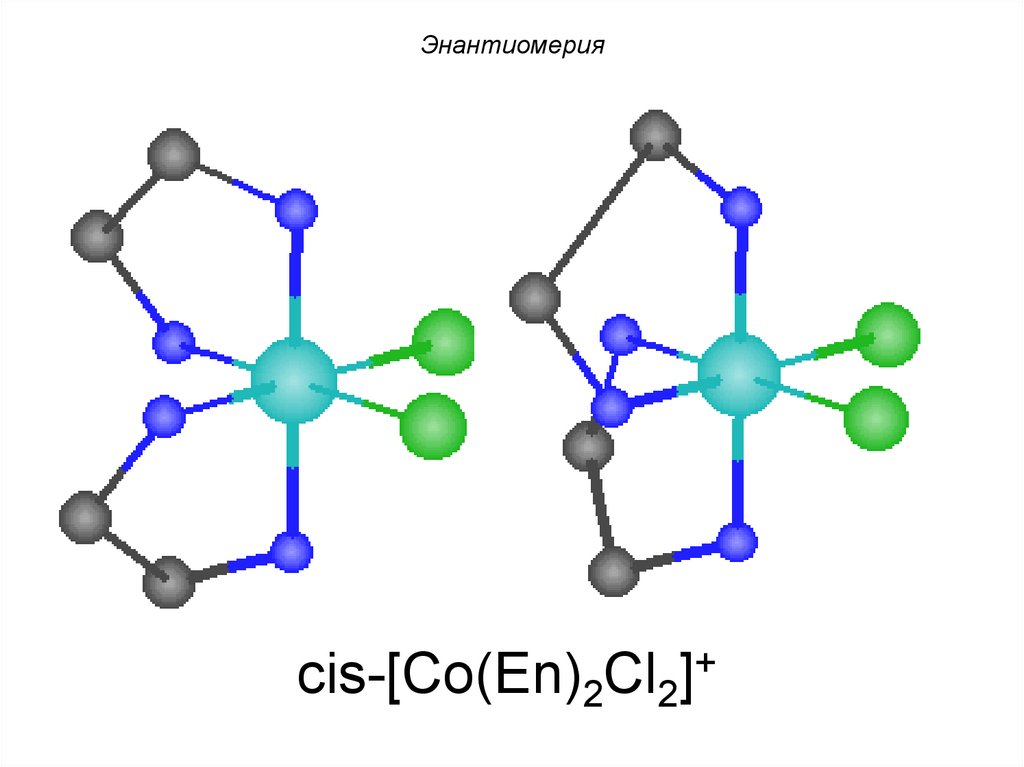
mirror planeПример:
Энантиомерия
cis-[Co(En)2Cl2]+
88.
Энантиомерия180 °
89.
Энантиомерияenantiome
rs
cis-[Co(En)2Cl2]+
90.
Хелаты. КомплексоныЛиганды могут присоединяться к
комплексообразователю посредством
одного или нескольких атомов, т.е. лиганды
обладают координационной емкостью –
дентатностью.
Монодентатные лиганды
присоединяются к комплексообразователю
одним атомом и образуют одну
координационную связь.
Например: H2O, NH3, Cl-, CN-, OH- и др.
91.
Хелаты. Комплексоны. Краун-эфирыПолидентатные лиганды присоединяются
к
комплексообразователю
посредством
нескольких
атомов.
Например:
многофункциональные
органические
соединения.
Большое практическое значение имеют
комплексоны – полидентатные лиганды,
содержащие несколько
функциональных
групп и образующие прочные комплексы
практически
со
всеми
двухзарядными
ионами металлов (Ca2+, Mg2+, Zn2+, Cu2+,
Pt2+…).
92.
Хелаты. Комплексоны. Краун-эфирыНапример, комплексон-I содержит
два атома азота. За счет электронных пар этих
атомов этилендиамин присоединяется к
комплексообразователю двумя
координационными связями.
NH2
CH2 CH2
NH2
Этилендиамин
En
2+
бис(этилендиамин)меди(II)
93.
Хелаты. Комплексоны. Краун-эфиры[Pt2+(Еn)2]2+
бис(этилендиамин)платина(II)
94.
Хелаты. Комплексоны. Краун-эфиры[Co3+(Еn)3]3+
трис(этилендиамин)кобальт(III)
95.
Хелаты. Комплексоны. Краун-эфирыДля удобства координации молекулы
полидентатных лигандов сворачиваются в циклы. В
таких комплексах комплексообразователь зажат
«клешней» лигандов.
Комплексы, содержащие полидентатные
лиганды, называются хелатами (от греч.
chelate – клешня).
Термин «хелат»,
1920 г. Морган и Дрю
Ni2+
96.
Хелаты. Комплексоны. Краун-эфирыОбычно хелаты гораздо устойчивее комплексных
соединений, содержащих монодентатные лиганды,
т.к. комплексообразователь связан с лигандами
несколькими донорно-акцепторными связями.
Наиболее известными комплексонами
высшего порядка являются:
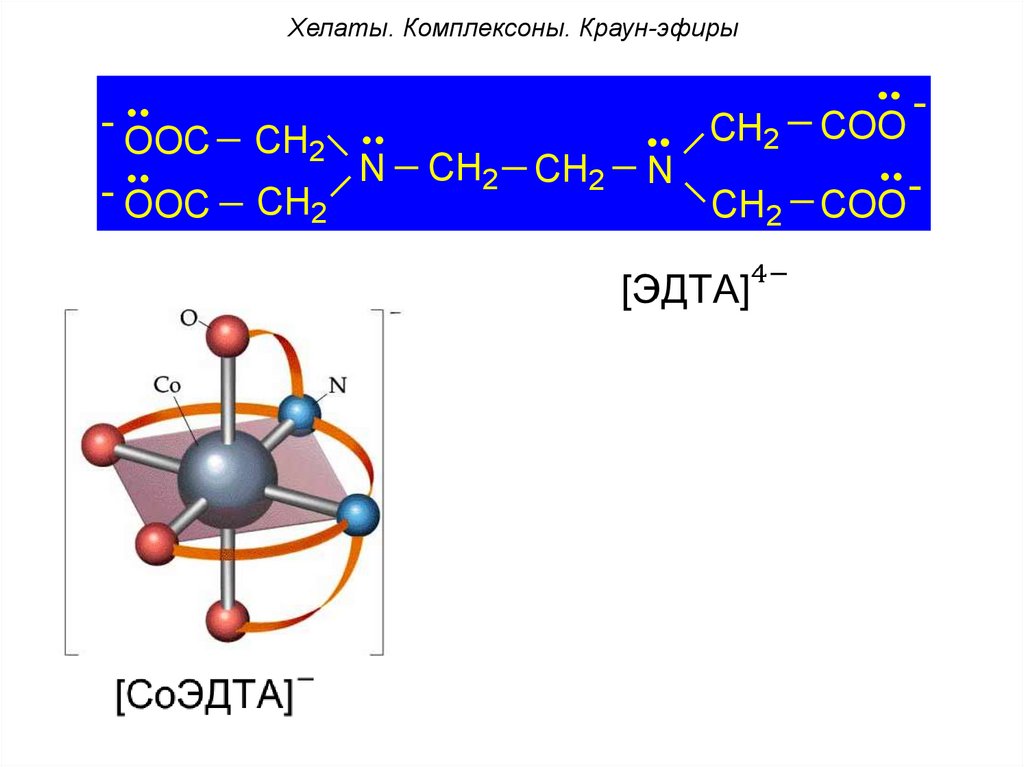
• комплексон-II – этилендиаминтетрауксусная
кислота (ЭДТА),
• комплексон-III – двузамещенная натриевая
соль ЭДТА – Трилон Б: Na2[H2Tr].
97.
Хелаты. Комплексоны. Краун-эфиры-
OOC
CH2
- OOC
CH2
N
CH2 CH2
N
-
CH2
COO
CH2
COO
98.
Хелаты. Комплексоны. Краун-эфирыТрилон Б широко используется в
клиническом анализе для титриметрического
определения ионов Са2+ и Мg2+ при
определении жесткости воды. Максимальная
дентатность такого лиганда равна 6.
99.
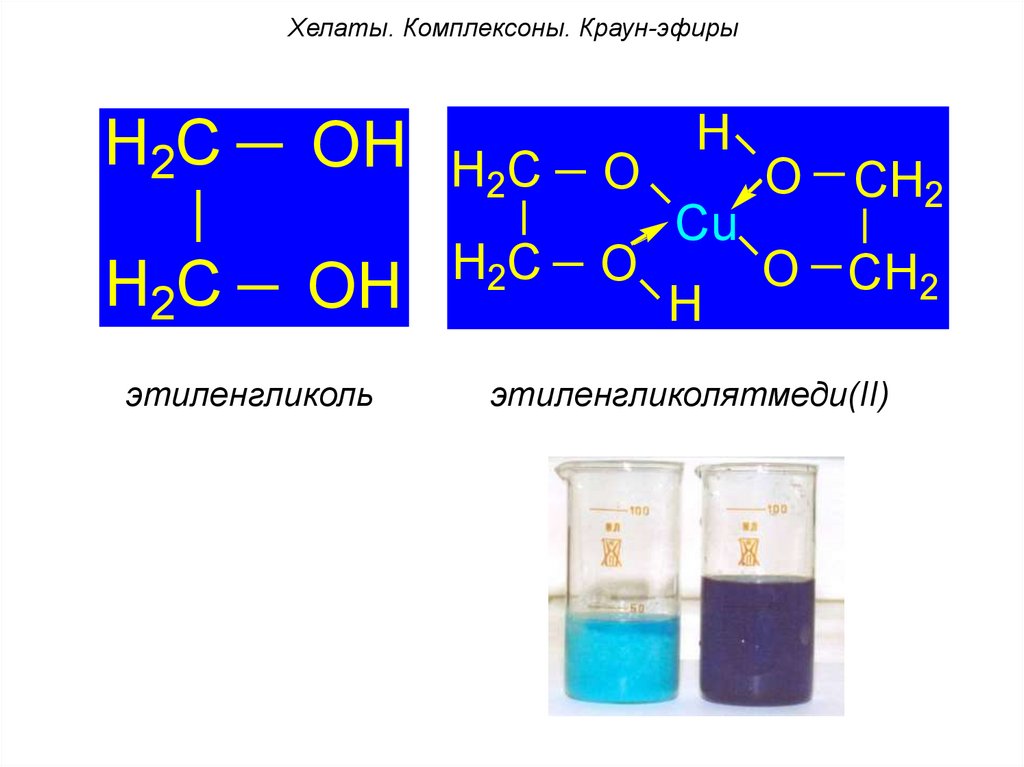
Хелаты. Комплексоны. Краун-эфирыH2C
H2C
OH H2C
O
H2C
O
OH
этиленгликоль
H
Cu
H
O
CH2
O CH2
этиленгликолятмеди(II)
100.
Хелаты. Комплексоны. Краун-эфирыОсобый тип полидентатных лигандов
представляет собой циклические эфиры или
краун-эфиры (от анг. crown – корона).
В них донорные атомы кислорода заключены
в плоский цикл определенного размера.
Краун-эфиры содержат от 4 до 12 атомов
кислорода (краун-4, краун-5 и т.д).
Полости краун-эфиров имеют строго
определенные размеры. Поэтому краун-эфиры
могут избирательно связывать ионы металлов,
размеры которых близки к размерам полости.
101.
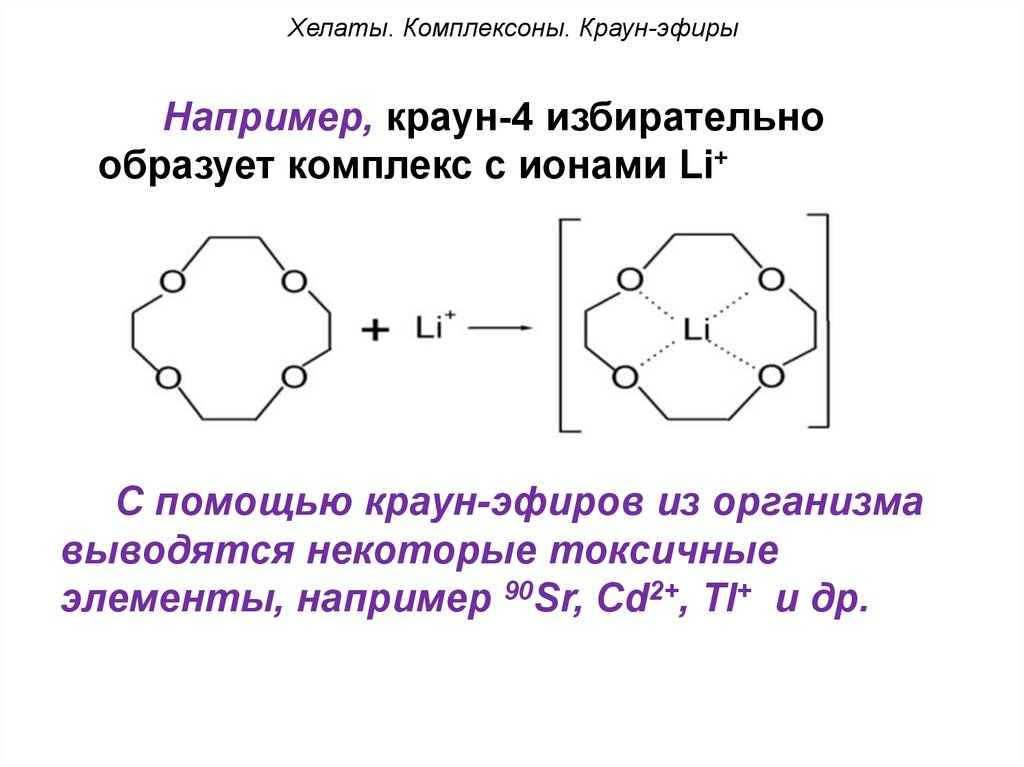
Хелаты. Комплексоны. Краун-эфирыНапример, краун-4 избирательно
образует комплекс с ионами Li+
+
С помощью краун-эфиров из организма
выводятся некоторые токсичные
элементы, например 90Sr, Cd2+, Tl+ и др.
102.
СПАСИБО ЗАВАШЕ
ВНИМАНИЕ!














































































 Химия
Химия








