Похожие презентации:
Фосфор
1. Фосфор. Оксид фосфора (V) и фосфорная кислота, физические и химические свойства, получение.
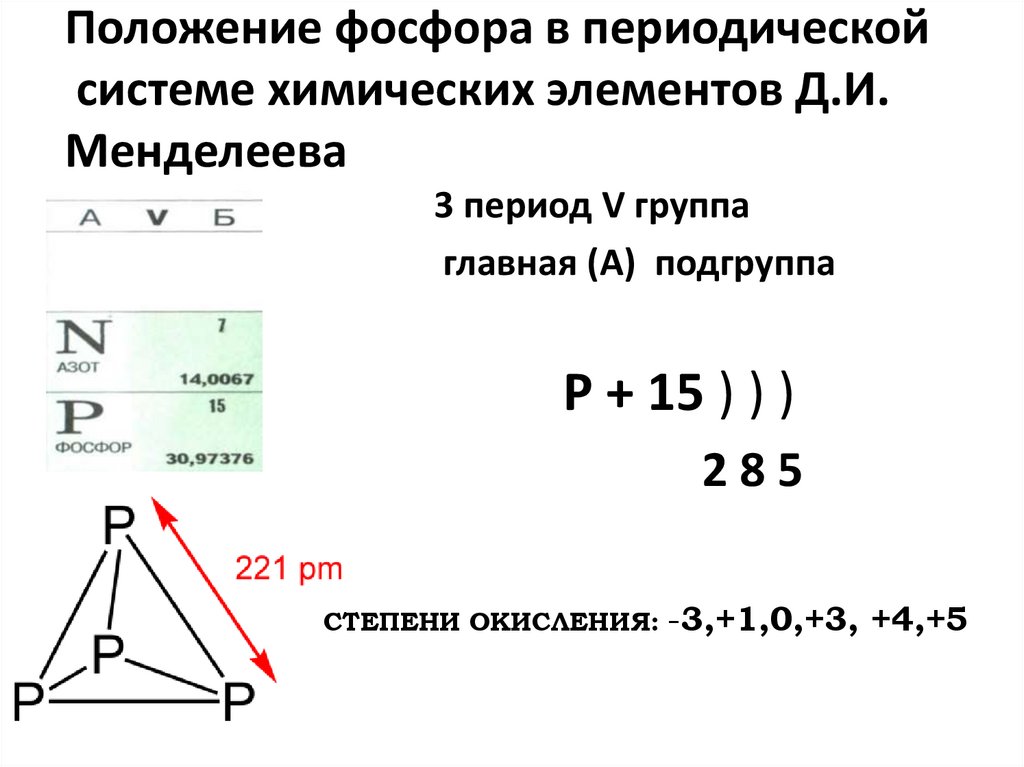
2. Положение фосфора в периодической системе химических элементов Д.И. Менделеева
3 период V группаглавная (А) подгруппа
P + 15 ) ) )
285
СТЕПЕНИ ОКИСЛЕНИЯ: -3,+1,0,+3, +4,+5
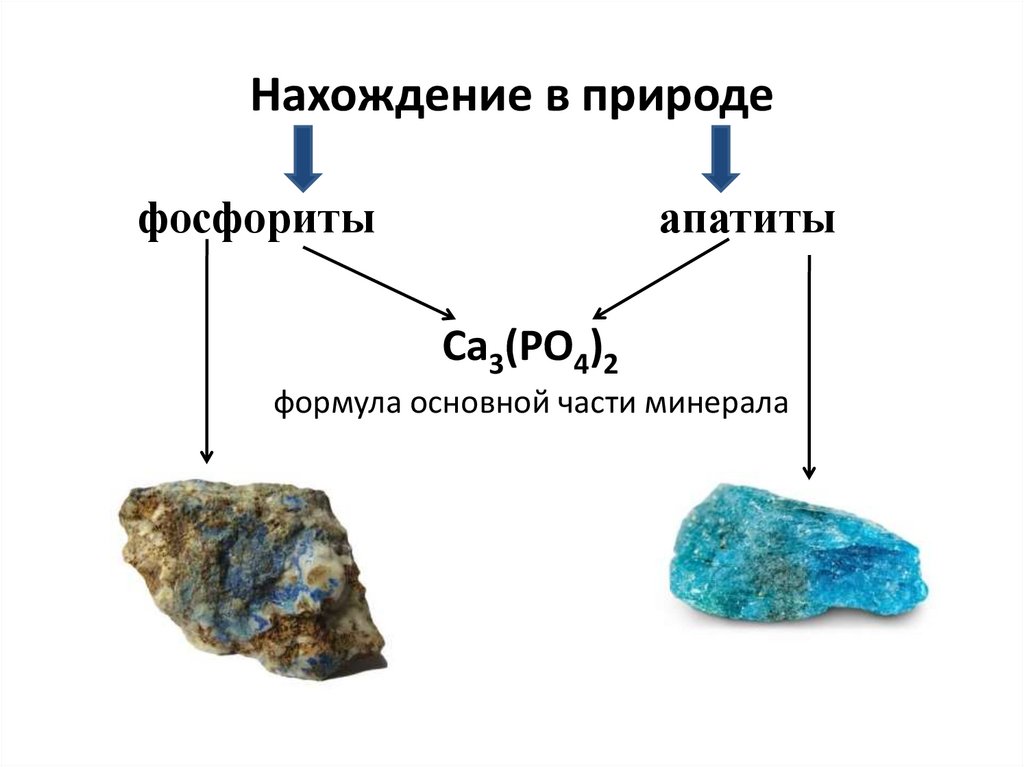
3. Нахождение в природе
фосфоритыапатиты
Ca3(PO4)2
формула основной части минерала
4. Физические свойства фосфора
• Твердое вещество;• в воде не растворяется;
• легкорастворим в органических
растворителях.
5. Аллотропные модификации фосфора
Простые вещества, образованные атомами одного и того же элемента,отличаются строением и свойствами.
Белый
Желтый
Красный
Химически
активен,
ядовит,
светится
Ядовит,
огнеопасен,
самовоспла
меняется
Не ядовит,
самовоспламе
няется при
трении или
ударе, не
светится
Черный
Металлический
Образуется при
нагревании
белого фосфора
без доступа
воздуха, не
ядовит, не
огнеопасен, не
светится,
химически не
активен
Химически не
активен,
хорошо
проводит
электрический
ток
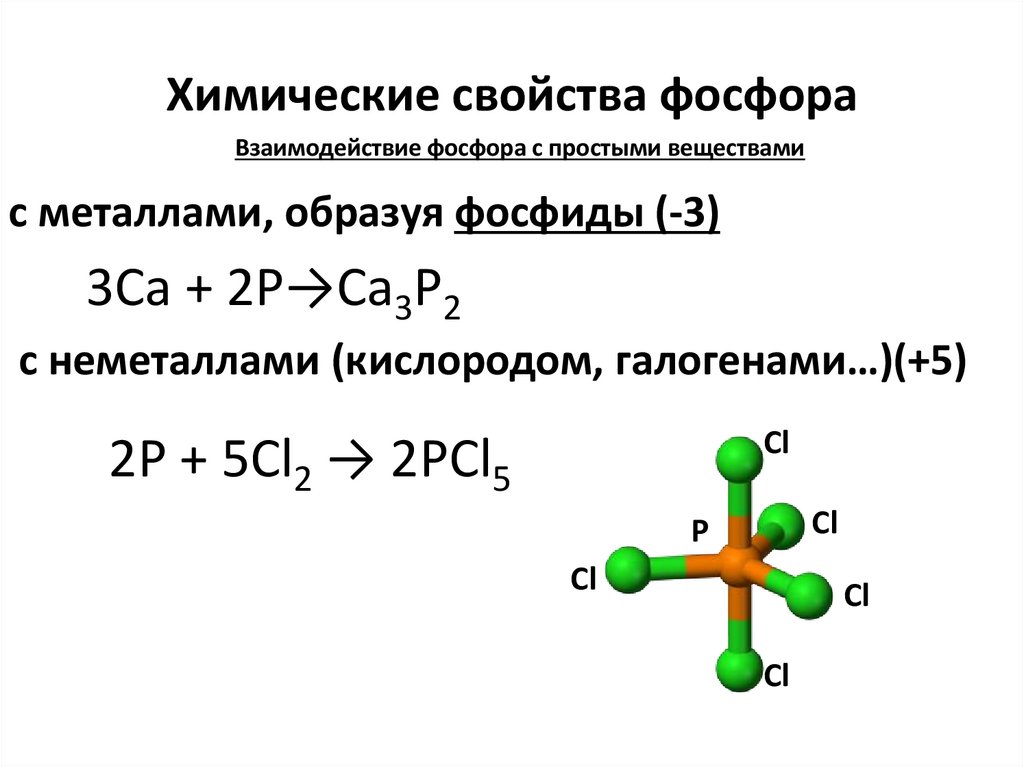
6. Химические свойства фосфора
Взаимодействие фосфора с простыми веществамис металлами, образуя фосфиды (-3)
3Са + 2Р→Са3Р2
с неметаллами (кислородом, галогенами…)(+5)
Cl
2P + 5Cl2 → 2РСl5
Cl
P
Cl
Cl
Cl
7.
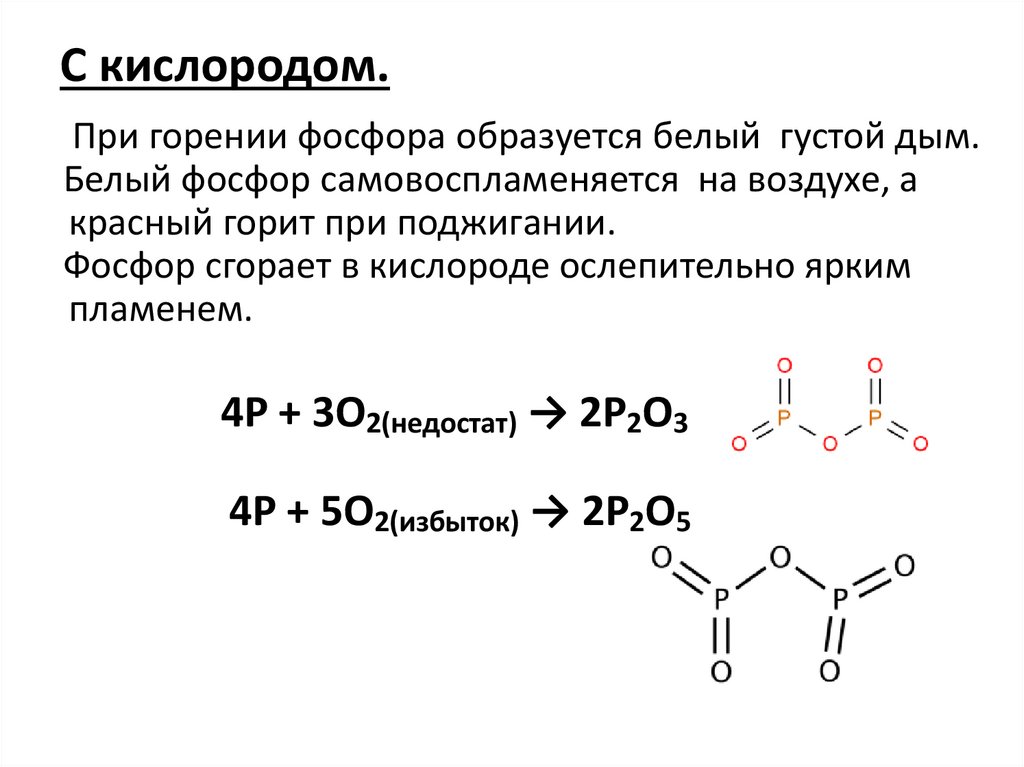
С кислородом.При горении фосфора образуется белый густой дым.
Белый фосфор самовоспламеняется на воздухе, а
красный горит при поджигании.
Фосфор сгорает в кислороде ослепительно ярким
пламенем.
4P + 3O2(недостат) → 2P2O3
4P + 5O2(избыток) → 2P2O5
8. Взаимодействие фосфора с сложными веществами
с хлоратом калия6P + 5KClO3 → 5KCl + 3P2O5
используется в производстве спичек
9. Применение фосфора
• В медицине.• В сельском хозяйстве.
• Производство спичек.
• Производство моющих средств.
• Зажигательные бомбы, дымовые завесы.
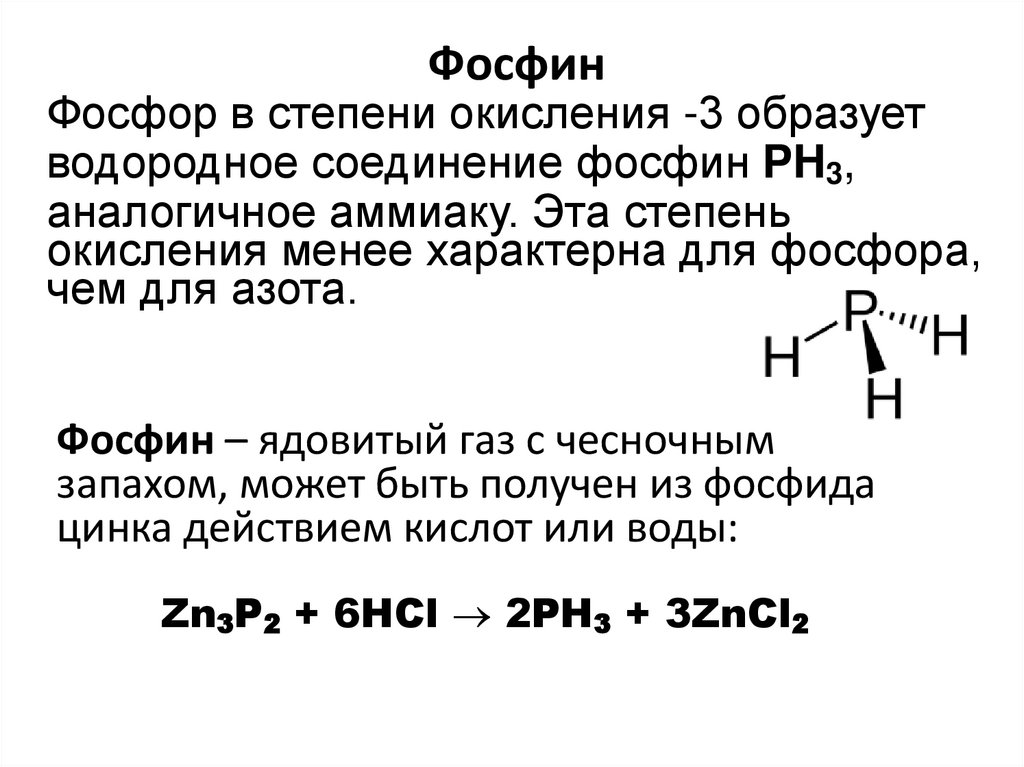
10. Фосфин
Фосфор в степени окисления -3 образуетводородное соединение фосфин PH3,
аналогичное аммиаку. Эта степень
окисления менее характерна для фосфора,
чем для азота.
Фосфин – ядовитый газ с чесночным
запахом, может быть получен из фосфида
цинка действием кислот или воды:
Zn3P2 + 6HCl 2PH3 + 3ZnCl2
11. Оксид фосфора (V)
Р2О5 - твердое, кристаллическое вещество.Гигроскопично и используется как
водоотнимающее средство.
Образуется при горении фосфора
на воздухе.
4Р + 5О2 2Р2О5
Активно соединяется с водой, а также
отнимает воду от других соединений
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
12. Химические свойства Р2О5
при обычных условиях (без нагревания), образует впервую очередь метафосфорную кислоту НРО3:
P2O5 + H2O = HPO3
при нагревании ортофосфорную кислоту Н3РО4:
P2O5 + 3H2O 2H3PO4
Как кислотный оксид, вступает в реакции с
основными оксидами и щелочами:
P2O5 + 3CaO → Ca3(PO4)2
P2O5 +3Ca(OH)2 → Ca3(PO4)2 + 3H2O
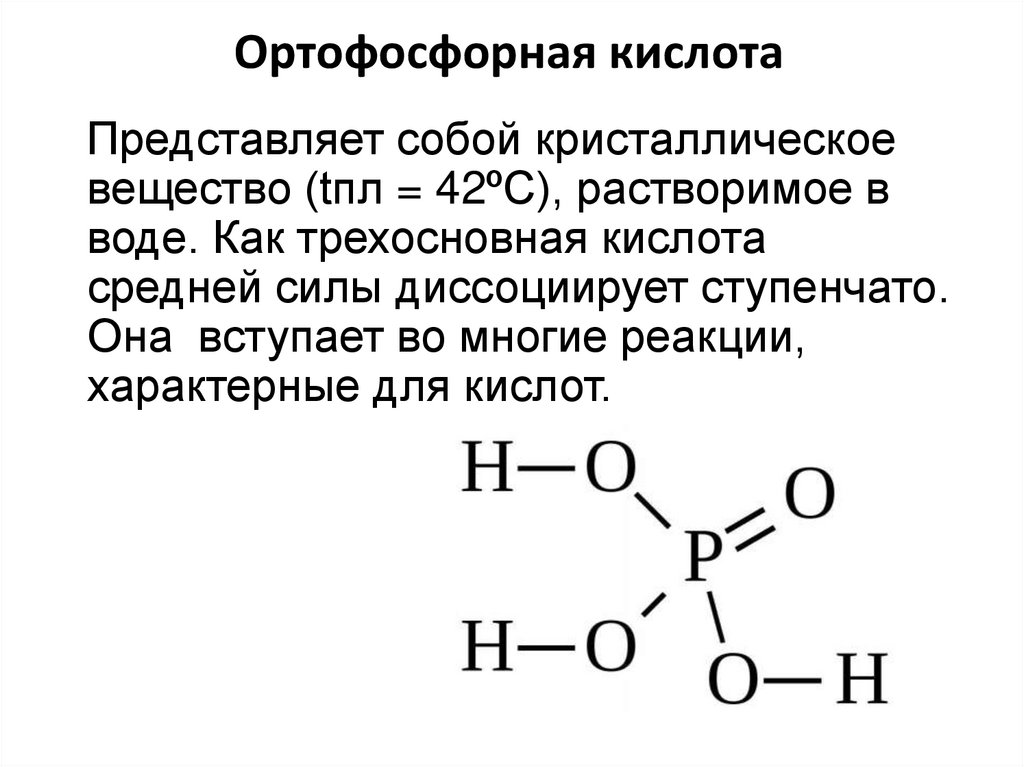
13. Ортофосфорная кислота
Представляет собой кристаллическоевещество (tпл = 42ºС), растворимое в
воде. Как трехосновная кислота
средней силы диссоциирует ступенчато.
Она вступает во многие реакции,
характерные для кислот.
14.
В промышленности фосфорную кислоту получаютдействием серной кислоты на фосфорит:
Ca3(PO4)2 + 3H2SO4 3CaSO4 + 2H3PO4
Термический способ. Заключается в сжигании
фосфора до оксида фосфора(V) и реакции
последнего с водой.
P2O5 +3H2O → 2H3PO4
Лабораторный метод. Заключается в окислении
фосфора азотной кислотой.
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO↑.
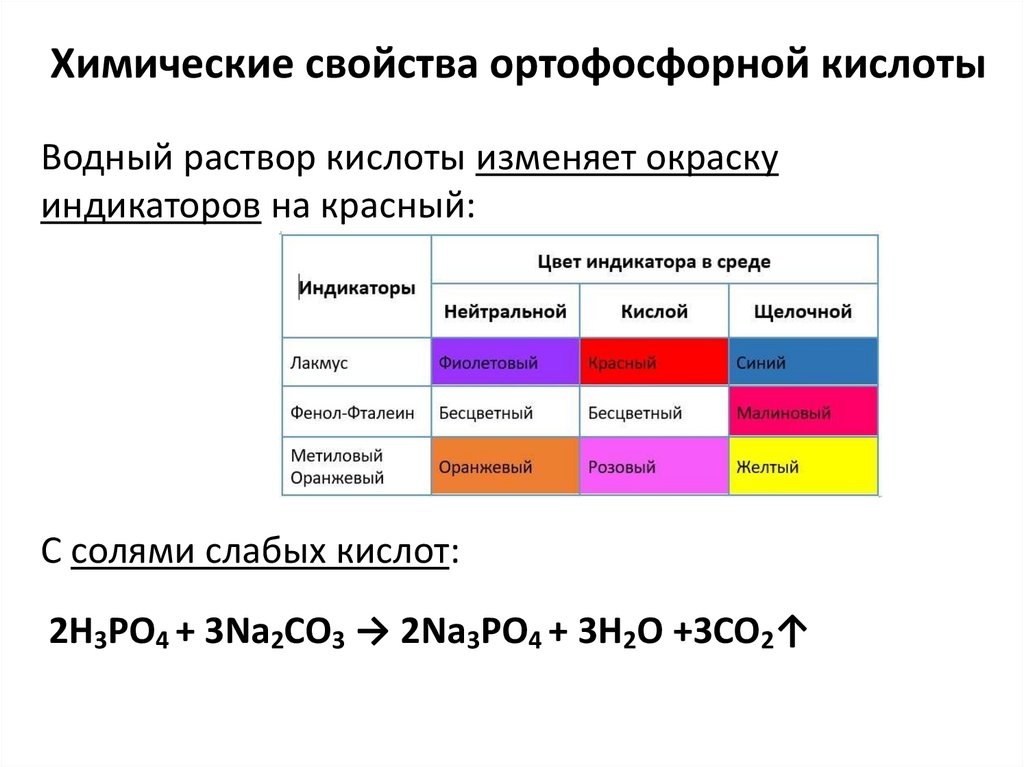
15. Химические свойства ортофосфорной кислоты
Водный раствор кислоты изменяет окраскуиндикаторов на красный:
С солями слабых кислот:
2H3PO4 + 3Na2CO3 → 2Na3PO4 + 3H2O +3CO2↑
16. Химические свойства ортофосфорной кислоты
Ортофосфорная кислота диссоциирует ступенчато:H3PO4 ↔ H+ + H2PO4-(дигидроортофосфат-ион)
H2PO4- ↔ H+ + HPO42-(гидроортофосфат-ион)
HPO42- ↔ H+ + PO43-(ортофосфат-ион)
При нагревании постепенно превращается в
метафосфорную кислоту:
2H3PO4 → H4P2O7 + H2O
дифосфорная кислота
H4P2O7 → 2HPO3 + H2O
метафосфорная кислот
17. Химические свойства ортофосфорной кислоты
С металлами, стоящими в ряду напряженияметаллов до водорода:
3Mg + 2H3PO4 Mg3(PO4)2 + 3H2↑
С основными оксидами:
3CaO + 2H3PO4 Сa3(PO4)2 + 3H2O
С основаниями:
H3PO4 + КOH → КH2PO4 + H2O
H3PO4 + 2КOH → К2HPO4 + 2H2O
H3PO4 + 3КOH → К3PO4 + 3H2O
С аммиаком:
H3PO4 + NH3 → (NH4)2HPO4
18. Химические свойства ортофосфорной кислоты
При действии раствора нитрата серебра появляетсяжелтый осадок:
H3PO4 + 3AgNO3 → Ag3PO4 ↓ + 3HNO3
желтый осадок
Это качественная реакция на фосфорную
кислоты и её соли – фосфаты.
19. Применение ортофосфорной кислоты
• Сельское хозяйство. Фосфорная кислота является основнымкомпонентом при производстве удобрений, в первую очередь,
фосфорных.
• Медицина. На её основе изготавливают стоматологические
гели для дентина и эмали, средства для отбеливания зубов.
• Промышленное производство. В производстве стекла,
керамики, также она увеличивает прочность и
противоударные свойства стекла и керамики.
• Пищевая промышленность. Ортофосфорная кислота марки А
(пищевая) используется для регуляции кислотности. Это
пищевая добавка Е 338, которой заменяют лимонную кислоту
в количестве не более 50% для производства безалкогольных
газированных напитков.
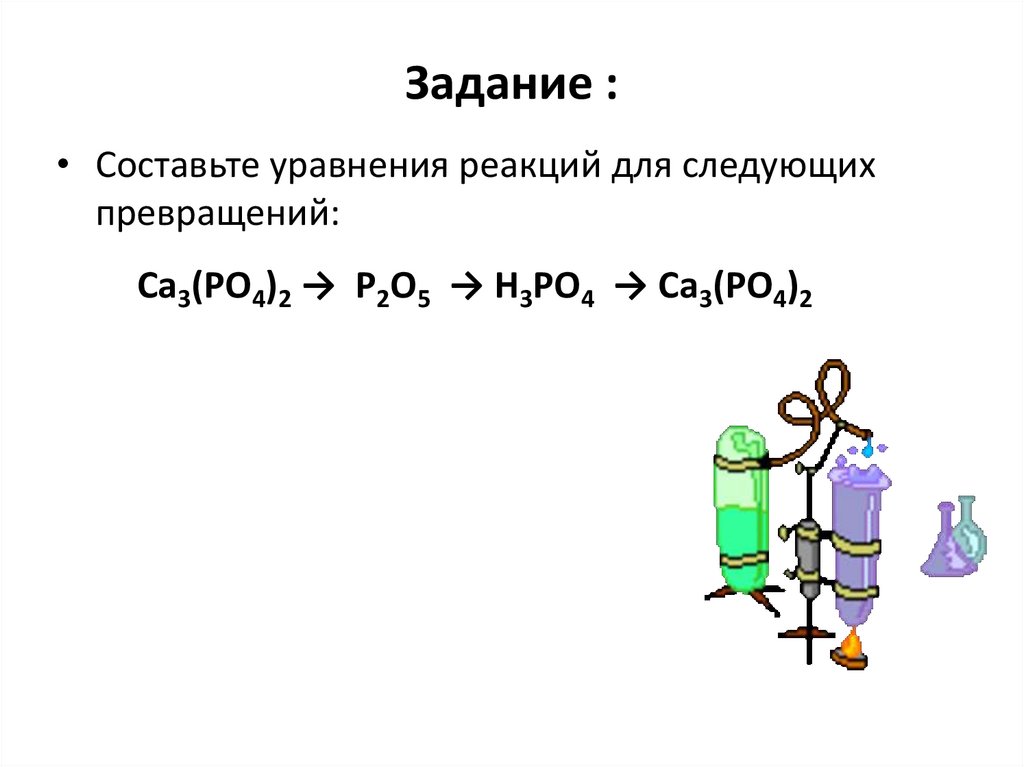
20. Задание :
• Составьте уравнения реакций для следующихпревращений:
Сa3(PO4)2 → P2O5 → H3PO4 → Ca3(PO4)2
21. Ответ :
Ca3(PO4)2 → P2O5 + 3CaOP2O5 +3H2O → 2H3PO4
3CaO + 2H3PO4 Сa3(PO4)2 + 3H2O
22. Задание :
• Составьте молекулярные и ионные уравненияреакций ортофосфорной кислоты с:
1. калием
2. гидроксидом калия
3. сульфитом калия
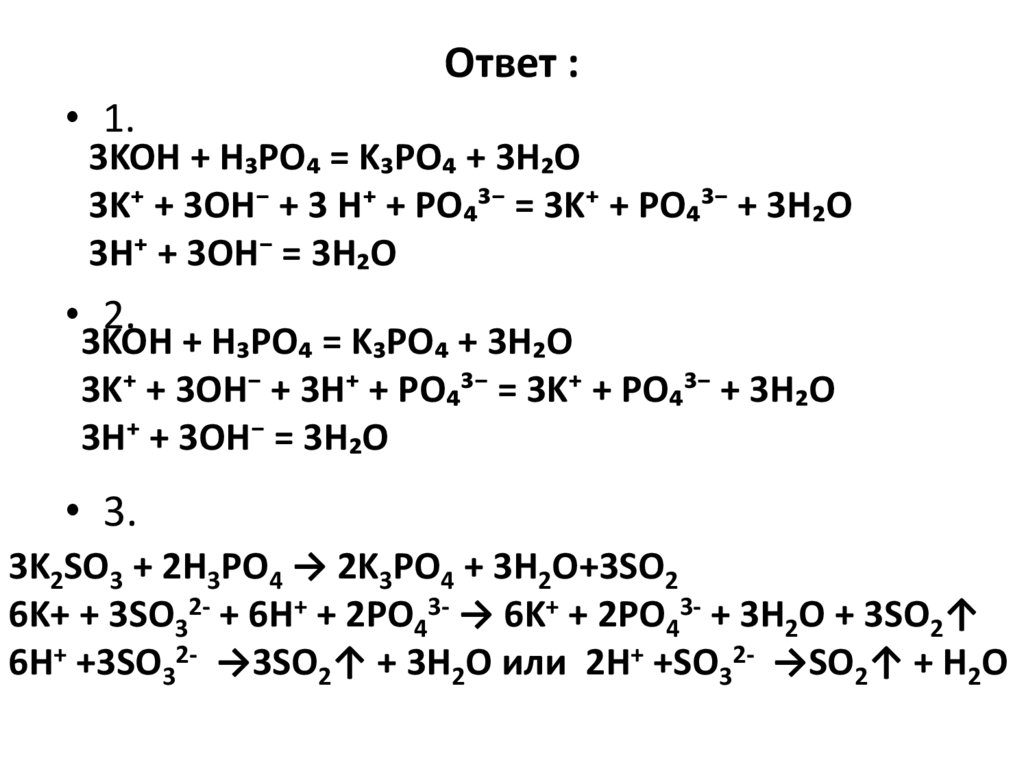
23. Ответ :
• 1.3KOH + H₃PO₄ = K₃PO₄ + 3H₂O
3K⁺ + 3OH⁻ + 3 H⁺ + PO₄³⁻ = 3K⁺ + PO₄³⁻ + 3H₂O
3H⁺ + 3OH⁻ = 3H₂O
• 2.
3KOH + H₃PO₄ = K₃PO₄ + 3H₂O
3K⁺ + 3OH⁻ + 3H⁺ + PO₄³⁻ = 3K⁺ + PO₄³⁻ + 3H₂O
3H⁺ + 3OH⁻ = 3H₂O
• 3.
3K2SO3 + 2H3PO4 → 2K3PO4 + 3H2O+3SO2
6K+ + 3SO32- + 6H+ + 2PO43- → 6K+ + 2PO43- + 3H2O + 3SO2↑
6H+ +3SO32- →3SO2↑ + 3H2O или 2H+ +SO32- →SO2↑ + H2O














 Химия
Химия








