Похожие презентации:
9кл 15 янв
1. Общая характеристика элементов VIA-группы (халькогены). Сера. Кислород
2. Элементы VI группы главной подгруппы.
OХалькогены, т.е
• S « рождающие руды».
• Se
• Te
• Po
3. Se и Te -минералов не образуют Ро - очень редкий радиоактивный элемент
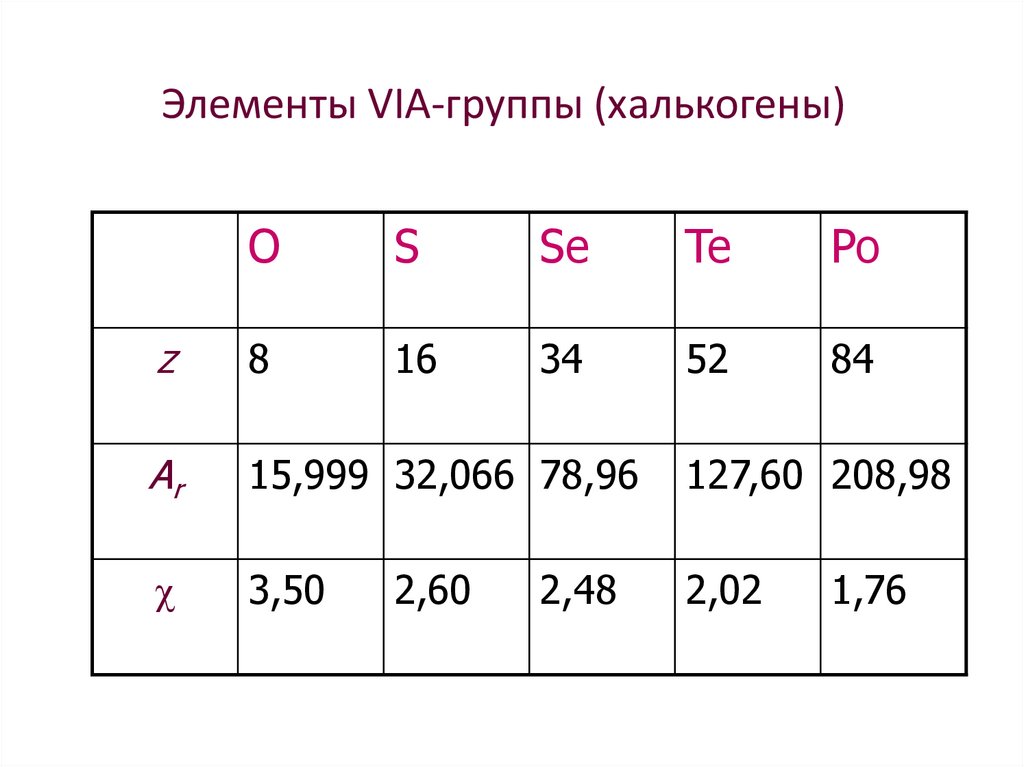
4. Элементы VIА-группы (халькогены)
OS
Se
Te
Po
z
8
16
34
52
84
Ar
15,999 32,066 78,96
127,60 208,98
3,50
2,02
2,60
2,48
1,76
5. Сера
6.
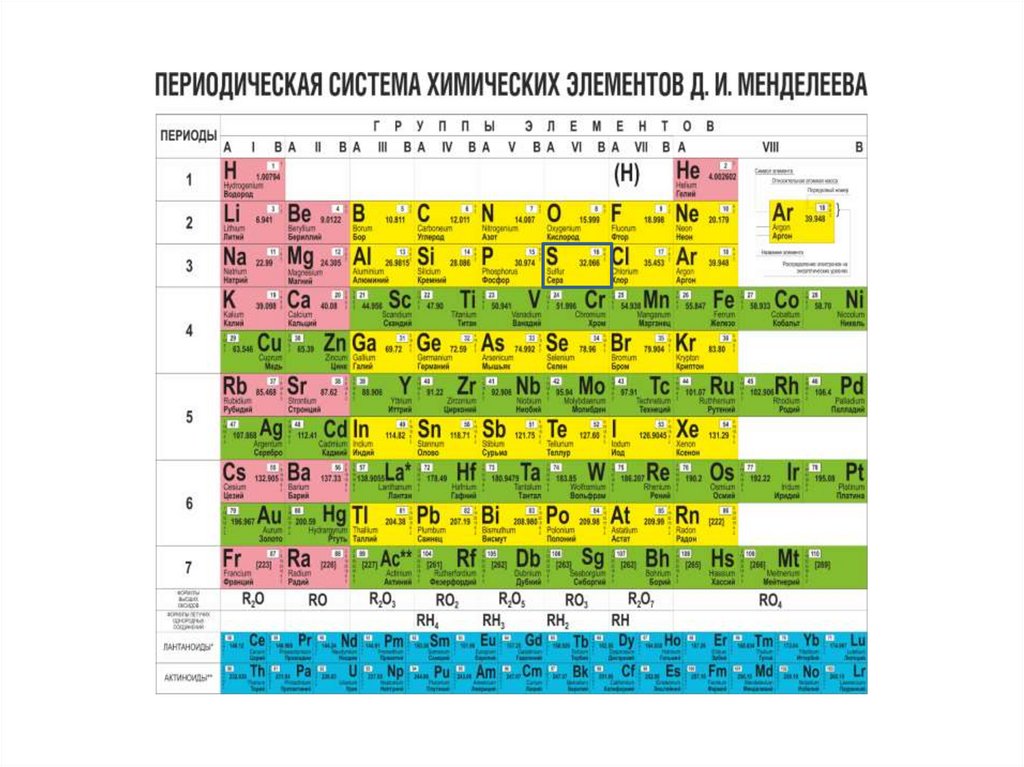
7. Сера- химический элемент
• Сера - химическийэлемент ΙΙΙ( малого)
периода,3 ряда, VΙ(А)
группы
• Атомный номер 16
• Заряд ядра +16
• Атомная масса 32,066
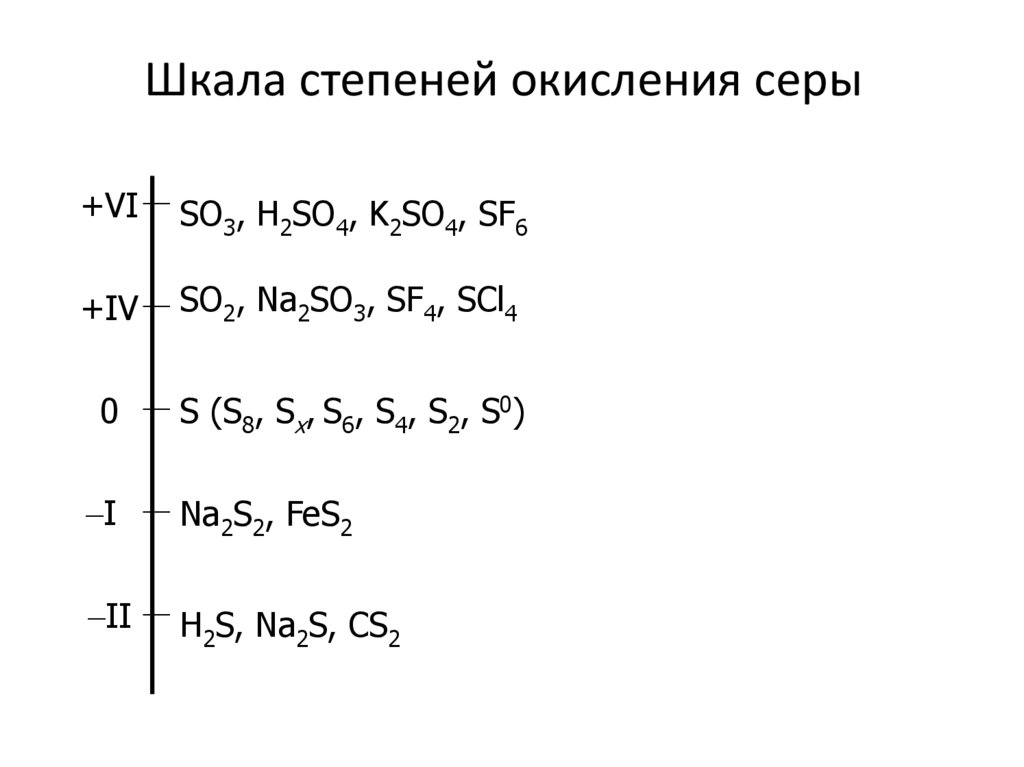
8. Шкала степеней окисления серы
+VISO3, H2SO4, K2SO4, SF6
+IV
SO2, Na2SO3, SF4, SCl4
0
S (S8, Sx, S6, S4, S2, S0)
I
Na2S2, FeS2
II
H2S, Na2S, CS2
9.
10.
11.
12.
— твердое агрегатноесостояние
— желтого цвета
— не растворима в воде
— не смачивается водой
— растворяется в
органических
растворителях
13.
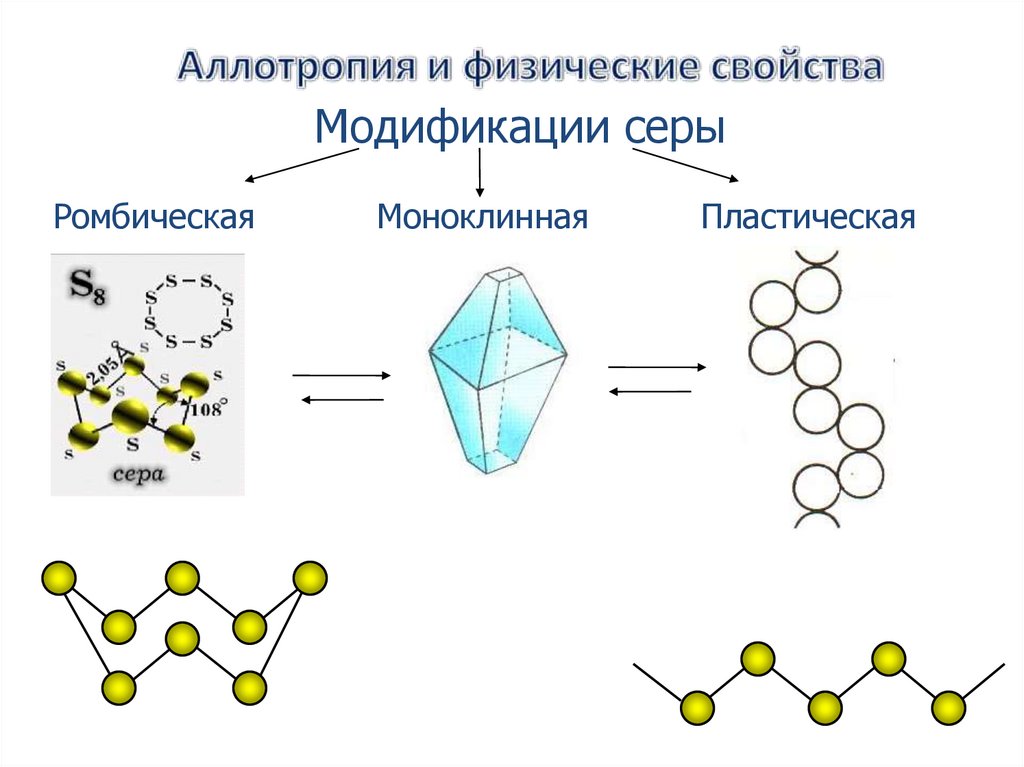
Модификации серыРомбическая
Моноклинная
Пластическая
14.
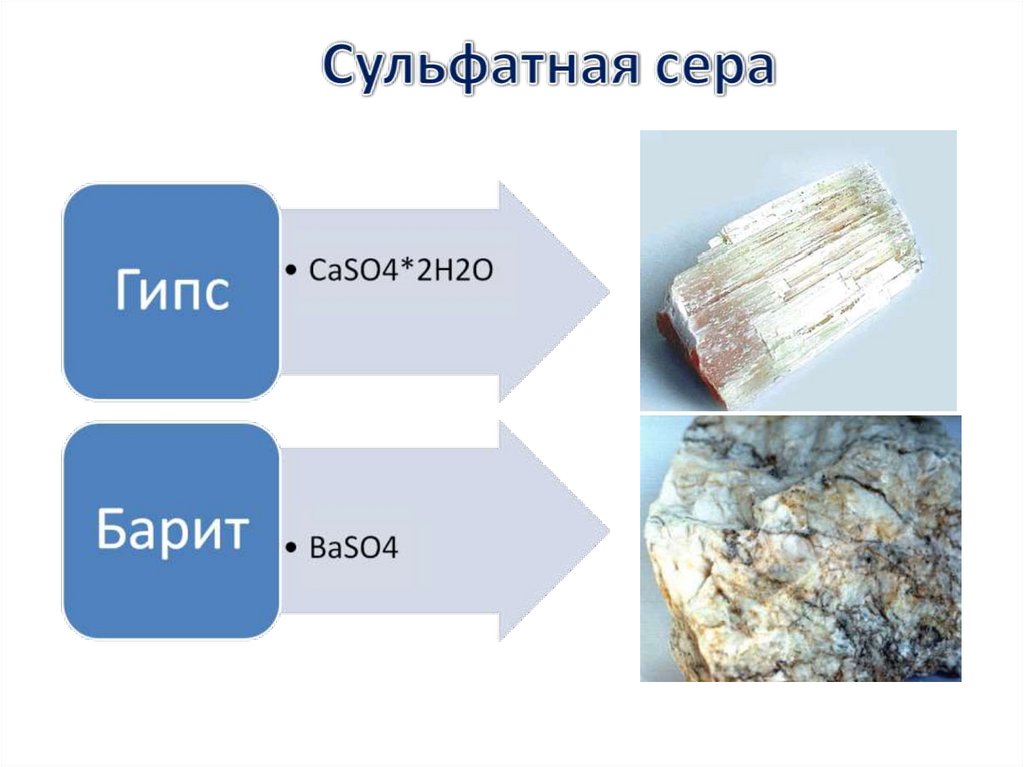
В природе сера встречается как в виде самородной серы, так и всоставе минералов и горных пород, таких как сульфиды и сульфаты.
15.
Обычная ромбическая сера состоит из циклическихмолекул S8. Кристаллы ромбической серы представляют
собой октаэдры со срезанными углами. Ромбическая сера
имеет полупрозрачную лимонно-жёлтую окраску,
температура плавления — 112,8 ˚С.
16.
Пластическаясера
Резиноподобное вещество
коричневого цвета.
17.
Получение.1. Выплавление из горных пород
FeS2 → FeS + S (без доступа воздуха)
2. В лаборатории
Неполное окисление сероводорода (при
недостатке кислорода).
1) H2S + O2 → S + Н2О
2) H2SO3 + H2S → S + H2O
18.
Химические свойства серыВзаимодействует со многими
металлами, кроме золота и платины:
Mg + S = MgS
2Al + 3S = Al2S3
Взаимодействует со всеми щелочными,
щёлочноземельными металлами, а также
медью, ртутью и серебром при обычных
условиях:
Cu + S = CuS
Hg + S = HgS
19.
Химические свойства серыС остальными металлами сера
реагирует при нагревании:
Zn + S = ZnS
Окислительные свойства сера
проявляет при взаимодействии с
некоторыми неметаллами:
H2 + S = H2S














 Химия
Химия