Похожие презентации:
Сера, ее физические и химические свойства
1.
Кто такиеО2
сера
алькогены?
Кислород из атмосферы,
двое «редких» братьев, сера,
И полоний несомненно…
селен
теллур
2.
Общая характеристика халькогеновпериод
группа
VI A группа
О
2 кислород
8
15,9994
3
4
5
6
S
16
сера
32,06
Se
34
селен
78,96
Te
52
теллур
127,6
Po
84
полоний
Определите положение халькогенов в ПСХЭ.
Перечислите химические элементы ─ халькогены,
дайте им краткую характеристику: выпишите их
их символы и названия.
Объясните характер изменений [(увеличение),
(усиление)] или [(уменьшение), (ослабление)]
в подгруппе халькогенов с ростом порядкового
номера:
увеличивается
1. заряда ядра (Z);
2. количества электронов на внешнем слое;
не изменяется
3. радиус атома, нм; увеличивается
0,066 0,104 0,117 0,137
O
S
Se
Te
4. прочность связи валентных электронов
уменьшается
с ядром;
ЭО
3,44
2,58 2,55
2,1
2
O
S
Se
Te
Po
5. электроотрицательность (ЭО); уменьшается
6. неметаллические свойства; ослабляются
[209] 7. окислительные свойства;
ослабляются
3.
Сера – химический элемент1. Положение серы в ПСХЭ Д.И.Менделеева.
Строение атома.
2. Сравнение строения атома кислород и серы
3. Нахождение в природе
4.
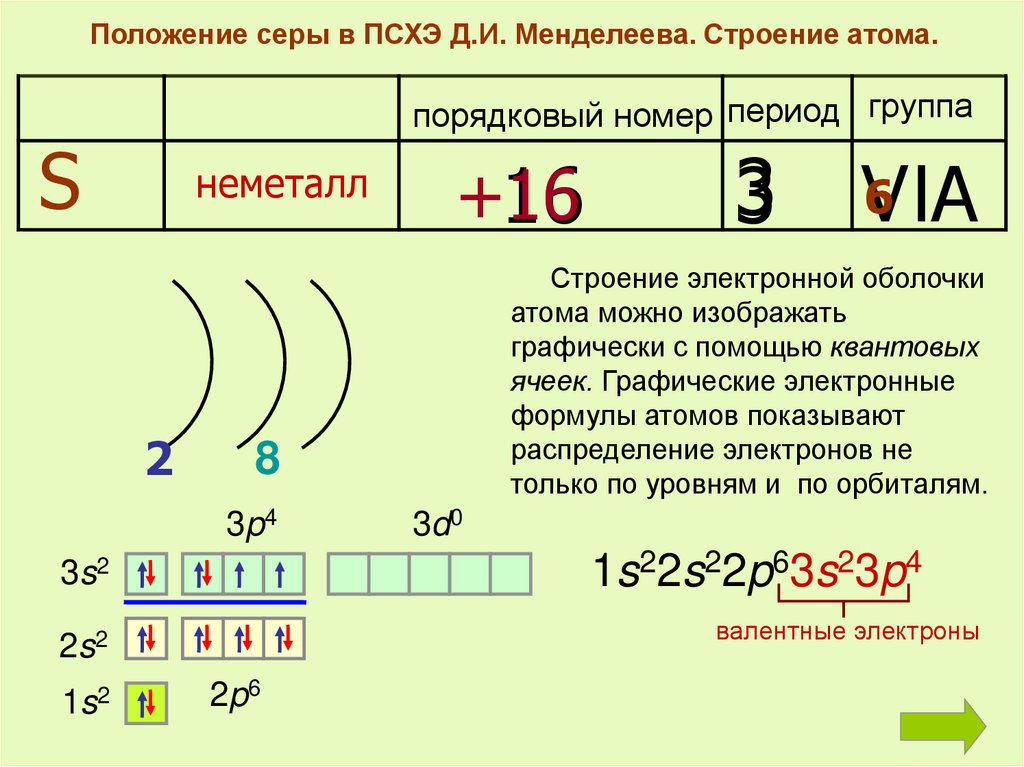
Положение серы в ПСХЭ Д.И. Менделеева. Строение атома.порядковый номер период группа
S
неметалл
2
3
6
VIA
Строение электронной оболочки
атома можно изображать
графически с помощью квантовых
ячеек. Графические электронные
формулы атомов показывают
распределение электронов не
только по уровням и по орбиталям.
8
3p4
3d0
1s22s22p63s23p4
3s2
валентные электроны
2s2
1s2
+16
16
2p6
5.
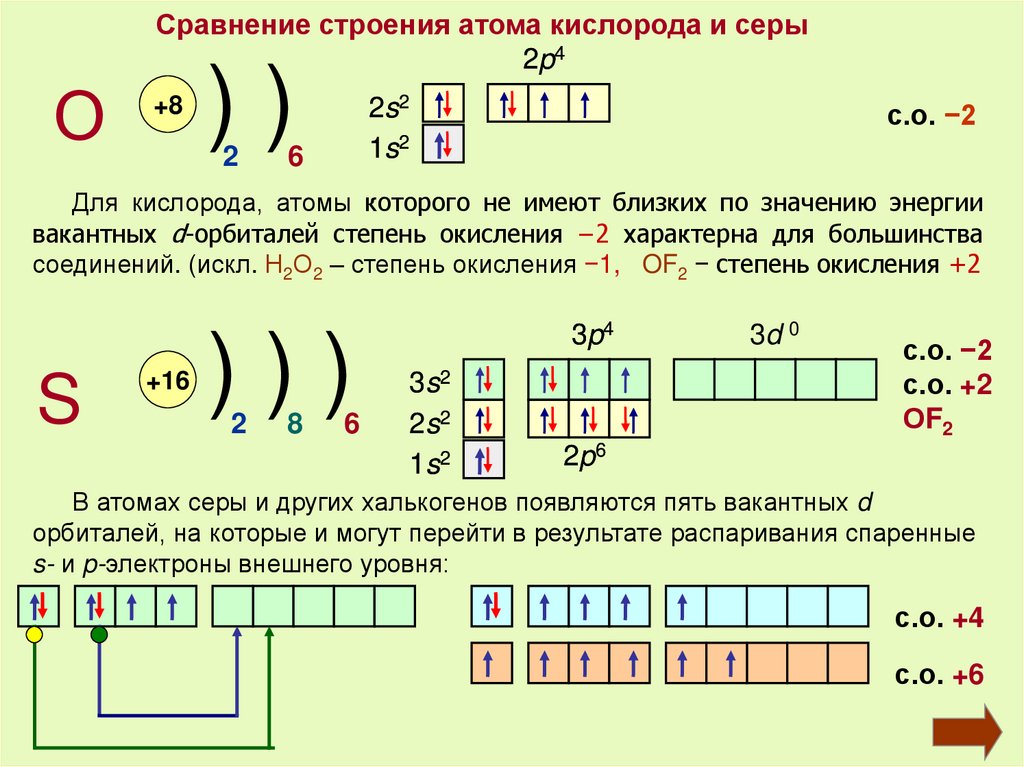
Сравнение строения атома кислорода и серы2p4
О
+8
))
2
2s2
1s2
6
с.о. −2
Для кислорода, атомы которого не имеют близких по значению энергии
вакантных d-орбиталей степень окисления −2 характерна для большинства
соединений. (искл. Н2О2 – степень окисления −1, OF2 − степень окисления +2
S
+16
)))
2
8
6
3p4
3s2
2s2
1s2
3d 0
с.о. −2
с.о. +2
ОF2
2p6
В атомах серы и других халькогенов появляются пять вакантных d
орбиталей, на которые и могут перейти в результате распаривания спаренные
s- и p-электроны внешнего уровня:
с.о. +4
с.о. +6
6.
Охарактеризуйте электронное строение атома серыВставьте пропущенные слова:
Порядковый номер серы в Периодической системе 16 , поэтому атом
серы содержит 16 электронов. Сера – элемент
периода,
3
следовательно, электроны в атоме серы расположены на трех
энергетических уровнях. В атомах всех элементов третьего периода
первый и второй энергетические уровни завершены . Число электронов
на первом равно 2 и на втором - 8 . Сера находится в VIA
группе,
поэтому число валентных электронов (электронов внешнего уровня)
равно 6 . Общее число электронов равно 16
Строение атома серы может быть представлено в виде схемы:
+16
2
Электронная формула:
8
6
1s22s22p63s23p4
7.
Нахождение в природеПо распространенности сера занимает 15-е место. Содержание в
земной коре составляет 0,05 % по весу.
В природе сера встречается в трех формах:
1) самородная сера.
2) сульфидная сера:
аурипигмент (As2S3)
галенит (PbS)
киноварь (HgS)
молибденит (MoS2)
пирит (FeS2)
халькопирит CuFeS2)
3) сульфатная сера:
ангидрит (CaSO4)
барит (BaSO4)
гипс (марьино стекло) CaSO4 ·2H2O ; гипс селенит; гипс пластинчатый.
мирабилит.
8.
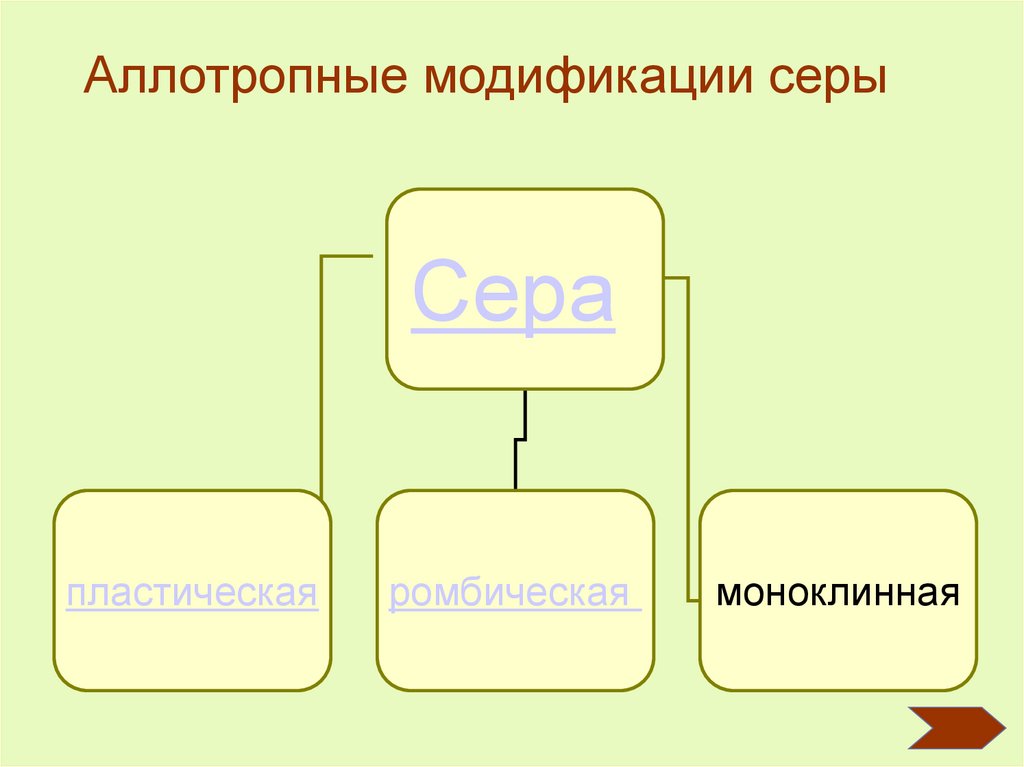
Сера – простое веществоАллотропные модификации серы
2. Характеристика аллотропных модификаций
3. Получение серы
4. Химические свойства серы
5. Применение серы
6. Сера в фармацевтике
1.
9.
Аллотропные модификации серыСера
пластическая
ромбическая
моноклинная
10.
Пластическая сераS∞
Длинные
полимерные
цепи;
пластическая
коричневая масса;
нерастворима в воде;
tпл. = 160ºС
11.
Ромбическая сераS8
Кристаллическое вещество
желтого цвета;
нерастворима в воде;
растворяется
в
органических растворителях;
tпл.= 112ºC
12.
Получение серы1. Добыча серы из породы,
содержащей серу: получают
выплавкой ее из самородных
месторождений с последующей
очисткой и перегонкой.
2. Получение серы из природных
минералов: термическое
разложение сульфидов, например:
FeS → Fe + S
3. Восстановление SO2 углеродом:
SO2 + C = S + CO2
4. Окисление сероводорода:
2H2S + O2 = 2S + 2H2O
2H2S + SO2 = 3S + 2H2O
13.
Взаимодействие серы с простыми веществами1) По приведенным ниже схемам составьте уравнения
химических реакций:
S
S
S
S
+
+
+
+
Al →
Cu →
Li →
Fe →
S + P →
S + H2 →
S + Cl2
S + O2 →
S+C →
Какую роль выполняет сера в этих реакциях? Составьте
электронный баланс к данным реакциям:
0 = Al+2
−2
0 +0 Сu
0 =
+ 2Al
00 ─ окислитель, процесс восстановления
S3S
Cu2+3SS−2
3
S
S ─+ окислитель,
процесс восстановления
0
0
−2
0
−2
S
0 0─
S + 2e → S
2 2+3 Li
1 =AlLi
2 S
Cu ─восстановитель,
восстановитель,пр.
пр.окисления.
окисления.
+3 +23 22 1
Cu
Al00──3e
2e→
→AlCu
14.
Взаимодействие серы с железомСоставьте
уравнение реакции взаимодействия
серы
и
железа.
Fe + S = FeS
15.
Горение серы в кислородеСоставьте уравнение
реакции горения серы.
S + O2 = SO2
16.
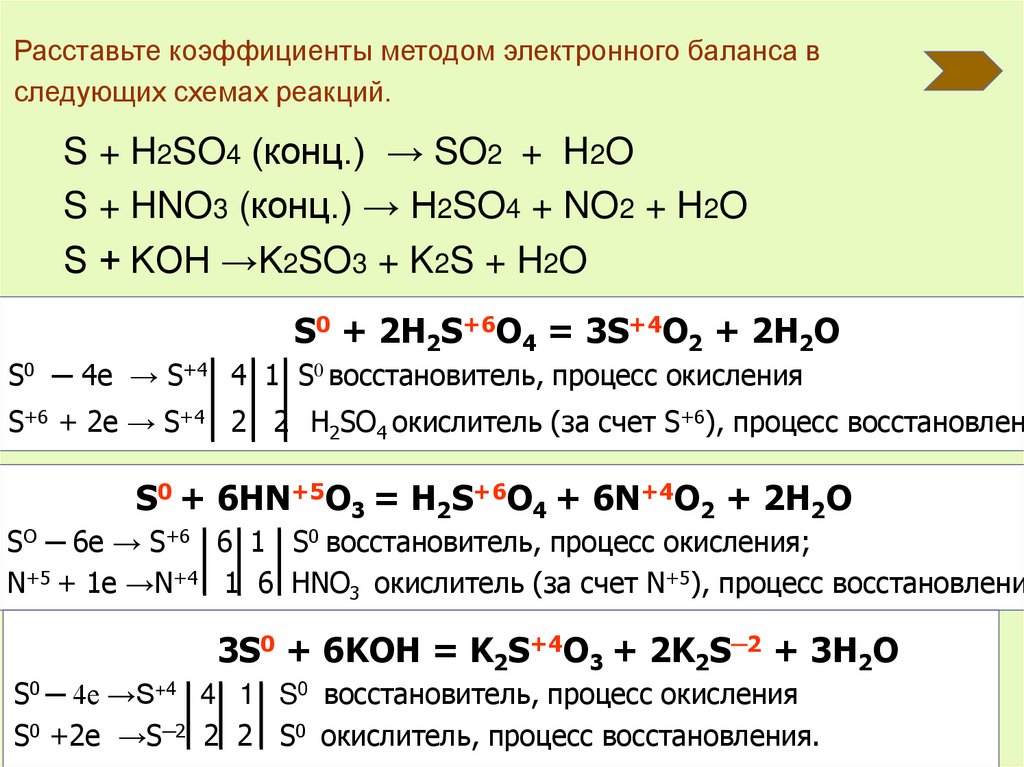
Расставьте коэффициенты методом электронного баланса вследующих схемах реакций.
S + H2SO4 (конц.) → SO2 + H2O
S + HNO3 (конц.) → H2SO4 + NO2 + H2O
S + KOH →K2SO3 + K2S + H2O
S0 + 2H2S+6O4 = 3S+4O2 + 2H2O
S0 ─ 4e → S+4 4 1 S0 восстановитель, процесс окисления
S+6 + 2e → S+4 2 2 H2SO4 окислитель (за счет S+6), процесс восстановлен
S0 + 6HN+5O3 = H2S+6O4 + 6N+4O2 + 2H2O
SO ─ 6e → S+6 6 1 S0 восстановитель, процесс окисления;
N+5 + 1e →N+4 1 6 HNO3 окислитель (за счет N+5), процесс восстановлени
3S0 + 6KOH = K2S+4O3 + 2K2S─2 + 3H2O
S0 ─ 4e →S+4 4 1 S0 восстановитель, процесс окисления
S0 +2e →S─2 2 2 S0 окислитель, процесс восстановления.
17.
Составить уравнения реакций при помощи которыхможно осуществить превращение.
Fe
1
2
FeS
3
H 2S
4
S
1) Fe + S = FeS
2) FeS + 2HCl = FeCl2 + H2S
3) 2H2S + SO2 = 3S + 2H2O
4) S + O2 =SO2
SO2
18.
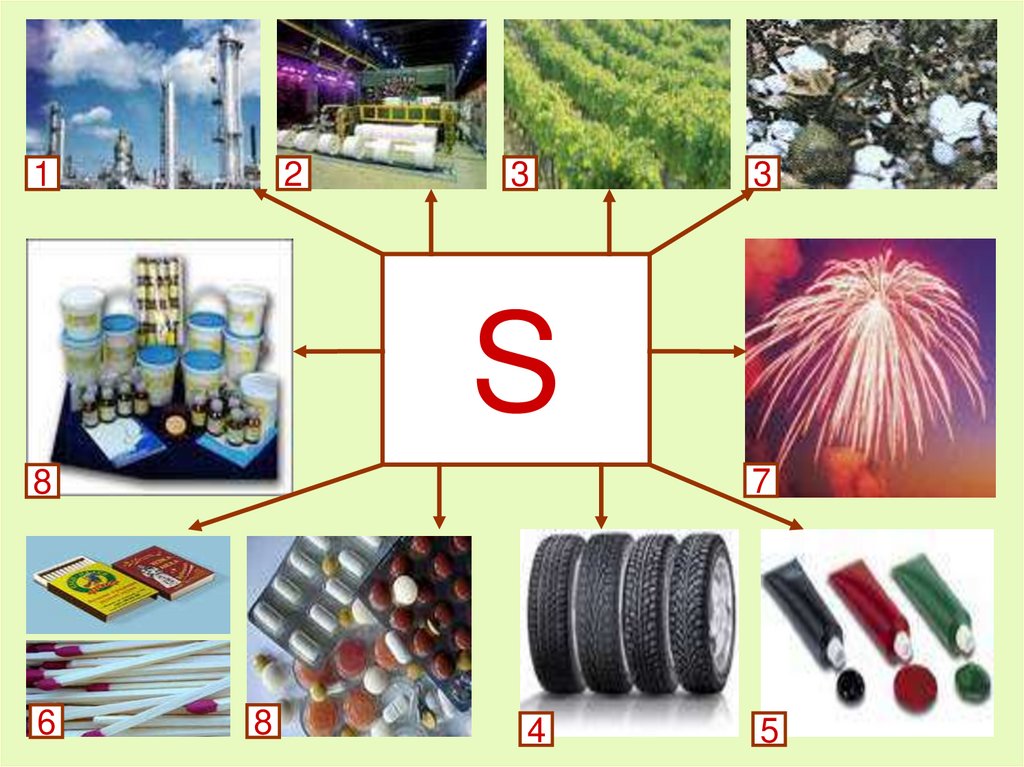
Применение серыСеру используют:
1. для производства серной кислоты (около 50% всей
производимой серы);
2. для производства сульфитов, применяемых для варки
целлюлозы (около 25%);
3. для борьбы с болезнями растений, главным образом
виноградника и хлопчатника (10 – 15%);
4. для вулканизации каучука;
5. в производстве красителей;
6. для производства спичек;
7. для получения фейерверков и салютов;
8. в медицине – для производства кожных мазей.
19.
12
3
3
S
7
8
6
8
4
5
20.
Сера в фармацевтикеПорошок «серы осажденной» применяют наружно в
виде мазей (5 – 10 – 20 %) и присыпок при лечении
кожных заболеваний (себореи, псориаза).
В организме образуются продукты окисления серы –
политионовые кислоты с общей формулой H2SХO6 (Х=3─6)
ферменты
S + O2
H2SХO6
Эти
продукты
обладают
противомикробной
и
противопаразитарной активностью. Таков же механизм
действия серы очищенной, применяемой в качестве
противоглистного средства.
Все сульфамидные препараты – сульфидин, сульфазол,
норсульфазол, сульгин, сульфодимезин, стрептоцид и
другие подавляют активность многочисленных микробов.
И все эти лекарства – органические соединения серы.
21.
Тест1. Последовательность цифр 2 — 8 — 18 — 6 соответствует распределению
электронов по энергетическим уровням атома:
А) кислород;
В) селен;
Б) сера;
Г) теллур.
2. Какая формула соответствует электронной конфигурации внешнего уровня
атома серы:
А) … 2s22p6; Б) … 3s23p6; В) … 2s22p4; Г) … 3s23p4;
3. В ряду элементов O→S→Se→Te неметаллические свойства:
А) увеличиваются;
В) не изменяются;
Б) уменьшаются;
Г) изменяются периодически.
4. Какое соединение серы называют пиритом:
А) H2S;
Б) ZnS;
В) PbS;
Г) FeS2 .
5. Какую серу можно получить в виде нитей:
А) пластическую;
В) моноклинную;
Б) ромбическую;
Г) циклическую.
6. Какое из перечисленных веществ вступает в реакцию с серой:
А) натрий;
В) вода;
Б) азот;
Г) соляная кислота.
7. Окислительные свойства сера проявляет в реакции:
А) S + O2 = SO2;
В) S + Fe = FeS;
Б) S + 3Cl2 = SCl6;
Г) S + 2H2SO4(конц.) = 3SO2 + 2H2O.
22.
БаритBaSO4
«Барос» по-гречески –
тяжесть.
Химический состав:
ВаО 65,7%, SO3 34,3%
Практическое значение:
Барит
находит
широкое применение в
различных
областях
промышленности.
23.
Гипс CaSO4 ·2Н2Омарьино стекло
селенит
гипс пластинчатый
«Гипс» - старое греческое название минерала.
Химический состав: СаО 32,5%, SO3 46,6% H2O 20,9%
Практическое значение гипса очень велико, особенно в строительном деле.
1. модельный или лепной (полуобожженный) гипс применяется для
получения отливок, гипсовых слепков, лепных украшений, в хирургии,
бумажном производстве
2. сырой (природный) гипс находит применение в цементной
промышленности.
24.
МирабилитNa2SО4·10H2O
Старинное
название
«удивительная
соль
Глауберова».
Синоним
глауберова соль.
Химический состав:
Na2O 19,3%, SO3 24.8%, H2O
55,9%
Практическое
значение:
Используется
для
приготовления
соды
по
способу Леблана (сплавлением с известняком и
углем),
а
также
в
стекольной, красочной и
других отраслях промышленности.
В
медицине
употребляется
как
слабительное средство.
25.
Самородная сераS
Наиболее устойчивую при комнатной
температуре α-модификацию серы
называют обычно ромбической
серой или просто серой.
Химический состав: в ряде случаев
устанавливается
химически
чистая сера, но обычно она
бывает загрязнена посторонними
механическими
примесями:
глинистым
или
органическим
веществом, капельками нефти,
газами и др.
Практическое значение. Главное
применение
сера
имеет
в
производстве серной кислоты.
26.
Аурипигмент As2S3Название
происходит
от
латинских слов «аурум» золото и «пигментум» краска. Предполагалось, что
минерал содержит золото.
Химический состав: As 61%,
S 39%
Практическое значение.
В случае наличия крупных по
запасам
скоплений
представляет собой сырье
для получения трехокиси
мышьяка,
а
также
используется в красильном
деле и других производствах
27.
Галенит PbSНазвание
происходит
от
латинского слова «галена» свинцовая руда. Синоним
свинцовый блеск.
Химический состав: Pb 86,6 %,
S 13,4%
Практическое значение. Галенит
представляет
собой
важнейшую свинцовую руду.
Почти
вся
мировая
продукция свинца связана с
добычей этого минерала.
Помимо выплавки металла,
небольшая
часть
галенитовых
руд
перерабатывается на глет
PbO с целью получения
свинцовых препаратов, в
частности красок, глазури.
При выплавке попутно со
свинцом
извлекаются
значительные
количества
серебра.
28.
КиноварьHgS
Предполагают,
что
название
перешло
из Индии, где так
называются красная
смола
и
«кровь
дракона».
Химический состав:
Hg 86,2%, Ѕ 13,8%
Практическое
значение: является
почти единственным
источником
получения ртути.
29.
МолибденитМоS2
Название происходит от
греческого
слова
«молибдос» - свинец.
Синоним молибденовый
блеск.
Химический состав:
Мо 60%, S 40%.
Практическое
значение:
Является единственным
промышленным
источником молибдена. Около
90% мировой добычи
этого
металла
расходуется
на
изготовление различных
высококачественных
сортов стали.
30.
ПиритFeS2
«Пирос» по-гречески – огонь. Повидимому, это название связано со
свойствами пирита давать искры
при ударе или с его сильным
блеском.
Химический состав:
Fe 46,6%, S 53,4%.
Практическое значение: Пиритовые
руды являются одним из основных
видов сырья, используемого для
получения серной кислоты. Часто
содержащиеся в пиритовых рудах
медь, цинк, иногда золото, селен и
др.
могут
быть
получены
побочными
способами.
Получаемые в результате обжига
железные огарки в зависимости от
их
частоты
могут
быть
использованы для изготовления
красок или как железная руда.
31.
ХалькопиритCuFeS2
«Халькос» по- гречески медь,
«пирос»
огонь.
Синоним
медный колчедан.
Химический состав:
Cu 34,5%, Fe 30,54%, S 34,9%
Практическое
значение:
халькопиритсодержащие
руды
являются одним из главных
источников меди.
32.
АнгидритCaSO4
Название
минерала
(«безводный») указывает
на отсутствие в нем воды,
в отличии от гипса.
Химический состав:
CaO 41,2%, SO3 58,8%.
В виде примеси довольно
часто содержит стронций.
Практическое
значение:
Ангидрит, так же как и
гипс,
используется
главным
образом
в
производстве
вяжущих
веществ (цементов), также
используется
для
изготовления поделок.



























 Химия
Химия