Похожие презентации:
Сера, ее физические и химические свойства
1.
Кто такиеО2
сера
алькогены?
Кислород из атмосферы,
двое «редких» братьев, сера,
И полоний несомненно…
селен
теллур
2.
Исторические сведенияСера известна людям очень давно. В теоретических
представлениях алхимиков сера играла большую роль, так как
считалась наиболее совершенным выразителем одного из
«основных начал» природы – горючести. Месторождения этого
желтого горючего вещества разрабатывались
греками и
римлянами, особенно в Сицилии. С помощью серы люди
защищались от врагов-завоевателей. При обороне крепостей
от
неприятеля
на
головы
осаждавших
выливали
расплавленную серу. Сера вместе с селитрой, смолой и
нефтью входила в состав древней зажигательной смеси –
«греческого огня», который применялся и на суше и в морских
сражениях. Позднее оказалось, что сера – важная составная
часть пороха . Немецкий
химик и металлург Георгиус
Агриколла (1494 – 1555) указывал, «что сера входит в состав
ужасного изобретения – порошка, который может метать
далеко вперед куски железа, бронзы или камня – орудие войны
нового типа».
3.
Общая характеристика халькогеновпериод
группа
VI A группа
О
2 кислород
8
15,9994
3
4
5
6
S
16
сера
32,06
Se
34
селен
78,96
Te
52
теллур
127,6
Po
84
полоний
Определите положение халькогенов в ПСХЭ.
Перечислите химические элементы ─ халькогены,
дайте им краткую характеристику: выпишите их
их символы и названия.
Объясните характер изменений [(увеличение),
(усиление)] или [(уменьшение), (ослабление)]
в подгруппе халькогенов с ростом порядкового
номера:
увеличивается
1. заряда ядра (Z);
2. количества электронов на внешнем слое;
не изменяется
3. радиус атома, нм; увеличивается
0,066 0,104 0,117 0,137
O
S
Se
Te
4. прочность связи валентных электронов
уменьшается
с ядром;
ЭО
3,44
2,58 2,55
2,1
2
O
S
Se
Te
Po
5. электроотрицательность (ЭО); уменьшается
6. неметаллические свойства; ослабляются
[209] 7. окислительные свойства;
ослабляются
4.
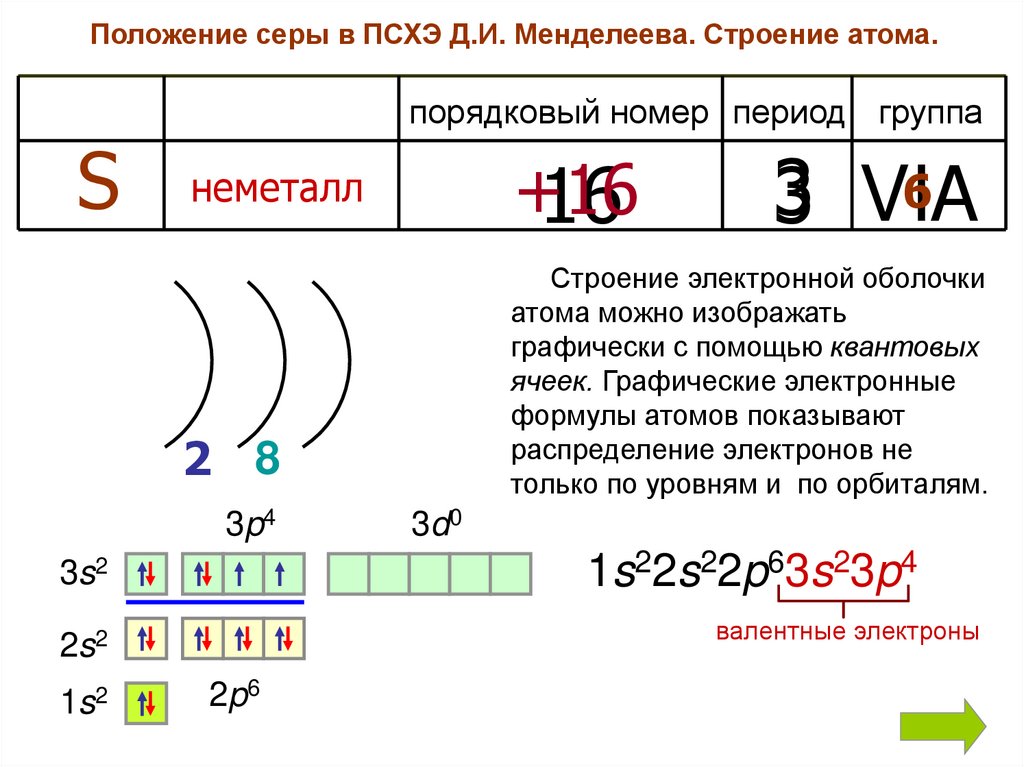
Положение серы в ПСХЭ Д.И. Менделеева. Строение атома.порядковый номер период группа
S
+16
16
неметалл
Строение электронной оболочки
атома можно изображать
графически с помощью квантовых
ячеек. Графические электронные
формулы атомов показывают
распределение электронов не
только по уровням и по орбиталям.
2 8
3p4
3d0
1s22s22p63s23p4
3s2
валентные электроны
2s2
1s2
6
3 VIA
2p6
5.
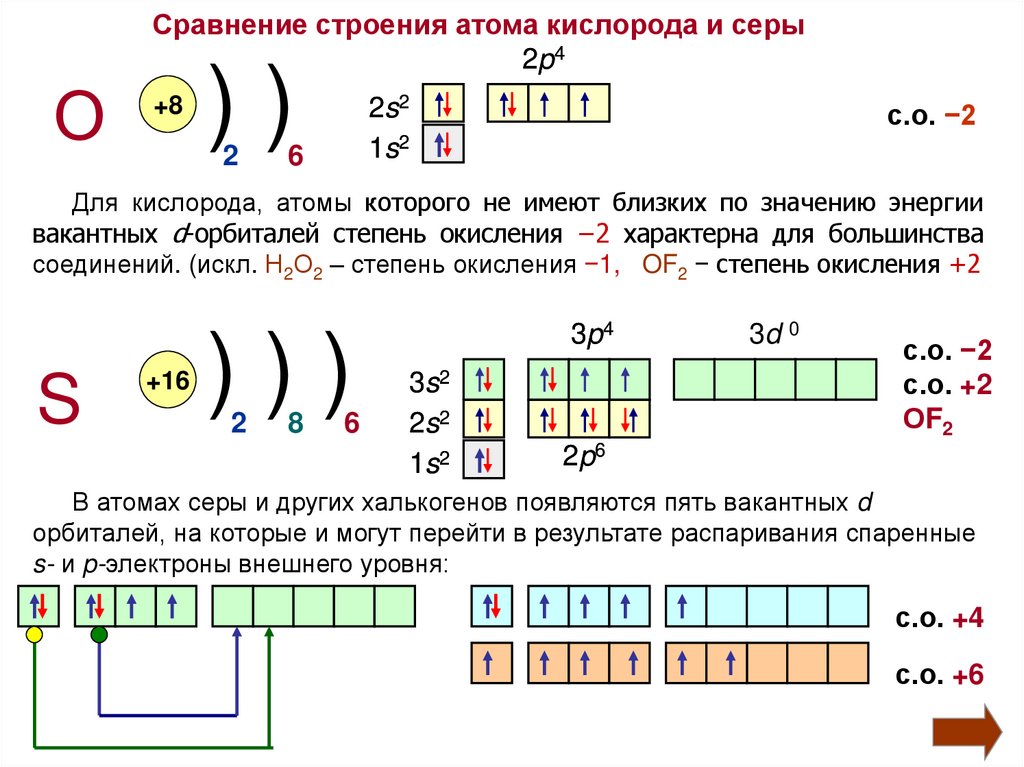
Сравнение строения атома кислорода и серы2p4
О
+8
))
2
2s2
1s2
6
с.о. −2
Для кислорода, атомы которого не имеют близких по значению энергии
вакантных d-орбиталей степень окисления −2 характерна для большинства
соединений. (искл. Н2О2 – степень окисления −1, OF2 − степень окисления +2
S
+16
)))
2
8
6
3p4
3s2
2s2
1s2
3d 0
с.о. −2
с.о. +2
ОF2
2p6
В атомах серы и других халькогенов появляются пять вакантных d
орбиталей, на которые и могут перейти в результате распаривания спаренные
s- и p-электроны внешнего уровня:
с.о. +4
с.о. +6
6.
Охарактеризуйте электронное строение атома серыВставьте пропущенные слова:
Порядковый номер серы в Периодической системе 16 , поэтому атом
серы содержит 16 электронов. Сера – элемент
периода,
3
следовательно, электроны в атоме серы расположены на трех
энергетических уровнях. В атомах всех элементов третьего периода
первый и второй энергетические уровни завершены . Число электронов
на первом равно 2 и на втором - 8 . Сера находится в VIA группе,
поэтому число валентных электронов (электронов внешнего уровня)
равно 6 . Общее число электронов равно 16
Строение атома серы может быть представлено в виде схемы:
+16
Электронная формула:
2
8
6
1s22s22p63s23p4
7.
Нахождение в природеПо распространенности сера занимает 15-е место. Содержание в
земной коре составляет 0,05 % по весу.
В природе сера встречается в трех формах:
1) самородная сера.
2) сульфидная сера:
аурипигмент (As2S3)
галенит (PbS)
киноварь (HgS)
молибденит (MoS2)
пирит (FeS2)
халькопирит CuFeS2)
3) сульфатная сера:
ангидрит (CaSO4)
барит (BaSO4)
гипс (марьино стекло) CaSO4 ·2H2O ; гипс селенит; гипс пластинчатый.
мирабилит.
8. Самородная сера S
Наиболее устойчивую при комнатнойтемпературе α-модификацию серы
называют обычно ромбической
серой или просто серой.
Химический состав: в ряде случаев
устанавливается химически чистая
сера, но обычно она бывает
загрязнена
посторонними
механическими
примесями:
глинистым
или
органическим
веществом, капельками нефти,
газами и др.
Практическое
значение.
Главное
применение
сера
имеет
в
производстве серной кислоты.
9. Киноварь HgS
Предполагают,что
название
перешло
из Индии, где так
называются красная
смола
и
«кровь
дракона».
Химический состав:
Hg 86,2%, Ѕ 13,8%
Практическое
значение: является
почти единственным
источником
получения ртути.
10. Пирит FeS2
«Пирос» по-гречески – огонь. Повидимому, это название связано сосвойствами пирита давать искры
при ударе или с его сильным
блеском.
Химический состав:
Fe 46,6%, S 53,4%.
Практическое значение: Пиритовые
руды являются одним из основных
видов сырья, используемого для
получения серной кислоты. Часто
содержащиеся в пиритовых рудах
медь, цинк, иногда золото, селен и
др.
могут
быть
получены
побочными
способами.
Получаемые в результате обжига
железные огарки в зависимости от
их
частоты
могут
быть
использованы для изготовления
красок или как железная руда.
11. Гипс CaSO4 ·2Н2О
марьино стеклоселенит
гипс пластинчатый
«Гипс» - старое греческое название минерала.
Химический состав: СаО 32,5%, SO3 46,6% H2O 20,9%
Практическое значение гипса очень велико, особенно в строительном деле.
1. модельный или лепной (полуобожженный) гипс применяется для
получения отливок, гипсовых слепков, лепных украшений, в хирургии,
бумажном производстве
2. сырой (природный) гипс находит применение в цементной
промышленности.
12.
Аллотропные модификации серыСера
пластическая
ромбическая
моноклинная
13.
Пластическая сераS∞
Длинные полимерные цепи;
пластическая корич-невая масса;
нерастворима в воде;
tпл. = 160ºС
14.
Ромбическая сераS8
Кристаллическое вещество
желтого цвета;
нерастворима в воде;
растворяется в органических растворителях;
tпл.= 112ºC
15.
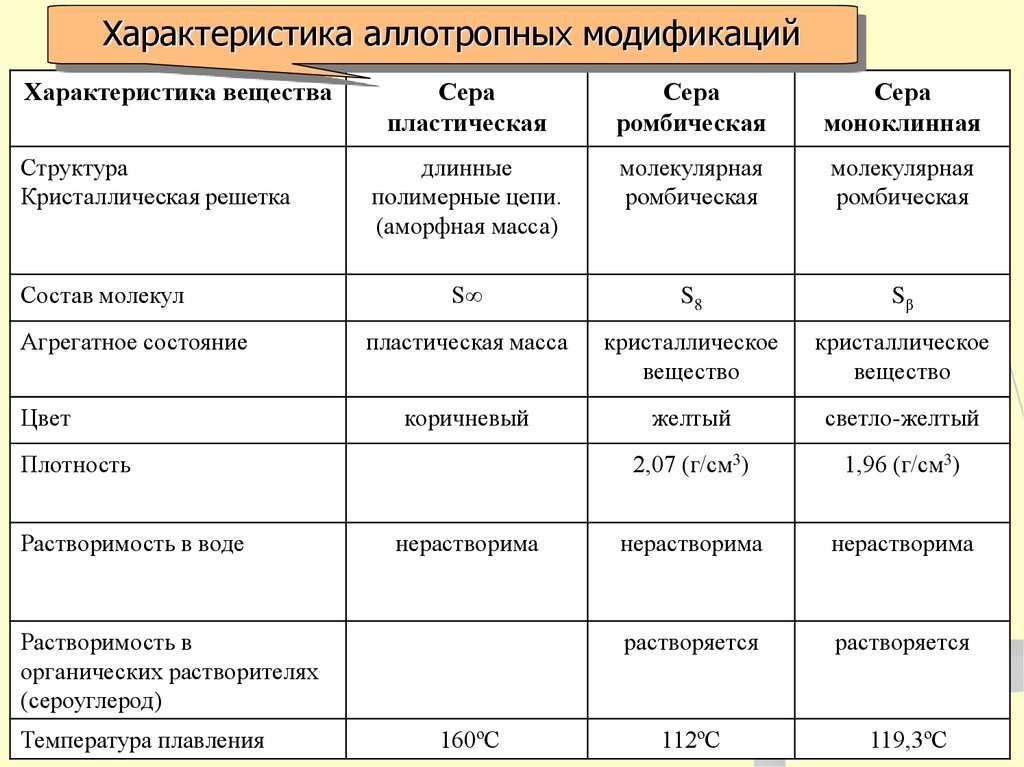
Характеристика аллотропных модификацийХарактеристика вещества
Структура
Кристаллическая решетка
Состав молекул
Агрегатное состояние
Цвет
Сера
пластическая
Сера
ромбическая
Сера
моноклинная
длинные
полимерные цепи.
(аморфная масса)
молекулярная
ромбическая
молекулярная
ромбическая
S∞
S8
Sβ
пластическая масса
кристаллическое
вещество
кристаллическое
вещество
коричневый
желтый
светло-желтый
2,07 (г/см3)
1,96 (г/см3)
нерастворима
нерастворима
растворяется
растворяется
112ºС
119,3ºС
Плотность
Растворимость в воде
нерастворима
Растворимость в
органических растворителях
(сероуглерод)
Температура плавления
160ºС
16.
Получение серы1. Добыча серы из породы,
содержащей серу: получают
выплавкой ее из самородных
месторождений с последующей
очисткой и перегонкой.
2. Получение серы из природных
минералов: термическое
разложение сульфидов, например:
FeS → Fe + S
3. Восстановление SO2 углеродом:
SO2 + C = S + CO2
4. Окисление сероводорода:
2H2S + O2 = 2S + 2H2O
2H2S + SO2 = 3S + 2H2O
17.
Химические свойства серыВзаимодействие серы с простыми веществами
(металлами, неметаллами)
Взаимодействие серы со сложными веществами
Составить уравнения реакций при помощи
которых можно осуществить превращение.
18.
Взаимодействие серы с простыми веществамиS0 + Li0 = Li2+S−2
1) По приведенным ниже схемам составьте уравнения
химических реакций:
S
S
S
S
+
+
+
+
Al →
Cu →
Li →
Fe →
S
S
S
S
+ P →
+ H2 →
+ Cl2
+ O2 →
S+C →
Какую роль выполняет сера в этих реакциях? Составьте
электронный баланс к данным реакциям:
+3+2 −2
−2
3S
S00 + 2Al
Сu00 ==Al
Cu
2 SS
3
S0 + 2e → S−2 2 23 1
+3 +23 22 1
Al00──3e
Cu
2e→
→AlCu
SS00 ─
─ окислитель,
окислитель, процесс
процесс восстановления
восстановления
0
Al
Cu0──восстановитель,
восстановитель,пр.
пр.окисления.
окисления.
19.
Взаимодействие серы с железомFe + S = FeS
Горение серы в кислороде
S + O2 = SO2
20.
Расставьте коэффициенты методом электронного баланса вследующих схемах реакций.
S + H2SO4 (конц.) → SO2 + H2O
S + HNO3 (конц.) → H2SO4 + NO2 + H2O
S + KOH →K2SO3 + K2S + H2O
S0 + 2H2S+6O4 = 3S+4O2 + 2H2O
S0 ─ 4e → S+4 4 1 S0 восстановитель, процесс окисления
S+6 + 2e → S+4 2 2 H2SO4 окислитель (за счет S+6), процесс восстановления.
S0 + 6HN+5O3 = H2S+6O4 + 6N+4O2 + 2H2O
SO ─ 6e → S+6 6 1 S0 восстановитель, процесс окисления;
N+5 + 1e →N+4 1 6 HNO3 окислитель (за счет N+5), процесс восстановления.
3S0 + 6KOH = K2S+4O3 + 2K2S─2 + 3H2O
S0 ─ 4e →S+4 4 1 S0 восстановитель, процесс окисления
S0 +2e →S─2 2 2 S0 окислитель, процесс восстановления.
21.
Применение серыСеру используют:
1. для производства серной кислоты (около 50% всей
производимой серы);
2. для производства сульфитов, применяемых для варки
целлюлозы (около 25%);
3. для борьбы с болезнями растений, главным образом
виноградника и хлопчатника (10 – 15%);
4. для вулканизации каучука;
5. в производстве красителей;
6. для производства спичек;
7. для получения фейерверков и салютов;
8. в медицине – для производства кожных мазей.
22. Сера в фармацевтике
Порошок «серы осажденной» применяют наружно ввиде мазей (5 – 10 – 20 %) и присыпок при лечении
кожных заболеваний (себореи, псориаза).
В организме образуются продукты окисления серы –
политионовые кислоты с общей формулой H2SХO6 (Х=3─6)
ферменты
S + O2
H2SХO6
Эти
продукты
обладают
противомикробной
и
противопаразитарной активностью. Таков же механизм
действия серы очищенной, применяемой в качестве
противоглистного средства.
Все сульфамидные препараты – сульфидин, сульфазол,
норсульфазол, сульгин, сульфодимезин, стрептоцид и
другие подавляют активность многочисленных микробов.
И все эти лекарства – органические соединения серы.


















 Химия
Химия








