Похожие презентации:
Раздел 2. Химические реакции. Тема 2.1. Часть 2
1. Лекция 2.1.2. Типы химических реакций
2. Количественные отношения в химии
Основные понятия и формулыo Относительная атомная и молекулярная масса
Aᵣ — масса атома элемента, выраженная в атомных единицах
массы. Указывается в периодической таблице.
Mᵣ — масса молекулы, равна сумме Aᵣ всех атомов в формуле.
o Количество вещества (n), моль
Моль — порция вещества, содержащая 6,02·10²³ частиц. Это
число — постоянная Авогадро (Nₐ).
Формула: n = N / Nₐ, где N — число частиц.
o Молярная масса (M)
Молярная масса — масса одного моля вещества. Численно
равна Mᵣ, но выражается в г/моль.
Формула: M = m / n, где m — масса вещества в граммах.
o Молярный объем газа (Vₘ)
При нормальных условиях 1 моль любого газа занимает объем
22,4 л/моль.
Формула: V = n · Vₘ
3.
Расчеты по химическим формуламМассовая доля элемента (ω)
ω(элемента) = (n · Aᵣ(элемента) / Mᵣ(вещества)) · 100%
где n — число атомов данного элемента в формуле.
Дополнительные понятия
Выход продукта (η):
η = (mпракт. / mтеорет.) · 100%
Массовая доля вещества в растворе:
ω(в-ва) = m(в-ва) / m(р-ра) · 100%
Типовые задачи с решениями
Задача. Нахождение массы продукта по известной массе реагента
Условие: Какая масса оксида алюминия образуется при сгорании 54 г алюминия?
Уравнение: 4Al + 3O₂ → 2Al₂O₃
Дано: m(Al) = 54 г. Найти: m(Al₂O₃) = ?
Находим n(Al): n(Al) = m / M = 54 г / 27 г/моль = 2 моль
Соотношение по уравнению: На 4 моль Al → 2 моль Al₂O₃ ⇒ на 2 моль Al → 1 моль Al₂O₃
Находим m(Al₂O₃): M(Al₂O₃) = 102 г/моль ⇒ m(Al₂O₃) = n · M = 1 моль · 102 г/моль = 102 г
4. Основные количественные законы в химии и расчеты по уравнениям химических реакций
Основные количественные законы химииЗакон сохранения массы (М.В. Ломоносов, А.Л. Лавуазье)
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
Следствие: Атомы в реакции не исчезают и не возникают, они только перегруппировываются. Это основа
для уравнивания химических уравнений.
Закон постоянства состава (Ж.Л. Пруст)
Всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и
количественный состав.
Закон кратных отношений (Дж. Дальтон)
Если два элемента образуют друг с другом несколько соединений, то массы одного элемента,
приходящиеся на одну и ту же массу другого, относятся как небольшие целые числа.
5.
Закон объемных отношений (Ж.Л. Гей-Люссак)Объемы газов, вступающих в реакцию и образующихся в результате нее, относятся как небольшие
целые числа.
Закон Авогадро
В равных объемах различных газов при одинаковых условиях (температура и давление) содержится
одинаковое число молекул.
Следствие: 1 моль любого газа при нормальных условиях (н.у.) занимает объем 22,4 л. Это ключ к
расчетам с газообразными веществами.
Расчеты по уравнениям химических реакций
Алгоритм расчета:
Записать уравнение реакции и уравнять его с помощью коэффициентов.
Перевести известные данные (массу, объем) в количество вещества (ν, моль).
Используя коэффициенты в уравнении, найти ν искомого вещества.
Перевести ν искомого вещества в нужные единицы (массу, объем, число частиц).
6.
Типовые задачи с решениямиЗадача 1. Расчет по уравнению: масса продукта → масса реагента
Условие: Какая масса кислорода потребуется для полного сжигания 8 г водорода?
Уравнение: 2H₂ + O₂ → 2H₂O
Дано: m(H₂) = 8 г. Найти: m(O₂) = ?
Находим ν(H₂): M(H₂) = 2 г/моль → ν(H₂) = 8 г / 2 г/моль = 4 моль
Соотношение по уравнению: На 2 моль H₂ требуется 1 моль O₂ → на 4 моль H₂ требуется 2 моль O₂
Находим m(O₂): M(O₂) = 32 г/моль → m(O₂) = 2 моль × 32 г/моль = 64 г
Задача 2. Расчет с использованием объема газа (н.у.)
Условие: Какой объем аммиака (н.у.) образуется из 5,6 л азота?
Уравнение: N₂ + 3H₂ → 2NH₃
Дано: V(N₂) = 5,6 л. Найти: V(NH₃) = ?
Находим ν(N₂): ν(N₂) = V / Vₘ = 5,6 л / 22,4 л/моль = 0,25 моль
Соотношение по уравнению: 1 моль N₂ → 2 моль NH₃ → 0,25 моль N₂ → 0,5 моль NH₃
Находим V(NH₃): V(NH₃) = 0,5 моль × 22,4 л/моль = 11,2 л
7. Моль как единица количества вещества
Моль — это единица измерения количествавещества в Международной системе единиц
(СИ). Один моль любого вещества содержит
строго определенное число структурных
частиц. Это число называется постоянной
Авогадро (Nₐ или NA).
Nₐ = 6,02 × 10²³ частиц/моль
Связь с атомной массой
Число 6,02 × 10²³ было выбрано не случайно. Один моль
вещества — это его количество, масса которого в
граммах численно равна его относительной атомной
(или молекулярной) массе. Углерод-12 принят за
стандарт: Aᵣ(¹²C) = 12 а.е.м. Атомная единица массы
(а.е.м.) определяется как 1/12 массы атома углерода-12.
Масса одного атома углерода-12 равна 12 а.е.м.
Расчет постоянной Авогадро:
Чтобы получить 12 граммов углерода-12, нужно собрать
вместе Nₐ атомов:
Nₐ = 12 г / (масса одного атома ¹²C в граммах)
Опытным путем было установлено, что это число равно
6,02 × 10²³.
Ключевой вывод:
1 моль углерода-12 = 6,02 × 10²³ атомов углерода =
12 граммов.
Это правило распространяется на все вещества:
1 моль железа (Aᵣ = 56) = 56 г
1 моль воды (Mᵣ = 18) = 18 г
8.
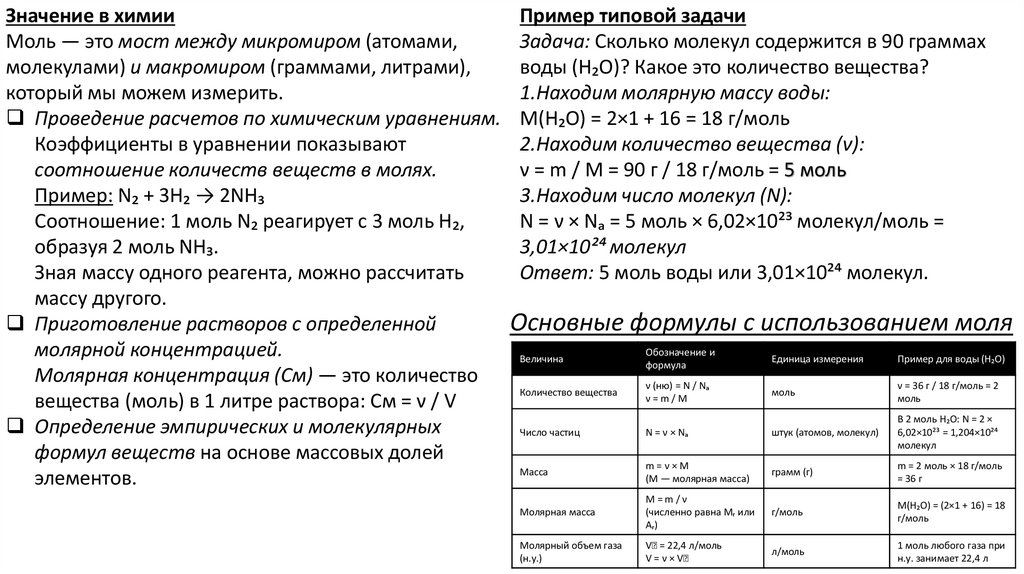
Значение в химииПример типовой задачи
Моль — это мост между микромиром (атомами,
Задача: Сколько молекул содержится в 90 граммах
молекулами) и макромиром (граммами, литрами),
воды (H₂O)? Какое это количество вещества?
который мы можем измерить.
1.Находим молярную массу воды:
Проведение расчетов по химическим уравнениям. M(H₂O) = 2×1 + 16 = 18 г/моль
Коэффициенты в уравнении показывают
2.Находим количество вещества (ν):
соотношение количеств веществ в молях.
ν = m / M = 90 г / 18 г/моль = 5 моль
Пример: N₂ + 3H₂ → 2NH₃
3.Находим число молекул (N):
Соотношение: 1 моль N₂ реагирует с 3 моль H₂,
N = ν × Nₐ = 5 моль × 6,02×10²³ молекул/моль =
образуя 2 моль NH₃.
3,01×10²⁴ молекул
Зная массу одного реагента, можно рассчитать
Ответ: 5 моль воды или 3,01×10²⁴ молекул.
массу другого.
Приготовление растворов с определенной
Основные формулы с использованием моля
Обозначение и
молярной концентрацией.
Величина
Единица измерения
Пример для воды (H₂O)
формула
Молярная концентрация (Cм) — это количество
ν (ню) = N / Nₐ
ν = 36 г / 18 г/моль = 2
Количество вещества
моль
ν
=
m
/
M
моль
вещества (моль) в 1 литре раствора: Cм = ν / V
В 2 моль H₂O: N = 2 ×
Определение эмпирических и молекулярных
Число частиц
N = ν × Nₐ
штук (атомов, молекул)
6,02×10²³ = 1,204×10²⁴
молекул
формул веществ на основе массовых долей
m=ν×M
m = 2 моль × 18 г/моль
Масса
грамм (г)
(M
—
молярная
масса)
= 36 г
элементов.
Молярная масса
M=m/ν
(численно равна Mᵣ или
Aᵣ)
г/моль
M(H₂O) = (2×1 + 16) = 18
г/моль
Молярный объем газа
(н.у.)
Vₘ = 22,4 л/моль
V = ν × Vₘ
л/моль
1 моль любого газа при
н.у. занимает 22,4 л
9. Молярная масса
Молярная масса — это физическая величина, которая показываетмассу одного моля вещества.
Определение и обозначение
Обозначение: M
Единица измерения: г/моль (грамм на моль)
Определение:
m
M = , где:
n
m — масса вещества (в граммах),
n — количество вещества (в молях).
Как рассчитать молярную массу?
Правило:
Молярная масса вещества, выраженная в г/моль, численно равна
его относительной молекулярной (или атомной) массе.
Для атомов: M=Ar, где Ar — относительная атомная масса (из
Периодической таблицы).
Для молекул и других частиц: M=Mr, где Mr — относительная
молекулярная масса.
Расчет относительной молекулярной массы (Mr):
Mr равна сумме относительных атомных масс всех атомов в молекуле.
10.
Примеры расчетаПример 1: Простое вещество (элемент)
Медь (Cu): Ar(Cu)=64
M(Cu)=64 г/моль
Это означает, что 1 моль меди имеет массу 64
грамма.
Пример 2: Сложное вещество (молекула)
Вода (H₂O):
Mr(H2O)=2⋅Ar(H)+Ar(O)=2⋅1+16=18
M(H2O)=18 г/моль
1 моль воды имеет массу 18 грамм.
Серная кислота (H₂SO₄):
Mr(H2SO4)=2⋅1+32+4⋅16=984
M(H2SO4)=98 г/моль
Гидроксид кальция (Ca(OH)₂):
Mr(Ca(OH)2)=40+2⋅(16+1)=40+34=74
M(Ca(OH)2)=74 г/моль
Молярная масса соединений с немолекулярным
строением
Для веществ с ионным (NaCl), атомным (SiO₂) или
металлическим (Fe) строением понятие "молекула"
часто не применимо. В этом случае формульная
единица (ФЕ) — это наименьшая частица,
выражающая состав вещества.
Поваренная соль (NaCl):
M(NaCl)=Ar(Na)+Ar(Cl)=23+35.5=58.5 г/моль
1 моль хлорида натрия имеет массу 58.5 г, даже
если он состоит не из молекул NaCl, а из ионов Na⁺ и
Cl⁻ в кристаллической решетке.
11.
Практическое применениеПересчет массы в количество вещества и обратно:
m
M = и m=n⋅M
n
Расчеты по химическим уравнениям:
Коэффициенты в уравнении показывают соотношения количеств веществ (в молях). Зная молярные
массы, можно рассчитать массы реагентов и продуктов.
Пример: 2H2+O2→2H2O
2 моль H2 (m=4 г) + 1 моль O2 (m=32 г) → 2 моль H2O (m=36 г).
Приготовление растворов с заданной молярной концентрацией:
V
m
См = =
n MV
где См — молярная концентрация (моль/л), V — объем раствора (л).
12. Законы сохранения массы и энергии
Законы сохранения массы и энергии — это фундаментальные законы природы, которые лежат в основе всеххимических и физических процессов.
Закон сохранения массы (ЗСМ)
Формулировка: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся
в результате реакции.
Исторически принадлежит М.В. Ломоносову (1748 г.) и, независимо, А. Лавуазье (1789 г.).
Сущность и значение:
Атомы в ходе реакции не создаются и не уничтожаются, а только перегруппировываются. Поэтому общее
число атомов каждого элемента и их общая масса остаются неизменными.
Этот закон является основой для составления химических уравнений. Именно благодаря ему мы
уравниваем коэффициенты в уравнениях реакций — чтобы число атомов каждого элемента слева и справа
было одинаковым.
Пример:
Горение угля:
C + O₂ → CO₂
Масса до реакции: 12 г (C) + 32 г (O₂) = 44 г
Масса после реакции: 44 г (CO₂)
Масса сохранилась.
13.
Закон сохранения энергии (ЗСЭ)Формулировка: Энергия не возникает из ничего и не исчезает бесследно; она только превращается из
одной формы в другую или переходит от одного тела к другому.
Сущность и значение:
В химических реакциях один вид энергии превращается в другой. Чаще всего это превращение
химической энергии в тепловую (в экзотермических реакциях) или электрическую, и наоборот.
Для того чтобы началась химическая реакция, часто требуется преодолеть энергетический барьер
(энергия активации).
Типы реакций по энергетическому эффекту:
Экзотермические: Реакции, идущие с выделением энергии (обычно в виде тепла). Энергия продуктов
реакции меньше энергии реагентов.
Пример: Горение, нейтрализация кислоты щёлочью.
Эндотермические: Реакции, идущие с поглощением энергии. Энергия продуктов реакции больше энергии
реагентов.
Пример: Разложение воды электрическим током, фотосинтез.
14.
Единство законов сохранения массы и энергииС появлением теории относительности А. Эйнштейна выяснилось, что масса и энергия взаимосвязаны.
Формула Эйнштейна:
E = m·c²
где:
E — энергия,
m — масса,
c — скорость света в вакууме.
Современная формулировка (Закон сохранения массы и энергии):
Сумма массы и энергии замкнутой системы сохраняется.
Что это значит на практике?
В обычных химических реакциях изменение массы из-за энергетических эффектов ничтожно мало и не
фиксируется весами. Поэтому ЗСМ выполняется с очень высокой точностью.
Пример: При сгорании 1 млн кг угля изменение массы составляет доли грамма.
В ядерных реакциях (синтез, деление) энергетические эффекты огромны, и изменение массы (дефект
массы) становится значимым и измеримым. Здесь законы сохранения массы и энергии рассматриваются
как единое целое.
15. Закон Авогадро
Закон Авогадро — один из фундаментальных газовых Следствия из закона Авогадрозаконов, играющий ключевую роль в химии.
Следствие 1: Молярный объем газа
Один моль любого газа при нормальных условиях
Формулировка закона Авогадро
(н.у.) занимает один и тот же объем, равный
В равных объемах различных газов при одинаковых
приблизительно 22,4 л/моль.
температуре и давлении содержится одинаковое
Нормальные условия (н.у.):
число молекул.
Температура, T0=0°C=273 K
Давление (p) и температура (T) должны быть
Давление, p0=101.3 кПа=1 атм
одинаковыми.
Молярный объем: Vm=22.4 л/моль
Объемы (V) газов должны быть равными.
Это означает, что:
Число молекул (N) будет одинаковым.
1 моль H2 (2 г) занимает объем 22,4 л.
1 моль CO2 (44 г) занимает объем 22,4 л.
1 моль O2 (32 г) занимает объем 22,4 л.
Формулы для расчета:
V
ν=
, где ν — количество вещества (моль), V —
Vm
объем газа (л).
16.
Следствие 2: Относительная плотность газаОтношение масс равных объемов двух газов при
одинаковых условиях равно отношению их молярных масс
(и плотностей).
Плотность газа (ρ):
M
ρ = V , где M — молярная масса газа.
m
Относительная плотность газа (D): Показывает, во
сколько раз один газ тяжелее другого.





















 Химия
Химия








