Похожие презентации:
28_Общие_химические_свойства_металлов
1.
Общие химические свойства металлов2.
• Химические свойства металлов зависят от строения еговнешнего или предвнешнего электронного слоя.
• У металлов одной группы наблюдаются сходства в химических
свойствах.
• У атомов металлов на внешнем энергетическом уровне
небольшое количество электронов и очень большой радиус
атома.
Me0 – nē = Men+
• Металлы окисляются, сами при этом выступают в роли
восстановителя.
3.
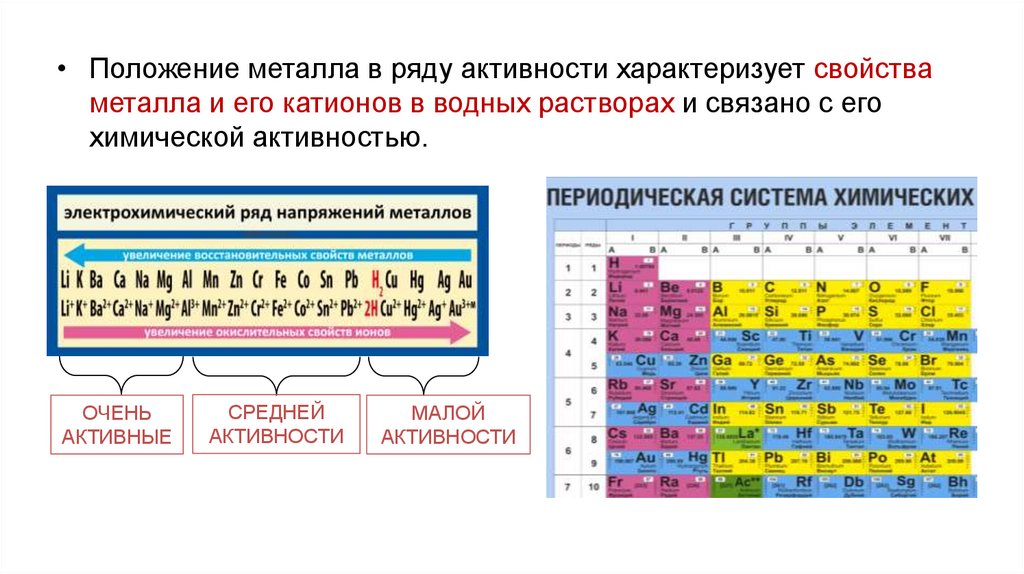
• Положение металла в ряду активности характеризует свойстваметалла и его катионов в водных растворах и связано с его
химической активностью.
ОЧЕНЬ
АКТИВНЫЕ
СРЕДНЕЙ
АКТИВНОСТИ
МАЛОЙ
АКТИВНОСТИ
4.
5.
Реакции с кислородом• С кислородом активно при комнатной температуре реагируют только
щелочные металлы, при этом образуются оксиды или пероксиды.
Такие металлы, как Au, Pt не реагируют с кислородом.
t
Mg + O2 =
Li + O2 =
Na + O2 =
t
Al + O2 =
6.
Реакции с серой• Большинство металлов, кроме Au, Pt реагируют при нагревании с
серой, при этом образуются соответствующие сульфиды.
t
Zn + S =
Ag + S =
t
7.
Реакции с галогенами• Условия протекания этих реакций зависит от активности металла
и галогена.
Ca + I2 =
Sb + Cl2 =
Sb + Cl2 =
8.
Реакции с другими неметаллами• Металлы при нагревании реагируют с другими неметаллами.
Al + N2 =
t
t
Ca + P =
t
Al + C =
t
Mg + Si =
9.
Реакции с водородом• С водородом реагируют только активные металлы.
Na + H2 =
t
10.
Реакции с водой• С металлами реагируют соединения всех классов – оксиды (в
том числе вода), кислоты, основания и соли.
2Li + 2H2O =
Ba + 2H2O =
11.
Реакции с водой• Поверхность таких металлов, как магний и алюминий, защищена
плотной плёнкой соответствующего оксида. Это препятствует
протеканию реакции с водой.
t
Mg + 2H2O =
t
Zn + H2O =
12.
Реакции с кислотами• Металлы, стоящие в ряду активности до водорода, реагируют с
кислотами (кроме HNO3 любой концентрации и H2SO4
концентрированной) с образованием солей и водорода.
Ca + HCl =
Al + H2SO4 =
13.
Реакции с кислотами• Малоактивные металлы часто практически не растворяются в
кислотах. Это обусловлено образованием на их поверхности
плёнки нерастворимой соли.
Pb + H2SO4 ≠
PbCl2, PbSO4 – нерастворимые соли.
14.
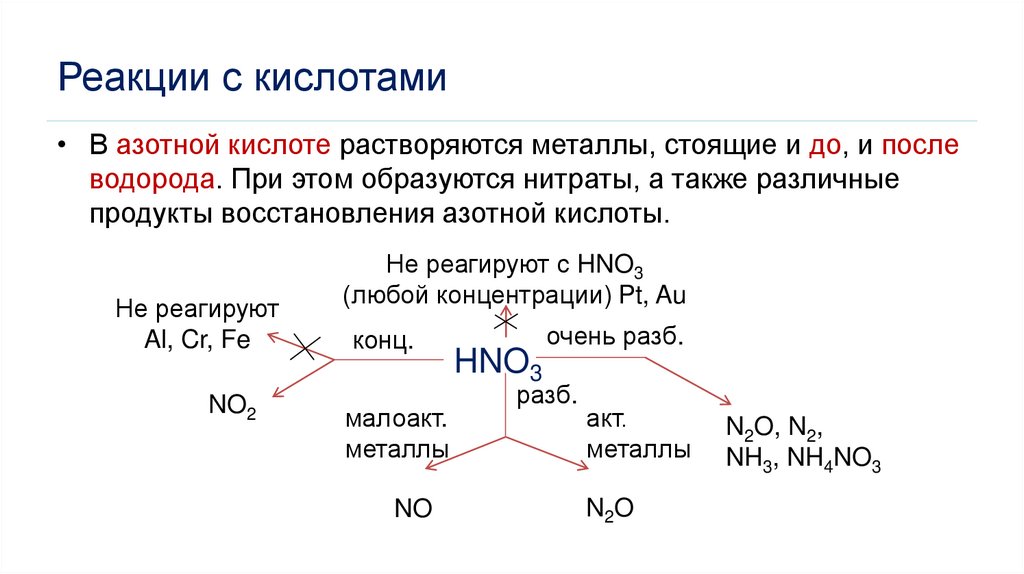
Реакции с кислотами• В азотной кислоте растворяются металлы, стоящие и до, и после
водорода. При этом образуются нитраты, а также различные
продукты восстановления азотной кислоты.
Не реагируют
Al, Cr, Fe
NO2
Не реагируют с HNO3
(любой концентрации) Pt, Au
конц.
малоакт.
металлы
NO
HNO3
очень разб.
разб.
акт.
металлы
N2O
N2O, N2,
NH3, NH4NO3
15.
Реакции с кислотами• Концентрированная серная кислота также может вступать в
реакции с металлами, расположенными в ряду активности после
водорода.
Au, Pt,
Ru, Pd
активные
металлы
H2SO4 (конц.)
неактив.
металлы
пассив.
H2S
SО2
Al, Fe, Cr
16.
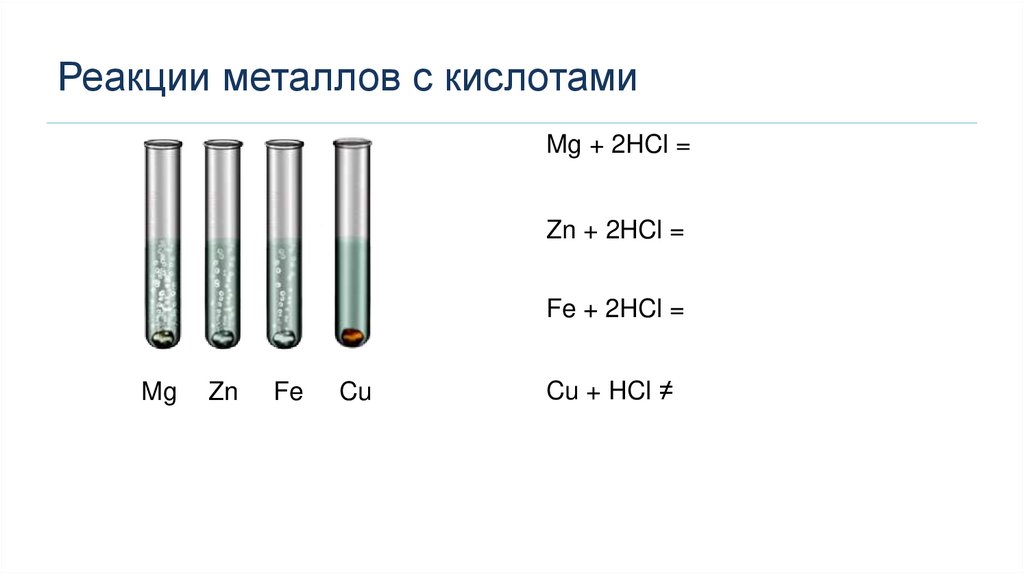
Реакции металлов с кислотамиMg + 2HCl =
Zn + 2HCl =
Fe + 2HCl =
Mg
Zn
Fe
Cu
Cu + HCl ≠
17.
Реакции металлов с кислотамиMg + 2CH3COOH =
t
Zn + 2CH3COOH =
t
Fe + 2CH3COOH =
Mg
Zn
Fe
Cu
Cu + CH3COOH ≠
18.
Металлы реагируют с кислотами, если:• металл должен стоять в ряду активности левее водорода;
• в реакции должна образоваться растворимая соль;
• концентрированная серная и азотная кислота любой
концентрации иначе реагируют с металлами;
• щелочные металлы для данных реакций лучше не использовать
из-за их высокой химической активности.
19.
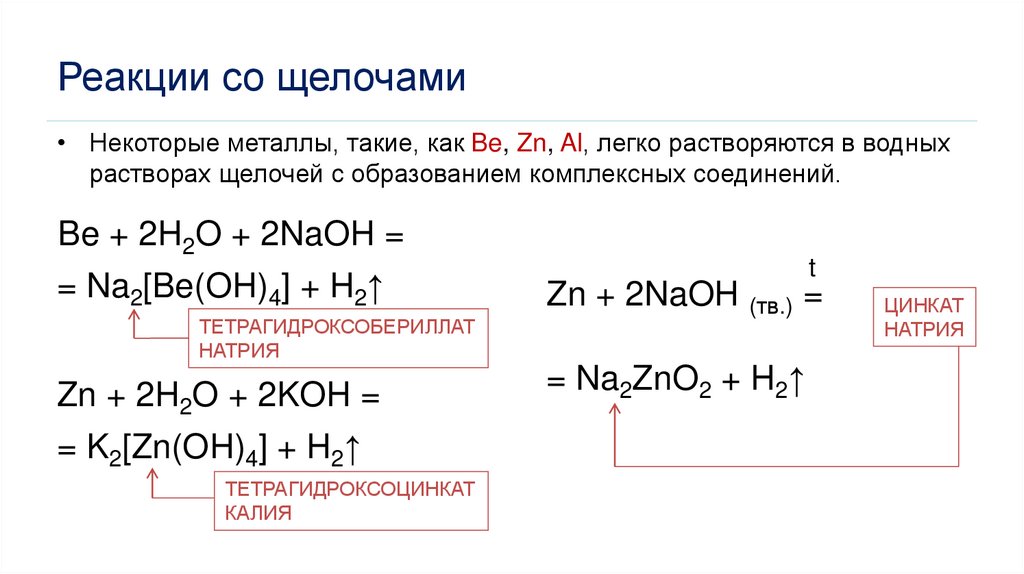
Реакции со щелочами• Некоторые металлы, такие, как Be, Zn, Al, легко растворяются в водных
растворах щелочей с образованием комплексных соединений.
Be + 2H2O + 2NaOH =
= Na2[Be(OH)4] + H2↑
ТЕТРАГИДРОКСОБЕРИЛЛАТ
НАТРИЯ
Zn + 2H2O + 2KOH =
= K2[Zn(OH)4] + H2↑
ТЕТРАГИДРОКСОЦИНКАТ
КАЛИЯ
t
Zn + 2NaOH (тв.) =
= Na2ZnO2 + H2↑
ЦИНКАТ
НАТРИЯ
20.
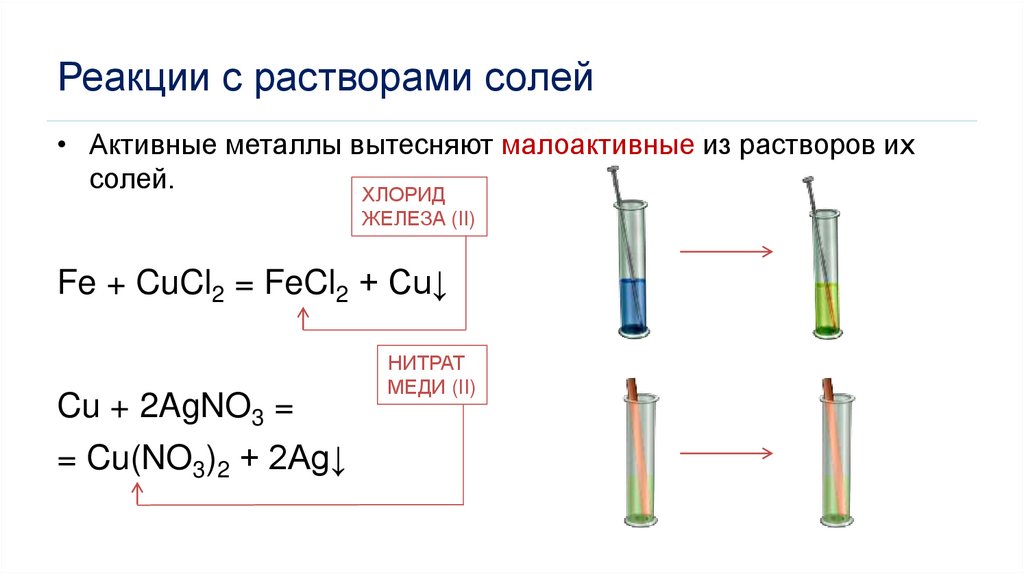
Реакции с растворами солей• Активные металлы вытесняют малоактивные из растворов их
солей.
ХЛОРИД
ЖЕЛЕЗА (II)
Fe + CuCl2 = FeCl2 + Cu↓
Cu + 2AgNO3 =
= Cu(NO3)2 + 2Ag↓
НИТРАТ
МЕДИ (II)
21.
Условия протекания реакций металлов срастворами солей:
• щелочные металлы брать нельзя, так как они будут
взаимодействовать с водой;
• металл должен находится левее того металла, который входит в
состав соли;
• в данных реакциях должна образоваться растворимая соль.
22.
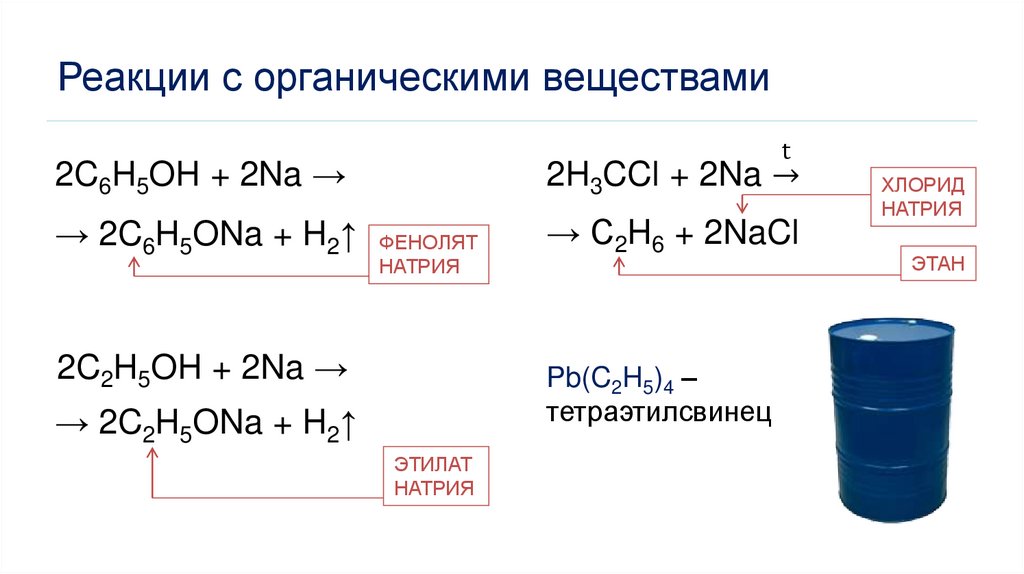
Реакции с органическими веществамиt
2C6H5OH + 2Na →
2H3CCl + 2Na ՜
→ 2C6H5ONa + H2↑ ФЕНОЛЯТ
→ C2H6 + 2NaCl
2C2H5OH + 2Na →
Pb(C2H5)4 –
тетраэтилсвинец
НАТРИЯ
→ 2C2H5ONa + H2↑
ЭТИЛАТ
НАТРИЯ
ХЛОРИД
НАТРИЯ
ЭТАН
23.
• О химической активности металлов можно судить по ихрасположению в электрохимическом ряду напряжений металлов;
• чем левее расположен металл, тем выше его химическая
активность в водном растворе;
• активные металлы размещаются в начале вытеснительного
ряда, а малоактивные – в конце;
• металлы реагируют как с простыми веществами – неметаллами,
так и со сложными: оксидами, кислотами, основаниями и солями.

















 Химия
Химия








