Похожие презентации:
Химия. Лекция 1
1. Строение атомов химических элементов
2. Атом
— частица вещества микроскопических размеров и массы,наименьшая часть химического элемента, являющаяся носителем
его химических свойств.
Название ввёл древнегреческий учёный Демокрит.
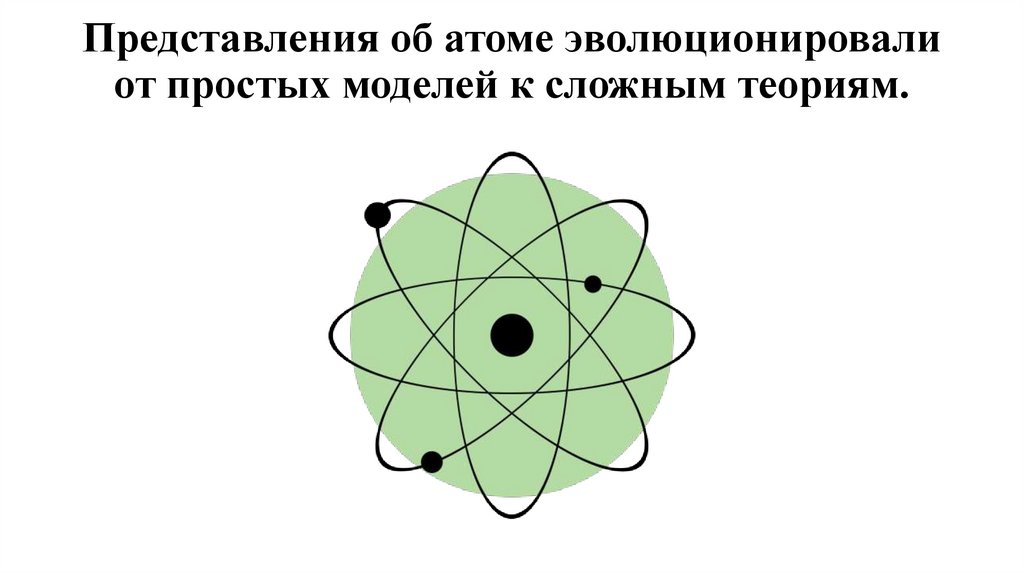
3. Представления об атоме эволюционировали от простых моделей к сложным теориям.
4. Сферическая модель Дальтона (1803 г.)
Атом представлялся как неразрушимая сфера.Считалось, что атомы неделимы.
• Все атомы одного и того же элемента равны друг другу, у
них одинаковый объём и масса.
• Атомы разных элементов различаются по объёму и массе.
• Существует столько же типов атомов, сколько и элементов.
• Атомы неизменны и не могут быть уничтожены, их нельзя
ни разрушить, ни создать химическими реакциями.
• В химических реакциях происходит перегруппировка
атомов исходных материалов, они связаны друг с другом в
определённых числовых пропорциях.
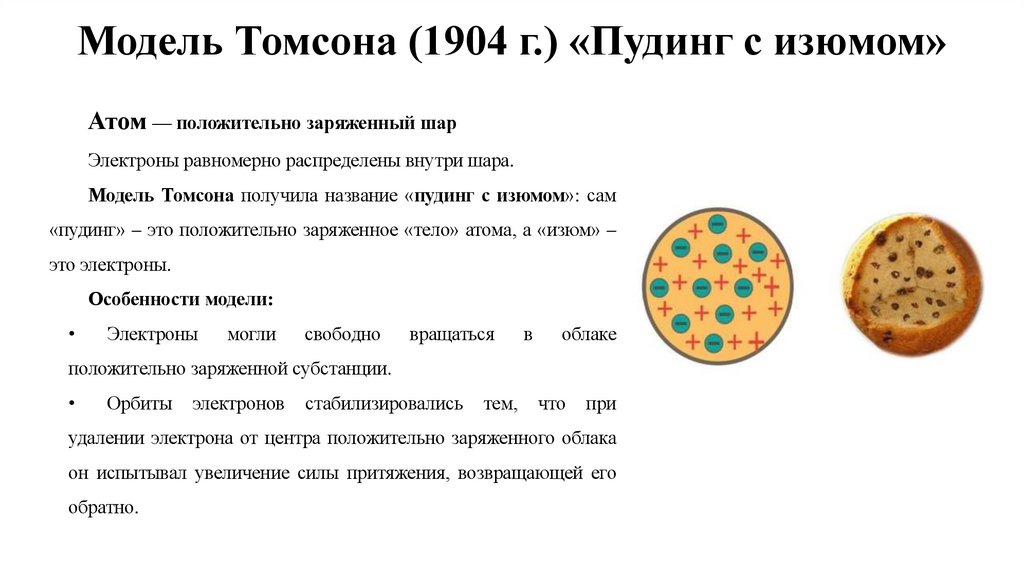
5. Модель Томсона (1904 г.) «Пудинг с изюмом»
Атом — положительно заряженный шарЭлектроны равномерно распределены внутри шара.
Модель Томсона получила название «пудинг с изюмом»: сам
«пудинг» – это положительно заряженное «тело» атома, а «изюм» –
это электроны.
Особенности модели:
Электроны
могли
свободно
вращаться
в
облаке
положительно заряженной субстанции.
Орбиты
электронов
стабилизировались
тем,
что
при
удалении электрона от центра положительно заряженного облака
он испытывал увеличение силы притяжения, возвращающей его
обратно.
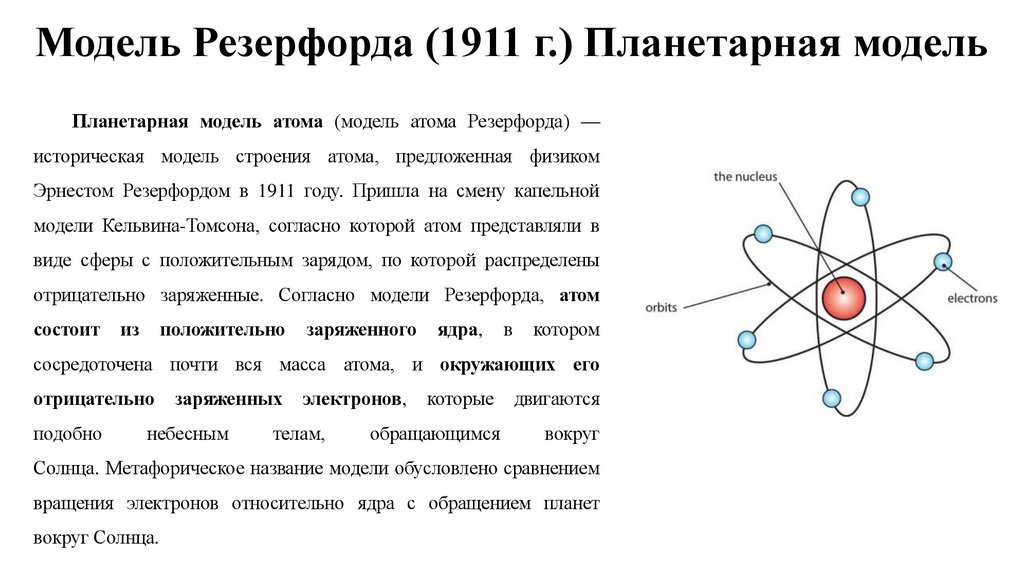
6. Модель Резерфорда (1911 г.) Планетарная модель
Планетарная модель атома (модель атома Резерфорда) —историческая модель строения атома, предложенная физиком
Эрнестом Резерфордом в 1911 году. Пришла на смену капельной
модели Кельвина-Томсона, согласно которой атом представляли в
виде сферы с положительным зарядом, по которой распределены
отрицательно заряженные. Согласно модели Резерфорда, атом
состоит
из
положительно
заряженного
ядра,
в
котором
сосредоточена почти вся масса атома, и окружающих его
отрицательно
подобно
заряженных
небесным
электронов,
телам,
которые
двигаются
обращающимся
вокруг
Солнца. Метафорическое название модели обусловлено сравнением
вращения электронов относительно ядра с обращением планет
вокруг Солнца.
7. Модель Бора (1913 г.) Квантовая модель
• Основные постулаты:• Электроны движутся только по разрешённым орбитам
• Каждая орбита имеет определённую энергию
• Возможен переход между орбитами с поглощением/выделением энергии
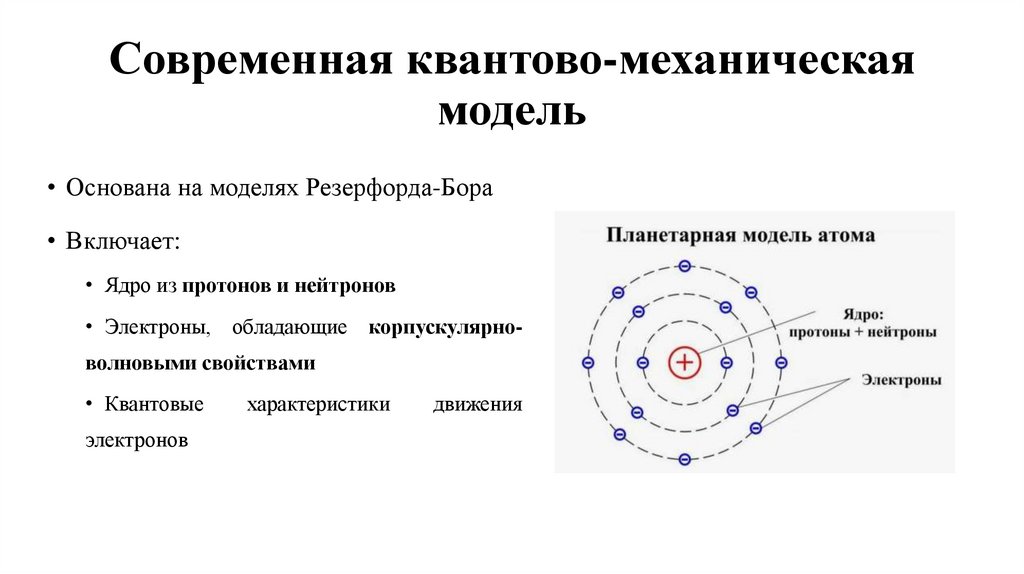
8. Современная квантово-механическая модель
• Основана на моделях Резерфорда-Бора• Включает:
• Ядро из протонов и нейтронов
• Электроны, обладающие корпускулярноволновыми свойствами
• Квантовые
электронов
характеристики
движения
9. Символический язык химии
Символический язык химииэто система условных обозначений и понятий, предназначенная для
краткой, ёмкой и наглядной записи и передачи химической ин-
формации.
10. Основные элементы символического языка
Основные элементы символического языкаХимические символы (знаки элементов)
• Представляют собой 1–2 буквы латинского алфавита (первая —
заглавная);
• Основаны на латинских названиях элементов;
• Например:
• H — водород (Hydrogenium);
• O — кислород (Oxygenium);
• C — углерод (Carboneum);
• Fe — железо (Ferrum);
• Au — золото (Aurum).
11.
Химические формулыПоказывают состав вещества: какие элементы и в каком количестве входят в мо
лекулу;
Индексы (цифры внизу справа) обозначают число атомов элемента в молекуле;
Если индекс равен 1, он не пишется;
Примеры:
• N2 — молекула азота (2 атома азота);
• H2O — вода (2 атома водорода, 1 атом кислорода);
• Fe2O3 — оксид железа(III) (2 атома железа, 3 атома кислорода).
Заряд и радикалы
Заряд иона указывается над символом (например, Na+, Cl−);
12.
Зачем нужен символический язык химииунификация: единый язык понятен химикам всего мира независимо от родного языка;
экономия места и времени: короткие символы и формулы заменяют длинные словесные опис
ания;
наглядность: структура формулы сразу даёт представление о составе и строении вещества;
удобство для расчётов: формулы легко использовать в уравнениях реакций, стехиометрически
х расчётах и т. п.
Таким образом, символический язык химии это фундамент, позволяющий точно и компактно о
писывать вещества, реакции и закономерности химического мира.
13. Химический элемент — это совокупность атомов с одинаковым зарядом ядра (одинаковым числом протонов)
Химический элемент —это совокупность атомов с одинаковым зарядом ядра
(одинаковым числом протонов)
Каждый элемент имеет:
- порядковый номер в Периодической системе Д. И. Менделеева;
- символ (1–2 латинские буквы);
- характерные химические свойства.
14.
Электронная конфигурация —это формула, показывающая распределение электронов по энергетическим уровням и подуровням
(орбиталям) в атоме.
Она позволяет:
- понять строение электронной оболочки;
- предсказать химические свойства элемента;
- объяснить закономерности Периодической системы.
15. Энергетические уровни и подуровни
Энергетические уровни и подуровниЭлектроны располагаются на энергетических уровнях (обозначают
ся номером n = 1, 2, 3 …), которые делятся на подуровни:
• s-подуровень — 1 орбиталь (максимум 2 электрона);
• p-подуровень — 3 орбитали (максимум 6 электронов);
• d-подуровень — 5 орбиталей (максимум 10 электронов);
• f-подуровень — 7 орбиталей (максимум 14 электронов).
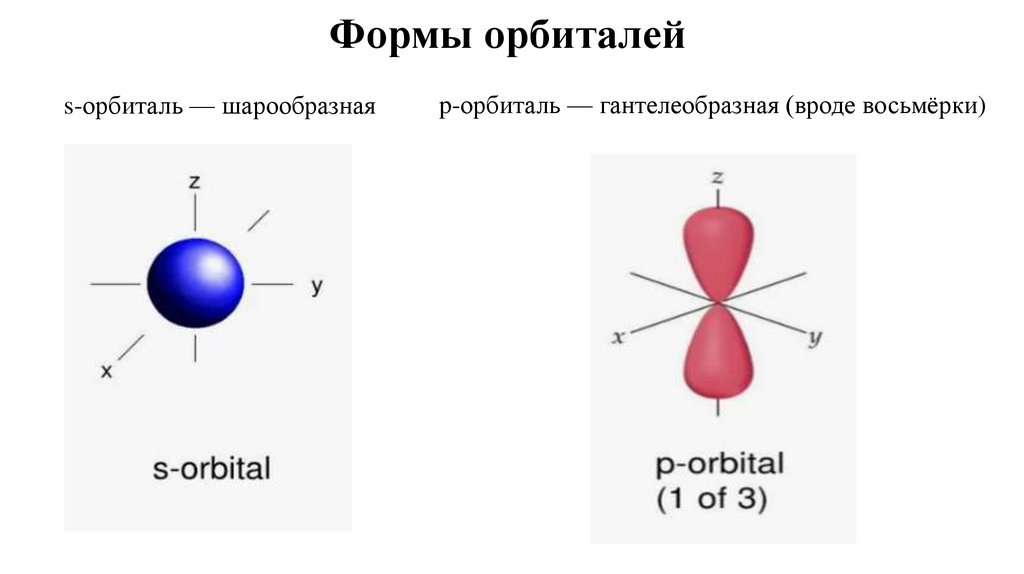
16. Формы орбиталей
s-орбиталь — шарообразнаяp-орбиталь — гантелеобразная (вроде восьмёрки)
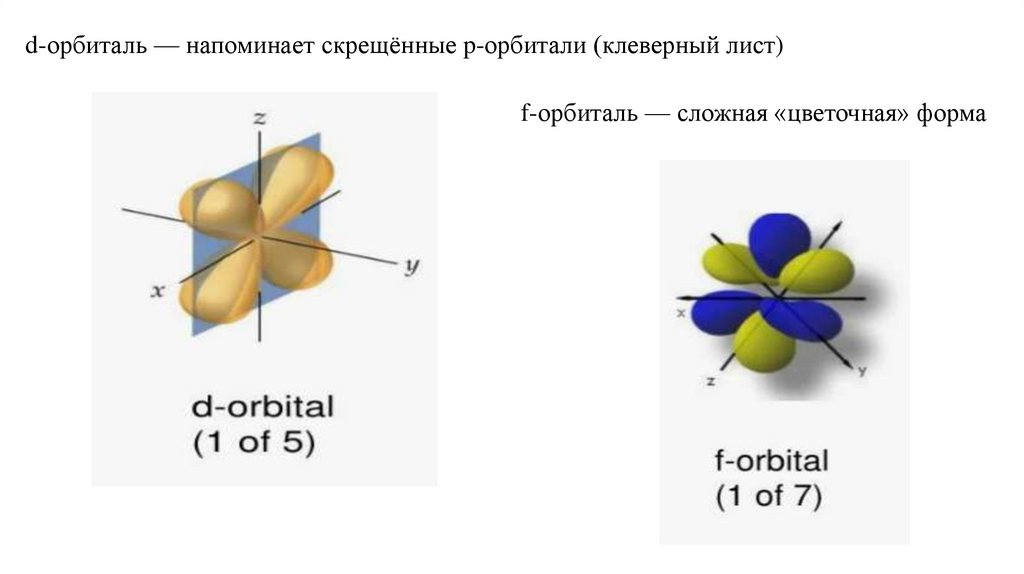
17.
d-орбиталь — напоминает скрещённые p-орбитали (клеверный лист)f-орбиталь — сложная «цветочная» форма
18.
Знание электронной конфигурации позволяет:• объяснять периодичность свойств элементов;
• предсказывать валентность и степени окисления;
• понимать природу химической связи;
• строить модели молекул и реакций.
19. Практическая работа
1. Группа делится на мини группы по 3-4 человека.2. Каждая мини группа выбирает 1 химический элемент, и готовит материал к
представлению мини проекта по этому элементу.
3. Разрабатывается:
-содержание;
-цель и задачи;
-актуальность;
-обьект и предмет;
-роль химического элемента для практического применения.
20.
21. Домашнее задание
Подготовка мини-проекта в формате презентации, и защита наследующей паре. Регламент 5-7 минут.













 Химия
Химия








