Похожие презентации:
Основные сведения о строении атома
1.
2.
НЕЙТРОНЭЛЕКТРОН
АТОМ
ЯДРО
ПРОТОН
3.
Основные сведения о строенииатома
4.
Дж. Томсон (1904 г.)«Пудинг с изюмом»
- атом состоит из положительного заряда,
равномерно распространенного по всему
объему атома, и электронов, колеблющихся
внутри этого заряда
5.
Э. Резерфорд (1911 г.)Планетарная, или
ядерная, модель атома
- внутри атома находится
положительно заряженное
ядро, занимающее
ничтожную часть объема
атома;
- весь положительный заряд
и почти вся масса атома
сосредоточены в ядре;
- электроны вращаются
вокруг ядра, они
нейтрализуют заряд ядра.
6.
Н. Бор (1913 г.)Квантовые
постулаты
- электроны в атоме вращаются по строго
определенным замкнутым орбитам, не
испуская и не поглощая энергии;
- при переходе электронов с одной орбиты на
другую происходит поглощение или
выделение энергии.
7.
Современная квантовая модельстроения атома
Электрон имеет двойственную (корпускулярноволновую) природу:
- подобно частице, электрон имеет массу и
заряд,
- движущийся электрон обладает свойствами
волны.
Электрон в атоме не движется по
определенной траектории, а может находиться
в любой части около-ядерного пространства.
8.
Атом — это наименьшая частицахимического элемента, сохраняющая все его
химические свойства.
Атом состоит из ядра, имеющего
положительный электрический заряд, и
отрицательно заряженных электронов.
9.
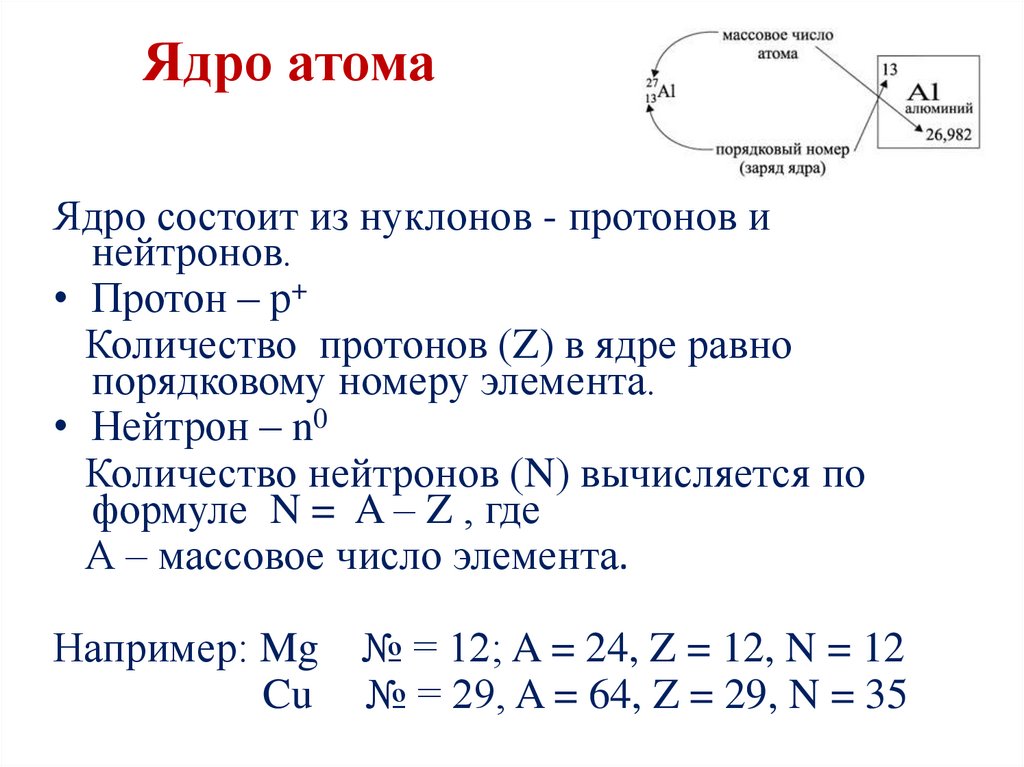
Ядро атомаЯдро состоит из нуклонов - протонов и
нейтронов.
• Протон – р+
Количество протонов (Z) в ядре равно
порядковому номеру элемента.
• Нейтрон – n0
Количество нейтронов (N) вычисляется по
формуле N = A – Z , где
А – массовое число элемента.
Например: Mg
Cu
№ = 12; A = 24, Z = 12, N = 12
№ = 29, A = 64, Z = 29, N = 35
10.
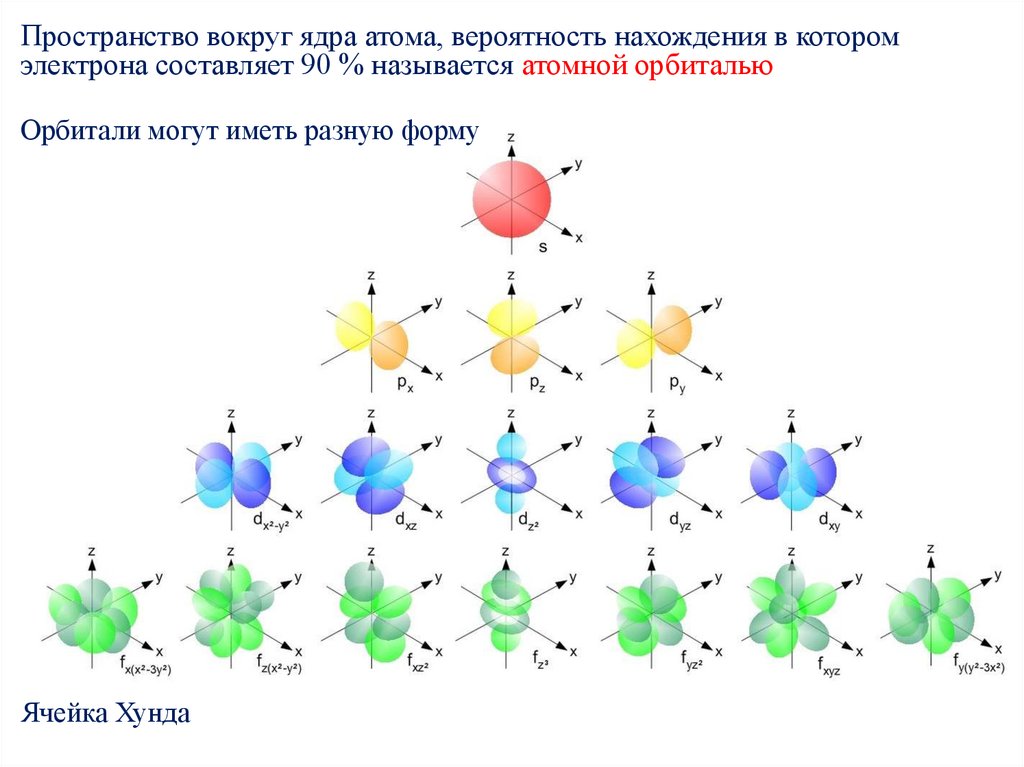
Пространство вокруг ядра атома, вероятность нахождения в которомэлектрона составляет 90 % называется атомной орбиталью
Орбитали могут иметь разную форму
Ячейка Хунда
11.
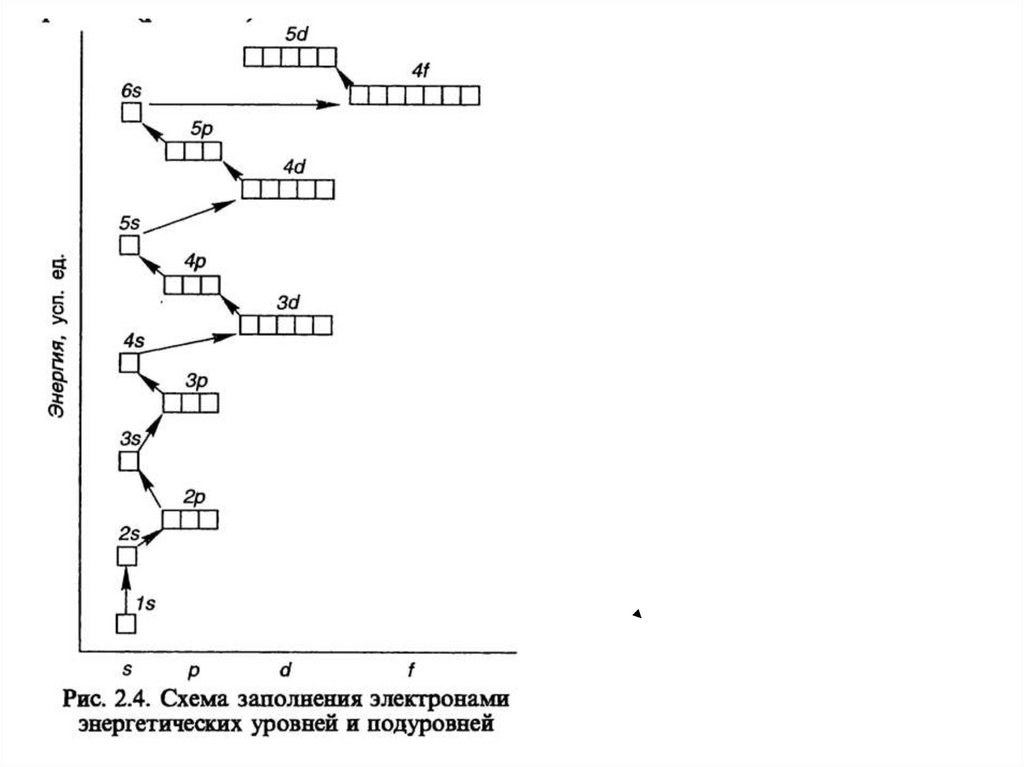
Электронная оболочка атома• Под электронной оболочкой понимают
совокупность всех электронов в атоме.
• Электроны близкие по энергии образуют
энергетический уровень
• Каждый уровень имеет свои подуровни:
1 период – 1 подуровень s
2 период – 2 подуровня sp
3 период – 3 подуровня spd
4 период – 4 подуровня spdf
Распределение электронов в атоме изображают с
помощью электронной или электронно – структурной
конфигурации
12.
13.
HHe
Li
Be
Bий.
14.
III
III
период период период
1S2
2S22P6
3S23P6
IV
V
VI
VII
период
период
период
период
4S23d104P6 5S24d105P6 6S25d104 f146P6 7S26d105 f147P6
Напишите электронные и электронно – структурные
конфигурации атомов следующих элементов:
N Si Fe Kr Te W
Могут ли электроны иона Al3+ находиться на
следующих орбиталях:
А) 2p
Б) 1р
В) 3d
15.
• Какой инертный газ и ионы какихэлементов имеют одинаковую
конфигурацию с частицей, образующейся в
результате удаления из атома кальция всех
валентных электронов?











 Химия
Химия








