Похожие презентации:
37d9d6979626416f82cbc4367e7b8c23
1.
2.
1.Строение, химическая связь(структурная формула)
H-N-H
|
H
Связь ковалентная полярная.
Молекула полярная.
3.
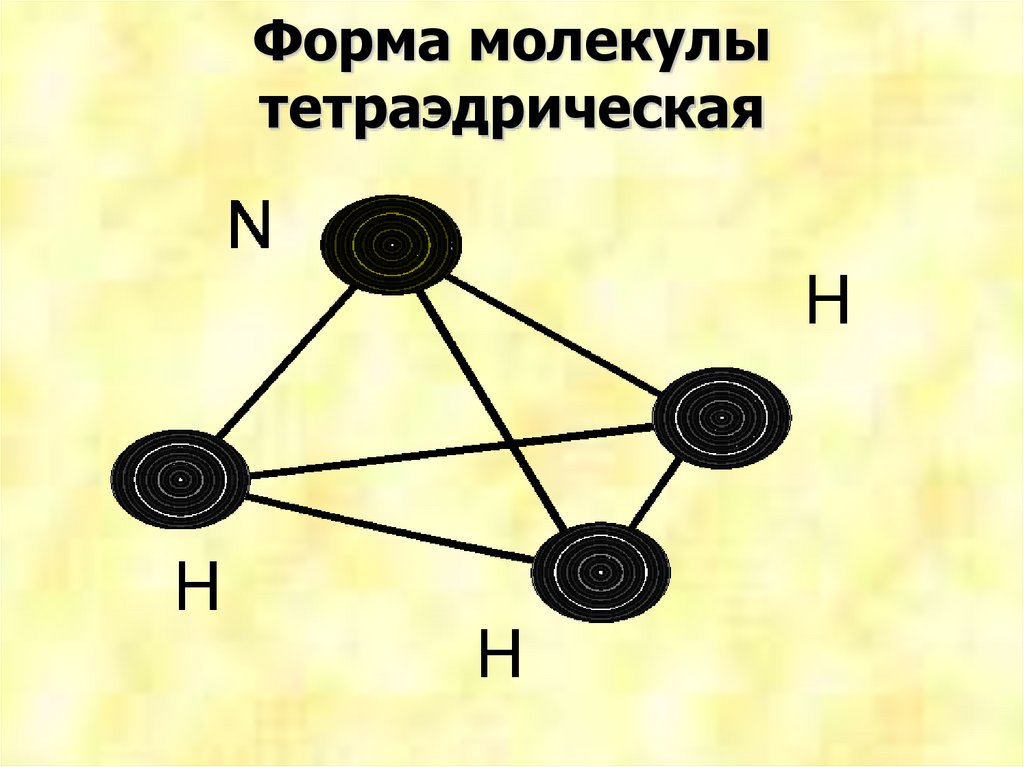
Форма молекулытетраэдрическая
4.
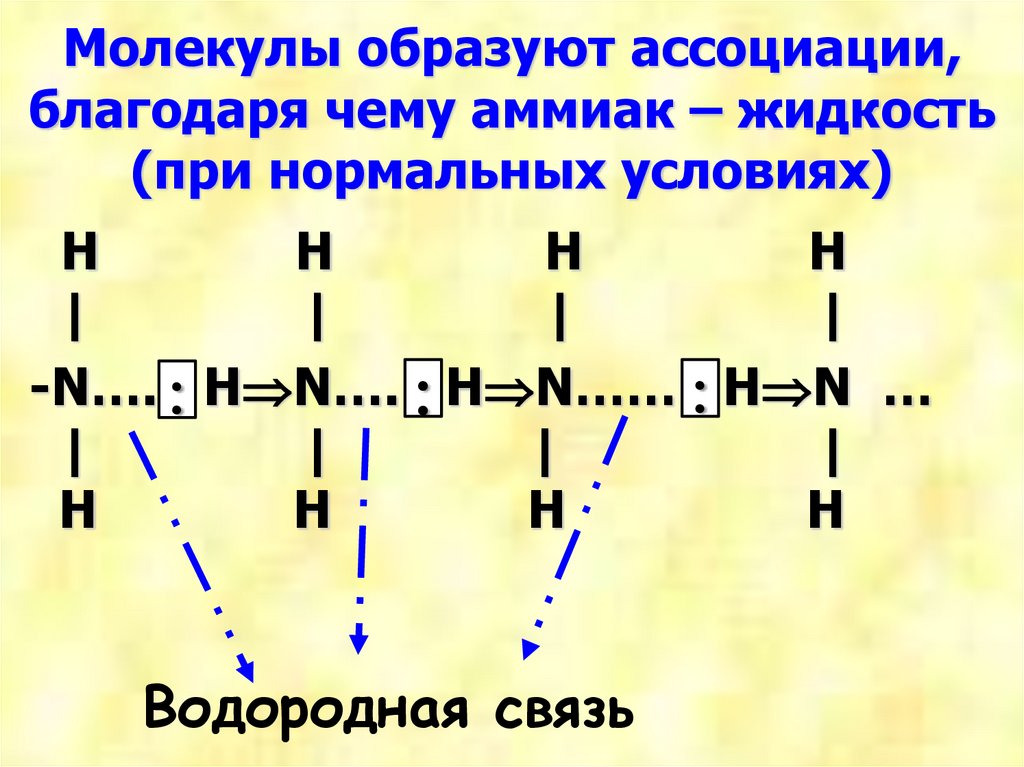
Молекулы образуют ассоциации,благодаря чему аммиак – жидкость
(при нормальных условиях)
H
H
H
H
|
|
|
|
-N…. H N…. H N…… H N …
|
|
|
|
H
H
H
H
Водородная связь
5.
Это особый вид химической межмолекулярной связи эта связь – водородная(….слабая)
Водородная связь-это хим. связь
между атомами водорода одной
молекулы и атомами очень электроотрицательных элементов
(фтора, кислорода, азота),
имеющих неподелённые
электронные пары.
6.
2.Получение.а) Промышленный способ:
условия: P=30МПа, t=450C, kаt.
N2 +3H2=2NH3 +Q (ОВР)
где kat-катализатор, в качестве
которого используют Fe c Al2O3
или Pt
7.
б) Лабораторный способ:2NH4Cl +Ca(OH)2=
хлорид
аммония
= CaCl2+ 2NH3 +2H2О (РИО)
8.
3.Физические свойства:а) газ-ядовитый, удушливый
б) без цвета
в) с резким запахом
г) очень хорошо растворим в воде
( в 1 V-ме воды растворяется
700 V NH3) д)tкип= -33,40С
е) при повышенном давлении
легко сжижается.
ё) при испарении жидкого аммиака из окружающей среды поглощается много тепла.
9.
4.Химические свойства:Реакции с изменением С.О. азота
2 NH3= N2 +3H2 (ОВР) при
нагревании
1.Горение
4NH3+ 3O2=2N2О+6H2O(ОВР)
2.Каталитическое окисление
Pt,Rh
4NH3 + 5O2 = 4 NO + 6H2O(ОВР)
10.
Реакции без изменения С.О. азотаNH3 + H2О = NH4OН
NH4OH =[NH4]+ + OHион
аммония
гидроксид-ион
гидроксид аммония (нашатырный
спирт)- слабый электролит
NH4OH
NH3 + H2O
11.
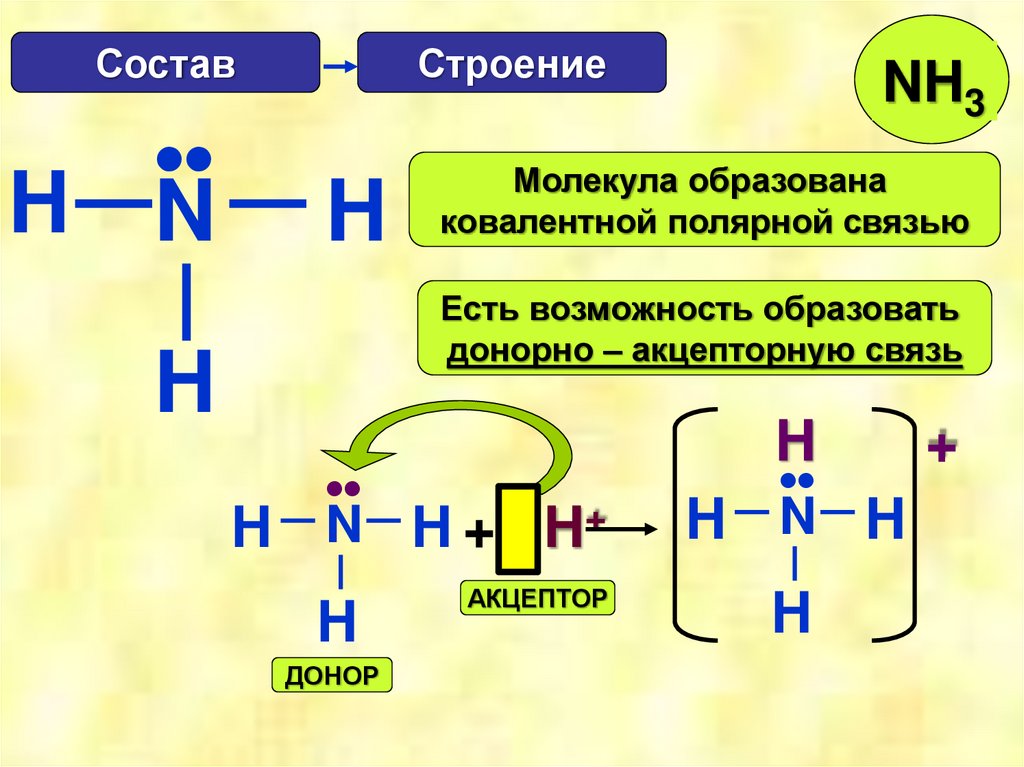
Состав•
H N
Строение
H
NH3
Молекула образована
ковалентной полярной связью
Есть возможность образовать
донорно – акцепторную связь
H
H
•
N H + H+
H
ДОНОР
АКЦЕПТОР
H
H
•
N H
H
+
12.
Донорно-акцепторная связьТакой механизм образования
ковалентной связи, которая
возникает не в результате
обобществления непарных
электронов, а благодаря
свободной электронной паре,
имеющейся у одного из
атомов, называется
донорно-акцепторным.
13.
14.
Аммиак слабое основание иводные растворы его
обладают щелочной
реакцией. NH3 образует
соли аммония (кислые и
средние) почти со всеми
известными кислотами:
15.
NH3 + H2SO4 = NH4HSO4,гидросульфат аммония
2NH3 + H2SO4 = (NH4)2SO4.
сульфат аммония
NH3 + HCl =NH4Cl
хлорид аммония
«дым без огня»
16. Физические свойства солей аммония.
а) твёрдые вещества;б) имеют кристаллическое
строение (ионные кристаллические решётки);
в) хорошо растворимые в воде.
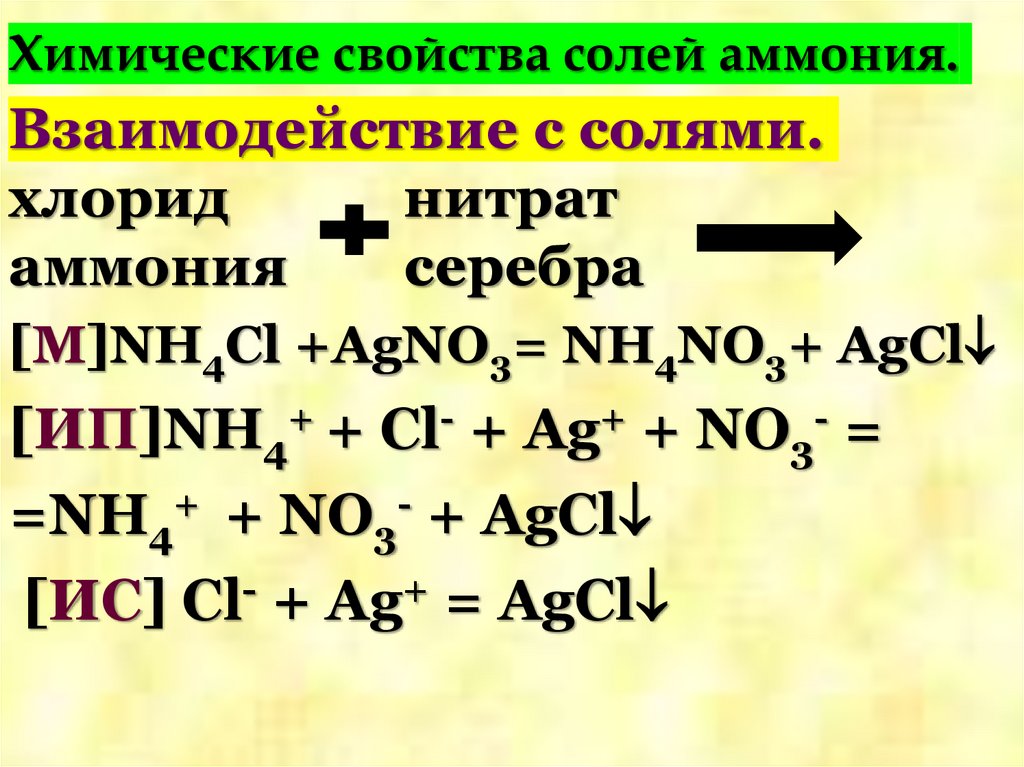
17. Химические свойства солей аммония.
Взаимодействие с солями.хлорид
нитрат
аммония
серебра
[M]NH4Cl +AgNO3= NH4NO3+ AgCl
[ИП]NH4+ + Cl- + Ag+ + NO3- =
=NH4+ + NO3- + AgCl
[ИС] Cl- + Ag+ = AgCl
18.
сульфат аммония + хлорид бария[M](NH4)2SO4 + BaCl2 = 2NH4Cl +
BaSO4
[ИП]2NH4++SO42- + Ba2+ +2Cl - =
2NH4 + +2Cl - + BaSO4
[ИС]Ba2+ + SO42- = BaSO4
19.
Взаимодействие с кислотами.карбонат аммония + соляная
кислота
[M](NH4 )2СО3 + 2HCl = 2NH4Cl +
CO2 + H2O
[ИП]2NH4 + + СО32- + 2H ++2Cl- =
2NH4 + + 2Cl- + CO2 + H2O
[ИС]СО32- + 2H + = CO2 + H2O
20.
Взаимодействие с щелочами.NH4Cl+ NaOH NH3 + H2O + NaCl
Взаимодействие с щелочами – это
качественная реакция на соли
аммония (признак реакции:
выделение газа с характерным
запахом, окрашивающий влажную
лакмусовую бумажку в синий цвет)
21.
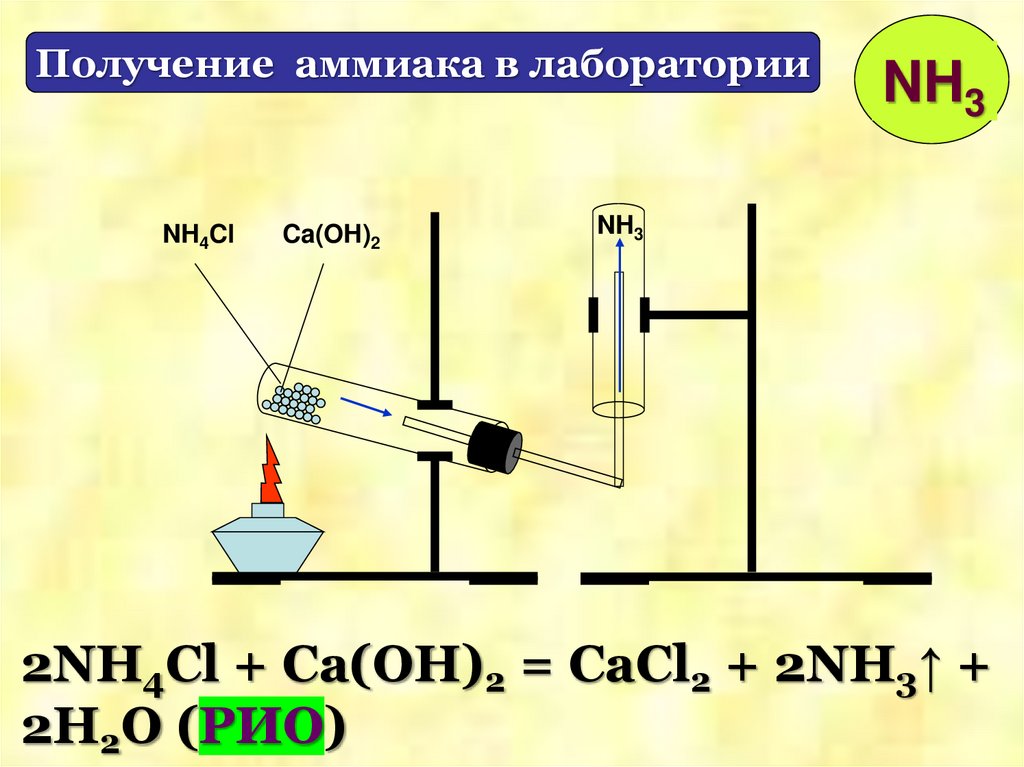
Получение аммиака в лабораторииNH4Cl
Ca(OH)2
NH3
NH3
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ +
2H2O (РИО)
22.
Термическое разложение.Все аммонийные соли при нагревании разлагаются.
соли
летучих
NH4NO2 = 2H2O + N2
кислот
(NH4)2CO3 =2NH3 + H2O + CO2
NH4Cl = NH3 + HCl соли кислот
окислителей
(NH4)2Cr2O7 = Cr2O3 +
4H2O + N2 «вулкан»
23.
Получение солей аммонияПолучают их при взаимодействии
NH3 или NH4 OH с кислотами:
1)NH3 + HCl = NH4 Сl
2)NH3+HNO3=NH4 NO3
3)2NH4 OH+H2 SO4=
=(NH4)2 SO4+2Н2O
24.
5.Применение.а) производство азот-
ной кислоты
б) производство удобрений
в) нашатырный спирт
г) взрывчатые вещества
д) в быту
25.
Русский химик Д.Н ПрянишниковСоли аммония
Азотные удобрения
26. Аммиачная селитра-(нитрат аммония)- прекрасное азотное удобрение.
27. Аммиачная селитра – взрывчатое (нитрат аммония) вещество.
28.
Смесь нитрата аммония салюминием и углем - аммонал
(взрывные работы, в
пиротехнике)
29. Нашатырь (хлорид аммония)
• Паяние, лужение •Изготовлениегальванических
металлов
элементов
Хлорид аммония NH4Cl используют при паянии, так как он очищает поверхность металла от
оксидной плёнки и к ней хорошо
пристаёт припой.
30.
Гидрокарбонат аммонияNH4HCO3 и
карбонат аммония
(NH4)2CO3
Применяют в кондитерском деле,
так как они легко разлагаются при
нагревании и образуют газы, разрыхляющие тесто и делающие его
пышным, например:
NH4HCO3 = NH3↑ + Н2O↑ + CO2↑
31.
Дома:прочитать§17,Упр№10
И
№12 стр93;


























 Химия
Химия








