Похожие презентации:
Электронный баланс 2.0
1. Электронный баланс
2.
Окислительно-восстановительные реакции (ОВР) — этореакции, в которых происходит передача электронов от одного
вещества к другому.
+
Обычные реакции:
-
+ -
+ -
+
3+
2+
-
AgNO₃ + HCl → AgCl↓ + HNO₃
2-
0
Окислительно-восстановительные H2S + Fe2O3 → FeS + S + H2O
реакции:
3. Определение степени окисления
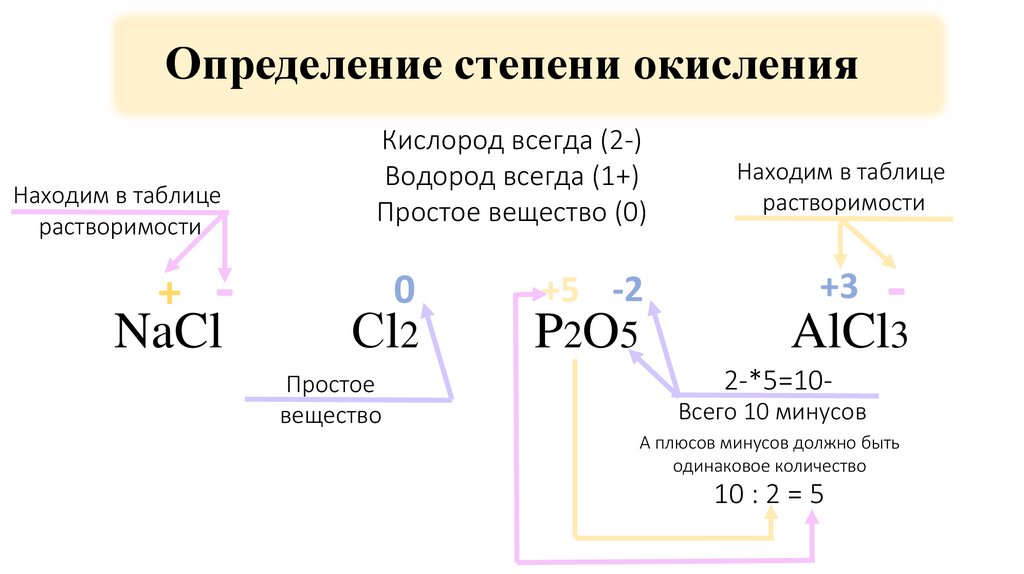
Кислород всегда (2-)Водород всегда (1+)
Простое вещество (0)
NaCl
Сl2
P2O5
AlCl3
4. Определение степени окисления
Находим в таблицерастворимости
+
-
NaCl
Кислород всегда (2-)
Водород всегда (1+)
Простое вещество (0)
0
Сl2
Простое
вещество
+5 -2
P2O5
Находим в таблице
растворимости
+3
-
AlCl3
2-*5=10Всего 10 минусов
А плюсов минусов должно быть
одинаковое количество
10 : 2 = 5
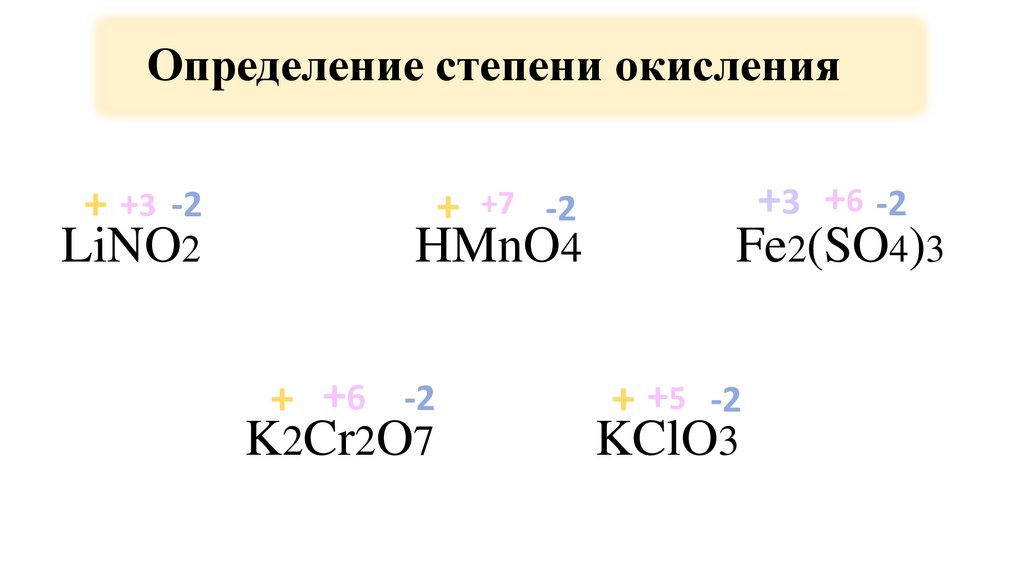
5.
Определение степени окисления+ +3 -2
LiNO2
+ +7 -2
HMnO4
+ +6 -2
K2Cr2O7
+3 +6 -2
Fe2(SO4)3
+ +5 -2
KClO3
6.
Определение степени окисленияCH4
ZnS
NO2
Ca3(PO4)2
Al2(SO4)3
SO3
MgSO4
Al2O3
7.
Определение степени окисленияK2S
Na3PO4
NaNO2
ZnSiO3
KClO3
MnO2
SO2
Cl2O7
8. Электронный баланс Реакции ОВР
9. Окислитель – атомы, ионы или молекулы, принимающие электроны. Восстановитель – атомы, ионы или молекулы, отдающие электроны.
10.
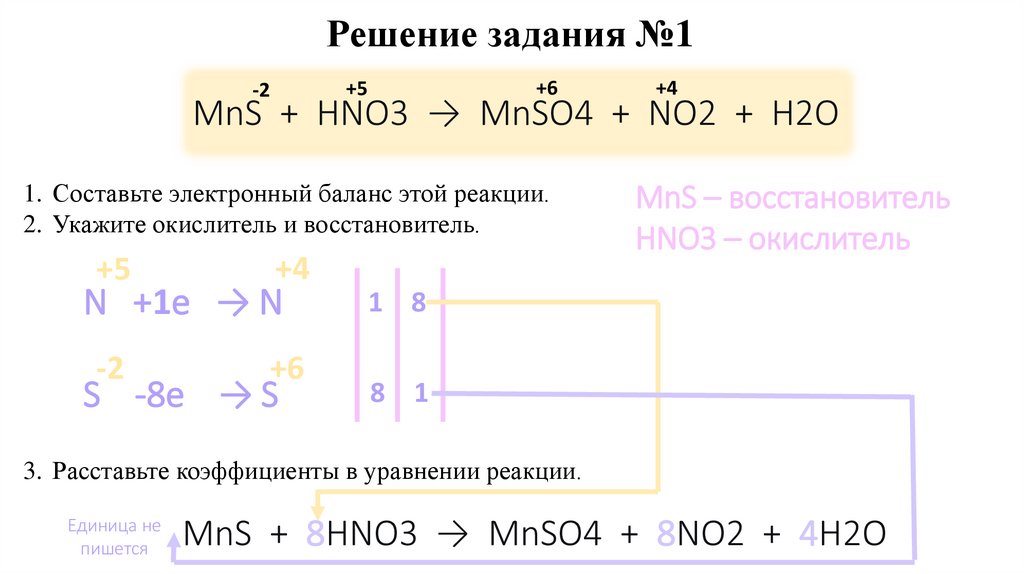
Задание №1MnS + HNO3 → MnSO4 + NO2 + H2O
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
3. Расставьте коэффициенты в уравнении реакции.
MnS + HNO3 → MnSO4 + NO2 + H2O
11.
Решение задания №1+6
+5
-2
+4
MnS + HNO3 → MnSO4 + NO2 + H2O
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
+5
+4
N +1e → N
-2
+6
S -8e → S
MnS – восстановитель
HNO3 – окислитель
1 8
8 1
3. Расставьте коэффициенты в уравнении реакции.
Единица не
пишется
MnS + 8HNO3 → MnSO4 + 8NO2 + 4H2O
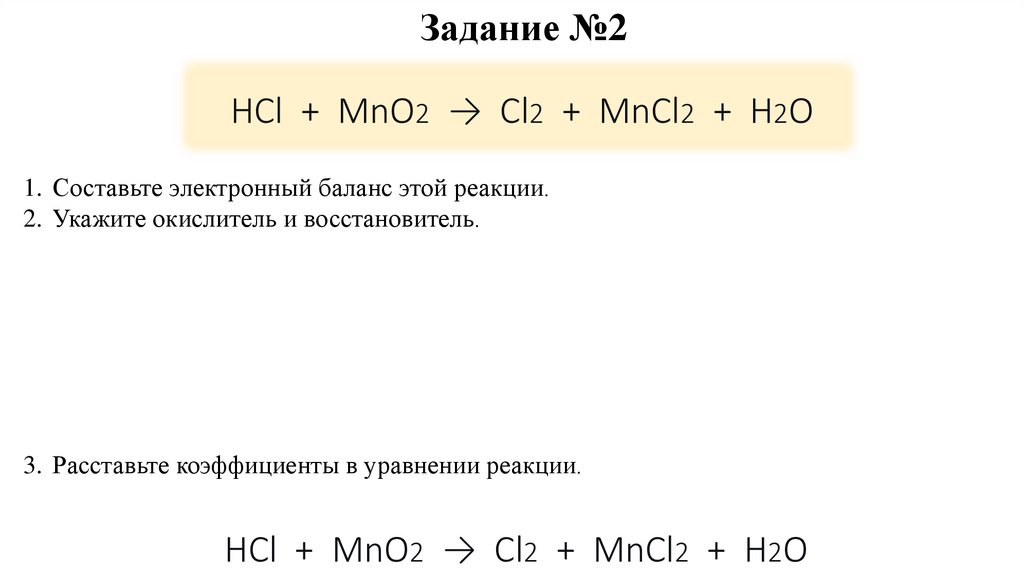
12.
Задание №2HCl + MnO2 → Cl2 + MnCl2 + H2O
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
3. Расставьте коэффициенты в уравнении реакции.
HCl + MnO2 → Cl2 + MnCl2 + H2O
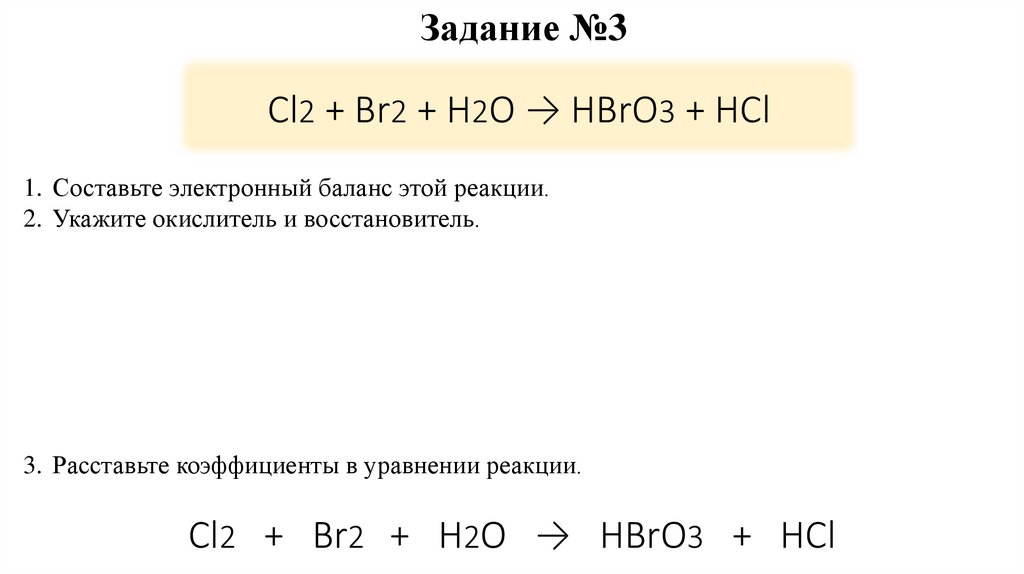
13. Cl2 + Br2 + H2O → HBrO3 + HCl
Задание №3Cl2 + Br2 + H2O → HBrO3 + HCl
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
3. Расставьте коэффициенты в уравнении реакции.
Cl2 + Br2 + H2O → HBrO3 + HCl
14.
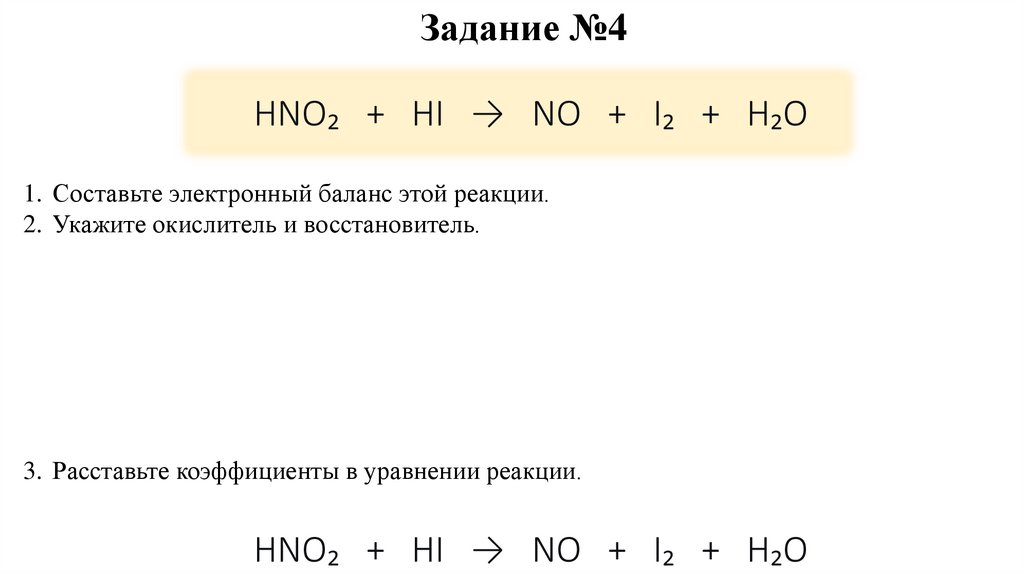
Задание №4HNO₂ + HI → NO + I₂ + H₂O
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
3. Расставьте коэффициенты в уравнении реакции.
HNO₂ + HI → NO + I₂ + H₂O
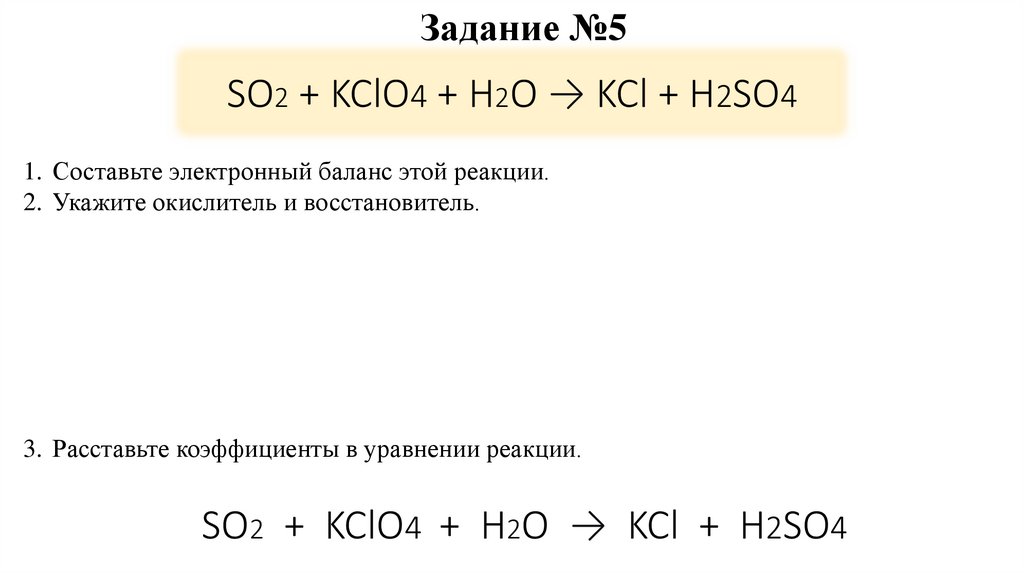
15. SO2 + KClO4 + H2O → KCl + H2SO4
Задание №5SO2 + KClO4 + H2O → KCl + H2SO4
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
3. Расставьте коэффициенты в уравнении реакции.
SO2 + KClO4 + H2O → KCl + H2SO4
16.
Задание №6H2S + Fe2O3 → FeS + S + H2O
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
3. Расставьте коэффициенты в уравнении реакции.
H2S + Fe2O3 → FeS + S + H2O
17.
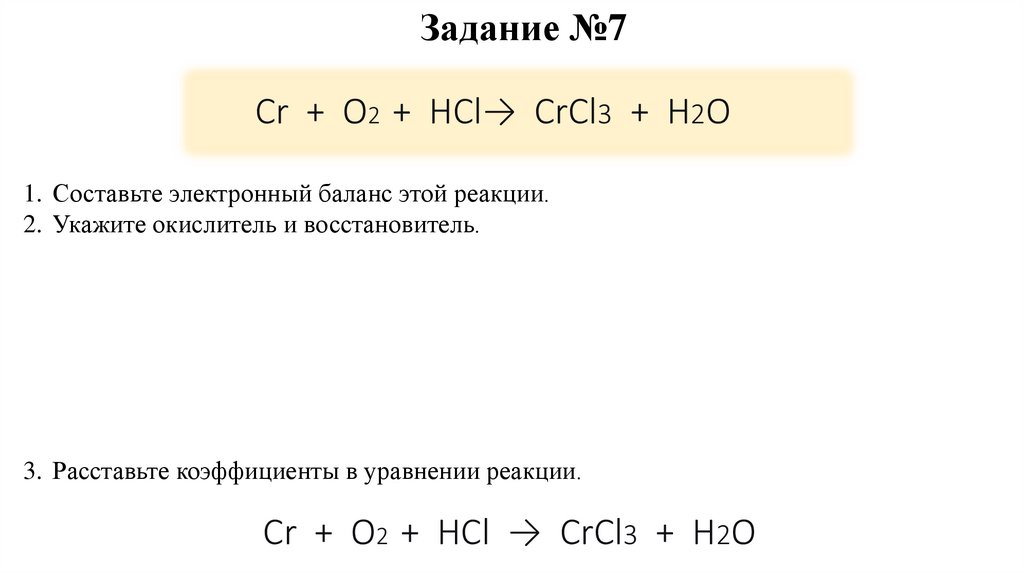
Задание №7Cr + O2 + HCl→ CrCl3 + H2O
1. Составьте электронный баланс этой реакции.
2. Укажите окислитель и восстановитель.
3. Расставьте коэффициенты в уравнении реакции.
Cr + O2 + HCl → CrCl3 + H2O










 Химия
Химия








