Похожие презентации:
3_III_A_gruppa (1)
1. IIIA группа
2.
3. История открытия элементов
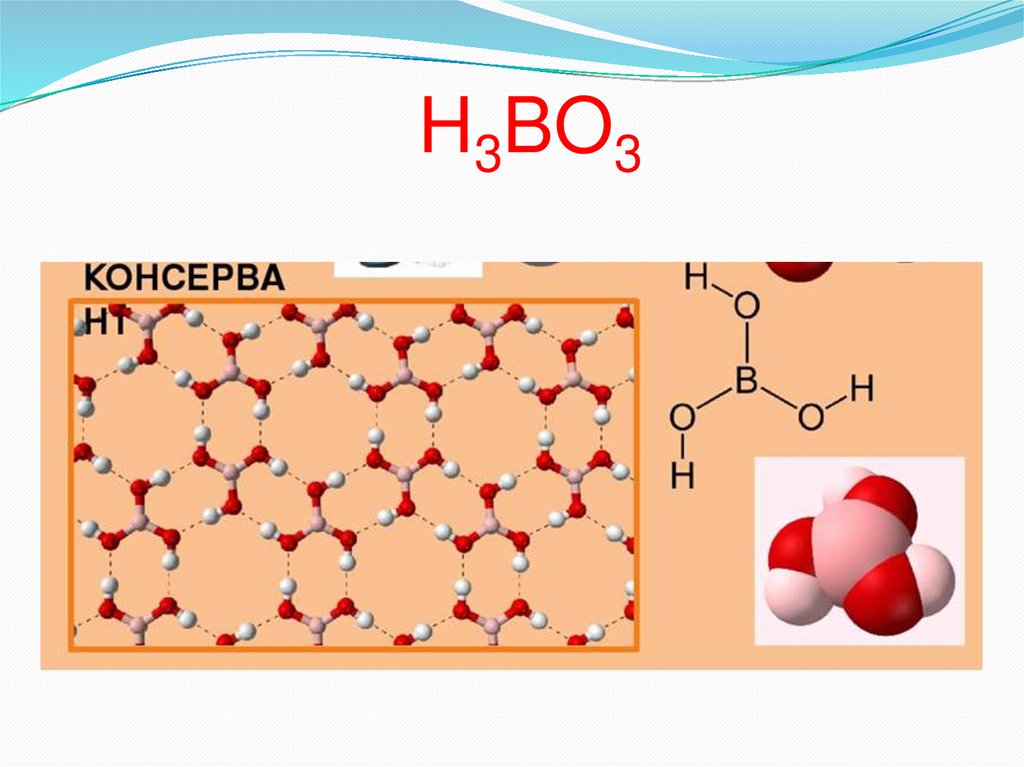
Бор известен с раннего средневековья в виде егосоединений (бура, борная кислота)
Алюминий получен в 1825 г Эрстедом (франц.) по
реакции: AlF3 + 3K = 3KF + Al
Галлий предсказал в 1870 г Д.И. Менделеев,
открыл в 1875 г Лекок де Буабодран (франц.)
Индий открыли в 1863 г методом спектрального
анализа полиметаллических руд Рейх и Рихтер
(нем.)
Таллий открыл в 1861 г методом спектрального
анализа отходов сернокислотного производства
Крукс (англ.)
4. Происхождение названий
Бор – в честь распространенного соединениябора – буры
Алюминий – от алюмина (лат.) – так с древности
называли квасцы, глину
Галлий – в честь Франции (Галлия – древнее
название Франции)
Индий – в честь краски индиго – по ярко-синей
линии в его спектре
Таллий – от таллос (греч.) – молодая зеленая
ветвь – по зеленой линии в его спектре
5.
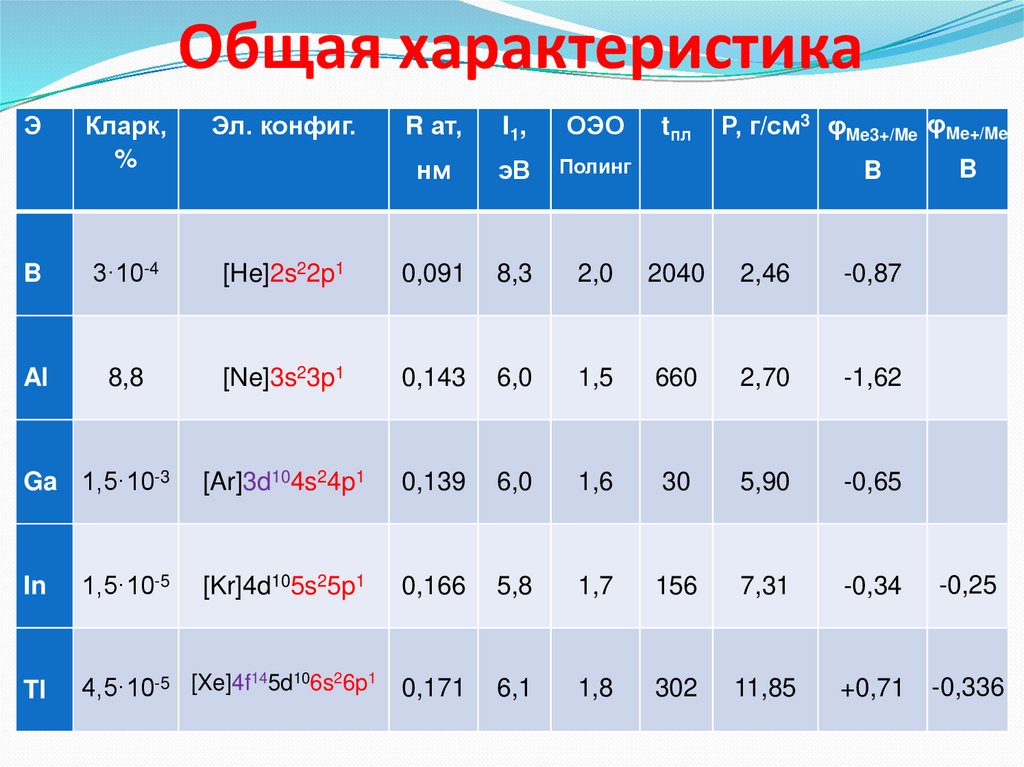
Общая характеристикаЭ
Кларк,
%
Эл. конфиг.
B
3·10-4
Al
8,8
Ρ, г/см3 φMe3+/Me φMe+/Me
R ат,
I1 ,
ОЭО
нм
эВ
Полинг
[He]2s22p1
0,091
8,3
2,0
2040
2,46
-0,87
[Ne]3s23p1
0,143
6,0
1,5
660
2,70
-1,62
Ga 1,5·10-3
[Ar]3d104s24p1
0,139
6,0
1,6
30
5,90
-0,65
In
1,5·10-5
[Kr]4d105s25p1
0,166
5,8
1,7
156
7,31
-0,34
-0,25
Tl
14
10
2
1
4,5·10-5 [Xe]4f 5d 6s 6p 0,171
6,1
1,8
302
11,85
+0,71
-0,336
tпл
B
B
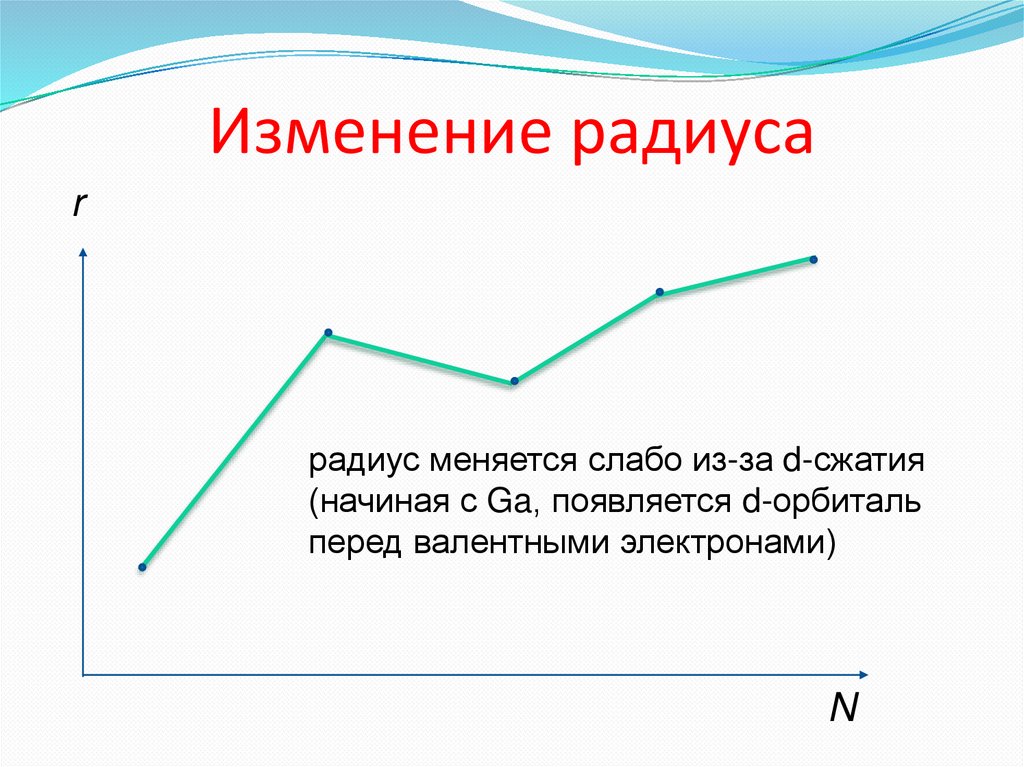
6. Изменение радиуса
rрадиус меняется слабо из-за d-сжатия
(начиная с Ga, появляется d-орбиталь
перед валентными электронами)
N
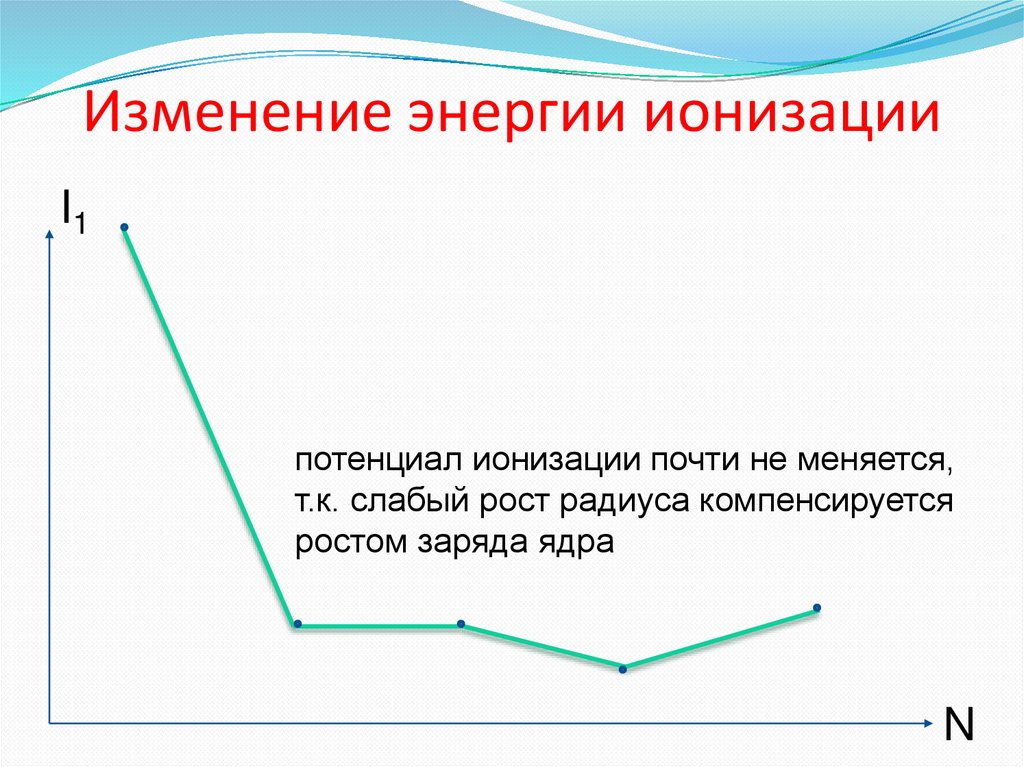
7. Изменение энергии ионизации
I1потенциал ионизации почти не меняется,
т.к. слабый рост радиуса компенсируется
ростом заряда ядра
N
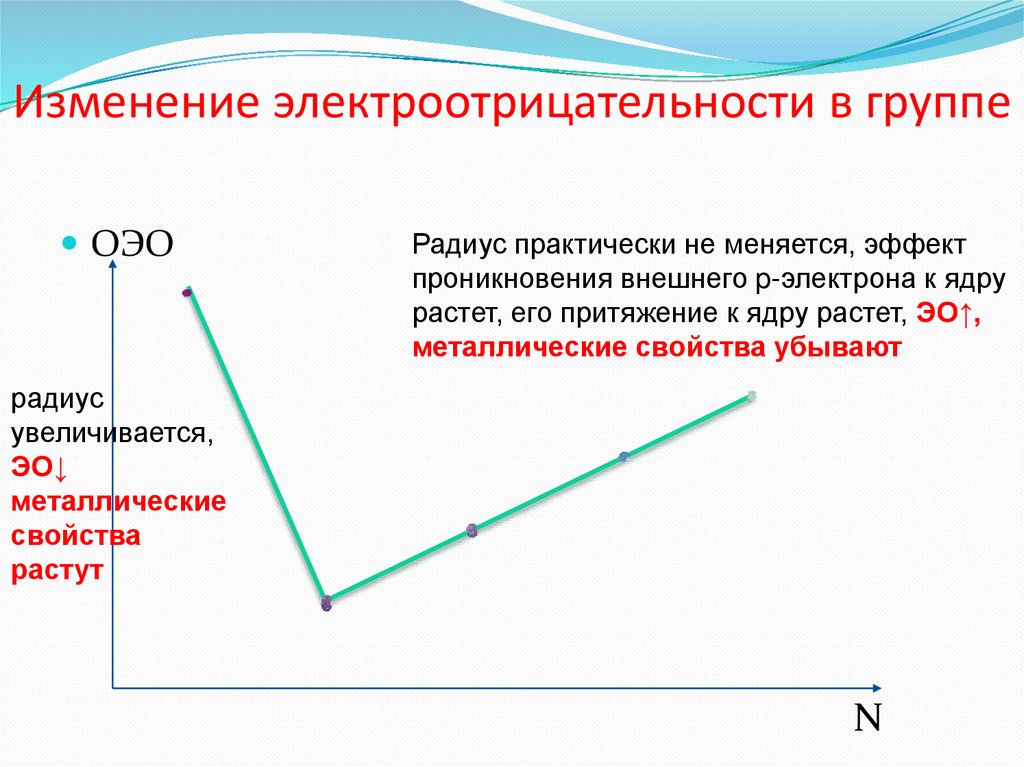
8. Изменение электроотрицательности в группе
ОЭОРадиус практически не меняется, эффект
проникновения внешнего p-электрона к ядру
растет, его притяжение к ядру растет, ЭО↑,
металлические свойства убывают
радиус
увеличивается,
ЭО↓
металлические
свойства
растут
N
9.
Электронная конфигурация и степени окисленияХарактеристические с.о. = 0, +1, +3
В
Al
Ga
In
Tl
Увеличивается число электронных слоев,
увеличивается эффект проникновения ns-электронов
к ядру, усиливается их связь с ядром, уменьшается
способность атомов отдавать s-электроны,
уменьшается устойчивость с.о. +3,
увеличивается устойчивость с.о. +1.
10. Устойчивые степени окисления
Для таллия эффект проникновения 6s-электронов к ядруособенно силен (эффект инертной 6s-электронной пары,
т.к. перед 6s-электронами находится 4fкайносимметричная орбиталь, а также 5d, поэтому эффект
проникновения очень велик. 6s-электроны сильно
притягиваются с ядру и не склонны к образованию связей.
Поэтому с.o. +1 для таллия особенно устойчива, а с.о. +3 –
неустойчива.
1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p1
В
Al
Ga
In
Tl
Устойчивые степени окисления
+3
+3
+3
+3
+1
не проявляет с.о.+1 !
11. Нахождение в природе и получение
Т.к. + 3 – самая устойчивая с.о. для бора,алюминия, галлия и индия, все они содержатся в
природе в виде соединений в с.о.+3.
Для таллия самая устойчивая с.о. +1, поэтому в
природе он содержится в виде соединений в с.о.
+1.
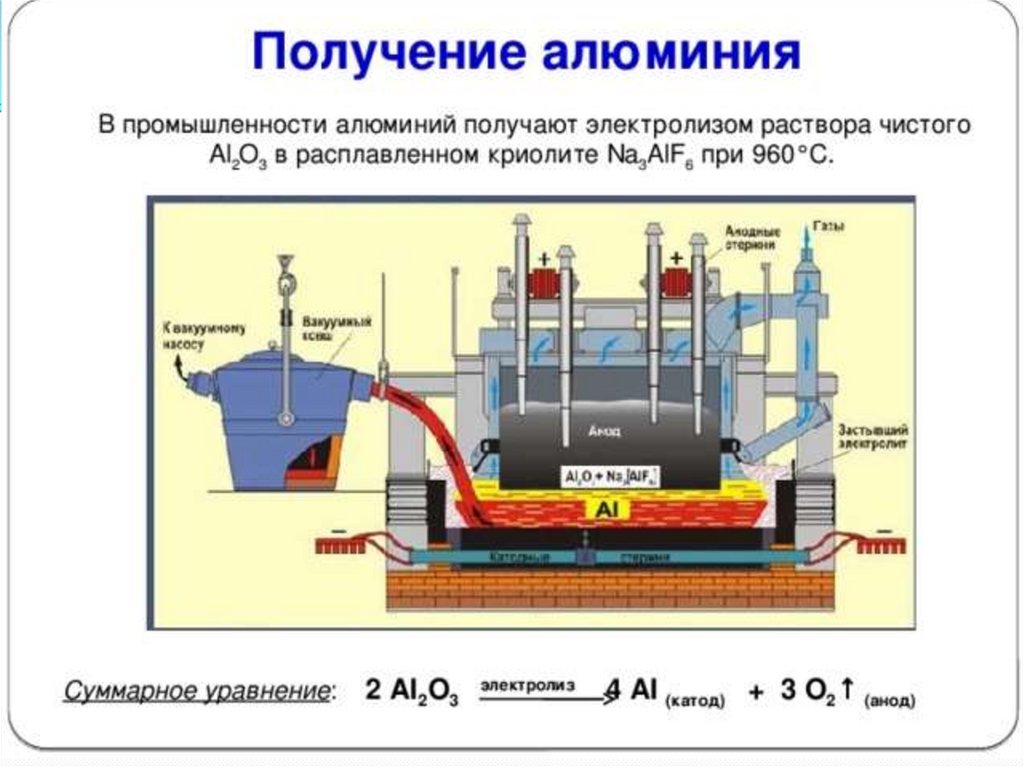
12. Получение:
Минералы бора:Получение:
13. Получение бора
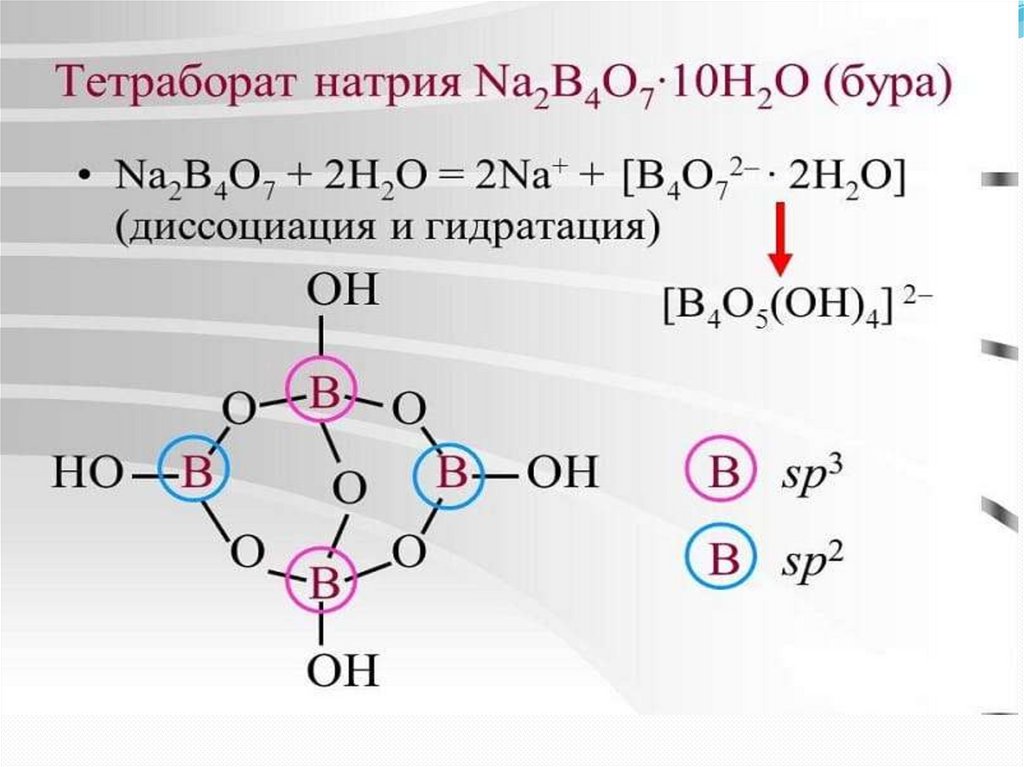
Из буры:4
2
3
3
Из гидрида и иодида разложением:
14.
15.
16. Галлий
Рассеянный элемент.СuGaS2 – галлит (Южная Америка)
Ga2O3 cопутствует алюминию в боксите (Al2O3·H2O),
GaS содержится в виде примеси в сфалерите
(ZnS).
Получение – из отходов производства алюминия:
2GaСl3
электролиз раствора
2Ga + 3Cl2
17. Индий
Рассеянный элементСuInS2 – рекезит
FeInS2 – индит
Получение:
Руды обрабатывают серной кислотой и получают
In2(SO4)3, из раствора которого восстанавливают
алюминием или цинком:
In2(SO4)3 + 2Al = Al2(SO4)3 + 2In
18. Таллий (в с.о.+1)
Рассеянный элементTlAsS2 – лорандит
(Tl, Cu, Ag)2Se – крукезит
Получение:
Электролизом раствора Tl2SO4, который получают
обработкой серной кислотой полиметаллических руд:
2Tl2SO4 + 2H2O
электролиз раствора
4Tl + O2 + 2H2SO4
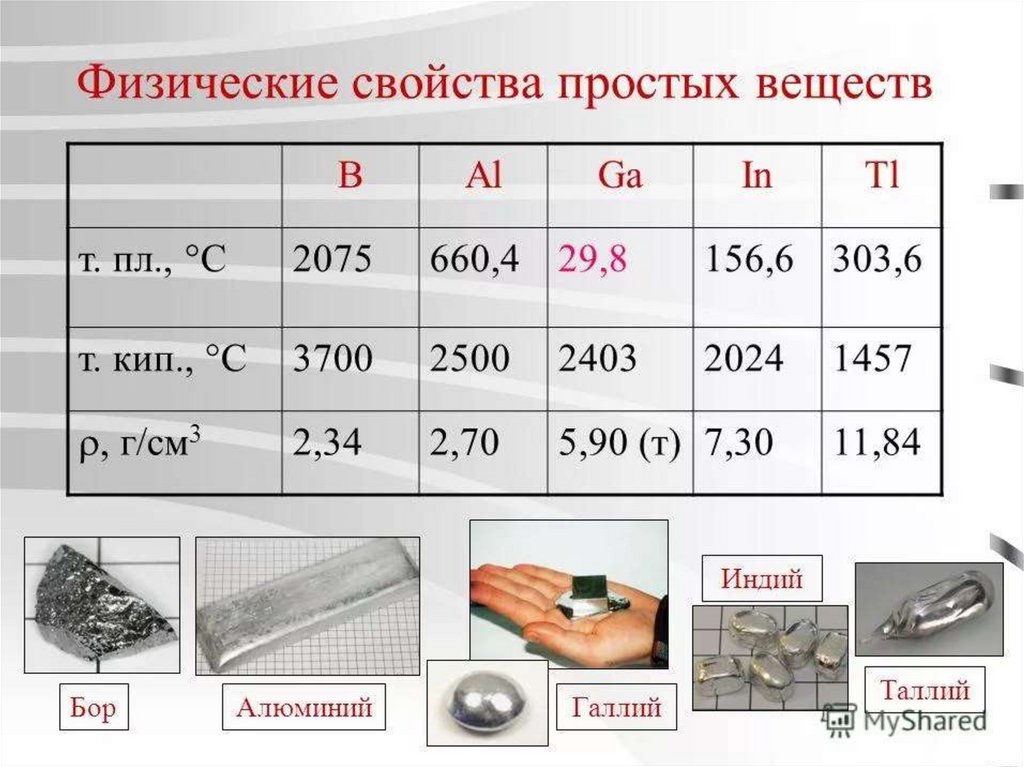
19. ПРОСТЫЕ ВЕЩЕСТВА. СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА
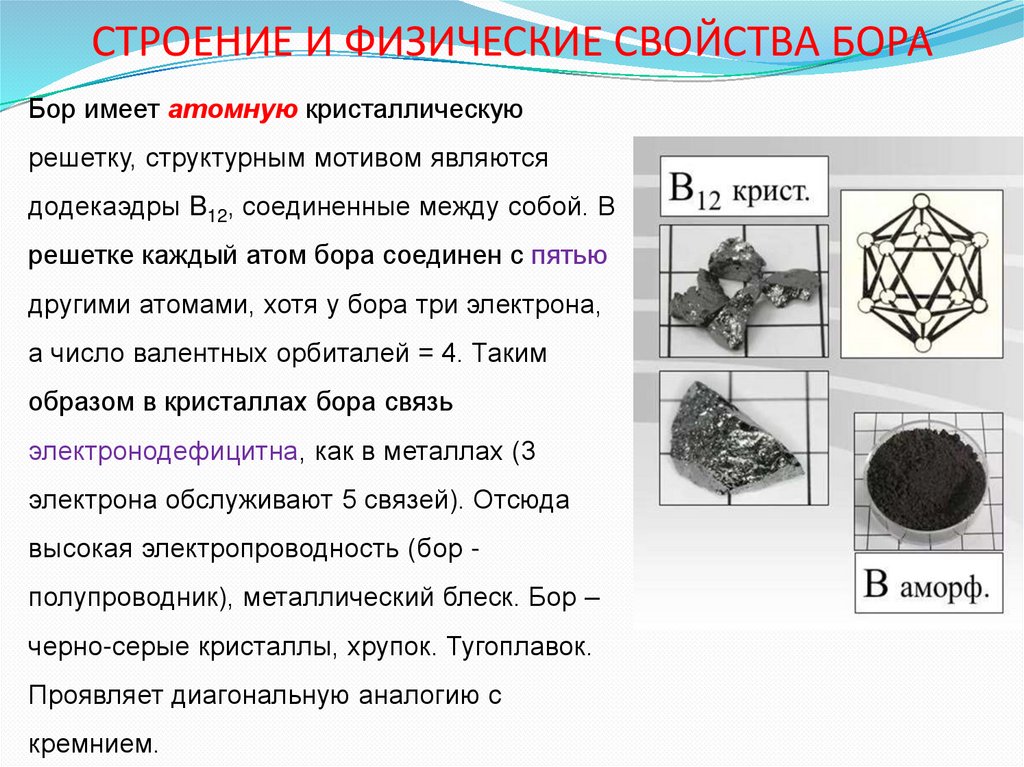
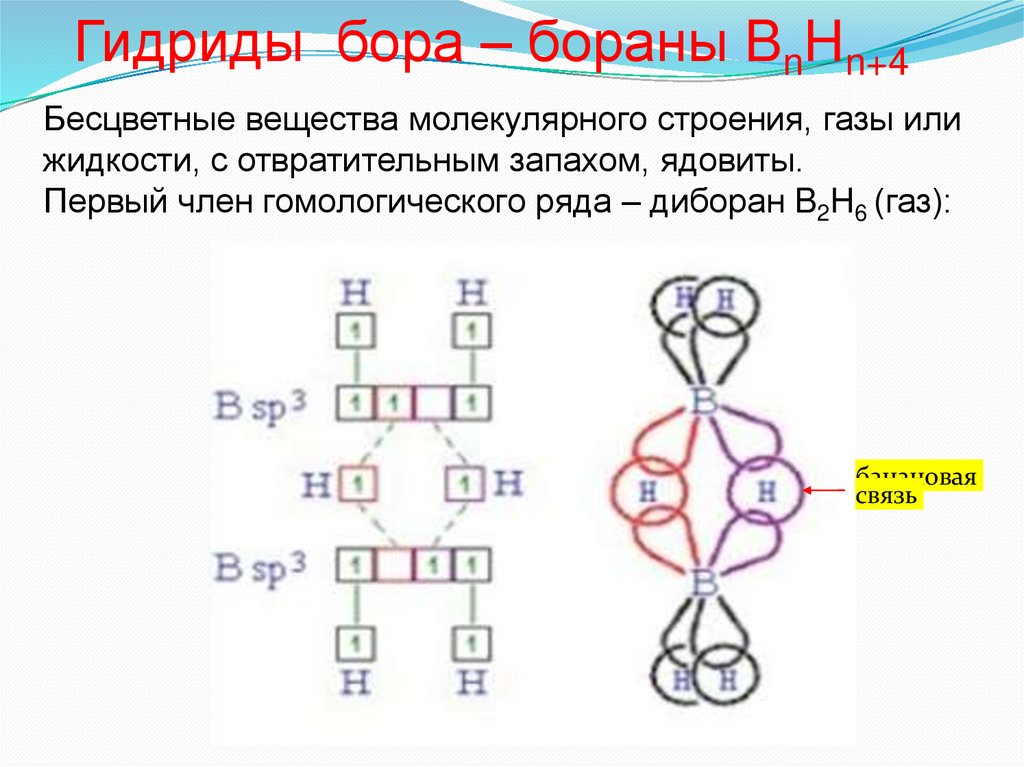
20. СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА БОРА
Бор имеет атомную кристаллическуюрешетку, структурным мотивом являются
додекаэдры B12, соединенные между собой. В
решетке каждый атом бора соединен с пятью
другими атомами, хотя у бора три электрона,
а число валентных орбиталей = 4. Таким
образом в кристаллах бора связь
электронодефицитна, как в металлах (3
электрона обслуживают 5 связей). Отсюда
высокая электропроводность (бор полупроводник), металлический блеск. Бор –
черно-серые кристаллы, хрупок. Тугоплавок.
Проявляет диагональную аналогию с
кремнием.
21. СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ IIIА ГРУППЫ
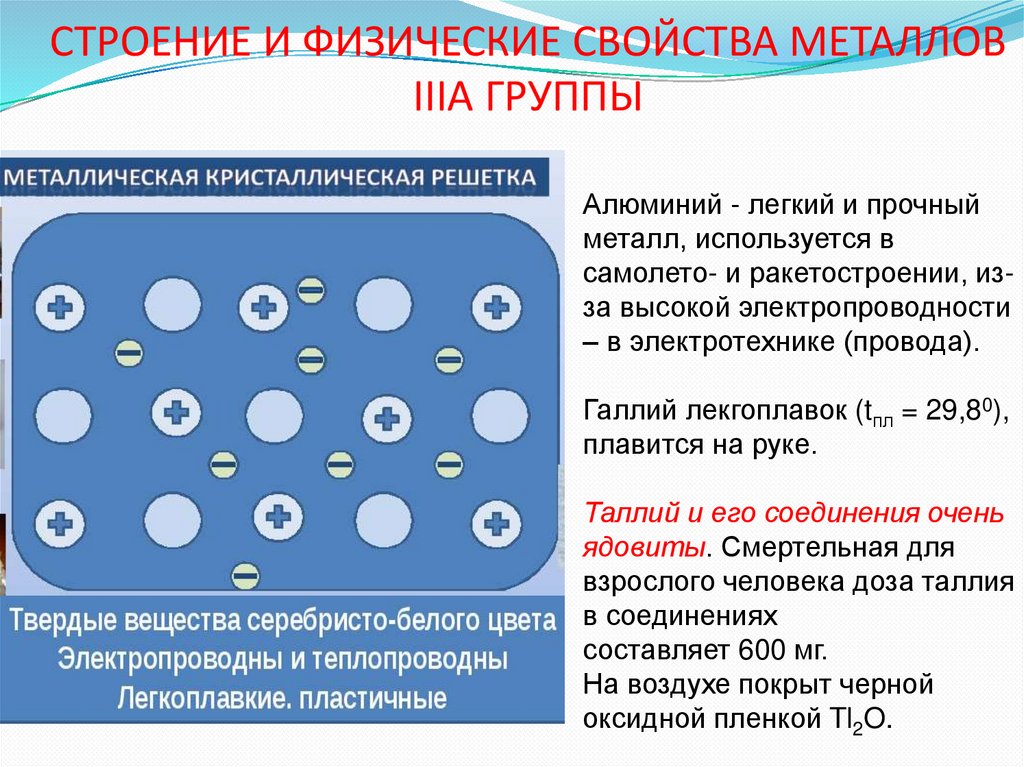
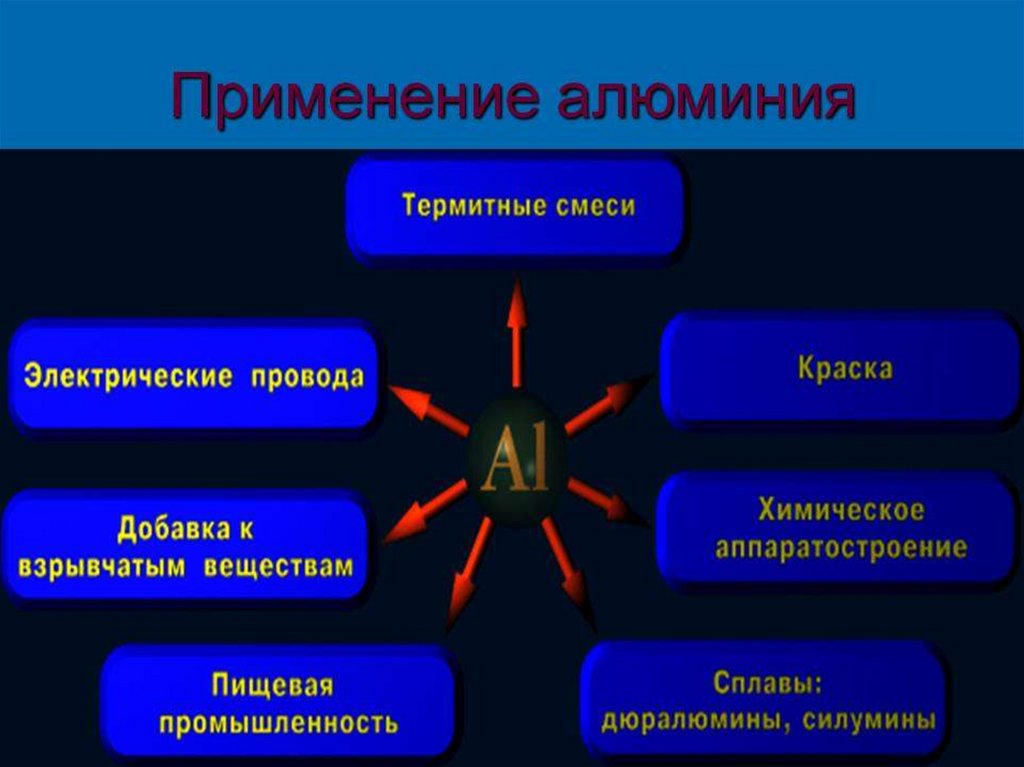
aАлюминий - легкий и прочный
металл, используется в
самолето- и ракетостроении, изза высокой электропроводности
– в электротехнике (провода).
Галлий лекгоплавок (tпл = 29,80),
плавится на руке.
Таллий и его соединения очень
ядовиты. Смертельная для
взрослого человека доза таллия
в соединениях
составляет 600 мг.
На воздухе покрыт черной
оксидной пленкой Tl2O.
22.
23. ХИМИЧЕСКИЕ СВОЙСТВА
В IIIА группе все свойства меняются нетипичнымобразом:
В
Al
Ga
In
Tl
Увеличиваются металлические свойства,
Al – самый активный металл.
В – неметалл атомного строения с низкой ЭО.
Химически малоактивен. Более характерны
восстановительные свойства.
φ(Al3+/Al) = - 1,62 В. Термодинамически алюминий очень
активен, но он порыт очень прочной и инертной
оксидной пленкой Al2O3, которая сильно снижает его
химическую активность.

























































 Химия
Химия