Похожие презентации:
Молекулярно-генетические механизмы инициации цветения
1.
Молекулярно-генетические механизмыинициации цветения
«ГЕНЕТИКА РАЗВИТИЯ РАСТЕНИЙ»
кафедра генетики и биотехнологии СПбГУ
1
2.
Регуляция различных этапов развития цветкавегетативная
меристема
побега
генеративная
меристема
соцветия
меристема
цветка
органы цветка
Температура
Гормоны,
сахара
Гены,
контролирую
щие время
цветения
Стресс
Длина
светового дня
Циркадные
ритмы
Гены
идентичности
флоральной
меристемы
Гены
идентичности
органов
цветка
2
3.
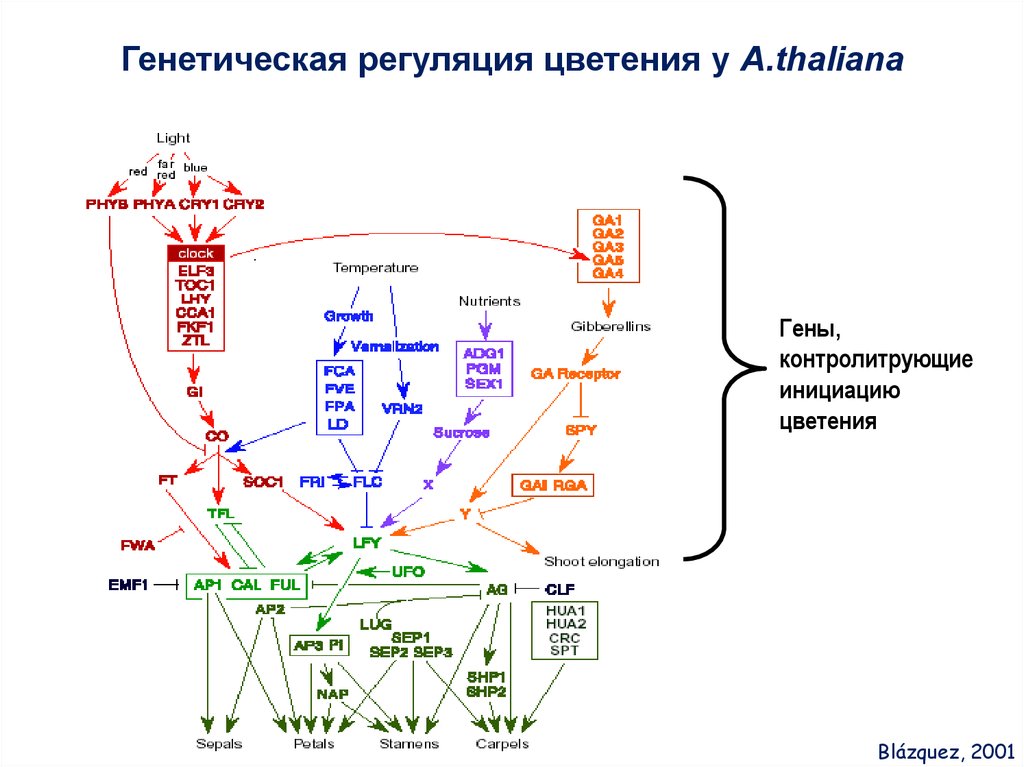
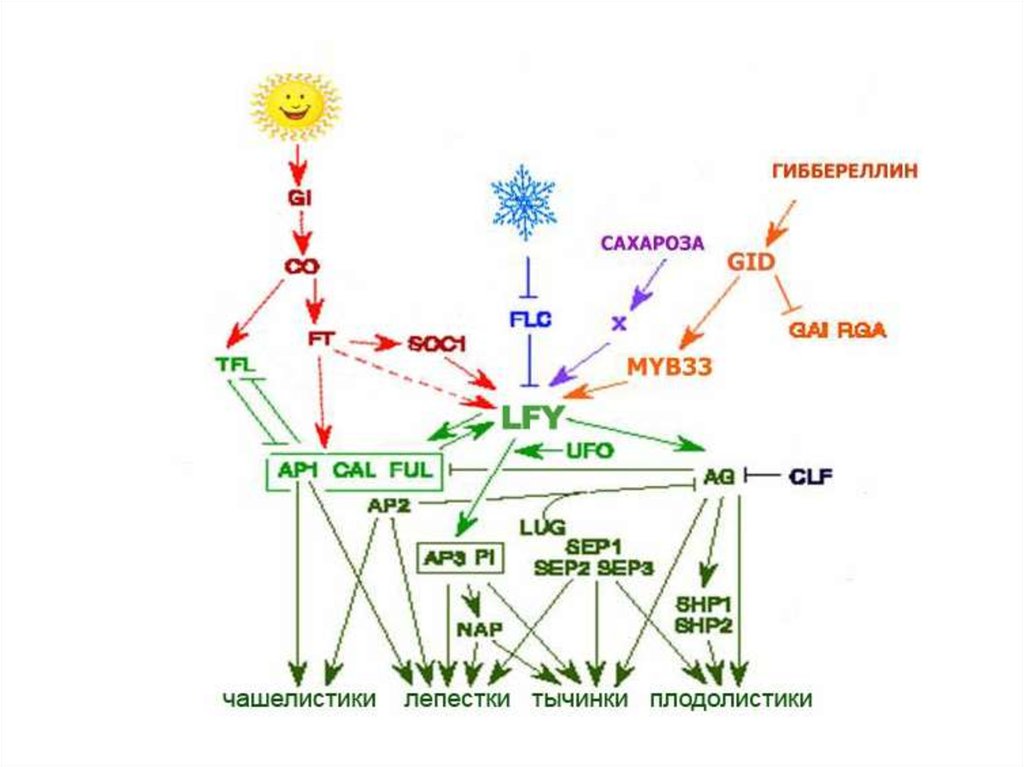
Генетическая регуляция цветения у A.thalianaГены,
контролитрующие
инициацию
цветения
Blázquez, 2001
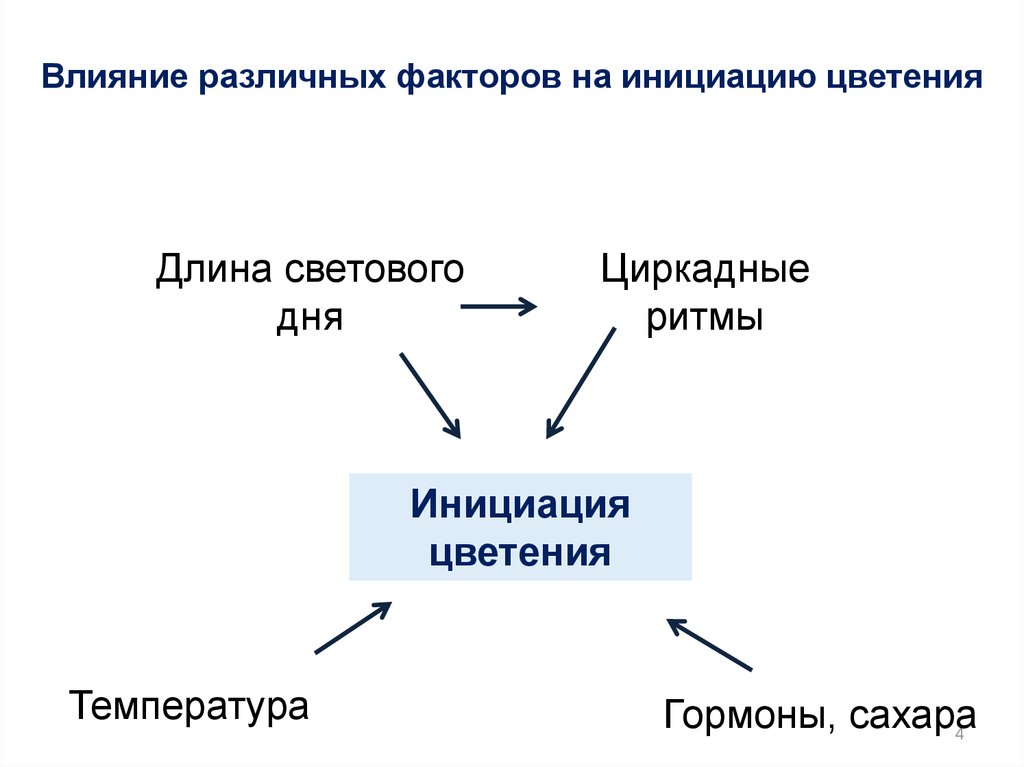
4.
Влияние различных факторов на инициацию цветенияДлина светового
дня
Циркадные
ритмы
Инициация
цветения
Температура
Гормоны, сахара
4
5.
Открытие фотопериодизма у растений:5
6.
Гипотеза «флоригена»Флориген - гормон цветения, термин предложен
М. Х. Чайлахяном, 1936
Гипотеза: флориген синтезируется в листьях и
перемещается в апекс. Его синтез регулируется светом.
Опыты Чайлахяна с дурнушником
(Xanthium strumarium)
Современные представления:
флориген (FT) – центральный
регулятор ВСЕХ путей контроля
цветения
6
7.
Влияние различных факторов на инициацию цветенияДлина
светового дня
Циркадные
ритмы
Инициация
цветения
Температура
Гормоны, сахара
7
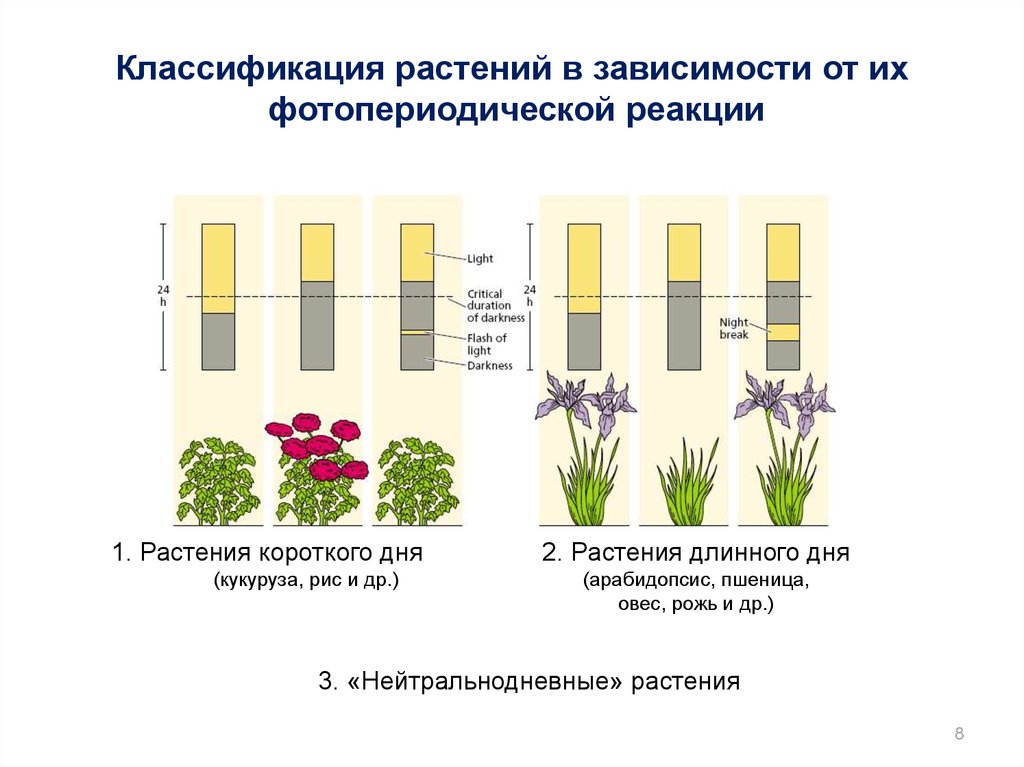
8.
Классификация растений в зависимости от ихфотопериодической реакции
1. Растения короткого дня
(кукуруза, рис и др.)
2. Растения длинного дня
(арабидопсис, пшеница,
овес, рожь и др.)
3. «Нейтральнодневные» растения
8
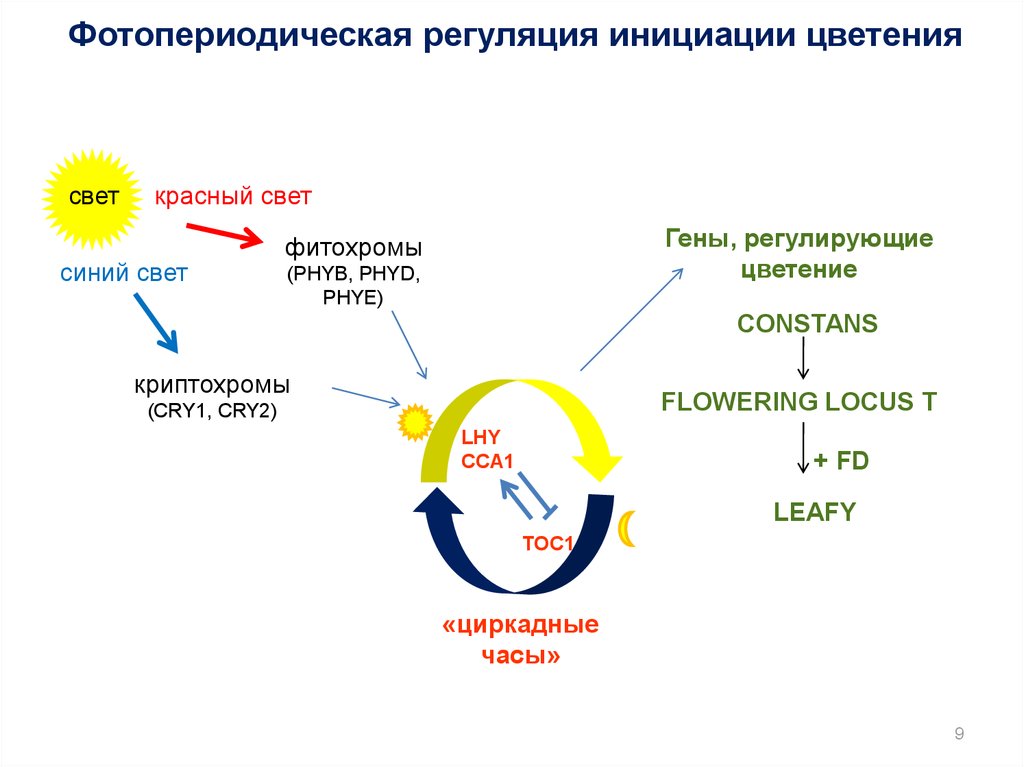
9.
Фотопериодическая регуляция инициации цветениясвет
красный свет
синий свет
Гены, регулирующие
цветение
фитохромы
(PHYB, PHYD,
PHYE)
CONSTANS
криптохромы
FLOWERING LOCUS T
(CRY1, CRY2)
LHY
CCA1
+ FD
LEAFY
TOC1
«циркадные
часы»
9
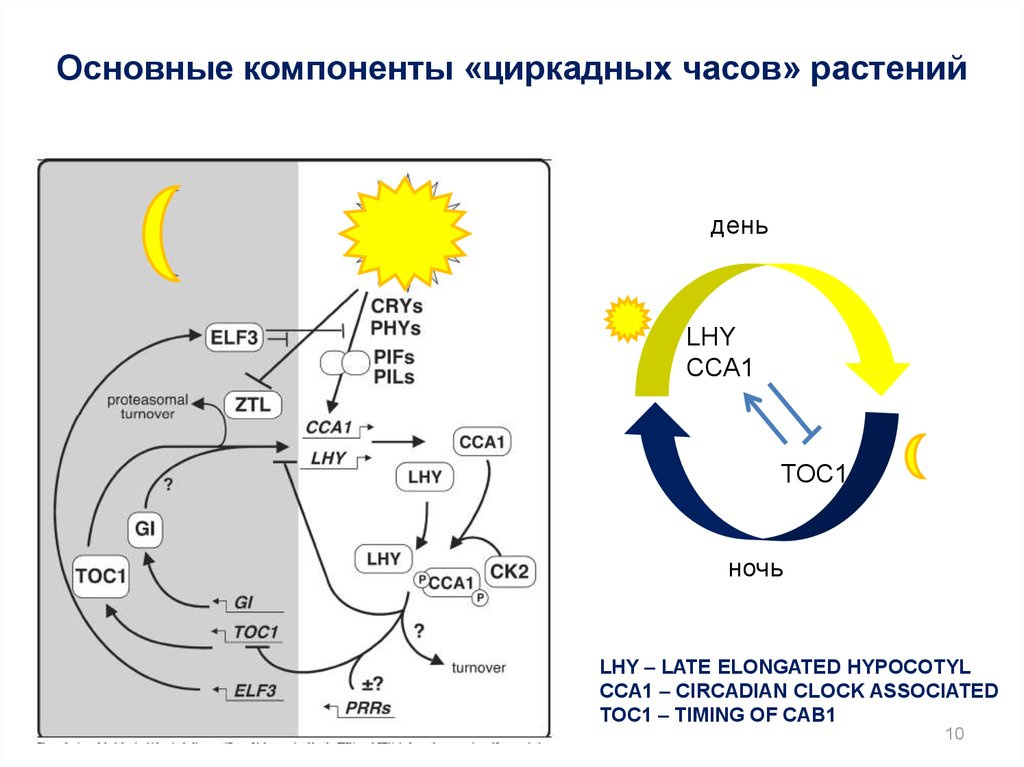
10.
Основные компоненты «циркадных часов» растенийдень
LHY
CCA1
TOC1
ночь
LHY – LATE ELONGATED HYPOCOTYL
CCA1 – CIRCADIAN CLOCK ASSOCIATED
TOC1 – TIMING OF CAB1
10
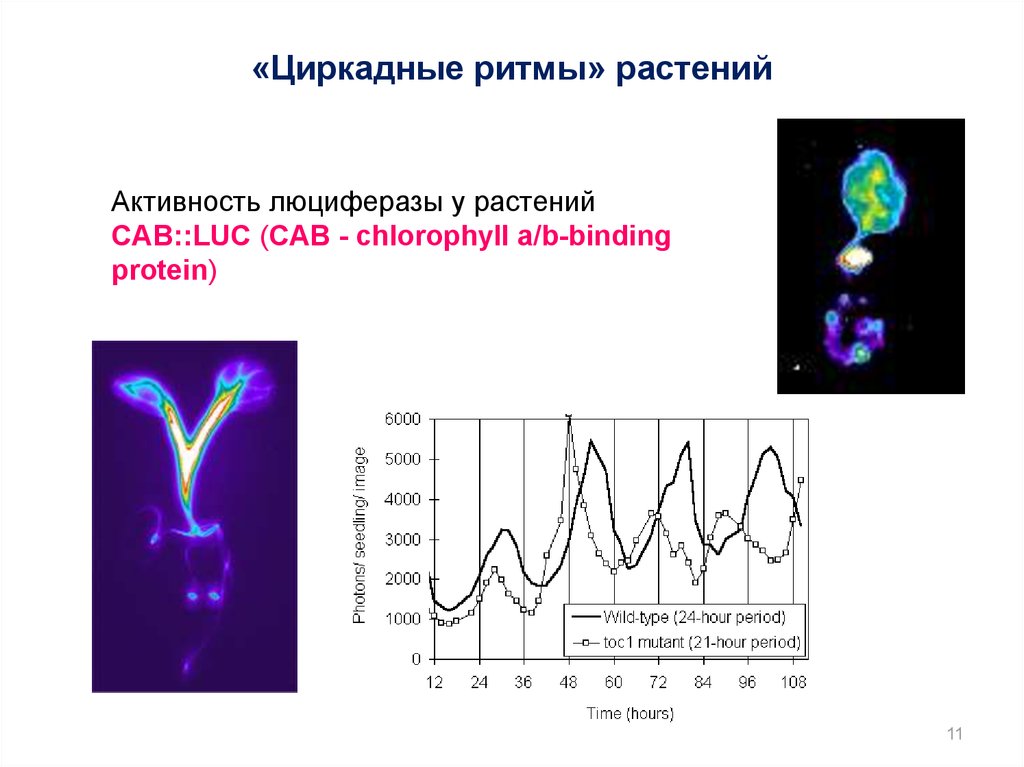
11.
«Циркадные ритмы» растенийАктивность люциферазы у растений
CAB::LUC (CAB - chlorophyll a/b-binding
protein)
11
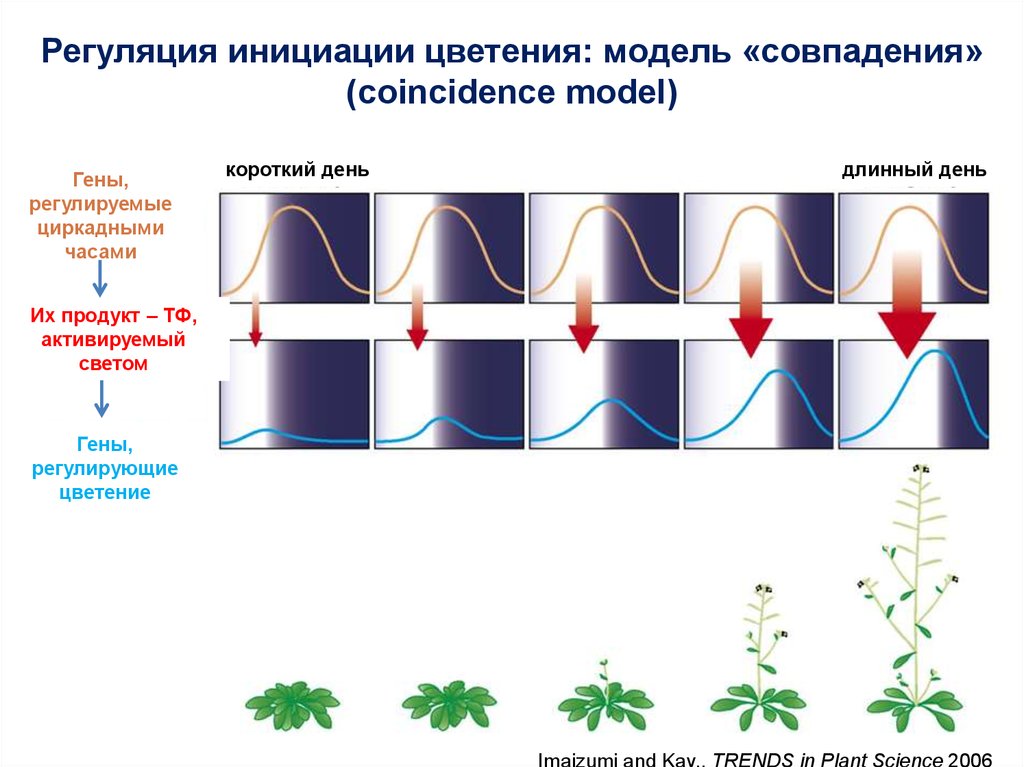
12.
Регуляция инициации цветения: модель «совпадения»(coincidence model)
Гены,
регулируемые
циркадными
часами
короткий день
длинный день
Их продукт – ТФ,
активируемый
светом
Гены,
регулирующие
цветение
Imaizumi and Kay., TRENDS in Plant Science 2006
13.
Ген CONSTANS (CO) в регуляции инициациицветения
Фенотип мутантов co и трансгенных растений со сверхэкспрессией CO
WT
co
WT
35S::CO
Ген CO – кодирует предполагаемый ТФ с доменами «цинковые пальцы»
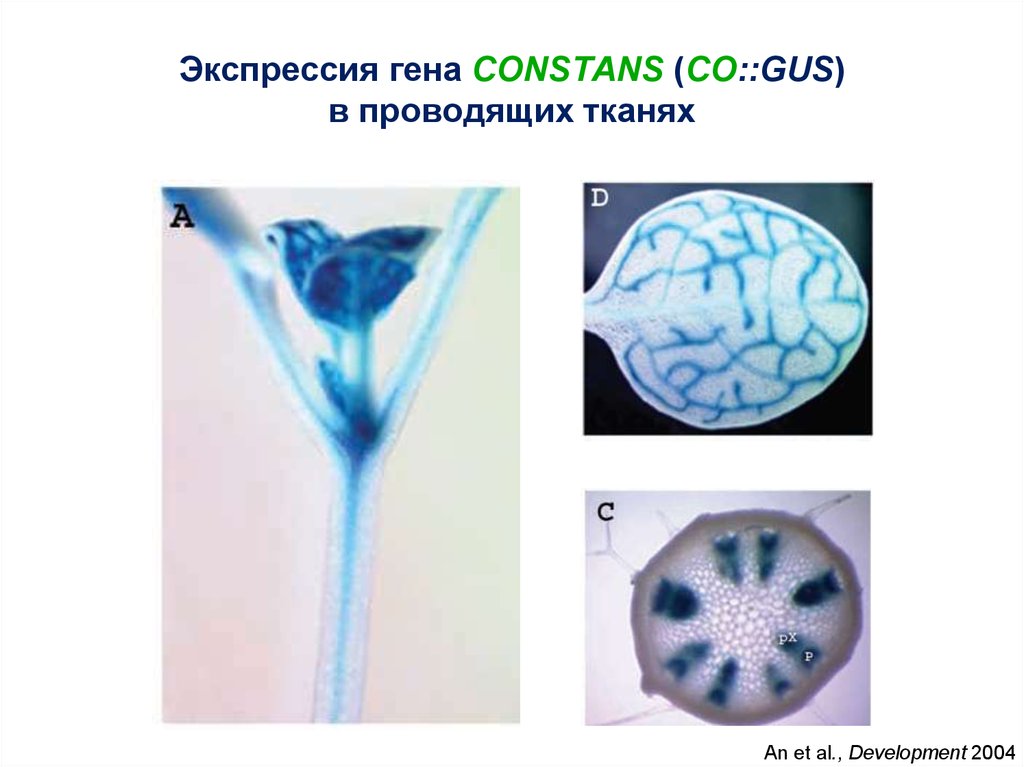
14.
Экспрессия гена CONSTANS (CO::GUS)в проводящих тканях
An et al., Development 2004
15.
Динамика экспрессии гена CONSTANS в течение сутокДлинный день
Короткий день
Время
день
ночь
день
ночь
Цветение
Нестабильность
белка CO в темноте
Ночь
День
Экспрессия CO::CO–YFP
15
16.
Фотопериодическая регуляция активности COКОРОТКИЙ ДЕНЬ
мРНК CO
Темновая
деградация
белок CO
белок CO
ДЛИННЫЙ ДЕНЬ
мРНК CO
белок CO
16
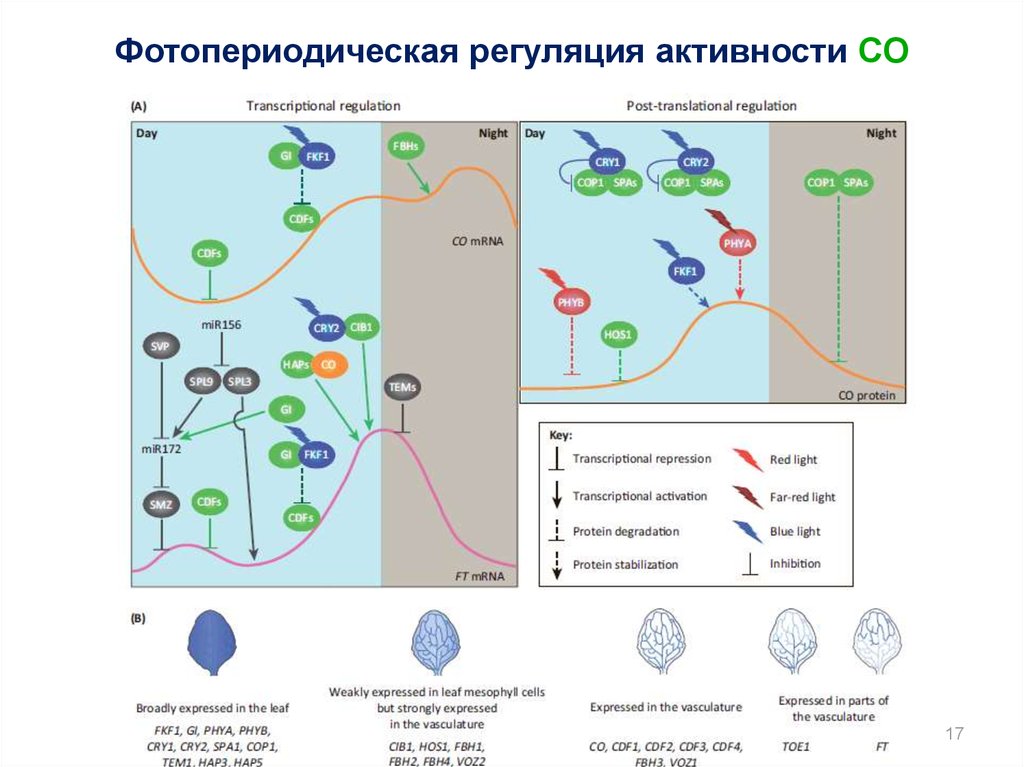
17.
Фотопериодическая регуляция активности CO17
18.
Фотопериодическая регуляция активности COцветение
криптохромы
(CRY1, CRY2)
COP1
Убиквитин
-лигаза
CO
protein
синий свет
Криптохромоподобный
белок (FKF1)
Убиквитин
-лигаза
CDF
CO
mRNA
Репрессор
транскрипции
18
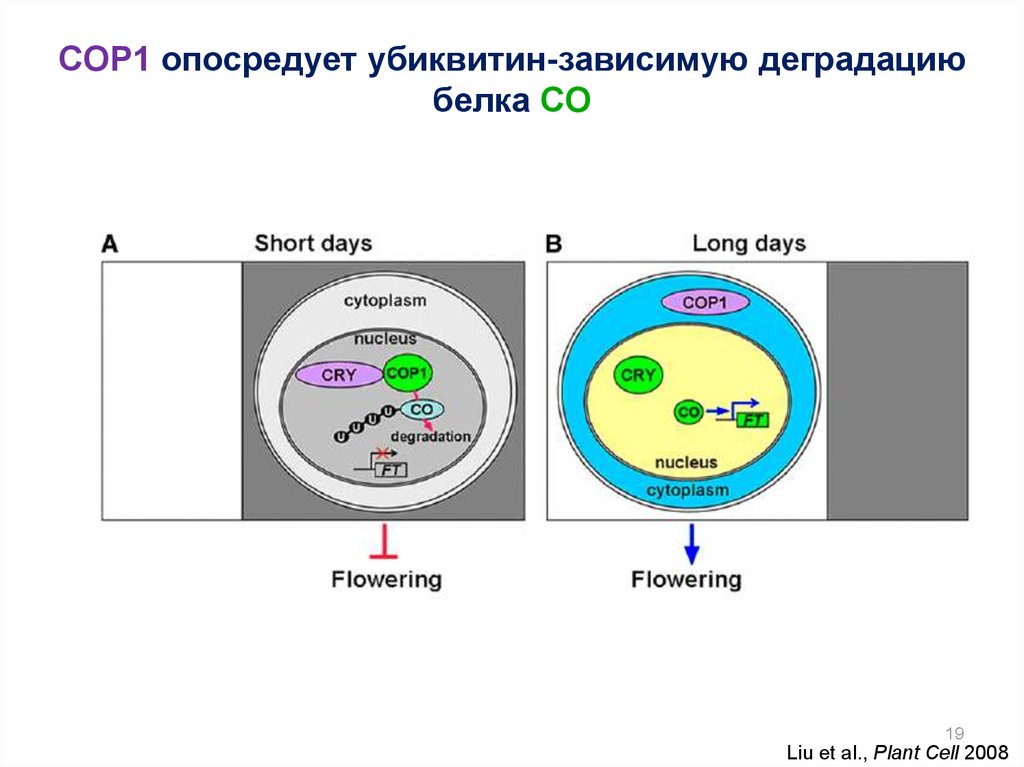
19.
COP1 опосредует убиквитин-зависимую деградациюбелка CO
19
Liu et al., Plant Cell 2008
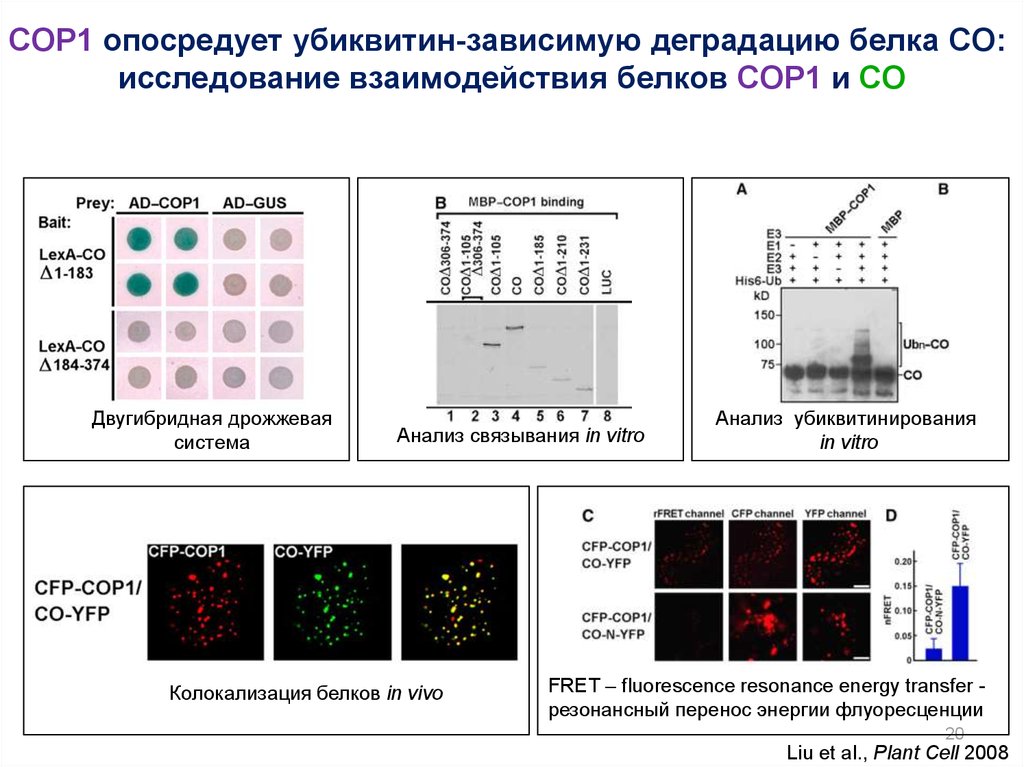
20.
COP1 опосредует убиквитин-зависимую деградацию белка CO:исследование взаимодействия белков COP1 и CO
Двугибридная дрожжевая
система
Анализ связывания in vitro
Колокализация белков in vivo
Анализ убиквитинирования
in vitro
FRET – fluorescence resonance energy transfer резонансный перенос энергии флуоресценции
20
Liu et al., Plant Cell 2008
21.
СОР1 опосредует темновую деградацию белка СО22.
Молекулярные механизмы «гипотезы совпадения»Регуляция на
уровне мРНК СО:
FKF1 (FLAVIN-BINDING
KELCH REPEAT FBOX1) –
Fbox-содержащий
криптохромподобный белок
GI (GIGANTEA) –
активатор FKF1
CDF (CYCLING DOF
FACTORS)–
репрессоры
транскрипции
Регуляция на
уровне белка
СО:
• СОР1
(CONSTITUTIVE
PHOTOMORPHOGE-
- Fboxсодержащий
белок
NESIS 1)
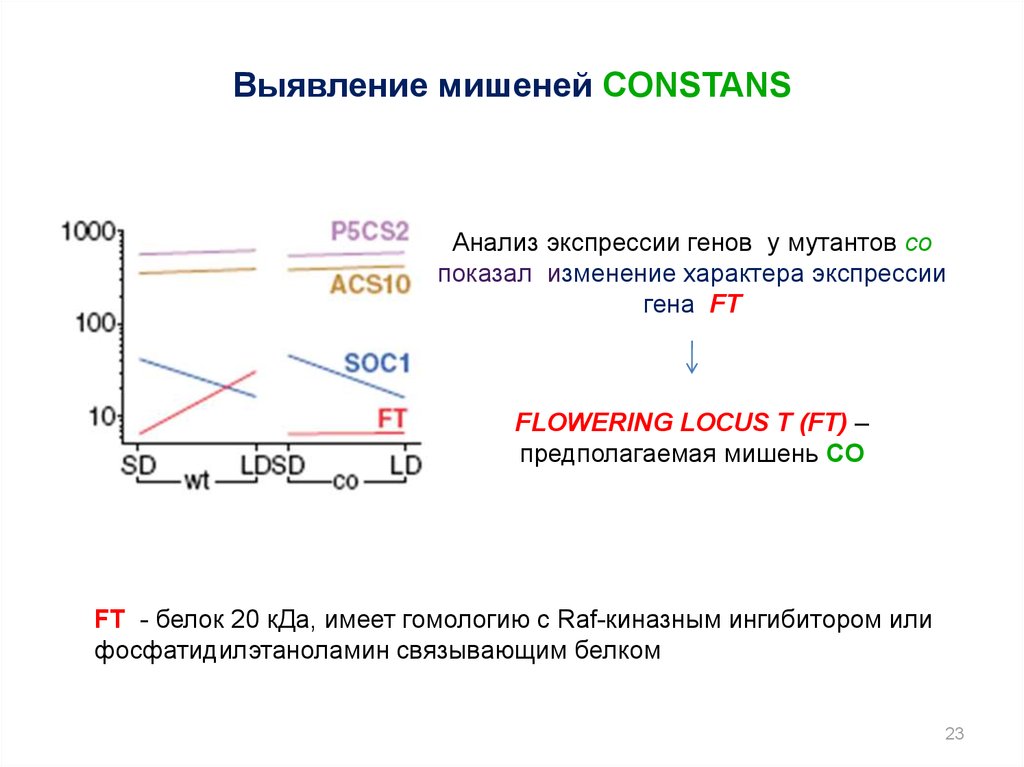
23.
Выявление мишеней CONSTANSАнализ экспрессии генов у мутантов co
показал изменение характера экспрессии
гена FT
FLOWERING LOCUS T (FT) –
предполагаемая мишень CO
FT - белок 20 кДа, имеет гомологию с Raf-киназным ингибитором или
фосфатидилэтаноламин связывающим белком
23
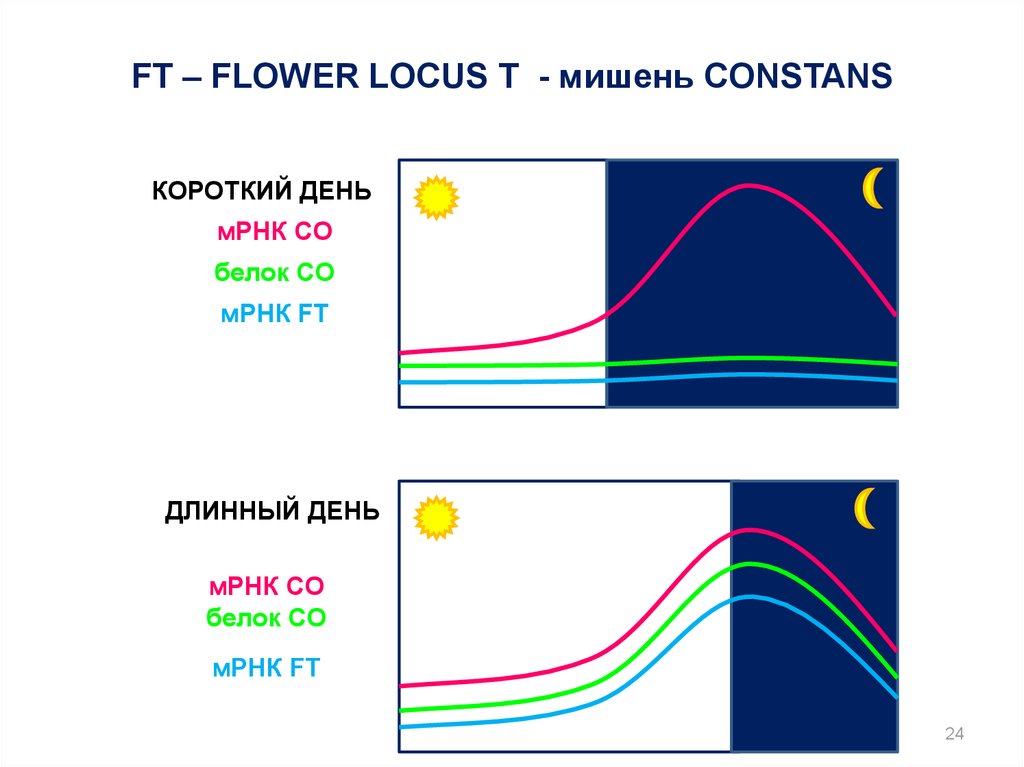
24.
FT – FLOWER LOCUS T - мишень CONSTANSКОРОТКИЙ ДЕНЬ
мРНК CO
белок CO
мРНК FT
ДЛИННЫЙ ДЕНЬ
мРНК CO
белок CO
мРНК FT
24
25.
Продукт гена FT (мРНК, белок-?) – транспортируется излиста в апекс побега, где инициирует цветение
Imaizumi and Kay., TRENDS in Plant Science 2006
26.
Продукт гена FT (мРНК, белок-?) – транспортируетсяиз листа в апекс побега, где инициирует цветение
Активация
экспрессии FT
(HSP::FT)
тепловой
шок
цветение
Hsp::GUS
Hsp::GUS
Содержание транскриптов FT и GUS (контроль) в апексе
побега после индукции конструкций Hsp::FT и Hsp::GUS
тепловым шоком (ТШ)
GUS
FT
апекс побега
мРНК FT
белок FT
лист
ТШ
ТШ
26
Huang et al. Science 2005
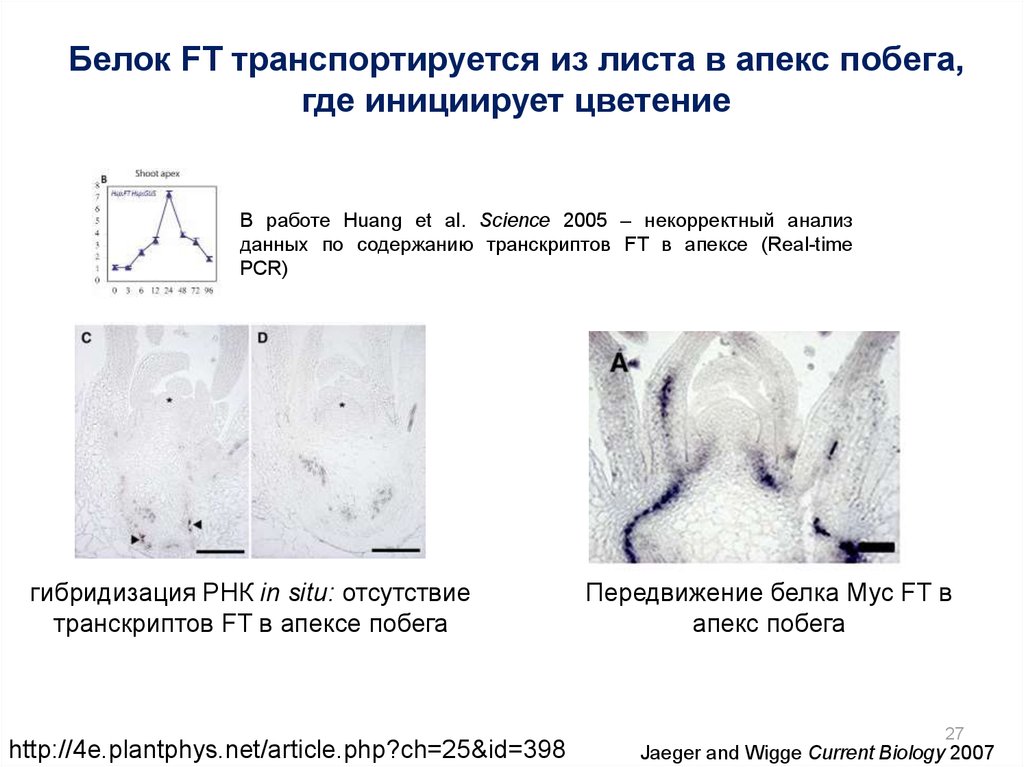
27.
Белок FT транспортируется из листа в апекс побега,где инициирует цветение
В работе Huang et al. Science 2005 – некорректный анализ
данных по содержанию транскриптов FT в апексе (Real-time
PCR)
гибридизация РНК in situ: отсутствие
транскриптов FT в апексе побега
http://4e.plantphys.net/article.php?ch=25&id=398
Передвижение белка Myc FT в
апекс побега
27
Jaeger and Wigge Current Biology 2007
28.
Белок FT (флориген)транспортируется из
листа в апекс побега, где
инициирует цветение
28
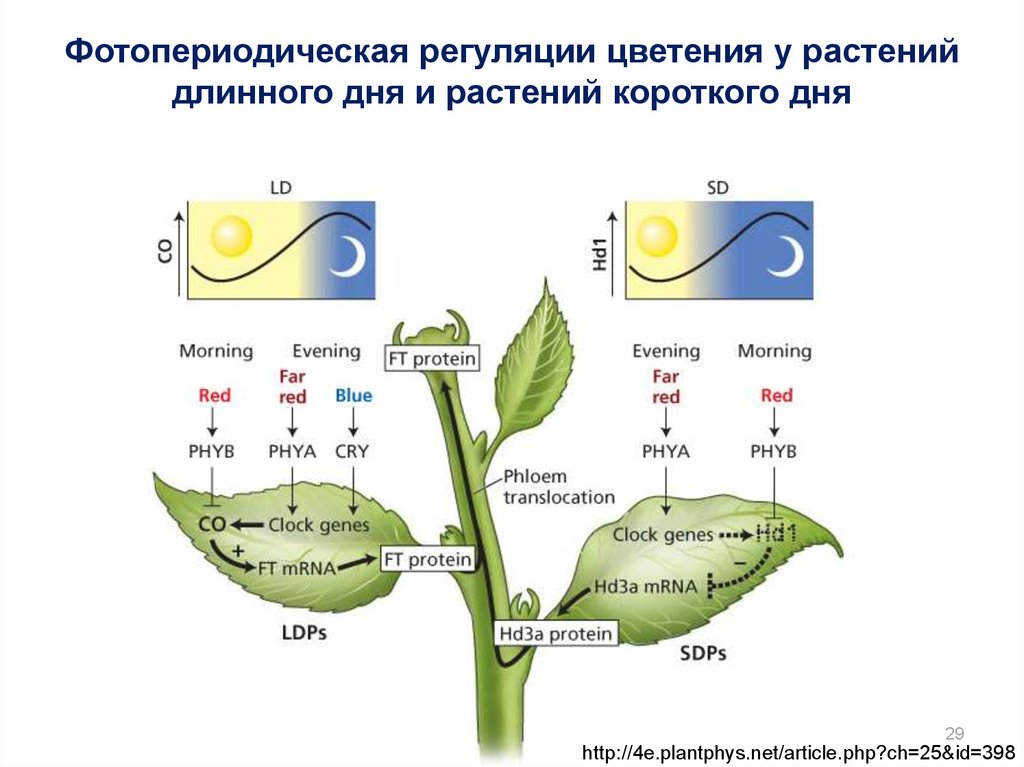
29.
Фотопериодическая регуляции цветения у растенийдлинного дня и растений короткого дня
29
http://4e.plantphys.net/article.php?ch=25&id=398
30.
Фотопериодическая регуляция активности CO и FT30
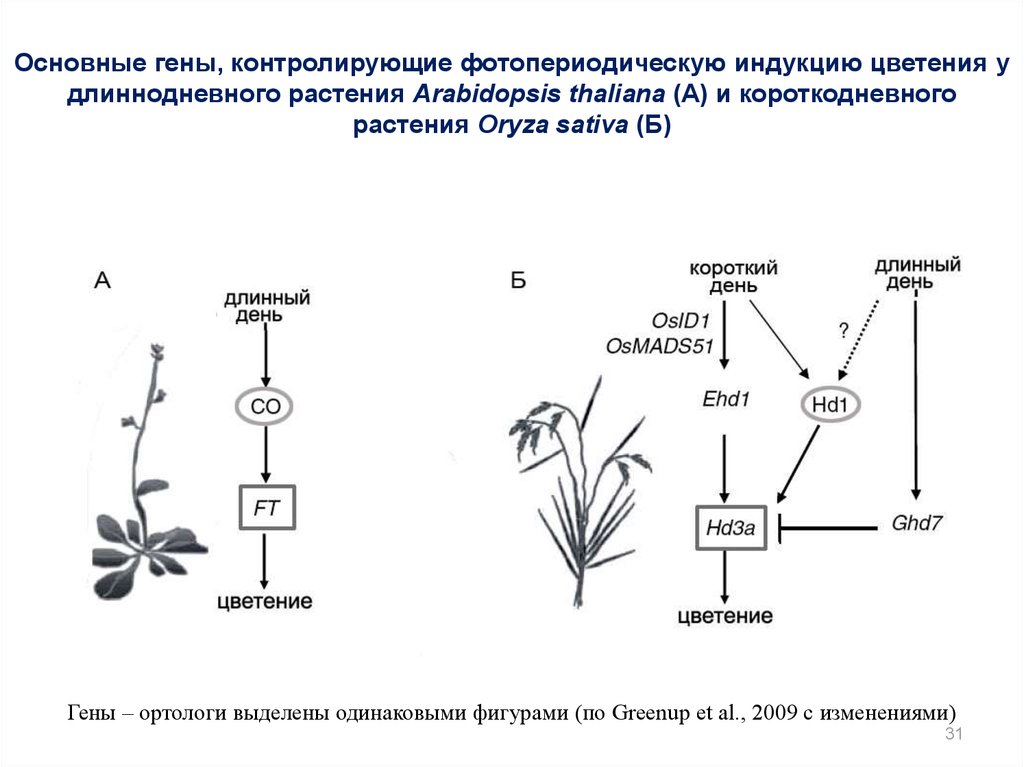
31.
Основные гены, контролирующие фотопериодическую индукцию цветения удлиннодневного растения Arabidopsis thaliana (А) и короткодневного
растения Oryza sativa (Б)
Гены – ортологи выделены одинаковыми фигурами (по Greenup et al., 2009 с изменениями)
31
32.
Ген TFL (Terminal Flower) арабидопсисаПродукт гена TFL – белок - репрессор цветения, на 60% сходный с FT
По функции - АНТИФЛОРИГЕН
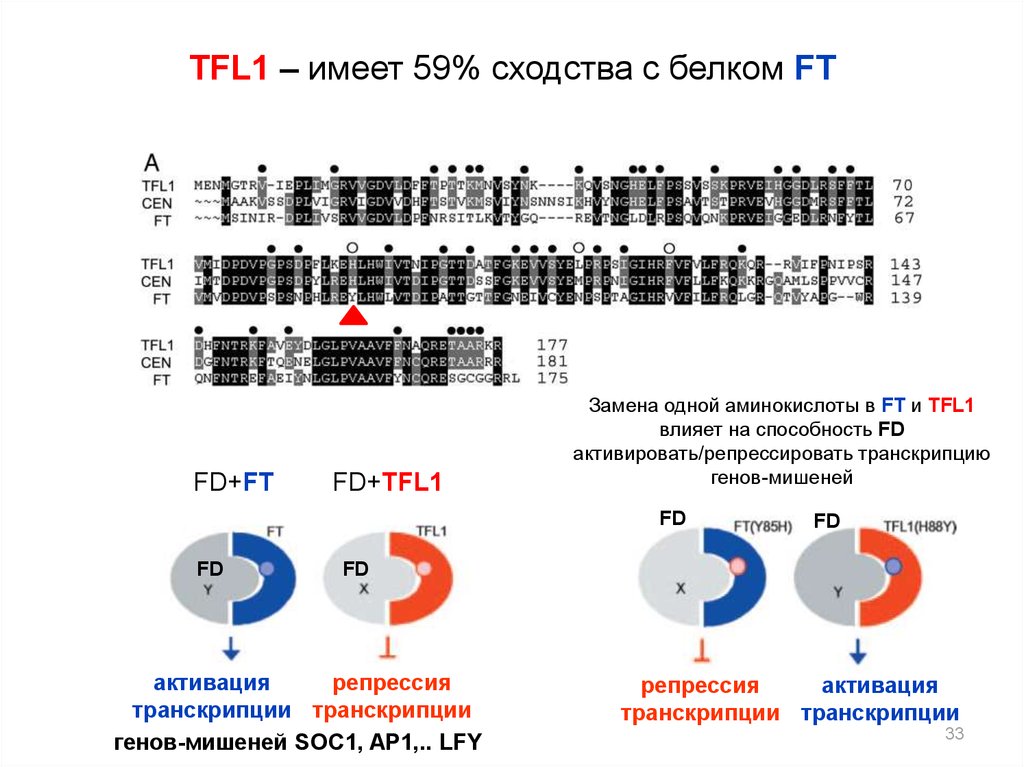
33.
TFL1 – имеет 59% сходства с белком FTFD+FT
FD+TFL1
Замена одной аминокислоты в FT и TFL1
влияет на способность FD
активировать/репрессировать транскрипцию
генов-мишеней
FD
FD
FD
FD
активация
репрессия
транскрипции транскрипции
генов-мишеней SOC1, AP1,.. LFY
репрессия
активация
транскрипции транскрипции
33
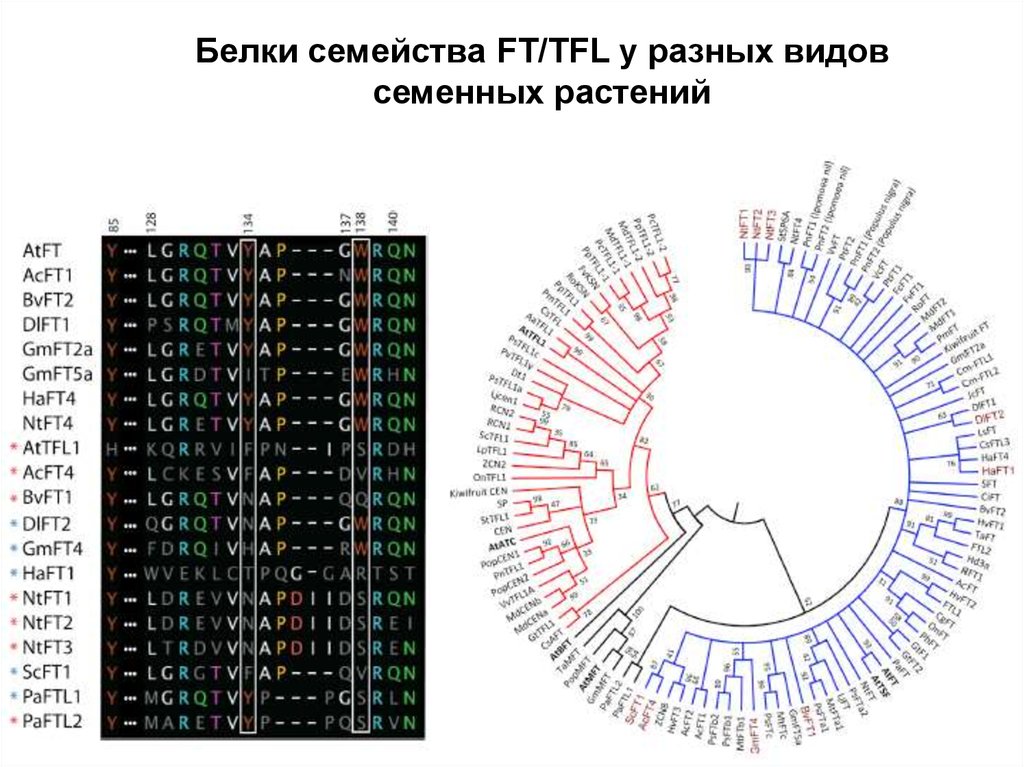
34.
Белки семейства FT/TFL у разных видовсеменных растений
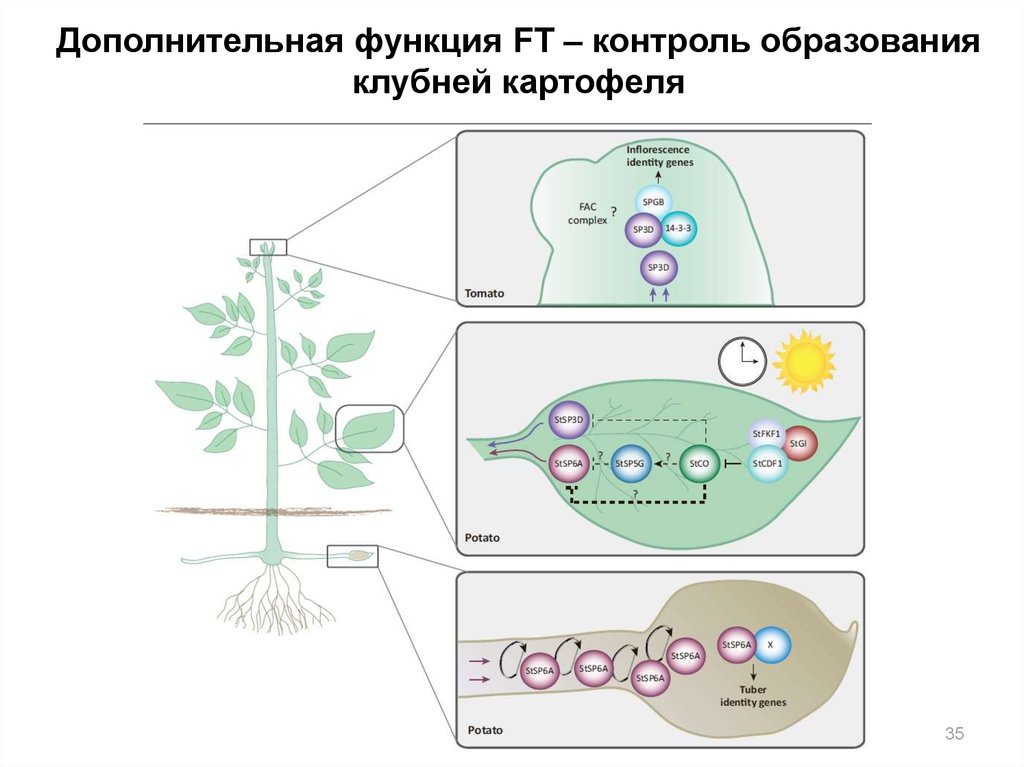
35.
Дополнительная функция FT – контроль образованияклубней картофеля
35
36.
Выявление мишеней FT:Изучение влияния мутаций по различным генам, контролирующих инициацию
цветения, на фенотип трансгенных растений 35S::FT
Мутация fd-1 супрессирует проявление сверхэкспрессии FT (35S::FT)
FT
FD (FLOWERING LOCUS D)
36
Abe et al., SCIENCE 2005
37.
Экспрессия FD (FD::GUS) в апексе побегаГен FD кодирует транскрипционный фактор семейства bZIP
37
Abe et al., SCIENCE 2005
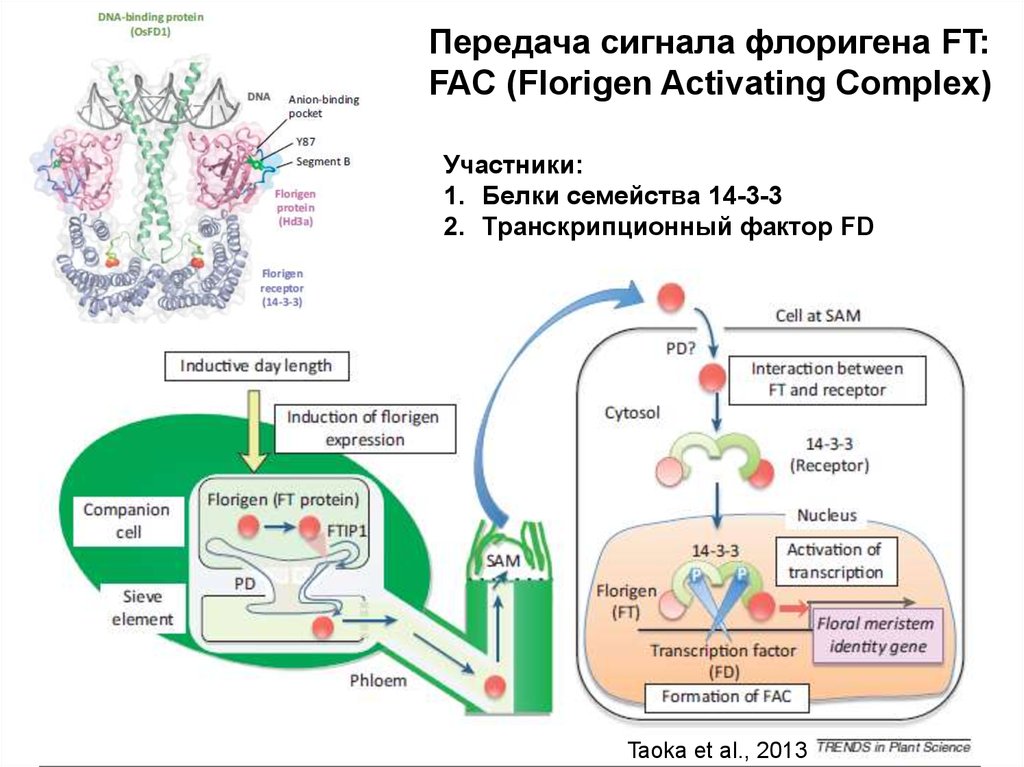
38.
Передача сигнала флоригена FT:FAC (Florigen Activating Complex)
Участники:
1. Белки семейства 14-3-3
2. Транскрипционный фактор FD
Taoka et al., 2013
39.
Выявление мишеней FTFT
SOC1
(SUPPRESSOR OF
OVEREXPRESSION OF
CONSTANS1)
39
40.
Функции ТФ SOC1гиббереллины
CO
FT + FD
SOC1
LFY
+ AGL24, 71, 72
FLC
Органы
цветка
ТФ с MADS доменом, центральный координатор
генеративного развития
SOC1
экспрессируется
в меристеме
соцветия
Экспрессия
SOC1
подавляется
после закладки
органов цветка
40
41.
Мишени ТФ SOC141
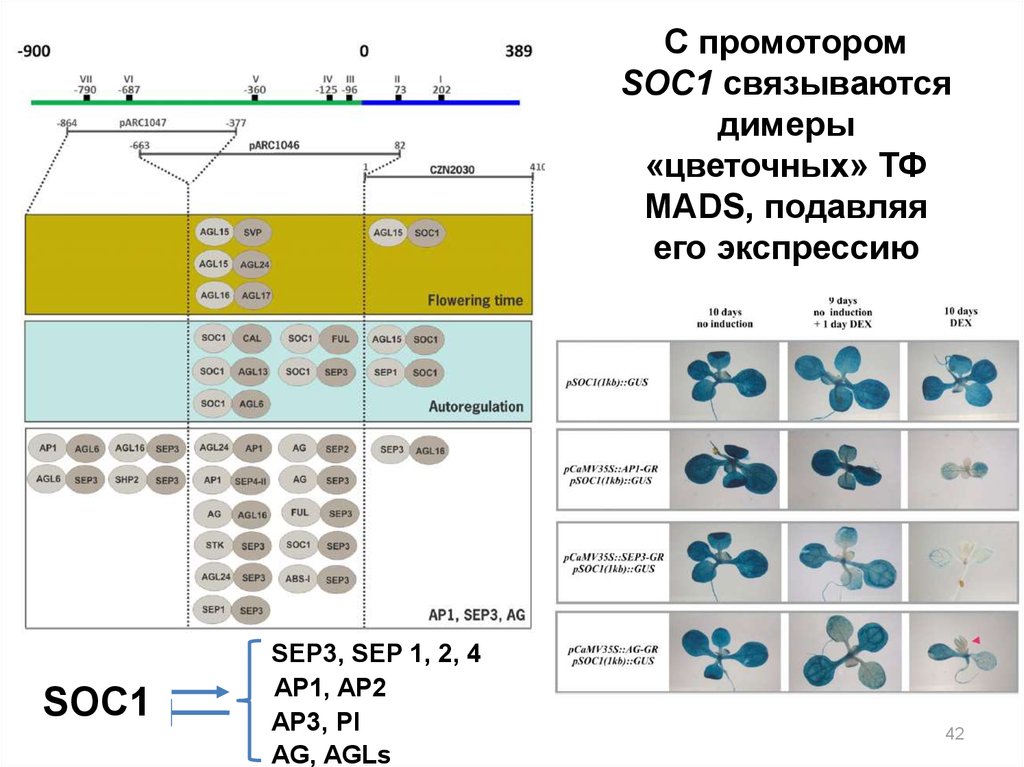
42.
C промоторомSOC1 связываются
димеры
«цветочных» ТФ
MADS, подавляя
его экспрессию
SOC1
SEP3, SEP 1, 2, 4
AP1, AP2
AP3, PI
AG, AGLs
42
43.
Схема регуляции цветения у растений с участиемТФ SOC1
43
http://4e.plantphys.net/article.php?ch=25&id=398
44.
Влияние различных факторов на инициацию цветенияДлина светового
дня
Циркадные
ритмы
Инициация
цветения
Температура
Гормоны, сахара
44
45.
Антагонизм этилена и гиббереллинов врегуляции цветения
гиббереллины
цветение
этилен
45
Achard et al., PNAS 2007
46.
Роль гиббереллинов в индукции цветенияGA
LFY
SOC
цветение
FT
47.
Влияние различных факторов на инициацию цветенияДлина светового
дня
Циркадные
ритмы
Инициация
цветения
Температура
Гормоны, сахара
47
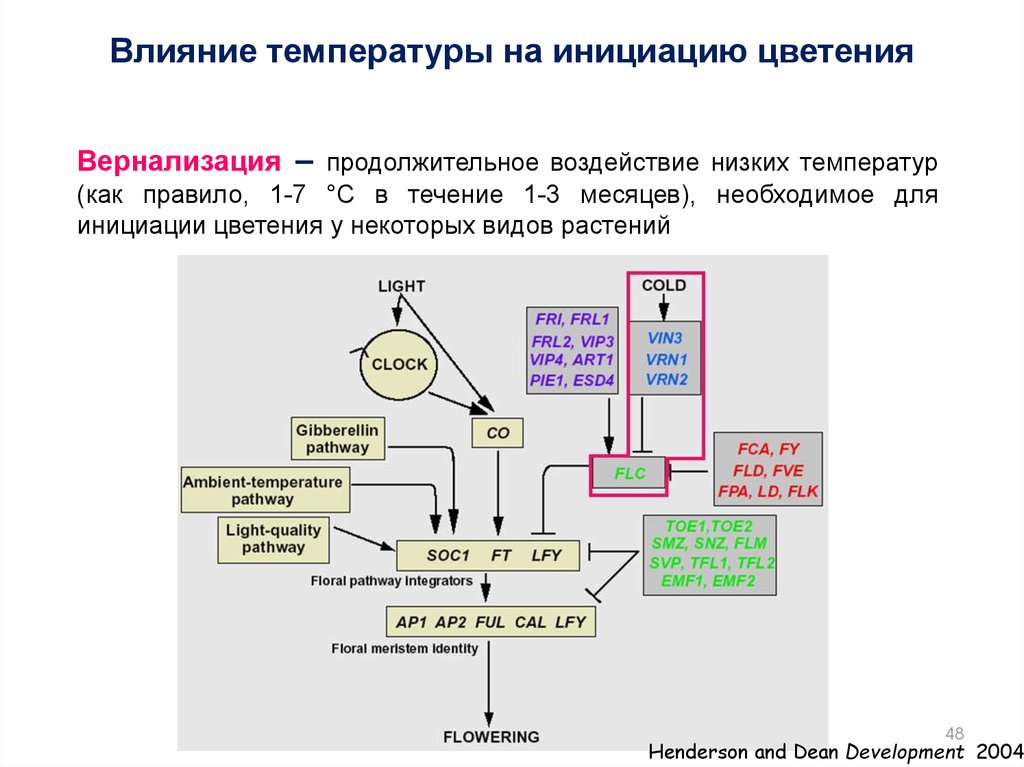
48.
Влияние температуры на инициацию цветенияВернализация – продолжительное воздействие низких температур
(как правило, 1-7 °С в течение 1-3 месяцев), необходимое для
инициации цветения у некоторых видов растений
48
Henderson and Dean Development 2004
49.
Молекулярные основы эпигенетических изменений:1. метилирование ДНК
2. модификация структуры хроматина:
изменение уровня метилирования и
ацетилирования гистонов
группа Polycomb- белков
3. РНК-сайленсинг (микроРНК (miRNAs) и малые
интерферирующие РНК (siRNAs))
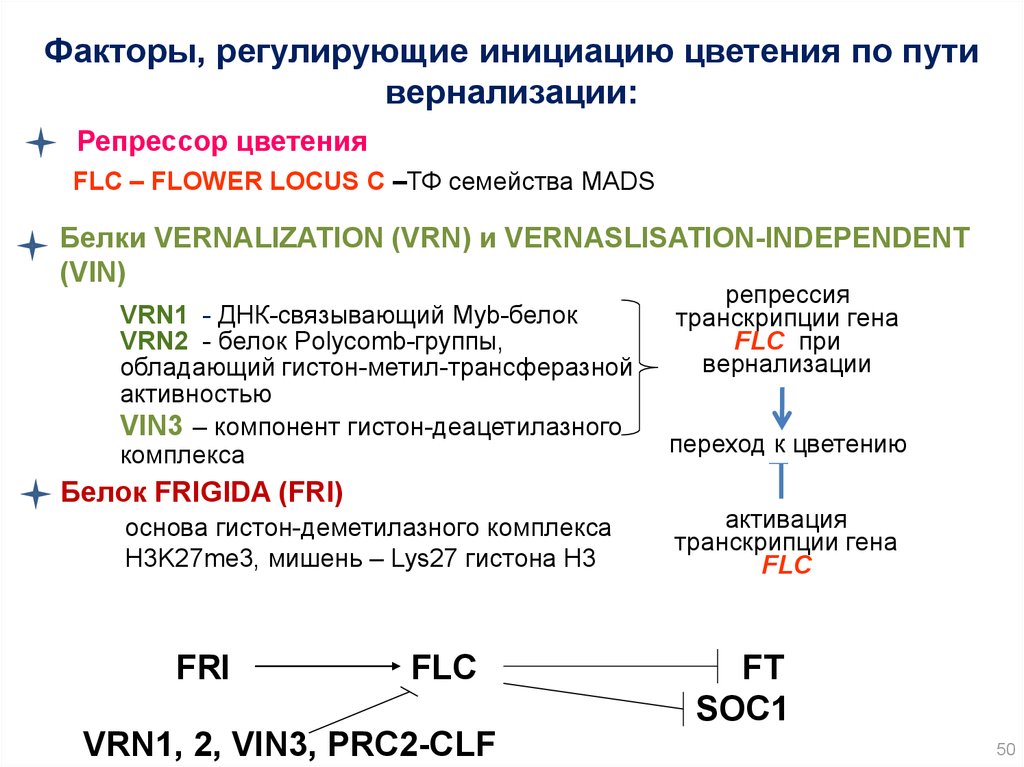
50.
Факторы, регулирующие инициацию цветения по путивернализации:
Репрессор цветения
FLC – FLOWER LOCUS C –ТФ семейства MADS
Белки VERNALIZATION (VRN) и VERNASLISATION-INDEPENDENT
(VIN)
VRN1 - ДНК-связывающий Myb-белок
VRN2 - белок Polycomb-группы,
обладающий гистон-метил-трансферазной
активностью
VIN3 – компонент гистон-деацетилазного
комплекса
Белок FRIGIDA (FRI)
основа гистон-деметилазного комплекса
H3K27me3, мишень – Lys27 гистона H3
FRI
FLC
VRN1, 2, VIN3, PRC2-CLF
репрессия
транскрипции гена
FLC при
вернализации
переход к цветению
активация
транскрипции гена
FLC
FT
SOC1
50
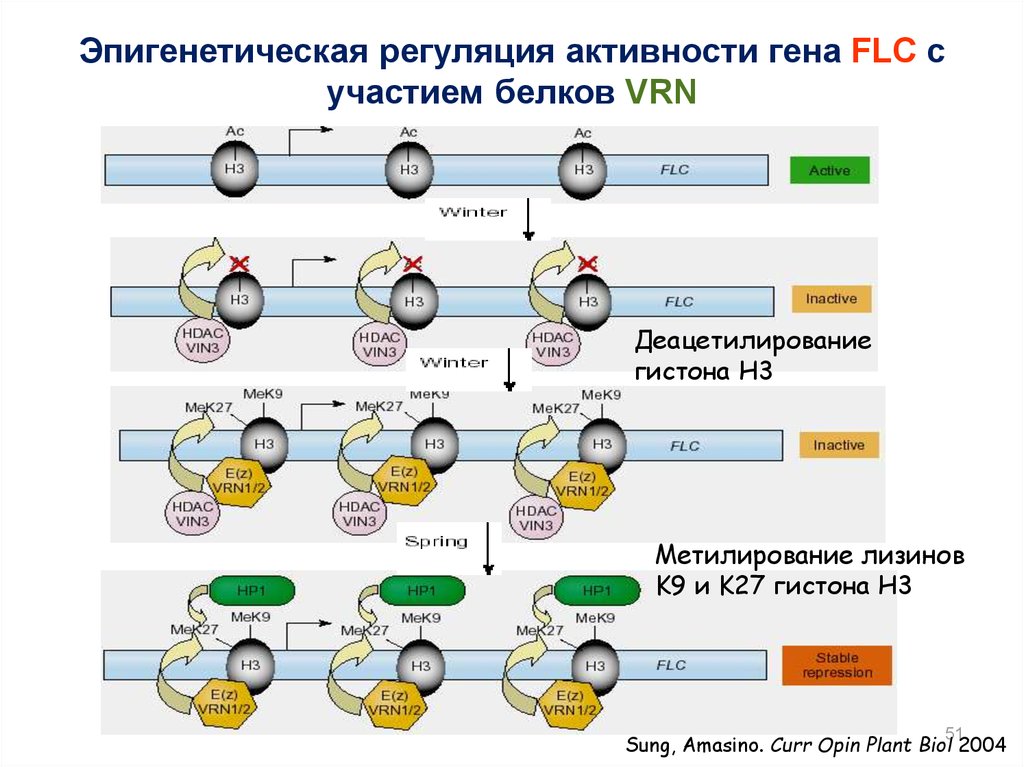
51.
Эпигенетическая регуляция активности гена FLC сучастием белков VRN
Деацетилирование
гистона H3
Метилирование лизинов
K9 и K27 гистона H3
51
Sung, Amasino. Curr Opin Plant Biol 2004
52.
Регуляция уровнятранскриптов FLC:
метилирорвание /де-метилирование
гистонов, антисенс-РНК
COOLAIR
FCA, FY
FCA+FY –
факторы процессинга
РНК, регулируют
стабильность
COOLAIR
52
53.
Белки Polycomb-группы подавляют транскрипциюгенов, изменяя структуру хроматина
Drosophila melanigaster
Arabidopsis thaliana
POLYCOMB комплекс обладает
гистон –
метилтрансферазной
активностью
(метилирует Lys9 и
Lys27 N-конца Н3)
Chanvivattana et al., Development 2004
54.
Взаимодействие комплекса PRC2 с другими белками(а) – только PRC2 комплекс неполное подавление экспрессии
(b) – присоединение белков-кофакторов полное подавление экспресии
(с) – присоединение комплекса PRC1 стабилизация подавления экспрессии
(d) – присоединение комплекса trxG снятие репрессии
55.
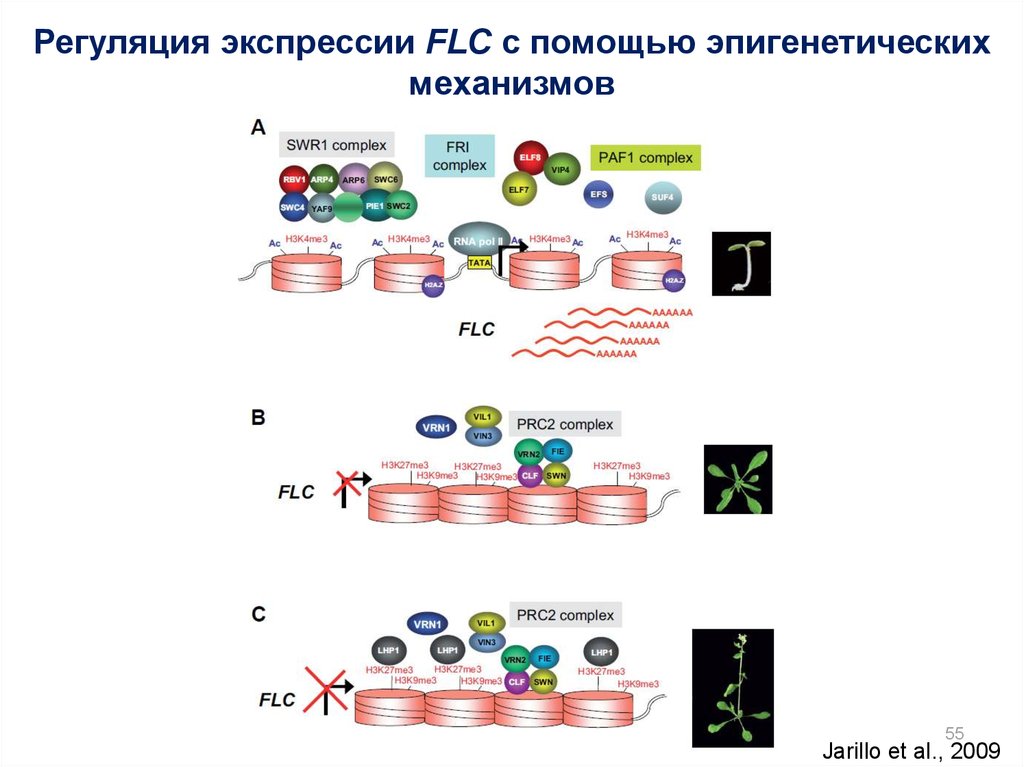
Регуляция экспрессии FLC с помощью эпигенетическихмеханизмов
55
Jarillo et al., 2009
56.
Активация экспрессии FLC(в эмбриональном развитии)
ARP6
Гистон H2A.Z
H3K4Me
TRITHORAX 1 (ATX-1)
56
Jarillo et al., 2009
57.
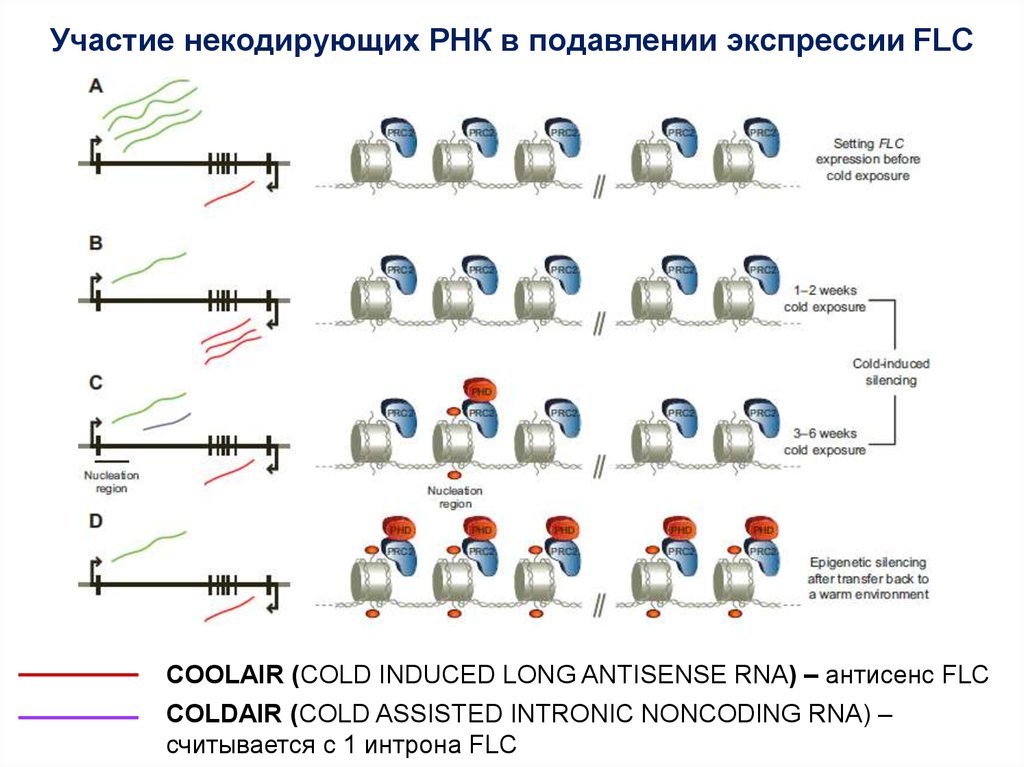
Участие некодирующих РНК в подавлении экспрессии FLCCOOLAIR (COLD INDUCED LONG ANTISENSE RNA) – антисенс FLC
COLDAIR (COLD ASSISTED INTRONIC NONCODING RNA) –
считывается с 1 интрона FLC
58.
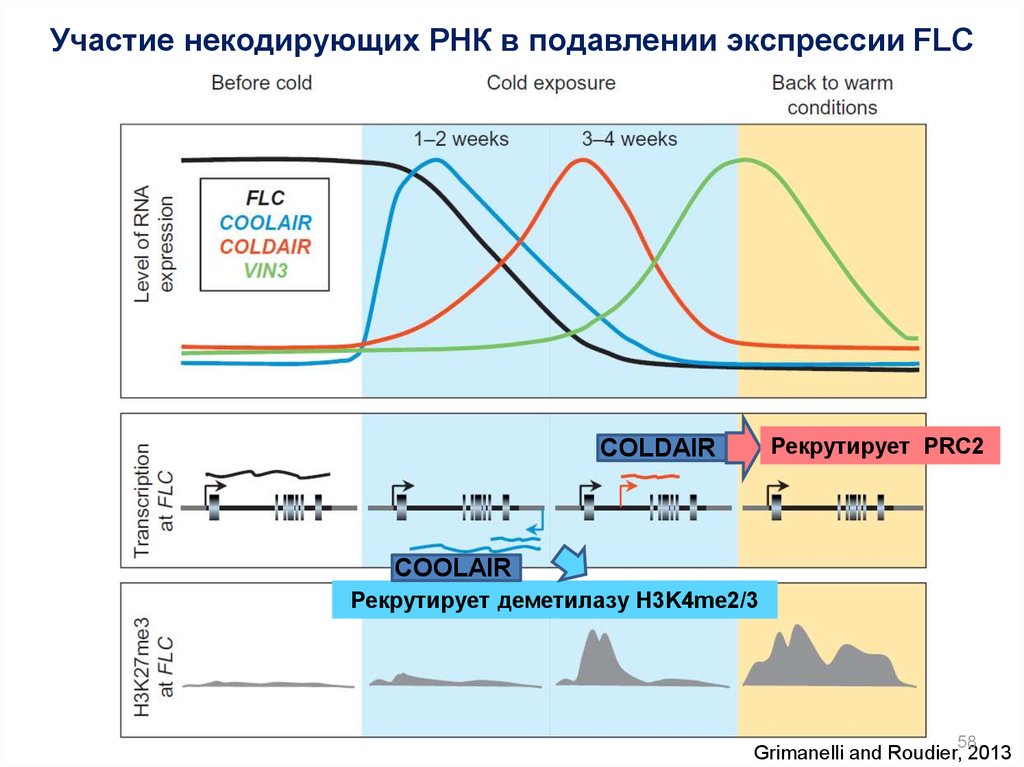
Участие некодирующих РНК в подавлении экспрессии FLCРекрутирует PRC2
COLDAIR
COOLAIR
Рекрутирует деметилазу H3K4me2/3
58
Grimanelli and Roudier, 2013
59.
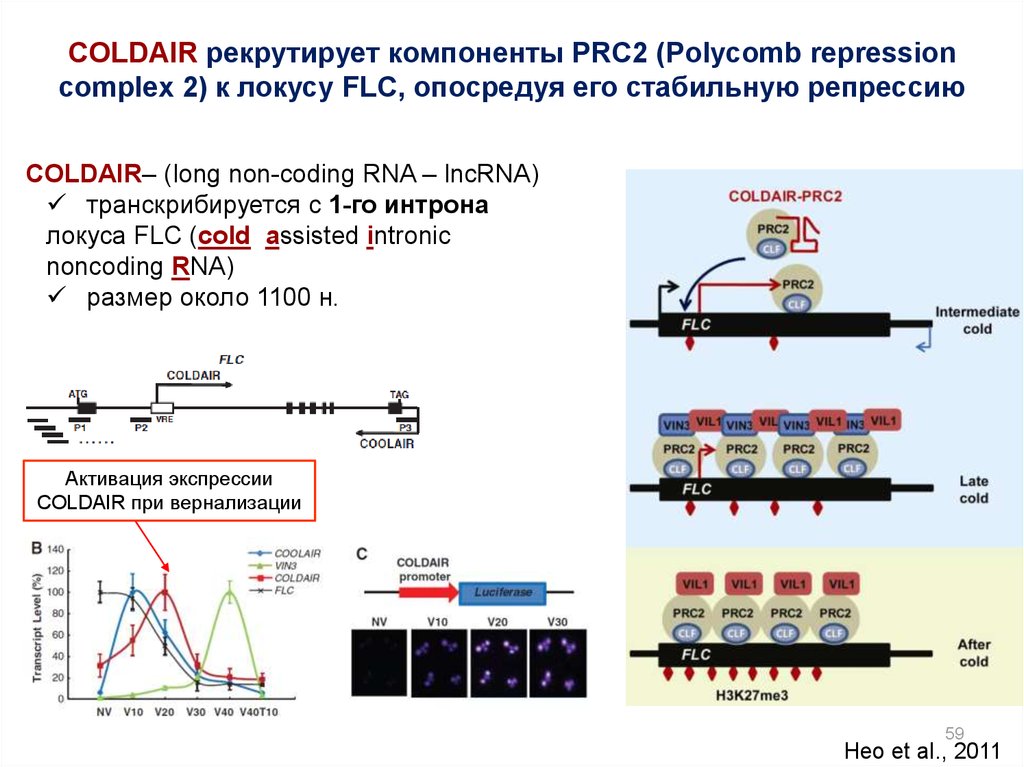
COLDAIR рекрутирует компоненты PRC2 (Polycomb repressioncomplex 2) к локусу FLC, опосредуя его стабильную репрессию
COLDAIR– (long non-coding RNA – lncRNA)
транскрибируется с 1-го интрона
локуса FLC (cold assisted intronic
noncoding RNA)
размер около 1100 н.
Активация экспрессии
COLDAIR при вернализации
59
Heo et al., 2011
60.
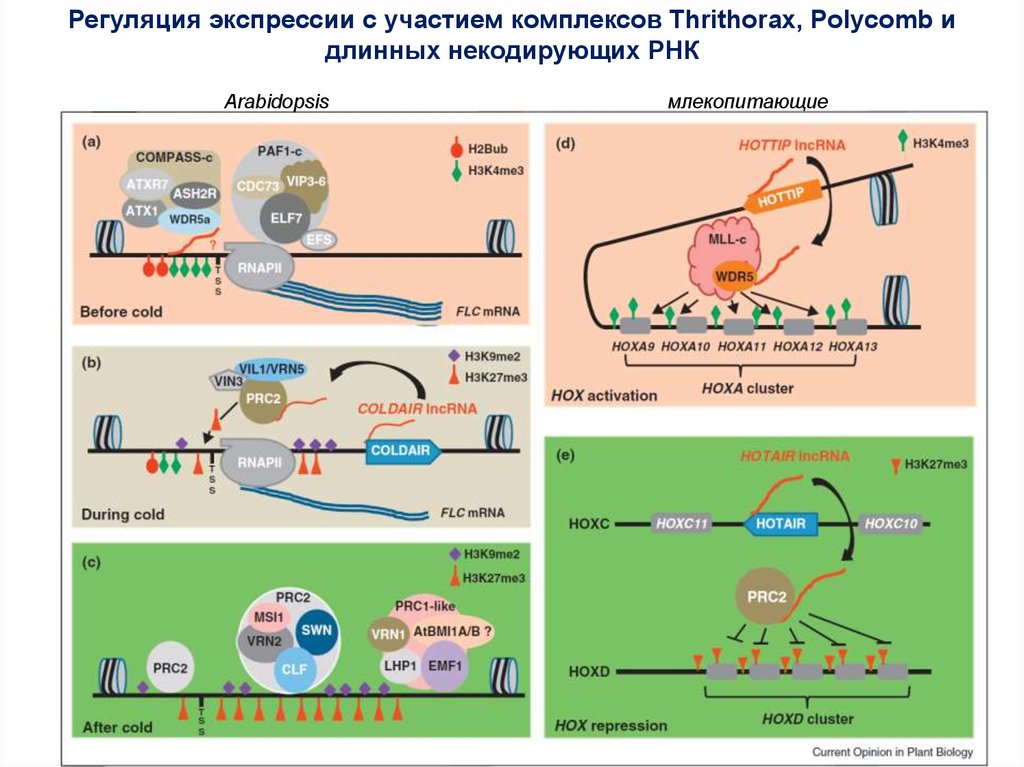
Регуляция экспрессии с участием комплексов Thrithorax, Polycomb идлинных некодирующих РНК
Arabidopsis
млекопитающие
60
61.
62.
Основные гены идентичности цветковых меристем уA.thaliana
- LEAFY (LFY )
- APETALA1 (AP1)
- CAULIFLOWER (CAL )
- UNUSUAL FLORAL ORGANS (UFO)
63.
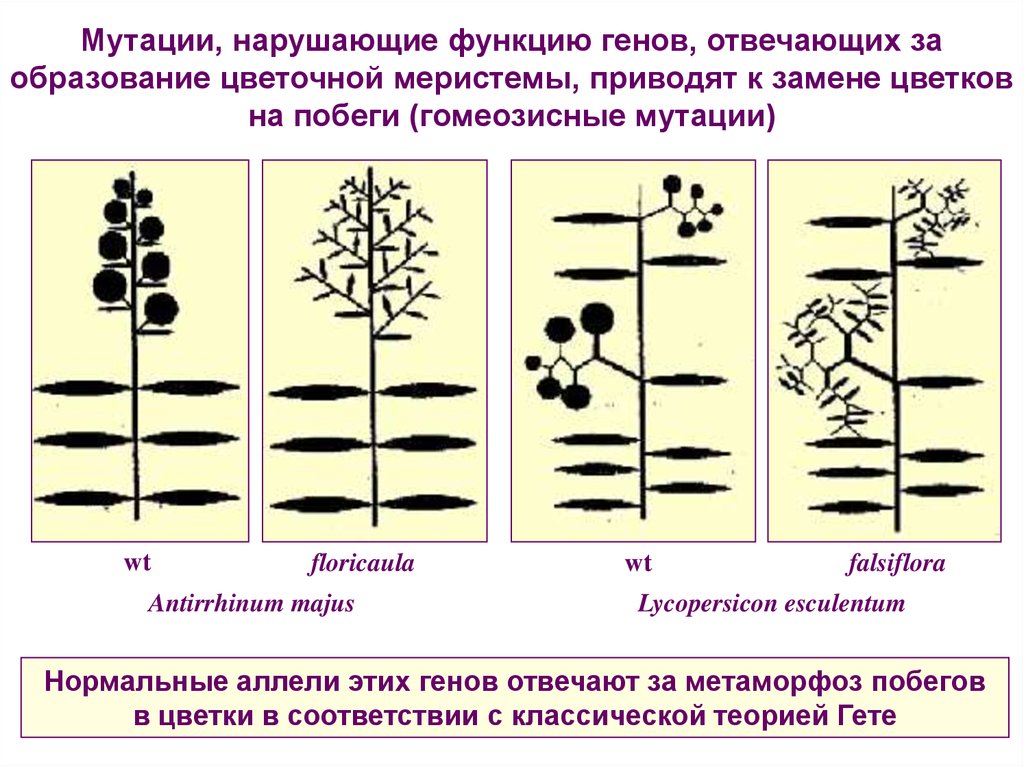
Мутации, нарушающие функцию генов, отвечающих заобразование цветочной меристемы, приводят к замене цветков
на побеги (гомеозисные мутации)
wt
floricaula
Antirrhinum majus
wt
falsiflora
Lycopersicon esculentum
Нормальные аллели этих генов отвечают за метаморфоз побегов
в цветки в соответствии с классической теорией Гете
64.
Фенотип мутации lfy у арабидопсисадикий тип
lfy
lfy
65.
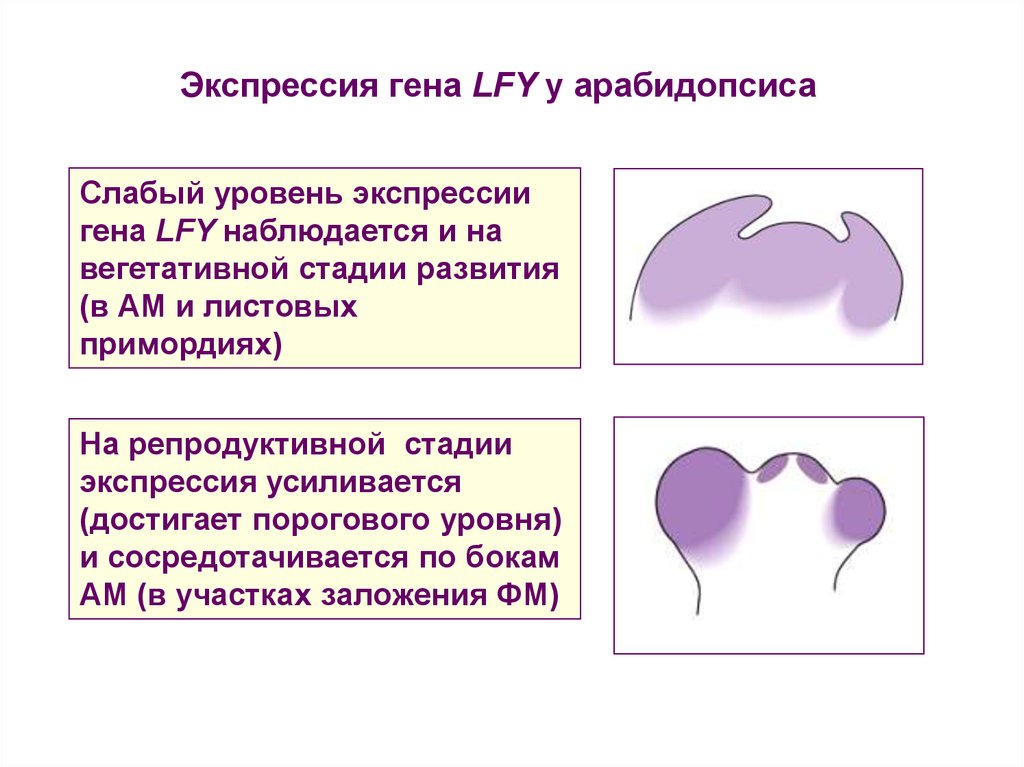
Экспрессия гена LFY у арабидопсисаСлабый уровень экспрессии
гена LFY наблюдается и на
вегетативной стадии развития
(в АМ и листовых
примордиях)
На репродуктивной стадии
экспрессия усиливается
(достигает порогового уровня)
и сосредотачивается по бокам
АМ (в участках заложения ФМ)
66.
Фенотип трансгенных растений 35S::LFY служитдополнительным подтверждением роли LFY в
формировании ФМ
У растений 35S::LFY ген LFY экспрессируется и в АМ, что
приводит к ее превращению во ФМ и формированию
терминальных цветков (закрытию соцветия)
67.
Ортологи гена LFYFLORICAULA (FLO) – Antirrhinum majus
NFL – Nicotiana tabacum
ALF – Petunia hybrida
FALSIFLORA – Lycopersicon esculentum
UNIFOLIATA (UNI) – Pisum sativum
ELF1 – Eucalyptus globules
NEEDLY (NLY) - Pinus radiata
68.
Характер экспрессии генов-ортологов LFY/FLO определяет тип соцветия(открытое или закрытое)
открытое
закрытое
LFY
LFY
Antirrhinum Arabidopsis
табак
томат
69.
Ген сосны NEEDLY под промотором гена LFY супрессируетмутацию lfy-26
lfy-26
LFY::NLY
70.
Наличие ортологов генов LFY/FLO у голосеменных ипокрытосеменных растений позволяет предполагать,
что эти гены участвовали в возникновении
репродуктивных органов у предковых форм семенных
растений
Зависимость структуры побега (открытый/закрытый)
от особенностей экспрессии ортологов LFY/FLO
свидетельствуют о том, что генетически
обусловленные изменения характера экспрессии этих
генов могли оказывать существенное влияние на
эволюцию структуры соцветия
71.
Ген TFL1 – антогонист гена LFY. Его экспрессия препятствуетэкспрессии LFY в АМ. При мутации tfl1 ген LFY начинает
экспрессироваться и в АМ, превращая соцветие в закрытое
(как в растениях 35S::LFY)
Экспрессия LFY
72.
Связь между структурой соцветия (открытое/закрытое) иособенностями экспрессии генов антогонистов – ортологов LFY и
TFL1 в меристеме соцветия
72
73.
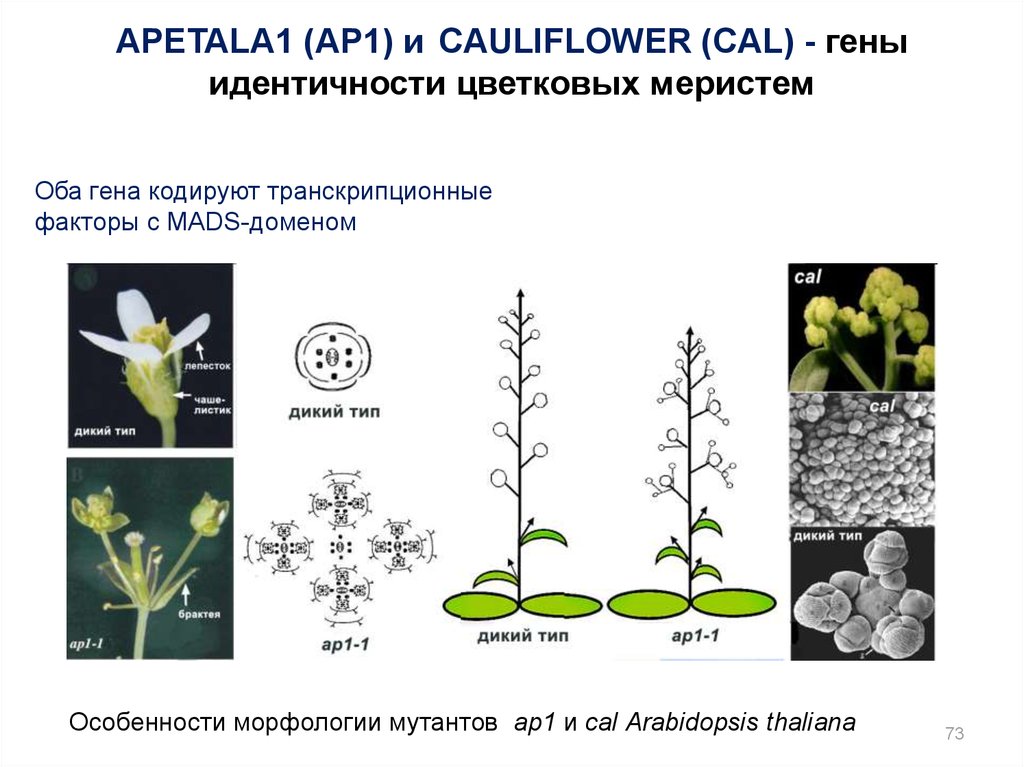
APETALA1 (AP1) и CAULIFLOWER (CAL) - геныидентичности цветковых меристем
Оба гена кодируют транскрипционные
факторы с MADS-доменом
Особенности морфологии мутантов ap1 и cal Arabidopsis thaliana
73
74.
Фенотип двойной мутации ap1 cal у арабидопсисаУ мутанта ap1cal меристемы
соцветия формируют новые
меристемы соцветия, но не
цветочные меристемы
Соцветие двойного мутанта
apetala1 cauliflower арабидопсиса
75.
Генетический контроль дифференцировкиорганов цветка
ap3
wt
Гомеозисные
мутанты
арабидопсиса
ap2
ag
76.
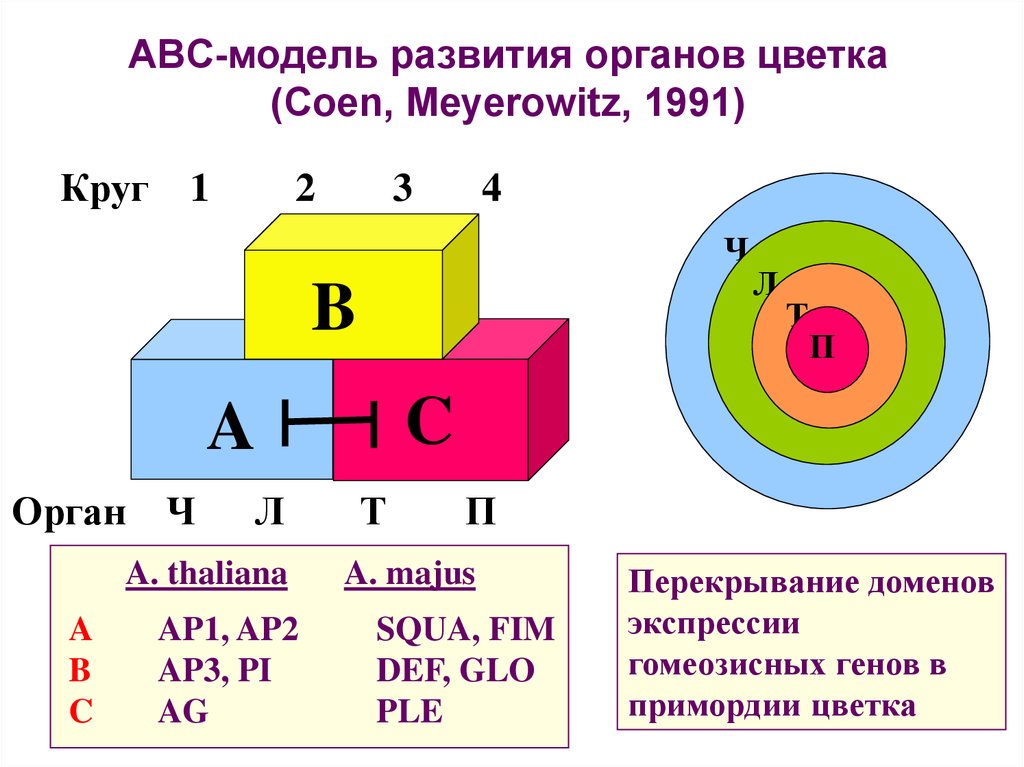
ABC-модель развития органов цветка(Coen, Meyerowitz, 1991)
Круг
1
2
3
4
Ч
B
Л
A. thaliana
A
B
C
AP1, AP2
AP3, PI
AG
Т
П
C
A
Орган Ч
Л
Т
П
A. majus
SQUA, FIM
DEF, GLO
PLE
Перекрывание доменов
экспрессии
гомеозисных генов в
примордии цветка
77.
Объяснение фенотипов мутантов с нарушением развитияорганов цветка с помощью АВС-модели
77
78.
Подтверждение АВС-модели путем исследованиятрансгенных растений
AP3/PI
35S::AP3 35S::PI;
AP3/PI
ag 35S::AP3 35S::PI
AP3/PI
35S::AP3 35S::PI 35S::AG
AG
78
79.
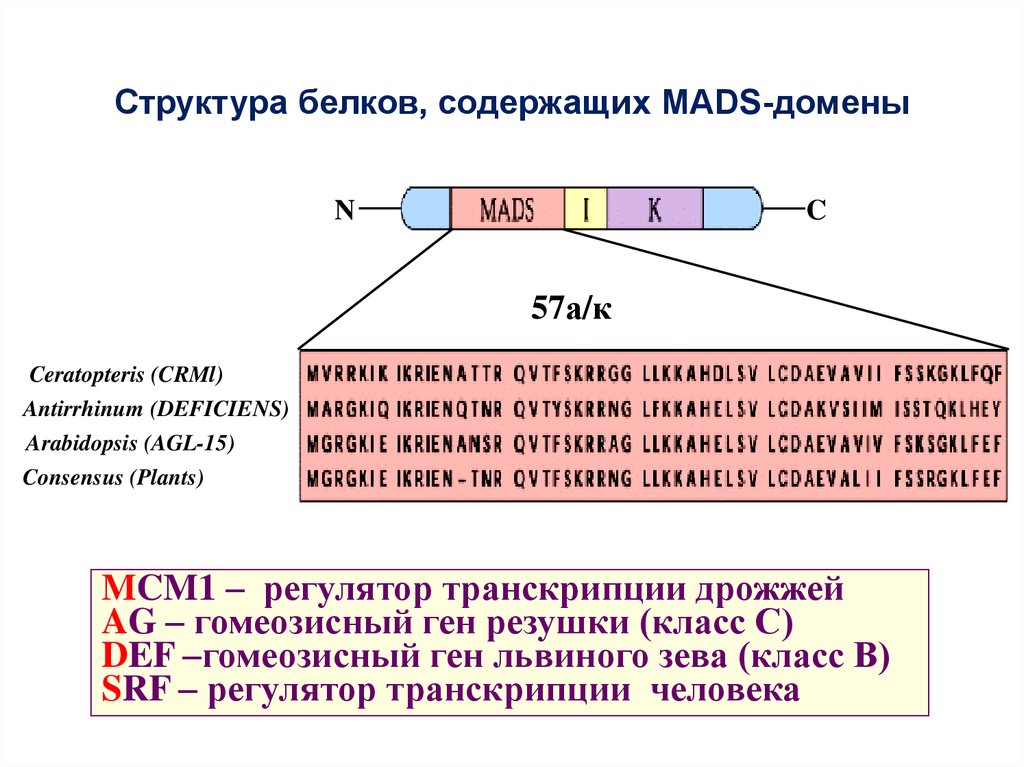
Структура белков, содержащих MADS-доменыN
C
57а/к
Ceratopteris (CRMl)
Antirrhinum (DEFICIENS)
Arabidopsis (AGL-15)
Consensus (Plants)
MCM1 – регулятор транскрипции дрожжей
AG – гомеозисный ген резушки (класс С)
DEF –гомеозисный ген львиного зева (класс В)
SRF – регулятор транскрипции человека
80.
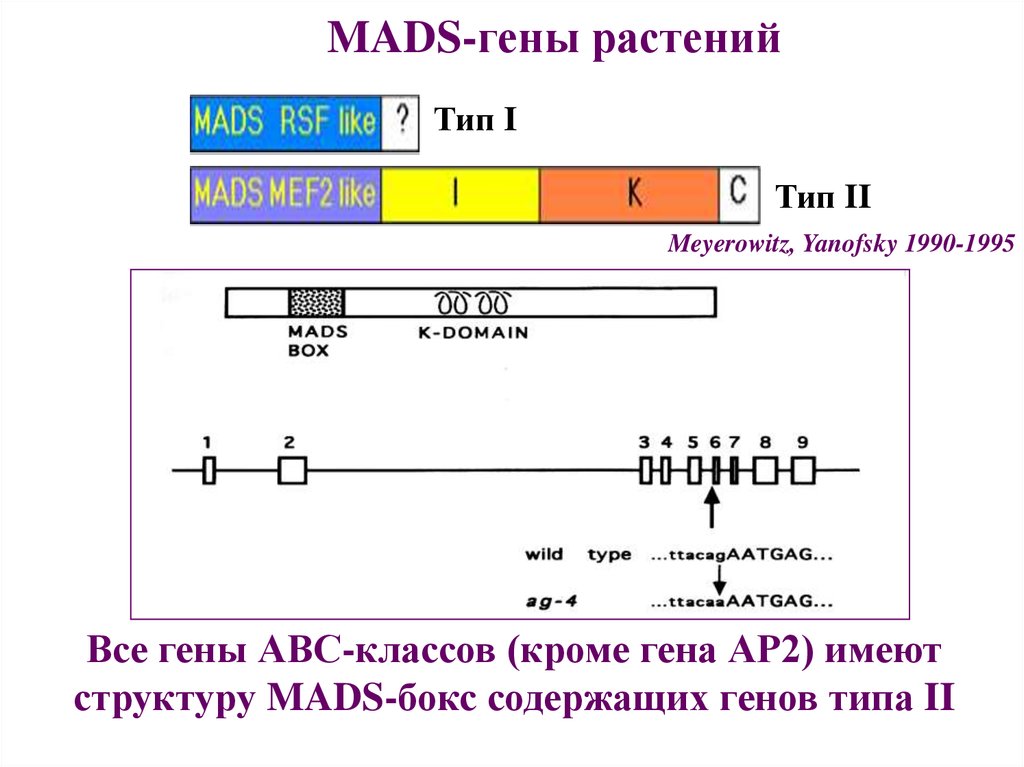
MADS-гены растенийТип I
Тип II
Meyerowitz, Yanofsky 1990-1995
Все гены АВС-классов (кроме гена АР2) имеют
структуру MADS-бокс содержащих генов типа II
81.
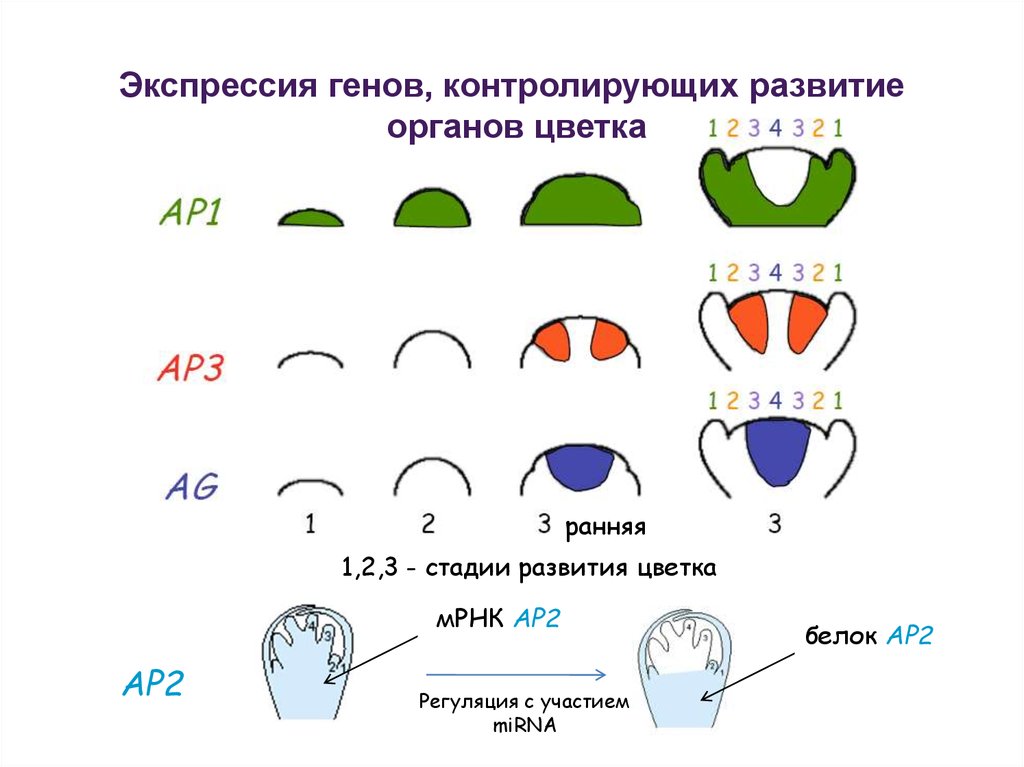
Экспрессия генов, контролирующих развитиеорганов цветка
ранняя
1,2,3 - стадии развития цветка
мРНК AP2
AP2
Регуляция с участием
miRNA
белок AP2
82.
miR172 регулирует экспрессию гена AP2AP3/PI
B
Мутация ap2:
C
A
Ч Л
Т
A. wt
П
AG
П T
B. ap2-9
Т
П
C. 35S::MIR172a-1
Фенотип трансгенных растений 35S::MIR172a-1 повторяет фенотипическое
проявление мутации ap2-9
83.
miR172 регулирует экспрессию гена AP284.
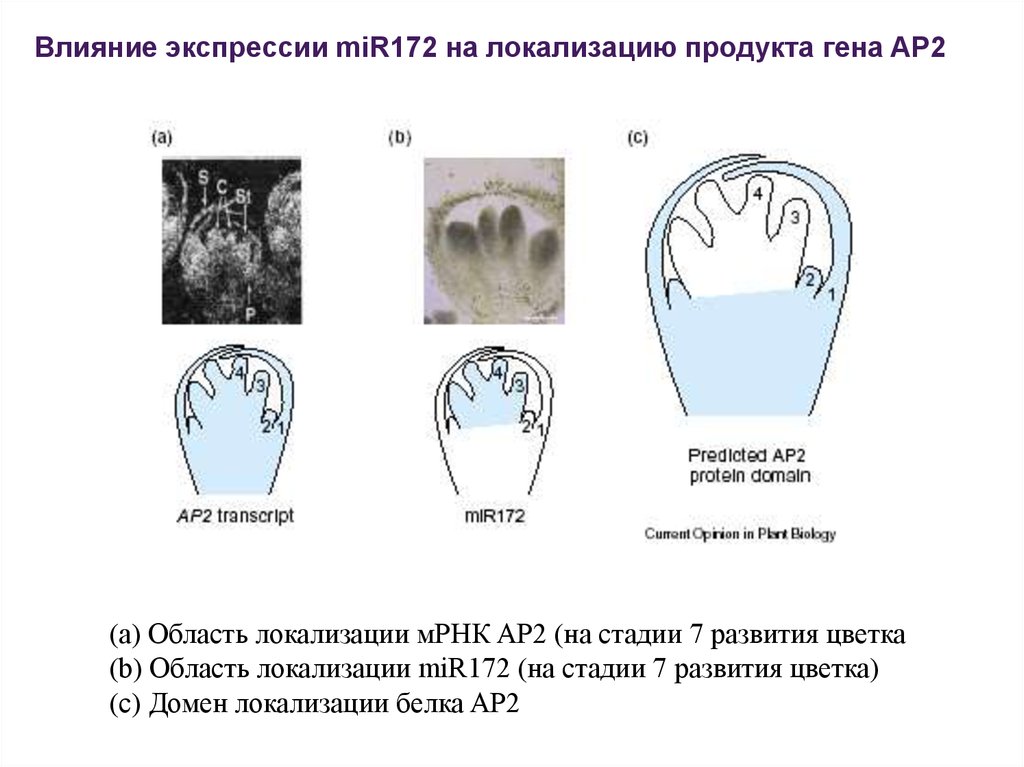
Влияние экспрессии miR172 на локализацию продукта гена AP2(a) Область локализации мРНК AP2 (на стадии 7 развития цветка
(b) Область локализации miR172 (на стадии 7 развития цветка)
(c) Домен локализации белка AP2
85.
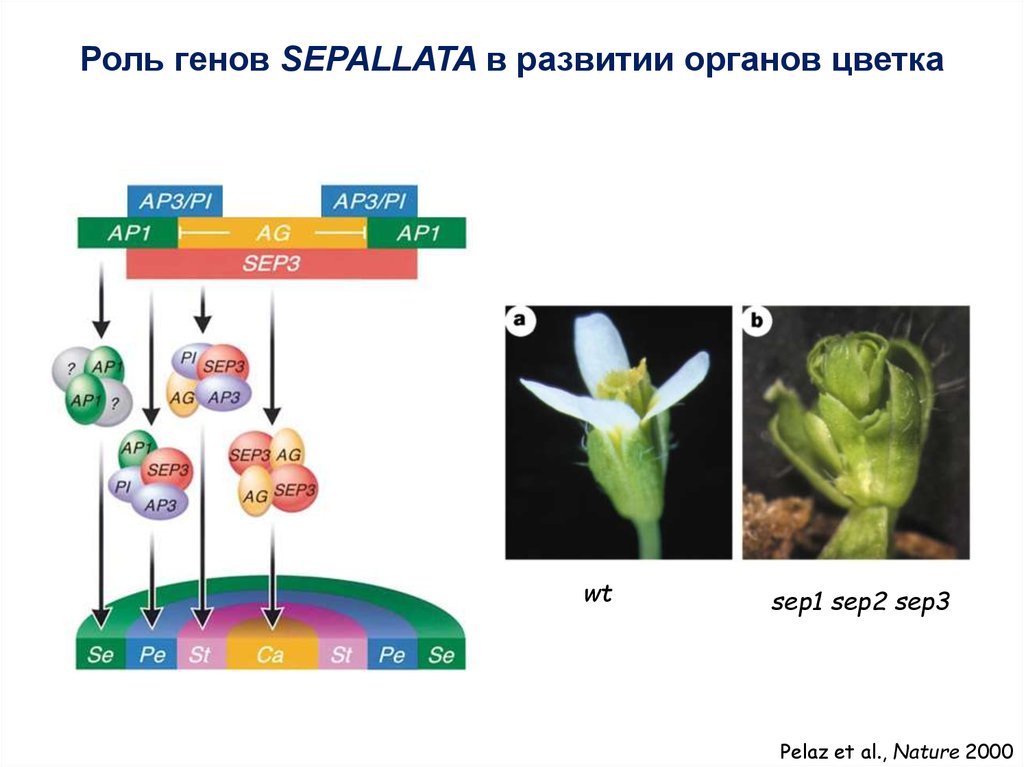
Роль генов SEPALLATA в развитии органов цветкаwt
sep1 sep2 sep3
Pelaz et al., Nature 2000
86.
Дополненная модель развития цветкаSHATTERPROOF 1, 2,
SEEDSTICK
SEPALLATA 1,2,3,4
87.
Дополненная модель развития цветка«Модель квартета»:
продукты генов
идентичности органов
цветка функционируют в
виде гетеротетрамерных
белковых комплексов
Lohmann et al., Developmental Cell 2002
88.
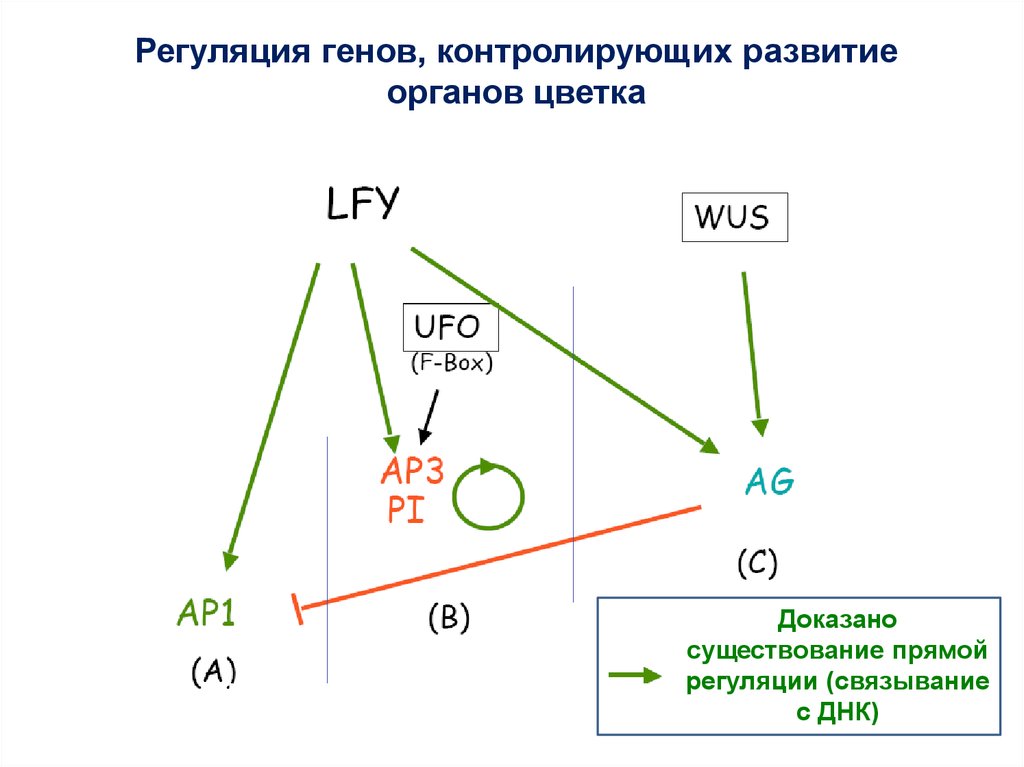
Регуляция генов, контролирующих развитиеорганов цветка
Доказано
существование прямой
регуляции (связывание
с ДНК)
89.
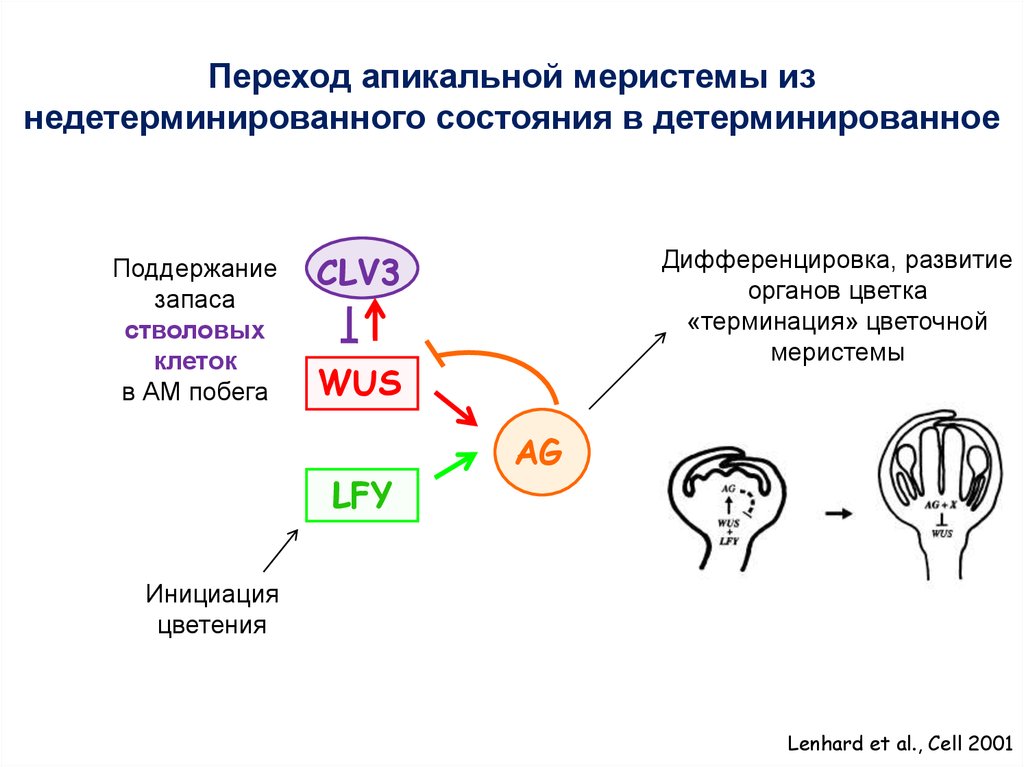
Переход апикальной меристемы изнедетерминированного состояния в детерминированное
Поддержание
запаса
стволовых
клеток
в АМ побега
Дифференцировка, развитие
органов цветка
«терминация» цветочной
меристемы
CLV3
WUS
LFY
AG
Инициация
цветения
Lenhard et al., Cell 2001
90.
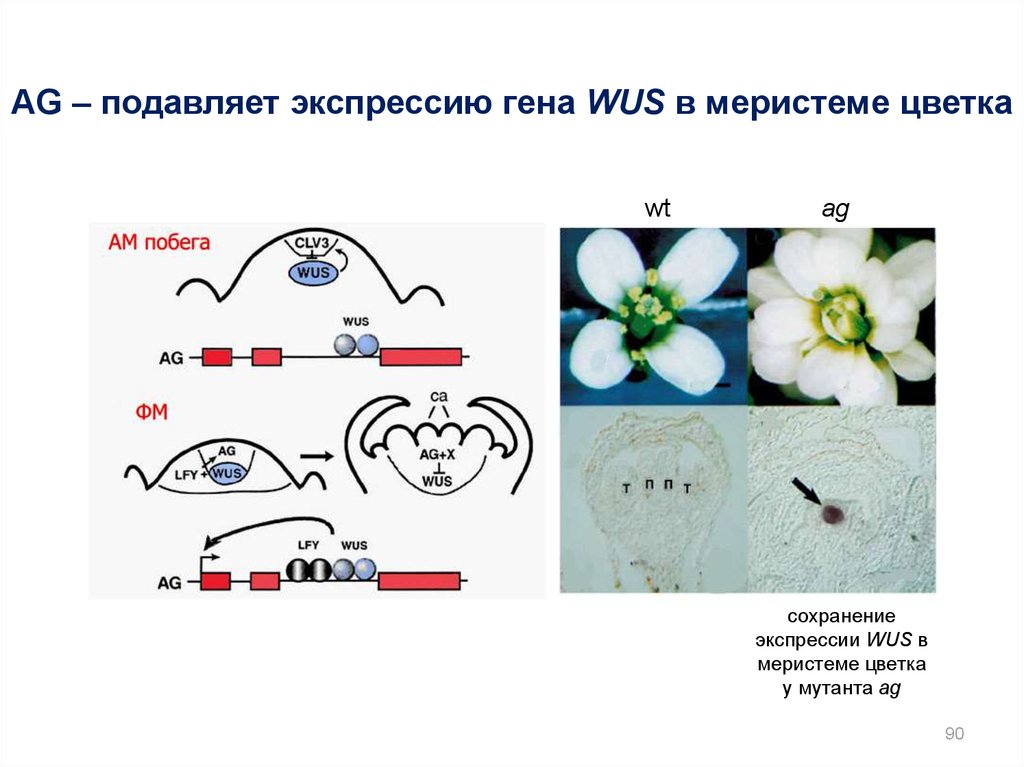
AG – подавляет экспрессию гена WUS в меристеме цветкаwt
ag
сохранение
экспрессии WUS в
меристеме цветка
у мутанта ag
90
91.
Кадастровые гены определяют пространственныеграницы «кругов»:
AG
C2H2 белки с
«цинковыми пальцами»
AP3, PI
Фенотип мутации по
гену SUP
SUPERMAN (SUP)
RABBIT EARS (RBE)
AG
AP3, PI
Фенотип мутации по
гену RBE
Круг 1
2
3
4
B
C
A
Орган
Ч
Л
Т
П
91
92.
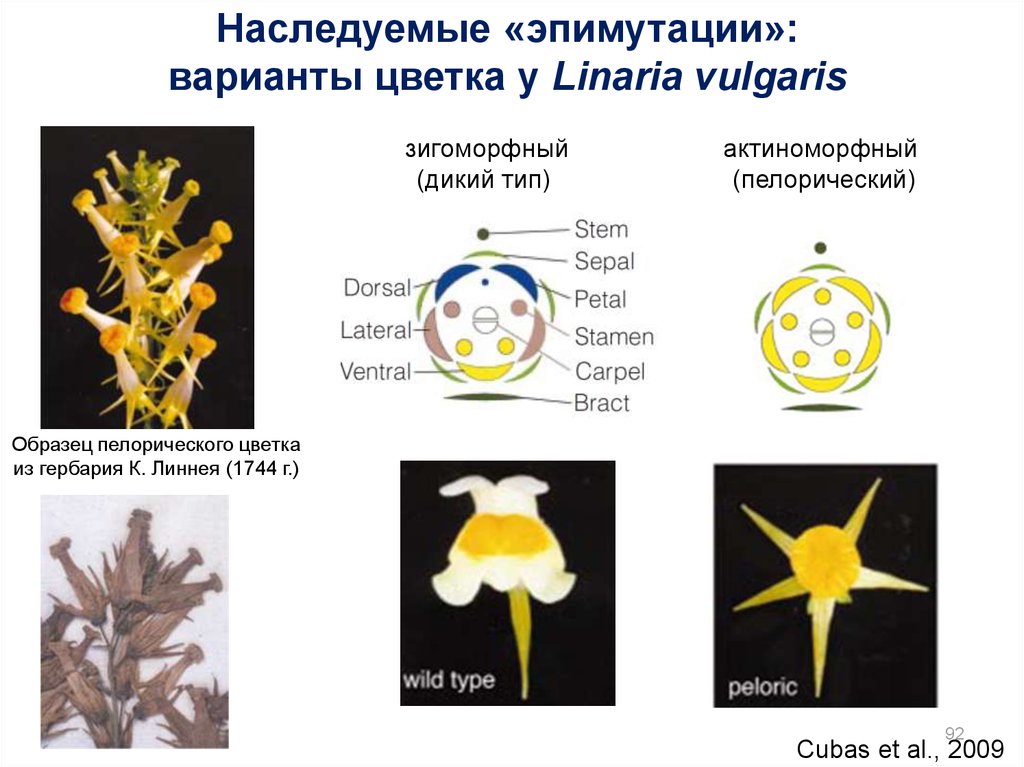
Наследуемые «эпимутации»:варианты цветка у Linaria vulgaris
зигоморфный
(дикий тип)
актиноморфный
(пелорический)
Образец пелорического цветка
из гербария К. Линнея (1744 г.)
92
Cubas et al., 2009
93.
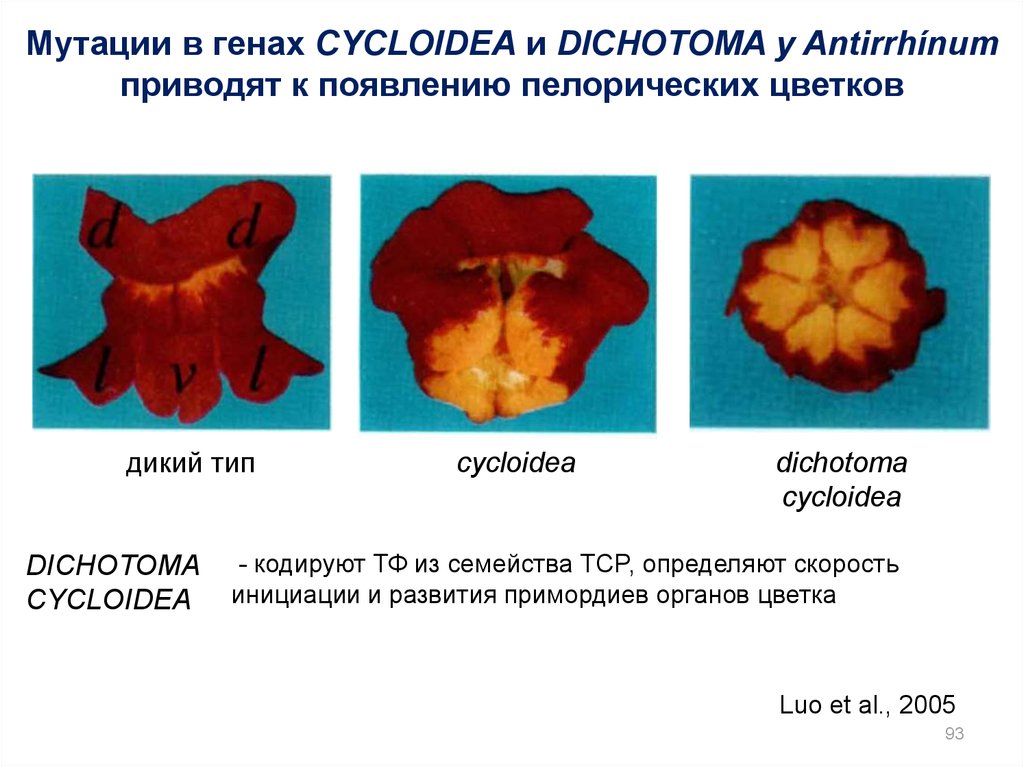
Мутации в генах CYCLOIDEA и DICHOTOMA у Antirrhínumприводят к появлению пелорических цветков
дикий тип
DICHOTOMA
CYCLOIDEA
cycloidea
dichotoma
cycloidea
- кодируют ТФ из семейства TCP, определяют скорость
инициации и развития примордиев органов цветка
Luo et al., 2005
93
94.
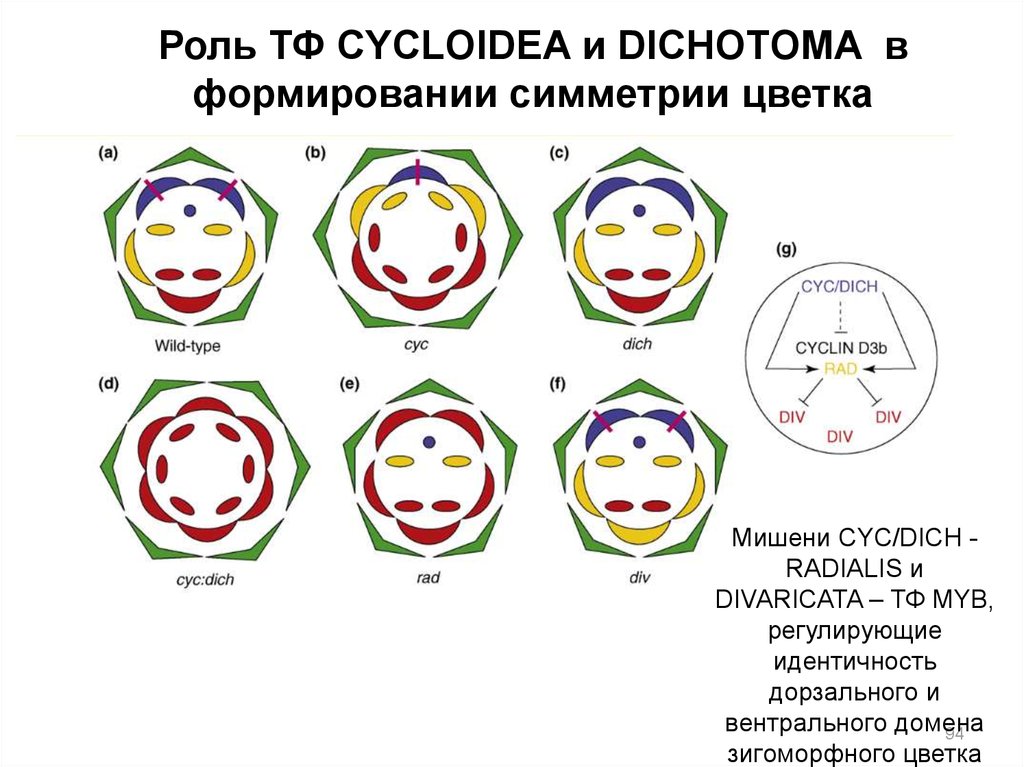
Роль ТФ CYCLOIDEA и DICHOTOMA вформировании симметрии цветка
Мишени CYC/DICH RADIALIS и
DIVARICATA – ТФ MYB,
регулирующие
идентичность
дорзального и
вентрального домена
94
зигоморфного цветка
95.
У растений с пелорическими цветками Linaria vulgarisпоказано наследуемое метилирование локуса Lcyc
(«эпимутация»)
Анализ метилирования в локусе Lvcyc у
пелорических «мутантов»льнянки с
помощью чувствительных к
метилированию рестриктаз Sau3A и MboI
Соматическая нестабильность
пелорического фенотипа коррелирует
с деметилированием в локусе Lcyc
95
Cubas et al., 2009
96.
Гиперметилирование локуса SUPERMAN у«эпимутантов» clark kent (clk)
дикий тип
superman
clark kent
96
Jacobsen and Meyerowitz, 1997
97.
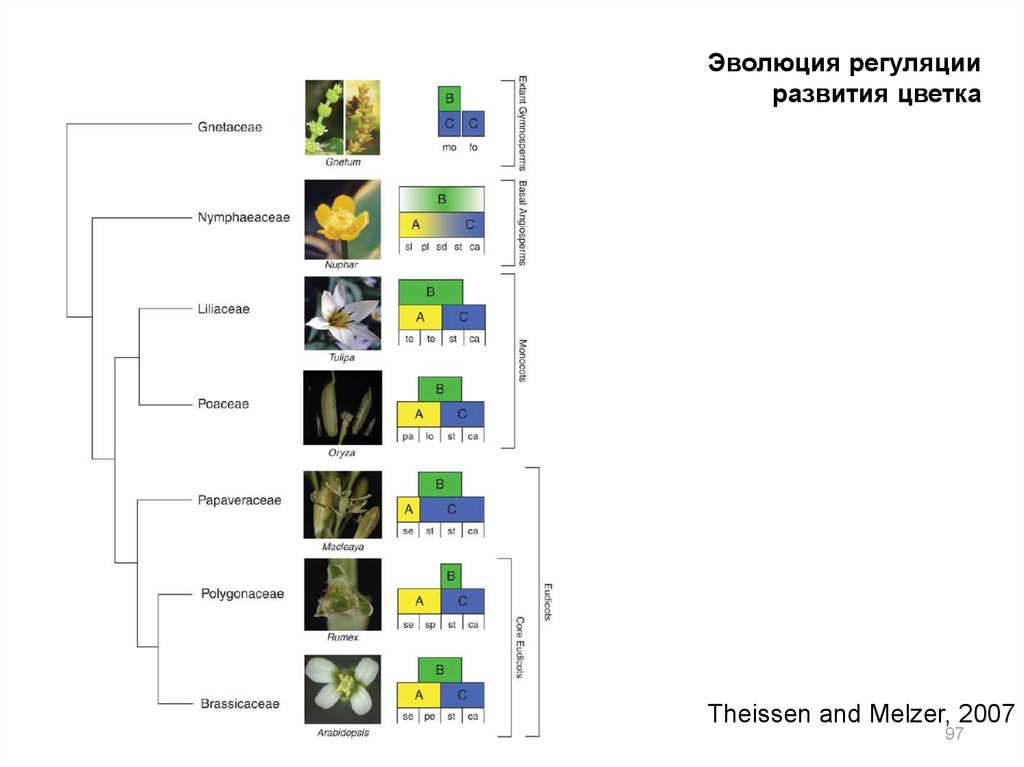
Эволюция регуляцииразвития цветка
Theissen and Melzer, 2007
97
98.
Модели, объясняющиеформирование в ходе эволюции
обоеполого цветка
«mostly-male» theory
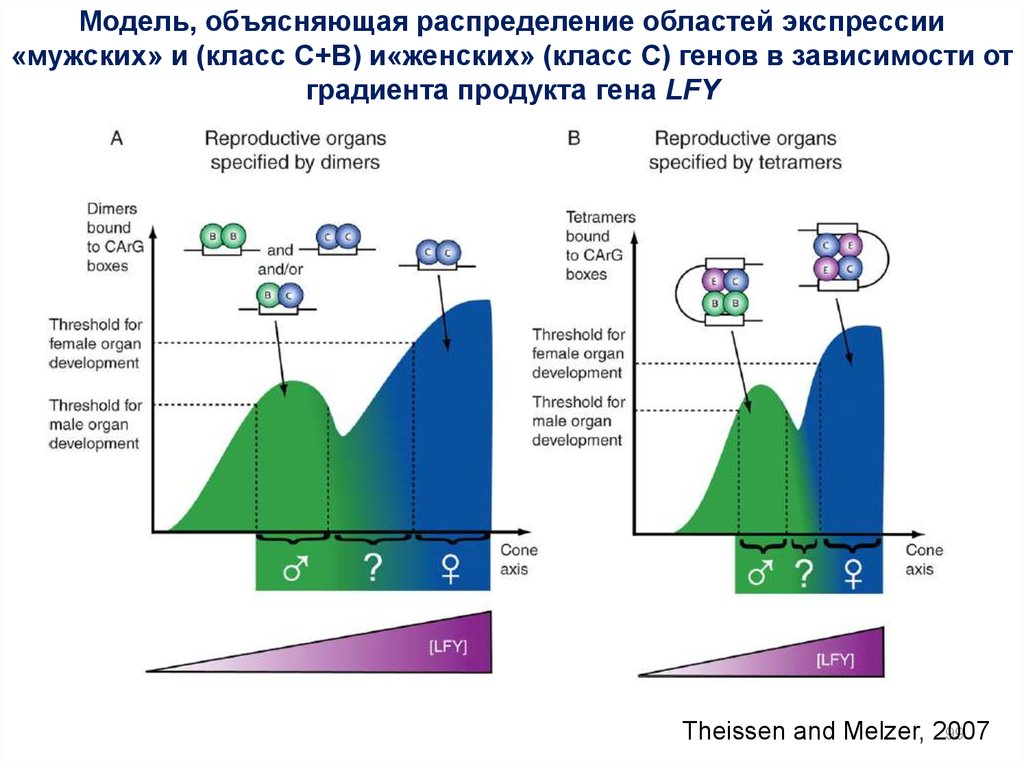
Зависимость экспрессии «мужских» и (C+B)
и«женских» (С) генов от градиента продукта
гена LFY
«out-of-male» theory
«out-of-female» theory
98
Ferrandiz et al. Carpel development. From Advances in botanical research, V.55. 2010
99.
Модель, объясняющая распределение областей экспрессии«мужских» и (класс C+B) и«женских» (класс С) генов в зависимости от
градиента продукта гена LFY
Theissen and Melzer, 2007
99
100.
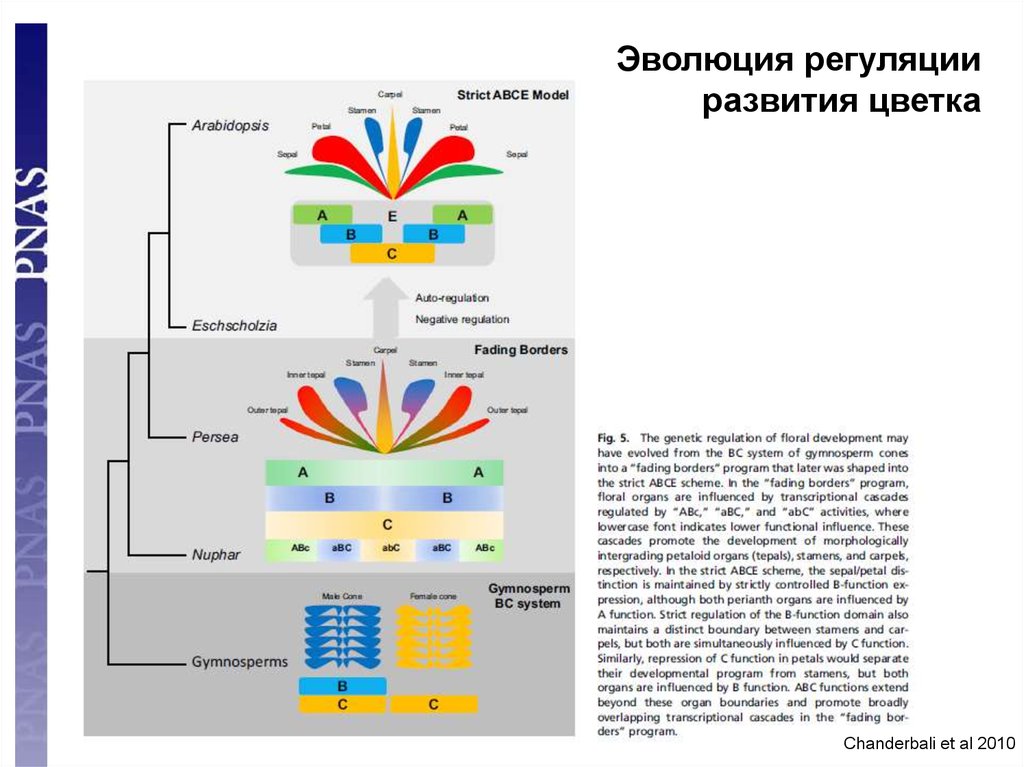
Эволюция регуляцииразвития цветка
100
Chanderbali et al 2010
101.
Мутациив
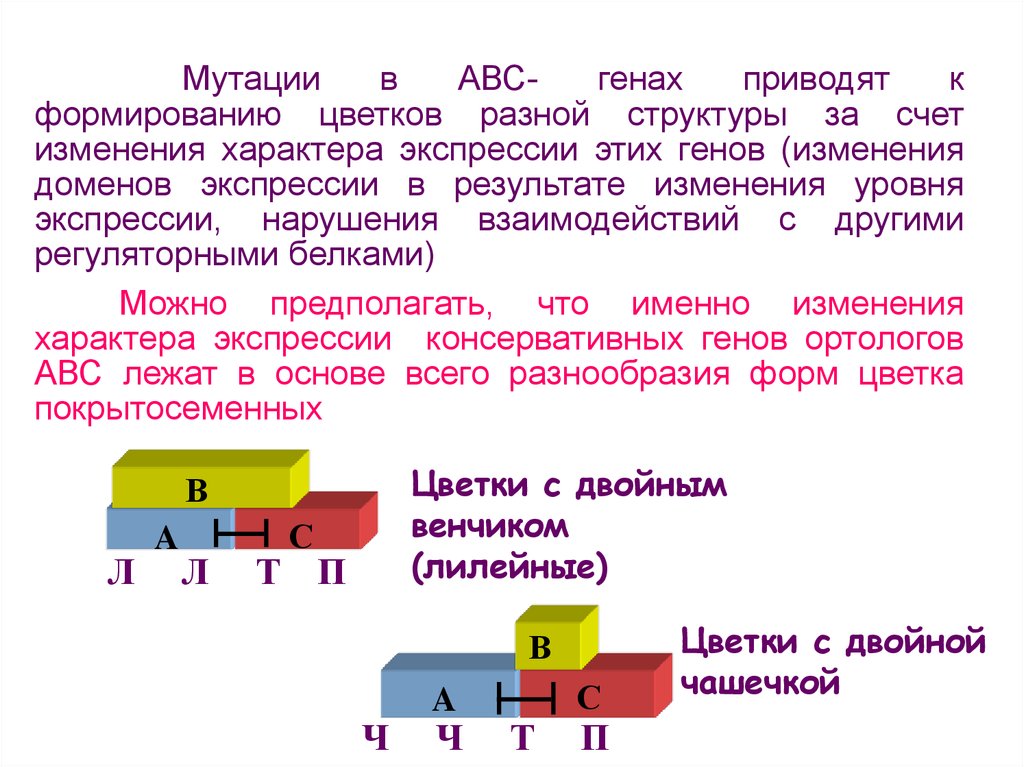
АВСгенах
приводят
к
формированию цветков разной структуры за счет
изменения характера экспрессии этих генов (изменения
доменов экспрессии в результате изменения уровня
экспрессии, нарушения взаимодействий с другими
регуляторными белками)
Можно предполагать, что именно изменения
характера экспрессии консервативных генов ортологов
АВС лежат в основе всего разнообразия форм цветка
покрытосеменных
Цветки с двойным
венчиком
(лилейные)
В
Л
A
Л
С
Т П
В
Ч
A
Ч
С
Т
П
Цветки с двойной
чашечкой
102.
Формирование цветков однодольных (Лилейные)Модифицированная
модель
102
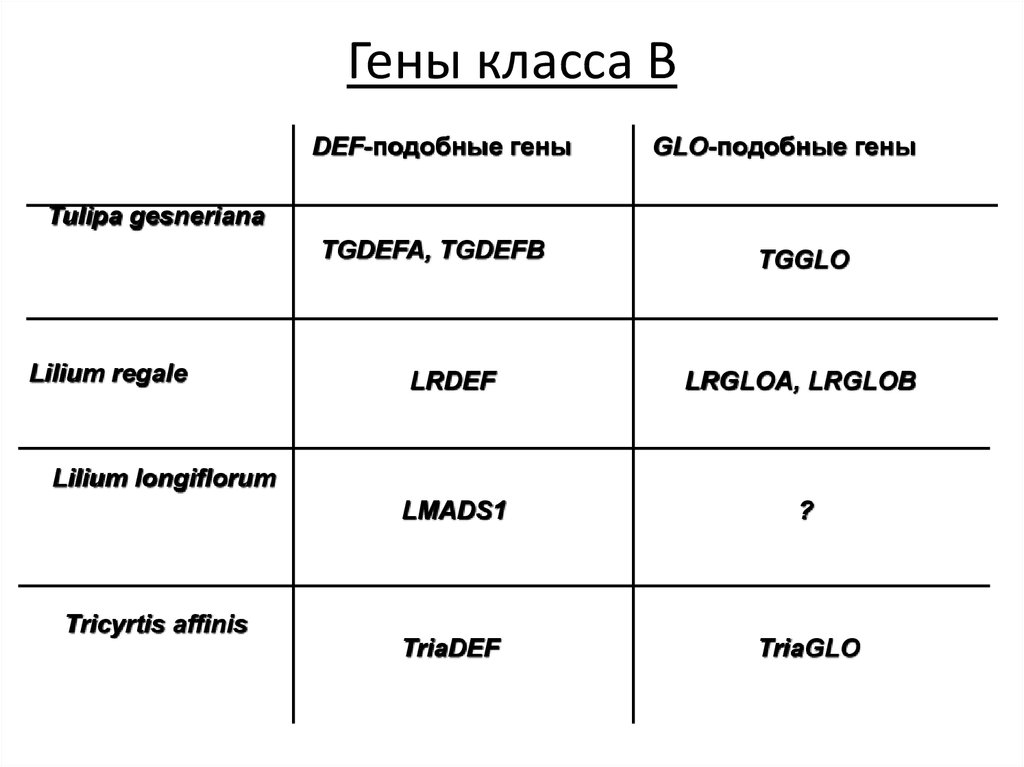
103. Гены класса В
DEF-подобные геныGLO-подобные гены
Tulipa gesneriana
TGDEFA, TGDEFB
Lilium regale
TGGLO
LRDEF
LRGLOA, LRGLOB
LMADS1
?
TriaDEF
TriaGLO
Lilium longiflorum
Tricyrtis affinis
104. Экспрессия генов класса В
Tulipagesneriana
Tricyrtis
affinis
Asparagales:
Phalaenopsis equestris, Dendrobium crumenatum,
Agapanthus praecox
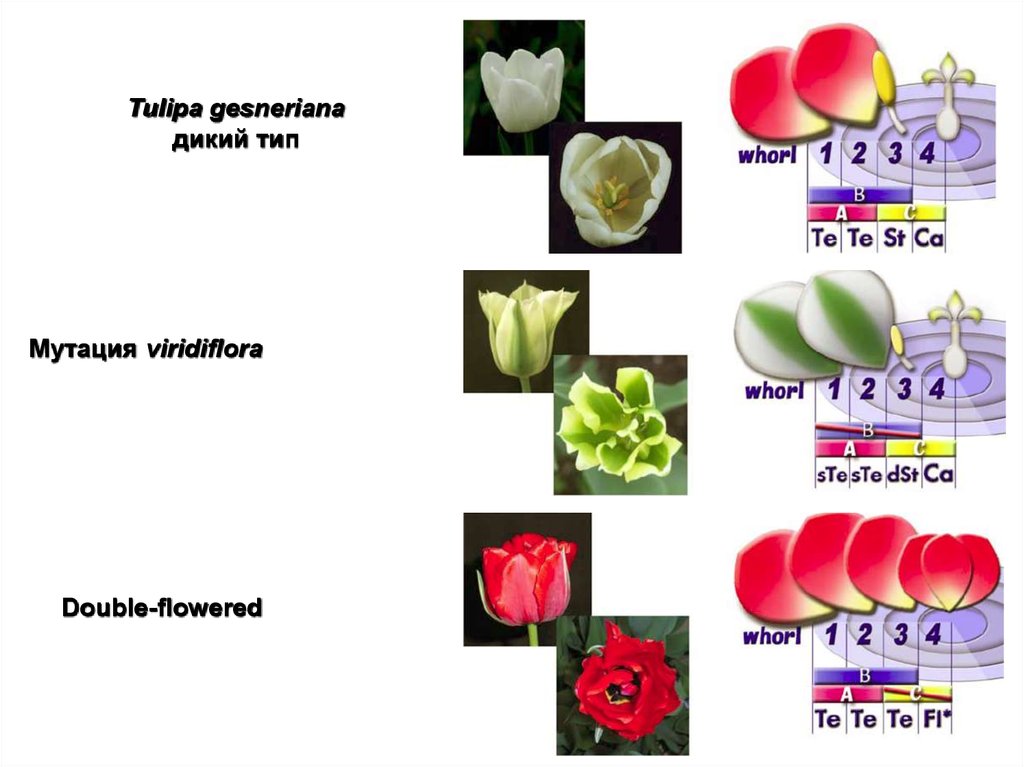
105.
Tulipa gesnerianaдикий тип
Мутация viridiflora
Double-flowered
106. Нерешённые вопросы модифицированной АВС модели
Muscari armeniacumAsparagus officinalis
Tulipa gesneriana
107.
Формирование цветков однодольных (Злаки)107
























































 Биология
Биология








