Похожие презентации:
Электроповерхностные явления. Строение двойного электрического слоя
1. ЭЛЕКТРОПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ СТРОЕНИЕ ДВОЙНОГО ЭЛЕКТРИЧЕСКОГО СЛОЯ
ЛЕКЦИЯ №72. Электрокинетические свойства
Электрокинетическимиявлениями называют перемещение
одной фазы относительно другой в
электрическом поле и
возникновение разности
потенциалов при течении жидкости
через пористые материалы или при
оседании частиц.
3.
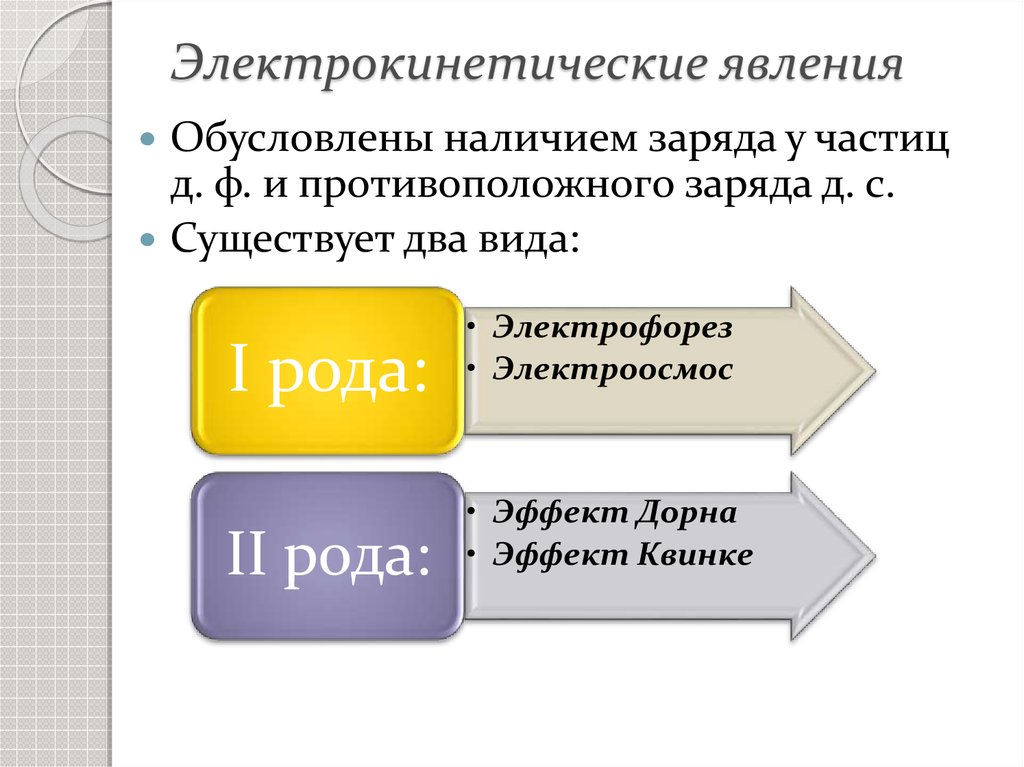
Электрокинетические явленияОбусловлены наличием заряда у частиц
д. ф. и противоположного заряда д. с.
Существует два вида:
I рода:
II рода:
• Электрофорез
• Электроосмос
• Эффект Дорна
• Эффект Квинке
4.
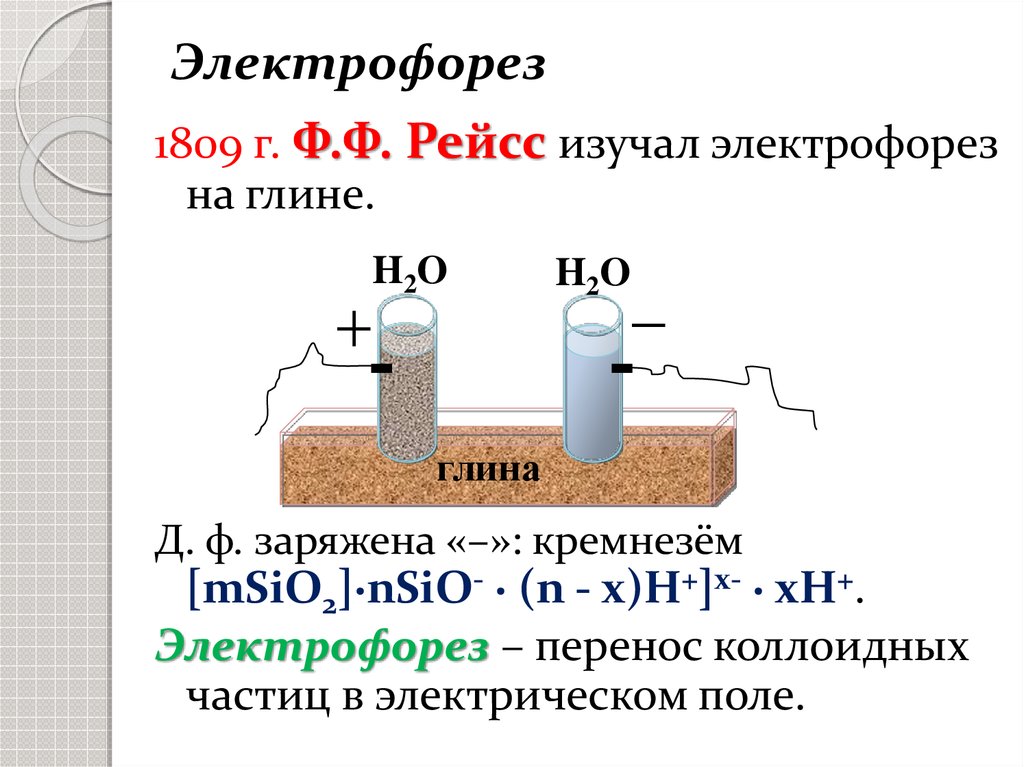
Электрофорез1809 г. Ф.Ф. Рейсс изучал электрофорез
на глине.
H2O
H2O
глина
Д. ф. заряжена «–»: кремнезём
[mSiO2]∙nSiO- ∙ (n - x)H+]x- ∙ xH+.
Электрофорез – перенос коллоидных
частиц в электрическом поле.
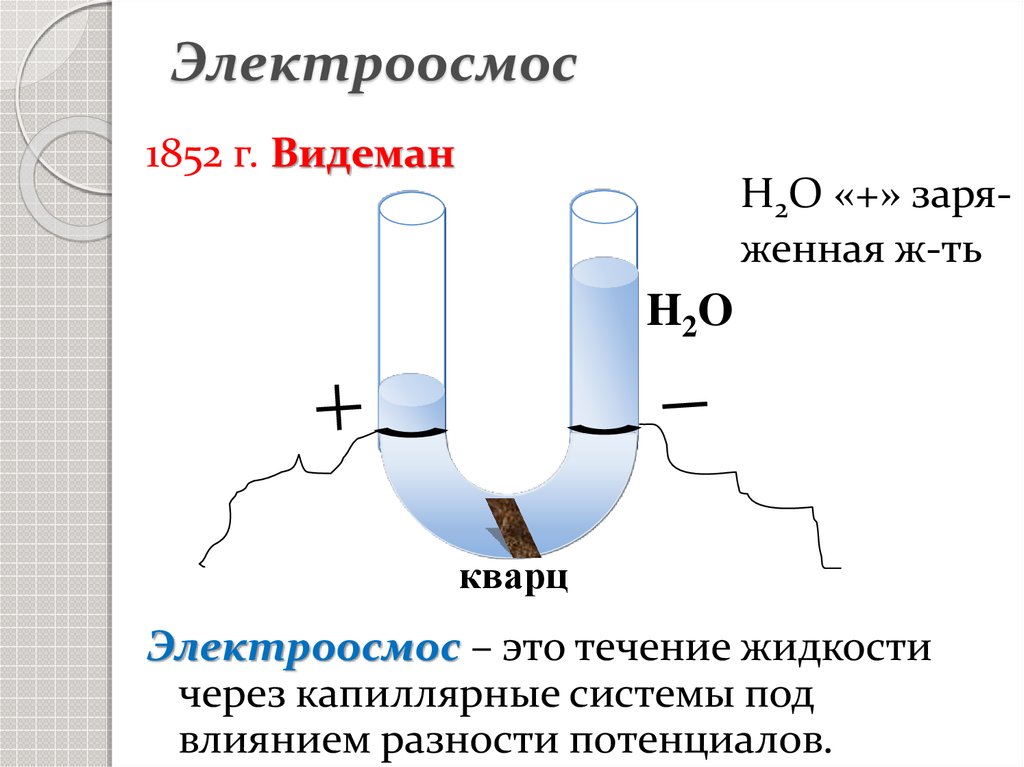
5. Электроосмос
1852 г. ВидеманH2O «+» заряженная ж-ть
H2O
кварц
Электроосмос – это течение жидкости
через капиллярные системы под
влиянием разности потенциалов.
6. Эффект Дорна
Эффект Дорна или потенциалседиментации (1878г.) – явление
возникновения разности
потенциалов между двумя
электродами при оседании
дисперсной фазы.
7. Эффект Квинке
Эффект Квинке или потенциалпротекания (1859 г.) –
возникновение разности
потенциалов при течение воды и
водных растворов через
разнообразные пористые материалы
под действием перепада давлений.
8. ДЭС
Возникает в результате двух причин:- или в результате избирательной
адсорбции одного из ионов
электролита;
- или за счет ионизации
поверхностных молекул вещества.
9.
ДЭСK+
+
K
I II
+
K IAgI I
+
K
I
I
+
K I I+
K
K+
K+
ДЭС в результате избирательной
адсорбции одного из ионов электролита.
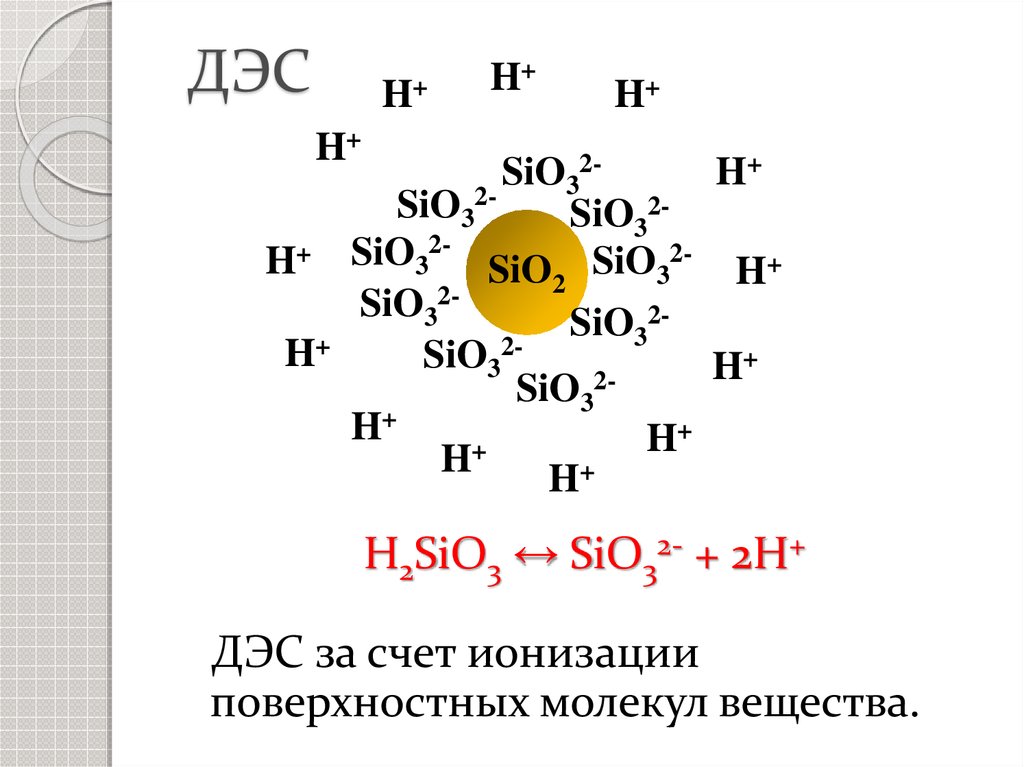
10.
ДЭСH+
H+
H+
H+
SiO32H+
SiO32SiO322+
2SiO
H
3
SiO2 SiO3
H+
SiO322SiO
3
+
2H
+
SiO3
H
SiO32H+
H+
+
H
H+
H2SiO3 ↔ SiO32- + 2H+
ДЭС за счет ионизации
поверхностных молекул вещества.
11. Строение двойного электрического слоя
Существует несколько моделей:Модель ГельмгольцаПеррена
Модель Гуи-Чэпмена
Модель Штерна
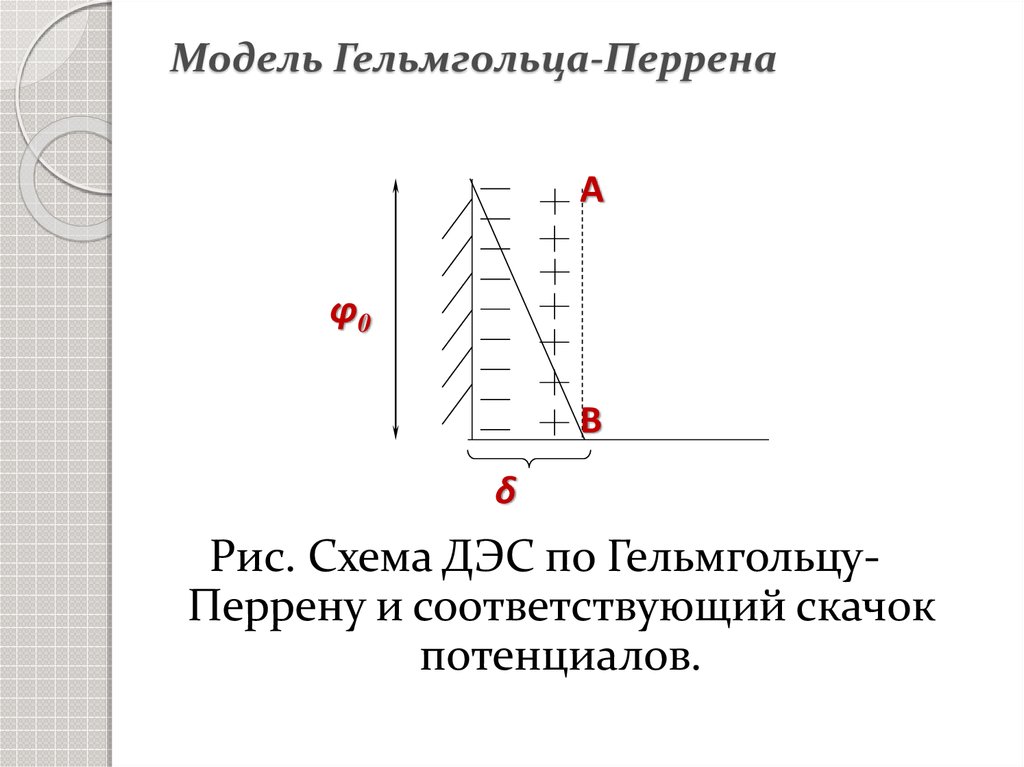
12. Модель Гельмгольца-Перрена
ДЭС – это два близко расположенныхслоя ионов: один на поверхности
(потенциалопределяющие ионы),
другой – в растворе на расстоянии
удвоенного радиуса ионов
(противоионы), в целом система
электронейтральна, является как бы
плоским конденсатором.
13. Модель Гельмгольца-Перрена
Аφ0
В
δ
Рис. Схема ДЭС по ГельмгольцуПеррену и соответствующий скачок
потенциалов.
14. Модель Гельмгольца-Перрена
ДЭС является как бы плоским конденсатором.q
0
C
где φ0 – разность потенциалов между дисперсной
фазой и дисперсионной средой;
q – поверхностный заряд;
0
C
C – емкость конденсатора:
;
ε – диэлектрическая проницаемость дисперсионной
среды;
ε0 – абсолютная диэлектрическая проницаемость:
Ф
0 8,85 10 12 ;
м
δ – расстояние между пластинами. Или
0
q
0
15. Модель Гельмгольца-Перрена
Недостатки теории:- толщина ДЭС Гельмгольца-Перрена
очень мала и приближена к
молекулярным размерам;
– невозможно определить реальный
электрокинетический потенциал.
16.
ДЭСПлоскость скольжения (АВ) –
место разрыва при перемещении
твердой и жидкой фазы
относительно друг друга.
Электрокинетический
потенциал (ξ - дзета потенциал) –
это разность потенциалов между
подвижной (диффузной) и
неподвижной (адсорбционной)
частями двойного электрического
слоя.
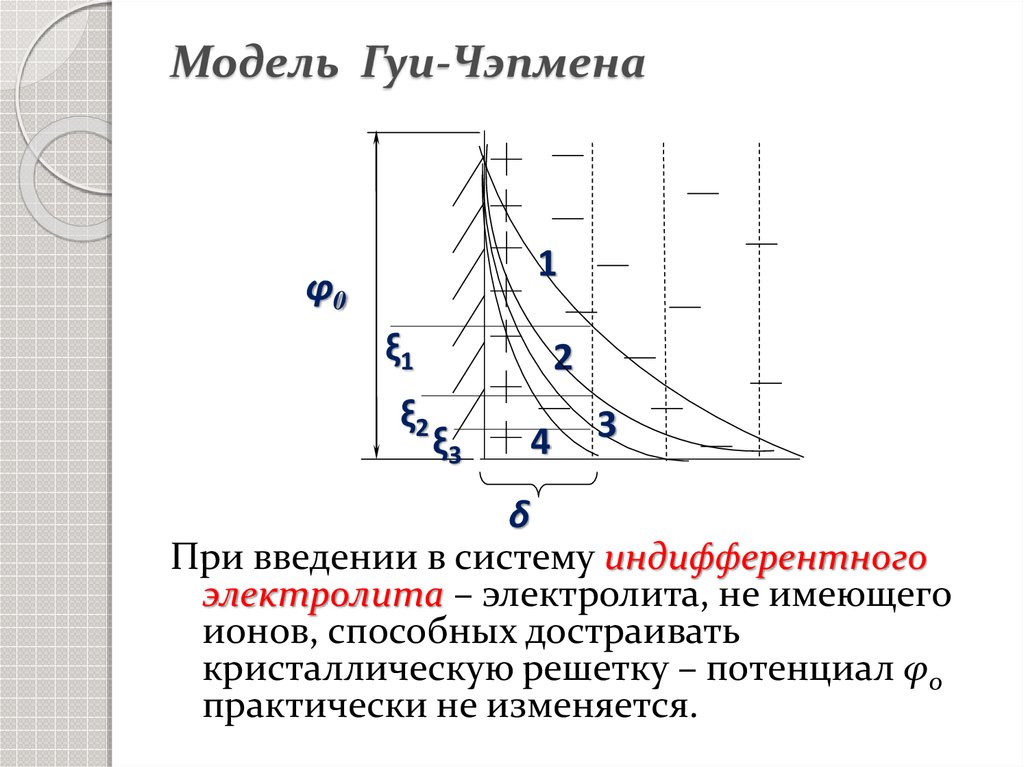
17. Модель Гуи-Чэпмена
Теория ДЭС с диффузным слоемпротивоионов предложена
независимо друг от друга Гуи (1910 г.)
и Чэпменом (1913 г.).
18. Модель Гуи-Чэпмена
Аφ0
ξ
В
δ
х
Рис. Схема ДЭС по Гуи-Чэпмену и
падение в нём потенциала.
19. Модель Гуи-Чэпмена
Величина электрокинетическогопотенциала зависит от:
концентрации
противоионов
индифферентного
электролита
валентности
противоиона
20. Модель Гуи-Чэпмена
1φ0
ξ1
ξ2
2
ξ3
4
3
δ
При введении в систему индифферентного
электролита – электролита, не имеющего
ионов, способных достраивать
кристаллическую решетку – потенциал φ0
практически не изменяется.
21. Модель Гуи-Чэпмена
С увеличением валентностипротивоиона резко уменьшается
ξ-потенциал.
22. Модель Гуи-Чэпмена
Недостатки теории:- не принимается во внимание объем
ионов;
- не объясняет явление перезарядки перемены знака электрокинетического
потенциала при введении в систему
электролита с многовалентными
ионами;
- не объясняет различного действия
противоионов с одной и той же
валентностью и разным радиусом на
ДЭС.
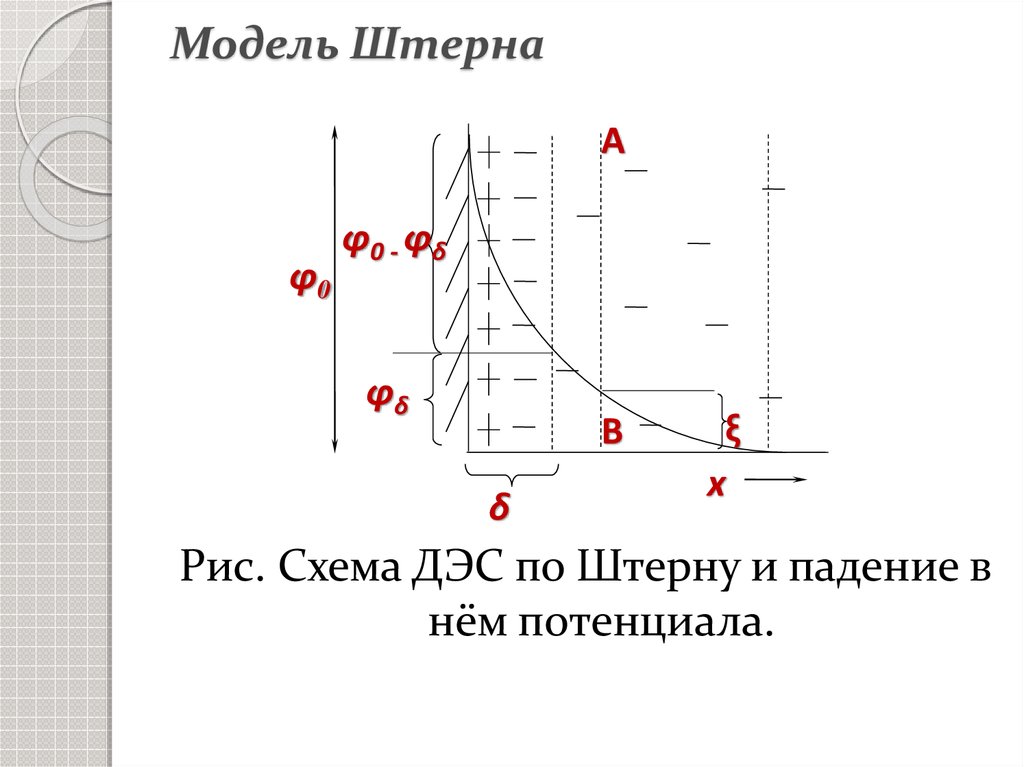
23. Модель Штерна
1924 г. Штерн объединил схемустроения ДЭС Гельмгольца-Перрена
и Гуи-Чэпмена.
24. Модель Штерна
Аφ0
φ 0 - φδ
φδ
В
δ
ξ
х
Рис. Схема ДЭС по Штерну и падение в
нём потенциала.
25. Модель Штерна
Падение потенциала φ0складывается из φδ – падения
потенциала в диффузнном слое - и
разности потенциалов между
обкладками конденсатора φ0 - φδ .
Границы скольжения не ясны, в
общем случае по границе слоя Гуи.
26. Модель Штерна
Зависимость электрокинетическогопотенциала от валентности
противоиона определяется
адсорбционной способностью,
обусловленной их поляризуемостью и
гидратацией.
Перезарядка ДЭС: многовалентные
электроны могут втягиваться в слой
Гельмгольца из-за сильных
электрических взаимодействий.
Потенциал φ0 не изменяется
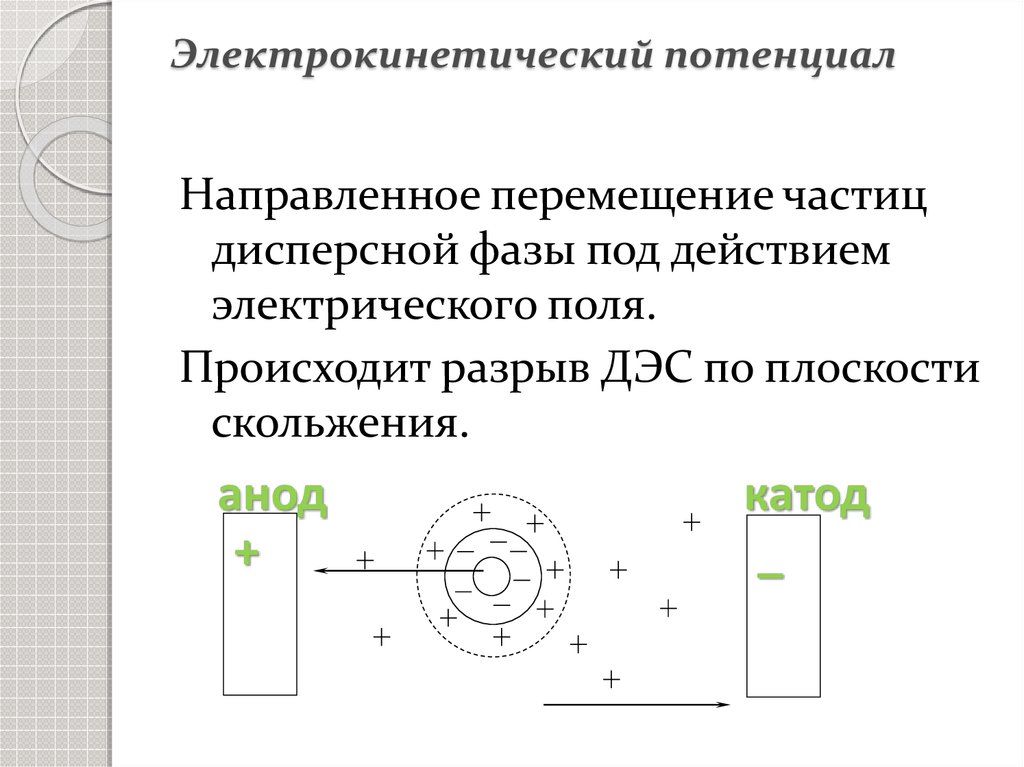
27. Электрокинетический потенциал
Направленное перемещение частицдисперсной фазы под действием
электрического поля.
Происходит разрыв ДЭС по плоскости
скольжения.
анод
+
катод
_
28.
Линейная скорость (U) – движениечастиц относительно мембраны при
электроосмосе и движение частиц
при электрофорезе:
0 E
u
- уравнение ГельмгольцаСмолуховского
где η - вязкость.
u = [м/с].
29.
При движении частиц дисперсной фазыони вынуждены взаимодействовать с
противоионами дисперсионной среды,
что вызывает электрофоретическое
торможение:
u эф
uэф = [ м 2 /с В]
u
E





















 Химия
Химия Электроника
Электроника