Похожие презентации:
Процессы дыхания, брожения, обмена веществ, фотосинтеза, нервная деятельность
1.
Процессыдыхания,
брожения, обмена
веществ,
фотосинтеза,
нервная
деятельность
2.
МОДУЛЬ 1Редокс -процессы (ОВР) и равновесия; редокспотенциалы, его биологическая роль
Основные понятия
•Окислительно-восстановительный процесс /или
редокс- процесс (ОВП) - это процесс, в ходе которого
происходит частичный или полный перенос электронов
от одних атомов или ионов к другим.
•Признаком протекания редокс- процесса служит изменение
степеней окисления.
Î êèñëåí èå
Âî çðàñòàí èå ñòåï åí è î êèñëåí èÿ (î òäà÷à ýëåêòðî í î â)
Âî ññòàí î âëåí èå
Óáû âàí èå ñòåï åí è î êèñëåí èÿ (ï ðèí ÿòèå ýëåêòðî í î â)
3.
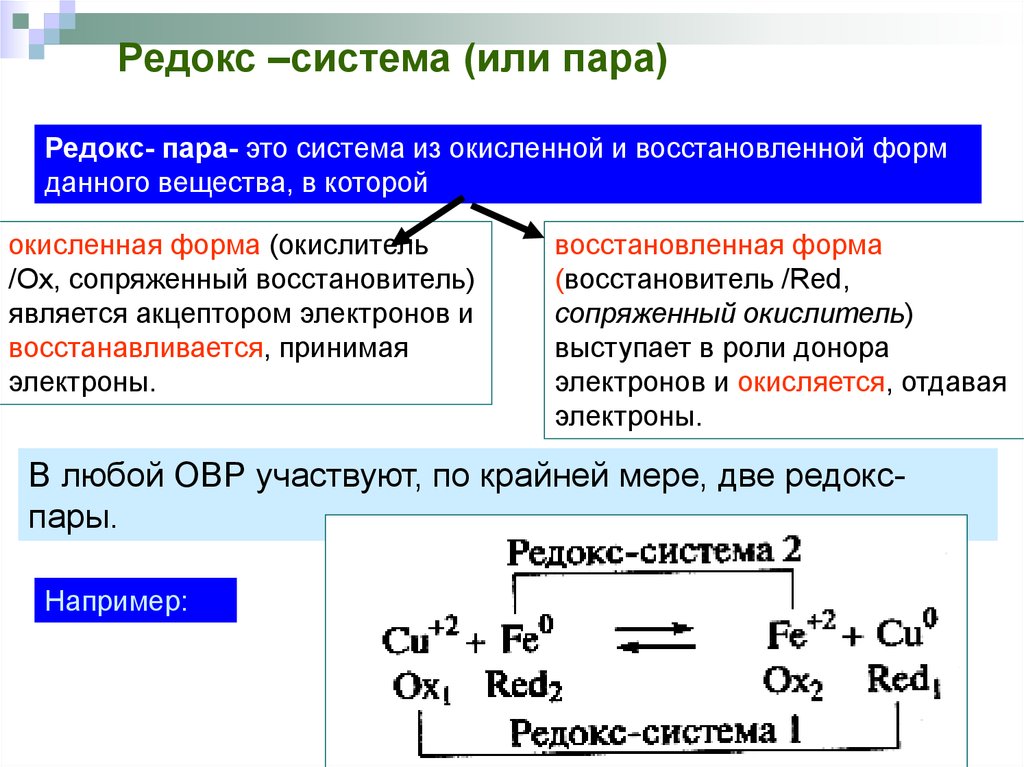
Редокс –система (или пара)Редокс- пара- это система из окисленной и восстановленной форм
данного вещества, в которой
окисленная форма (окислитель
/Ox, сопряженный восстановитель)
является акцептором электронов и
восстанавливается, принимая
электроны.
восстановленная форма
(восстановитель /Red,
сопряженный окислитель)
выступает в роли донора
электронов и окисляется, отдавая
электроны.
В любой ОВР участвуют, по крайней мере, две редокспары.
Например:
4.
Сопряженная окислительно-восстановительная пара•Любая ОВР является совокупностью двух сопряженных процессов –
полуреакций: окисления восстановителя и восстановления окислителя.
В общем виде:
âî ññò àí î âè ò åëü 1 î êèñëèò åëü 2 ñî ï ðÿæ åí í û é ñî ï ðÿæ åí í û é
âî ññò àí î âè ò åëü 1
Например:
î êèñëèò åëü 2
2 FeCl3 SnCl2 2 FeCl2 SnCl4 ,
полуреакция имеет вид:
2 e
Sn 2 Sn 4 î êèñëåí èå
2 e
2 Fe3 2 Fe 2 âî ññò àí î âëåí èå
или в ионной форме:
2
2 Fe 3
Sn
2 Fe 2
î êèñëèò åëü
âî ññò àí î âè ò åëü
ñî ï ðÿæ åí í û é
âî ññò àí î âè ò åëü
Sn 4
ñî ï ðÿæ åí í û é
î êèñëèò åëü
.
Здесь имеются две редокс-пары: Fe3 | Fe 2 и Sn 4 | Sn 2 , каждая из которых
содержит окисленную форму Fe3 , Sn 4 и восстановленную форму Fe 2 , Sn 2 .
5.
Типы редокс- системы1/ Если между окисленной и восстановленной формами
осуществляется только перенос электронов, то редокс- систему
относят к первому типу.
Например:
2/ Если осуществляется перенос как электронов, так и протонов
(точнее ионов гидроксония Н3О+), то редокс-систему относят ко
второму типу.
Например:
6. Примеры окислителей и восстановителей
Окислители и восстановители:S и др. неметаллы, SO2,KNO2,HCl,H2O2
7.
ОВР разделяют на 4-е группы или типы:1. Внутримолекулярные. Реакция внутримолекулярного окислениявосстановления, в которой атомы окислителя и восстановителя входят в
состав одной молекулы. Внутримолекулярные реакции протекает, как
правило, при термическом разложении веществ, содержащих окислитель и
восстановитель.
Например:
2. Межмолекулярные. Реакция межмолекулярного окисления, в которой
атомы окислителя и восстановителя находятся в разных веществах.
Например:
Cr 6 -окислитель; Fe 2 - восстановитель.
8.
3. Реакции диспропорционирования. При реакциях диспропорцирования(перераспределения) атомы одного и того же элемента проявляют
окислительные и восстановительные свойства. Эти свойства могут
проявлять вещества, содержащие элементы в промежуточной степени
окисления.
Например:
4. Реакции контрдиспропорционирования. При реакциях
кондрдиспропорцирования (реакции конмутация) атомы одного элемента в
двух разных степенях окисления принимают одинаковую степень
окисления в продуктах реакции
Например:
9.
Существует два основных способа составления уравненийокислительно-восстановительных реакций: метод электронного баланса
и ионно-электронный метод (или метод полуреакций).
Электронно-ионный баланс (метод полуреакций)
При использовании этого метода:
Степени окисления элементов в составе реагирующих веществ не
определяют.
В полуреакциях записывают ионы или молекулы сопряженных
окисленной и восстановленной форм в том виде, в каком они
существуют в растворе в условиях проведения реакции.
Слабые электролиты, газы и малорастворимые вещества записывают
в молекулярном виде.
При уравнивании масс кислорода и водорода в правой и левой
частях полуреакции можно использовать молекулы H2O, а также
ионы Н+ и ОН-, образующиеся при ионизации воды.
10.
В целом:Баланс атомов O2 в ОВР, протекающих в различных средах:
11. Эквивалент
•Эквивалент окислителя – реальная или условная частица его, которая впроцессе восстановления принимает 1ē.
•Эквивалент восстановителя -реальная или условная частица его,
которая в процессе восстановления отдает 1ē.
•Молярная масса эквивалентов окислителя и
восстановителя численно равна произведению
молярной массы окислителя или восстановителя на
фактор эквивалентности этого окислителя или
восстановителя в данной реакции:
12.
13.
Факторы, влияющие на протекание ОВР-Концентрации реагента
-Температуры реакции (при нагревании и охлаждении )
-Наличие катализатора
-Влияния характера среды (кислая, нейтральная, щелочная ).
Например:
Перманганаты - сильные окислители,
особенно в кислой среде:
Окисленная
форма
Восстановленная
форма
р-р б/ц
осадок
бурый
р-р зел.
цвета
14. Для организма перманганаты ядовиты
Для обезвреживания острых отравлений перманганатомKMnO4 используют восстановитель - 3% раствор
пероксида водорода H2O2 в уксуснокислой среде
СН3СООН:
2КМпО4 + 5Н2О2 + 6СН3СООН =
2(СН3СОО)2Мп + 2СН3СООК + 5О2 + 8Н2О
В результате реакции между ядом и противоядием
образуется нетоксичное или малотоксичное соединение.
•Химические противоядия, как антидоты прямого
действия могут действовать в любом месте –
до проникновения яда в кровь,
при циркуляции яда в крови,
и после фиксации в тканях.
15.
Редокс -потенциал•Редокс –потенциал - это разность потенциалов, возникающая на
границе раздела инертный металл- раствор, содержащий редокссистему.
Редокс- потенциал служит количественной характеристикой
окислительно-восстановительной способности редокс – системы.
•Таким образом, редокс-потенциал можно рассматривать как
частный случай электродного потенциала, возникающего на
межфазной границе, разделяющей два проводника, обладающих
разной проводимостью: электронной (металл) и ионной (раствор
электролита).
16.
Уравнение Нернста-ПетерсаДля расчета редокс-потенциала (единица измерения — вольт (В))
окислительно-восстановительной реакции используют уравнение
Нернста:
17.
Уравнение Нернста-Петерса для биологических систем-значения стандартных рдокс-потенциалов являются справочными;
-измеряются относительно потенциала редокс-системы 2Н+/Н2,
значение стандартного потенциала которой принято равным нулю:
î (2 Í
Í 2) 0
Чем больше значение редокс-потенциала редокс-системы, тем выше
ее окислительная способность, т.е. тем сильнее окислитель и слабее
сопряженный ему восстановитель.
18. Направление самопроизвольного протекания ОВР
•Окислительно-восстановительные потенциалы позволяютколичественно судить об активности окислителя и восстановителя.
Согласно второму закону термодинамики,
самопроизвольно могут протекать только процессы,
сопровождающиеся уменьшением свободной энергии
Гиббса (ΔG < 0).
•Для ОВ реакций ΔG < 0 в том случае, если из более сильных
окислителя и восстановителя образуются более слабые.
•Условием самопроизвольного протекания ОВР является
положительное значение её ЭДС :
(î êèñëèò åëÿ ) (âî ññò àí î âè ò åëÿ )
î
o
r
o
r
Если Δφо > 0, то реакция протекает в прямом направлении в соответствии с
записью уравнения реакции (∆Gо < 0).
Если Δφо < 0, то реакция протекает в обратном направлении согласно
записи уравнения реакции (∆Gо > 0).
Если Δφо = 0, то система находится в состоянии устойчивого химического
равновесия (∆ Gо =0).
19.
20.
Глубина протекания ОВРЧем больше стандартный потенциал реакции (φо), тем
выше ее константа равновесия (Кр) и тем больше
глубина протекания реакции.
Ê ð 10
î n
0 , 059
где n – количеств перераспределенных электронов
21.
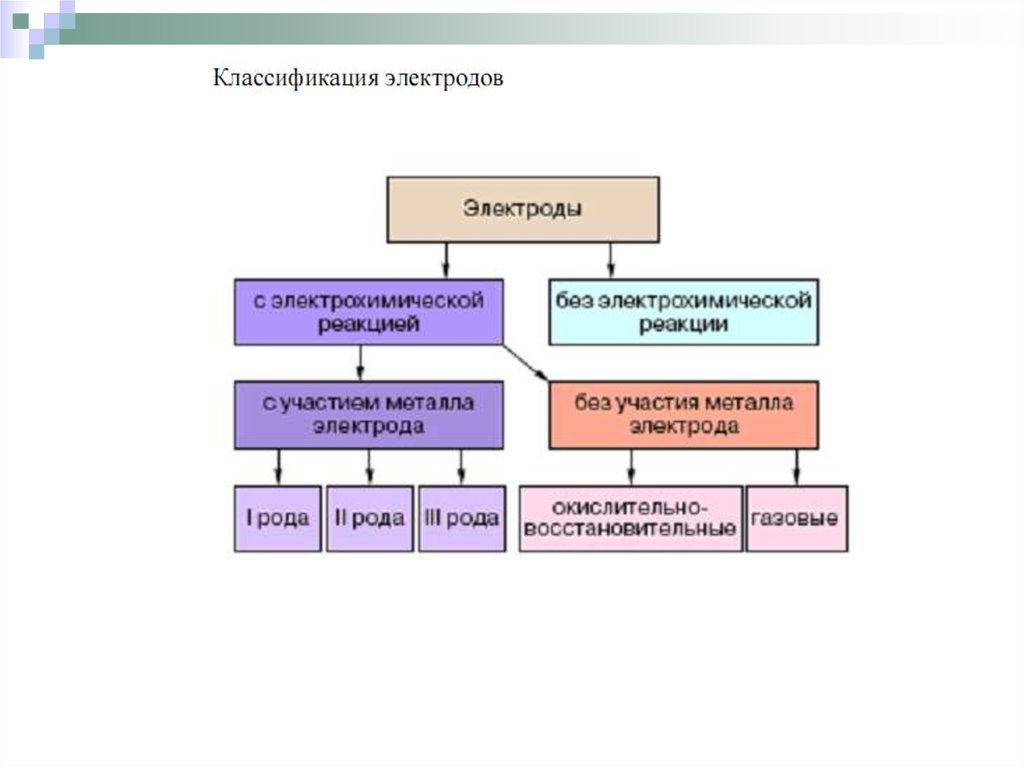
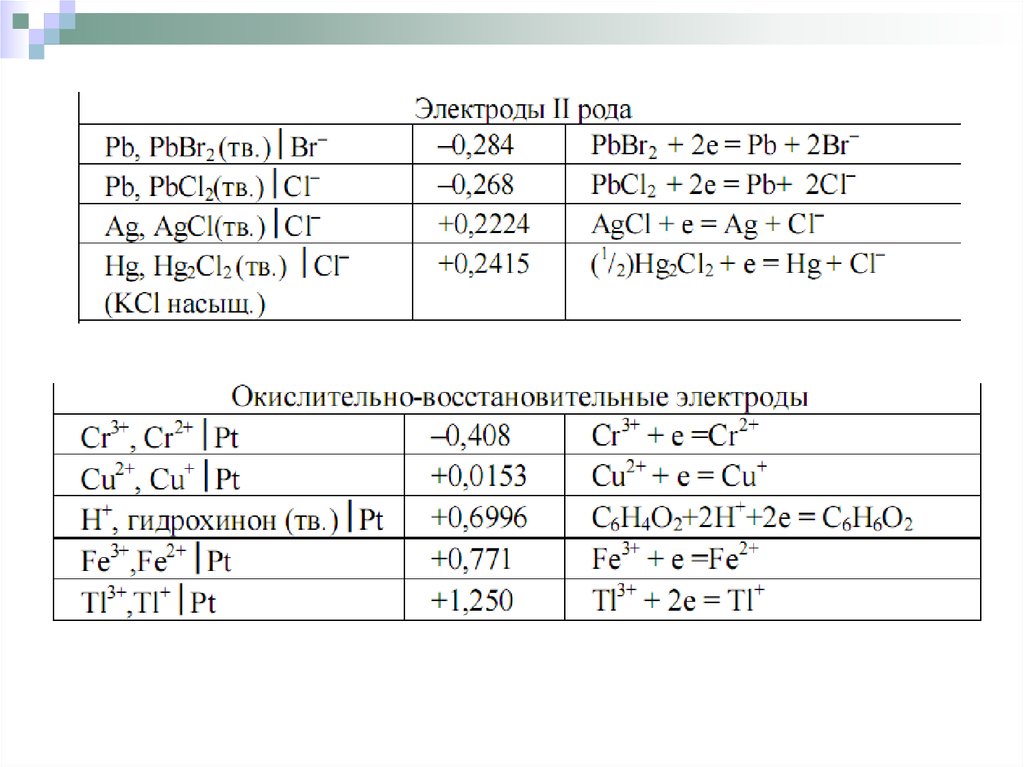
Окислительно-восстановительный электродэто электрод, состоящий из инертного материала(металлические платина, золото, вольфрам, титан, а также
графит), погруженного в водный раствор, в котором
имеются окисленная и восстановленная форма данного
вещества.
В общем виде схему сложного окислительновосстановительного электрода можно записать
следующим образом
восстановление
окисление
Потенциал такого электрода зависит не только от
активности окисленных и восстановленных частиц, но
и активности ионов водорода.
22.
23.
24.
25.
26.
27.
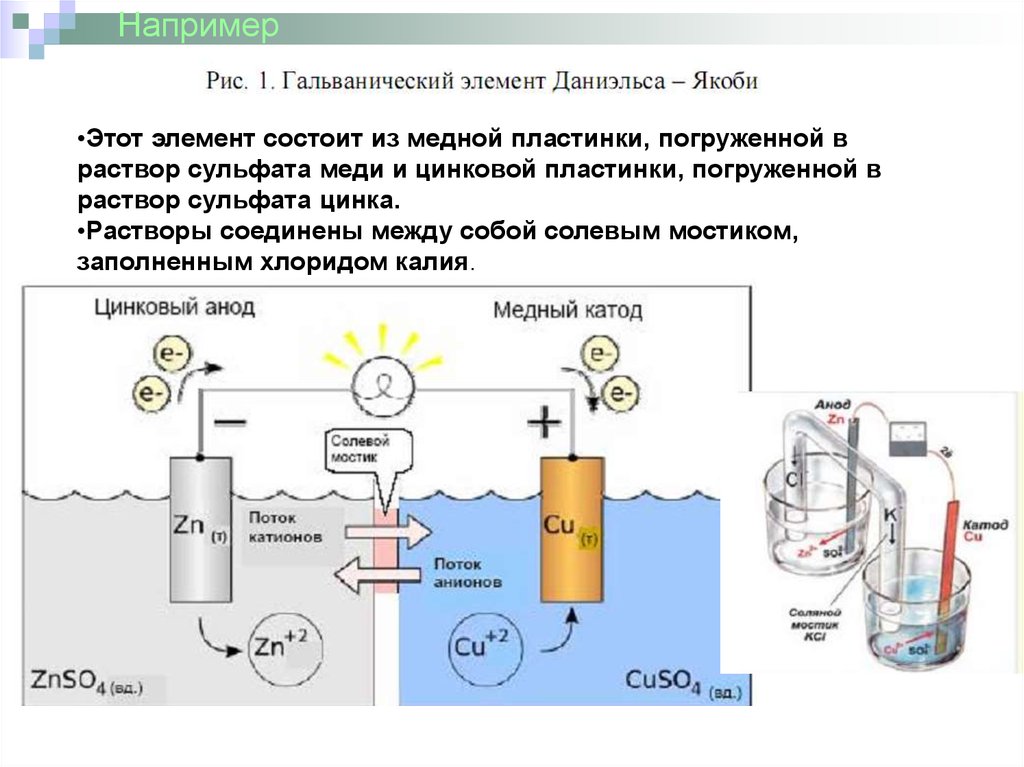
28. Гальванический элемент
29.
Например•Этот элемент состоит из медной пластинки, погруженной в
раствор сульфата меди и цинковой пластинки, погруженной в
раствор сульфата цинка.
•Растворы соединены между собой солевым мостиком,
заполненным хлоридом калия.
30.
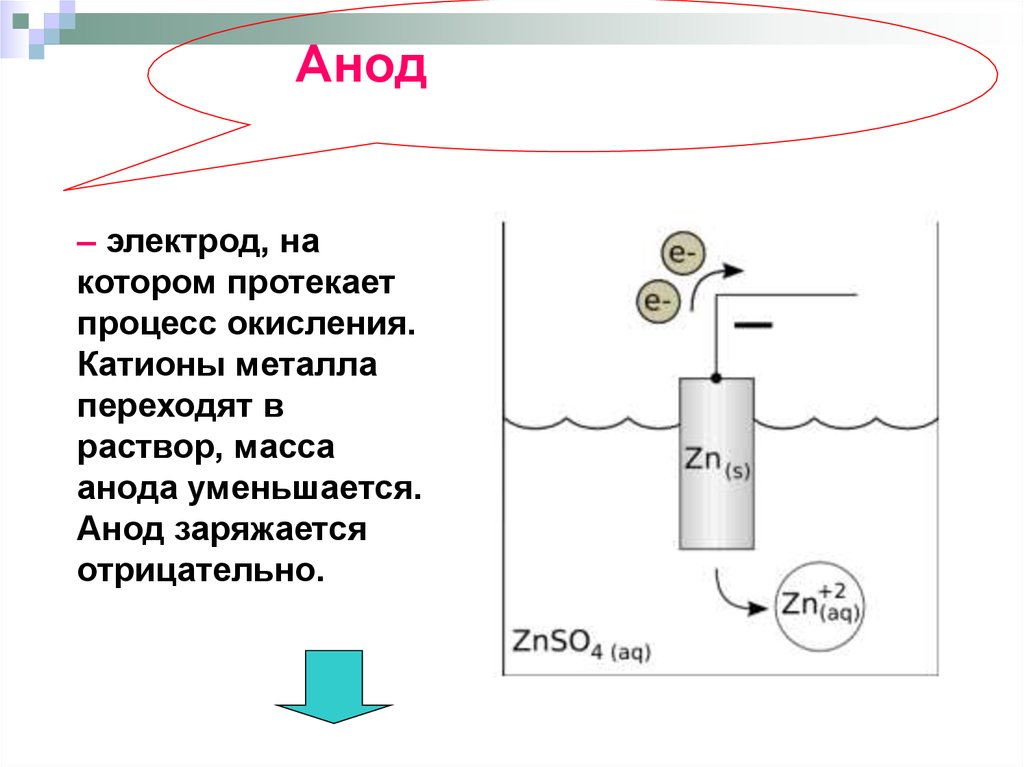
Анод– электрод, на
котором протекает
процесс окисления.
Катионы металла
переходят в
раствор, масса
анода уменьшается.
Анод заряжается
отрицательно.
31.
Катод– электрод, на
котором протекает
процесс
восстановления
катионов металла
из раствора, масса
катода
увеличивается.
Катод заряжается
положительно.
32. Условная запись гальванического элемента
•В схеме гальванического элемента согласноправилам ИЮПАК (Международный союз
теоретической и прикладной химии) слева
записывают анод, справа – катод.
•Границу раздела м/у металлом и раствором
обозначают одной вертикальной чертой.
•Границу раздела двух растворов – двумя
сплошными вертикальными чертами. Компоненты
одной фазы записывают через запятую.
33.
34.
12
3
4
5
35.
36.
37.
38. Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов- это
последовательность, в которой металлырасположены в порядке увеличения их
стандартных электрохимических
потенциалов φо (фи) или Ео, отвечающих
полуреакции восстановления катиона металла
Men+: Men+ + nē → Me.
39.
Ряд напряжений используется на практике для сравнительнойоценки химической активности металлов в реакциях с водными
растворами солей и кислот и для оценки катодных и анодных
процессов при электролизе:
-Металлы, стоящие левее, являются более сильными
восстановителями, чем металлы, расположенные
правее: они вытесняют последние из растворов солей.
Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu
возможно только в прямом направлении.
-Металлы, стоящие в ряду левее водорода, вытесняют водород
при взаимодействии с водными растворами кислотнеокислителей; наиболее активные металлы (до алюминия
включительно) — и при взаимодействии с водой.
-.
40.
- Металлы, стоящие в ряду правее водорода, с водными растворами кислотнеокислителей при обычных условиях не взаимодействуют-При электролизе металлы, стоящие правее водорода, выделяются на катоде;
восстановление металлов умеренной активности сопровождается выделением
водорода; наиболее активные металлы (до алюминия) невозможно при
обычных условиях выделить из водных растворов солей.
Электрохимический ряд напряжений металлов
Убывание восстановительной активности
Н
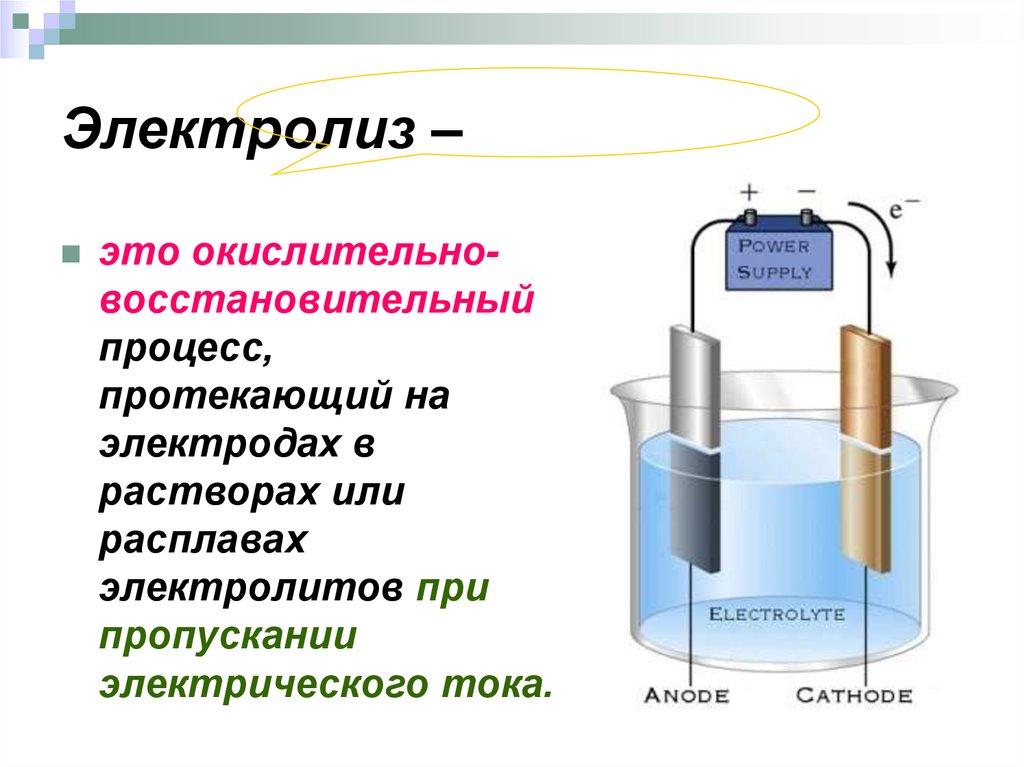
41. Электролиз –
это окислительновосстановительныйпроцесс,
протекающий на
электродах в
растворах или
расплавах
электролитов при
пропускании
электрического тока.
42. Сущность электролиза
заключается в том, что за счет электрическойэнергии осуществляется химическая реакция,
которая не может протекать самопроизвольно.
Протекание первичных анодных и катодных процессов подчиняется
законам, установленным английским ученым М Фарадеем (1834).
43.
Законы Фарадея44.
Второй закон Фарадея (формула без эквивалента)45.
46.
Электролиз в расплавахНа катоде происходит процесс восстановления
• В расплавах катионы металла
восстанавливаются до свободного
металла:
Мn+ + nē = М0
47.
• В расплавах анионы бескислородных кислот (кромефторидов) окисляются до соответствующего
простого вещества, например:
2Cl– – 2ē = Cl20
• Кислородсодержащие анионы выделяют кислород и
превращаются в один из оксидов:
SO42– – 2ē = SO20 + O20.
48.
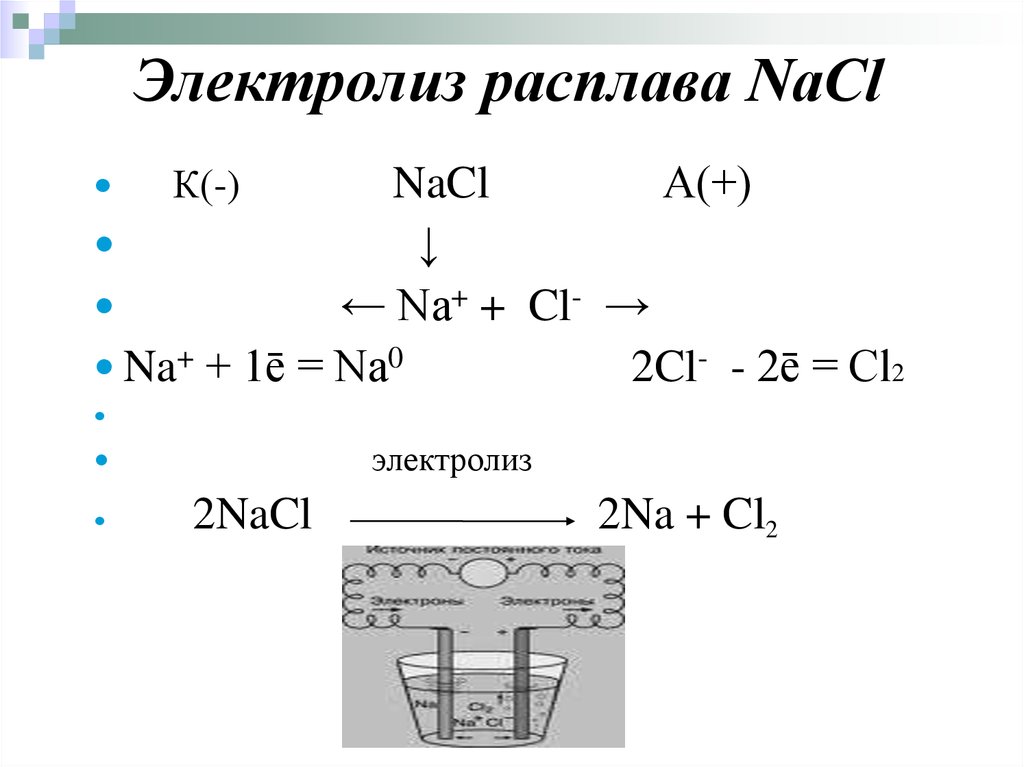
Электролиз расплава NaClNaCl
А(+)
↓
← Na+ + Cl- →
Na+ + 1ē = Na0
2Cl- - 2ē = Cl2
К(-)
электролиз
2NaCl
2Na + Cl2
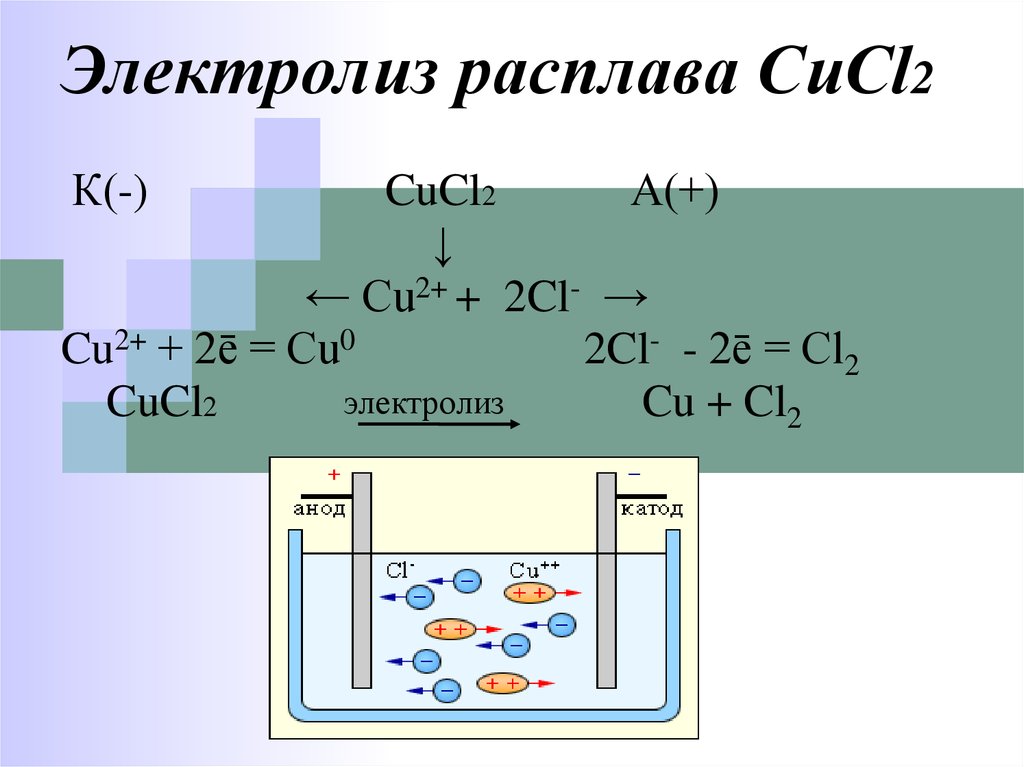
49. Электролиз расплава CuCl2
К(-)CuCl2
А(+)
↓
← Cu2+ + 2Cl- →
Cu2+ + 2ē = Cu0
2Cl- - 2ē = Cl2
электролиз
CuCl2
Cu + Cl2
50.
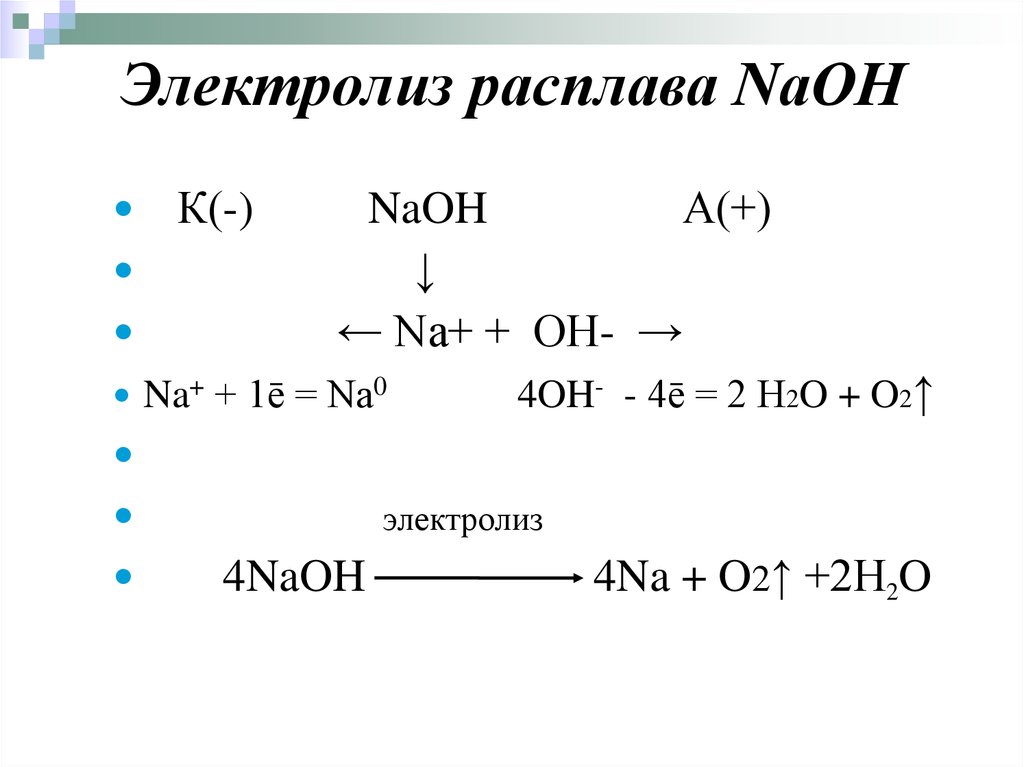
Электролиз расплава NaOHК(-)
NaOH
А(+)
↓
← Na+ + OH- →
Na+ + 1ē = Na0
4OH- - 4ē = 2 H2O + O2↑
электролиз
4NaOH
4Na + O2↑ +2H2O
51.
Электролиз в растворах1)процесс на катоде
• В растворах процесс на катоде не зависит от
материала катода, а зависит от активности
восстанавливаемого металла.
а) Если металл расположен в ряду напряжений от
Li до Al включительно, то на катоде идет
процесс восстановления воды:
2Н2О + 2ē = H20 + 2OH–
52.
б) Если металл расположен в ряду напряжений между Alи H2 , то на катоде идут одновременно процессы
восстановления воды и катионов металла:
2Н2О + 2ē = H20 + 2OH–
Мn+ + nē = М0
в) Если металл расположен в ряду напряжений после Н2,
то на катоде идет процесс восстановления катионов
металла:
Мn+ + nē = М0
При электролизе растворов кислот идет процесс
восстановления ионов водорода:
2Н+ + 2ē = H20
53.
Процесс на анодеВ растворах процесс на аноде зависит от
материала
анода и от природы аниона.
Аноды могут быть двух видов
– растворимые (железо, медь, цинк, серебро и все
металлы, которые окисляются в процессе
электролиза)
- и нерастворимые, или инертные (уголь, графит,
платина, золото)
а) Если анод растворимый, то независимо от природы
аниона всегда идет окисление металла анода, например:
Cu0 – 2ē = Cu2+
54.
Процесс на анодеб) Если анод инертный, то в случае бескислородных
анионов (кроме фторидов) идет окисление анионов:
2Cl– – 2ē = Cl20
В случае кислородсодержащих анионов и фторидов идет
процесс окисления воды, анион при этом не окисляется и
остается в растворе:
2H2O – 4ē = O20 + 4H+
При электролизе растворов щелочей идет окисление
гидроксид-ионов:
4OH– – 4ē = O20 + 2H2O
55.
Электролиз раствора NaClна инертном аноде
NaCl
А(+)
↓
← Na+ + Cl- →
2Н2О + 2ē = H2 + 2OH2Cl- - 2ē = Cl2↑
К(-)
электролиз
2NaCl + 2H2O
H2 + Cl2 +2NaOH
56.
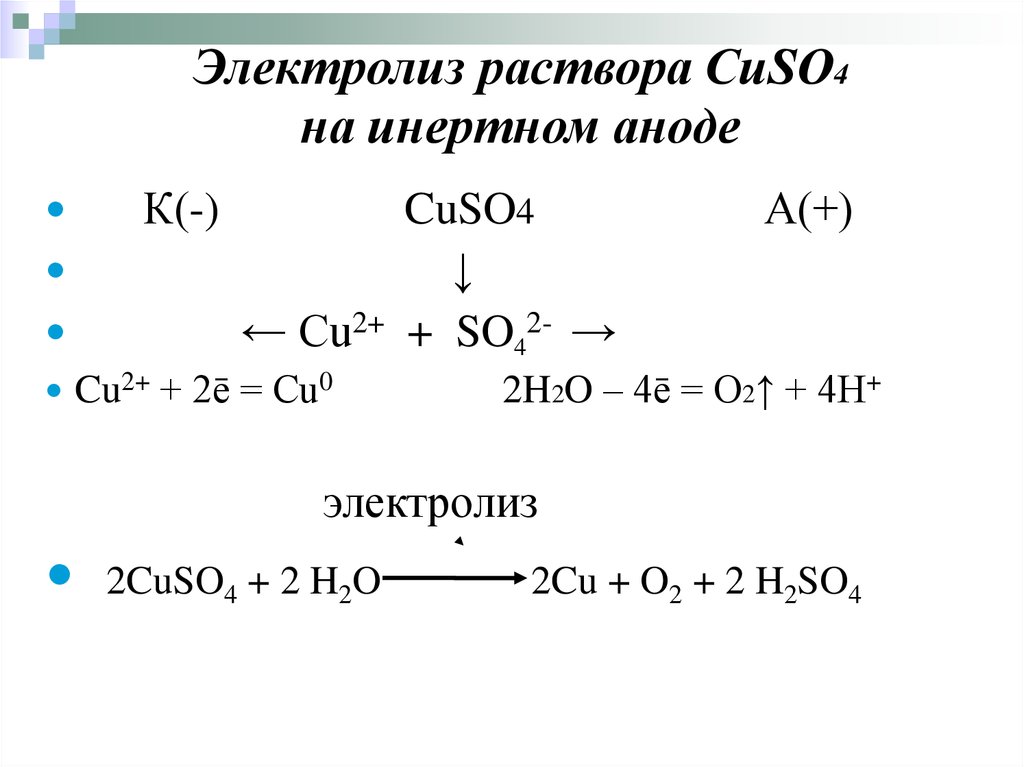
Электролиз раствора CuSO4на инертном аноде
К(-)
← Cu2+
Cu2+ + 2ē = Cu0
CuSO4
↓
+ SO42- →
А(+)
2H2O – 4ē = O2↑ + 4H+
электролиз
2CuSO4 + 2 H2O
2Cu + O2 + 2 H2SO4
57.
Электролиз раствора NaClна растворимом аноде
К(-)
NaCl
↓
← Na+ + Cl- →
Cu2+ + 2ē = Cu0
(т.к. Cu2+ в ряду напряжений
стоят после H+)
А(+)
(Cu)
Cu0 – 2ē =Cu2+
Происходит переход ионов меди с анода на
катод. Концентрация NaCl в растворе не
меняется.
58.
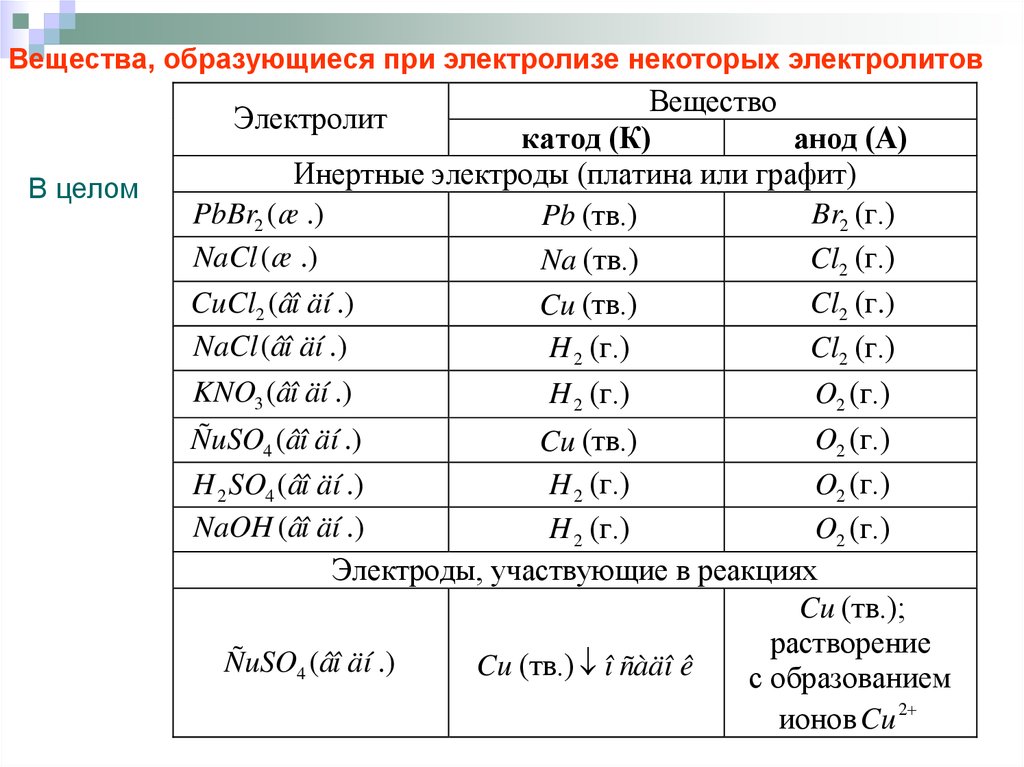
Вещества, образующиеся при электролизе некоторых электролитовВещество
катод (К)
анод (А)
Инертные электроды (платина или графит)
PbBr2 ( æ .)
Br2 (г.)
Pb (тв.)
NaCl (æ .)
Cl2 (г.)
Na (тв.)
CuCl2 (âî äí .)
Cl2 (г.)
Cu (тв.)
NaCl (âî äí .)
H 2 (г.)
Cl2 (г.)
KNO3 (âî äí .)
H 2 (г.)
O2 (г.)
Электролит
В целом
ÑuSO4 (âî äí .)
O2 (г.)
Cu (тв.)
H 2 SO4 (âî äí .)
H 2 (г.)
O2 (г.)
NaOH (âî äí .)
H 2 (г.)
O2 (г.)
Электроды, участвующие в реакциях
Cu (тв.);
растворение
ÑuSO4 (âî äí .)
Cu (тв.) î ñàäî ê
с образованием
ионов Cu 2
59.
Коррозией называется процесс разрушенияметаллов вследствие химического или
электрохимического взаимодействия их с внешней
средой.
Химическая коррозия
развивается в агрессивных средах, не проводящих
электрического тока, например, газах при высоких
температурах, Так, железо при нагревании
соединяется с кислородом воздуха с образованием
оксидов (окалины)
наблюдается в зубопротезировании в основном при
изготовлении и починке протезов.
В условиях эксплуатации протезов может
развиваться электрохимическая коррозия















































 Химия
Химия








