Похожие презентации:
Растворы жидкие, твердые, газообразные
1. Растворы
2.
• Растворами называются гомогенныесистемы переменного состава,
состоящие из двух или более
компонентов.
• Раствор состоит из растворенного
вещества и растворителя.
• Растворитель вода – водный раствор
3.
РастворыЖидкие
Твердые
Газообразные
4.
По растворимости в воде веществаделятся на 3 группы:
• Хорошо растворимые («р») более 10г
вещества в 1 л воды при температуре
20оС (сахар в воде);
• Малорастворимые – «м» 0,01 – 10г на
1л воды (сульфат кальция – гипс в
воде);
• Практически нерастворимые – «н»
менее 0,01 г.
5.
Растворы бывают:• Разбавленные
• Концентрированные
• Насыщенные
• Пересыщенные
6. Концентрация
• Концентрацией раствора называетсяколичество растворенного вещества,
содержащегося в определенном
количестве раствора или растворителя.
7. Способы выражения концентрации растворов
Массовая концентрация, массовая доля– отношение массы растворенного
вещества m(р.в.) к массе всего раствора
m(р-ра)
m( р.в.)
100 %
m( р ра)
8.
Молярная концентрация, молярность СМ(М) – число молей растворенного
вещества nр.в-ва, содержащегося в 1 л
раствора Vр-ра. [моль/л]
CM
n
V
р.в.
р ра
m р.в.
M р.в. V р ра
9.
0,1М – децимолярный;0,01М – сантимолярный;
0,02М – двусантимолярный;
0,001М – милимолярный.
Пример. 1,5М раствор H2SO4 или
СМ = 1,5 моль/л H2SO4
В 1 л раствора - 1,5 моля H2SO4
или
в 1 л раствора содержится
1,5 ∙ 98 = 147 г,
где 98 – молярная масса H2SO4
10.
В общем виде:в 1 л раствора содержится См ∙ М
в заданном V раствора содержится Х г
11.
Эквивалентная концентрация,нормальность CН число эквивалентов
растворенного вещества nэ,
содержащихся в 1 л раствора Vр-ра
[моль/л]
Cн
n
э
V
р ра
m р.в.
M р.в. V р ра
э
12.
0,1н – децинормальный;0,01н – сантинормальный;
0,001н – милинормальный.
Если в растворе содержится
1 эквивалент вещества,
то это 1Н раствор.
Один эквивалент весит эквивалентную
массу.
13.
Пример. 0,75н раствор H2SO4 илиCН = 0,75 моль/л H2SO4
В 1л раствора - 0,75 моль H2SO4
или
в 1 л раствора содержится
0,75 ∙ 49 = 36,75 г,
где 49 – эквивалентная масса H2SO4
В общем виде:
в 1 л раствора содержится СН ∙ МЭ
в заданном V раствора содержится Х г
14.
Моляльная концентрация, моляльностьCm – число молей растворенного
вещества nр.в., приходящихся на 1 кг
растворителя mр-ля. [моль/кг]
Cm
m р .в .
М р .в . m р л я
Пример. 2m раствор H2SO4
2 моля приходятся на1000 г растворителя
(т.е. воды)
Cm∙Мр.в.приходятся на1000 г растворителя
15.
Титр Т – показывает количество граммоврастворенного вещества mр.в.,
содержащихся в 1 мл раствора Vр-ра.
[г/мл]
Сн М э
Т
1000
Сн – нормальная концентрация
Мэ – молярная масса эквивалента
растворенного вещества
16.
• Если растворы имеют разнуюнормальность, то применяют:
Закон эквивалентов для растворов:
Объемы реагирующих веществ
обратно пропорциональны их
нормальностям.
V1Cн1 = V2Cн2
17. НЕФТЬ КАК ДИСПЕРСНАЯ СИСТЕМА
18.
Дисперсные системы — этомикрогетерогенные системы с сильно
развитой внутренней поверхностью раздела
между фазами.
Дисперсная
система
Дисперсионная
среда
Дисперсная
фаза
19.
Дисперсионная среда - непрерывнаяфаза (тело), в объёме которой распределена
другая (дисперсная) фаза в виде мелких
твёрдых частиц, капелек жидкости или
пузырьков газа.
Дисперсная фаза - совокупность мелких
однородных твёрдых частиц, капелек
жидкости или пузырьков газа, равномерно
распределённых в окружающей
(дисперсионной) среде.
20.
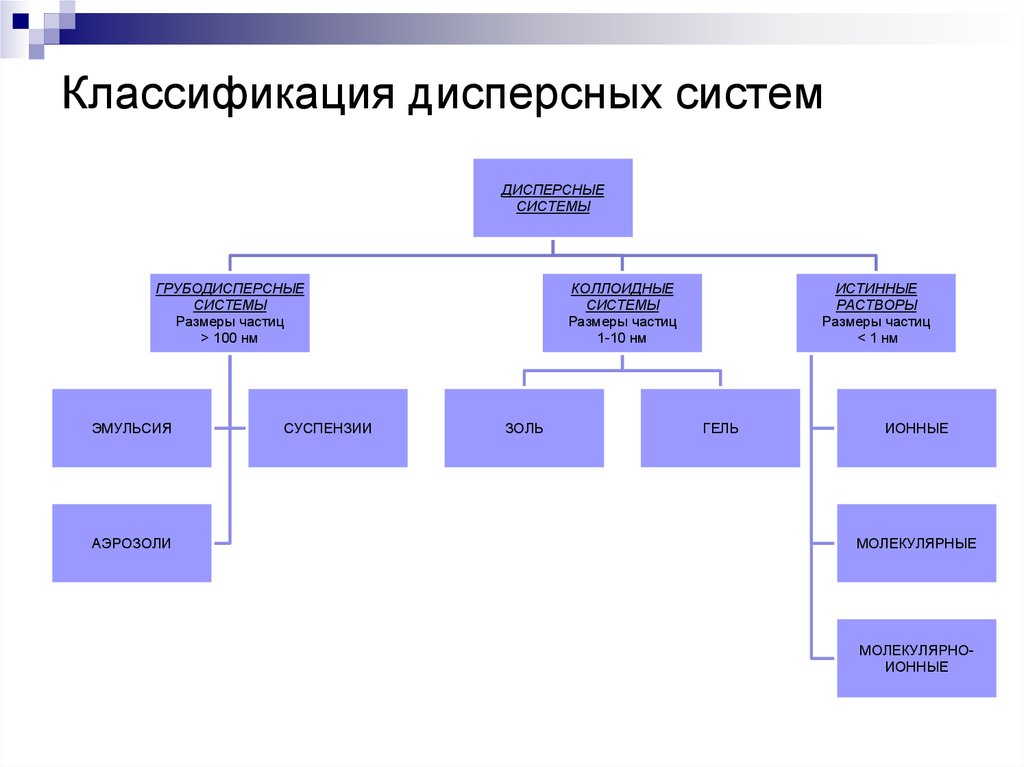
21. Классификация дисперсных систем
ДИСПЕРСНЫЕСИСТЕМЫ
ГРУБОДИСПЕРСНЫЕ
СИСТЕМЫ
Размеры частиц
> 100 нм
ЭМУЛЬСИЯ
АЭРОЗОЛИ
СУСПЕНЗИИ
КОЛЛОИДНЫЕ
СИСТЕМЫ
Размеры частиц
1-10 нм
ЗОЛЬ
ИСТИННЫЕ
РАСТВОРЫ
Размеры частиц
< 1 нм
ГЕЛЬ
ИОННЫЕ
МОЛЕКУЛЯРНЫЕ
МОЛЕКУЛЯРНОИОННЫЕ
22. Грубодисперсные системы (взвеси)
Эмульсии — это дисперсные системы, в которых идисперсная фаза и дисперсионная среда являются жидкостями,
взаимно не смешивающимися. Из воды и масла можно
приготовить эмульсию длительным встряхиванием смеси.
Примером эмульсии является молоко, в котором мелкие шарики
жира плавают в жидкости.
Суспензии — это дисперсные системы, в которых
дисперсной фазой является твердое вещество, а дисперсионной
средой — жидкость, — причем твердое вещество практически
нерастворимо в жидкости. Чтобы приготовить суспензию, надо
вещество измельчить до тонкого порошка, высыпать в жидкость,
в которой вещество не растворяется, и хорошо взболтать
(например, взбалтывание глины в воде). Со временем частички
выпадут на дно сосуда. Очевидно, чем меньше частички, тем
дольше будет сохраняться суспензия.
Аэрозоли - взвеси в газе мелких частиц жидкостей
или твёрдых веществ.
23. Коллоидные растворы
Золи получают дисперсионными и конденсационными методами.Диспергирование чаще всего производят при помощи особых
“коллоидных мельниц”. При конденсационном методе коллоидные
частицы образуются за счет объединения атомов или молекул в
агрегаты. При протекании многих химических реакций также
происходит конденсация и образуются высокодисперсные системы
(выпадение осадков, протекание гидролиза, окислительновосстановительные реакции и т.д.) - кровь, лимфа…
Гели. При определенных условиях коагуляция (явление
слипания коллоидных частиц и выпадения их в осадок)
золей приводит к образованию студенистой массы,
называемой гелем. В этом случае вся масса коллоидных
частиц, связывая растворитель, переходит в своеобразное
полужидкое-полутвердое состояние. - желатин, желе,
мармелад.
24. Истинные растворы
Молекулярные – это водные растворынеэлектролитов – органических веществ (спирта,
глюкозы, сахарозы и т.д.);
Ионные – это растворы сильных электролитов
(щелочей, солей, кислот – NaOH, K2SO4,HNO3,
HClO4);
Молекулярно – ионные – это растворы слабых
электролитов (азотистой, сероводородной кислот
и др.).
25. Классификация
по агрегатному состояниюдисперсионной среды и дисперсной
фазы:
Твердое
вещество
Газ
Жидкость
26. Дисперсная среда: твердое вещество
Дисперсная фаза – газ:Почва, текстильные ткани,
кирпич и керамика, пористый
шоколад, порошки.
Дисперсная фаза – жидкость:
Влажная почва, медицинские
и косметические средства.
Дисперсная фаза – твердое
вещество:
Горные породы, цветные
стекла, некоторые сплавы.
27. Дисперсная среда: газ
Дисперсная фаза – газ:Всегда гомогенная смесь
(воздух, природный газ)
Дисперсная фаза – жидкость:
Туман, попутный газ с
капельками нефти, аэрозоли.
Дисперсная фаза – твердое
вещество:
Пыли в воздухе, дымы,
смог, песчаные бури.
28. Дисперсная среда: жидкость
Дисперсная фаза – газ:Шипучие напитки, пены.
Дисперсная фаза – жидкость:
Эмульсии: нефть, крем,
молоко; жидкие среды
организма, жидкое содержимое
клеток.
Дисперсная фаза – твердое
вещество:
Золи, гели, пасты.
Строительные растворы.
29. Значение дисперсных систем
Для химии наибольшее значение имеютдисперсные системы, в которых средой
является вода и жидкие растворы.
Природная вода всегда содержит растворённые
вещества. Природные водные растворы
участвуют в процессах почвообразования и
снабжают растения питательными
веществами. Сложные процессы
жизнедеятельности, происходящие в
организмах человека и животных, также
протекают в растворах. Многие
технологические процессы в химической и
других отраслях промышленности, например
получение кислот, металлов, бумаги, соды,
удобрений протекают в растворах.
30.
Нефть - это сложная многокомпонентная смесь, которая взависимости от внешних условий проявляет свойства
молекулярного раствора или дисперсной системы
31.
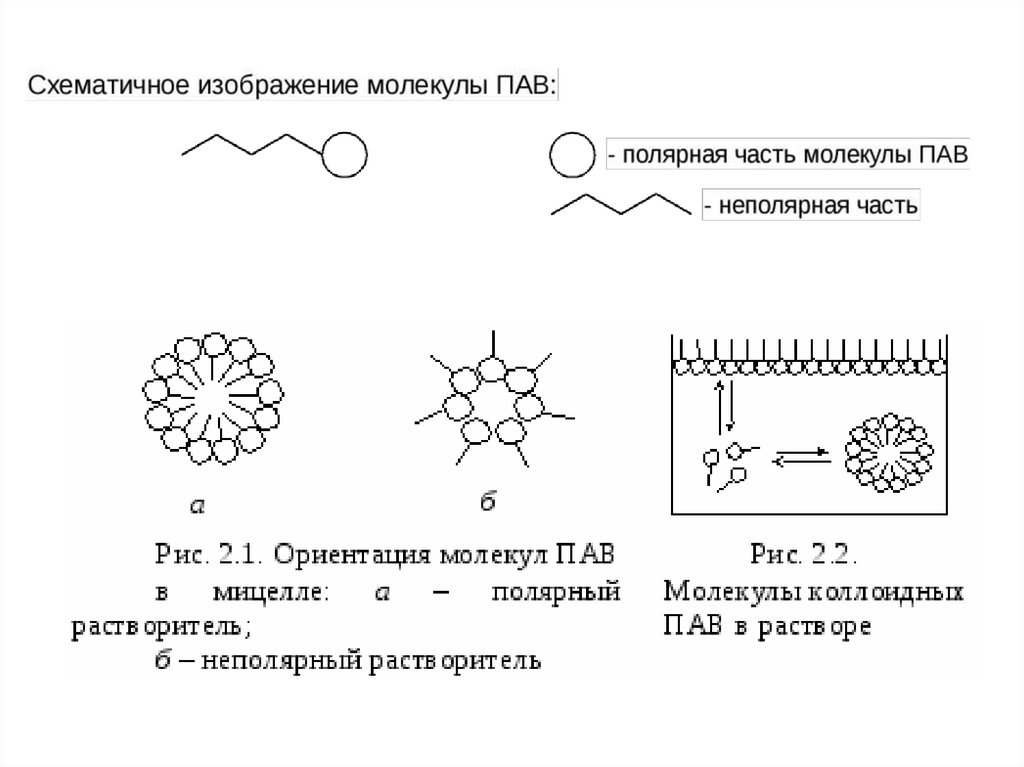
Особую группу коллоидных частиц образуют молекулы поверхностноактивных веществ (ПАВ). Они отличаются способностью переходить израстворов на поверхность жидкостей и твердых тел или
концентрироваться на поверхности раздела «раствор –
несмешивающаяся с ним жидкость или нерастворимое твердое тело».
Поверхностная активность зависит от строения молекул ПАВ, которые
состоят из двух частей: полярной, растворимой в полярной жидкости
(вода ), и неполярной, растворимой в неполярных жидкостях
(углеводороды ).
Примерами ПАВ могут служить жирные кислоты, спирты, мыла.
Схематически полярную группу молекул изображают кружком, а
неполярную – палочкой.
На поверхности раздела полярной и неполярной жидкостей (такие
жидкости не смешиваются), например воды и масла, молекулы ПАВ
располагаются таким образом, что полярная часть находится в первой
жидкости, а неполярная – во второй. Этим обеспечивается их более
высокая «растворимость», чем в любой из жидкостей в отдельности. Это
и есть одна из причин поверхностной активности ПАВ.
32.
33.
Увеличение добычи нефти идет как путем освоения новых месторождений, таки путем интенсификации добычи в эксплуатируемых месторождениях. Второй
путь экономически выгоднее, хотя и сложнее технически. Достаточно сказать,
что по ряду причин нефтеотдача нефтяного пласта редко превышает 50% от
потенциала. Интенсификация добычи нефти опирается на углубленное
изучение закономерностей ее движения в нефтяном пласте. Нефть при
добыче проходит через дисперсные и пористые породы. Сечение пор лежит в
пределах долей мм, причем они могут быть заполнены водой. Движение
нефти через эти поры зависит от смачиваемости нефтью стенок горных
пород, образования адсорбционных слоев и пленок нефти, а также от
реологических свойств нефти в этих условиях.
Смачивание – процесс взаимодействия жидкости с поверхностью твердого
тела. Он характеризуется краевым углом смачивания, теплотой смачивания
и адгезией, т.е. силой прилипания капли к твердому телу. Краевой угол
смачивания – это угол между касательной к поверхности капли, лежащей на
поверхности твердого тела и плоскостью этого тела.
34.
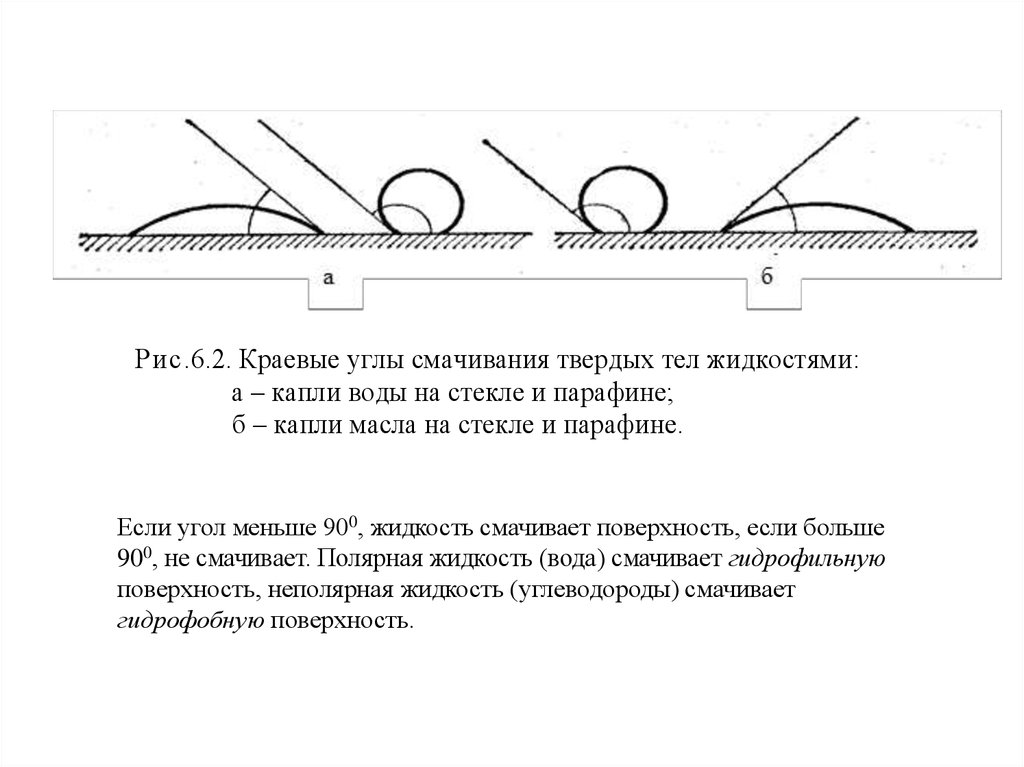
Рис.6.2. Краевые углы смачивания твердых тел жидкостями:а – капли воды на стекле и парафине;
б – капли масла на стекле и парафине.
Если угол меньше 900, жидкость смачивает поверхность, если больше
900, не смачивает. Полярная жидкость (вода) смачивает гидрофильную
поверхность, неполярная жидкость (углеводороды) смачивает
гидрофобную поверхность.
35.
Минералы, образующие нефтяные пласты и слои горных пород, черезкоторые нефть подтекает к скважине, гидрофильны. Это препятствует
движению нефти и особенно вытеснению ею грунтовой воды. Но, с другой
стороны, гидрофильность горных пород облегчает вытеснение нефти
закачиваемой под нее водой.
































 Химия
Химия








