Похожие презентации:
Неравновесные электрохимические методы. Вольтамперометрия
1. Дисциплина: Методы геохимического опробования и анализа
Тема:Неравновесные электрохимические
методы.
Вольтамперометрия
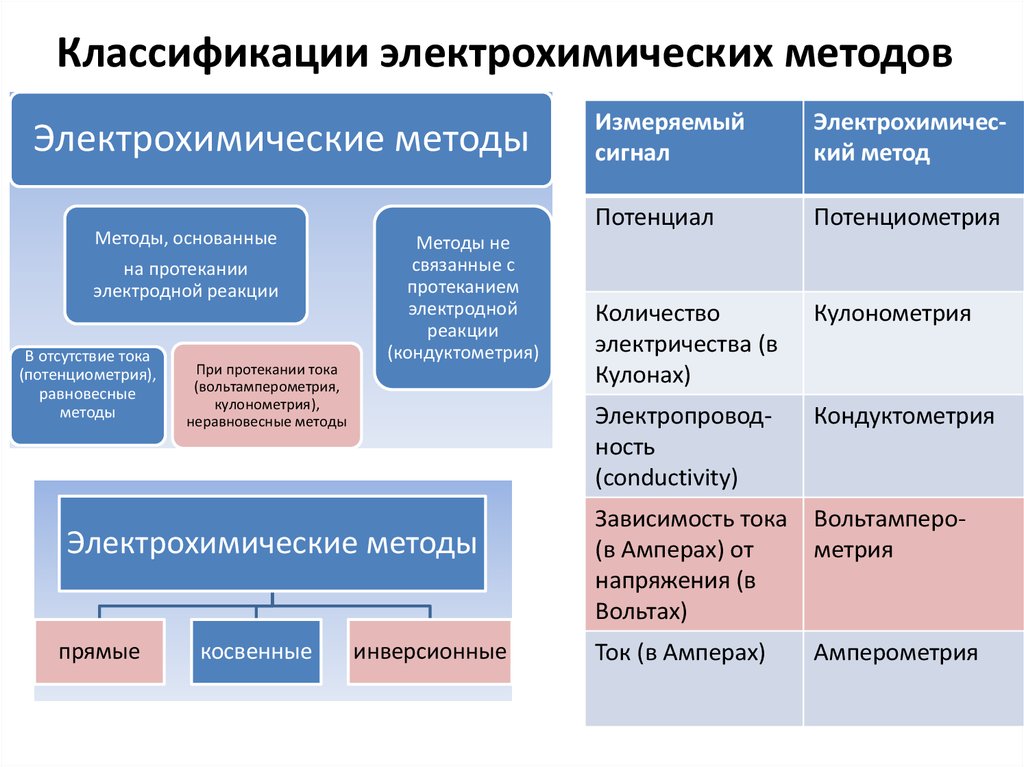
2. Классификации электрохимических методов
Электрохимические методыМетоды, основанные
на протекании
электродной реакции
В отсутствие тока
(потенциометрия),
равновесные
методы
При протекании тока
(вольтамперометрия,
кулонометрия),
неравновесные методы
Методы не
связанные с
протеканием
электродной
реакции
(кондуктометрия)
Электрохимические методы
прямые
косвенные
инверсионные
Измеряемый
сигнал
Электрохимический метод
Потенциал
Потенциометрия
Количество
электричества (в
Кулонах)
Кулонометрия
Электропроводность
(conductivity)
Кондуктометрия
Зависимость тока
(в Амперах) от
напряжения (в
Вольтах)
Вольтамперометрия
Ток (в Амперах)
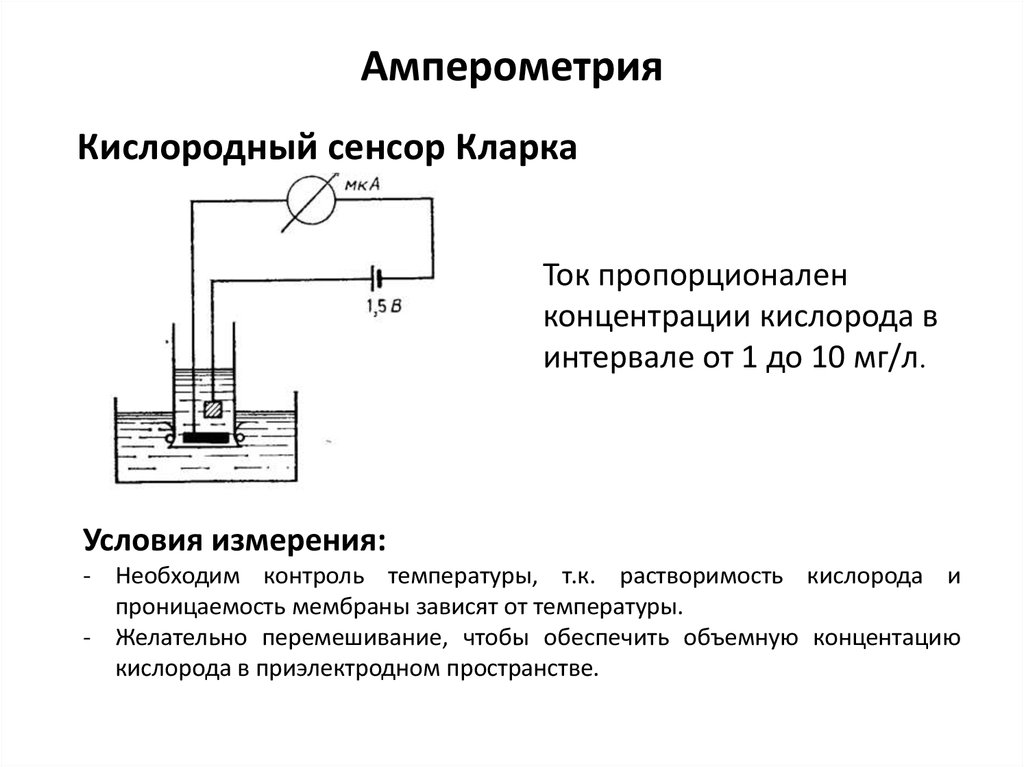
Амперометрия
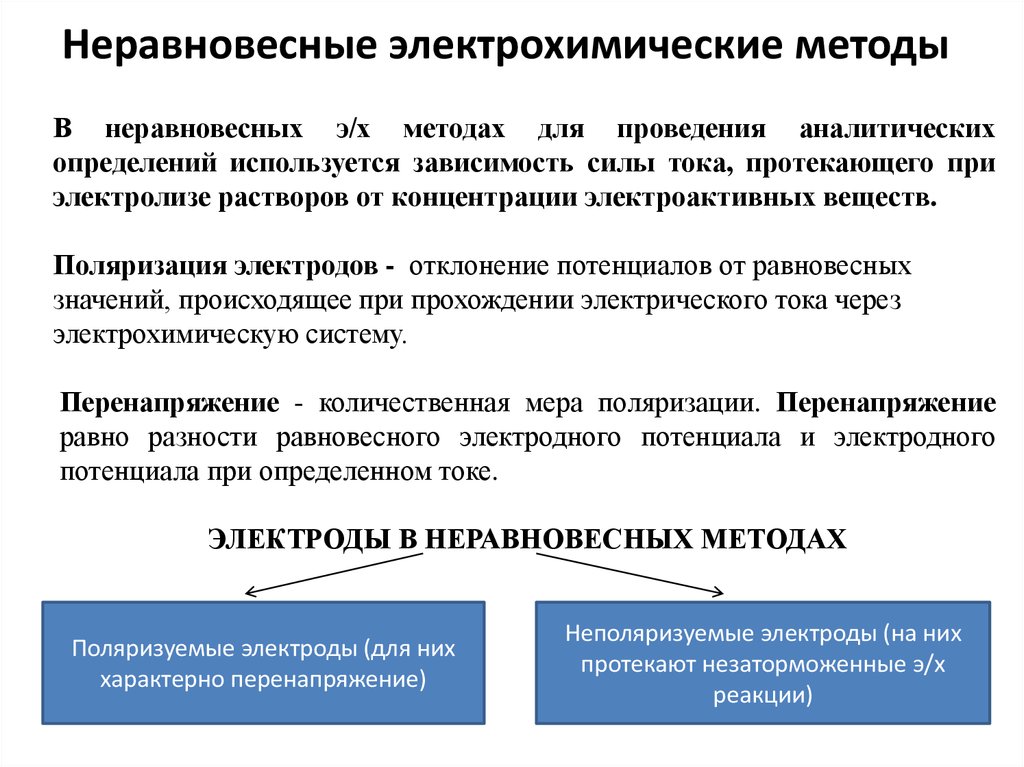
3. Неравновесные электрохимические методы
В неравновесных э/х методах для проведения аналитическихопределений используется зависимость силы тока, протекающего при
электролизе растворов от концентрации электроактивных веществ.
Поляризация электродов - отклонение потенциалов от равновесных
значений, происходящее при прохождении электрического тока через
электрохимическую систему.
Перенапряжение - количественная мера поляризации. Перенапряжение
равно разности равновесного электродного потенциала и электродного
потенциала при определенном токе.
ЭЛЕКТРОДЫ В НЕРАВНОВЕСНЫХ МЕТОДАХ
Поляризуемые электроды (для них
характерно перенапряжение)
Неполяризуемые электроды (на них
протекают незаторможенные э/х
реакции)
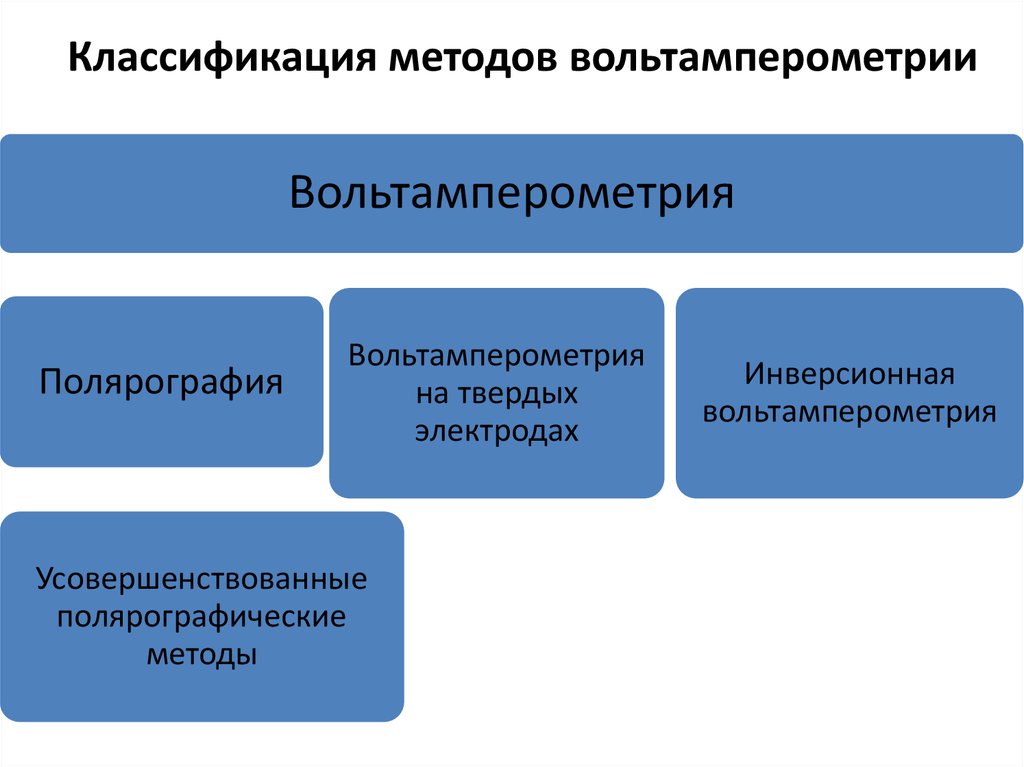
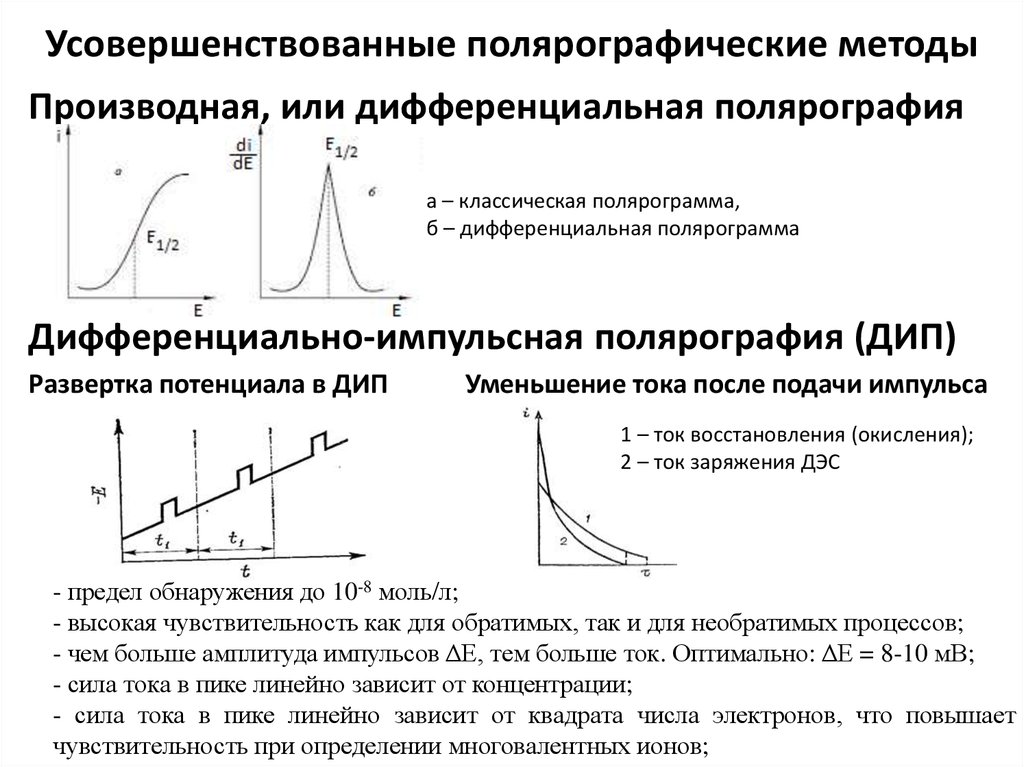
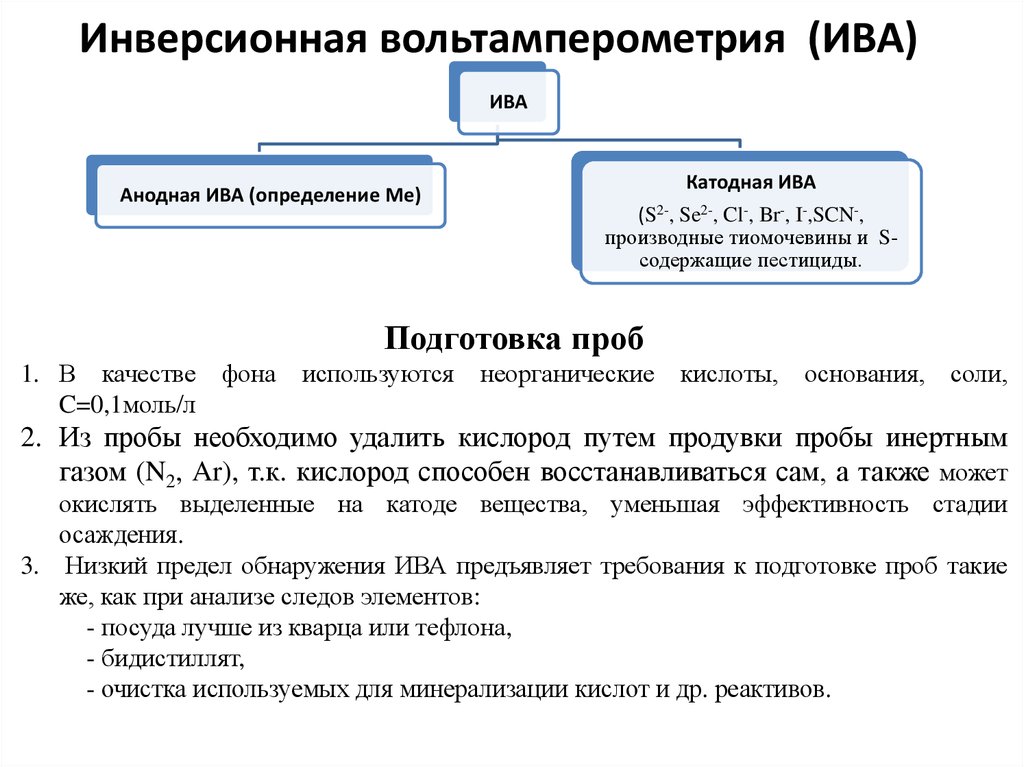
4. Классификация методов вольтамперометрии
ВольтамперометрияПолярография
Вольтамперометрия
на твердых
электродах
Усовершенствованные
полярографические
методы
Инверсионная
вольтамперометрия
5. Полярография
Принципиальная схемаI - аккумулятор; 2 - выключатель; 3 потенциометр; 4 - вольтметр; 5 , 6 последовательное
и
параллельное
сопротивление шунта; 7 -гальванометр; 8,
9 - катод и анод полярографической
ячейки.
ЭДС = Еа – Ек + iR
iR
Eа и Eк - потенциалы анода и катода,
iR - омическое падение напряжения в ячейке
0;
тогда ЭДС = - Ек
Eа = 0,
6. Ртутный капельный электрод (РКЭ) – стеклянный капилляр (внутренний диаметр 5·10-2мм)
ПреимуществаНедостатки
Большое перенапряжение выделения водорода
на ртути, что позволяет достичь в кислых
растворах до -1,2 в, в щелочных - до -2,0 в
отн.х/с ЭС
Высокая токсичность ртути
Непрерывно обновляющаяся поверхность
электрода
Площадь поверхности мала, плотность тока
велика, хорошая поляризуемость даже при
малых (до 10 -10 А) токах
Характеристики (зависят от высоты столба ртути (Н))
Период капания (t1) – время жизни одной капли,
t1 = f (1/Н, потенциала электрода и состава раствора)
Масса вытекания ртути (mHg или просто m) - количество ртути в мг, вытекающее
из капилляра за 1 сек.
mHg= f (Н и потенциала электрода)
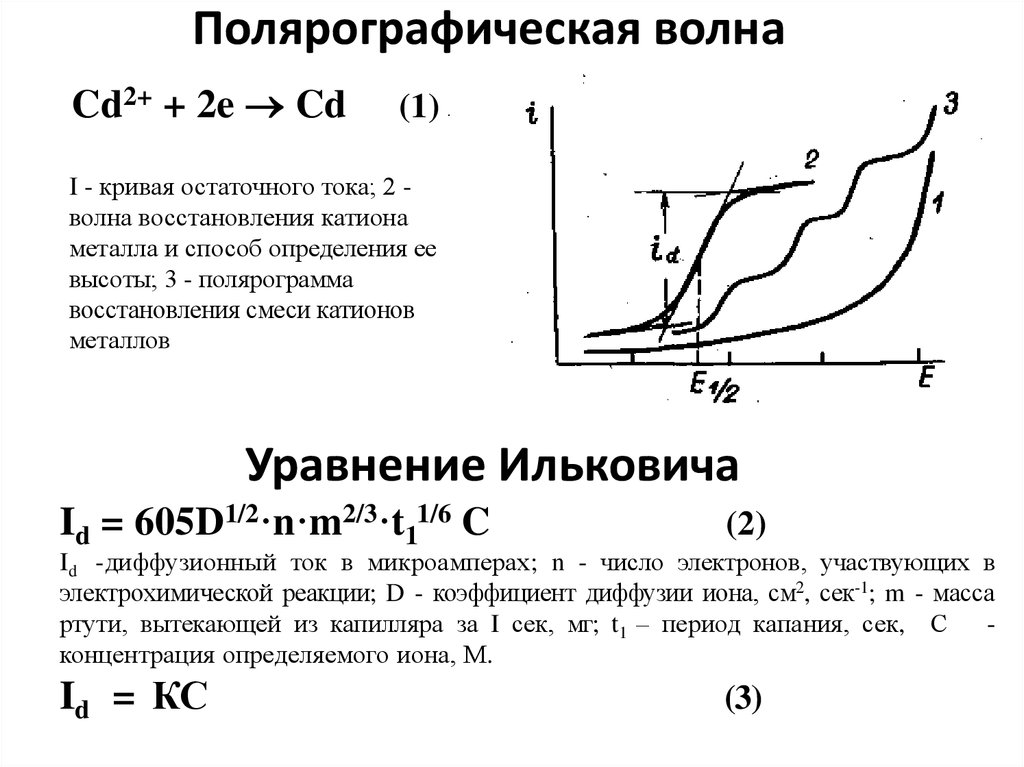
7. Полярографическая волна
Cd2+ + 2e Cd(1)
I - кривая остаточного тока; 2 волна восстановления катиона
металла и способ определения ее
высоты; 3 - полярограмма
восстановления смеси катионов
металлов
Уравнение Ильковича
Id = 605D1/2·n·m2/3·t11/6 C
(2)
Id = КС
(3)
Id -диффузионный ток в микроамперах; n - число электронов, участвующих в
электрохимической реакции; D - коэффициент диффузии иона, см2, сек-1; m - масса
ртути, вытекающей из капилляра за I сек, мг; t1 – период капания, сек, С
концентрация определяемого иона, М.
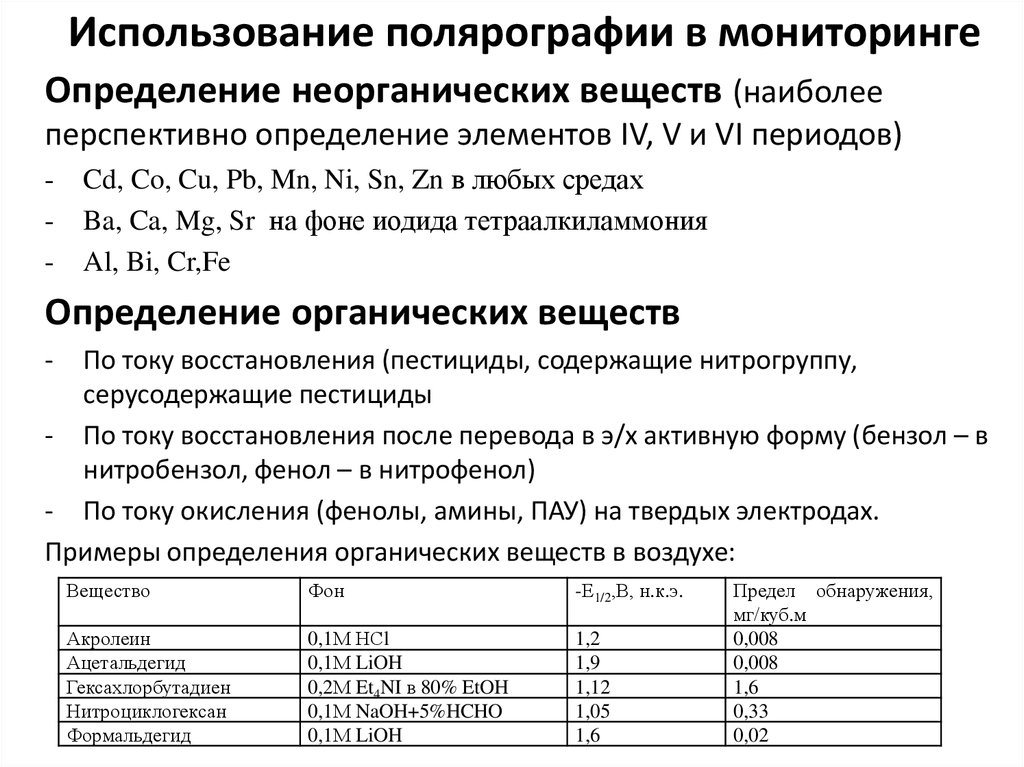
8. Необходимые условия количественного полярографического анализа
• Измеряемый ток должен быть диффузионным.• Необходимо создать высокую концентрацию фона (на 1-2 порядка выше,
чем концентрация определяемого вещества). Сфона 0,1 моль/л.
• Из пробы необходимо удалить кислород путем продувки пробы инертным
газом (N2, Ar), т.к. кислород способен восстанавливаться на РКЭ.
• Следует предупреждать искажение формы полярограмм из-за образования
полярографических максимумов (добавляют ПАВ).
• Необходимо поддерживать постоянную температуру и неизменное
положение емкости со ртутью на штативе; работать с одним капилляром
(чтобы в ур.3 К=const).
• При определении нескольких ионов из одной пробы необходимо увеличить
разницу
в
Е1/2
определяемых
ионов
(например,
используя
комплексообразование).
• Если потенциал разряда определяемых ионов близок или даже более
отрицателен, чем потенциал разряда протонов, прибегают к изменению рН
среды. Для органических веществ повышение кислотности сдвигает Е1/2 в
сторону менее отрицательных потенциалов.
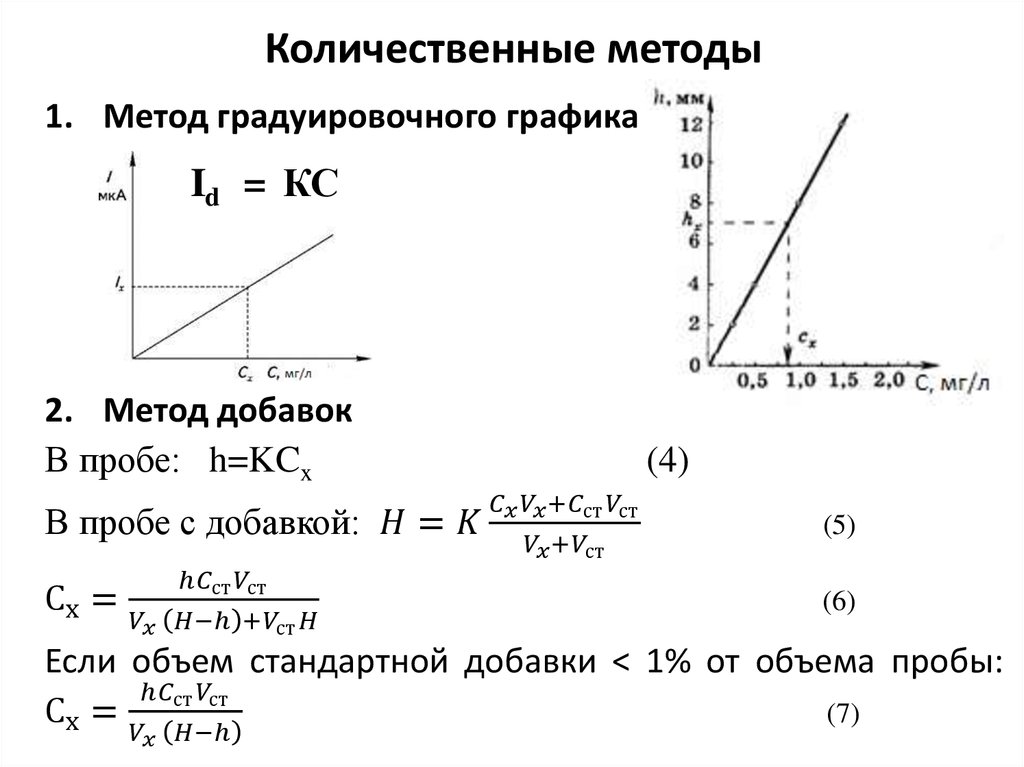
9. Количественные методы
1. Метод градуировочного графикаId = КС
2. Метод добавок
В пробе: h=KCx
В пробе с добавкой:







 Химия
Химия








