Похожие презентации:
Комплексообразователь. (Лекция 5)
1. Комплекс [PtВr6]2-
Комплекс [PtВr6]2Комплексообразователь Pt4+: 5d66s0 ; лиганд Br– ; к.ч. 6Комплексообразователь 5d-элемент лиганды сильного поля
К.ч. 6 октаэдрическое расщепление 5d- орбиталей.
Е
Энергетическая диаграмма:
Br– Br–
Br–
5d
.. ..
..
Br– Br– Br–
..
.. ..
d2sp3
5d
d2sp3 – гибридизация АО
структура комплекса - октаэдр
комплекс - внутриорбитальный, низкоспиновый, диамагнитный
2. Координационное число 4
1. Если комплексообразователь 3d – элементлиганды слабого поля тетраэдрическое
расщепление. Гибридизация: d3s, d2sp, sp3
и
2. Если комплексообразователь 3d – элемент и
лиганды сильного поля плоско-квадратное
расщепление. Гибридизация: dsp2
3. Если комплексообразователь 4d- или 5dэлементы, то все лиганды сильного поля
плоско-квадратное расщепление.
Гибридизация: dsp2
3. комплекс [Au(NH3)4]3+
Комплексообразователь Au3+: 5d86s0 ; лиганд NH3 ; к.ч. 4комплексообразователь 5d- элемент все лиганды
сильного поля плоско-квадратное расщепление
Энергетическая диаграмма:
Е
:NH3 :NH3:NH3:NH3
dsp2
dsp2- гибридизации АО
Структура комплекса – плоский квадрат
Комплекс – внутриорбитальный, низкоспиновый, диамагнитный
4. комплекс [NiCl4]2-
комплекс [NiCl4]2комплексообразователь Ni2+: 3d84s2 ; лиганд Cl– ; к.ч. 4Т.к. комп-тель 3d-элемент => по спектрохимическому ряду лиганд
Cl– - слабого поля => тетраэдрическое расщепление d- АО
Энергетическая диаграмма:
Е
3d
Cl– Cl– Cl– Cl–
•
•• •• •
sp3
3d
sp3 – гибридизация АО
структура комплекса - тетраэдр
комплекс - внешнеорбитальный, высокоспиновый,
парамагнитный
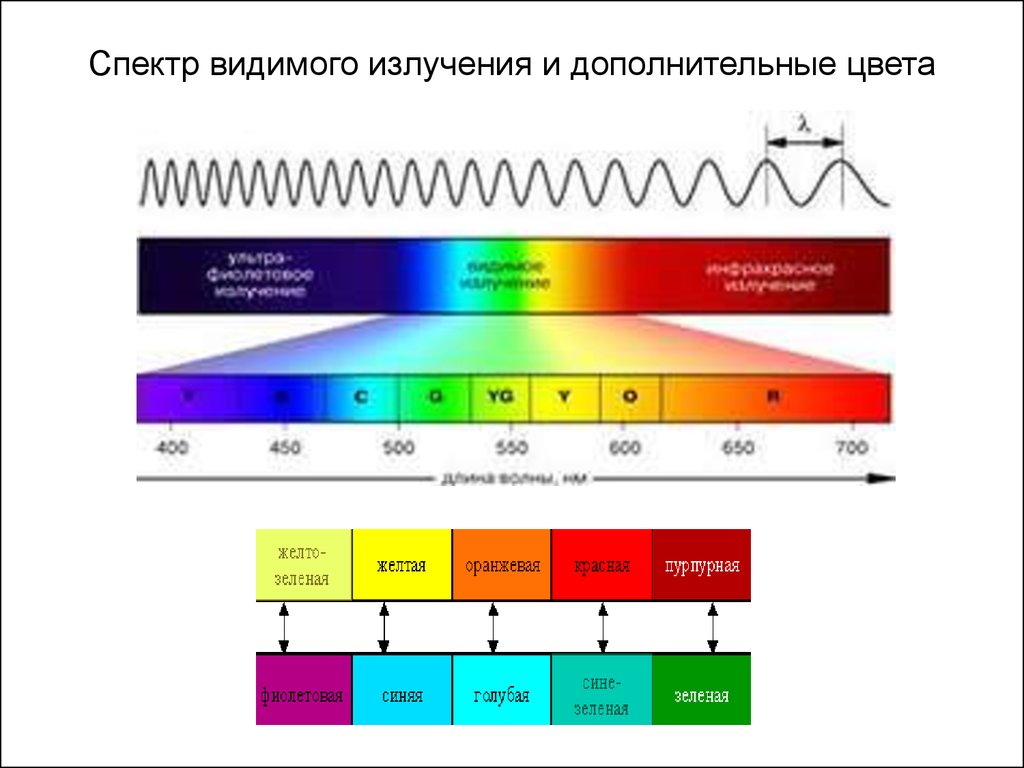
5. Спектр видимого излучения и дополнительные цвета
6. Окраска комплексных соединений
При поглощении кванта света (h ) электрон переходит с подуровня d,имеющего более низкую энергию Е1, на подуровень d с более высокой Е2 и
этот переход является причиной определенной окраски комплекса
Энергия поглощенного кванта света равна энергии расщепления:
h = Е2 – Е1 = ∆
Зная длину волны поглощенного света ( =c/ ), соответствующую окраске комплекса (дополнительному цвету), можно рассчитать энергию
расщепления = hc /
Энергия расщепления и окраска комплекса определяются природой лиганда, а также природой и степенью окисления комплексообразователя
При замене в комплексе одних лигандов на другие, расположенные в спектрохимическом ряду левее (т. е. обладающие большей силой поля), значение
возрастает, и комплекс начинает поглощать лучи света с меньшей длиной
волны. Это сказывается на изменении его окраски. Например,
[ Со(ONO)(NH3)5 ]2+
[ CuCl4 ] 2-
[ Co(NO2)(NH3)5 ]2+
[ Cu(H2O)4 ] 2+
[ Cu(NH3)4 ] 2+
7. Гексаакватитан (III) [Ti(H2O)6]3+
Комплекс поглощает свет в желто-зеленой области спектра(20300 см-1, λ≈ 500 нм). Это связано с переходом единственного
электрона комплексообразователя с dε-АО на dγ-подуровень:
Поэтому раствор, содержащий [Ti (H2O)6]3+, приобретает
фиолетовый цвет (дополнительный к поглощенному желтозеленому).
8. комплекс [Сu(NH3)4]2+
Комплексообразователь Сu2+: 3d94s0 ; лиганд NH3 ; к.ч. 4комплексообразователь 3d- элемент для Сu2+ лиганды NH3
сильного поля плоско-квадратное расщепление
Энергетическая диаграмма:
Е
:NH3 :NH3:NH3:NH3
dsp2
dsp2- гибридизации АО
Структура комплекса – плоский квадрат
Комплекс – внутриорбитальный, парамагнитный
9. Ионная химическая связь
• А - nē→ Аn+ (катионы)А + nē→ Аn- (анионы)
• Электростатическое взаимодействие между
противоположно заряженными ионами
• Сила взаимодействия ионов зависит от величины зарядов и
расстояния между ними (по закону Кулона)
• Сферическое электрическое поле
Взаимодействие со многими соседними ионами
• I (ионизации) > Е( сродства к электрону)=>не происходит
полного перехода электронов, доля ионности связи (Na +0,9Cl0,9)
• Для большой ∆ЭО ( LiF, CsCl, K2O и др.)
• Связь прочная. Твердые вещества с ионной кристаллической
решеткой – тугоплавкие (высокие Тпл), высокопрочные,
растворимы в полярных растворителях. Формулы (NаСl, СаF2,
Аl2(SО4)3 ) - отражают лишь состав)
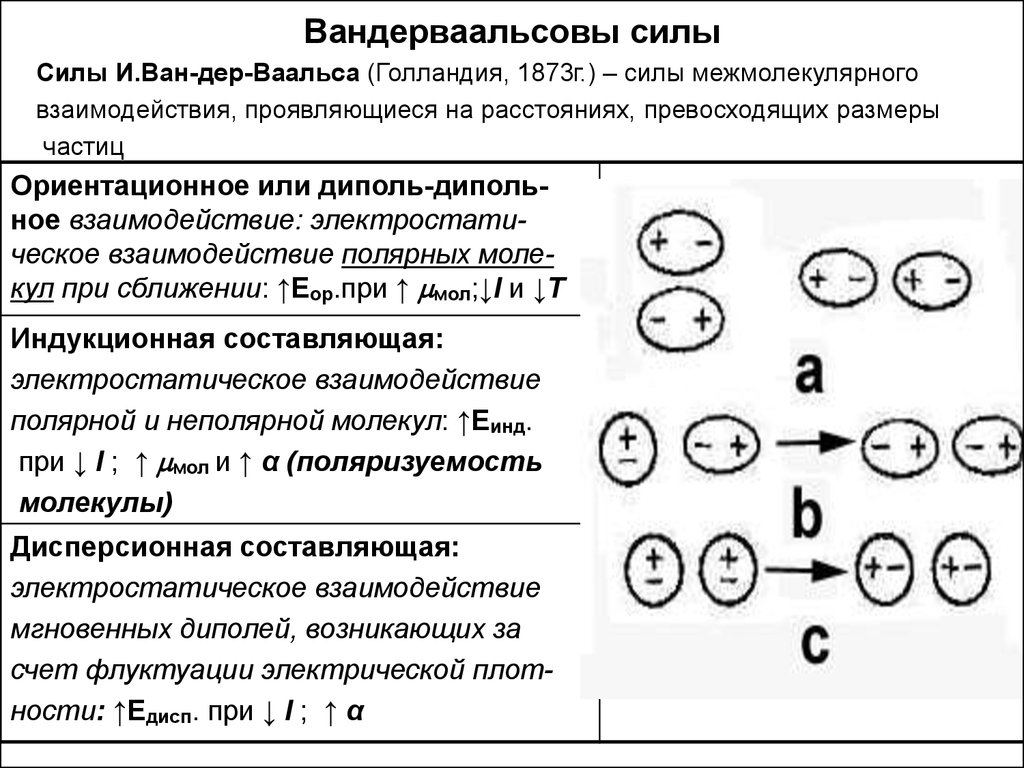
10. Вандерваальсовы силы
Силы И.Ван-дер-Ваальса (Голландия, 1873г.) – силы межмолекулярноговзаимодействия, проявляющиеся на расстояниях, превосходящих размеры
частиц
Ориентационное или диполь-дипольное взаимодействие: электростатическое взаимодействие полярных молекул при сближении: ↑Еор.при ↑ мол;↓l и ↓Т
Индукционная составляющая:
электростатическое взаимодействие
полярной и неполярной молекул: ↑Еинд.
при ↓ l ; ↑ мол и ↑ α (поляризуемость
молекулы)
Дисперсионная составляющая:
электростатическое взаимодействие
мгновенных диполей, возникающих за
счет флуктуации электрической плотности: ↑Едисп. при ↓ l ; ↑ α
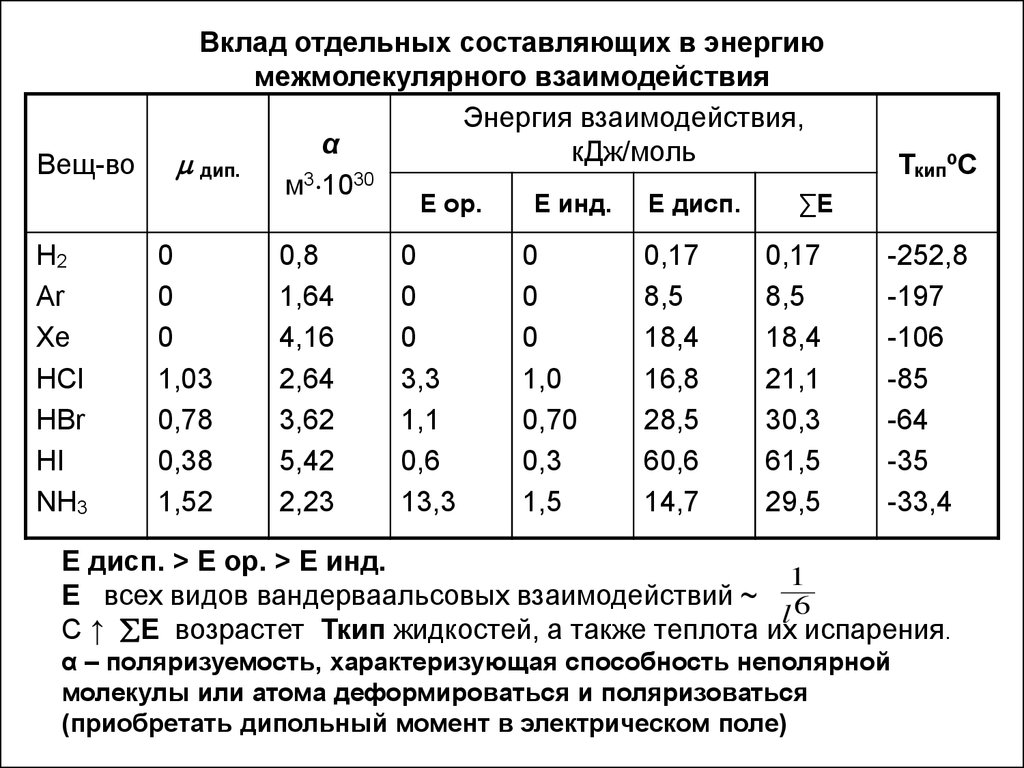
11. Вклад отдельных составляющих в энергию межмолекулярного взаимодействия
Вещ-воВклад отдельных составляющих в энергию
межмолекулярного взаимодействия
Энергия взаимодействия,
α
кДж/моль
дип.
м3 1030
Е ор.
H2
Ar
Xe
HCl
HBr
HI
NH3
0
0
0
1,03
0,78
0,38
1,52
0,8
1,64
4,16
2,64
3,62
5,42
2,23
0
0
0
3,3
1,1
0,6
13,3
Е инд.
0
0
0
1,0
0,70
0,3
1,5
Е дисп.
0,17
8,5
18,4
16,8
28,5
60,6
14,7
ТкипºС
∑Е
0,17
8,5
18,4
21,1
30,3
61,5
29,5
-252,8
-197
-106
-85
-64
-35
-33,4
Е дисп. > Е ор. > Е инд.
1
Е всех видов вандерваальсовых взаимодействий ~ 6
l
С ↑ Е возрастет Ткип жидкостей, а также теплота их испарения.
α – поляризуемость, характеризующая способность неполярной
молекулы или атома деформироваться и поляризоваться
(приобретать дипольный момент в электрическом поле)
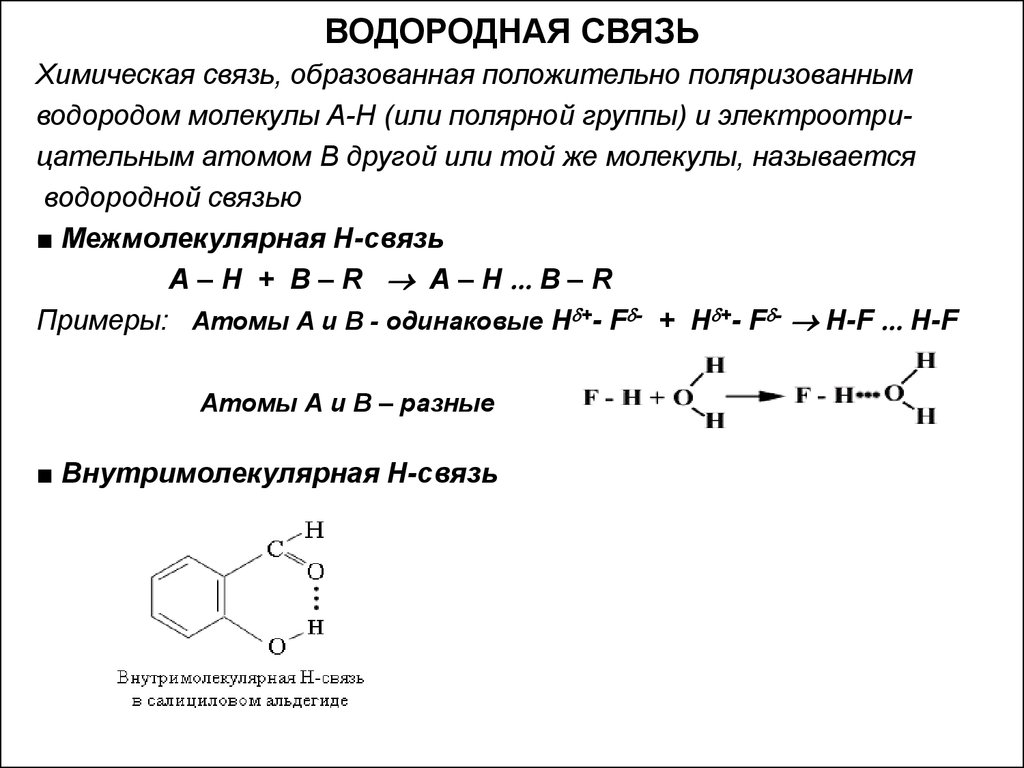
12. ВОДОРОДНАЯ СВЯЗЬ
Химическая связь, образованная положительно поляризованнымводородом молекулы А-Н (или полярной группы) и электроотрицательным атомом В другой или той же молекулы, называется
водородной связью
■ Межмолекулярная Н-связь
А – Н + В – R А – Н В – R
Примеры: Атомы А и В - одинаковые Н +- F - + Н +- F - H-F H-F
Атомы А и В – разные
■ Внутримолекулярная Н-связь
13.
► Е(н-связи) возрастает с ↑ ЭО и ↓ размеров атомов В-Н F- >
-Н O=
> -Н N≡
25-42
13-19
8-21
кдж/моль
► Энергия водородной связи имеет промежуточное значение между
энергией ковалентной связи и вандерваальсовых сил
► Для Н2О длина связи О–Н – 0,096 нм, а связи О Н – 0,177 нм
► Возникновение водородных связей приводит к образованию
димеров, тримеров и других полимерных структур ( например,
зигзагообразных структур (НF)n,)кольцевой димерной структуры
низших карбоновых кислот:
►Межмолекулярные Н-связи изменяют свойства веществ:
повышают вязкость, диэлектрическую постоянную,
температуру кипения и плавления, теплоту плавления и
парообразования.
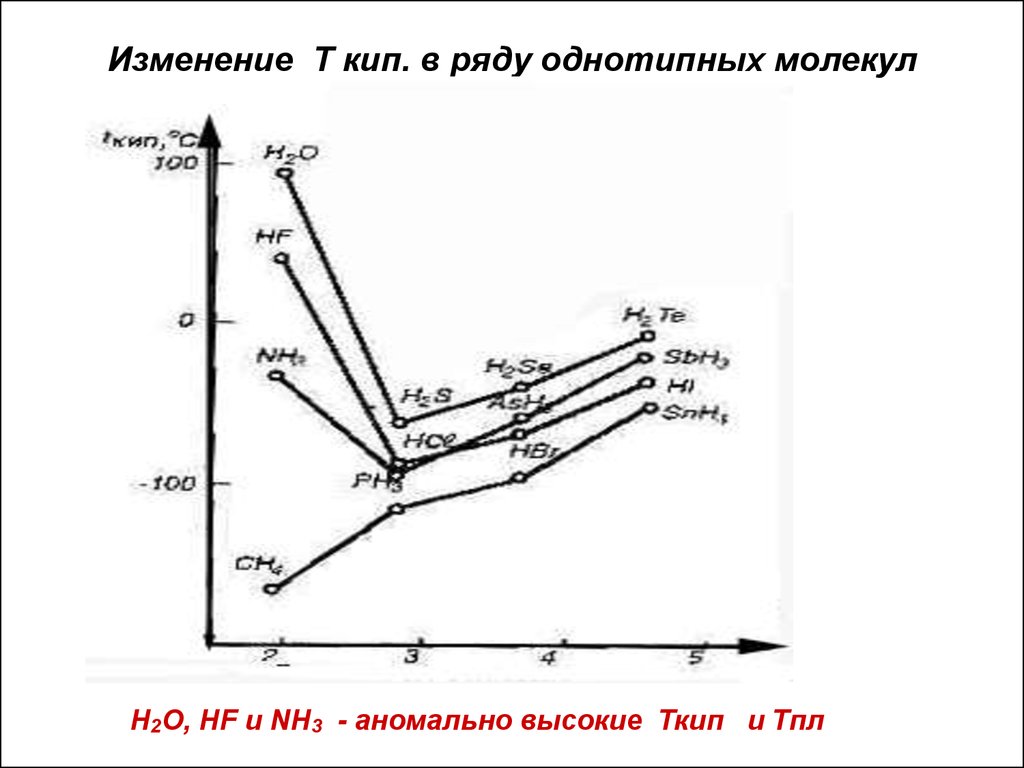
14. Изменение Т кип. в ряду однотипных молекул
Н2О, НF и NН3 - аномально высокие Ткип и Тпл15. Металлическая связь
У большинства металлов на внешнем энергетическом уровненебольшое число электронов, наличие свободных орбиталей,
низкая энергия ионизации
Совокупность нелокализованных, обобществленных, подвижных
электронов – электронный газ
Металл – плотно упакованная структура положительных ионов,
связанных друг с другом электронным газом
Металлическая связь –
притяжение между ионами и обобществленными электронами
Металлические свойства
• Высокая электропроводность
• Высокая теплопроводность
• Ковкость
• Пластичность
• Металлический блеск
![Комплекс [PtВr6]2- Комплекс [PtВr6]2-](https://cf.ppt-online.org/files/slide/e/e10JnslcRPUHtoX9vamFQk58WK6LOqTbwzBu2E/slide-0.jpg)

![комплекс [Au(NH3)4]3+ комплекс [Au(NH3)4]3+](https://cf.ppt-online.org/files/slide/e/e10JnslcRPUHtoX9vamFQk58WK6LOqTbwzBu2E/slide-2.jpg)
![комплекс [NiCl4]2- комплекс [NiCl4]2-](https://cf.ppt-online.org/files/slide/e/e10JnslcRPUHtoX9vamFQk58WK6LOqTbwzBu2E/slide-3.jpg)

![Гексаакватитан (III) [Ti(H2O)6]3+ Гексаакватитан (III) [Ti(H2O)6]3+](https://cf.ppt-online.org/files/slide/e/e10JnslcRPUHtoX9vamFQk58WK6LOqTbwzBu2E/slide-6.jpg)
![комплекс [Сu(NH3)4]2+ комплекс [Сu(NH3)4]2+](https://cf.ppt-online.org/files/slide/e/e10JnslcRPUHtoX9vamFQk58WK6LOqTbwzBu2E/slide-7.jpg)



 Химия
Химия