Похожие презентации:
Комплексные соединения
1. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Сложные соединения, в узлах кристаллической решетки которых находятся сложные частицы, способные к самостоятельному существованию при переходе вещества в расплавленноеили растворенное состояние, называются комплексными соединениями. В комплексных соединениях имеются ковалентные связи, образованные по донорно-акцепторному механизму
[Сu (NH3)4]SO4
→
[Сu (NH3)4]2+ + SO42–
внутр. и внешняя сферы
Тетраамминосульфат Сu
Внутренняя сфера – комплекс:
Катионный [Сu (NH3)4]2+
Анионный [Zn (CN)4]2–
Нейтральный [Pt (NH3)2Cl2] (не имеет внешней сферы)
2. Состав комплекса: [Сu (NH3)4]2+ Комплексообразователь Сu2+ и лиганд NH3
швейцарский химик Альфред ВернерОснователь координационной теории
Состав комплекса: [Сu (NH3)4]2+
Комплексообразователь Сu2+ и лиганд NH3
Лиганды:
простые анионы (F–,Cl–, Br–,S2–),
сложные анионы (OH–,CN–, NCS–, NO2–),
нейтральные молекулы Н2O, NH3, CO, H2NCH2CH2NH2
монодентантные, бидентантные, полидентантные (по
числу занимаемых орбиталей комплексообразователя)
амбидентатный - лиганд, который может координироваться
различными своими атомами
например, лиганд (NCS) – :
(-NCS) –
(-SCN) –
Координационное число (к.ч.) – количество лигандов,
координируемых комплексообразователем
3. Химическая связь в комплексных соединениях
Между внешней и внутренней сферой – электростатическоеион-ионное взаимодействие
Между комплексообразователем и лигандами –
ковалентная связь по донорно-акцепторному механизму
Теория валентных связей (ВС)
• Донор – лиганд (поставщик пары электронов)
• Акцептор – комплексообразователь (наличие свободных АО)
• Все вакантные орбитали комплексообразователя,
принимающие участие в образовании связи, одинаковы по
энергии и по форме, т.е. они гибридизованы.
4. Комплекс [AlBr4]
Комплекс [AlBr4]Аl …3s23р1 ,
но комплексообразователь Al3+: …3s03р0
•
[AlBr4]
Br
•
•
•
Br Br Br–
лиганд – анион Br …4s24р6
Донор неподеленной пары электронов
sp3-гибридизация АО алюминия
Строение комплексного иона - тетраэдр
5. Комплекс [Ag(CN)2]–
Ag …4d105s1Комплексообразователь: Ag+ …4d105s0
Лиганд CN– , к.ч. 2
CN– CN–
Ag+
•
•
sp
sp- гибридизация AO
структура комплекса - линейная
6. Теория кристаллического поля
Комплексообразователь – d1-9 элемент1.
Лиганды располагаются вокруг комплексообразователя так,
чтобы силы притяжения были максимальны, а силы
отталкивания минимальны.
2.
Лиганды влияют на энергетическое состояние d-электронов
комплексообразователя.
В отсутствии внешнего электростатического поля все d-орбитали
- вырожденные.
Под воздействием поля лигандов расщепление d-подуровня
на величину , называемую энергией расщепления.
- зависит от к.ч., природы лигандов и комплексообразователя.
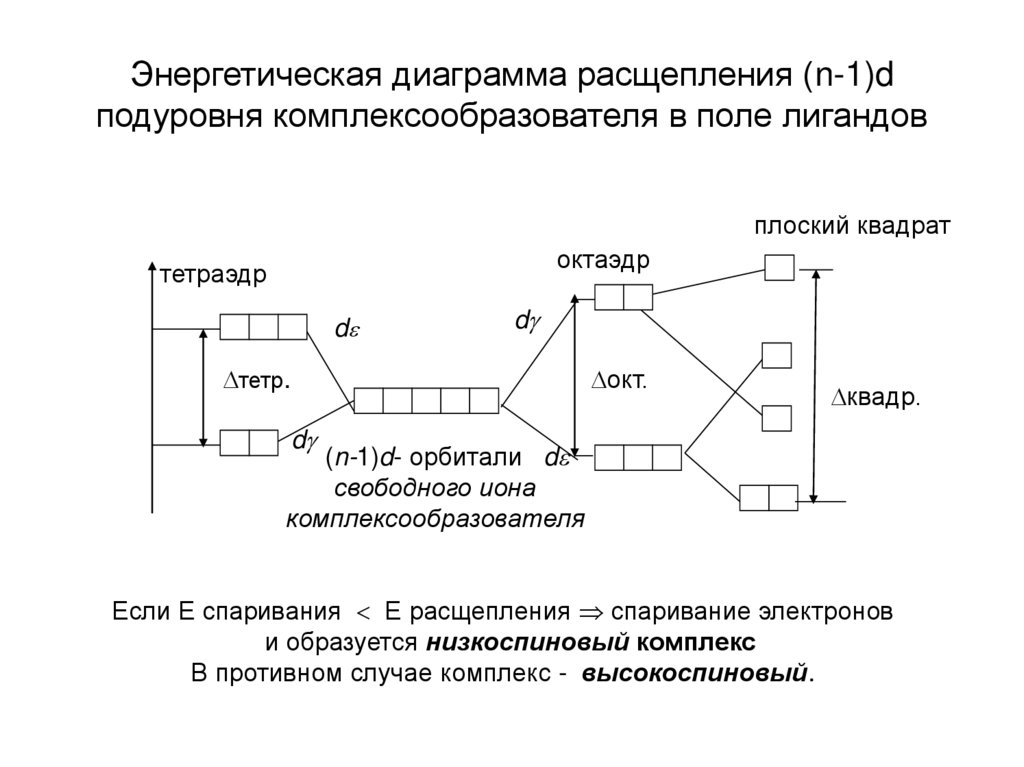
7. Энергетическая диаграмма расщепления (n-1)d подуровня комплексообразователя в поле лигандов
плоский квадратоктаэдр
тетраэдр
d
d
тетр.
окт.
квадр.
d
(n-1)d- орбитали d
свободного иона
комплексообразователя
Если Е спаривания Е расщепления спаривание электронов
и образуется низкоспиновый комплекс
В противном случае комплекс - высокоспиновый.
8.
Обитали лигандов, внедряясь в электронную оболочку
комплексообразователя, оказывают влияние на состояние электронов
на d- орбиталях.
Неспаренные электроны, испытывая отталкивание от электронных пар
лигандов, могут спариваться, переходя на более дальние от лигандов dорбитали центрального атома.
Лиганд сильного поля => электроны на d-подуровне
комплексообразователя максимально спариваются
Лиганд слабого поля => спаривание электронов на d-подуровне
комплексообразователя не происходит
Для 4d-и 5d-элементов – все лиганды сильного поля
Для 3d-элементов - спектрохимический ряд лигандов:
I Br SCN Cl F ОН H2O NCS NH3 NO2 CN CO
(в порядке возрастания силы поля лиганда)
Но границы между сильным и слабым полями лигандов провести
сложно, например:
[MnF6]2- лиганд F - слабое; [NiF6]2- лиганд F - сильное поле
Лиганд Н2О в [Со(Н2О)6]2+ – сильное поле; в [Со(Н2О)6]3+ – слабое поле
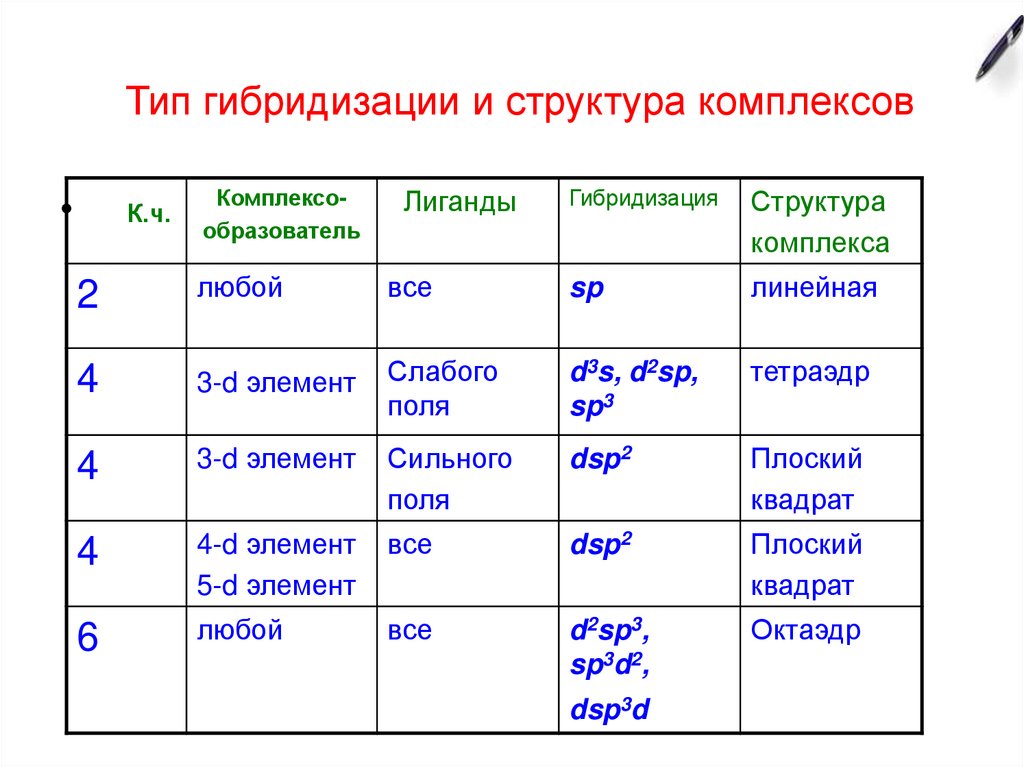
9. Тип гибридизации и структура комплексов
К.ч.
Комплексообразователь
Лиганды
Гибридизация
Структура
комплекса
любой
все
sp
линейная
4
3-d элемент
Слабого
поля
d3s, d2sp,
sp3
тетраэдр
4
3-d элемент
Сильного
поля
dsp2
Плоский
квадрат
4
4-d элемент
5-d элемент
все
dsp2
Плоский
квадрат
6
любой
все
d2sp3,
sp3d2,
Октаэдр
2
dsp3d
10. Комплекс [Fe(CN)6]3-
Комплекс [Fe(CN)6]3Комплексообразователь Fe3+: 3d 54s0лиганд CN– сильного поля => происходит спаривание е на d-подуровне
к.ч.6
CN– CN– CN– CN– CN– CN–
•• •
•
•• •• •
d2sp3
d2sp3- гибридизация AO
структура комплекса - октаэдр.
Комплекс: низкоспиновый, внутриорбитальный,
парамагнитный.
11. Магнитные свойства комплексных соединений
парамагнетики — вещества, намагничивающиеся во внешнеммагнитном поле по направлению поля.
Парамагнетики втягиваются в магнитное поле
Парамагнитные свойства комплексных соединений
определяются числом неспаренных электронов.
диамагнетики – вещества, намагничивающиеся во внешнем
магнитном поле против направления поля.
Диамагнетики выталкиваются из магнитного поля
12. Комплекс [Co(Н2О)6]2+
комплексообразователь Со2+: 3d 74s0 , лиганд Н2О, к.ч. 6Компл-тель 3d –элемент Н2О – лиганд среднего поля, а для Со2+
(низшая степень окисления) он относится к слабым.
Н 2О Н 2О Н 2О Н 2О Н 2О Н 2 О
•
•• •• •
•• •
sp3d2
sp3d2-гибридизация AO
структура комплекса - октаэдр
Комплекс: высокоспиновый, внешнеорбитальный,
парамагнитный
13. комплекс [Au(NH3)4]3+
Комплексообразователь Au3+: 5d86s0лиганд NH3 ; к.ч. 4
комплексообразователь 5d- элемент все лиганды
сильного поля происходит спаривание е на d-подуровне
:NH3 :NH3:NH3:NH3
•
•
•• •
dsp2
dsp 2- гибридизации АО
Структура комплекса – плоский квадрат
Комплекс – внутриорбитальный, низкоспиновый, диамагнитный
14. комплекс [NiCl 4]2-
комплекс [NiCl 4]2комплексообразователь Ni2+: 3d84s0лиганд Cl– ; к.ч. 4
Т.к. никель - 3d-элемент => по спектрохимическому ряду лиганд Cl–
- слабого поля => не происходит спаривание е на d- подуровне
Cl– Cl– Cl– Cl–
•
•• •• •
sp3
sp3 – гибридизация АО
структура комплекса - тетраэдр
комплекс - внешнеорбитальный, высокоспиновый,
парамагнитный
15. (исключение!) комплекс [Сu(NH3)4]2+
Комплексообразователь Сu2+: 3d94s0лиганд NH3 ; к.ч. 4
комплексообразователь 3d- элемент для Сu2+ лиганды NH3
сильного поля плоско-квадратное расщепление
:NH3 :NH3:NH3:NH3
•
•
•
•
dsp2
dsp2 - гибридизации АО
Структура комплекса – плоский квадрат
Комплекс – внутриорбитальный, парамагнитный
16. Ионная химическая связь
• К - nē→ Кn+ (катионы)А + nē→ Аn- (анионы)
• Электростатическое взаимодействие между
противоположно заряженными ионами
• Сила взаимодействия ионов зависит от величины зарядов и
расстояния между ними (по закону Кулона)
• Сферическое электрическое поле
Взаимодействие со многими соседними ионами
• I (ионизации) > Е( сродства к электрону)=>не происходит
полного перехода электронов, доля ионности связи
(Na +0,9 Cl -0,9)
• Для большой ∆ЭО ( LiF, CsCl, K2O и др.)
• Связь прочная. Твердые вещества с ионной кристаллической
решеткой – тугоплавкие (высокие Тпл), высокопрочные,
растворимы в полярных растворителях. Формулы (NаСl, СаF2,
Аl2(SО4)3 ) - отражают лишь состав)
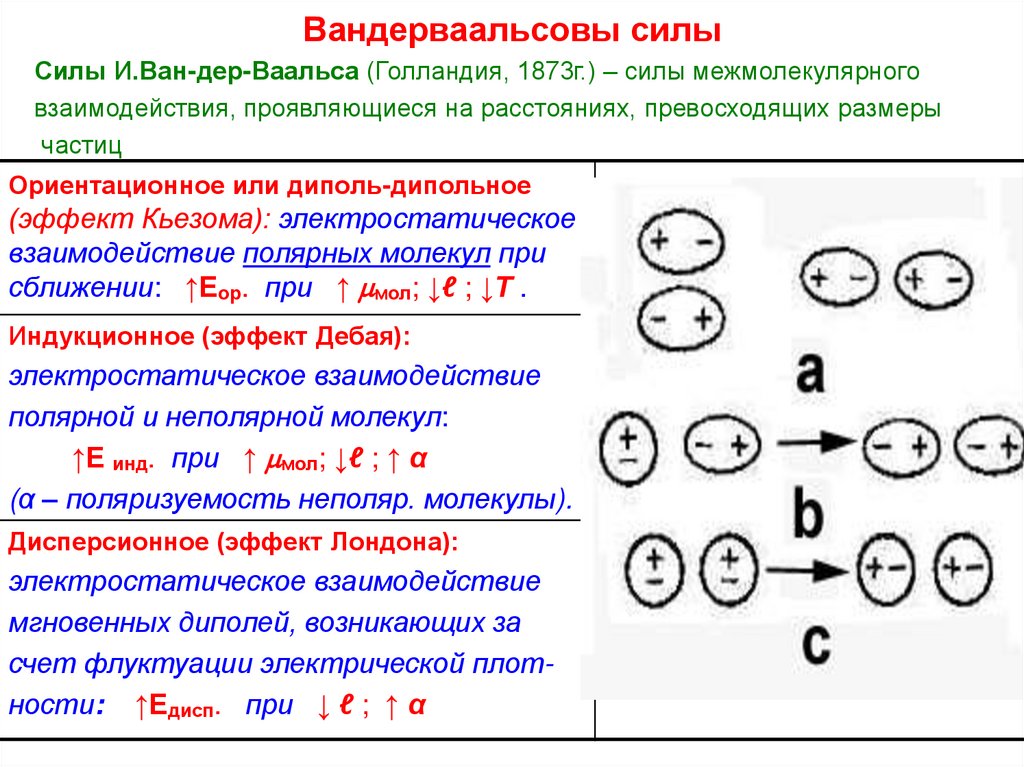
17. Вандерваальсовы силы
Силы И.Ван-дер-Ваальса (Голландия, 1873г.) – силы межмолекулярноговзаимодействия, проявляющиеся на расстояниях, превосходящих размеры
частиц
Ориентационное или диполь-дипольное
(эффект Кьезома): электростатическое
взаимодействие полярных молекул при
сближении: ↑Еор. при ↑ мол; ↓ℓ ; ↓Т .
Индукционное (эффект Дебая):
электростатическое взаимодействие
полярной и неполярной молекул:
↑Е инд. при ↑ мол; ↓ℓ ; ↑ α
(α – поляризуемость неполяр. молекулы).
Дисперсионное (эффект Лондона):
электростатическое взаимодействие
мгновенных диполей, возникающих за
счет флуктуации электрической плотности: ↑Едисп. при ↓ ℓ ; ↑ α
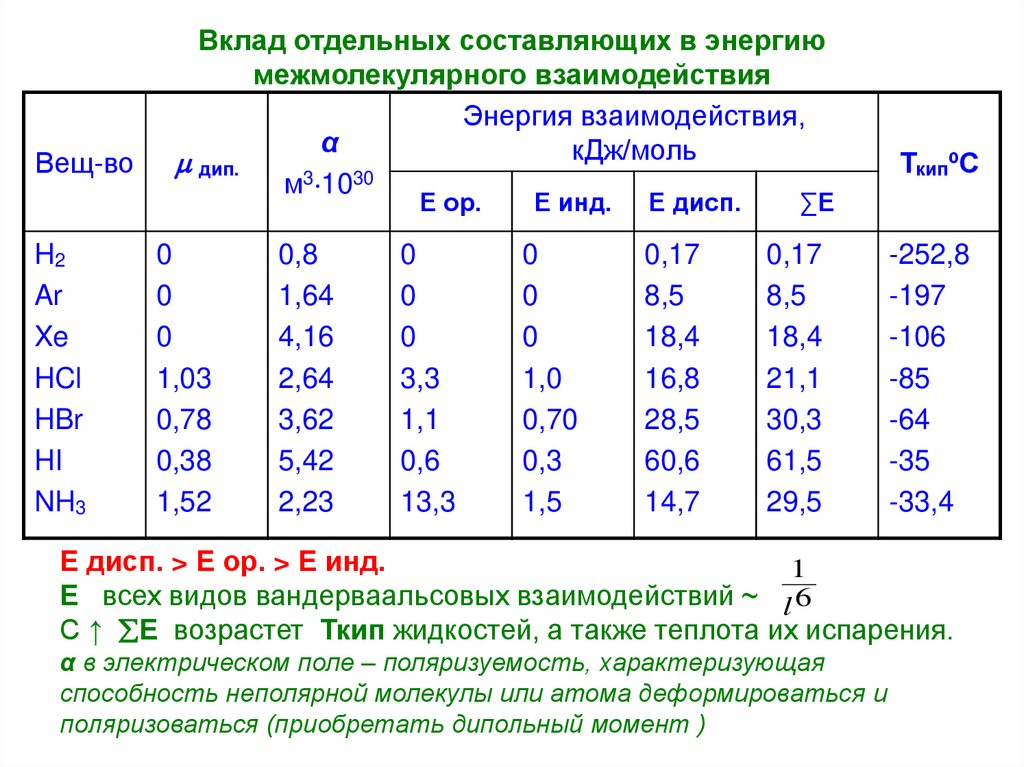
18. Вклад отдельных составляющих в энергию межмолекулярного взаимодействия
Вещ-воВклад отдельных составляющих в энергию
межмолекулярного взаимодействия
Энергия взаимодействия,
α
кДж/моль
дип.
м3 1030
Е ор.
H2
Ar
Xe
HCl
HBr
HI
NH3
0
0
0
1,03
0,78
0,38
1,52
0,8
1,64
4,16
2,64
3,62
5,42
2,23
0
0
0
3,3
1,1
0,6
13,3
Е инд.
0
0
0
1,0
0,70
0,3
1,5
Е дисп.
0,17
8,5
18,4
16,8
28,5
60,6
14,7
ТкипºС
∑Е
0,17
8,5
18,4
21,1
30,3
61,5
29,5
-252,8
-197
-106
-85
-64
-35
-33,4
Е дисп. > Е ор. > Е инд.
1
Е всех видов вандерваальсовых взаимодействий ~ l 6
С ↑ Е возрастет Ткип жидкостей, а также теплота их испарения.
α в электрическом поле – поляризуемость, характеризующая
способность неполярной молекулы или атома деформироваться и
поляризоваться (приобретать дипольный момент )
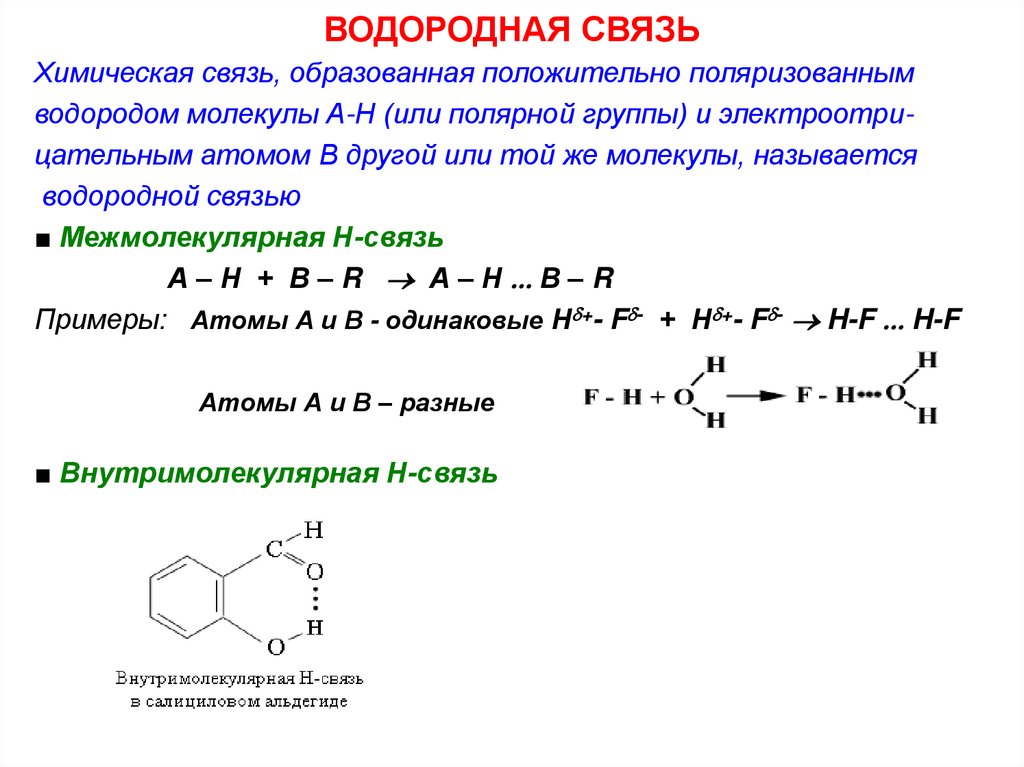
19. ВОДОРОДНАЯ СВЯЗЬ
Химическая связь, образованная положительно поляризованнымводородом молекулы А-Н (или полярной группы) и электроотрицательным атомом В другой или той же молекулы, называется
водородной связью
■ Межмолекулярная Н-связь
А – Н + В – R А – Н В – R
Примеры: Атомы А и В - одинаковые Н +- F - + Н +- F - H-F H-F
Атомы А и В – разные
■ Внутримолекулярная Н-связь
20.
► Е(н-связи) возрастает с ↑ ЭО и ↓ размеров атомов В-Н F- >
-Н O=
> -Н N≡
25-42
13-19
8-21
кдж/моль
► Энергия водородной связи имеет промежуточное значение между
энергией ковалентной связи и вандерваальсовых сил
► Для Н2О длина связи О–Н – 0,096 нм, а связи О Н – 0,177 нм
► Возникновение водородных связей приводит к образованию
димеров, тримеров и других полимерных структур, например:
зигзагообразных структур (НF)n, кольцевой димерной структуры
низших карбоновых кислот:
►Межмолекулярные Н-связи изменяют свойства веществ:
повышают вязкость, диэлектрическую постоянную,
температуру кипения и плавления, теплоту плавления и
парообразования.
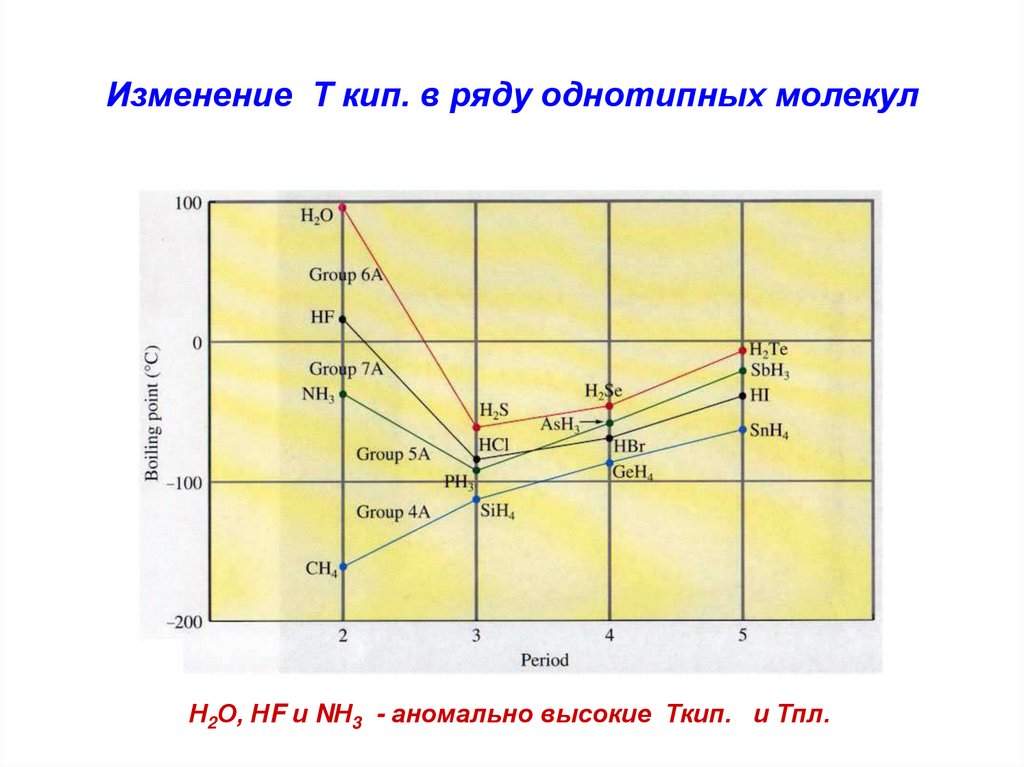
21. Изменение Т кип. в ряду однотипных молекул
Н2О, НF и NН3 - аномально высокие Ткип. и Тпл.22. Металлическая связь
У большинства металлов на внешнем энергетическом уровненебольшое число электронов, наличие свободных орбиталей,
низкая энергия ионизации
Совокупность нелокализованных, обобществленных, подвижных
электронов – электронный газ
Металл – плотно упакованная структура положительных ионов,
связанных друг с другом электронным газом
Металлическая связь –
притяжение между ионами и обобществленными электронами
Металлические свойства
• Высокая электропроводность
• Высокая теплопроводность
• Ковкость
• Пластичность
• Металлический блеск
23. Агрегатное состояние веществ
• Газообразное (отсутствие дальнего и ближнего порядка,неспособность сохранять объем и форму)
• Жидкое ( наличие ближнего порядка, способность сохранять
объем и неспособность сохранять форму)
• Твердое (наличие дальнего порядка для кристаллических тел,
способность сохранять объем и форму, наличие ближнего
порядка для аморфных тел)
• Плазма является частично или полностью ионизованным
газом и в равновесном состоянии обычно возникает при
высокой температуре, от нескольких тысяч кельвинов и
выше.
24. кристаллические вещества
• Кристалл - совокупность частиц (атомов, ионов, молекул),образующих закономерную регулярную пространственновременную структуру.
• Кристаллическая решетка - пространственная структура
кристаллических тел с периодически повторяющимися
частицами в узлах решетки.
Основные параметры кристаллических тел
• Энергия кристаллической решетки Екр. энергия, необходимая для
удаления частиц, составляющих решетку на расстояния,
превышающие пределы их взаимодействия.
• Координационным числом (к.ч.) данной частицы называется
число ближайших частиц, непосредственно взаимодействующих с
ней в кристаллической решетке.
Основные виды кристаллов:
молекулярные, ионные, атомные и металлические
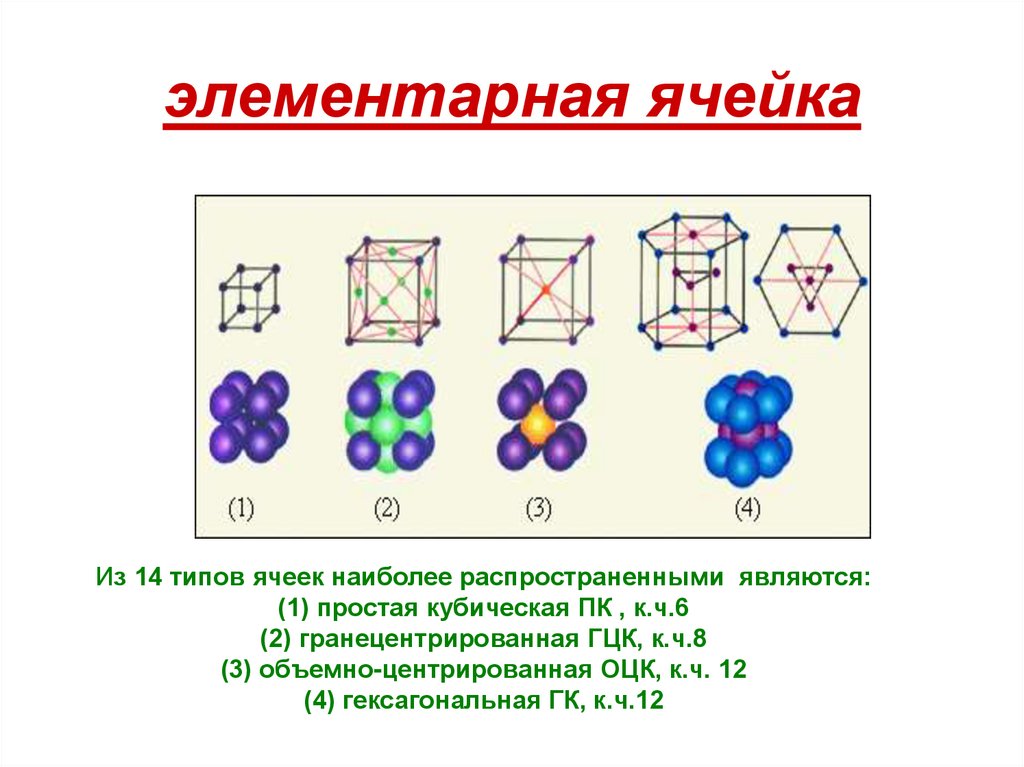
25. элементарная ячейка
Из 14 типов ячеек наиболее распространенными являются:(1) простая кубическая ПК , к.ч.6
(2) гранецентрированная ГЦК, к.ч.8
(3) объемно-центрированная ОЦК, к.ч. 12
(4) гексагональная ГК, к.ч.12
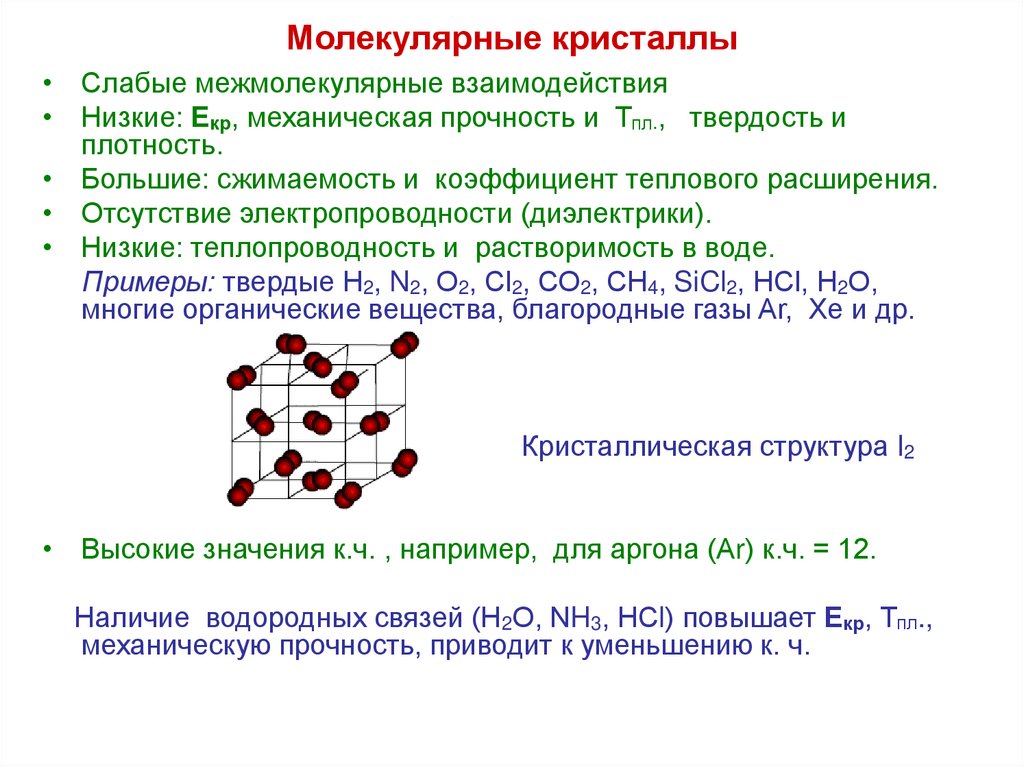
26. Молекулярные кристаллы
• Слабые межмолекулярные взаимодействия• Низкие: Екр, механическая прочность и Тпл., твердость и
плотность.
• Большие: сжимаемость и коэффициент теплового расширения.
• Отсутствие электропроводности (диэлектрики).
• Низкие: теплопроводность и растворимость в воде.
Примеры: твердые Н2, N2, О2, Сl2, СО2, СН4, SiCl2, НСl, Н2О,
многие органические вещества, благородные газы Ar, Хе и др.
Кристаллическая структура I2
• Высокие значения к.ч. , например, для аргона (Аr) к.ч. = 12.
Наличие водородных связей (Н2О, NH3, НСl) повышает Екр, Тпл.,
механическую прочность, приводит к уменьшению к. ч.
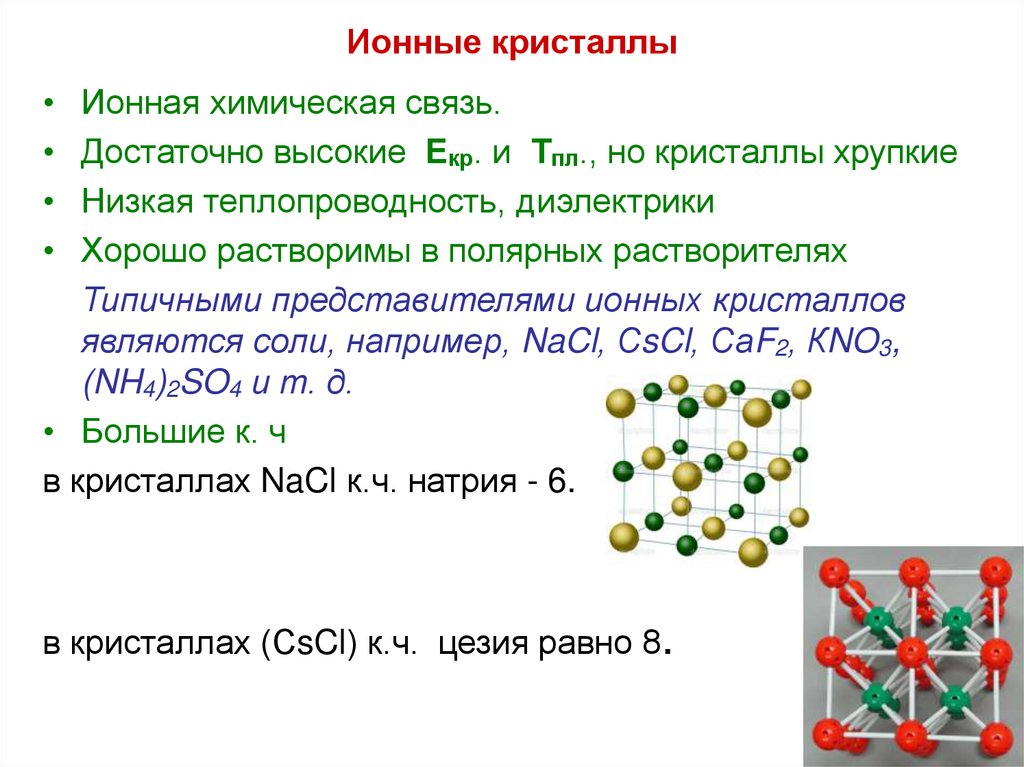
27. Ионные кристаллы
Ионная химическая связь.
Достаточно высокие Екр. и Тпл., но кристаллы хрупкие
Низкая теплопроводность, диэлектрики
Хорошо растворимы в полярных растворителях
Типичными представителями ионных кристаллов
являются соли, например, NaCl, СsCl, СаF2, КNO3,
(NH4)2SO4 и т. д.
• Большие к. ч
в кристаллах NaCl к.ч. натрия - 6.
в кристаллах (СsCl) к.ч. цезия равно 8.
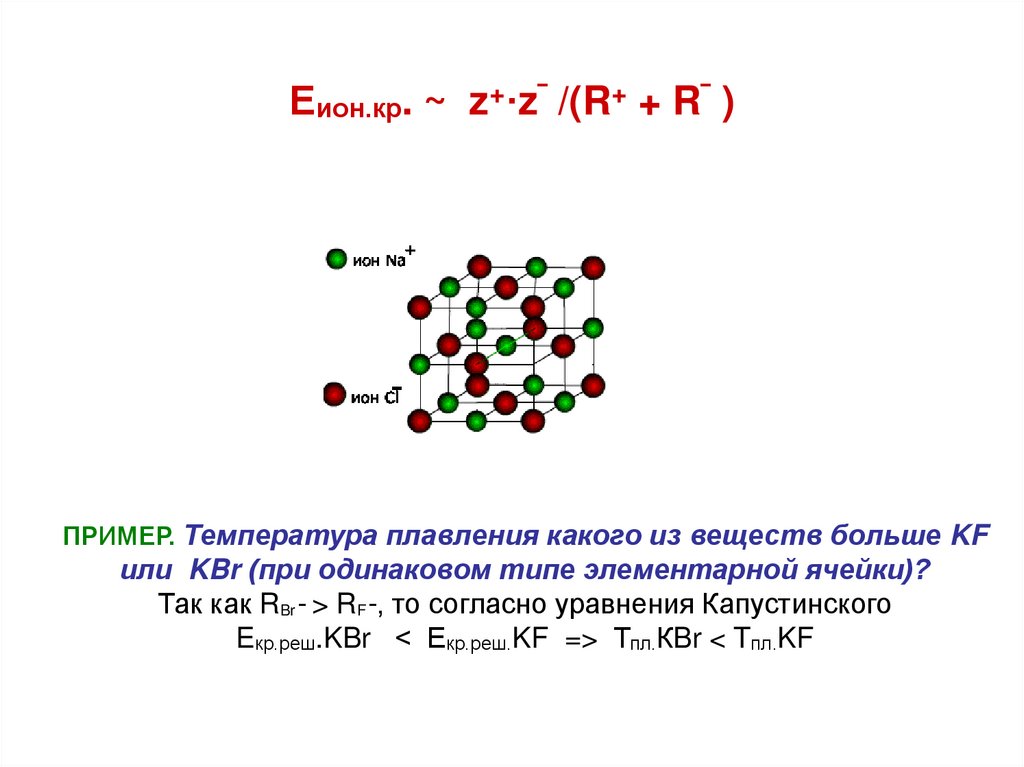
28. Еион.кр. ~ z+·z‾ /(R+ + R‾ )
ПРИМЕР. Температура плавления какого из веществ больше KFили KBr (при одинаковом типе элементарной ячейки)?
Так как RBr ‾ > RF ‾, то согласно уравнения Капустинского
Eкр.реш.KBr < Екр.реш.KF => Тпл.КBr < Tпл.KF
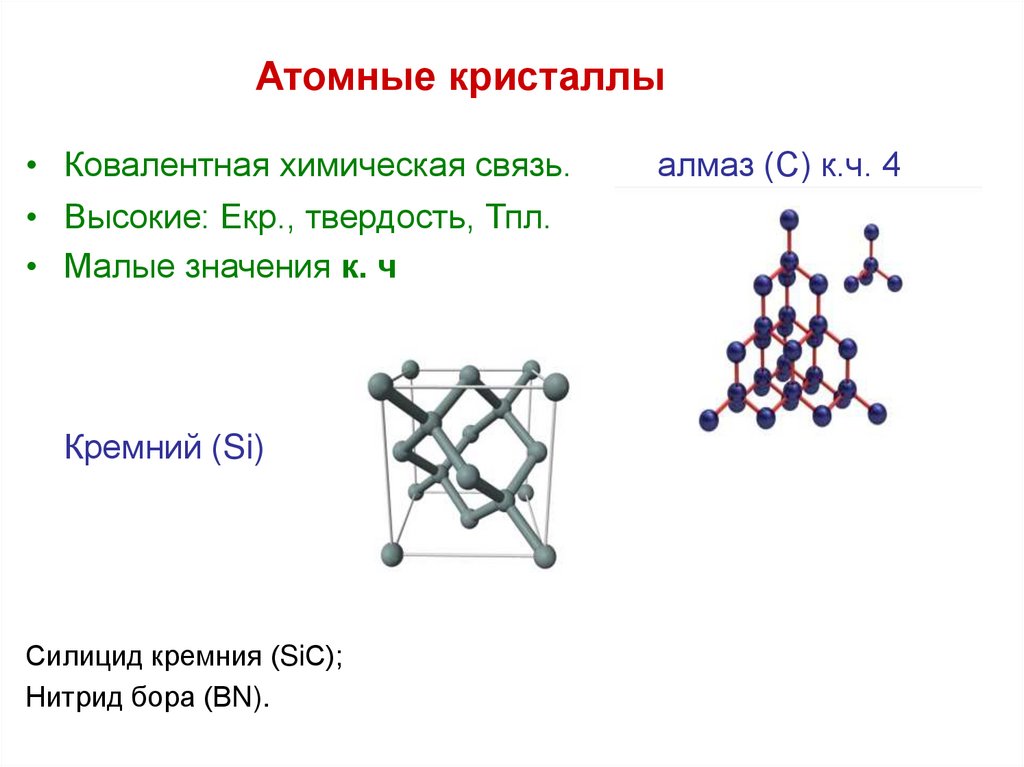
29. Атомные кристаллы
• Ковалентная химическая связь.• Высокие: Екр., твердость, Тпл.
• Малые значения к. ч
Кремний (Si)
Силицид кремния (SiС);
Нитрид бора (ВN).
алмаз (С) к.ч. 4
30. Металлические кристаллы
• Металлическая связь• Высокие к. ч., Например, для Мg и Рb к.ч. = 12,
для W к.ч. = 8.
Характерный блеск и высокая отражательная способность поверхности
Высокие тепло- и электропроводность
Пластичность при механических деформациях, ковкость
Большое разнообразие элементов, образующих металлические решетки
(s,р-элементы, все d- и f-элементы).
Специфика свойств d- и f-металлов объясняется возможностью участия
электронов предвнешнего уровня во взаимодействии с ионами решетки.
Типичными примерами различий в некоторых свойствах являются жидкая
ртуть(Нg), тугоплавкий вольфрам (W) с температурой плавления более
3500°С.
Имеются мягкие металлы (натрий – s-элемент, галлий – р-элемент) и
обладающие очень высокой твердостью (рений – d-элемент).
31. Кристаллы с несколькими типами связи
В большинстве кристаллических тел имеются несколько типов связи, а не
один единственный.
Не существует ионной или ковалентной связи в чистом идеальном виде. В
реальных химических соединениях всегда имеется доля как ионной, так и
ковалентной составляющей.
В металлах d- и f-электроны дают ковалентную составляющую в
металлическую связь.
Силы Ван-дер-Ваальса присутствуют во всех типах кристаллов.
В реальных же кристаллах всегда наблюдаются отклонения от идеального
регулярного расположения частиц в узлах кристаллической решетки и
имеются примеси других веществ.
Неконтролируемая дефектность кристаллической решетки ухудшает
эксплуатационные характеристики материалов. А специальным
направленным введением определенных добавок в структуру основного
материала (матрицы) добиваются синтеза новых материалов с уникальными
полезными свойствами.
К таким материалам относятся, например, жаростойкие химически стойкие
сорта стали при введении в железо (Fе) некоторых других металлов.
Современная электронная техника базируется на легированных
полупроводниковых материалах – германии (Gе), кремнии (Si) с добавками
бора (В), фосфора (Р) и других веществ. Получение новых уникальных
высокотемпературных сверхпроводящих материалов в конце ХХ века было
достигнуто введением специальных добавок в матрицы оксидов и сульфидов
металлов.
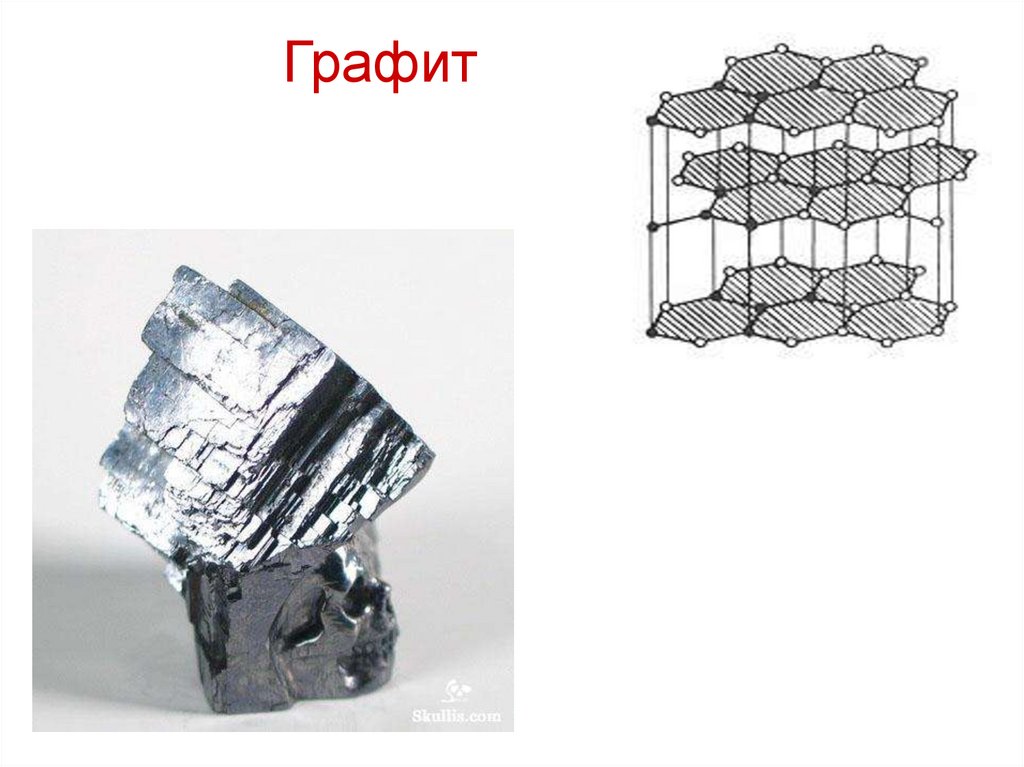
32. Графит
В графите действуют два типа связи: наряду с прочными ковалентными
связями в одном направлении кристаллической решетки, в другом
направлении действуют лишь слабые силы Ван-дер-Ваальса. Как показано
на рисунке графит состоит из плоских чередующихся слоев углеродных
атомов, несколько смещенных друг относительно друга. Причем, третий
слой повторяет первый.
Внутри слоя каждый из атомов углерода, находящийся в состоянии sр2гибридизации, связан с тремя соседними атомами углерода (к.ч. = 3) тремя
короткими прочными s-связями. Кроме того, четвертые электроны каждого
из атомов углерода образуют систему p-связей по всему плоскому слою.
Расстояние между слоями превышает расстояние между соседними
атомами углерода в слое примерно в 2,5 раза. А связь между слоями
осуществляется слабым межмолекулярным взаимодействием.
Наличие двух типов связи в графите обусловливает его свойства. Графит
обладает одной из самых высоких температур плавления и в большинстве
случаев химически малоактивенй. Эти свойства объясняются образованием
системы устойчивых, с высокими энергиями связи и малой длиной связи,
неполярных ковалентных химических связей углерод-углерод внутри
плоских слоев. Высокая электропроводность графита обусловлена
делокализованными подвижными p-электронами – они легко перемещаются
вдоль слоев при наложении разности потенциалов. Причем,
электропроводность в кристаллической решетке графита вдоль оси слоя на
несколько порядков превышает электропроводность в поперечном
направлении. Графит легко деформируется и обладает малым значением
плотности вследствие слабых связей между слоями и большого расстояния
между ними.
33. Графит
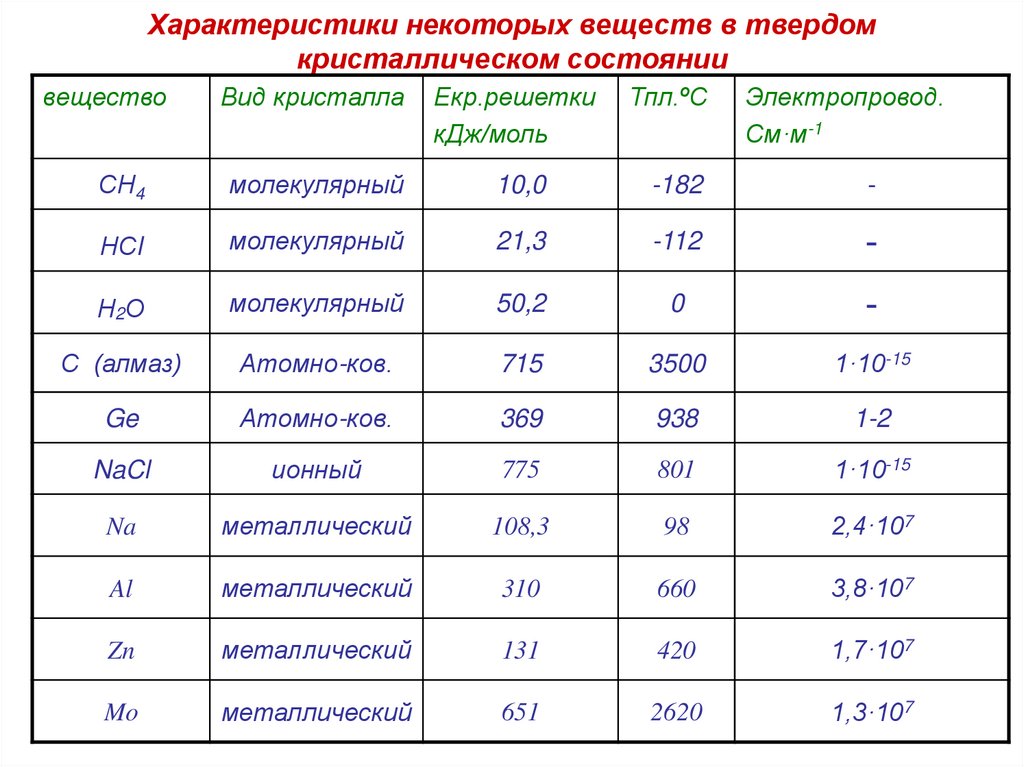
34. Характеристики некоторых веществ в твердом кристаллическом состоянии
веществоВид кристалла
Екр.решетки
кДж/моль
Тпл.ºС
Электропровод.
См·м-1
СН4
молекулярный
10,0
-182
-
НСl
молекулярный
21,3
-112
-
Н2О
молекулярный
50,2
0
-
С (алмаз)
Атомно-ков.
715
3500
1·10-15
Ge
Атомно-ков.
369
938
1-2
NaCl
ионный
775
801
1·10-15
Na
металлический
108,3
98
2,4·107
Al
металлический
310
660
3,8·107
Zn
металлический
131
420
1,7·107
Mo
металлический
651
2620
1,3·107
35. ПРИМЕР. Какова природа сил взаимодействия между частицами в кристаллах Li и Мо ? Какие физико – химические свойства характерны
для этого типа кристаллов? У какого изэтих веществ больше энергия кристаллической решетки и
выше температура плавления?
• Li – s- металл, с металлическим типом кристалла:
атомы связаны металлической связью.
• Мо – d-металл, со смешанным типом кристалла:
атомы из-за наличия большого количества валентных
электронов связаны не только металлической
связью но и дополнительными локализованными
ковалентными связями.
• Поэтому Мо имеет большую Екрист.реш и
следовательно, его труднее разрушить и его Тпл.
выше.

![Состав комплекса: [Сu (NH3)4]2+ Комплексообразователь Сu2+ и лиганд NH3 Состав комплекса: [Сu (NH3)4]2+ Комплексообразователь Сu2+ и лиганд NH3](https://cf2.ppt-online.org/files2/slide/4/4cJU0fhMi7w8bO1SLIs2g9V6EketojKvuaxDzr/slide-1.jpg)

![Комплекс [AlBr4] Комплекс [AlBr4]](https://cf2.ppt-online.org/files2/slide/4/4cJU0fhMi7w8bO1SLIs2g9V6EketojKvuaxDzr/slide-3.jpg)
![Комплекс [Ag(CN)2]– Комплекс [Ag(CN)2]–](https://cf2.ppt-online.org/files2/slide/4/4cJU0fhMi7w8bO1SLIs2g9V6EketojKvuaxDzr/slide-4.jpg)


![Комплекс [Fe(CN)6]3- Комплекс [Fe(CN)6]3-](https://cf2.ppt-online.org/files2/slide/4/4cJU0fhMi7w8bO1SLIs2g9V6EketojKvuaxDzr/slide-9.jpg)

![Комплекс [Co(Н2О)6]2+ Комплекс [Co(Н2О)6]2+](https://cf2.ppt-online.org/files2/slide/4/4cJU0fhMi7w8bO1SLIs2g9V6EketojKvuaxDzr/slide-11.jpg)
![комплекс [Au(NH3)4]3+ комплекс [Au(NH3)4]3+](https://cf2.ppt-online.org/files2/slide/4/4cJU0fhMi7w8bO1SLIs2g9V6EketojKvuaxDzr/slide-12.jpg)
![комплекс [NiCl 4]2- комплекс [NiCl 4]2-](https://cf2.ppt-online.org/files2/slide/4/4cJU0fhMi7w8bO1SLIs2g9V6EketojKvuaxDzr/slide-13.jpg)
![(исключение!) комплекс [Сu(NH3)4]2+ (исключение!) комплекс [Сu(NH3)4]2+](https://cf2.ppt-online.org/files2/slide/4/4cJU0fhMi7w8bO1SLIs2g9V6EketojKvuaxDzr/slide-14.jpg)









 Химия
Химия