Похожие презентации:
Химическая связь. Валентность элементов в ковалентных соединениях. Степень окисления элементов
1.
Образовательный центр«ПАРАМИТА»
2. Лекция №4
ЛЕКЦИЯ №4Тема:
Химическая
связь
Валентность элементов в
ковалентных соединениях
Степень окисления элементов
3.
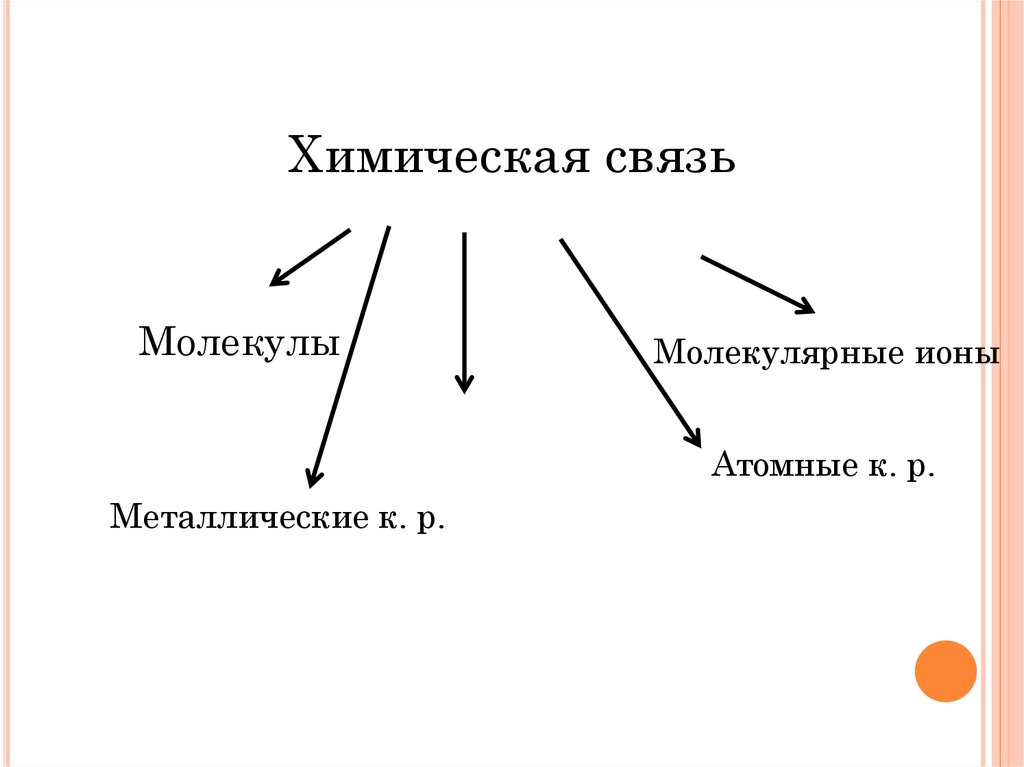
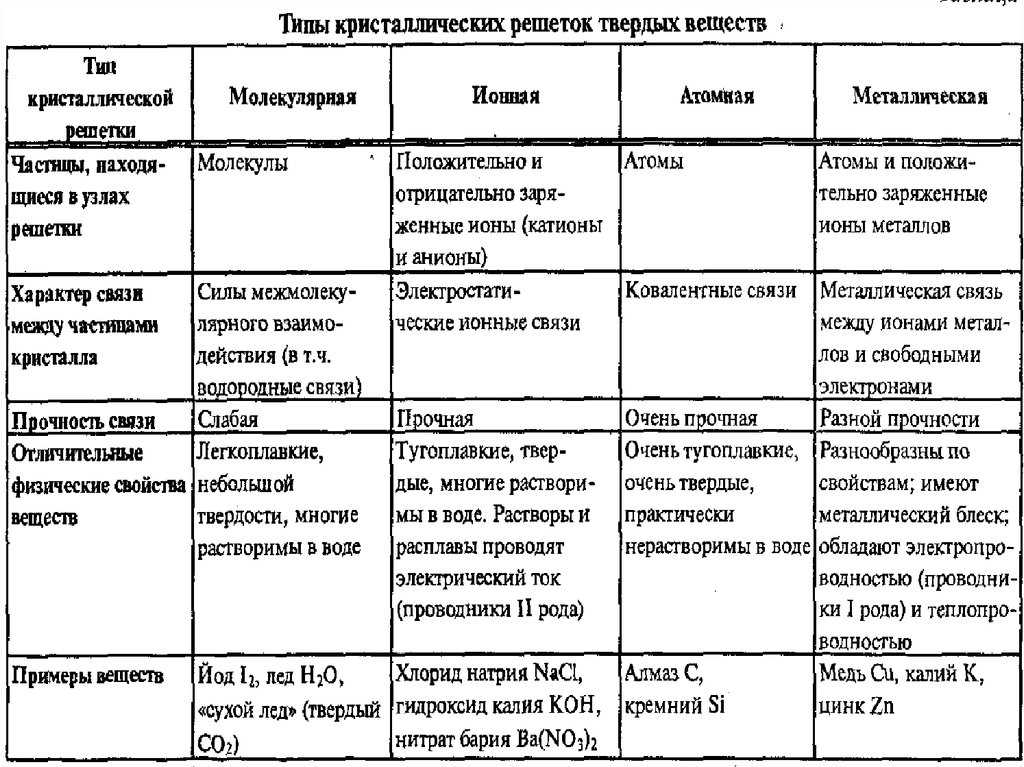
Химическая связьМолекулы
Молекулярные ионы
Ионные к. р.
Атомные к. р.
Металлические к. р.
4. Понятие валентных электронов
ПОНЯТИЕ ВАЛЕНТНЫХ ЭЛЕКТРОНОВ5. Виды химической связи
ВИДЫ ХИМИЧЕСКОЙ СВЯЗИКовалентная
Ионная
Металлическая
Водородная
6. Ковалентная связь (обменный механизм)
КОВАЛЕНТНАЯ СВЯЗЬ(ОБМЕННЫЙ МЕХАНИЗМ)
Теория ковалентной связи: «Химическая связь
возникает в результате образования общих
электронных пар между
взаимодействующими атомами».
7. Образование молекулы водорода
ОБРАЗОВАНИЕ МОЛЕКУЛЫ ВОДОРОДА8. Образование молекулы хлора
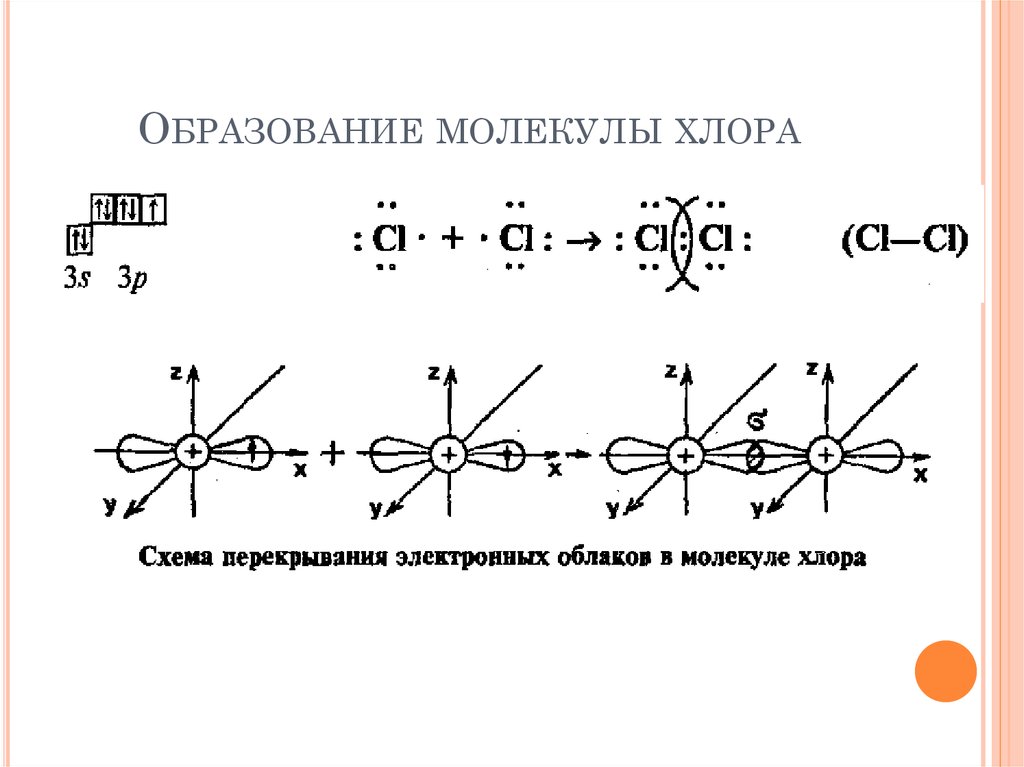
ОБРАЗОВАНИЕ МОЛЕКУЛЫ ХЛОРА9.
10.
11.
12.
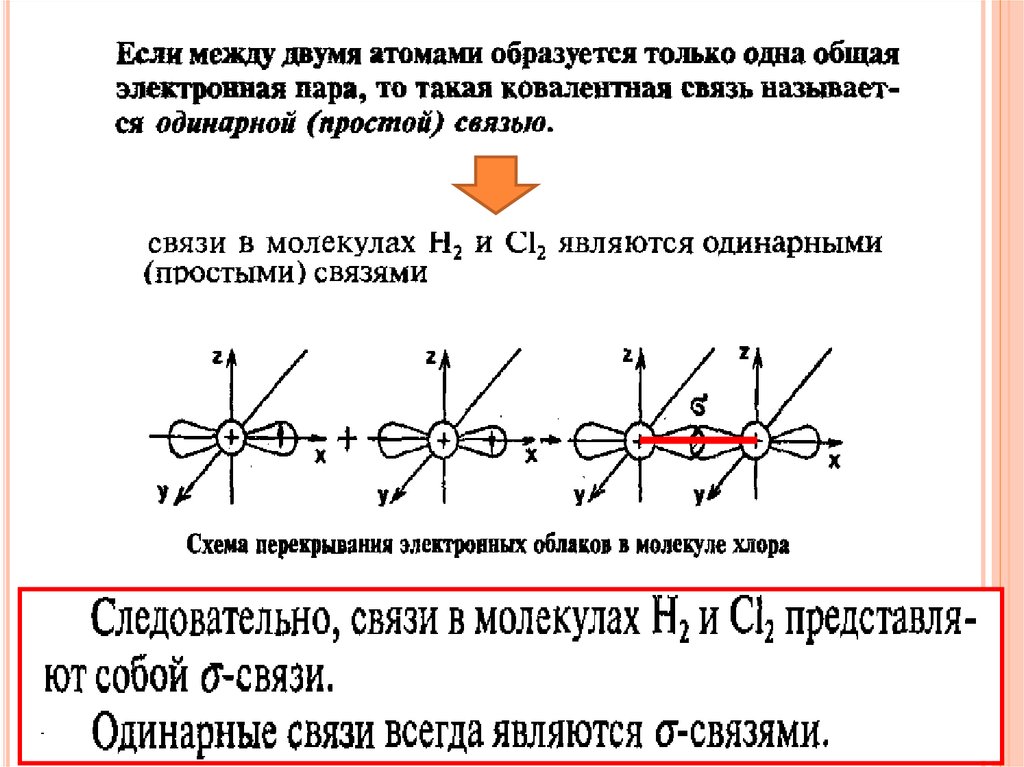
Двойная связь – связь между двумя атомамиобразована двумя общими электронными
парами
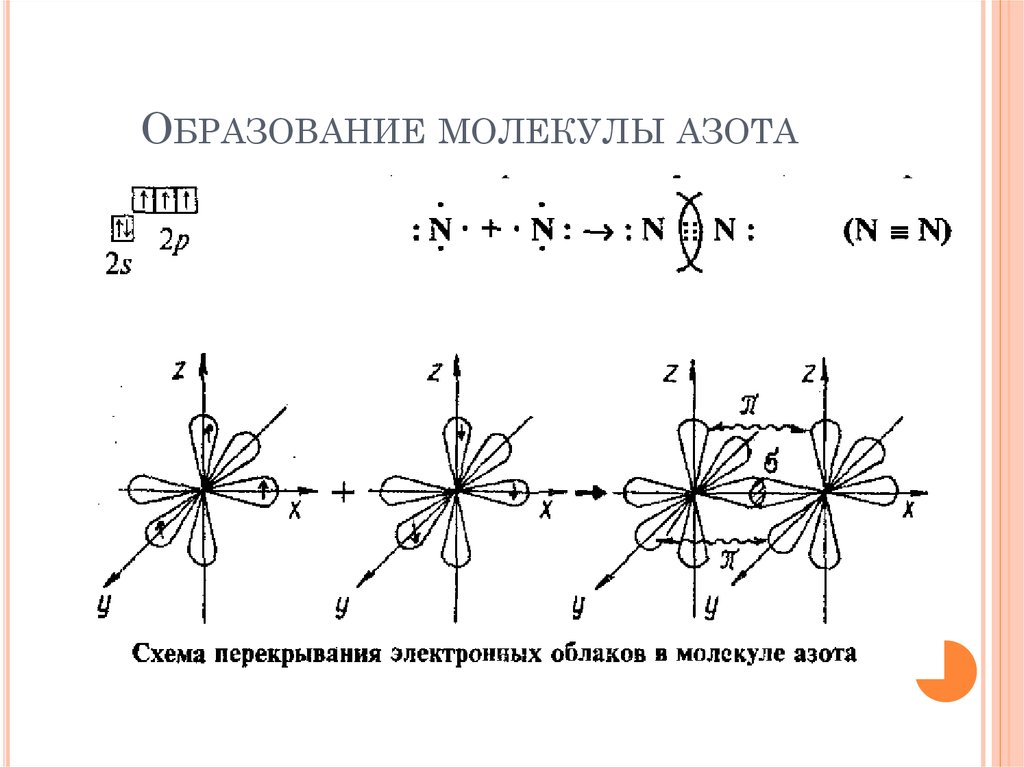
Тройная связь - связь между двумя атомами
образована тремя общими электронными
парами
13. Образование молекулы азота
ОБРАЗОВАНИЕ МОЛЕКУЛЫ АЗОТА14. Полярность связи
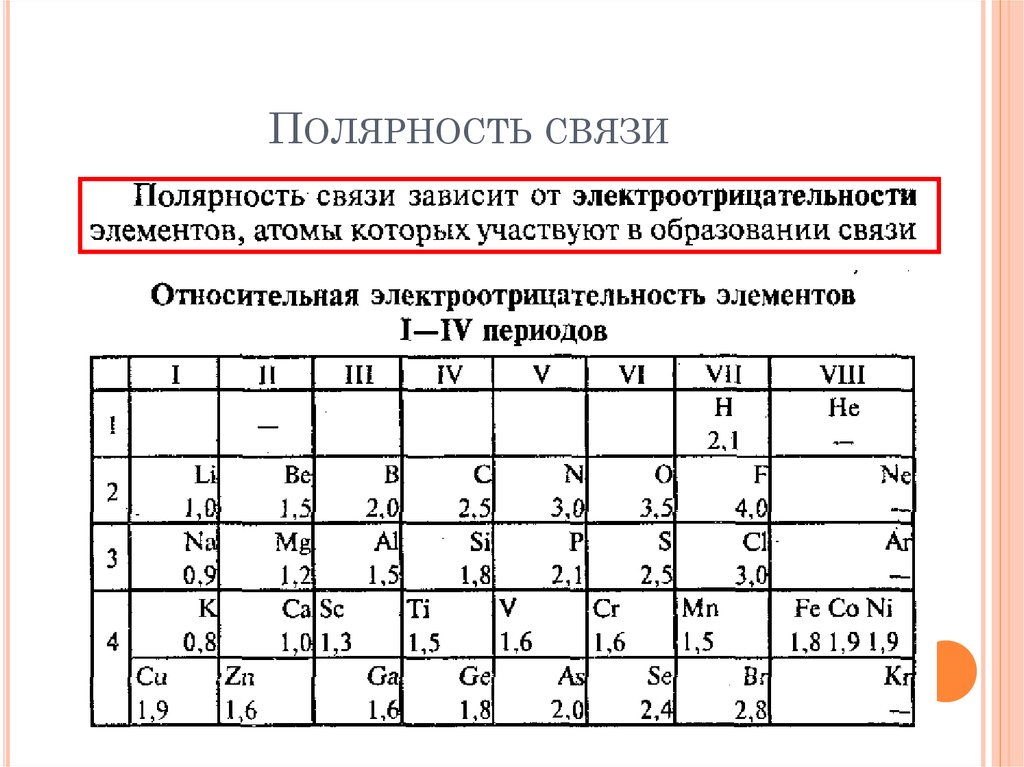
ПОЛЯРНОСТЬ СВЯЗИ15. Полярность связи
ПОЛЯРНОСТЬ СВЯЗИ16. Полярность связи
ПОЛЯРНОСТЬ СВЯЗИ17. Полярность связи
ПОЛЯРНОСТЬ СВЯЗИПолярная
молекула = диполь
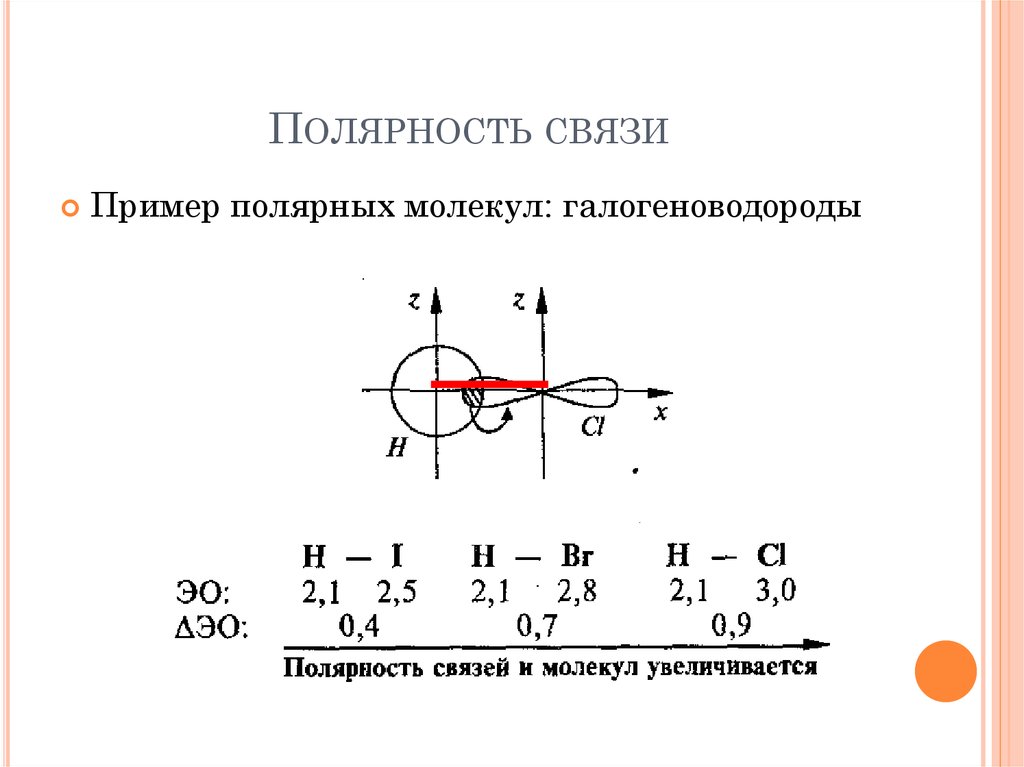
18. Полярность связи
ПОЛЯРНОСТЬ СВЯЗИПример полярных молекул: галогеноводороды
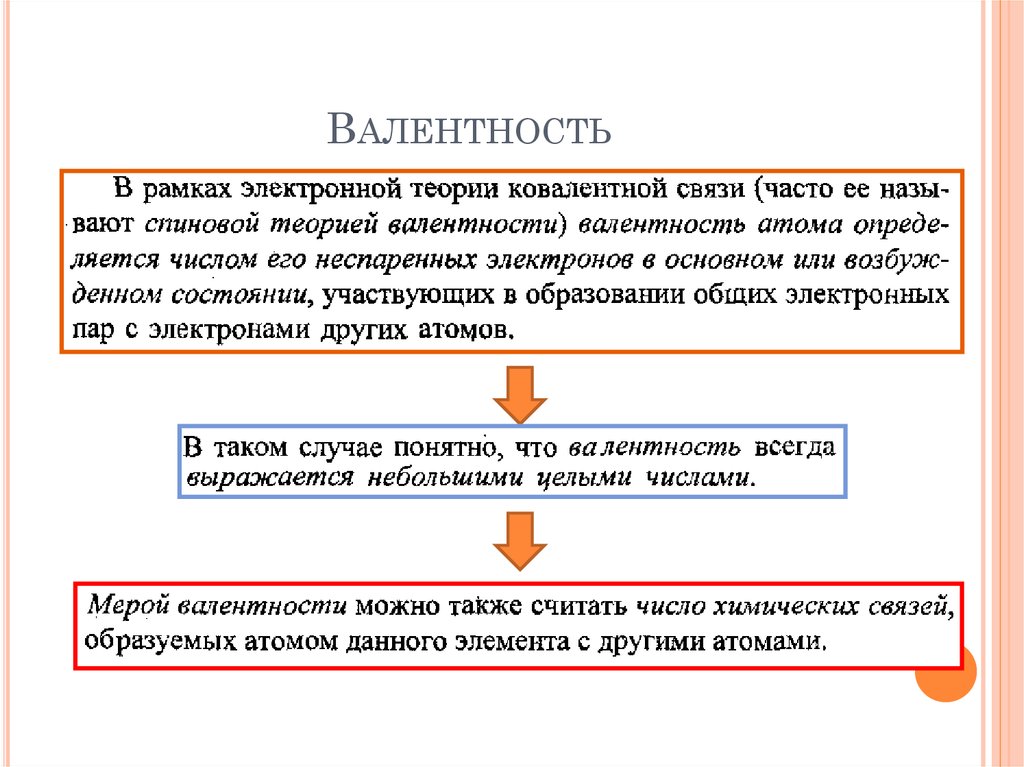
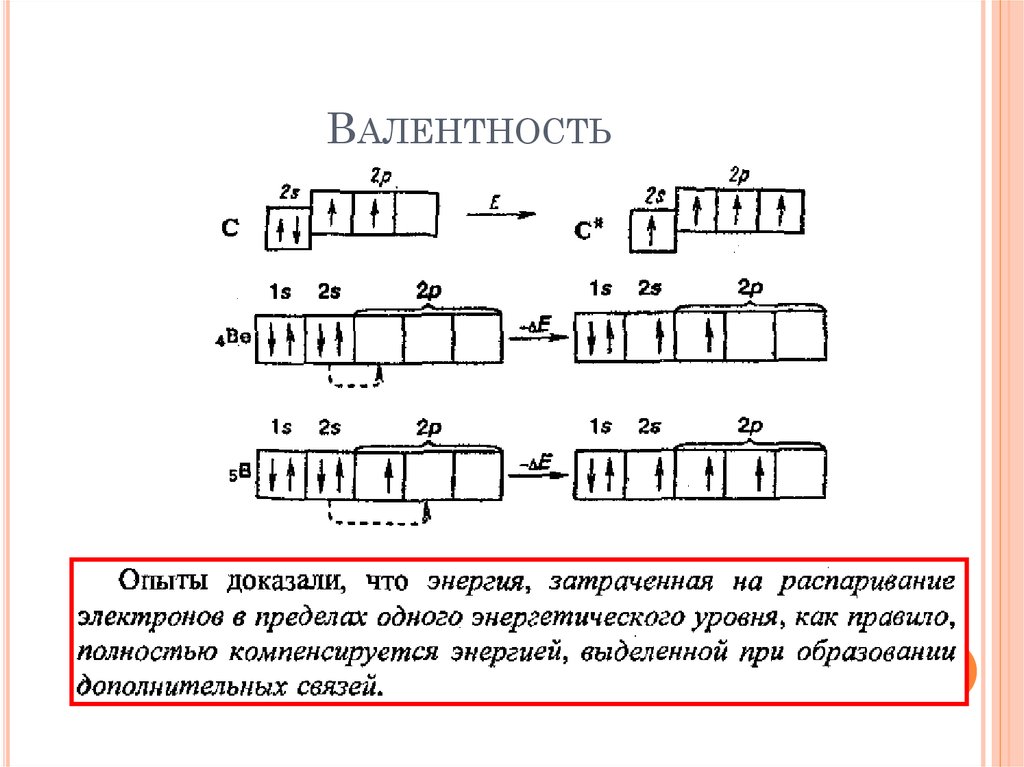
19. Валентность
ВАЛЕНТНОСТЬ20. Валентность
должнаРавняться числу
неспаренных
электронов
ВАЛЕНТНОСТЬ
21. Валентность
ВАЛЕНТНОСТЬ22. Валентность
ВАЛЕНТНОСТЬ23. Ковалентная связь (донорно-акцепторный механизм)
КОВАЛЕНТНАЯ СВЯЗЬ(ДОНОРНО-АКЦЕПТОРНЫЙ
МЕХАНИЗМ)
!
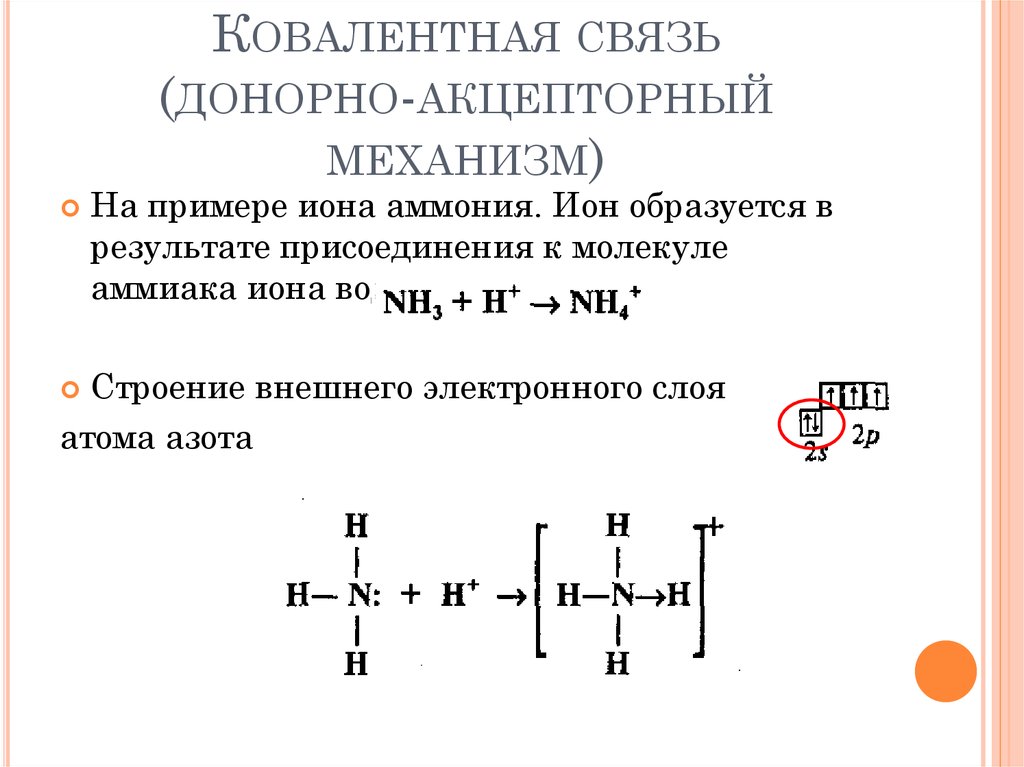
24. Ковалентная связь (донорно-акцепторный механизм)
КОВАЛЕНТНАЯ СВЯЗЬ(ДОНОРНО-АКЦЕПТОРНЫЙ
МЕХАНИЗМ)
На примере иона аммония. Ион образуется в
результате присоединения к молекуле
аммиака иона водорода.
Строение внешнего электронного слоя
атома азота
25. Ковалентная связь (донорно-акцепторный механизм)
КОВАЛЕНТНАЯ СВЯЗЬ(ДОНОРНО-АКЦЕПТОРНЫЙ
МЕХАНИЗМ)
26. Ковалентная связь (донорно-акцепторный механизм)
КОВАЛЕНТНАЯ СВЯЗЬ(ДОНОРНО-АКЦЕПТОРНЫЙ
МЕХАНИЗМ)
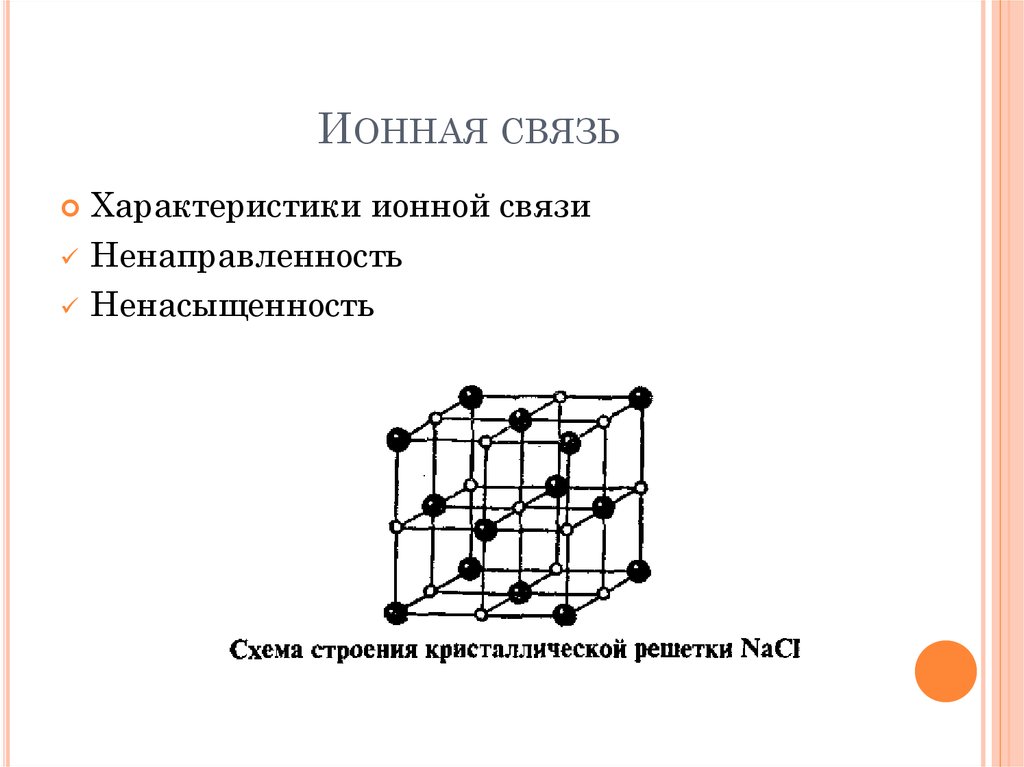
27. Ионная связь
ИОННАЯ СВЯЗЬ28. Ионная связь
ИОННАЯ СВЯЗЬИонную связь можно рассматривать как
крайний случай ковалентной полярной связи
Наименьшая ЭО у Ме
Наибольшая ЭО у неметаллов
29. Ионная связь
ИОННАЯ СВЯЗЬНа примере хлорида натрия
30. Ионная связь
ИОННАЯ СВЯЗЬХарактеристики ионной связи
Ненаправленность
Ненасыщенность
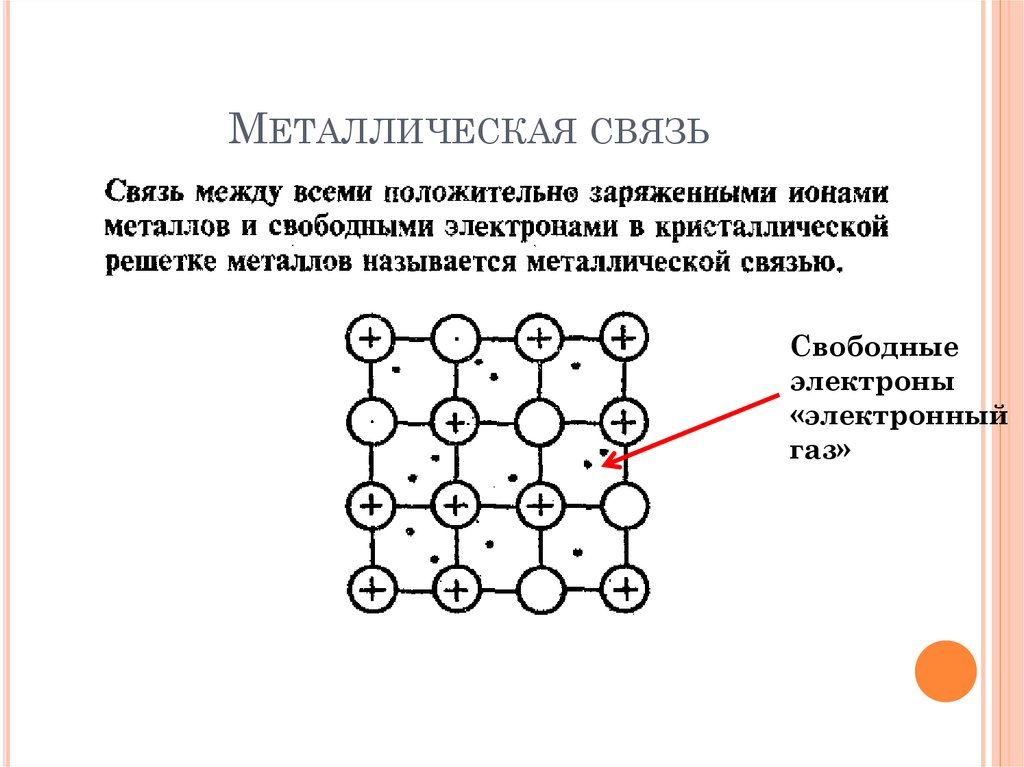
31. Металлическая связь
МЕТАЛЛИЧЕСКАЯ СВЯЗЬСвободные
электроны
«электронный
газ»
32. Водородная связь (межмолекулярная)
ВОДОРОДНАЯ СВЯЗЬ(МЕЖМОЛЕКУЛЯРНАЯ)
Ассоциаты молекул
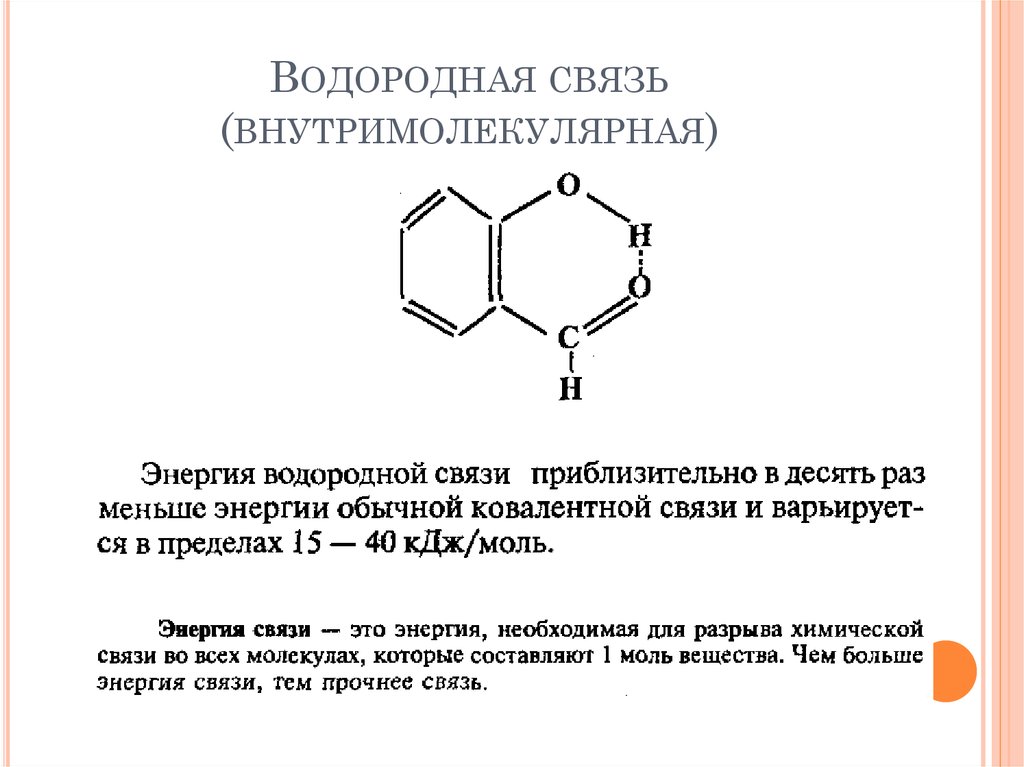
33. Водородная связь (внутримолекулярная)
ВОДОРОДНАЯ СВЯЗЬ(ВНУТРИМОЛЕКУЛЯРНАЯ)
34.
35.
36.
37.
38.
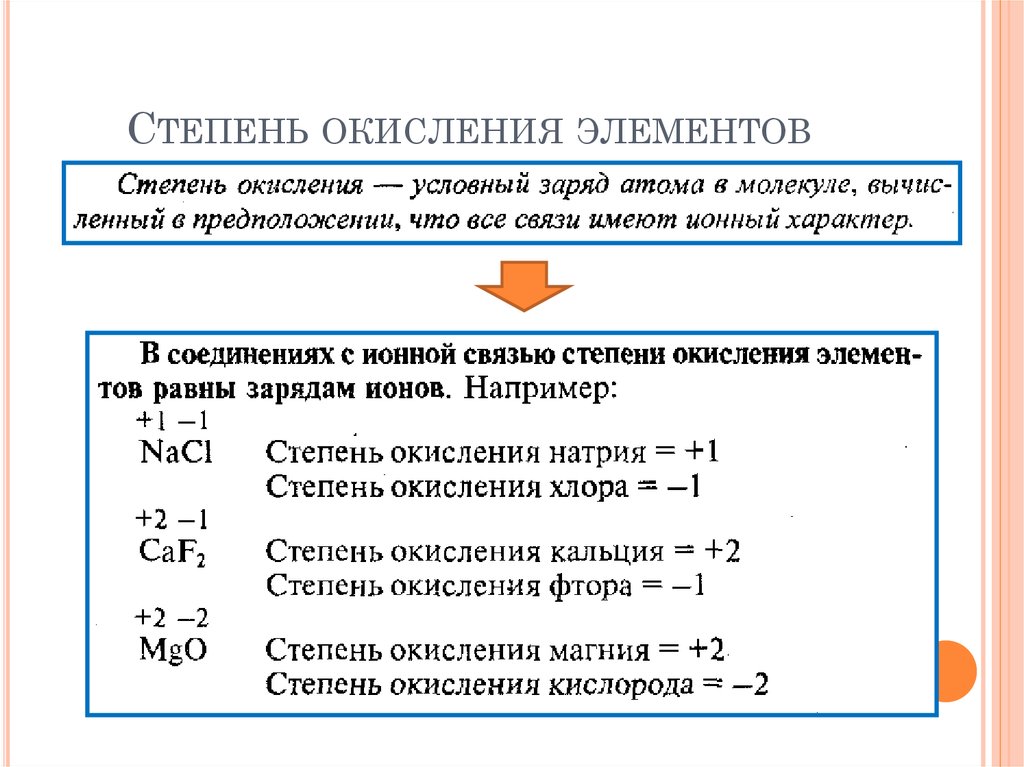
39. Степень окисления элементов
СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ40. Степень окисления элементов
СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ41. Степень окисления элементов
СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВПравила:
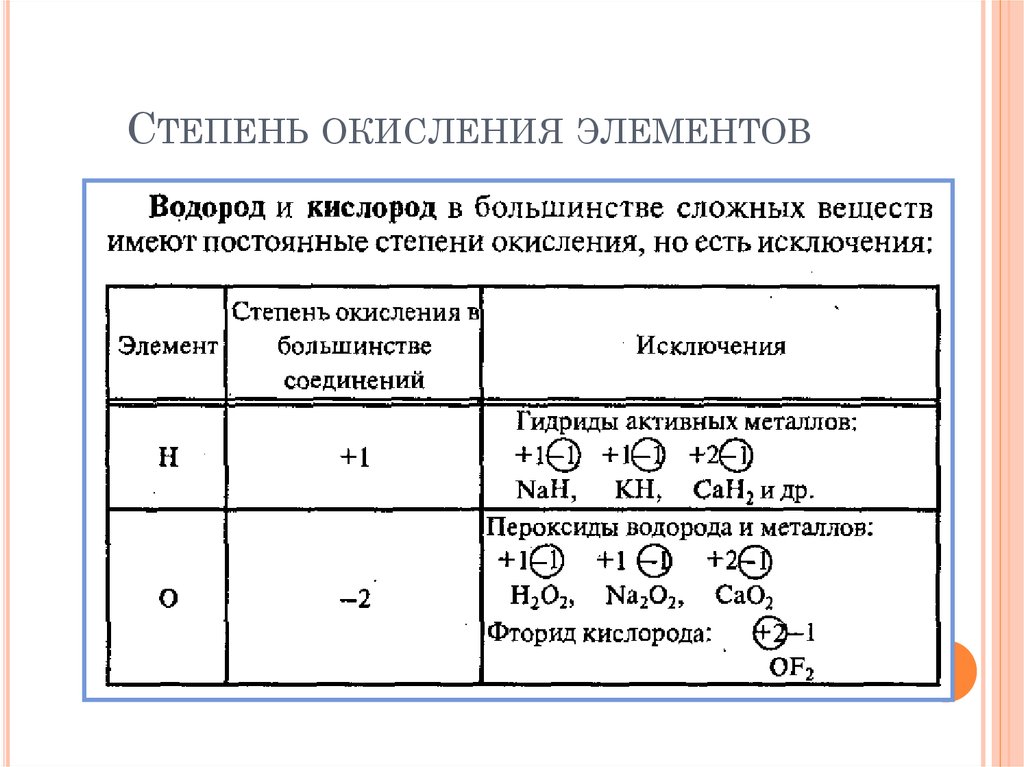
42. Степень окисления элементов
СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВЭлементы с постоянной степенью окисления
































 Химия
Химия








