Похожие презентации:
Вуглеводи. Класифікація вуглеводів
1. ВУГЛЕВОДИ
• Вуглеводами називаються сполуки з загальноюформулою Сn(Н2О)m, з чим і пов'язана їх назва
(К.Шмідт,1844) - вуглець (С) і вода (Н2О). За хімічною
класифікацією
вуглеводи
відносяться
до
гідроксиальдегідів або до гідроксикетонів, тобто до
сполук, що містять одночасно гідроксильні та
карбонільні
групи.
Вуглеводи
ще
називають
сахаридами або цукрами. Вони широко розповсюджені
у рослинному і тваринному світі і мають важливе
значення у життєвих процесах, як джерело енергії для
біологічних систем.
2.
КЛАСИФІКАЦІЯ ВУГЛЕВОДІВВуглеводи діляться на дві великі групи:
1 - Моносахариди (монози));
2 - Полісахариди (поліози).
Моносахариди, у свою чергу класифікують за кількістю
атомів вуглецю у молекулі – триози, тетрози, пентози,
гексози, або за природою функціональних груп (альдози та
кетози). Альдози містять альдегідну та гідросильні, а
кетози – кетонну та гідроксильні функціональні групи.
Полісахариди, в свою чергу, бувають: цукроподібні або
олігосахариди (дисахариди, трисахариди, пентасахариди
тощо) і нецукроподібні (крохмаль, целюлоза, декстрани).
3. У природі найбільш поширені два види моноз: пентози С5Н10О5 та гексози С6Н12О6. Найчастіше зустрічаються монози, що мають D-конфігурацію. Відне
У природі найбільш поширені два видимоноз: пентози С5Н10О5 та гексози
С6Н12О6.
Найчастіше зустрічаються монози, що
мають D-конфігурацію. Віднесення вуглеводів до D- або L-ряду базується на
конфігурації нижнього асиметричного
вуглецевого атома, на відміну від
гідроксикислот і амінокислот.
4. Генетичний ряд альдоз D-ряду
CHOH
OH
CH2OH
D-Гліцериновий альдегід
CHO
CHO
H
OH
HO
H
OH
H
CH2OH D-Еритроза
H
OH
CH2OH D-Треоза
Тетрози
CHO
CHO
H
OH
H
OH
HO
H
OH
OH
H
HO
OH
H
OH
H
H
H
D-Рибоза
HO
H
HO
H
CH2OH
CH2OH
D-Ликсоза
D-Ксилоза
D-Арабіноза
OH
H
OH
H
CH2OH
CH2OH
CHO
CHO
Пентози
CHO
CHO
CHO
CHO
CHO
OH HO
H
H
OH HO
HO
H
H
OH
H
OH HO
H
H
OH
H
OH HO
H
H
OH
H
OH
H
OH
H
OH HO
H
H
OH
H
OH
H
OH
H
OH
OH
CH2OH
D-Алоза
о
(+14 )
CH2OH
D-Альтроза
о
(+33 )
H
CH2OH
D-Глюкоза
о
(+52,7 )
H
CH2OH
D-Маноза
о
(+14 )
CH2OH
D-Гулоза
о
(-20 )
Гексози
H
H
HO
H
(+15 )
OH HO
H
H
HO
H
H
H
HO
H
CH2OH
о
H
OH HO
OH
D-Ідоза
CHO
CHO
CHO
HO
H
OH
CH2OH
D-Галактоза
о
(+80 )
H
OH
CH2OH
D-Талоза
о
(+21 )
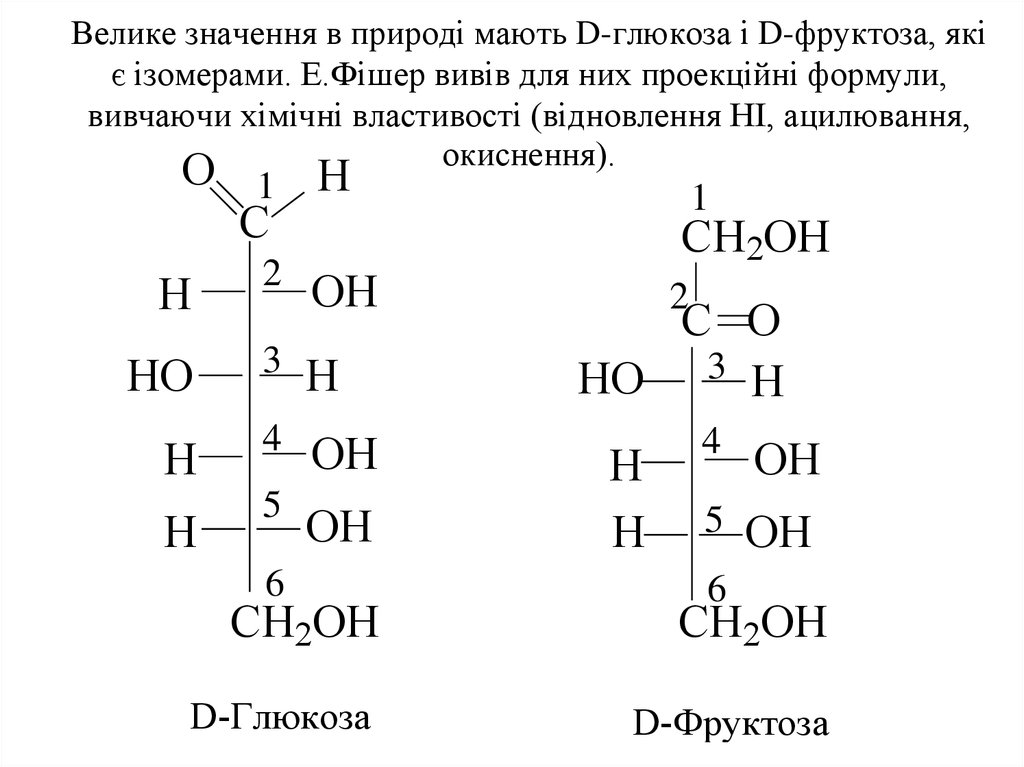
5. Велике значення в природі мають D-глюкоза і D-фруктоза, які є ізомерами. Е.Фішер вивів для них проекційні формули, вивчаючи хімічні властивос
Велике значення в природі мають D-глюкоза і D-фруктоза, якіє ізомерами. Е.Фішер вивів для них проекційні формули,
вивчаючи хімічні властивості (відновлення НІ, ацилювання,
окиснення).
O 1 H
C
H
2
HO
3
H
H
4
OH
H
5
OH
OH
6
1
CH2OH
2
C O
HO 3 H
H
H
4
OH
5
OH
6
CH2OH
CH2OH
D-Глюкоза
D-Фруктоза
6. В молекулі глюкози є 4 асимметричних атоми вуглецю, тому вона має 24=16 оптичних ізомерів. З них 8 належать до D-ряду і 8 до L-ряду. Нагадаємо, що в
В молекулі глюкози є 4 асимметричнихатоми вуглецю, тому вона має 24=16
оптичних ізомерів. З них 8 належать до Dряду і 8 до L-ряду. Нагадаємо, що
віднесення вуглеводів до D або L-ряду
здійснюється
на підставі конфігурації
останнього (п‘ятого) асиметричного атома
вуглецю.
7. В молекулах як глюкози, та і фруктози є по 5 гідроксильних груп. Було встановлено, що один гідроксил за хімічними властивостями відрізняєть
В молекулах як глюкози, та і фруктози є по5 гідроксильних груп. Було встановлено,
що один гідроксил за хімічними
властивостями відрізняється від чотирьох
інших —ОН (він більш реакційноздатний).
Крім того, глюкоза і фруктоза, хоча і
містять карбонільні групи, але не реагують
з натрій гідросульфітом NaHSO3.
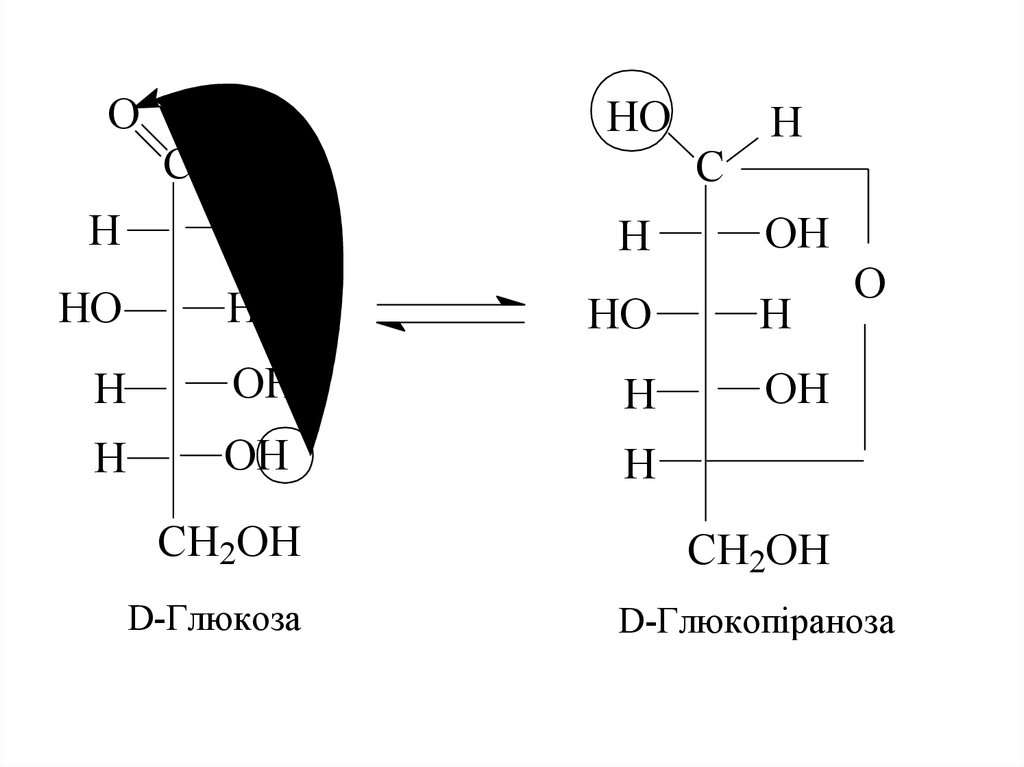
8. Причиною такої аномальної поведінки цих сполук є утворення циклічних або напівацетальних форм за рахунок взаємодії карбонільної групи з
Причиною такої аномальної поведінки цихсполук є утворення циклічних або
напівацетальних форм за рахунок взаємодії
карбонільної групи з одним із гідроксилів.
Отже, існує інша форма моноз, так звана
циклічна або напівацетальна, або
кільчаста, або форма Коллі-Толленса, що
утворюється, як показано на схемі.
9.
OC
H
HO
H
НO
C
OH
H
H
HO
H
OH
H
H
OH
H
CH2OH
D-Глюкоза
H
OH
H
O
OH
CH2OH
D-Глюкопіраноза
10.
CH2OHO C
HO
H
H
H
OH
OH
CH2OH
HO C
H O
HO
H
OH
CH2OH
CH2OH
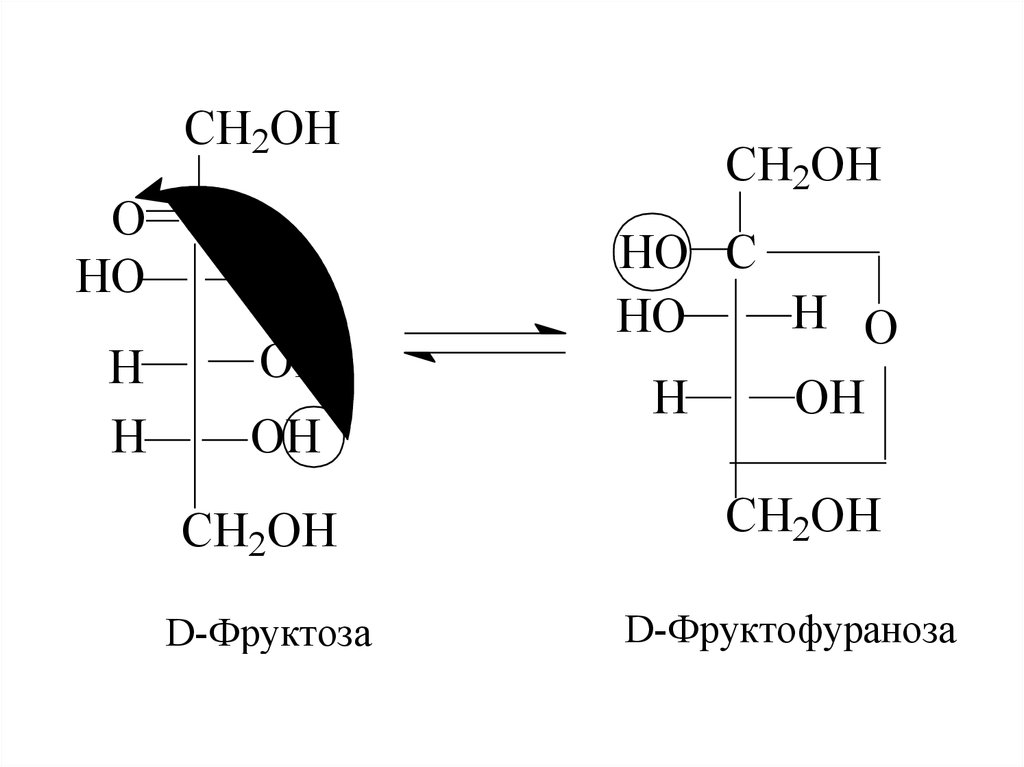
D-Фруктоза
D-Фруктофураноза
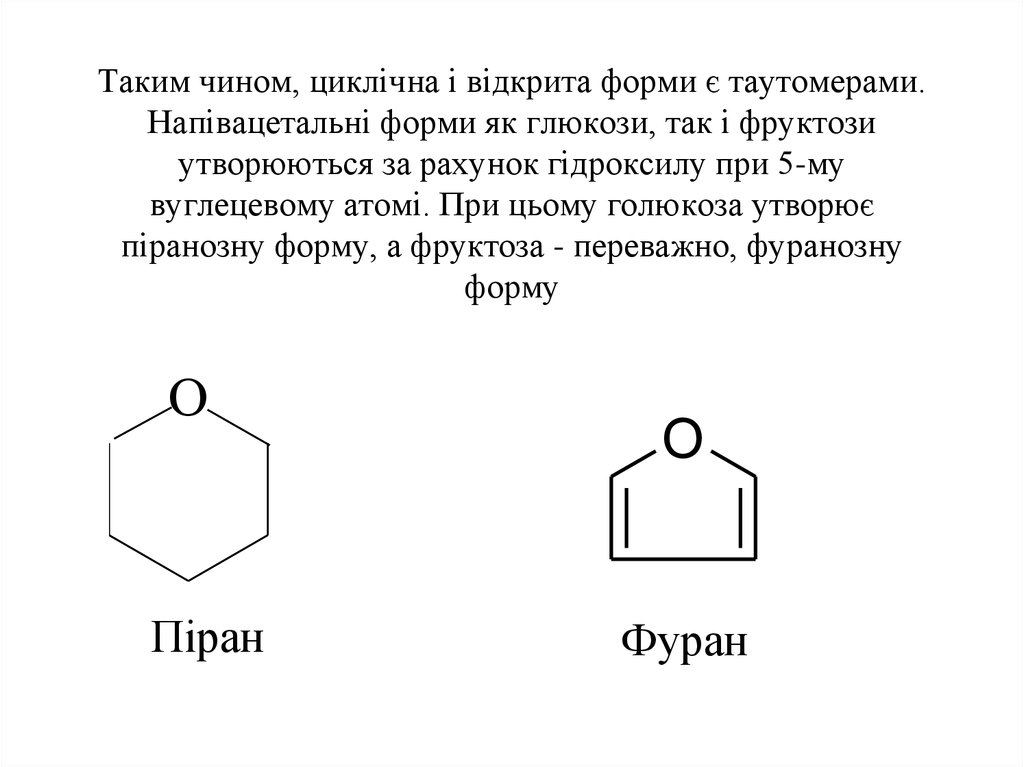
11. Таким чином, циклічна і відкрита форми є таутомерами. Напівацетальні форми як глюкози, так і фруктози утворюються за рахунок гідроксилу пр
Таким чином, циклічна і відкрита форми є таутомерами.Напівацетальні форми як глюкози, так і фруктози
утворюються за рахунок гідроксилу при 5-му
вуглецевому атомі. При цьому голюкоза утворює
піранозну форму, а фруктоза - переважно, фуранозну
форму
O
Піран
O
Фуран
12. Утворений при циклізації напівацетальний гідроксил і є тим, що відрізняється за хімічними властивостями від чотирьох інших –ОН-груп. Його
називаютьглікозидним, а для глюкози ще й
глюкозидним гідроксилом (у формулах він
обведений кружечком).
13. Просторову будову моносахаридів у циклічній формі зручно зображати перспективними формулами У.Хеуорса (1929). При побудові формули Хеуорса
Просторову будову моносахаридів у циклічнійформі зручно зображати перспективними
формулами У.Хеуорса (1929). При побудові
формули Хеуорса гетероцикл малюють у
горизонтальній площині, причому так, щоб
гетероатом кисню був якомога далі від
спостерігача. Ті групи атомів, що у відкритій
формі Толленса розташовані зліва від головного
ланцюга, ставляться зверху від площини циклу, а
ті, що у відкритій формі розташовані зправа –
ставляться, відповідно, знизу. Кінцевий тетраедр
–СН2ОН розміщують над площиною кільця,
якщо атом, з яким він сполучений, має Dконфігурацію, і знизу – якщо L-конфігурацію.
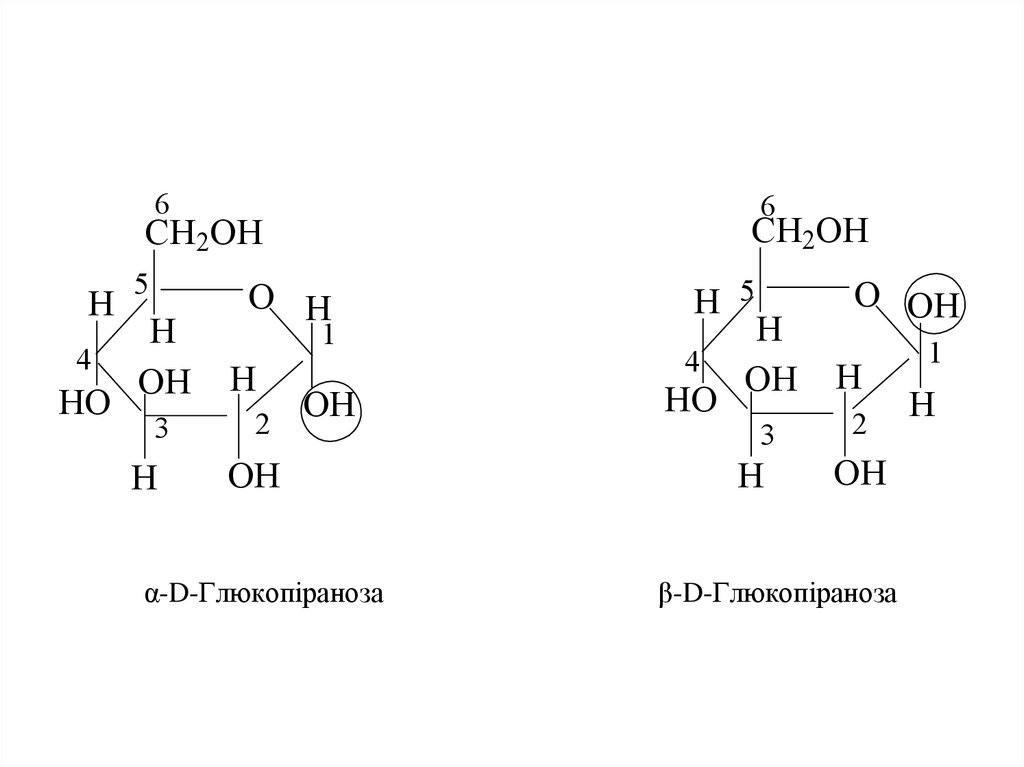
14. α-D-Глюкопіраноза β-D-Глюкопіраноза
66
CH2OH
CH2OH
H
4
HO
5
H
OH
3
H
O H
1
H
OH
2
OH
α-D-Глюкопіраноза
H 5
4
HO
H
OH
3
H
O OH
H
2
OH
β-D-Глюкопіраноза
1
H
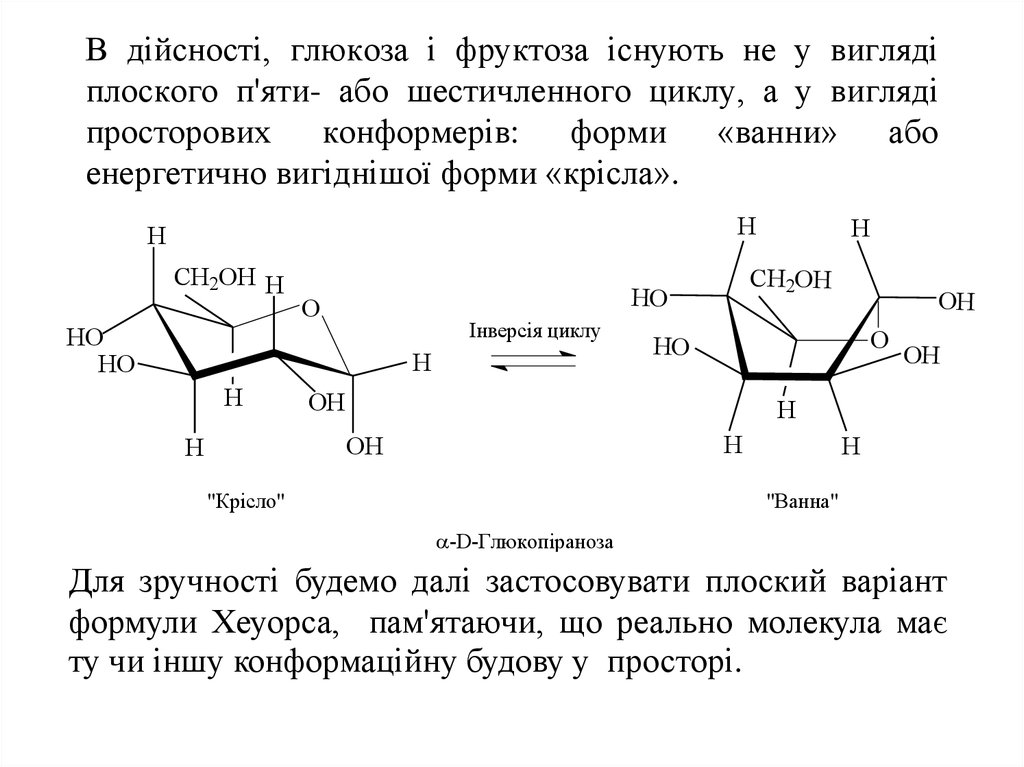
15. В дійсності, глюкоза і фруктоза існують не у вигляді плоского п'яти- або шестичленного циклу, а у вигляді просторових конформерів: форми «ва
В дійсності, глюкоза і фруктоза існують не у виглядіплоского п'яти- або шестичленного циклу, а у вигляді
просторових конформерів: форми «ванни» або
енергетично вигіднішої форми «крісла».
H
H
CH2OH H
Інверсія циклу
HO
HO
H
H
OH
O
HO
OH
OH
H
H
OH
H
CH2OH
HO
O
H
"Крісло"
H
"Ванна"
-D-Глюкопіраноза
Для зручності будемо далі застосовувати плоский варіант
формули Хеуорса, пам'ятаючи, що реально молекула має
ту чи іншу конформаційну будову у просторі.
16. Утворені напівацеталі можуть мати α- і β-форми, які відрізняються положенням напівацтального гідроксилу відносно площини кільця і називаю
Утворені напівацеталі можуть мати α- і β-форми,які відрізняються положенням напівацтального
гідроксилу відносно площини кільця і
називаються аномерами (від грецького "ано"зверху). У α–аномерів глікозидний гідроксил і
кінцева –СН2ОН-група розташовуються по різні
боки від площини кільця, а у β-аномерів – по
один бік. Тобто у цукрів D-ряду в форомулі
Хеуорса глікозидний гідроксил знаходиться
знизу від площини кільця для α–аномерів і
зверху – для β-аномерів.
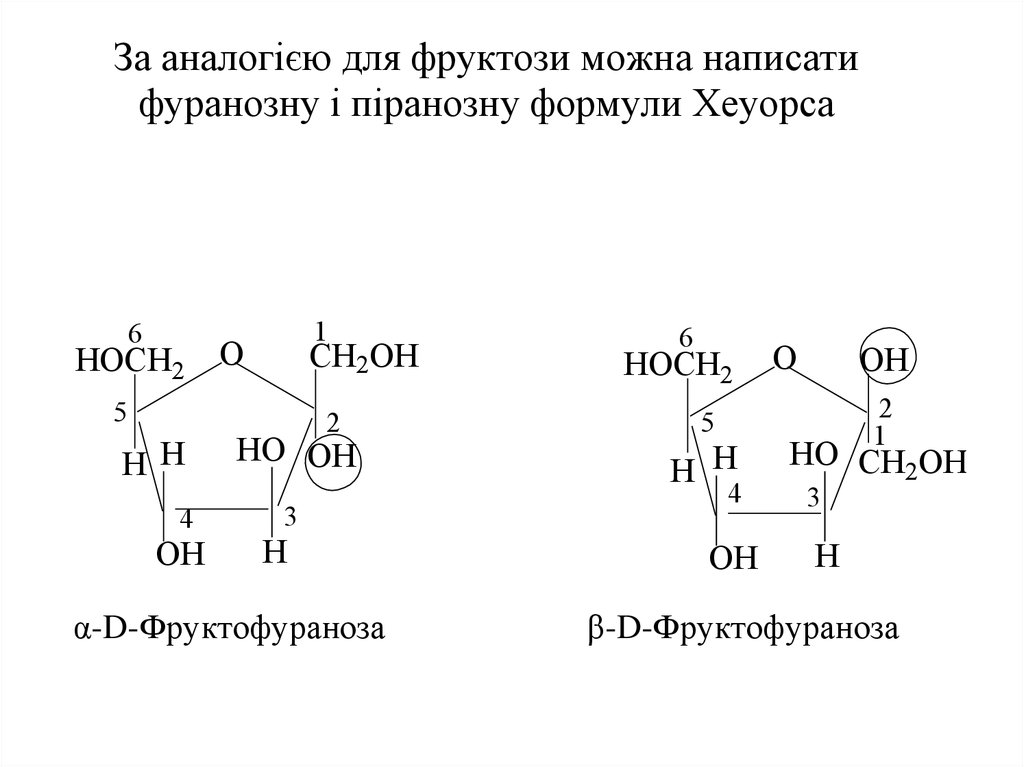
17. За аналогією для фруктози можна написати фуранозну і піранозну формули Хеуорса α-D-Фруктофураноза β-D-Фруктофураноза
За аналогією для фруктози можна написатифуранозну і піранозну формули Хеуорса
6
НОСH2
1
O
CH2OH
5
HH
4
OH
2
HO OH
3
H
α-D-Фруктофураноза
6
НОСH2
5
H H
4
OH
O
OH
2
1
HO CH2OH
3
H
β-D-Фруктофураноза
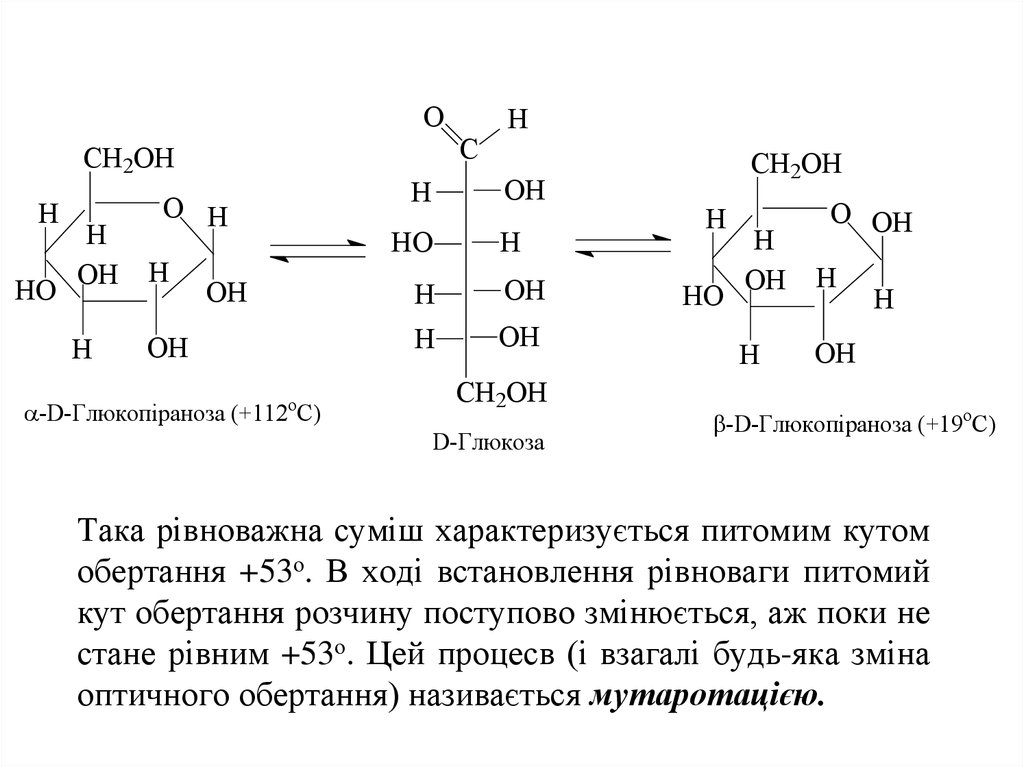
18. Для напівацетальних форм альдогексоз, число ізомерів зростає у два рази до 32 за рахунок появи аномерів (α- та β-). Аномери глюкози характериз
Для напівацетальних форм альдогексоз, числоізомерів зростає у два рази до 32 за рахунок появи
аномерів (α- та β-).
Аномери глюкози
характеризуються різним питомим обертанням
площини поляризації плоско поляризованого
променя світла. α-D-Глюкоза має питомий кут
обертання +112о, а β-D-глюкоза - +19о.
У водному розчині аномери можуть переходити
один в одного через відкриту форму, аж поки між
ними не встановиться рівновага, що відповідає
вмісту 64% β-D-глюкопіранози і 36% α-Dглюкопіранози. Вміст відкритої форми незначний і
ним можна знехтувати.
19. Така рівноважна суміш характеризується питомим кутом обертання +53о. В ході встановлення рівноваги питомий кут обертання розчину поступов
OC
CH2OH
H
HO
H
OH
H
H
OH
OH
H
O H
HO
OH
o
-D-Глюкопіраноза (+112 C)
H
H
H
OH
H
OH
CH2OH
D-Глюкоза
CH2OH
H
HO
O OH
H
OH
H
H
OH
H
-D-Глюкопіраноза (+19oC)
Така рівноважна суміш характеризується питомим кутом
обертання +53о. В ході встановлення рівноваги питомий
кут обертання розчину поступово змінюється, аж поки не
стане рівним +53о. Цей процесв (і взагалі будь-яка зміна
оптичного обертання) називається мутаротацією.
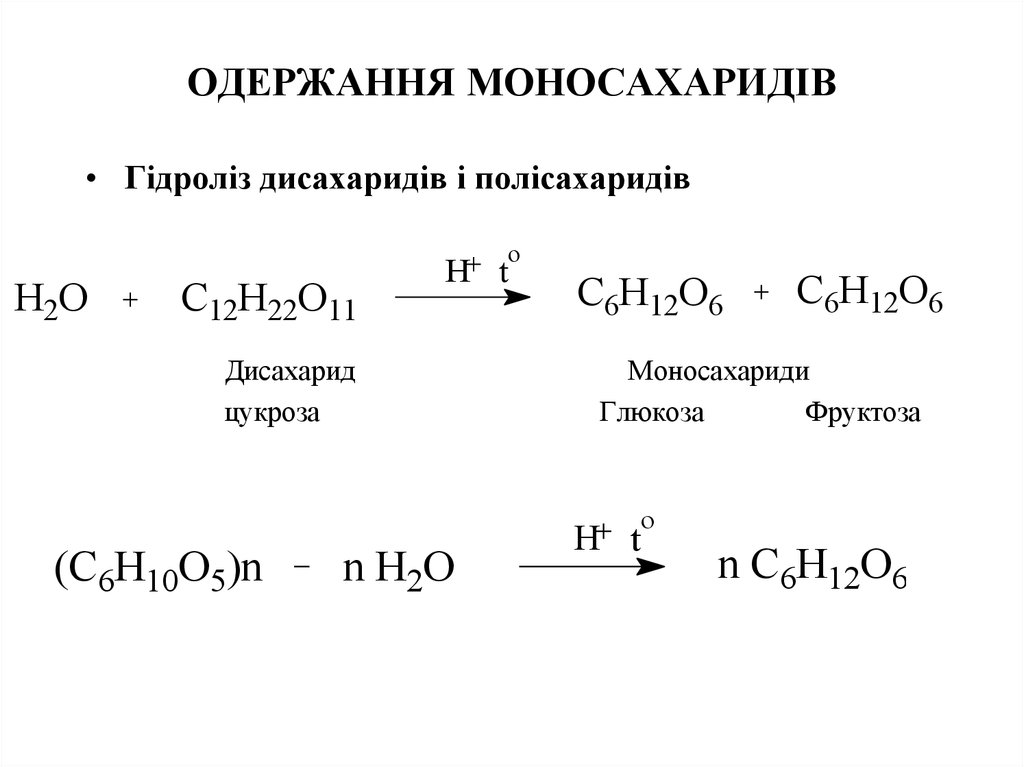
20. ОДЕРЖАННЯ МОНОСАХАРИДІВ
• Гідроліз дисахаридів і полісахаридівo
H2О
C12H22O11
H t
Дисахарид
цукроза
C6H12O6
C6H12O6
Моносахариди
Глюкоза
Фруктоза
o
(C6H10O5)n
n H2О
H t
n C6H12O6
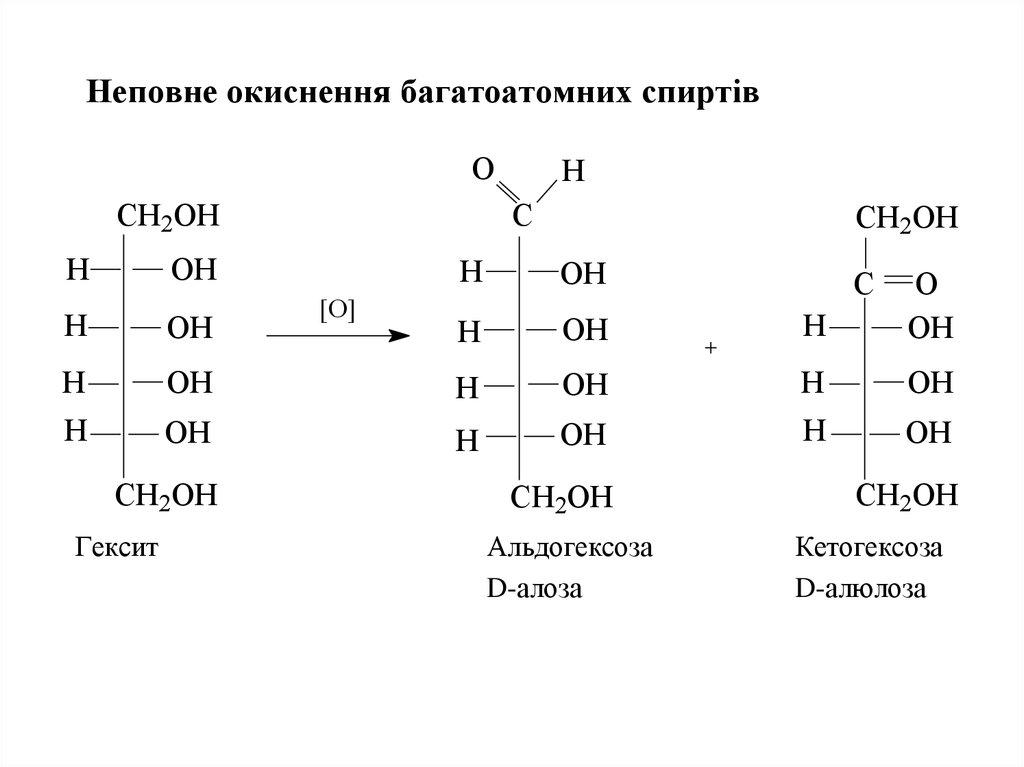
21. Неповне окиснення багатоатомних спиртів
Неповне окиснення багатоатомних спиртівO
CH2OH
H
H
C
OH
[O]
CH2OH
H
OH
H
OH
H
O
OH
C
H
OH
H
OH
H
OH
H
OH
H
OH
H
OH
H
OH
CH2OH
Гексит
CH2OH
Альдогексоза
D-алоза
CH2OH
Кетогексоза
D-алюлоза
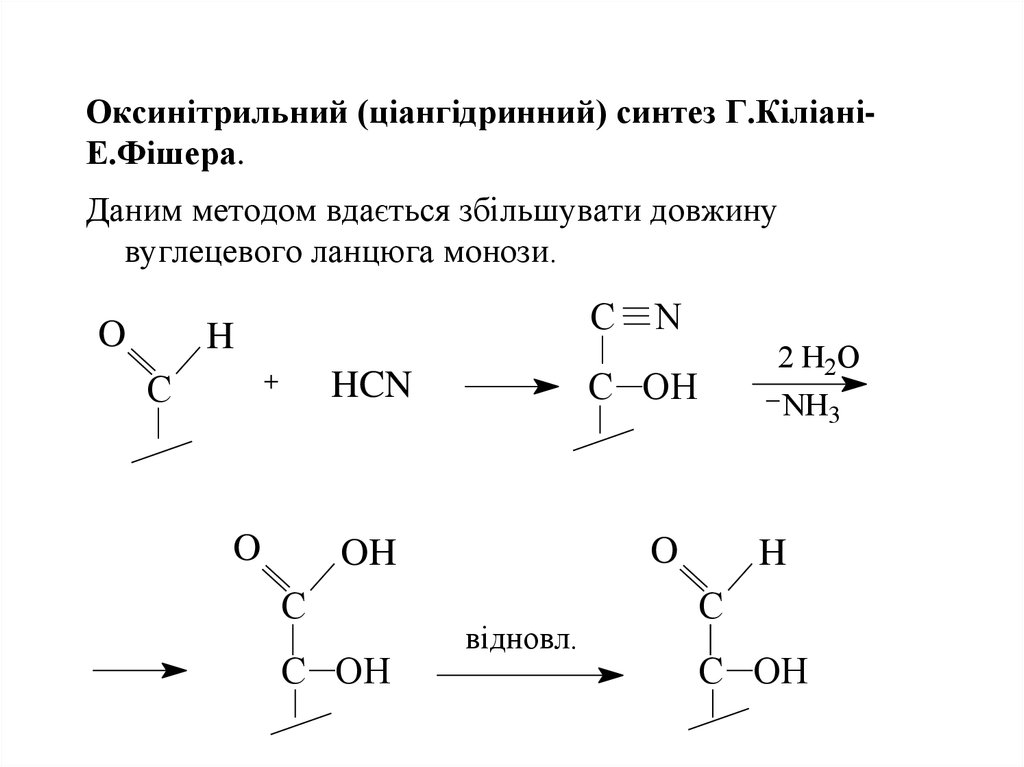
22. Оксинітрильний (ціангідринний) синтез Г.Кіліані-Е.Фішера.
Оксинітрильний (ціангідринний) синтез Г.КіліаніЕ.Фішера.Даним методом вдається збільшувати довжину
вуглецевого ланцюга монози.
O
C N
H
C
C OH
HCN
O
C OH
NH3
O
OH
C
2 H2O
відновл.
H
C
C OH
23. Фотосинтез.
• В природі моносахариди утворюються внаслідокфотосинтезу в зелених рослинах
n CO2
n H2O
хлорофіл
СnH2nO n
n O2
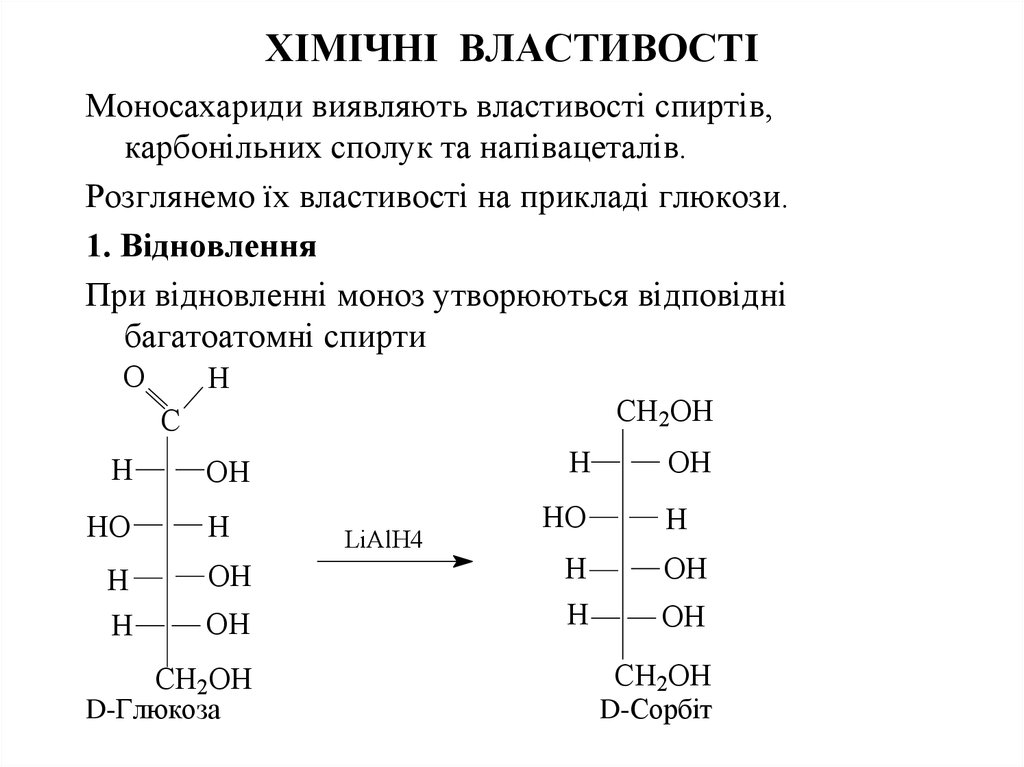
24. ХІМІЧНІ ВЛАСТИВОСТІ
Моносахариди виявляють властивості спиртів,карбонільних сполук та напівацеталів.
Розглянемо їх властивості на прикладі глюкози.
1. Відновлення
При відновленні моноз утворюються відповідні
багатоатомні спирти
O
H
CH2OH
C
H
HO
H
OH
H
LiAlH4
HO
OH
H
H
OH
H
OH
H
OH
H
OH
CH2OH
D-Глюкоза
CH2OH
D-Сорбіт
25. 2. Окиснення
Залежно від характеру окиснювача утворюються різніпродукти. Слабкі окиснювачі (Ag2O, розв.HNO3, HOBr
тощо) окиснюють альдози за альдегідною групою:
O
O
H
C
C
H
HO
OH
H
OH
H
Ag2O
HO
OH
H
H
OH
H
OH
H
OH
H
OH
CH2OH
Глюкоза
CH2OH
Глюконова кислота
26. При дії сильніших окисників, наприклад, конц. HNO3 окиснення протікає також за гідроксильною групою при шостому атомі вуглецю з утворенням д
При дії сильніших окисників, наприклад, конц. HNO3окиснення протікає також за гідроксильною групою при
шостому атомі вуглецю з утворенням двоосновних
гідроксикислот.
O
O
OH
C
C
H
HO
OH
H
OH
H
OH
Конц. HNO3
HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
C
O
OH
Цукрова або
глюкарова кислота
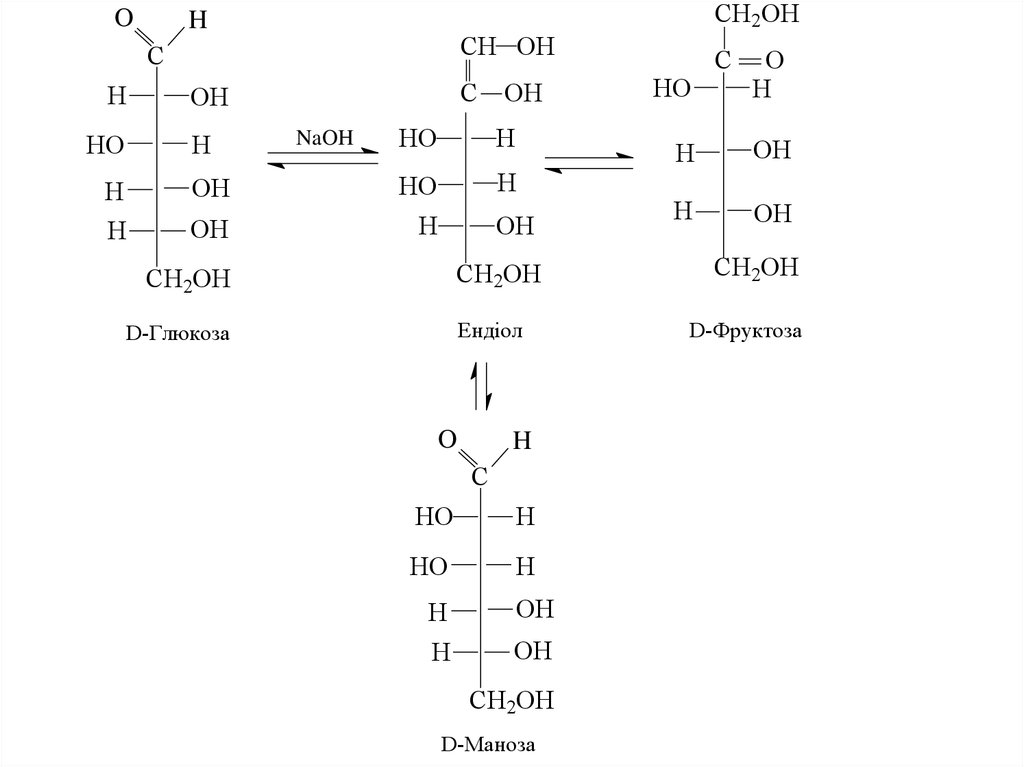
27. 3. Дія лугів на моносахариди
Луги за нормальних умов викликають ізомерніперетворення біля С1 і С2, що приводить до утворення
рівноважної суміші альдоз і кетоз. Такі перетворення
мають назву епімеризації.
Нагадаємо, що епімерами називаються вуглеводи, що
відрізняються когфігурацією лише одного
асиметричного атома вуглецю.
28.
OCH2OH
H
CH OH
C
H
HO
C
OH
H
NaOH
OH
HO
H
H
H
OH
HO
H
OH
H
OH
CH2OH
CH2OH
Ендіол
D-Глюкоза
O
H
C
HO
H
HO
H
H
OH
H
OH
CH2OH
D-Маноза
HO
C
O
H
H
OH
H
OH
CH2OH
D-Фруктоза
29. 4. Реакції алкілування одержання (повних і неповних етерів)
Легко алкілується глікозидна НО-група з утворенням неповногоетеру, як в α-, так і в β=формах.
CH2OH
CH2OH
H
HO
O H
H
OH
H
H
OH
OH
α-D-Глюкопіраноза
CH3OH
H
H
HO
O OH
H
OH
H
H
OH
H2О
О CH3
О-Метил- α-Dглюкопіраноза
Одержана сполука відноситься до глікозидів. Глікозидами
називаються похідні моносахаридів, у молекулах яких атоми
водню глікозидного гідроксилу заміщено якимось замісником.
Цей замісник називається агліконом. В даному випадку
агліконом являється метил (СН3). Глікозиди досить поширені
у природі. Під дією кислот або ферментів вони легко
гідролізуються до вихідного моносахариду.
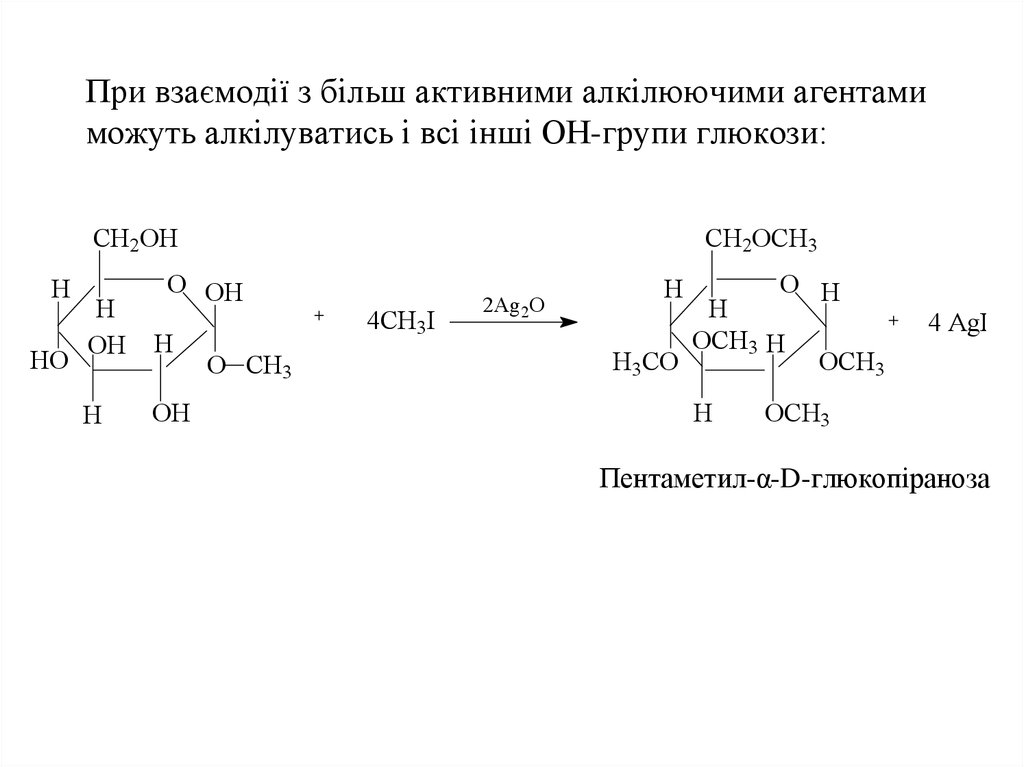
30. При взаємодії з більш активними алкілюючими агентами можуть алкілуватись і всі інші ОН-групи глюкози:
CH2OHH
HO
CH2OCH3
O OH
H
OH
H
H
OH
О CH3
4CH3І
2Ag2O
H
H3CO
O H
H
OCH3 H
H
4 AgI
OCH3
OCH3
Пентаметил-α-D-глюкопіраноза
31. При нагріванні з розведеним розчином мінеральної кислоти етери гідролізуються. Реакція гідролізу алкілованих моноз зворотна реакції утв
При нагріванні з розведеним розчином мінеральноїкислоти етери гідролізуються. Реакція гідролізу
алкілованих моноз зворотна реакції утворення етерів.
При гідролізі в першу чергу гідролізується етерна група,
утворена за рахунок глюкозидного гідроксилу
CH2OCH3
H
H3CO
CH2OCH3
O H
H
OCH3 H
H
H2О
OCH3
OCH3
2H
H
H3CO
O H
H
ОCH3 H
H
OH
ОCH3
CH3ОH
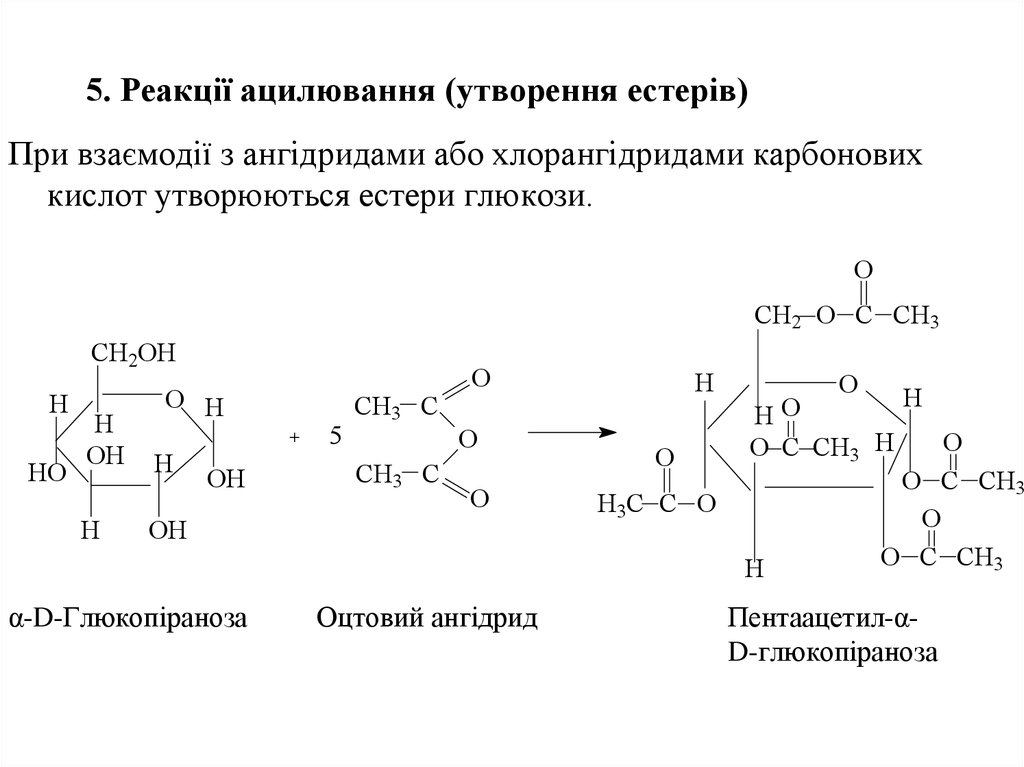
32. 5. Реакції ацилювання (утворення естерів)
При взаємодії з ангідридами або хлорангідридами карбоновихкислот утворюються естери глюкози.
О
CH2 O C CH3
CH2OH
H
HO
H
OH
H
O H
H
OH
5
CH3 C
O
O
CH3 C
O
OH
H
О
O
HО
O C CH3 H
H3C C O
H
α-D-Глюкопіраноза
Оцтовий ангідрид
H
О
O C CH3
О
O C CH3
Пентаацетил-αD-глюкопіраноза
33. 6. Бродіння
6.1. Спиртове. Для деяких гексоз характернерозщеплення молекул до спирту під дією ферментів
(зимази). Цю суміш ферментів виробляють дріжджові
гриби. Хімізм даного процесу дуже складний і сумарно
може бути виражений рівнянням
C6H12O6
Глюкоза,
фруктоза
або маноза
зимаза
2 C2H5OН + 2 СО2
Етанол
Причому, етиловий спирт під дією ферментів
утворюється лише з D-глюкози, D-фруктози та Dманози.
34. 6.2. Гліцеринове – лежить в основі одержання харчового гліцерину
C6H12O6CH2 CH CH2
CH3 C
OH OH OH
O
H
CO2
6.3. Бутиратнокисле (Маслянокисле)
C6H12O6
CH3 CH2 CH2 C
O
ОH
2 CO2
6.4. Ацетонове бродіння: під дією бактерій Bacyllus
acetobutilicus крохмаль перетворюється на суміш
ацетону та бутанолу.
H2
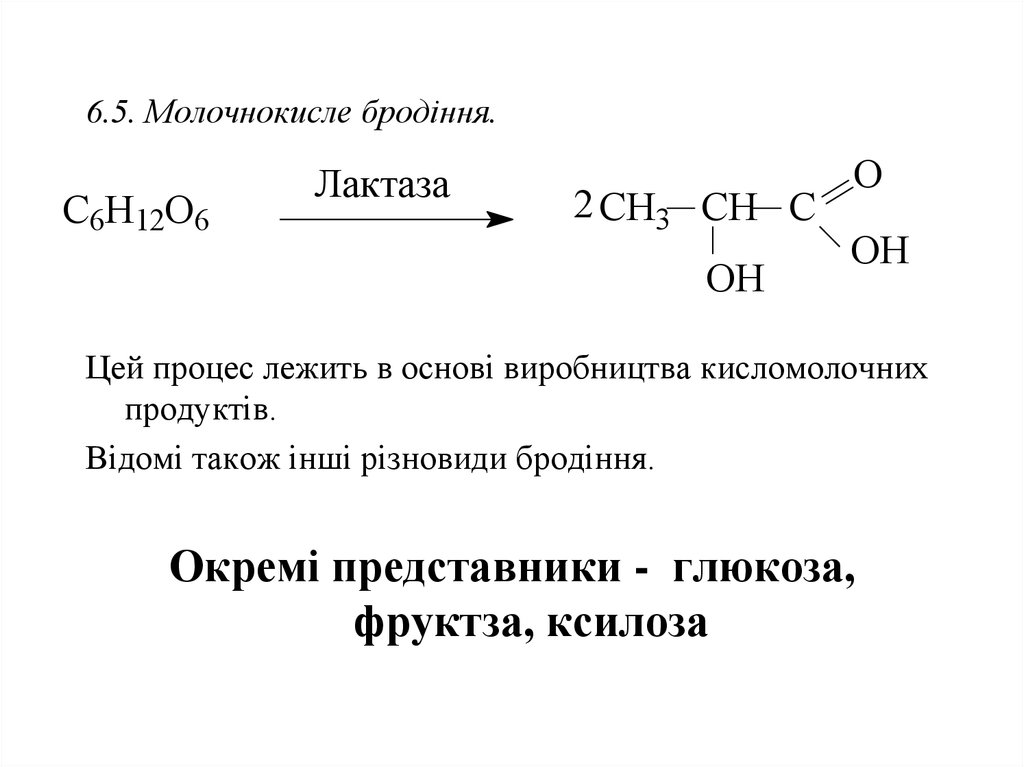
35. 6.5. Молочнокисле бродіння.
C6H12O6Лактаза
2 CH3 CH C
OH
O
ОH
Цей процес лежить в основі виробництва кисломолочних
продуктів.
Відомі також інші різновиди бродіння.
Окремі представники - глюкоза,
фруктза, ксилоза
36. ДИСАХАРИДИ
• Сполуки, що складаються з двох залишківмоносахаридів, з'єднаних між собою глікозидним
зв’язком, називаються дисахаридами.
• Глікозидний зв’язок утворюється за рахунок
відщеплення молекули води від двох молекул
моносахаридів, причому в утворенні цього зв’язку
обов’язково приймає участь хоча б один глікозидний
гідроксил, наприклад:
CH2OH
H
HO
H
OH
H
CH2OH
O H
H
OH
OH
-D-Глюкопіраноза
H
HO
H
OH
H
CH2OH
O H
H
OH
OH
-D-Глюкопіраноза
H
H2О
HO
H
OH
H
Глікозидний
звязок
O H
H
H
O
OH
Мальтоза ( -форма)
CH2OH
O H
H
OH
H
H
OH
OH
37. Молекула дисахариду може приєднувати молекулу води з утворенням двох молекул моносахариду.
2 C12H22O11 + Н2ОДисахарид
C6H12O6 + C6H12O6
Моносахариди
• За своєю будовою дисахариди відносяться до
глікозидів, в яких роль аглікона виконує друга
молекула моносахариду
38. Дисахариди бувають відновлюючі і невідновлюючі.
• Якщо для утворення глікозидного зв’язкувикористовується лише один глікозидний
(напівацетальний) гідроксил, то в молекулі дисахариду
друга глікозидна НО-група зберігається і здатна
утворювати альдегідну форму, яка проявляє
відновлюючі властивості, наприклад, взаємодіє з
аміачним розчином оксиду срібла (реакція срібного
дзеркала). До таких дисахаридів відносяться мальтоза,
целобіоза, лактоза тощо. Якщо глікозидний зв’язок
між молекулами моноз утворений за рахунок двох
глікозидних НО-груп, то такі дисахариди, не здатні
утворювати альдегідну групу і називаються
невідновлюючими.
• До них відноситься цукроза, трегалоза тощо.
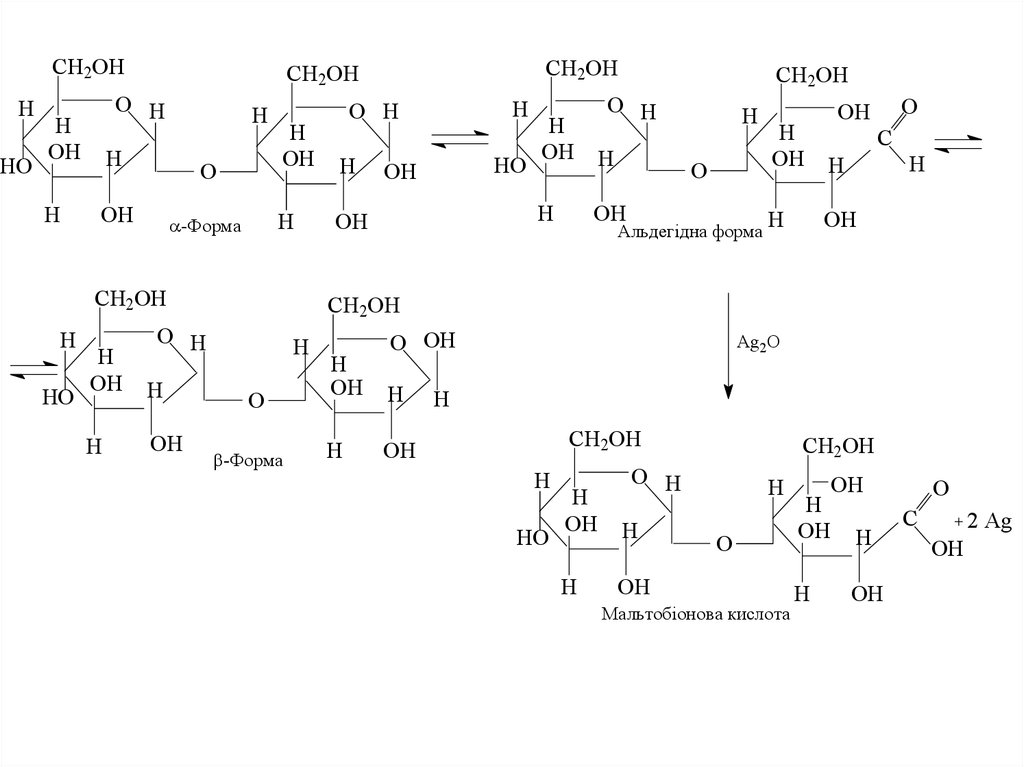
39. Відновлюючі дисахариди
• Мальтоза (солодовий цукор)• Глікозидний зв’язок в молекулі мальтози утворюється
за участю гідроксилів при 1-му атомі вуглецю однієї
молекули α-D-глюкози і 4-ому атомі вуглецю - другої,
так званий α-(1,4′)-глікозидний зв'язок. Тому один з
двох глікозидних гідроксилів зберігається. В
результаті мальтоза здатна до мутаротації і може
існувати у вигляді α і β-аномерів. Взаємний перехід
між α і β-формами здійснюється через альдегідну
форму, тому мальтоза здатна проявляти відновлюючі
властивості:
40.
CH2OHH
HO
O H
H
OH
H
H
OH
H
O
-Форма
H
H
OH
HO
H
H
OH
HO
OH
CH2OH
O H
H
OH
H
H
OH
H
O
Альдегідна форма
O
OН
H
OH
H
H
OH
С
H
CH2OH
O H
H
OH
H
O H
H
OH
CH2OH
H
CH2OH
CH2OH
H
O
-Форма
O OH
H
OH
H
H
OH
Ag2O
H
CH2OH
H
HO
CH2OH
O H
H
OH
H
H
OH
H
O
Мальтобіонова кислота
H
OH
H
OH
H
OH
O
С
2 Ag
OH
41. Целобіоза
• Целобіоза відрізняється від мальтози наявністю β(1,4′)-глікозидного зв'язку. Вона утворюється принеповному гідролізу целюлози.
CH2OH
H
HO
H
OH
H
CH2OH
O
H
OH
H
O
H
O OH
H
OH
H
H
OH
H
42. Невідновлюючі дисахариди
• Цукроза• Цукроза є харчовим продуктом, який виділяється з цукрової
тростини або буряка. Вміст цукру в тростині 14-16%, а в
цукровому буряці – 17-20%. В організмі людини і тварин вона
легко розщеплюється під дією ферментів на фруктозу і глюкозу.
• Цукроза побудована із залишків α-D-глюкопіранози і β-Dфруктофуранози, за рахунок α-(1-2′ ) глікозидного зв'язку.
Схематично її утворення можна показати наступною схемою:
CH2OH
H
HO
H
OH
H
1
O H
H
OH
OH
D-Глюкопіраноза
O
НОCH2
2
HO
CH2OH
H
3
OH
4
H
OH
5
6
CH2OH
H
H
H2О
HO
H
OH
H
O H НОCH2
H
O
OH
D-Фруктофураноза
• При гідролізі відбувається зворотна реакція,
Цукроза
O
H
H
OH
OH
H
CH2OH
43.
Цукроза характеризується правим обертанням з питомим кутом+66о. В результаті гідролізу утворюється еквімолярна суміш
глюкози (+53о) та фруктози, що є лівообертаючим цукром з
питомим кутом –92о. Така суміш має питоме обертання –39,5о.
Отже в процесі гідролізу праве обертання поступово змінюється на
ліве (відбувається інверсія обертання). Тому продукт гідролізу
цукрози називається інвертним цукром. Він солодший за цукрозу,
бо фруктоза, що входить до складу інвертного цукру солодша як за
цукрозу, так і за глюкозу.
44. ПОЛІСАХАРИДИ
• Полісахариди - високомолекулярні нецукроподібнівуглеводи. Вони являють собою продукти конденсації
великого числа молекул за аналогією з дисахаридами.
Залишки моноз в їх молекулах з'єднані між собою
глікозидним зв'язком, утвореним за рахунок
глікозидного гідроксилу однієї молекули монози і,
переважно, четвертим або шостим гідроксилом іншої
молекули монози.
• Головні представники полісахаридів - крохмаль і
целюлоза.
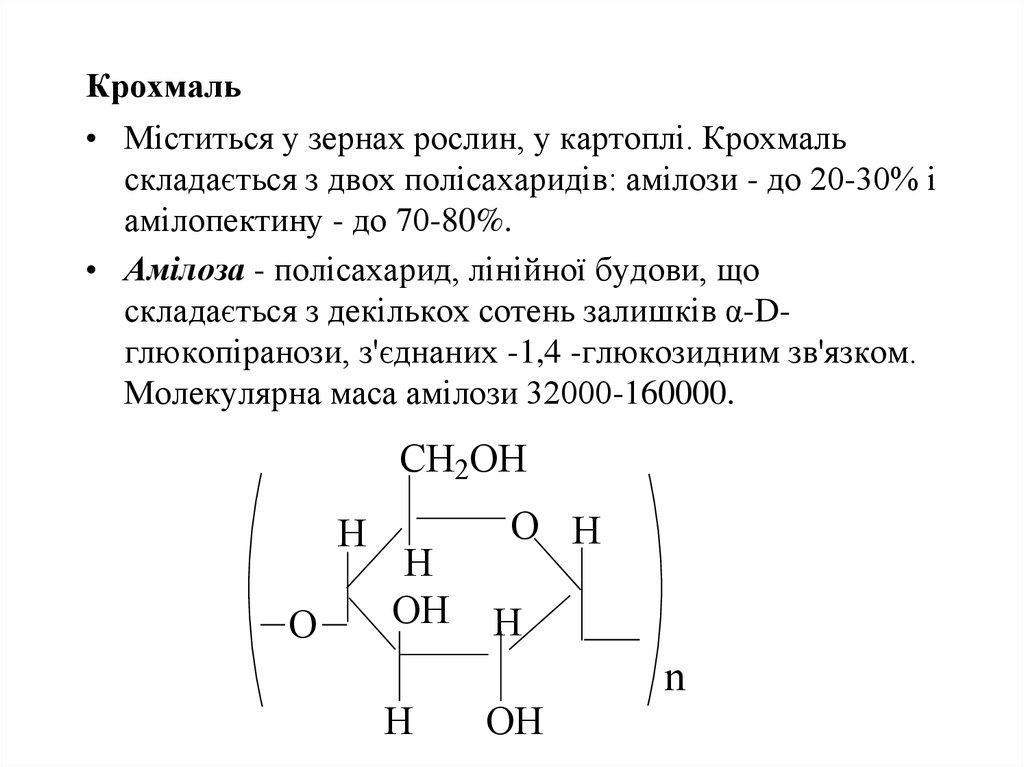
45. Крохмаль
• Міститься у зернах рослин, у картоплі. Крохмальскладається з двох полісахаридів: амілози - до 20-30% і
амілопектину - до 70-80%.
• Амілоза - полісахарид, лінійної будови, що
складається з декількох сотень залишків α-Dглюкопіранози, з'єднаних -1,4 -глюкозидним зв'язком.
Молекулярна маса амілози 32000-160000.
CH2OH
H
O
H
OH
H
O H
H
OH
n
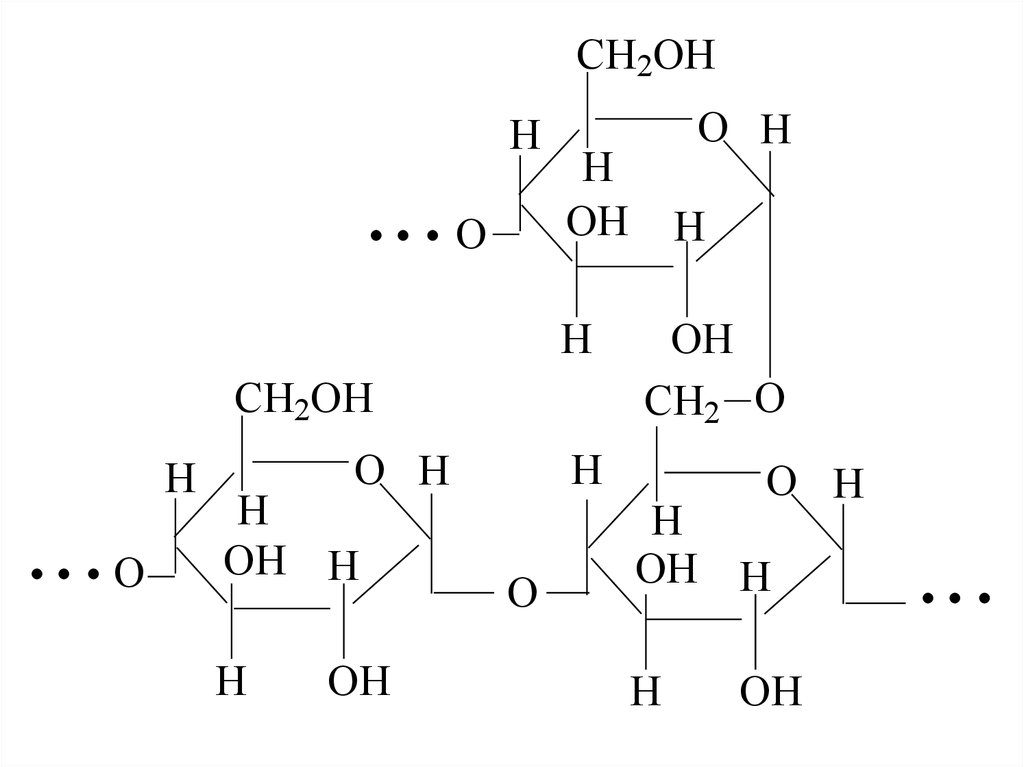
46. Амілопектин – більш високомолекулярний полісахарид з розгалуженою структурою, молекулярної маси 100000-1000000. За аналогією з амілозою, залишк
Амілопектин – більш високомолекулярний полісахаридз розгалуженою структурою, молекулярної маси 1000001000000. За аналогією з амілозою, залишки α-D-
глюкопіранози з'єднані-1,4-глюкозидним зв'язком.
Розгалуження утворюється за рахунок зв'язування деяких
фрагментів глюкози глюкозидним 1,6-зв’язками.
47.
CH2OHH
O
H
OH
H
CH2OH
H
O
O H
H
OH H
H
OH
O H
H
OH
CH2 O
H
O
O H
H
OH H
H
OH
48. За структурою близький до крохмалю глікоген (тваринний крохмаль). Його макромолекули дуже розгалужені, а молекулярна маса значно вища порі
За структурою близький до крохмалю глікоген(тваринний крохмаль). Його макромолекули дуже
розгалужені, а молекулярна маса значно вища порівняно
з рослинним крохмалем. При довгому кип’ятінні з
розведеною кислотою, або в результаті ферментативного
гідролізу
крохмаль
утворює
глюкозу.
CH2 OН
CH2OH
H
O
H
OH
H
O H
n H2О
H
OH
n
Амілаза
H
n
HO
H
OH
O H
H
OH
H
OH
Крохмаль міститься в рослинах і є основною складовою
частиною багатьох продуктів харчування. В організмі
людини легко ферментується.
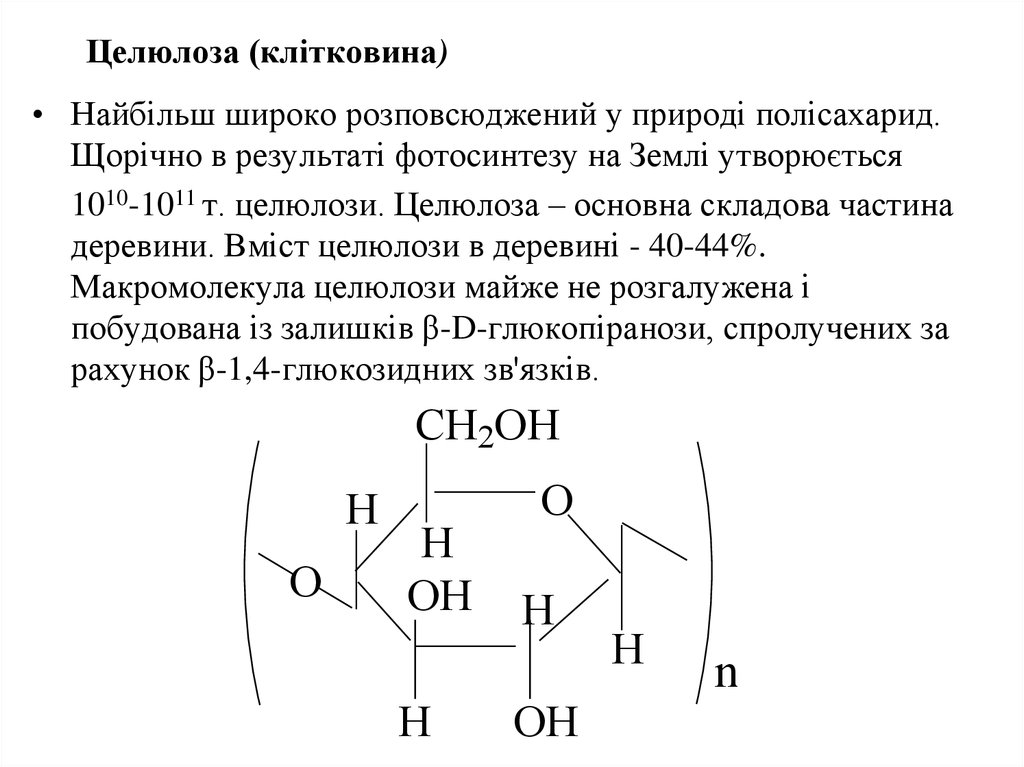
49. Целюлоза (клітковина)
• Найбільш широко розповсюджений у природі полісахарид.Щорічно в результаті фотосинтезу на Землі утворюється
1010-1011 т. целюлози. Целюлоза – основна складова частина
деревини. Вміст целюлози в деревині - 40-44%.
Макромолекула целюлози майже не розгалужена і
побудована із залишків β-D-глюкопіранози, спролучених за
рахунок β-1,4-глюкозидних зв'язків.
CH2OH
H
O
H
OH
H
O
H
OH
H
n
50.
• Молекулярна маса целюлози 21000-50000.• Особливості будови макромолекул целюлози є в тому,
що всі НО-групи розміщені тільки з зовнішнього боку
ланцюга. Завдяки цьому між макромолекулами
целюлози виникають водневі зв'язки, що надають
жорсткості речовині і роблять її нерозчинною у воді.
Кожна елементарна ланка целюлози містить три
гідроксильні групи, тому формулу целюлози зручно
зображати так: [C6H7O2 (OH)3]n.
• Целюлоза широко застосовується для виготовлення
волокон, тканин, лаків, пластмас тощо. Подібно до
крохмалю, целюлоза здатна піддаватися гідролізу до
глюкози, яку потім переробляють в етиловий спирт
(гідролізний).
51. 1. Одержання віскозного волокна
• При обробці целюлози водним розчином лугу, а потімсірковуглецем (СS2) одержують ксантогенат целюлози.
Ксантогенат розчиняється у воді, утворюючи дуже
в’язкий розчин, що називається віскозою.
52. 2. Нітрування
• Целюлоза нітрується конц. НNO3. Реакція може протікатипоступово із залученням однієї, двох або всіх трьох ОН-груп.
C6H7O2(OH)3
n
nHNO3
H2O
nHNO3
C6H7O2(OH)2(ONO2) n nH O
2
Мононітроцелюлоза
C6H7O2(OH)(ONO2)2 n
Динітроцелюлоза
HNO3
nH2O
C6H7O2(ONO2)3 n
Тринітроцелюлоза
• Суміш моно- і динітроцелюлози називається колоксилін, який
використовують для виготовлення нітролаків, колодію,
целулоїду (суміш колоксиліну з камфорою 1:3).
Тринітроцелюлоза використовується для виготовлення
бездимного пороху.
53. 3. Ацилювання
• Гідроксильні групи целюлози здатні ацилюватисьангідридами або галогенангідридами кислот.
O O
C6H7O2(OH)3
n
3n CH3COCCH3
O
C6H7O2(OCCH3)3 n
Оцтовий ангідрид
Триацетат целюлози
3n CH3COOH
• Фільєруванням ацетонового розчину триацетату
целюлози одержують ацетатний шовк. Ацетатний
шовк (ацетатне волокно) може бути добутий і з
діацетату целюлози.
54. 4. Алкілування
• Целюлоза алкілується алкілгалогенідами абоалкілсульфатами.
C6H7O2(OH)3
n
1,5 n(CH3)2SO4
C6H7O2(O CH3)3 n
Диметилсульфат
Триметилцелюлоза
1,5n H2SO4
• Найпоширеніші метил-, етил- і бензилцелюлоза
використовуються як основа лаків, плівкоутворювачів
тощо.
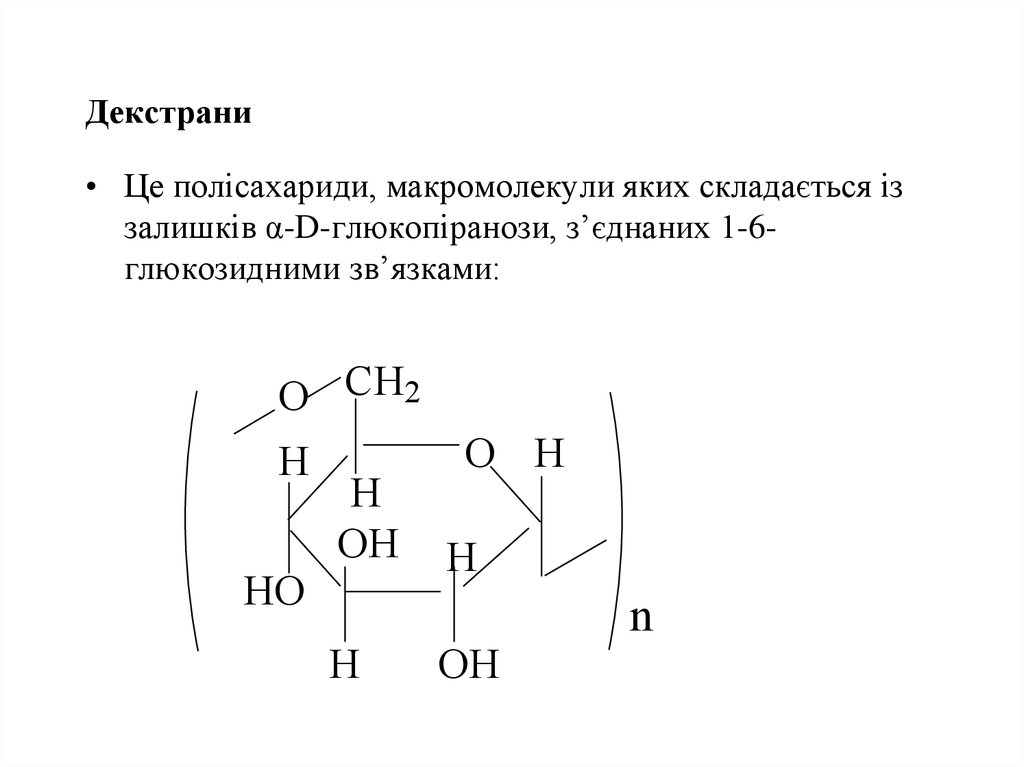
55. Декстрани
• Це полісахариди, макромолекули яких складається іззалишків α-D-глюкопіранози, з’єднаних 1-6глюкозидними зв’язками:
O CH2
H
НО
H
OH
H
O H
H
OH
n
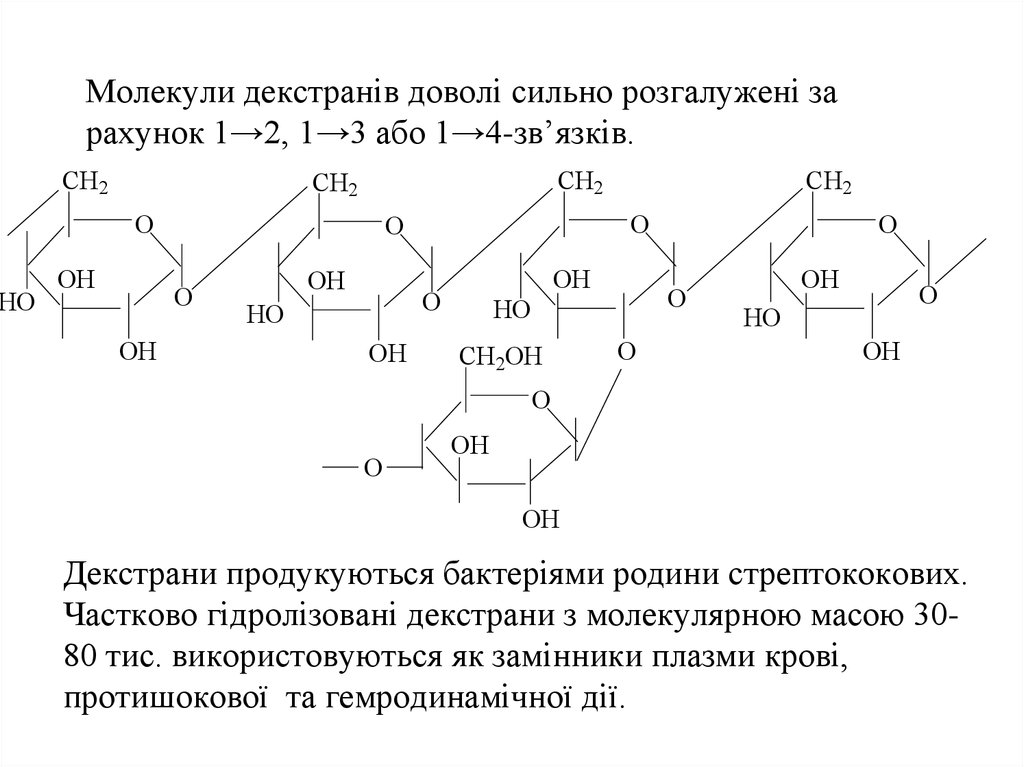
56. Молекули декстранів доволі сильно розгалужені за рахунок 1→2, 1→3 або 1→4-зв’язків.
HOМолекули декстранів доволі сильно розгалужені за
рахунок 1→2, 1→3 або 1→4-зв’язків.
CH2
CH2
CH2
O
OH
OH
O
O
O
OH
OH
O
HO
OH
CH2
O
HO
CH2OH
O
O
OH
O
HO
OH
O
O
OH
OH
Декстрани продукуються бактеріями родини стрептококових.
Частково гідролізовані декстрани з молекулярною масою 3080 тис. використовуються як замінники плазми крові,
протишокової та гемродинамічної дії.
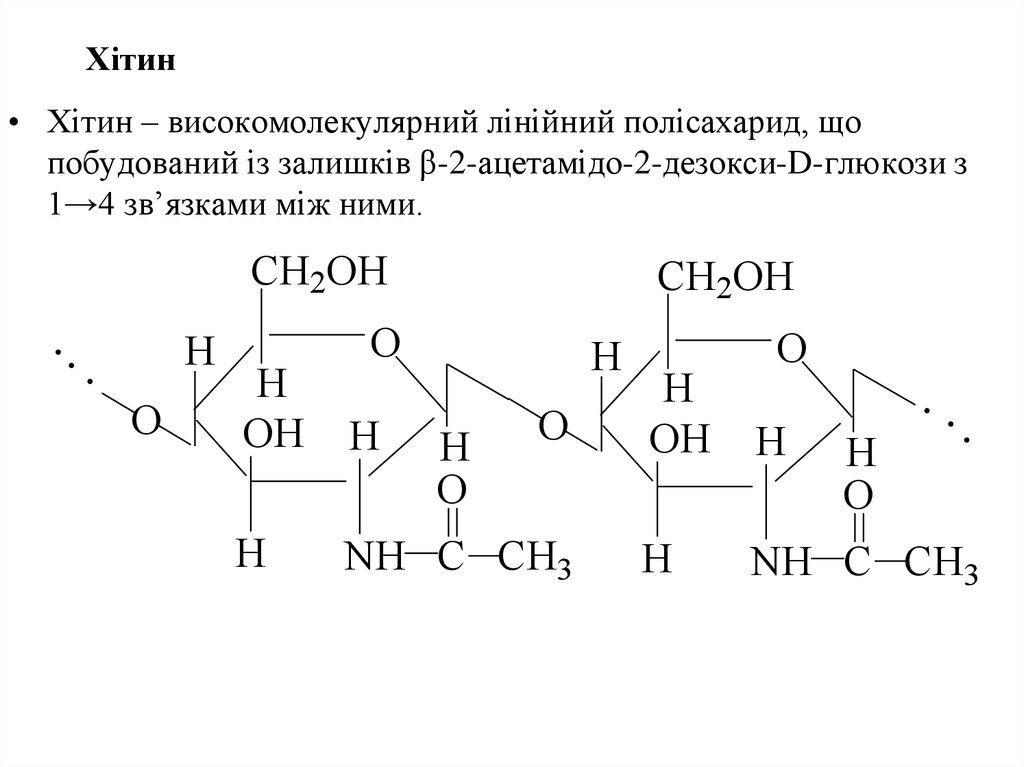
57. Хітин
• Хітин – високомолекулярний лінійний полісахарид, щопобудований із залишків β-2-ацетамідо-2-дезокси-D-глюкози з
1→4 зв’язками між ними.
CH2OH
H
O
CH2OH
O
H
H
OH
H
H
NH C CH3
H
O
O
O
H
OH
H
H
NH C CH3
H
O
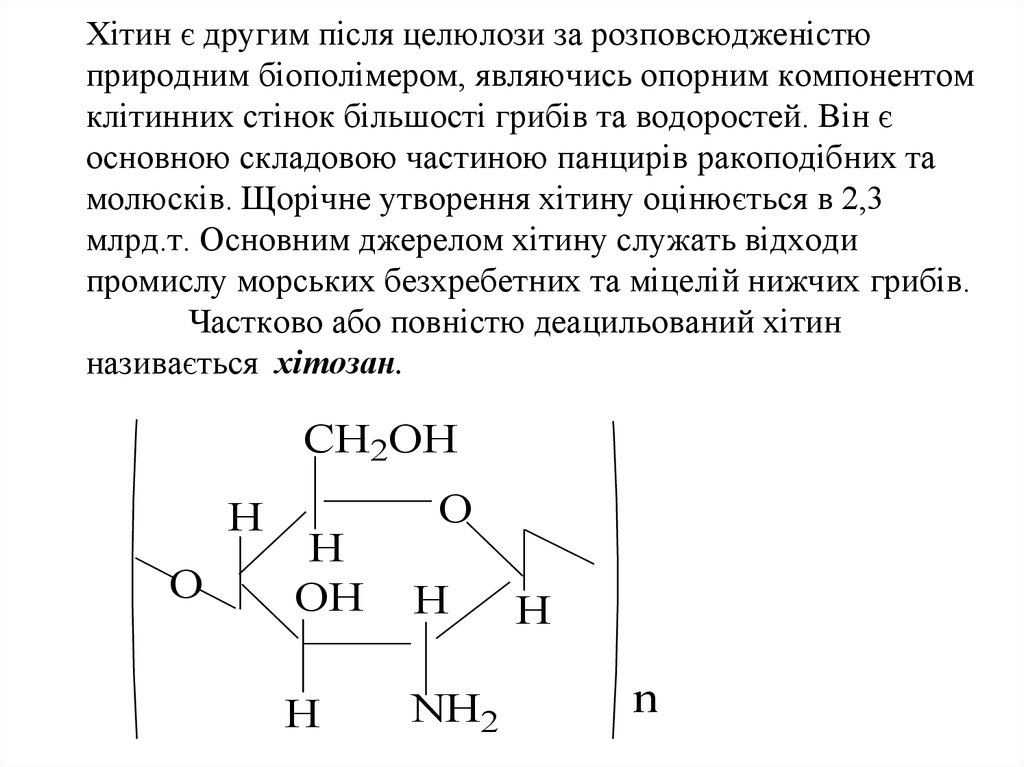
58. Хітин є другим після целюлози за розповсюдженістю природним біополімером, являючись опорним компонентом клітинних стінок більшості гриб
Хітин є другим після целюлози за розповсюдженістюприродним біополімером, являючись опорним компонентом
клітинних стінок більшості грибів та водоростей. Він є
основною складовою частиною панцирів ракоподібних та
молюсків. Щорічне утворення хітину оцінюється в 2,3
млрд.т. Основним джерелом хітину служать відходи
промислу морських безхребетних та міцелій нижчих грибів.
Частково або повністю деацильований хітин
називається хітозан.
CH2OH
H
O
O
H
OH
H
H
NH2
H
n
59.
SC6H7O2(OH)3
n
n NaOH
nCS2
nH2O
C6H7O2(OH)2 (OCSNa) n
Ксантогенат
целюлози
H2SO4
C6H7O2(OH)3
n
S
HO C SNa
Регенерована
целюлоза
Продавлюючи віскозу через дрібні отвори (фільєри) у розчин
сульфатної кислоти, одержують тонкі волокна регенерованої
целюлози - віскозне волокно (віскозний шовк). Якщо
продавлювати через щілину у розчин кислоти суміш віскози і
гліцерину, то утворюється тонка прозора плівка - целофан.



































 Химия
Химия








