Похожие презентации:
Органическая химия в ряду других наук
1. Органическая химия
2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
Часть I2
3. Органическая химия в ряду других наук
Органическая химия вполнеможет свести человека с ума.
Она создает у меня
впечатление девственного
тропического леса, полного
самых удивительных вещей;
из этой чудовищной и
безграничной чащи
невозможно выбраться и в
нее страшно войти.
Фридрих Велер (1835)
Фридрих Велер
(1800-1882)
3
4. Органическая химия в ряду других наук
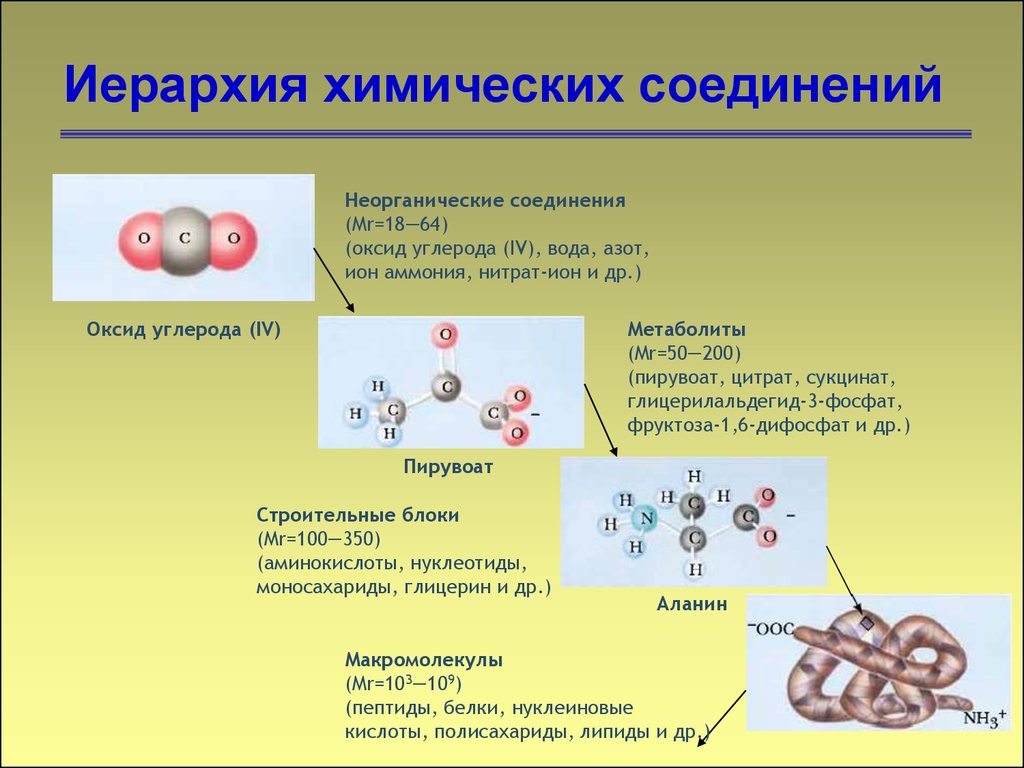
45. Иерархия химических соединений
Неорганические соединения(Mr=18―64)
(оксид углерода (IV), вода, азот,
ион аммония, нитрат-ион и др.)
Оксид углерода (IV)
Метаболиты
(Mr=50―200)
(пирувоат, цитрат, сукцинат,
глицерилальдегид-3-фосфат,
фруктоза-1,6-дифосфат и др.)
Пирувоат
Строительные блоки
(Mr=100―350)
(аминокислоты, нуклеотиды,
моносахариды, глицерин и др.)
Аланин
Макромолекулы
(Mr=103―109)
(пептиды, белки, нуклеиновые
кислоты, полисахариды, липиды и др.)
5
6. Предмет органической химии
Органическая химия — химия соединенийуглерода.
Элементы Н, О, N, S, галогены –
называют органогенами.
Органическая химия — химия
углеводородов и их производных.
6
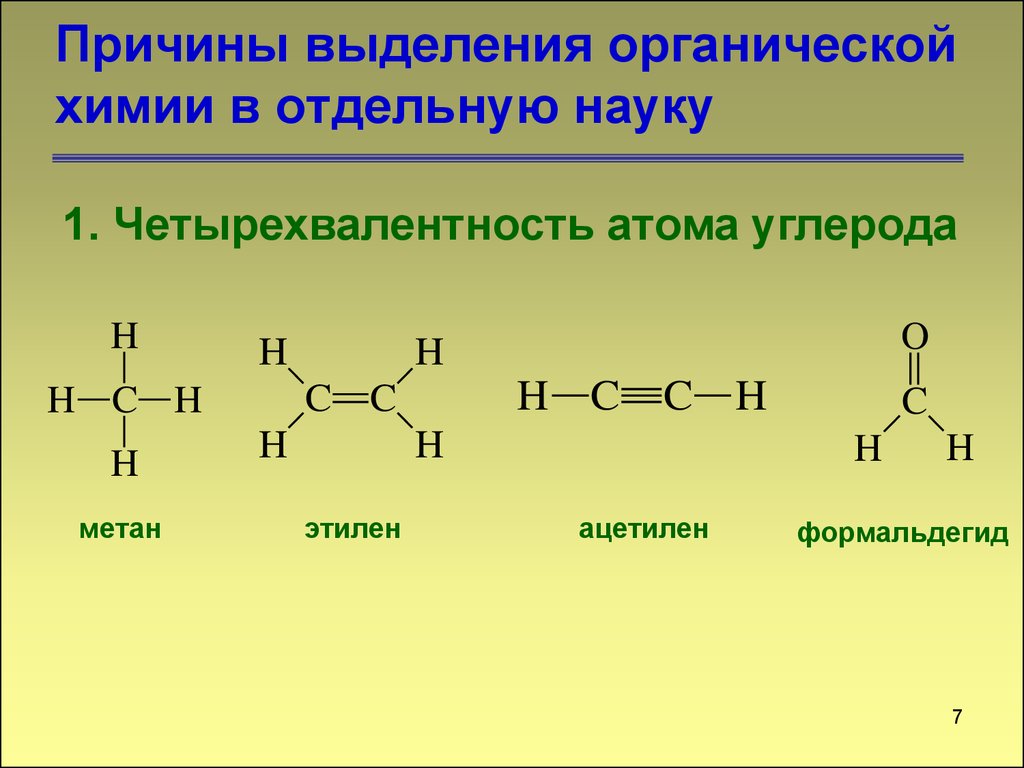
7. Причины выделения органической химии в отдельную науку
1. Четырехвалентность атома углеродаH
H
H
метан
H C
C C
H C H
O
H
H
C H
H
этилен
C
H
ацетилен
H
формальдегид
7
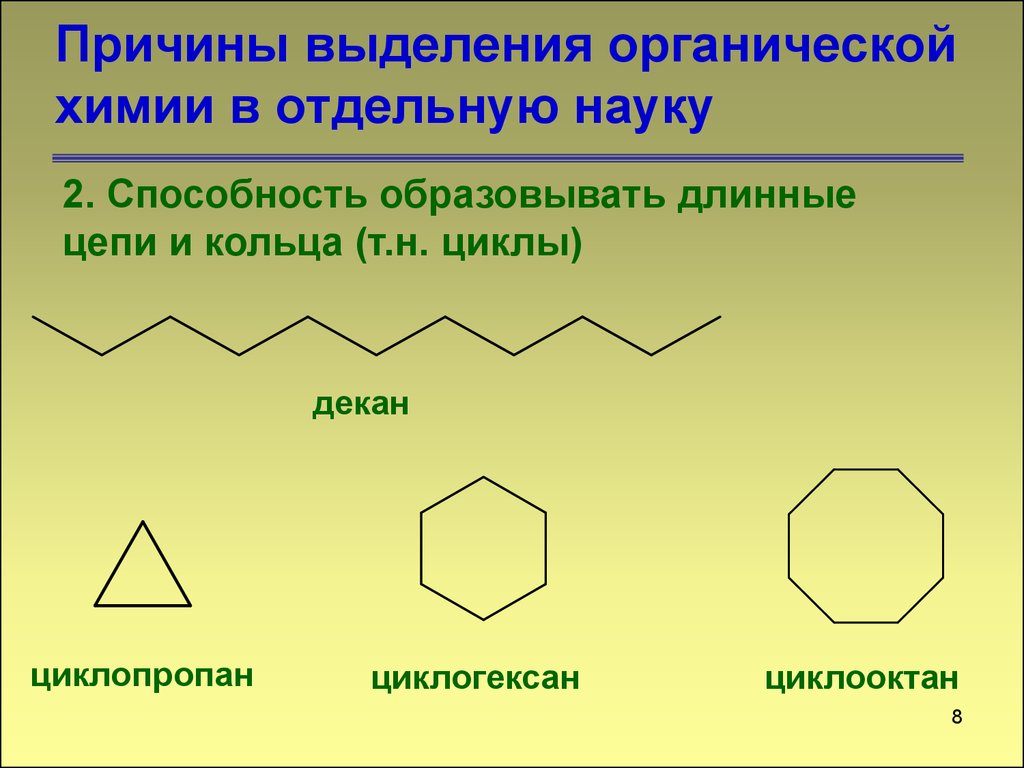
8. Причины выделения органической химии в отдельную науку
2. Способность образовывать длинныецепи и кольца (т.н. циклы)
декан
циклопропан
циклогексан
циклооктан
8
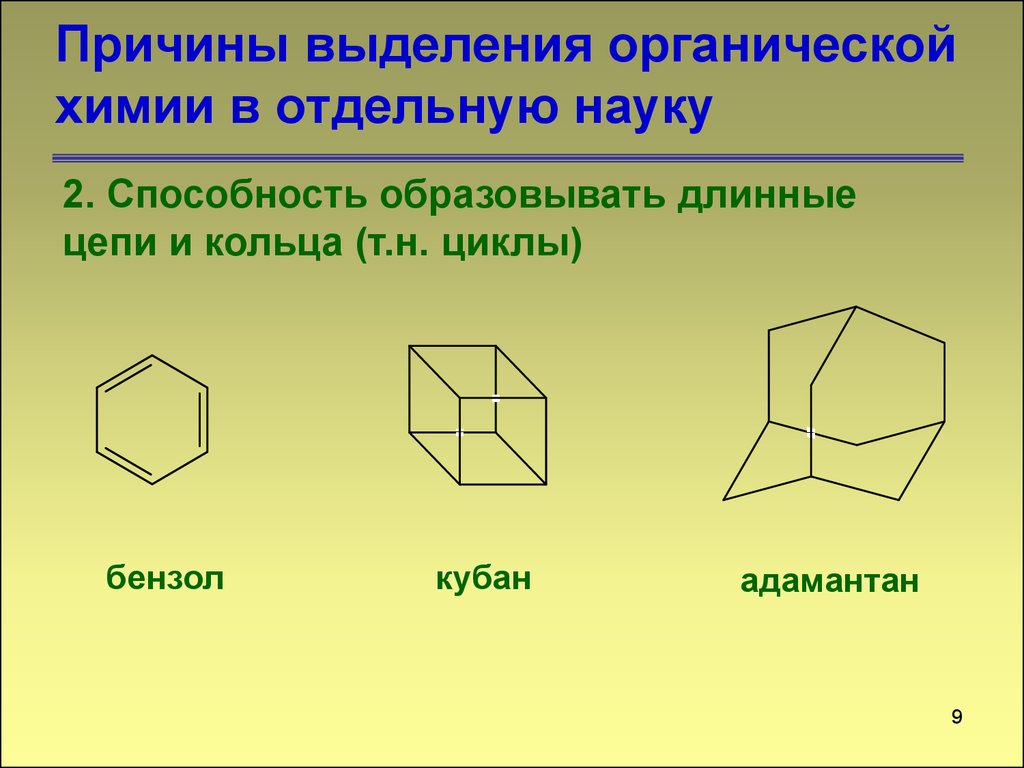
9. Причины выделения органической химии в отдельную науку
2. Способность образовывать длинныецепи и кольца (т.н. циклы)
бензол
кубан
адамантан
9
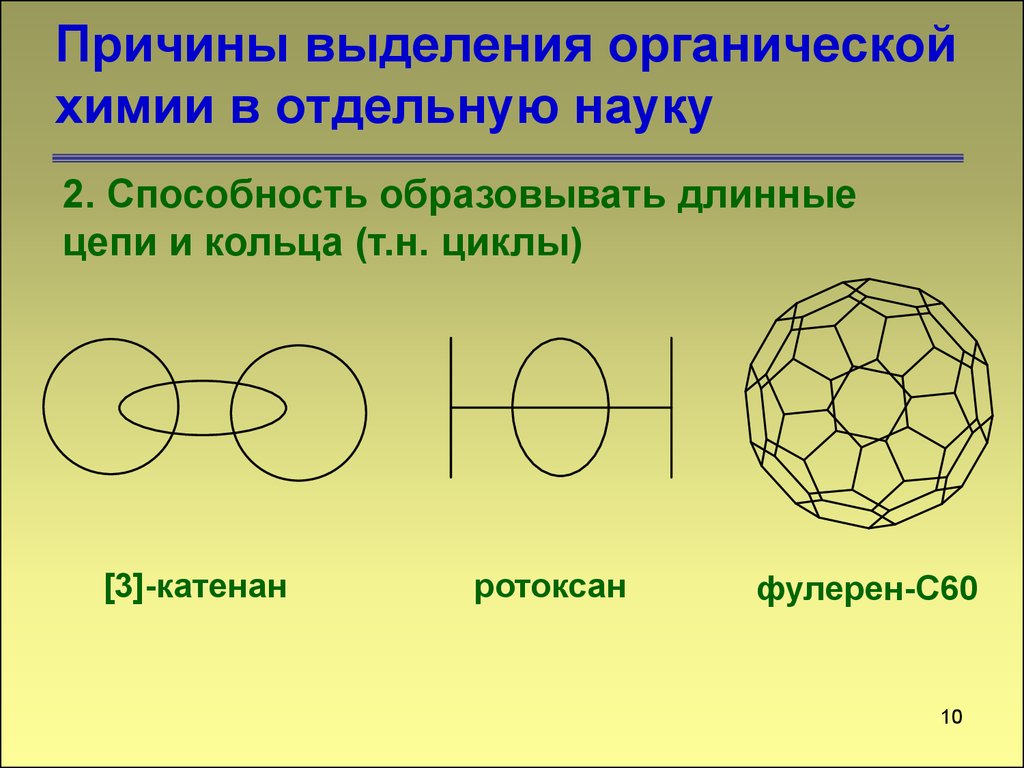
10. Причины выделения органической химии в отдельную науку
2. Способность образовывать длинныецепи и кольца (т.н. циклы)
[3]-катенан
ротоксан
фулерен-С60
10
11. Причины выделения органической химии в отдельную науку
3. Способность образовывать устойчивыеили очень устойчивые связи с другими
элементами
11
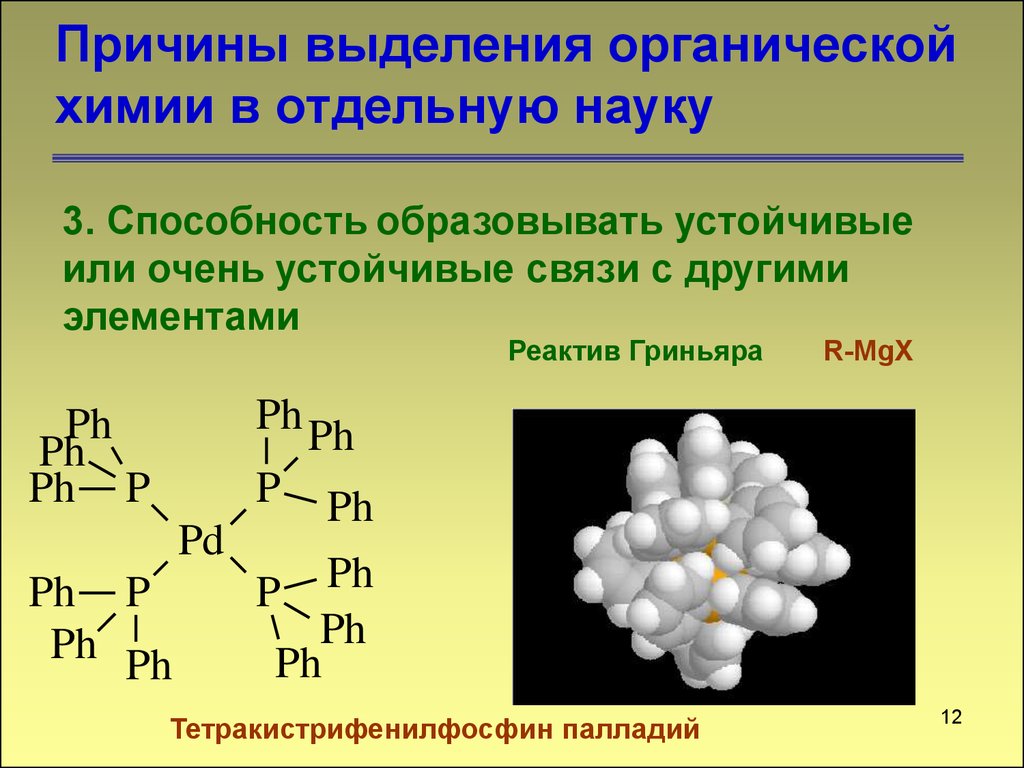
12. Причины выделения органической химии в отдельную науку
3. Способность образовывать устойчивыеили очень устойчивые связи с другими
элементами
Реактив Гриньяра
R-MgX
Ph Ph
Ph
Ph
Ph P
P
Pd
Ph P
Ph Ph
Ph
Ph
Ph
Ph
P
Тетракистрифенилфосфин палладий
12
13. Причины выделения органической химии в отдельную науку
4. Из всех элементов периодическойсистемы именно углерод играет главную и
определяющую роль в биологическом мире
13
14. Многочисленность органических соединений
Chemical AbstractService (CAS)
http://www.cas.org
14
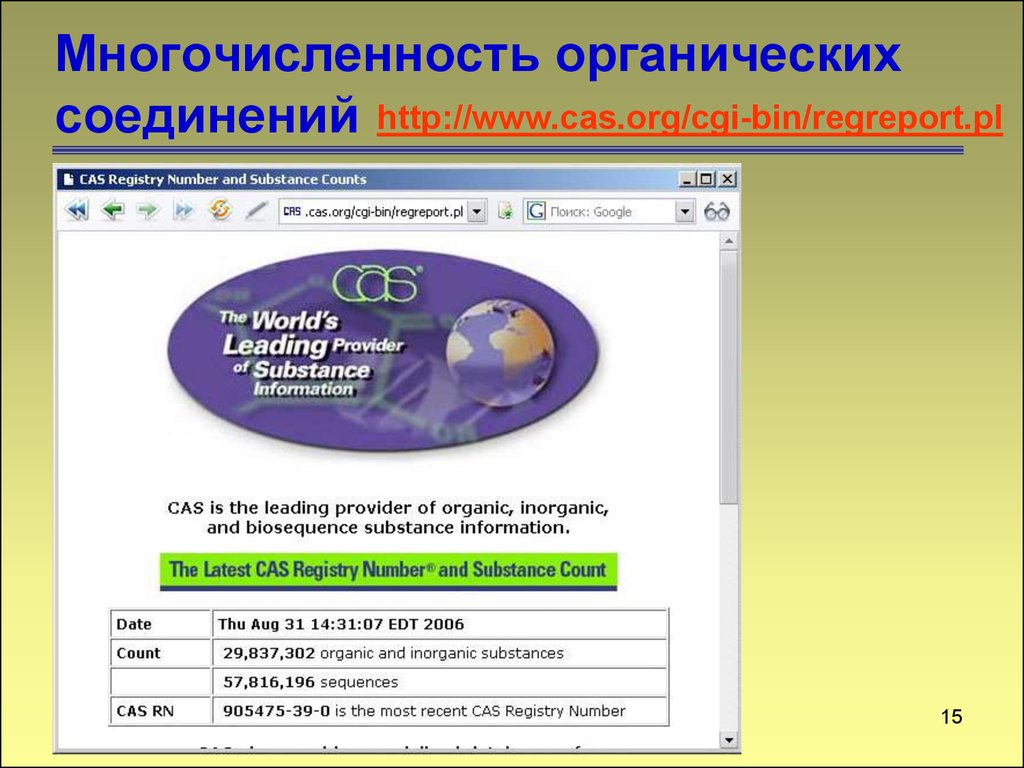
15. Многочисленность органических соединений
http://www.cas.org/cgi-bin/regreport.pl15
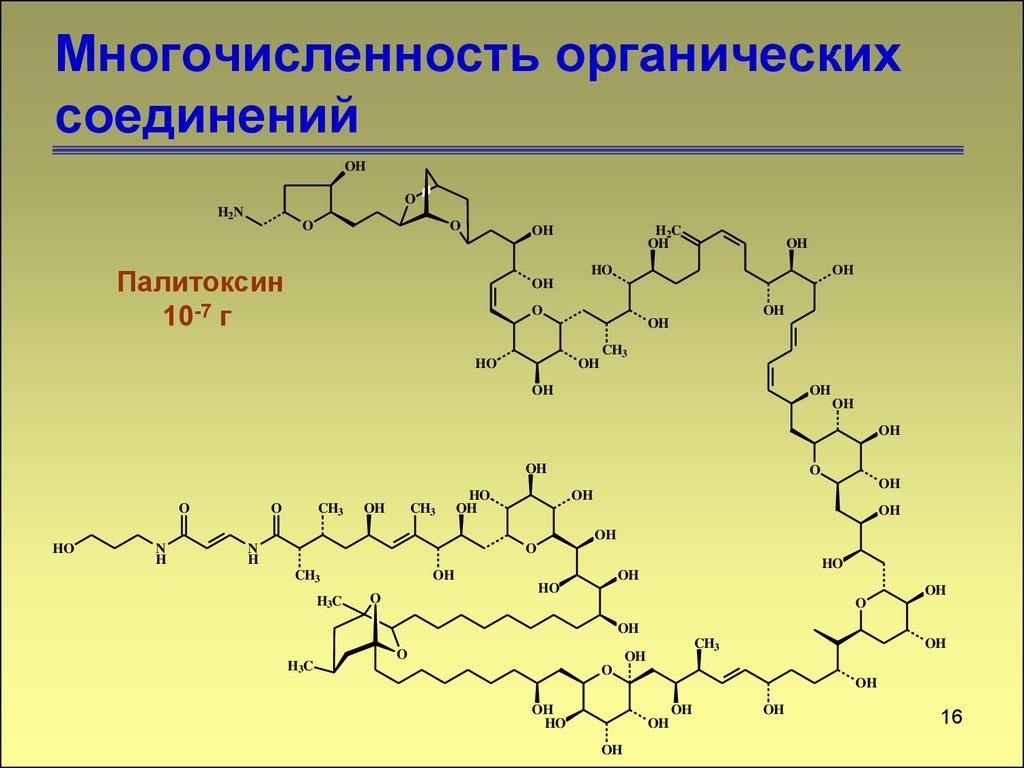
16. Многочисленность органических соединений
OHO
H2N
O
O
OH
H2C
OH
OH
HO
Палитоксин
10-7 г
OH
OH
O
OH
OH
HO
OH
CH3
OH
OH
OH
OH
OH
O
O
CH3
OH
CH3
HO
OH
O
OH
OH
OH
OH
HO
N
H
N
H
O
CH3
H3C
OH
HO
OH
HO
O
OH
O
OH
H3C
O
CH3
OH
OH
O
OH
OH
HO
OH
OH
OH
OH
16
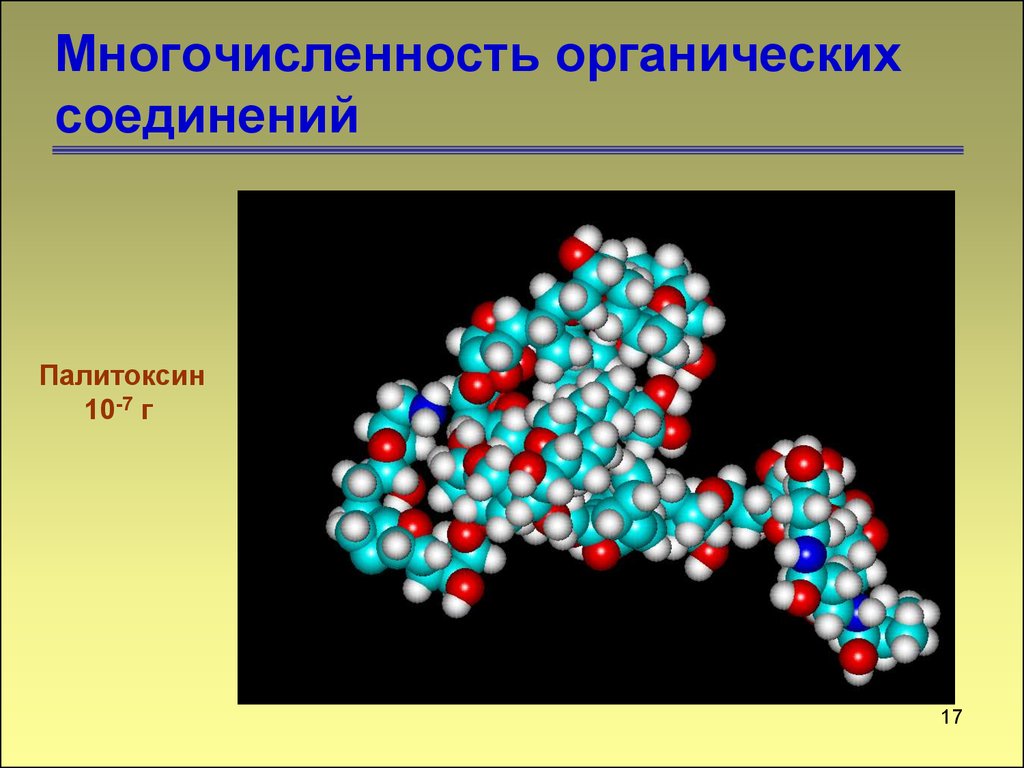
17. Многочисленность органических соединений
Палитоксин10-7 г
17
18. Многочисленность органических соединений
Итак, богатство и разнообразиемира органических соединений
является первой и важной
причиной выделения
органической химии в
самостоятельную науку.
18
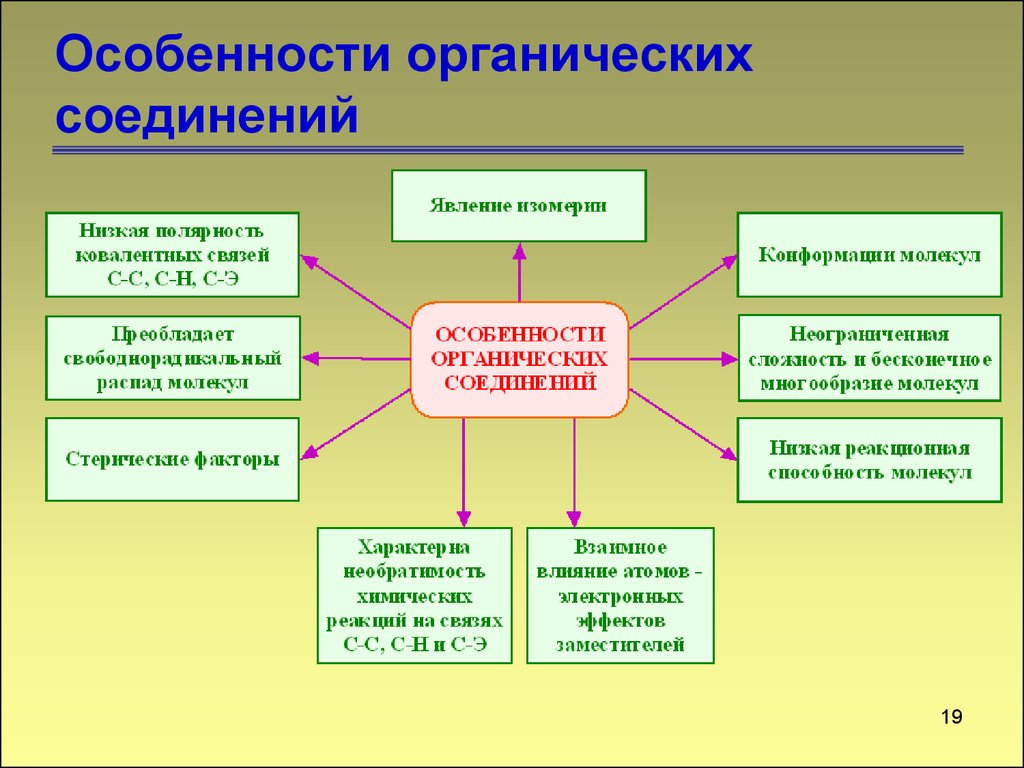
19. Особенности органических соединений
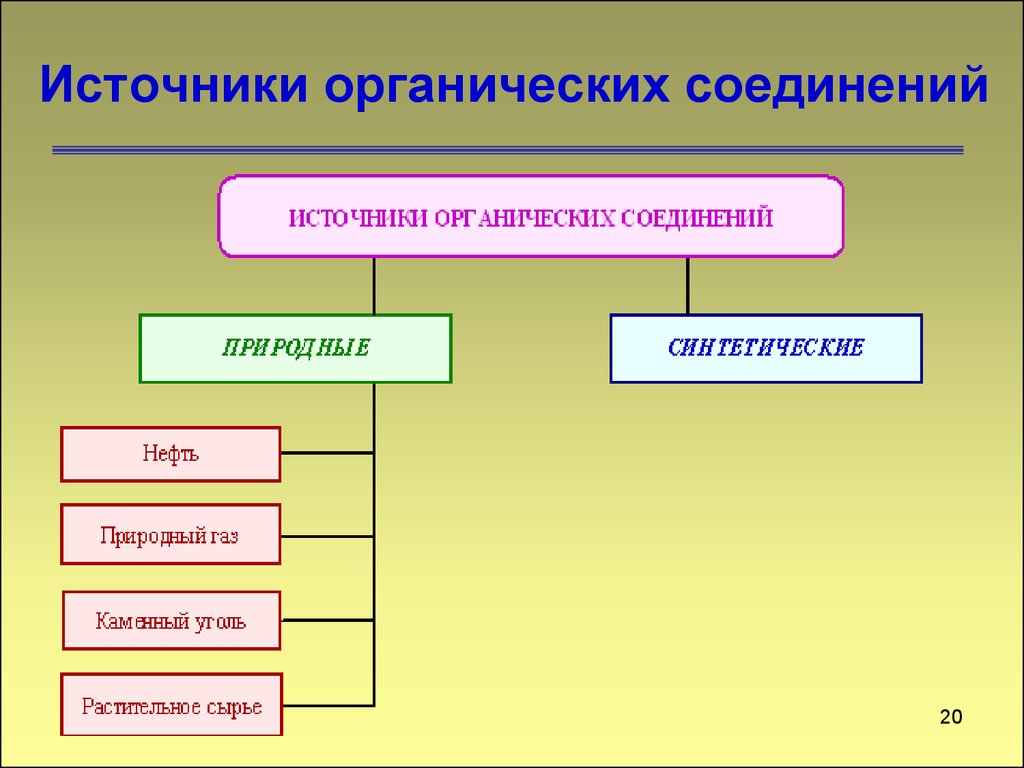
1920. Источники органических соединений
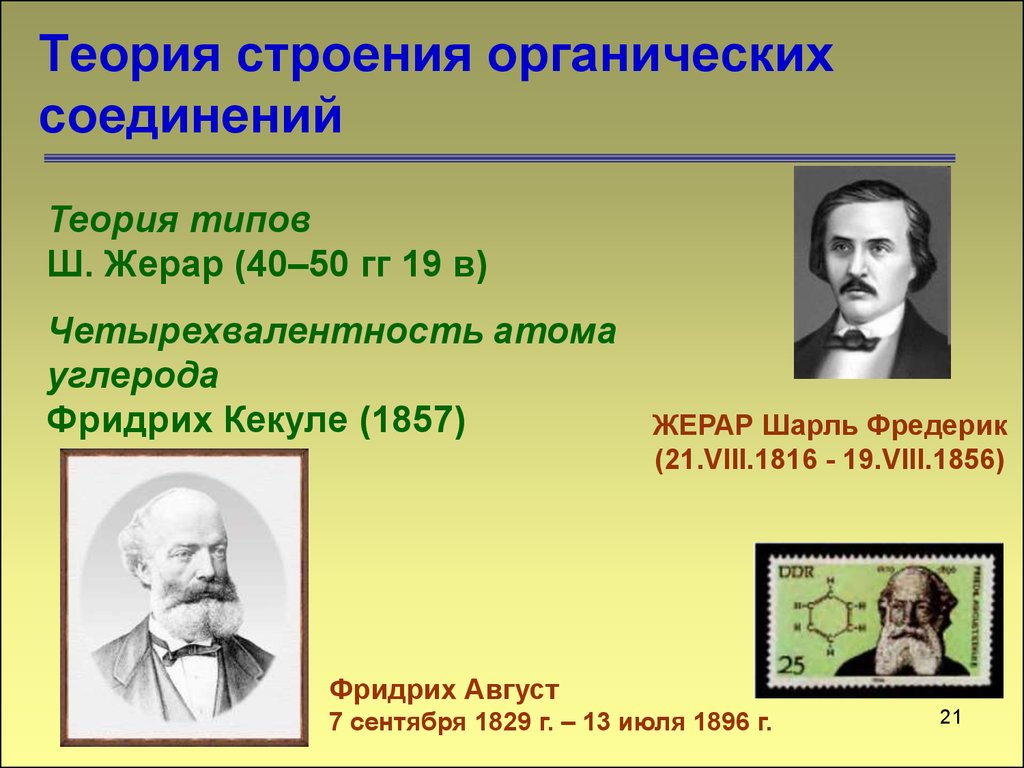
2021. Теория строения органических соединений
Теория типовШ. Жерар (40–50 гг 19 в)
Четырехвалентность атома
углерода
Фридрих Кекуле (1857)
ЖЕРАР Шарль Фредерик
(21.VIII.1816 - 19.VIII.1856)
Фридрих Август
7 сентября 1829 г. – 13 июля 1896 г.
21
22. Основные положения теории строения органических соединений (1861)
БУТЛЕРОВАлександр Михайлович
3(15) сентября 1828 г. –
5(17) августа 1886 г. 22
23. Основные положения теории строения органических соединений (1861)
1) атомы в молекулах соединены друг сдругом химическими связями в соответствии
с их валентностью;
2) атомы в молекулах органических веществ
соединяются между собой в определенной
последовательности, что обусловливает
химическое строение молекулы;
3) свойства органических соединений зависят
не только от числа и природы входящих в их
состав атомов, но и от химического строения
23
молекул;
24. Основные положения теории строения органических соединений (1861)
4) в молекулах существует взаимноевлияние атомов как связанных, так и
непосредственно друг с другом не
связанных;
5) химическое строение вещества можно
определить в результате изучения его
химических превращений и, наоборот, по
строению вещества можно характеризовать
его свойства.
24
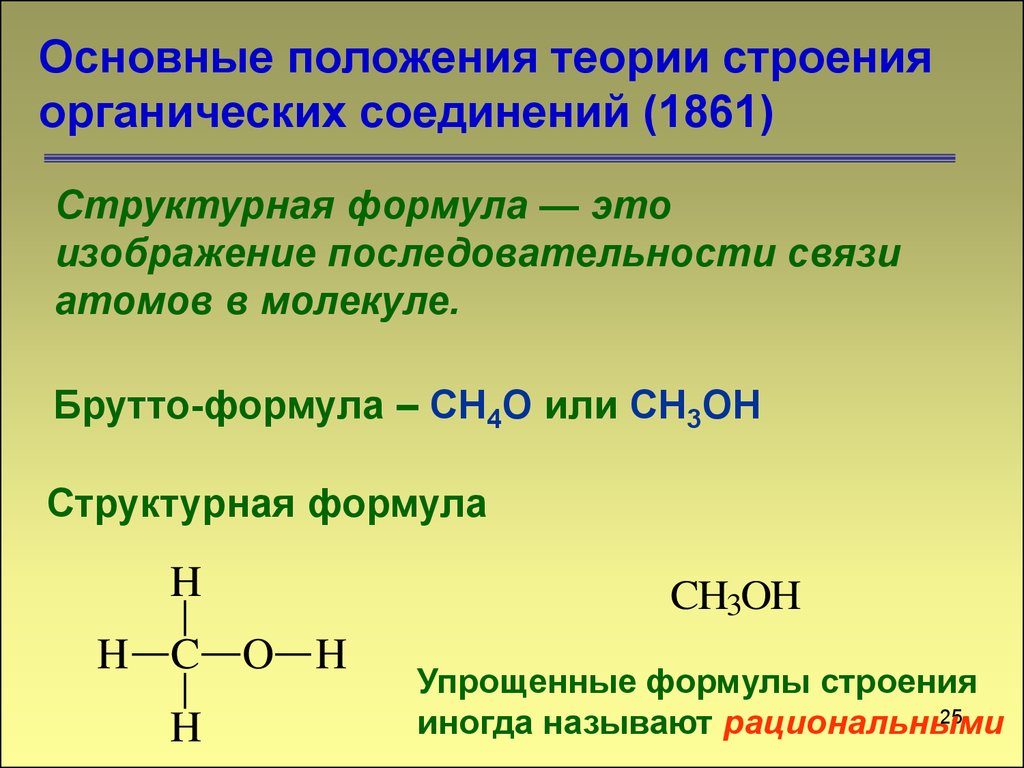
25. Основные положения теории строения органических соединений (1861)
Структурная формула — этоизображение последовательности связи
атомов в молекуле.
Брутто-формула – СН4О или CH3OH
Структурная формула
H
H C O H
H
CH3OH
Упрощенные формулы строения
25
иногда называют рациональными
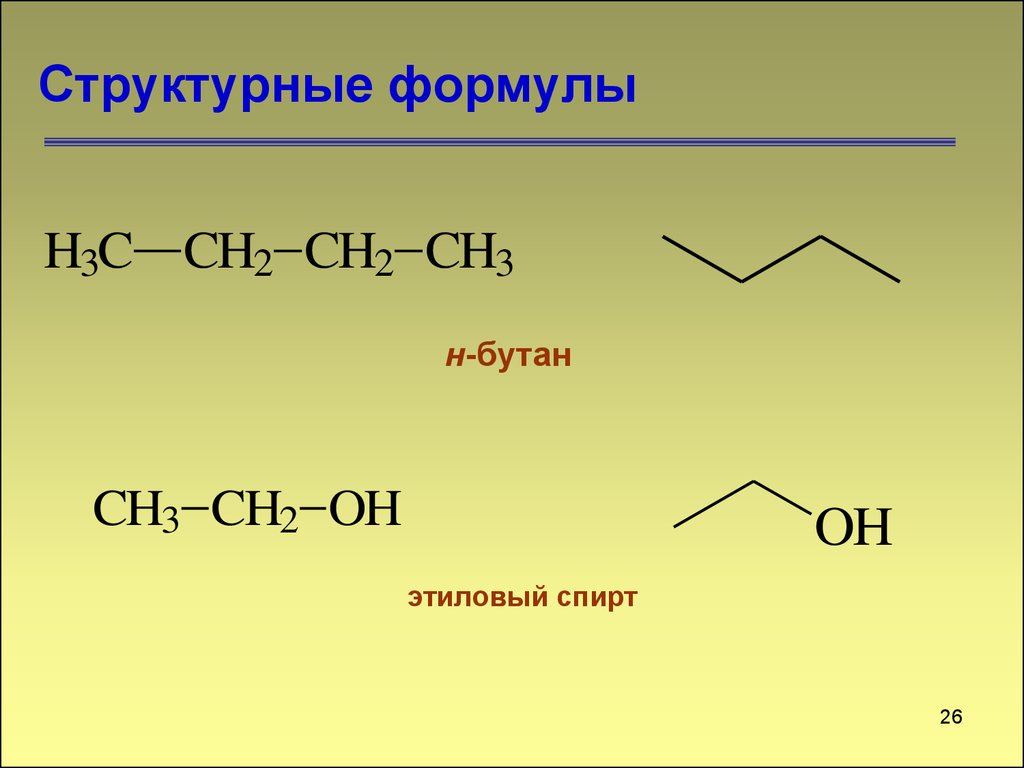
26. Структурные формулы
H3C CH2 CH2 CH3н-бутан
CH3 CH2 OH
OH
этиловый спирт
26
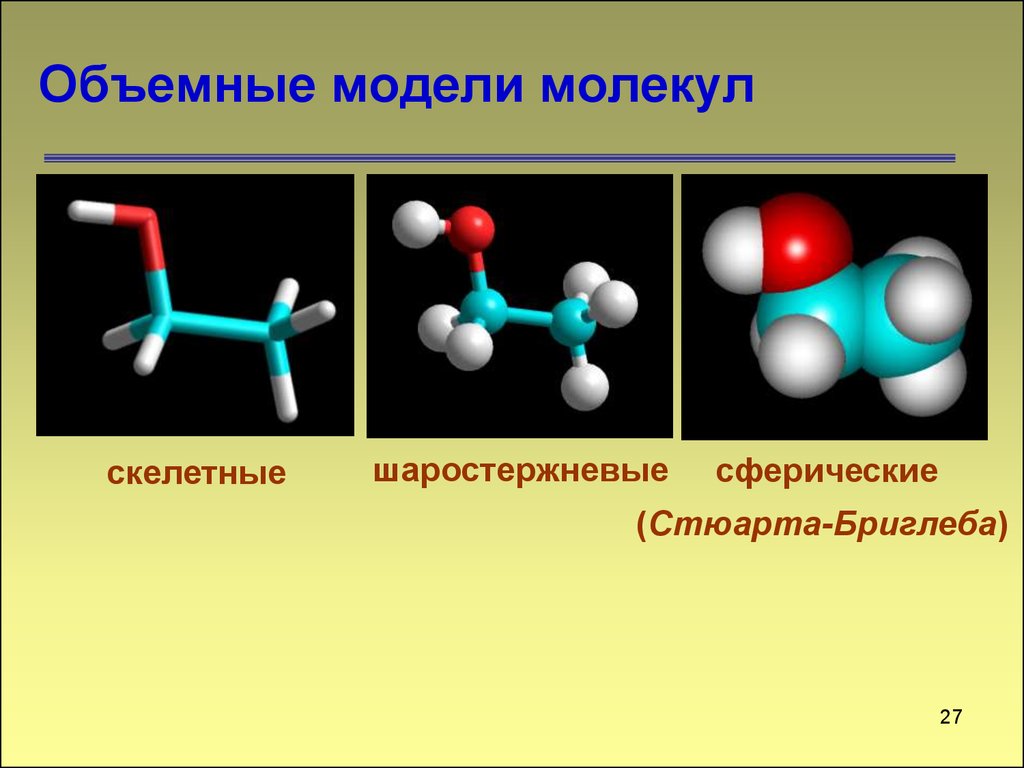
27. Объемные модели молекул
скелетныешаростержневые
сферические
(Стюарта-Бриглеба)
27
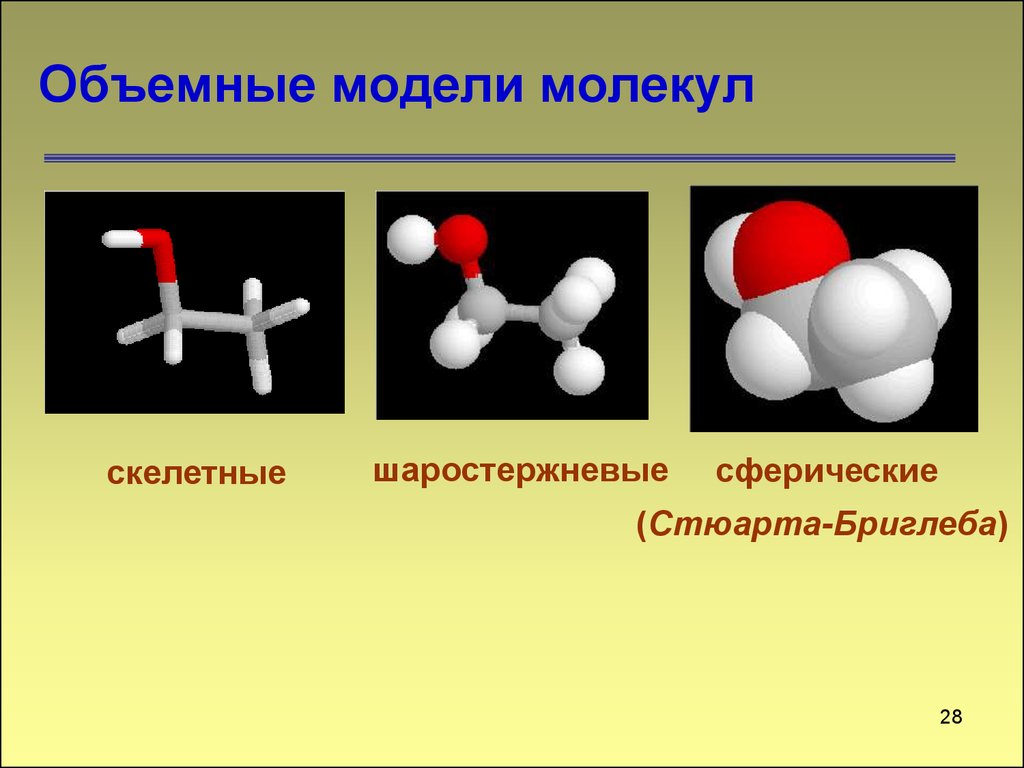
28. Объемные модели молекул
скелетныешаростержневые
сферические
(Стюарта-Бриглеба)
28
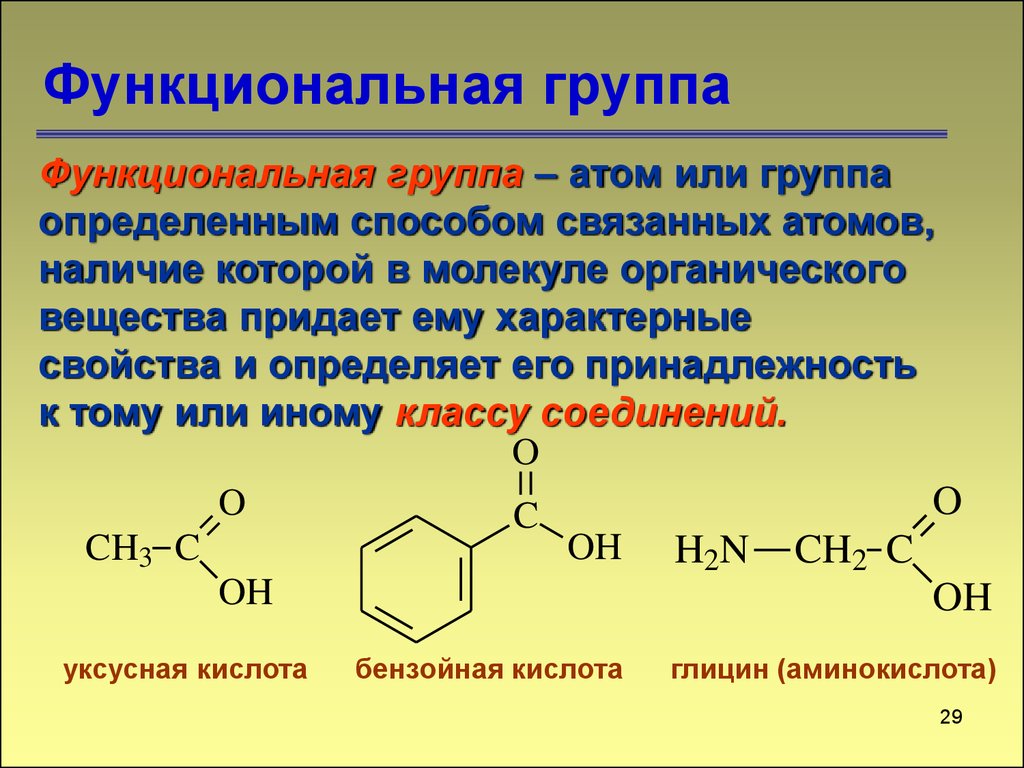
29. Функциональная группа
Функциональная группа – атом или группаопределенным способом связанных атомов,
наличие которой в молекуле органического
вещества придает ему характерные
свойства и определяет его принадлежность
к тому или иному классу соединений.
O
O
O
C
OH H2N CH2 C
CH3 C
OH
OH
уксусная кислота
бензойная кислота
глицин (аминокислота)
29
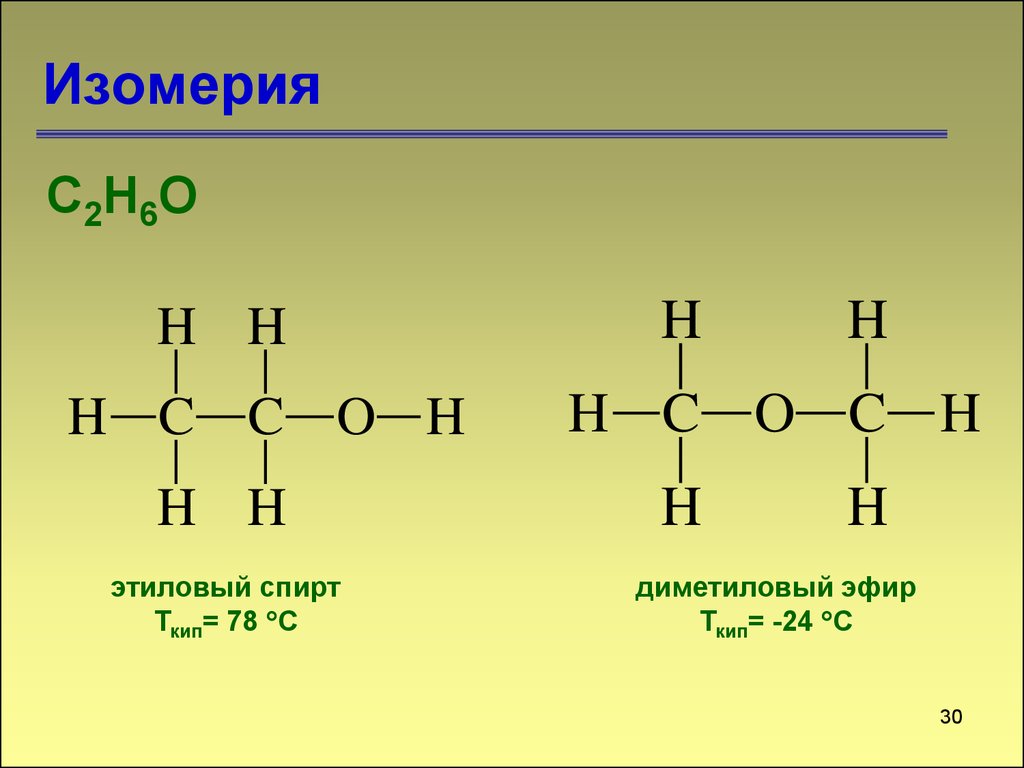
30. Изомерия
С2Н6ОH H
H C C O H
H H
этиловый спирт
Ткип= 78 С
H
H
H C O C H
H
H
диметиловый эфир
Ткип= -24 С
30
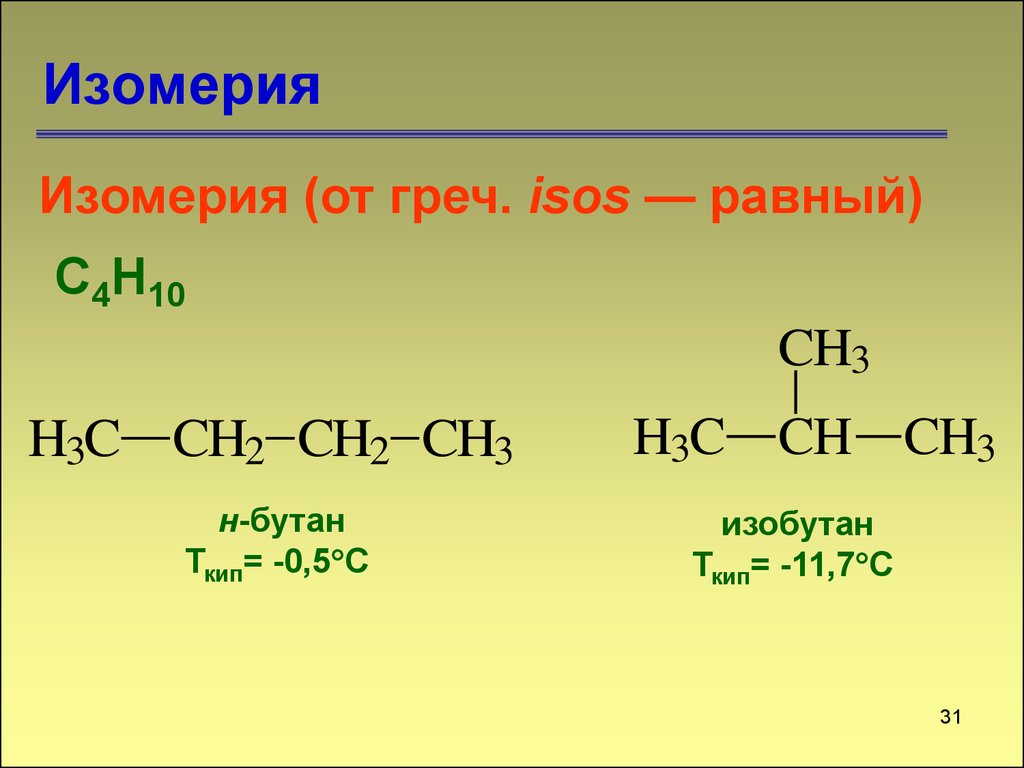
31. Изомерия
Изомерия (от греч. isos — равный)С4Н10
CH3
H3C CH2 CH2 CH3
н-бутан
Ткип= -0,5 С
H3C CH CH3
изобутан
Ткип= -11,7 С
31
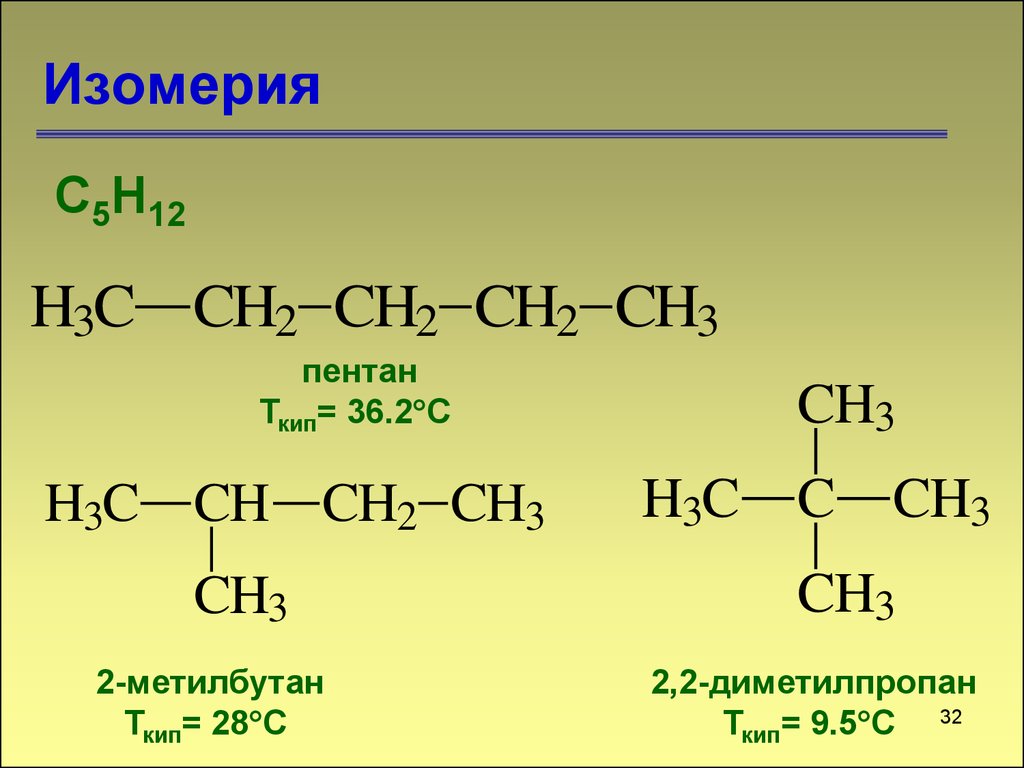
32. Изомерия
С5Н12H3C CH2 CH2 CH2 CH3
пентан
Ткип= 36.2 С
H3C CH CH2 CH3
CH3
2-метилбутан
Ткип= 28 С
CH3
H3C
C
CH3
CH3
2,2-диметилпропан
Ткип= 9.5 С 32
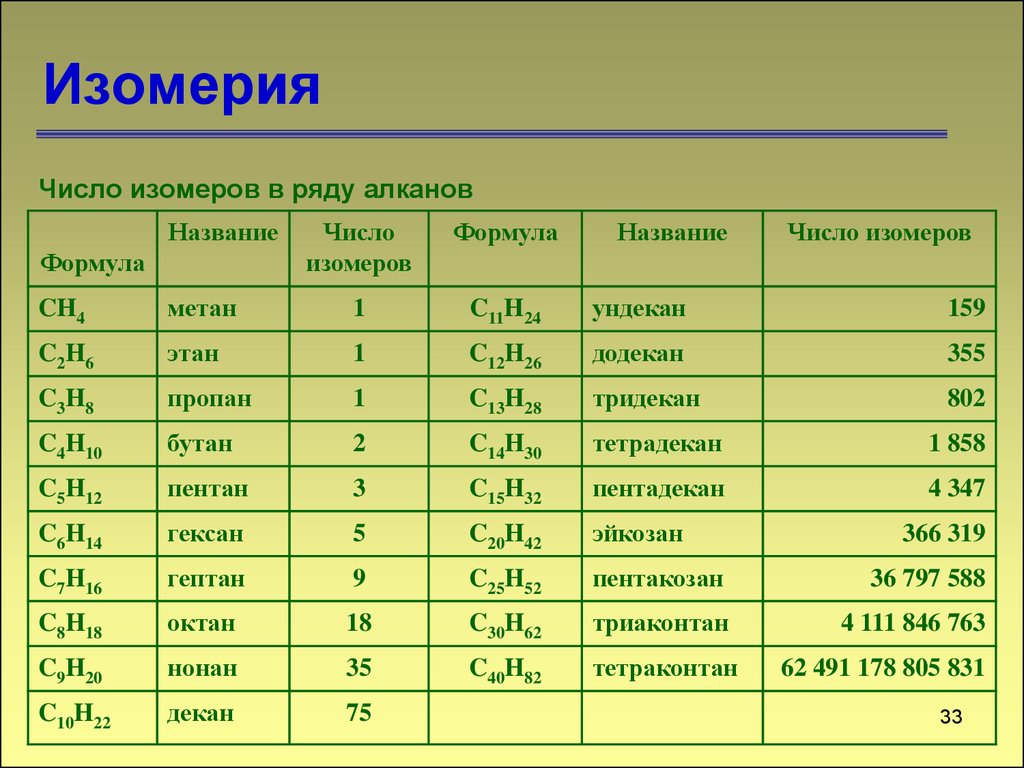
33. Изомерия
Число изомеров в ряду алкановНазвание
Формула
Число
изомеров
Формула
Название
Число изомеров
CH4
метан
1
C11H24
ундекан
159
C2H6
этан
1
C12H26
додекан
355
C3H8
пропан
1
C13H28
тридекан
802
C4H10
бутан
2
C14H30
тетрадекан
1 858
C5H12
пентан
3
C15H32
пентадекан
4 347
C6H14
гексан
5
C20H42
эйкозан
C7H16
гептан
9
C25H52
пентакозан
36 797 588
C8H18
октан
18
C30H62
триаконтан
4 111 846 763
C9H20
нонан
35
C40H82
тетраконтан
C10H22
декан
75
366 319
62 491 178 805 831
33
34. Изомерия
Изомеры — это вещества,которые имеют одинаковую
молекулярную формулу, но
различное химическое строение,
а поэтому обладают разными
свойствами.
34
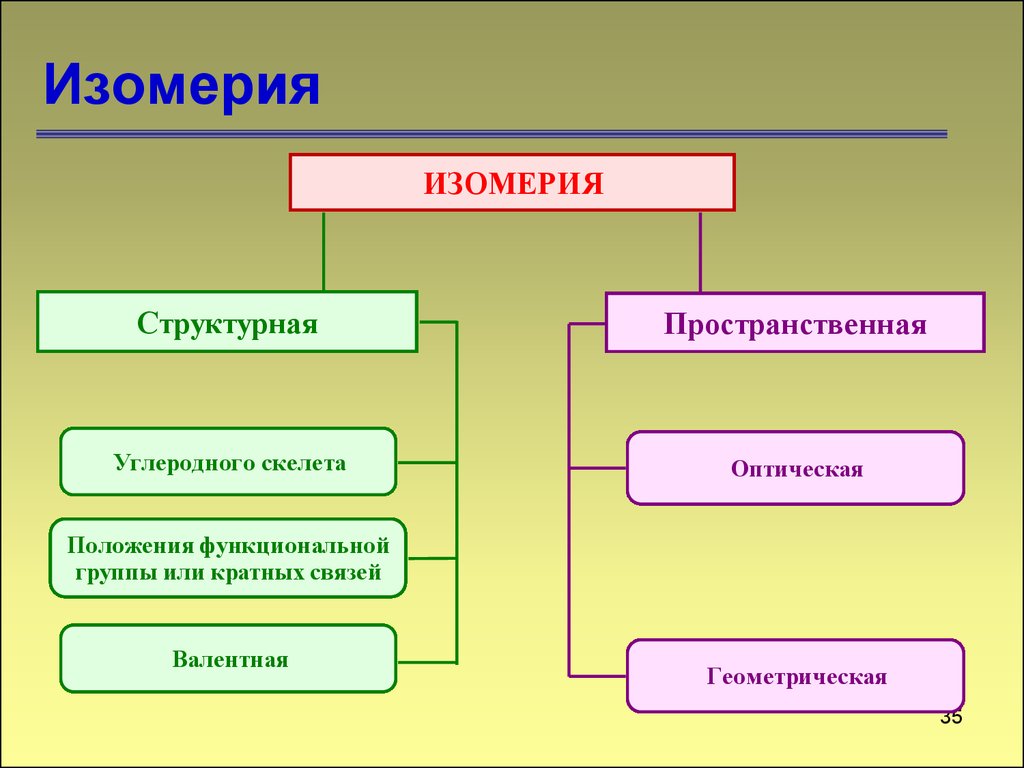
35. Изомерия
ИЗОМЕРИЯСтруктурная
Пространственная
Углеродного скелета
Оптическая
Положения функциональной
группы или кратных связей
Валентная
Геометрическая
35
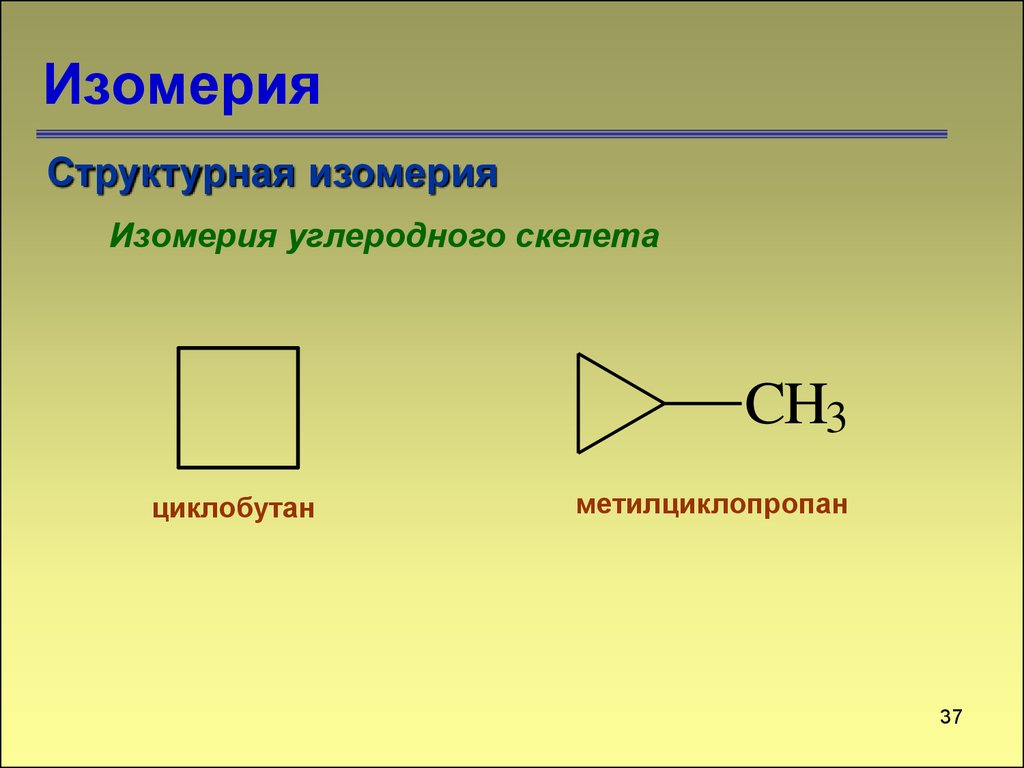
36. Изомерия
Структурная изомерияИзомерия углеродного скелета
CH3
циклобутан
метилциклопропан
37
37. Изомерия
Структурная изомерияИзомерия положения функциональной группы
CH3CH2CH2CH2OH
CH3CHCH2CH3
OH
бутан-1-ол
бутан-2-ол
CH2 CHCH3CH3
CH3CH CHCH3
бут-1-ен
бут-2-ен
38
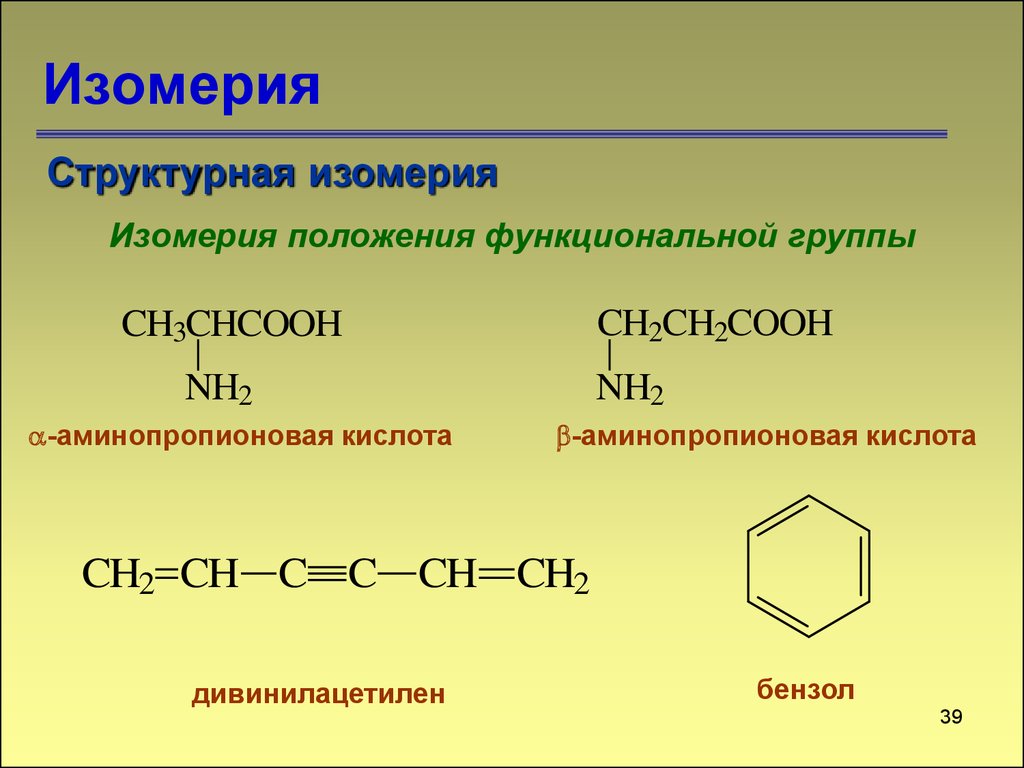
38. Изомерия
Структурная изомерияИзомерия положения функциональной группы
CH2CH2COOH
CH3CHCOOH
NH2
NH2
-аминопропионовая кислота
-аминопропионовая кислота
CH2 CH C C CH CH2
дивинилацетилен
бензол
39
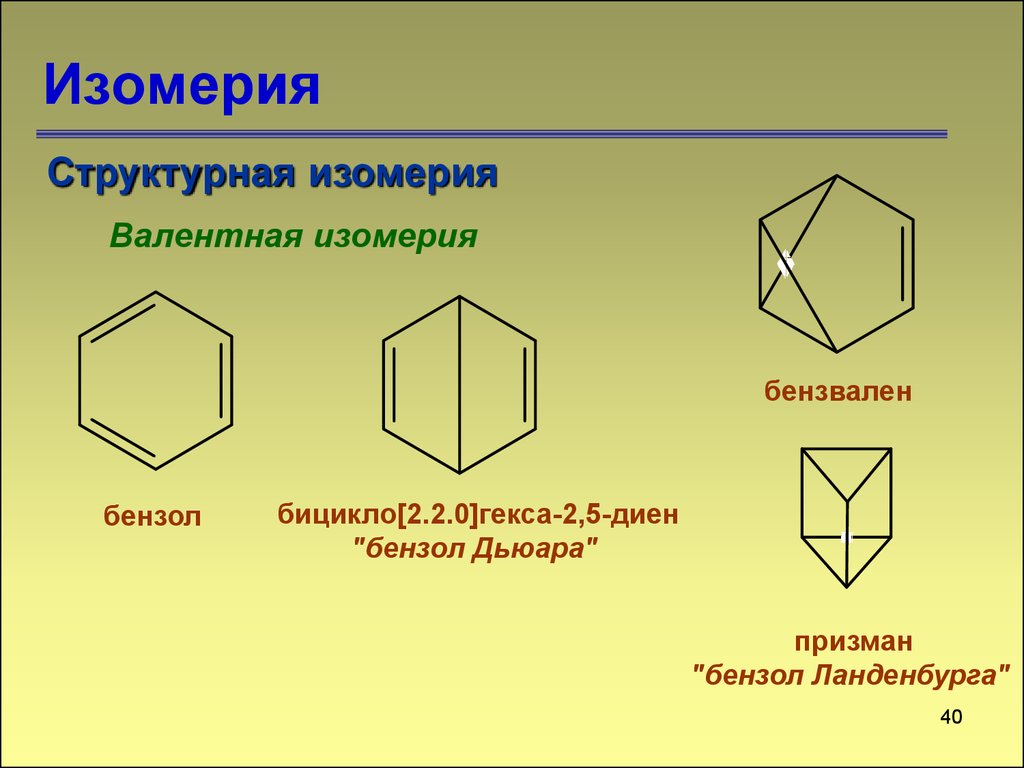
39. Изомерия
Структурная изомерияВалентная изомерия
бензвален
бензол
бицикло[2.2.0]гекса-2,5-диен
"бензол Дьюара"
призман
"бензол Ланденбурга"
40
40. Изомерия
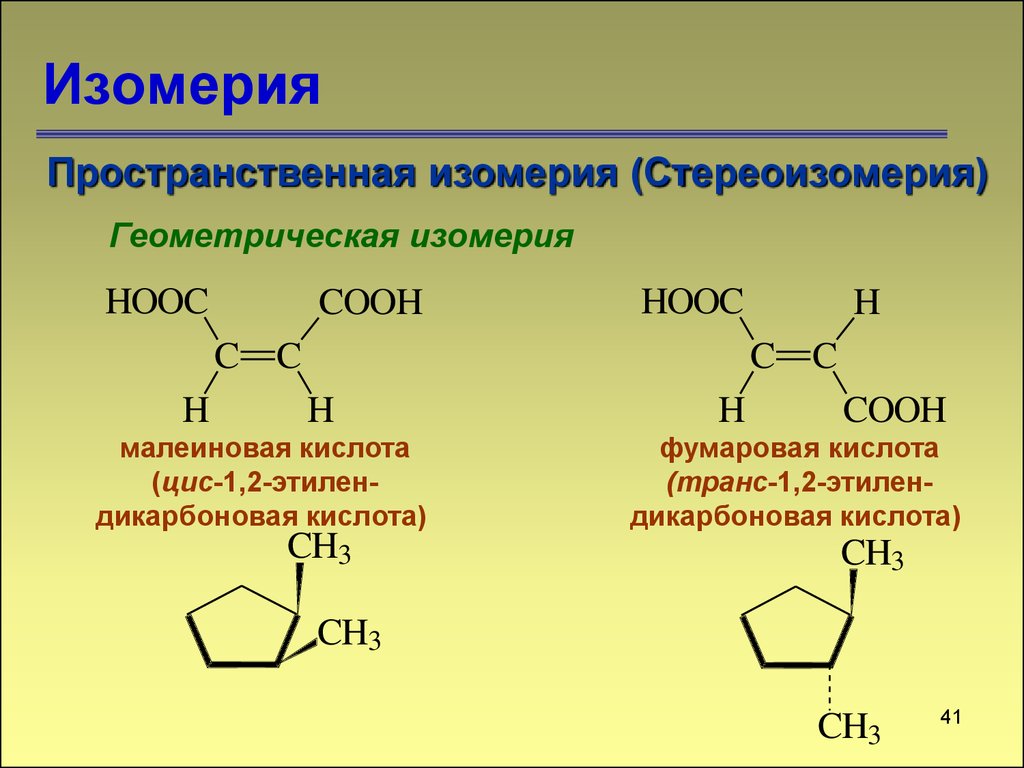
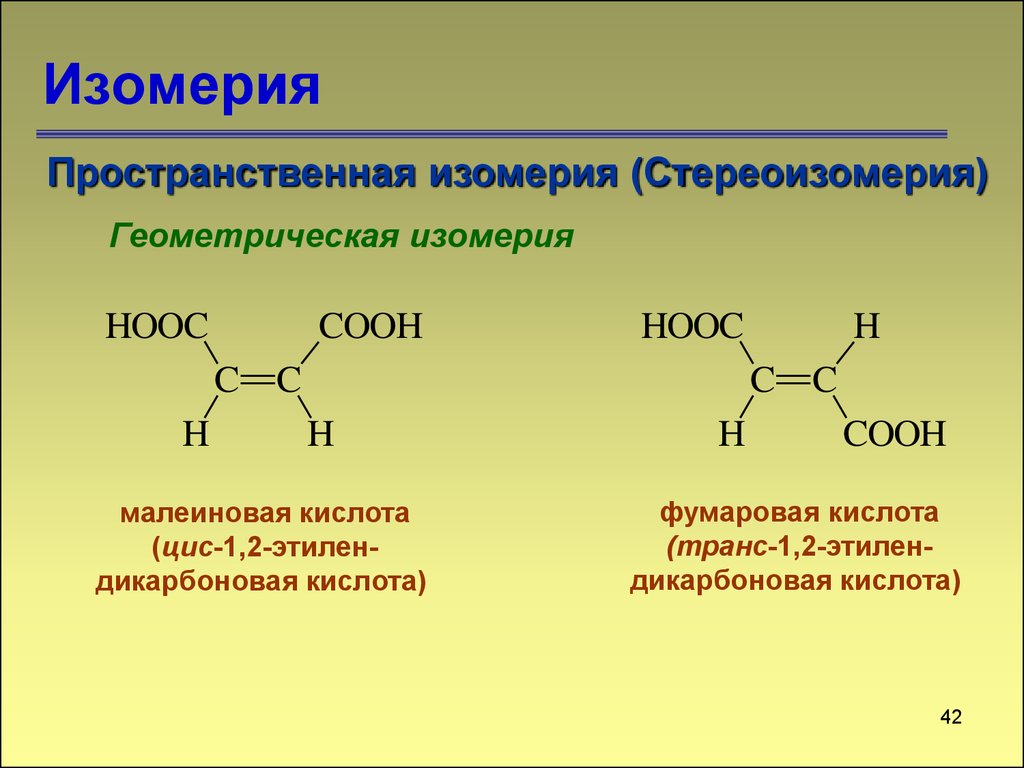
Пространственная изомерия (Стереоизомерия)Геометрическая изомерия
HOOC
COOH
HOOC
C C
H
H
C C
H
малеиновая кислота
(цис-1,2-этилендикарбоновая кислота)
CH3
H
COOH
фумаровая кислота
(транс-1,2-этилендикарбоновая кислота)
CH3
CH3
CH3
41
41. Изомерия
Пространственная изомерия (Стереоизомерия)Геометрическая изомерия
HOOC
COOH
HOOC
C C
H
H
C C
H
малеиновая кислота
(цис-1,2-этилендикарбоновая кислота)
H
COOH
фумаровая кислота
(транс-1,2-этилендикарбоновая кислота)
42
42. Изомерия
Пространственная изомерия (Стереоизомерия)Геометрическая изомерия
CH3
CH3
CH3
цис-1,2-диметилциклопентан
CH3
транс-1,2-диметилциклопентан
43
43. Изомерия
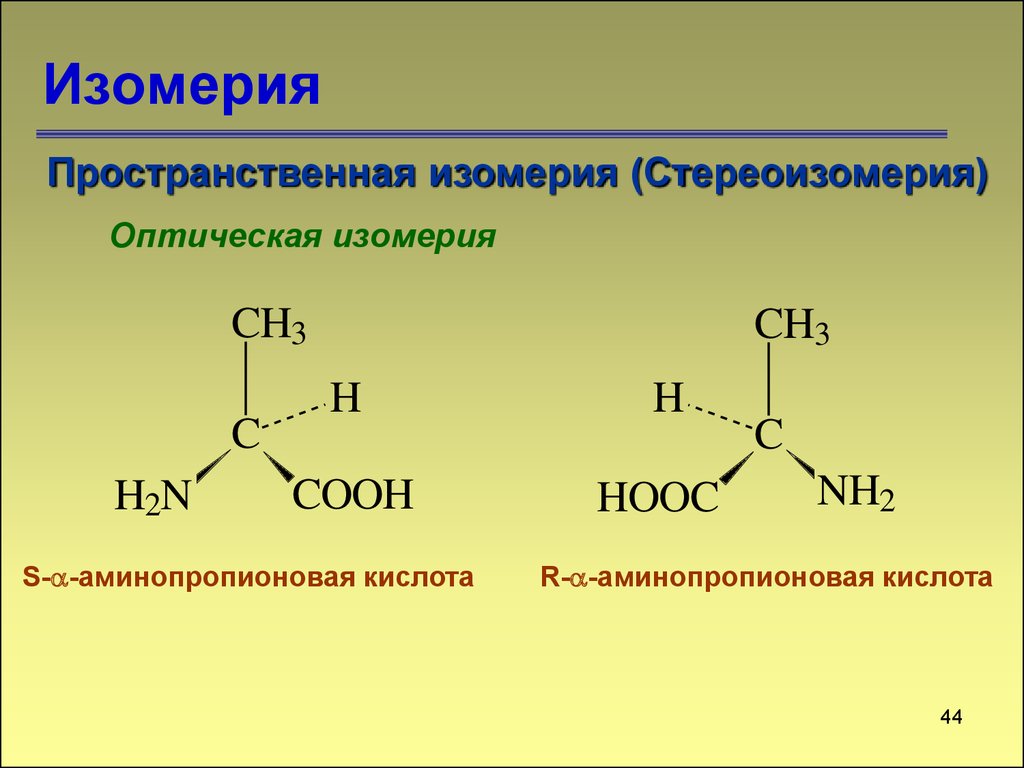
Пространственная изомерия (Стереоизомерия)Оптическая изомерия
CH3
C
H2N
CH3
H
H
COOH
HOOC
S- -аминопропионовая кислота
C
NH2
R- -аминопропионовая кислота
44
44. Изомерия
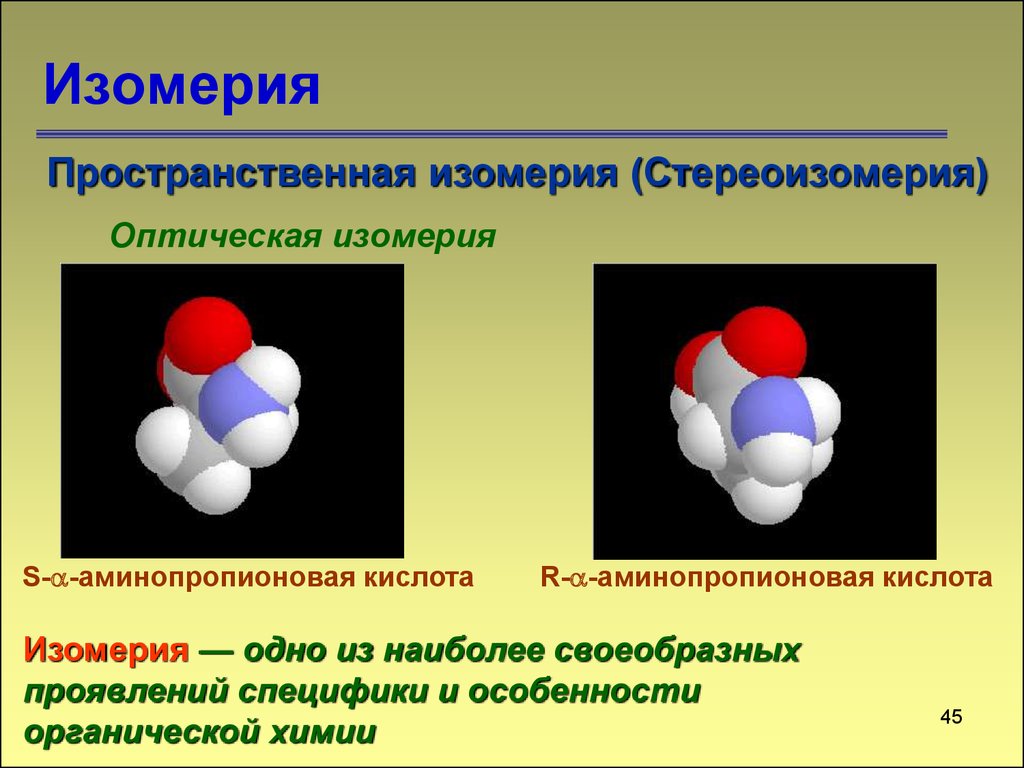
Пространственная изомерия (Стереоизомерия)Оптическая изомерия
S- -аминопропионовая кислота
R- -аминопропионовая кислота
Изомерия — одно из наиболее своеобразных
проявлений специфики и особенности
органической химии
45
45. Изомерия
ГомологияГруппы органических соединений
однотипной структуры с одинаковой
функциональными группами,
отличающиеся друг от друга по
количеству групп CH2 в углеродной цепи,
составляют гомологический ряд.
Гомологический ряд метана
CH4 CH3CH3 CH3CH2CH3 CH3CH2CH2CH3
и т.д.
46
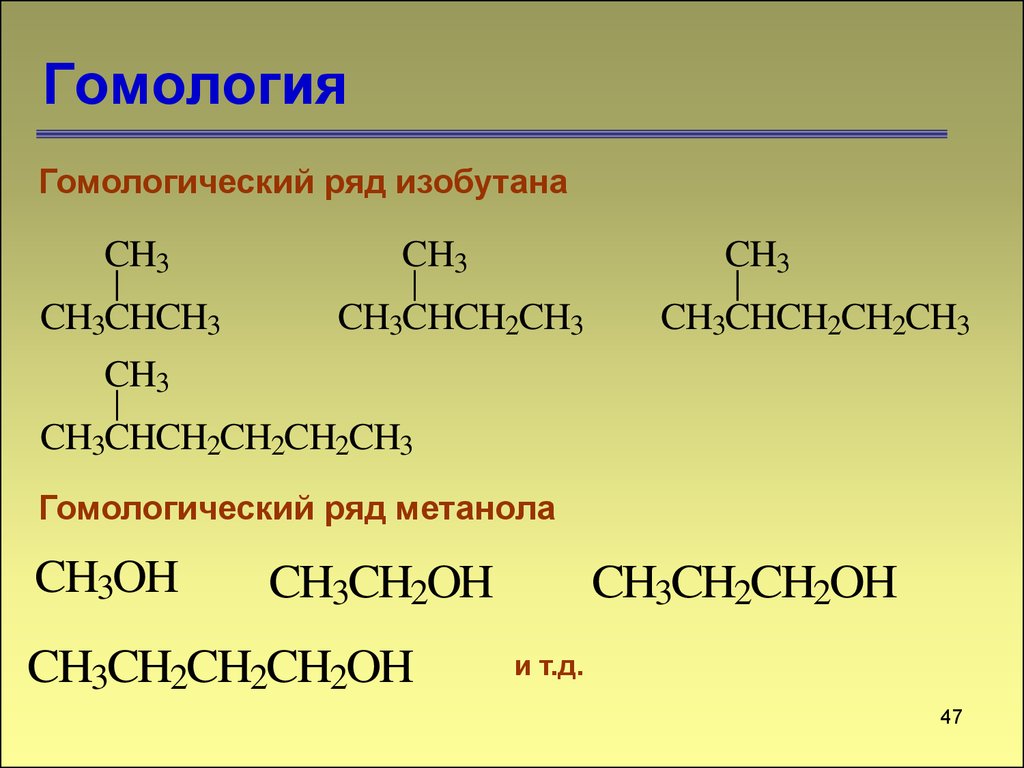
46. Гомология
Гомологический ряд изобутанаCH3
CH3CHCH3
CH3
CH3
CH3CHCH2CH3
CH3CHCH2CH2CH3
CH3
CH3CHCH2CH2CH2CH3
Гомологический ряд метанола
CH3OH
CH3CH2OH
CH3CH2CH2CH2OH
CH3CH2CH2OH
и т.д.
47
47. Гомология
Учение о взаимном влиянииатомов в молекуле
МАРКОВНИКОВ
Владимир Васильевич
1837–1904
48
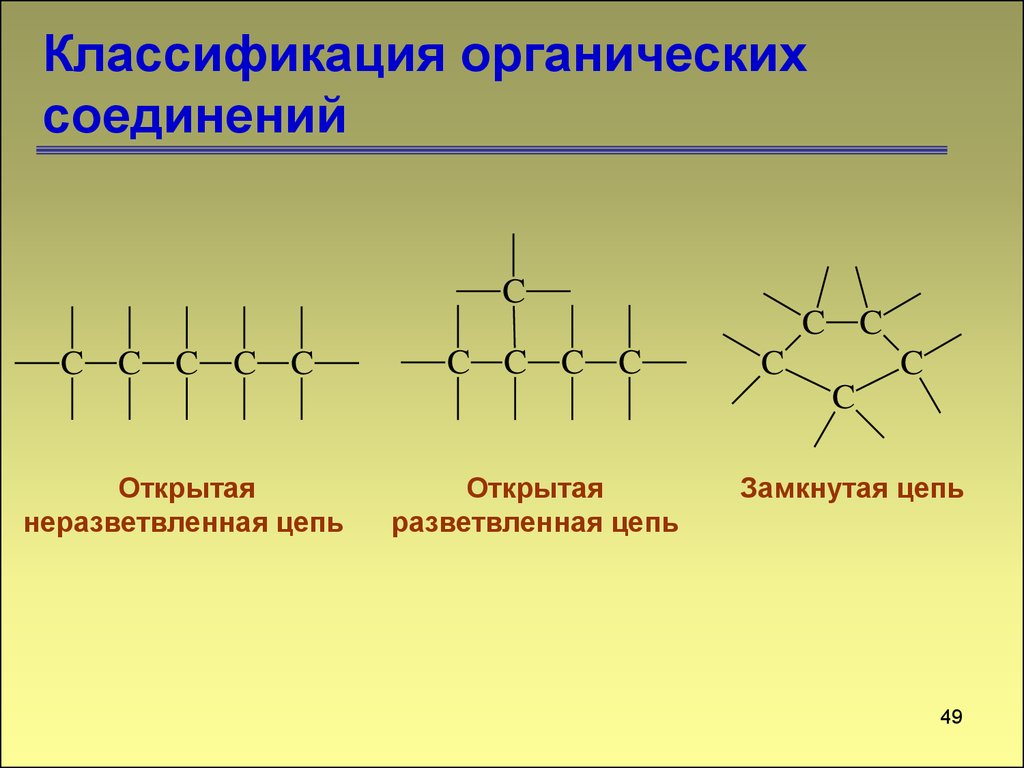
48. Учение о взаимном влиянии атомов в молекуле
Классификация органическихсоединений
C
C
C
C
C
C
C C C C
C C
C
C
C
Открытая
неразветвленная цепь
Открытая
разветвленная цепь
Замкнутая цепь
49
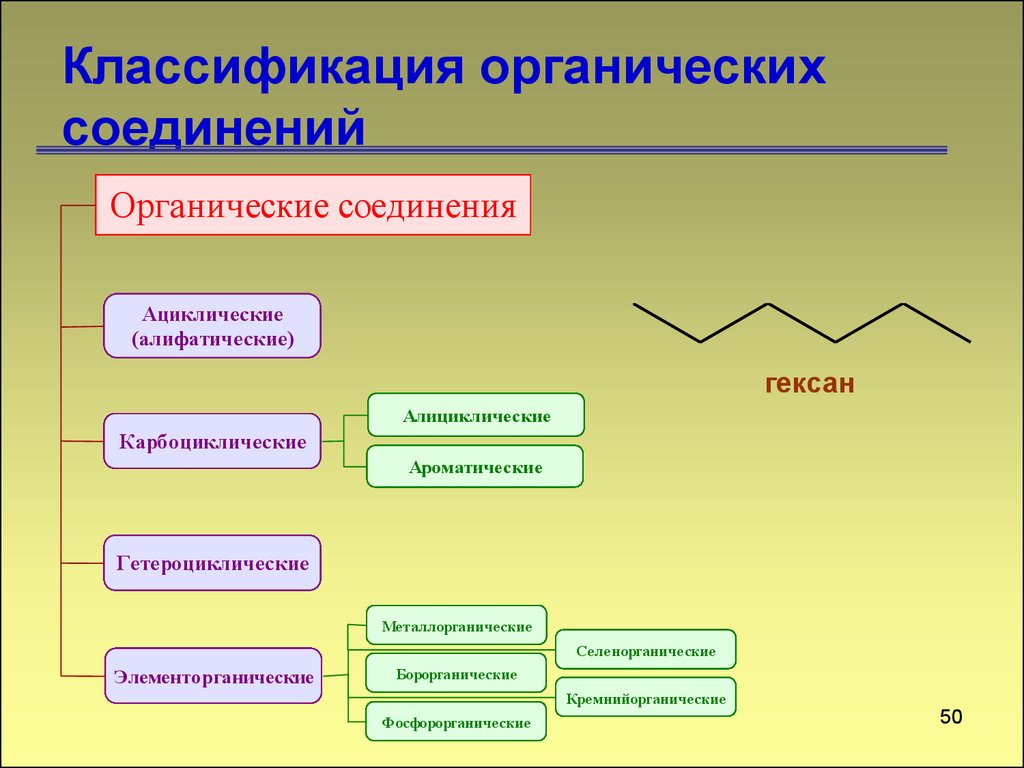
49. Классификация органических соединений
Органические соединенияАциклические
(алифатические)
гексан
Алициклические
Карбоциклические
Ароматические
Гетероциклические
Металлорганические
Селенорганические
Элементорганические
Борорганические
Кремнийорганические
Фосфорорганические
50
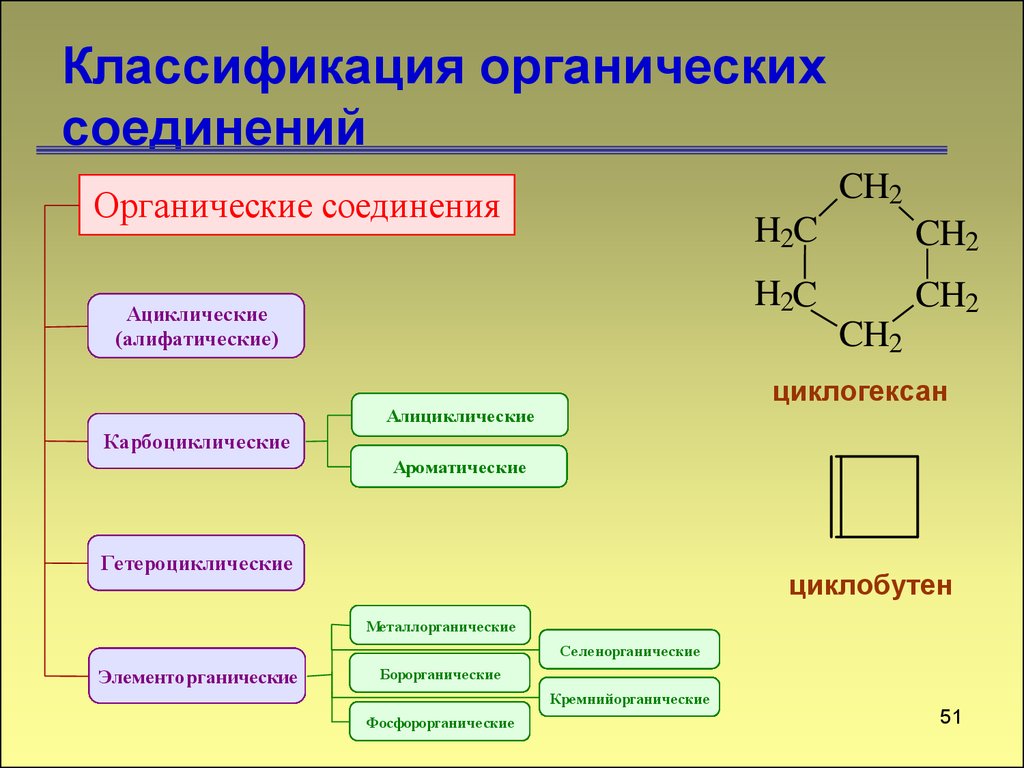
50. Классификация органических соединений
CH2Органические соединения
Ациклические
(алифатические)
H2C
CH2
H2C
CH2
CH2
циклогексан
Алициклические
Карбоциклические
Ароматические
Гетероциклические
циклобутен
Металлорганические
Селенорганические
Элементорганические
Борорганические
Кремнийорганические
Фосфорорганические
51
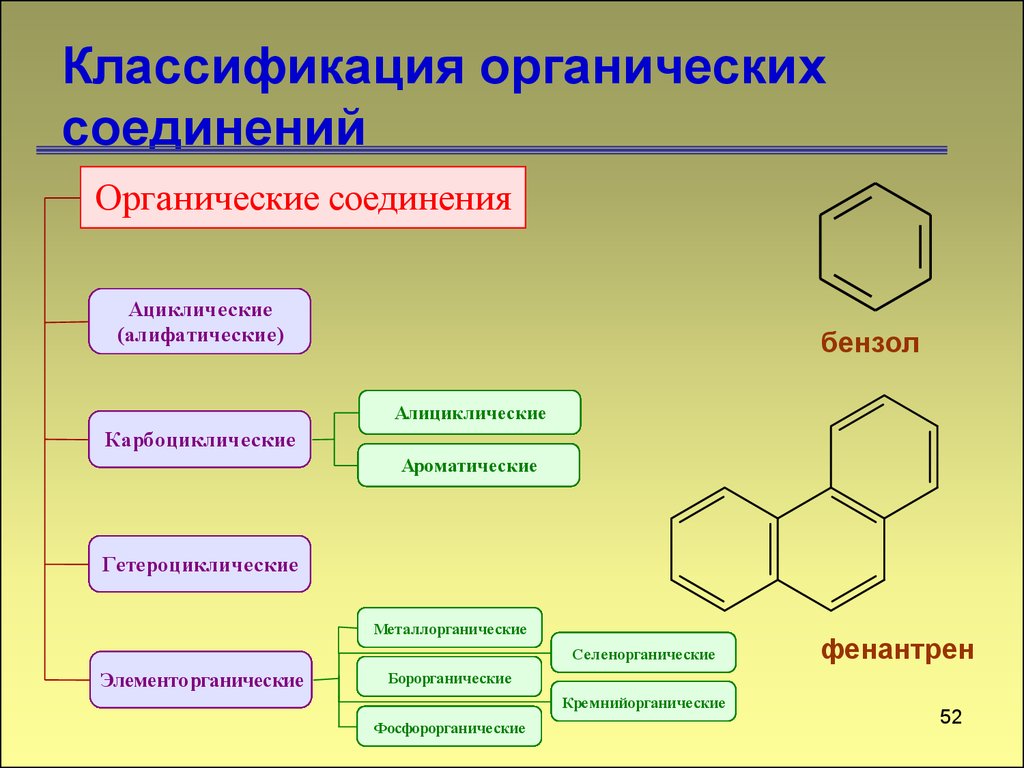
51. Классификация органических соединений
Органические соединенияАциклические
(алифатические)
бензол
Алициклические
Карбоциклические
Ароматические
Гетероциклические
Металлорганические
Селенорганические
Элементорганические
фенантрен
Борорганические
Кремнийорганические
Фосфорорганические
52
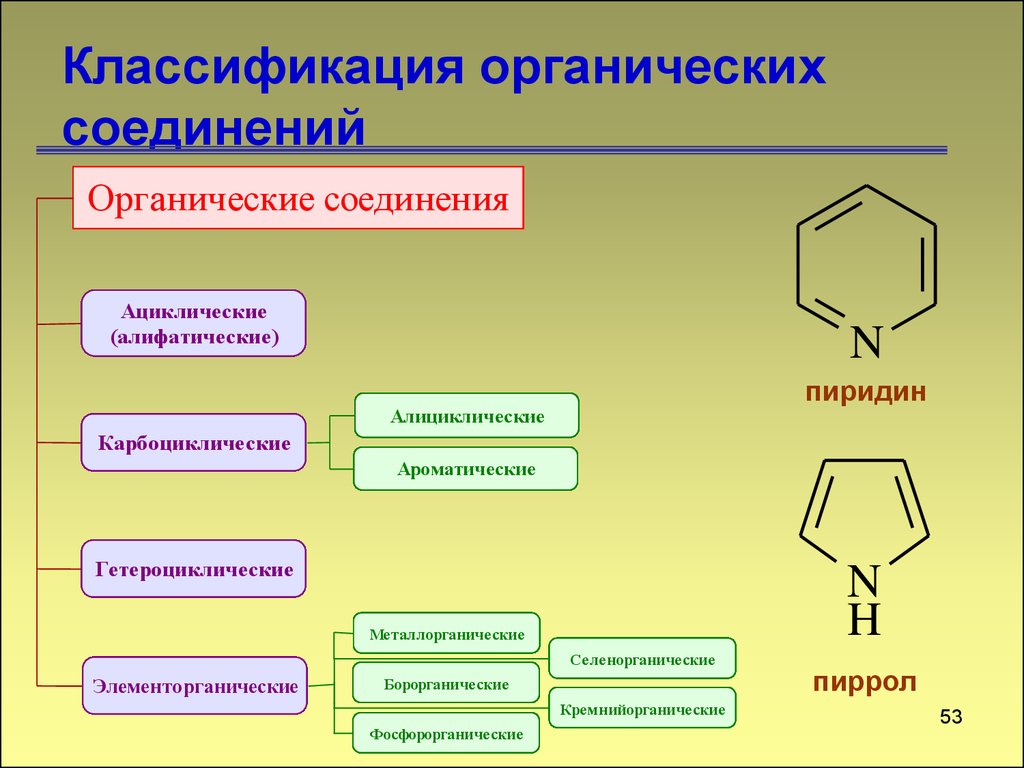
52. Классификация органических соединений
Органические соединенияАциклические
(алифатические)
N
пиридин
Алициклические
Карбоциклические
Ароматические
Гетероциклические
N
H
Металлорганические
Селенорганические
Элементорганические
Борорганические
Кремнийорганические
Фосфорорганические
пиррол
53
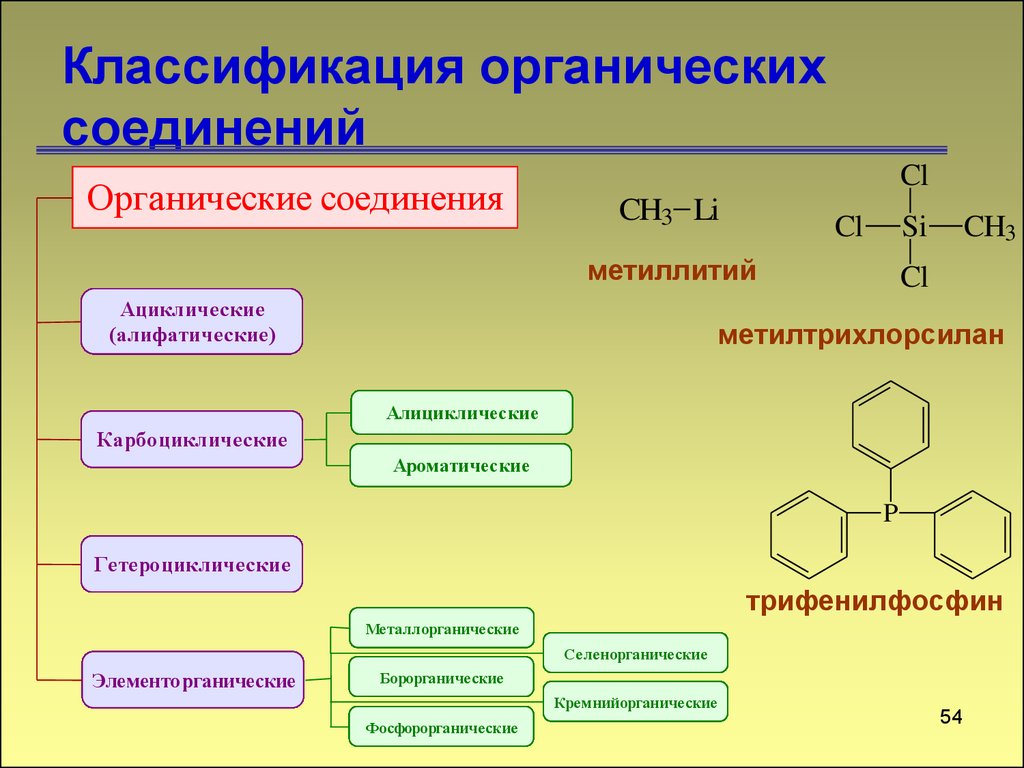
53. Классификация органических соединений
Органические соединенияCl
CH3 Li
Cl
Si
метиллитий
Ациклические
(алифатические)
CH3
Cl
метилтрихлорсилан
Алициклические
Карбоциклические
Ароматические
P
Гетероциклические
трифенилфосфин
Металлорганические
Селенорганические
Элементорганические
Борорганические
Кремнийорганические
Фосфорорганические
54
54. Классификация органических соединений
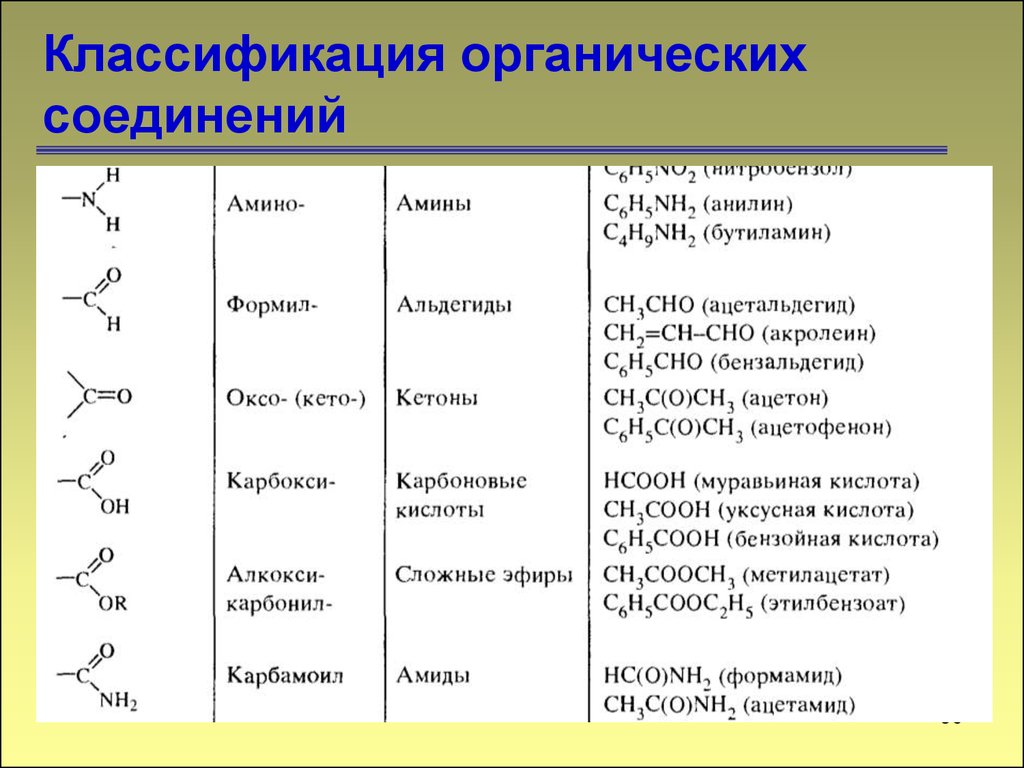
5555. Классификация органических соединений
5656. Классификация органических соединений
5757. Классификация органических соединений
Соединения могут содержать не одну, анесколько функциональных групп. Если эти
группы одинаковые, то соединения
называются полифункциональными.
CHCl3
CH2 CH CH2
OH OH OH
хлороформ
глицерин
58
58. Классификация органических соединений
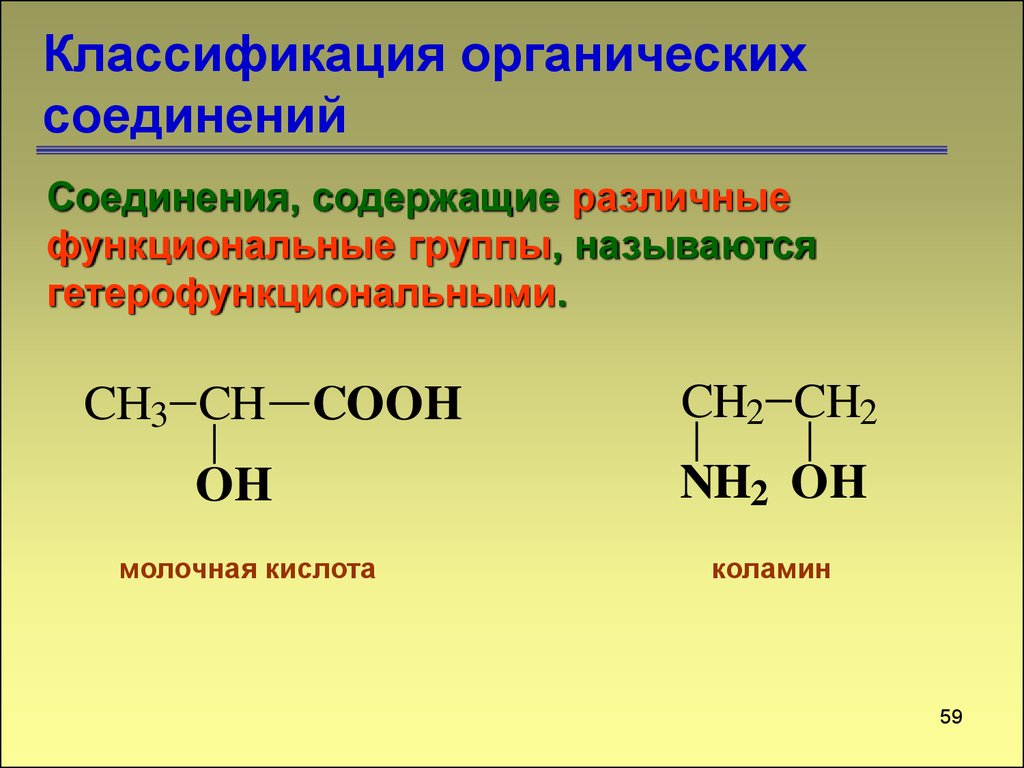
Соединения, содержащие различныефункциональные группы, называются
гетерофункциональными.
CH3 CH COOH
OH
молочная кислота
CH2 CH2
NH2 OH
коламин
59
59. Классификация органических соединений
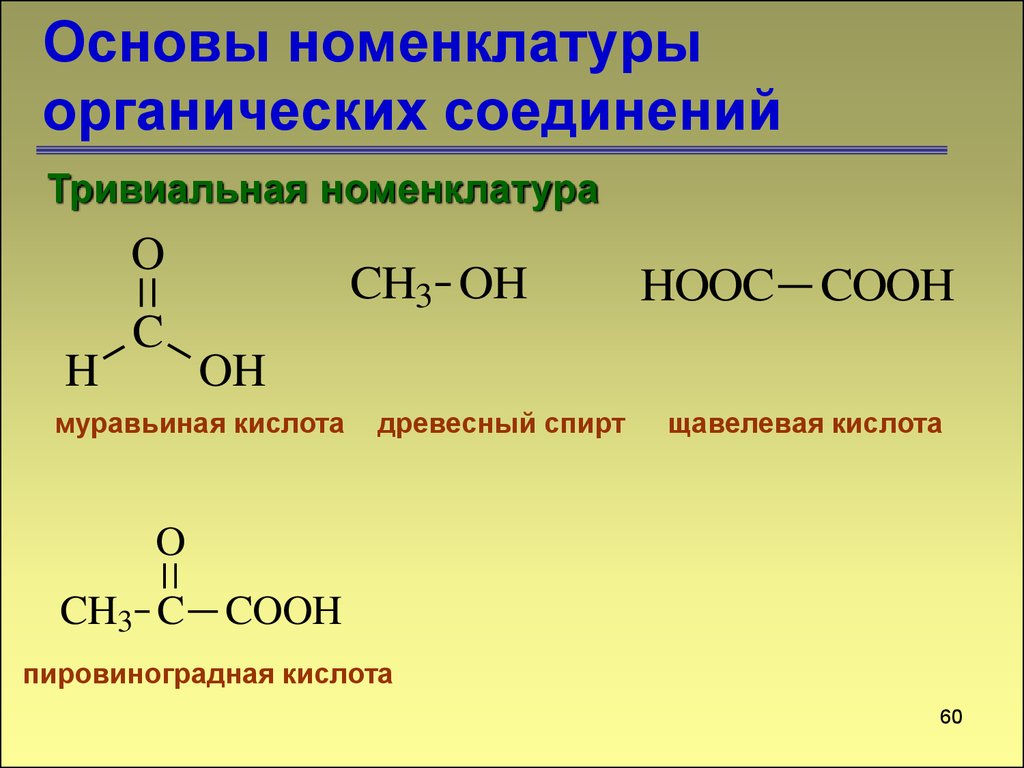
Основы номенклатурыорганических соединений
Тривиальная номенклатура
O
H
C
CH3 OH
HOOC COOH
OH
муравьиная кислота
древесный спирт
щавелевая кислота
O
CH3 C COOH
пировиноградная кислота
60
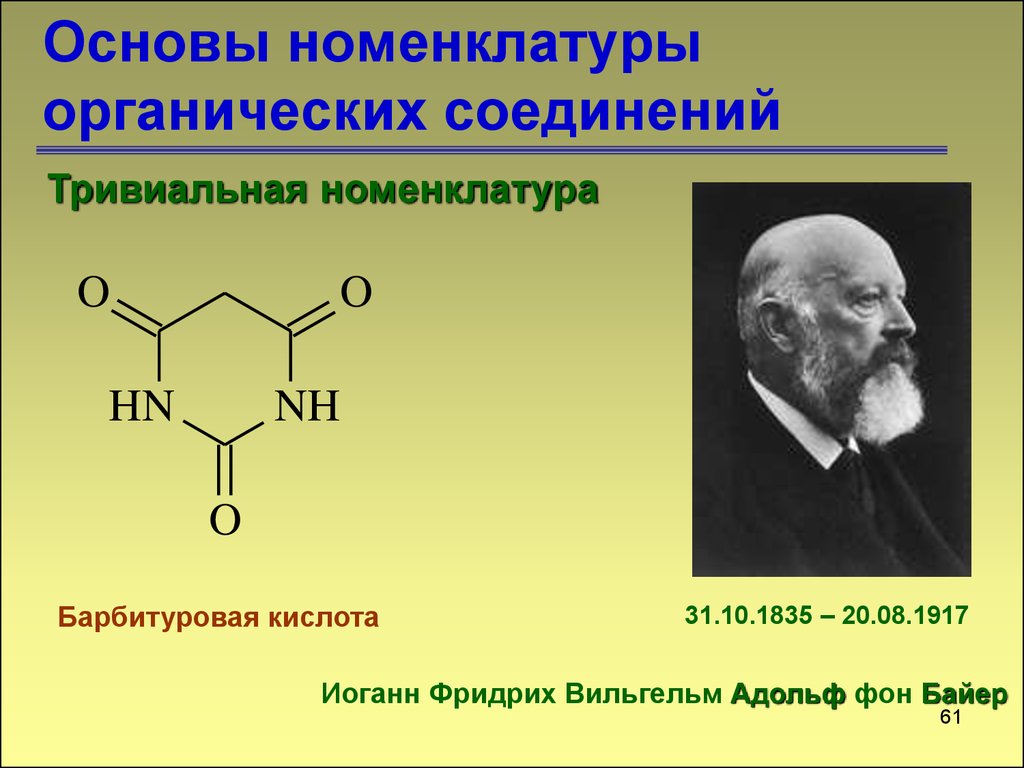
60. Основы номенклатуры органических соединений
Тривиальная номенклатураO
O
HN
NH
O
Барбитуровая кислота
31.10.1835 – 20.08.1917
Иоганн Фридрих Вильгельм Адольф фон Байер
61
61. Основы номенклатуры органических соединений
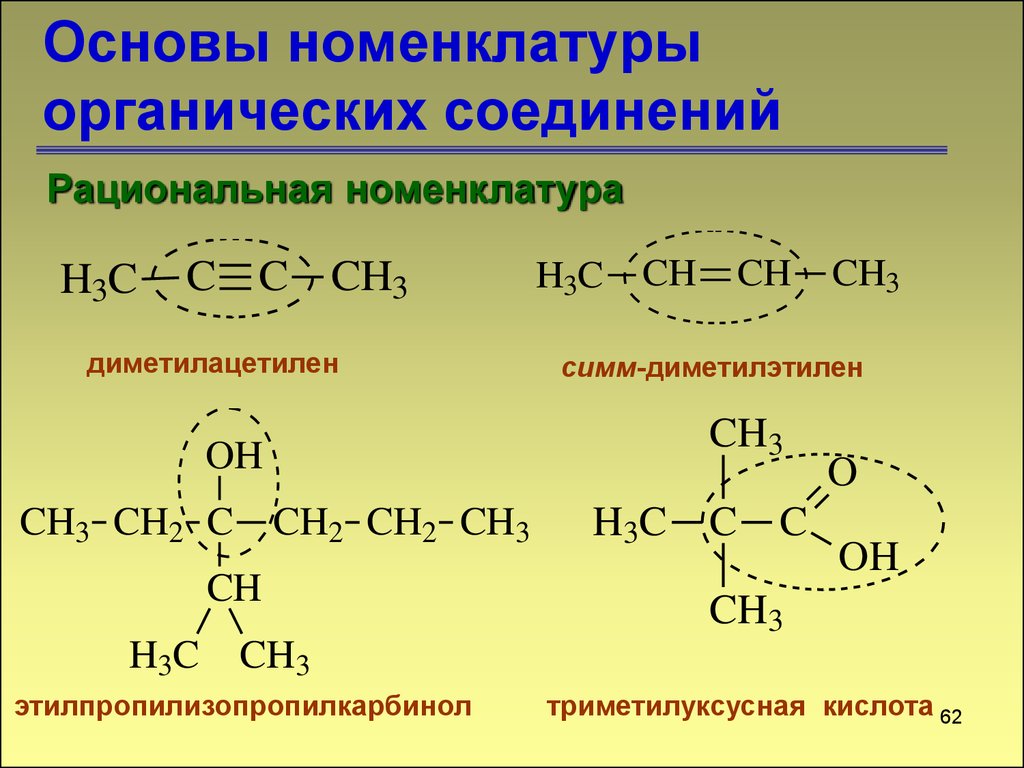
Рациональная номенклатураH3C
C C CH3
диметилацетилен
H3C
CH
CH
H3C
CH3
симм-диметилэтилен
CH3
OH
CH3 CH2 C CH2 CH2 CH3
CH
H3C
C
C
O
OH
CH3
CH3
этилпропилизопропилкарбинол
триметилуксусная кислота 62
62. Основы номенклатуры органических соединений
Заместительная номенклатура ИЮПАКИЮПАК [от английского названия Международного
союза чистой и прикладной химии — International
Union of Pure and Applied Chemistry (IUPAC)]
Систематические названия
составлены из слов, специально
созданных или выбранных для
описания структурных особенностей
соединения.
63
63. Основы номенклатуры органических соединений
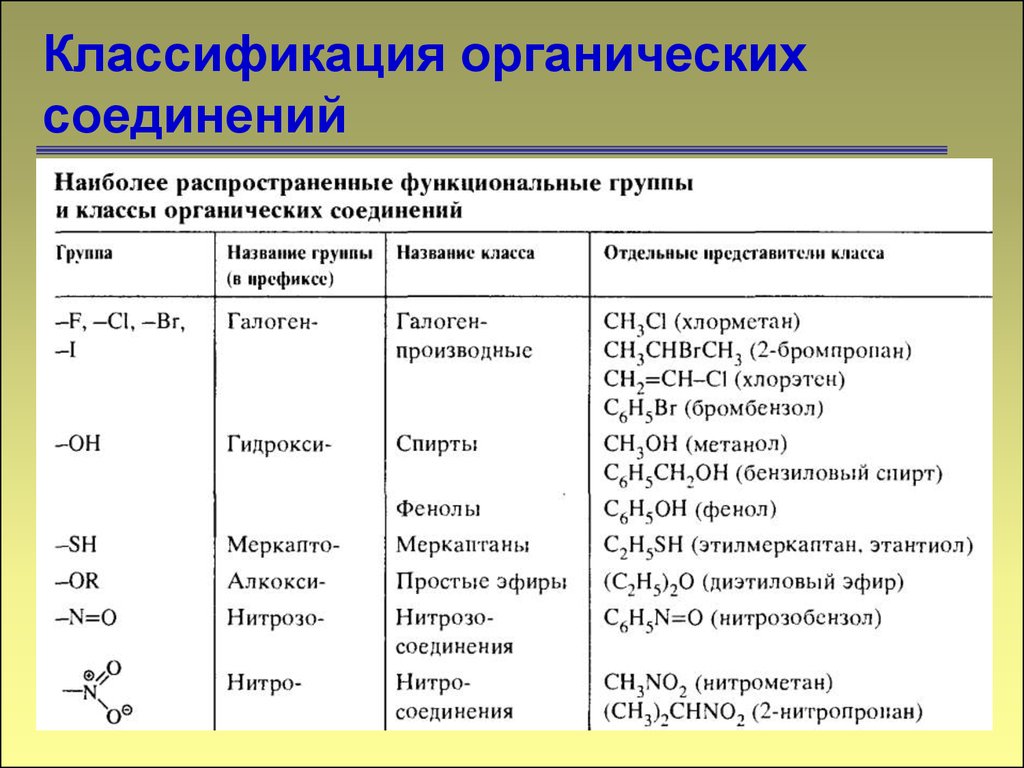
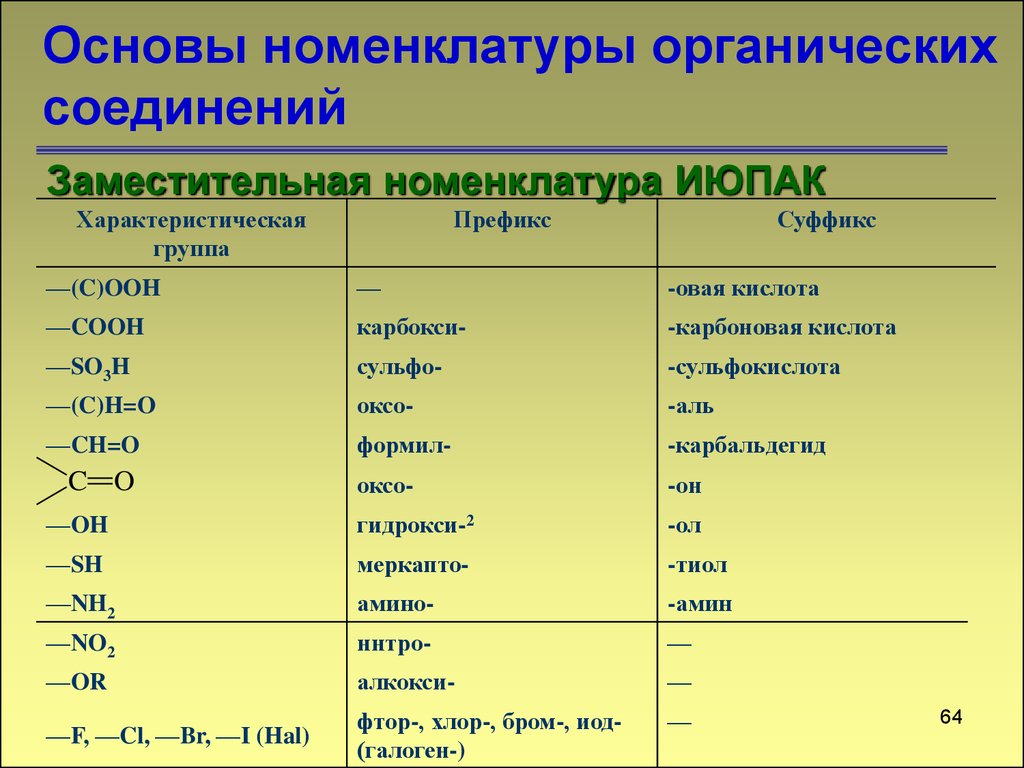
Заместительная номенклатура ИЮПАКХарактеристическая
группа
Префикс
Суффикс
—(C)OOH
—
-овая кислота
—COOH
карбокси-
-карбоновая кислота
—SO3H
сульфо-
-сульфокислота
—(C)H=O
оксо-
-аль
—CH=O
формил-
-карбальдегид
оксо-
-он
—OH
гидрокси-2
-ол
—SH
меркапто-
-тиол
—NH2
амино-
-амин
—NO2
ннтро-
—
—OR
алкокси-
—
—F, —Cl, —Br, —I (Hal)
фтор-, хлор-, бром-, иод(галоген-)
—
C O
64


















 Химия
Химия