Похожие презентации:
Органическая химия
1.
2.
Органическая химия – химия углеводородов и ихпроизводных.
Углеводороды (УВ) – простейшие органические вещества,
молекулы которых состоят из атомов только двух элементов: С
и Н (СН4, С4Н10).
Производные УВ – продукты замещения атомов «Н» в
молекулах УВ на другие атомы или группы атомов.
Органическая
вещества
Природные
(Нефть, белки,
жиры, углеводы)
Искусственные
(Бензин, вискоза)
Синтетические
(Лекарства,
витамины ,
пластмассы)
Назад
3.
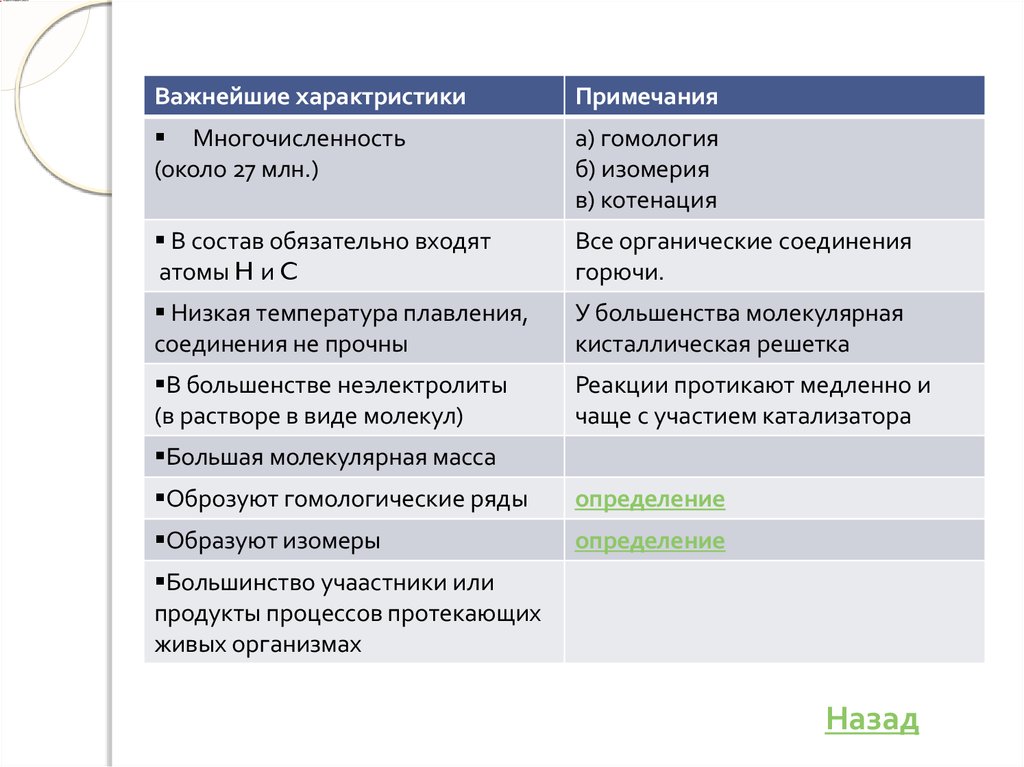
Важнейшие характристикиПримечания
Многочисленность
(около 27 млн.)
а) гомология
б) изомерия
в) котенация
В состав обязательно входят
атомы H и C
Все органические соединения
горючи.
Низкая температура плавления,
соединения не прочны
У большенства молекулярная
кисталлическая решетка
В большенстве неэлектролиты
(в растворе в виде молекул)
Реакции протикают медленно и
чаще с участием катализатора
Большая молекулярная масса
Оброзуют гомологические ряды
определение
Образуют изомеры
определение
Большинство учаастники или
продукты процессов протекающих
живых организмах
Назад
4.
Гомологический ряд – ряд веществ, расположеныхв пордке возрастания молекулярной массы,
имеющих сходно строение, свойства и
отличающиеся друг от друга на одну или несколько
групп СН2
Гомологи – сходное строение и свойства,
отличающиеся на одну или несколько СН2
5. Предмет органической химии
Органическая химия — химия соединенийуглерода.
Элементы С, Н, О, N (S, галогены) –
называют органогенами.
Органическая химия — химия
углеводородов и их производных.
6. Причины выделения органической химии в отдельную науку
1. Четырехвалентность атома углеродаметан
этилен
ацетилен
формальдегид
7. Причины выделения органической химии в отдельную науку
2. Способность образовывать длинныецепи и кольца (т.н. циклы)
декан
циклопропан
циклогексан
циклооктан
8. Причины выделения органической химии в отдельную науку
2. Способность образовывать длинныецепи и кольца (т.н. циклы)
бензол
кубан
адамантан
9. Причины выделения органической химии в отдельную науку
2. Способность образовывать длинныецепи и кольца (т.н. циклы)
[3]-катенан
ротоксан
фулерен-С60
10. Причины выделения органической химии в отдельную науку
3. Способность образовывать устойчивыеили очень устойчивые связи с другими
элементами
11. Причины выделения органической химии в отдельную науку
3. Способность образовывать устойчивыеили очень устойчивые связи с другими
элементами
Реактив Гриньяра
Тетракистрифенилфосфин палладий
R-MgX
12. Причины выделения органической химии в отдельную науку
4. Из всех элементов периодическойсистемы именно углерод играет главную и
определяющую роль в биологическом мире
13. Особенности органических соединений
14. Источники органических соединений
15.
Предельныеуглеводороды.
Алканы
16. Алифатические углеводороды
1617. Алканы
Алканами называютсянасыщенные углеводороды,
молекулы которых состоят
из атомов углерода и
водорода, связанных между
собой только -связями.
17
18. Алканы
метан19. Алканы
20. Электронная структура атома углерода в органических соединениях
основное состояниевозбужденное состояние
21. Электронная структура атома углерода в органических соединениях
АлканыГруппы органических соединений однотипной
структуры с одинаковой функциональными
группами, отличающиеся друг от друга по
количеству групп CH2 в углеродной цепи,
составляют гомологический ряд.
Гомологический ряд метана
и т.д.
22. Алканы
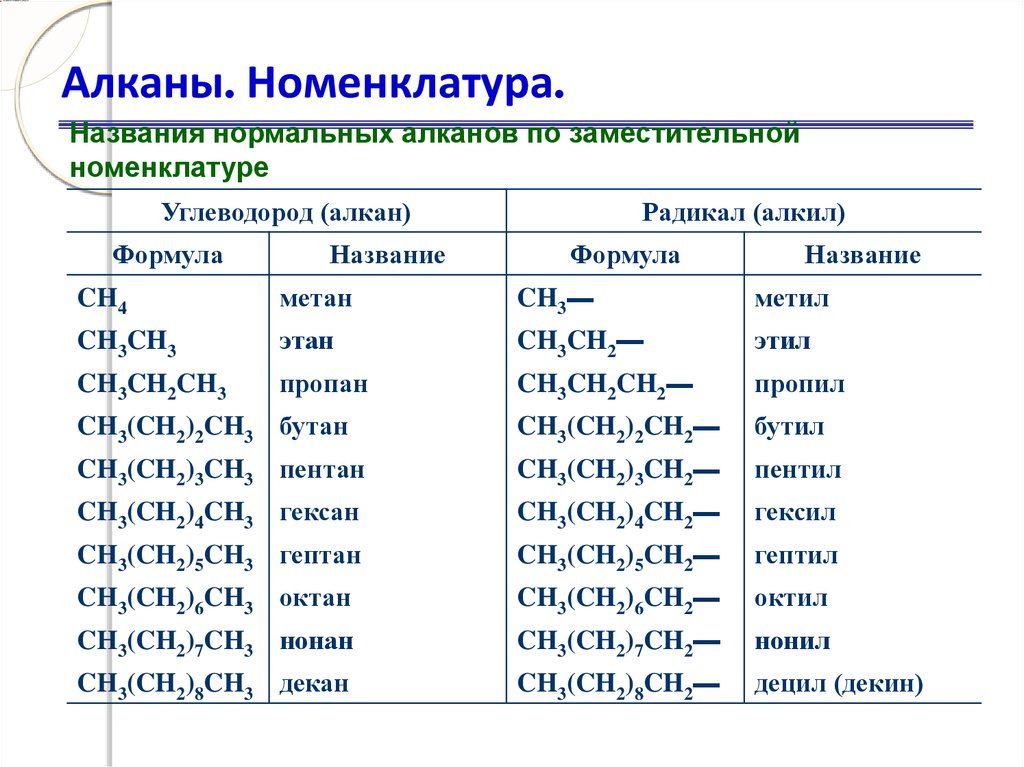
Алканы. Номенклатура.Названия нормальных алканов по заместительной
номенклатуре
Углеводород (алкан)
Формула
Название
Радикал (алкил)
Формула
Название
CH4
метан
CH3—
метил
CH3CH3
этан
CH3CH2—
этил
CH3CH2CH3
пропан
CH3CH2CH2—
пропил
CH3(CH2)2CH3 бутан
CH3(CH2)2CH2—
бутил
CH3(CH2)3CH3 пентан
CH3(CH2)3CH2—
пентил
CH3(CH2)4CH3 гексан
CH3(CH2)4CH2—
гексил
CH3(CH2)5CH3 гептан
CH3(CH2)5CH2—
гептил
CH3(CH2)6CH3 октан
CH3(CH2)6CH2—
октил
CH3(CH2)7CH3 нонан
CH3(CH2)7CH2—
нонил
CH3(CH2)8CH3 декан
CH3(CH2)8CH2—
децил (декин)
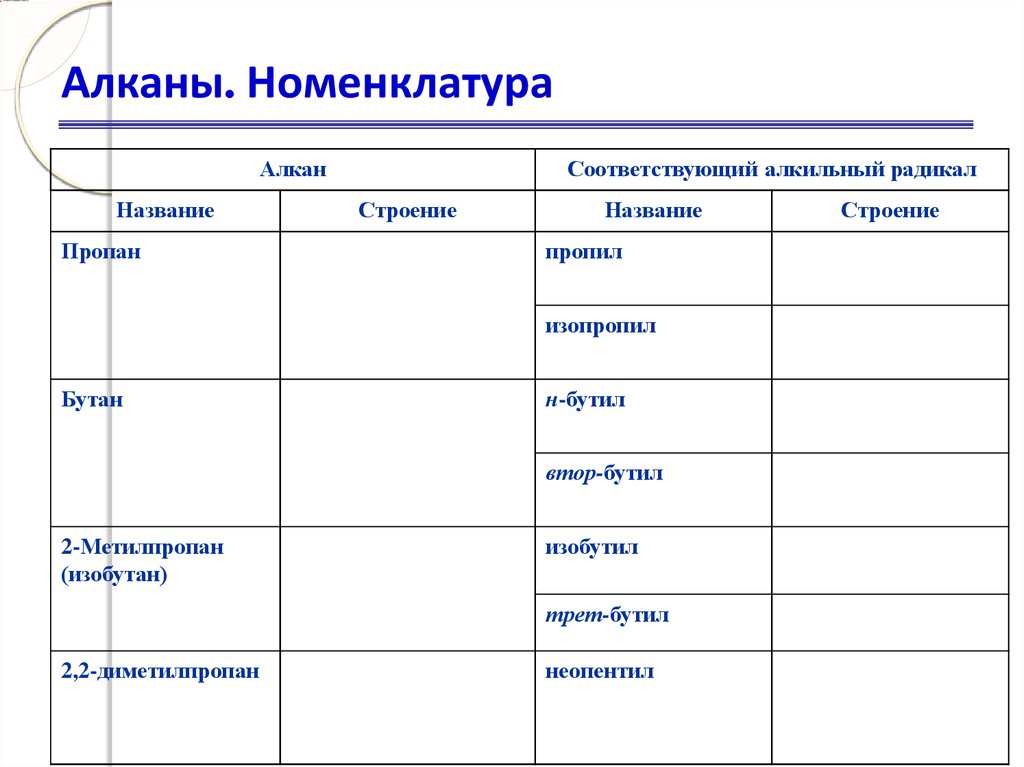
23. Алканы. Номенклатура.
Алканы. НоменклатураПервичный
Вторичный
Третичный
Четвертичный
2,2,4-триметилпентан
24. Алканы. Номенклатура
АлканНазвание
Пропан
Соответствующий алкильный радикал
Строение
Название
пропил
изопропил
Бутан
н-бутил
втор-бутил
2-Метилпропан
(изобутан)
изобутил
трет-бутил
2,2-диметилпропан
неопентил
Строение
25. Алканы. Номенклатура
Систематическая номенклатура ИЮПАК1) определяют самую длинную цепь атомов
углерода. Число атомов углерода в этой цепи
служит основой названия;
2) нумеруют главную цепь с того конца, ближе к
которому находится заместитель (углеводородный
радикал);
3) перед основой названия указывают цифровой
номер того атома углерода в главной цепи, у
которого находится заместитель, а затем в виде
префикса называют этот заместитель;
26. Алканы. Номенклатура
4) при наличии двух и более заместителейнумерацию цепи производят так, чтобы заместители
получили наименьшие номера. В названии алкана
радикалы перечисляются в алфавитном порядке.
Перед названием каждого радикала ставят цифру,
обозначающую его положение в главной углеродной
цепи. Если заместители одинаковые, то к их
названию добавляют умножительные приставки ди-,
три-, тетра-, пента- и т. д.
5) если в главной цепи на равном расстоянии от
концов стоят одинаковые радикалы, то нумерацию
производят таким образом, чтобы радикалы
получили наименьшие номера.
27. Алканы. Номенклатура
3,5-диметил-3-этилоктан28. Алканы. Номенклатура
2,3,4-триметилпентан29. Алканы. Номенклатура
Алканы. ИзомерияИзомеры — это вещества, которые имеют
одинаковую молекулярную формулу, но различное
химическое строение, а поэтому обладают разными
свойствами.
30. Алканы. Изомерия
Алканы. НоменклатураСтруктурная изомерия
С4Н10
н-бутан
Ткип= -0,5 С
изобутан
Ткип= -11,7 С
31. Алканы. Номенклатура
Структурная изомерияС5Н12
пентан
Ткип= 36.2 С
2-метилбутан
Ткип= 28 С
2,2-диметилпропан
Ткип= 9.5 С
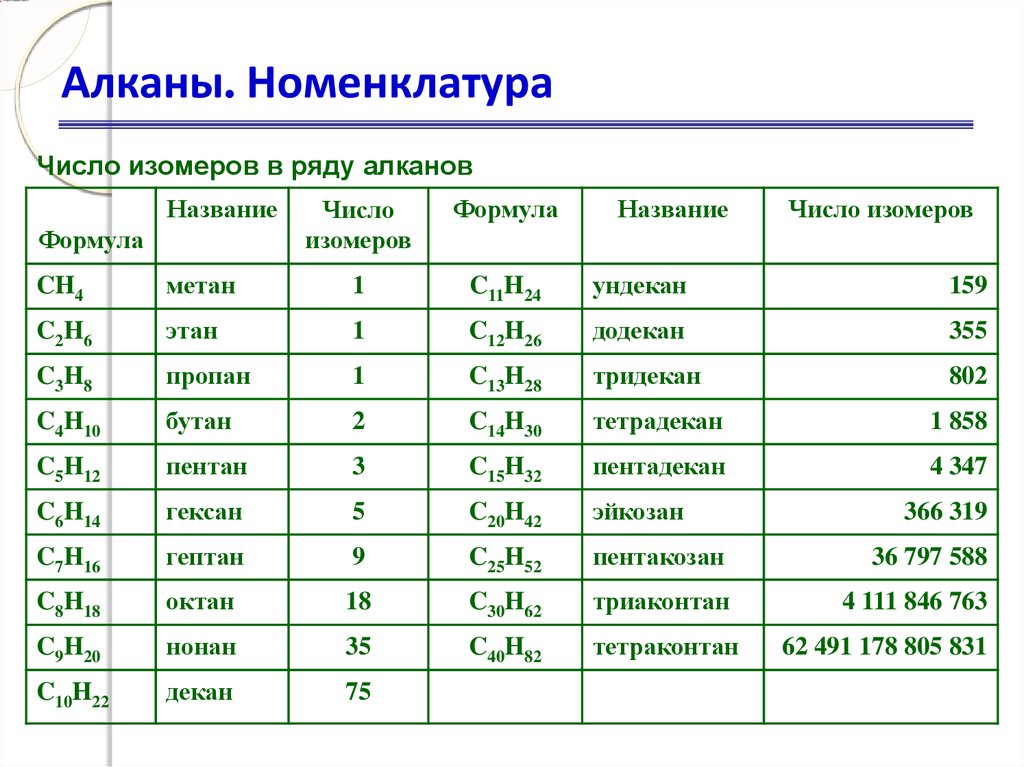
32. Алканы. Номенклатура
Число изомеров в ряду алкановНазвание
Формула
Число
изомеров
Формула
Название
Число изомеров
CH4
метан
1
C11H24
ундекан
159
C2H6
этан
1
C12H26
додекан
355
C3H8
пропан
1
C13H28
тридекан
802
C4H10
бутан
2
C14H30
тетрадекан
1 858
C5H12
пентан
3
C15H32
пентадекан
4 347
C6H14
гексан
5
C20H42
эйкозан
C7H16
гептан
9
C25H52
пентакозан
36 797 588
C8H18
октан
18
C30H62
триаконтан
4 111 846 763
C9H20
нонан
35
C40H82
тетраконтан
C10H22
декан
75
366 319
62 491 178 805 831
33. Алканы. Номенклатура
Алканы. Природные источники34. Алканы. Природные источники
Алканы. Химические свойстваГалогенирование
35. Алканы. Химические свойства
Галогенирование (Механизм реакции)Обрыв цепи
36. Алканы. Химические свойства
Галогенирование (Механизм реакции)4. Реакционная способность водорода у третичного
атома углерода выше, чем у вторичного, а
вторичного выше, чем у первичного.
376 кДж/моль
390 кДж/моль
415 кДж/моль
37. Алканы. Химические свойства
Галогенирование (Механизм реакции)38. Алканы. Химические свойства
ОкислениеCH4 + H2O CO + 3H2
CH4 + ½O2 CO + H2
CH4 + CO2 2CO + 2H2
CH4 + 2O2 CO2 + H2O + 890 кДж/моль
39. Алканы. Химические свойства
Изомеризация40. Алканы. Химические свойства
НЕПРЕДЕЛЬНЫЕ СОЕДИНЕНИЯ41
41. НЕПРЕДЕЛЬНЫЕ СОЕДИНЕНИЯ
Классификация42
42. Классификация
Гибридизация43. Гибридизация
Строениекумулированный
пропадиен
(аллен)
сопряженный
бутадиен-1,3
(дивинил)
изолированный
пентадиен-1,4
44
44. Строение
Сопряжение — это образование единогоэлектронного облака в результате
взаимодействия негибридизованных pz-орбиталей
в молекуле с чередующимися двойными и
одинарными связями.
45
45. Строение
Делокализация электронной плотности — это еераспределение по всей сопряженной системе, по
всем связям и атомам.
46
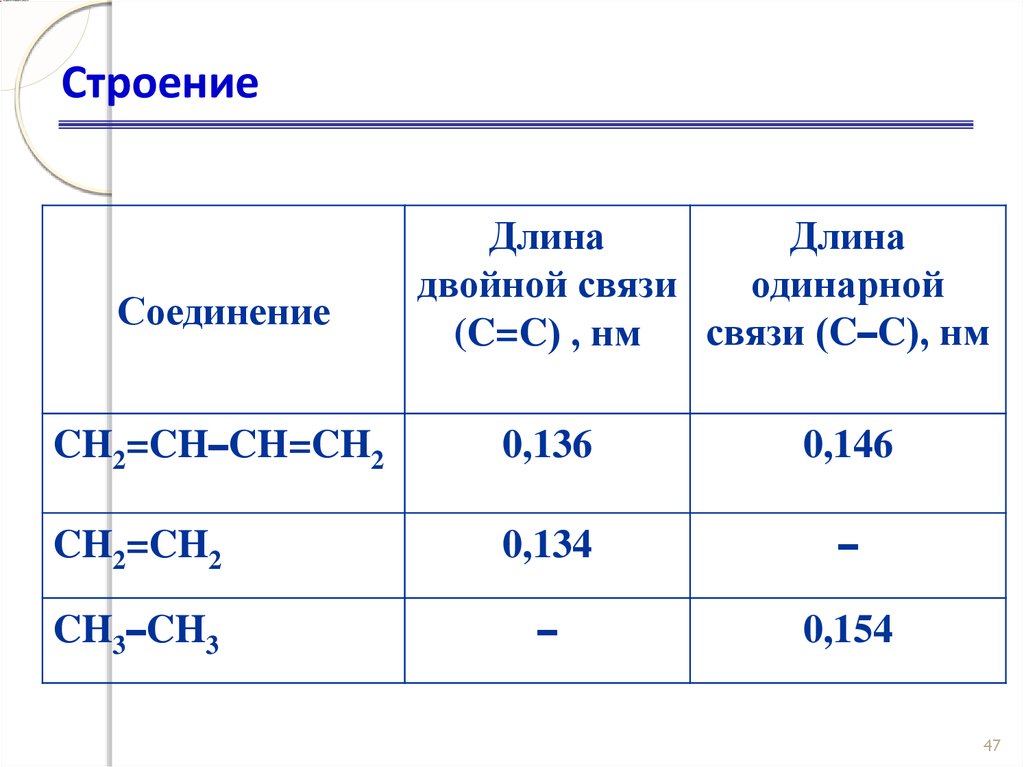
46. Строение
СоединениеДлина
Длина
двойной связи
одинарной
связи (C–C), нм
(C=C) , нм
CH2=CH–CH=CH2
0,136
0,146
CH2=CH2
0,134
–
CH3–CH3
–
0,154
47
47. Строение
48. Строение
49. Строение
Реакции алкенов, алкинов и сопряженных диенов с раскрытием πсвязиПрисоединение молекул типа H-X
Правило Марковникова: при
присоединении молекул типа НХ к
несимметричным алкенам атом
водорода присоединяется к более
гидрогенизированному атому
углерода двойной связи.
МАРКОВНИКОВ
Владимир Васильевич
13.12.1837 – 29.01.1904
50. Реакции алкенов, алкинов и сопряженных диенов с раскрытием π-связи
Реакции алкенов, алкинов и сопряженных диенов с раскрытием πсвязиПрисоединение молекул типа H-X
51. Реакции алкенов, алкинов и сопряженных диенов с раскрытием π-связи
Реакции алкенов, алкинов исопряженных диенов с раскрытием πсвязи
Присоединение молекул типа H-X
52. Реакции алкенов, алкинов и сопряженных диенов с раскрытием π-связи
Реакции гидрирования и окисления алкенов иалкинов
53. Реакции гидрирования и окисления алкенов и алкинов
Реакции полимеризации ненасыщенныхуглеводородов
54. Реакции полимеризации ненасыщенных углеводородов
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ(АРЕНЫ)
55
55. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (АРЕНЫ)
АреныАроматические соединения, или арены, —
большая группа соединений
карбоциклического ряда, молекулы
которых содержат устойчивую
циклическую группировку из шести атомов
углерода (бензольное кольцо), обладающую
особыми физическими и химическими
свойствами.
СnН2n-6
56
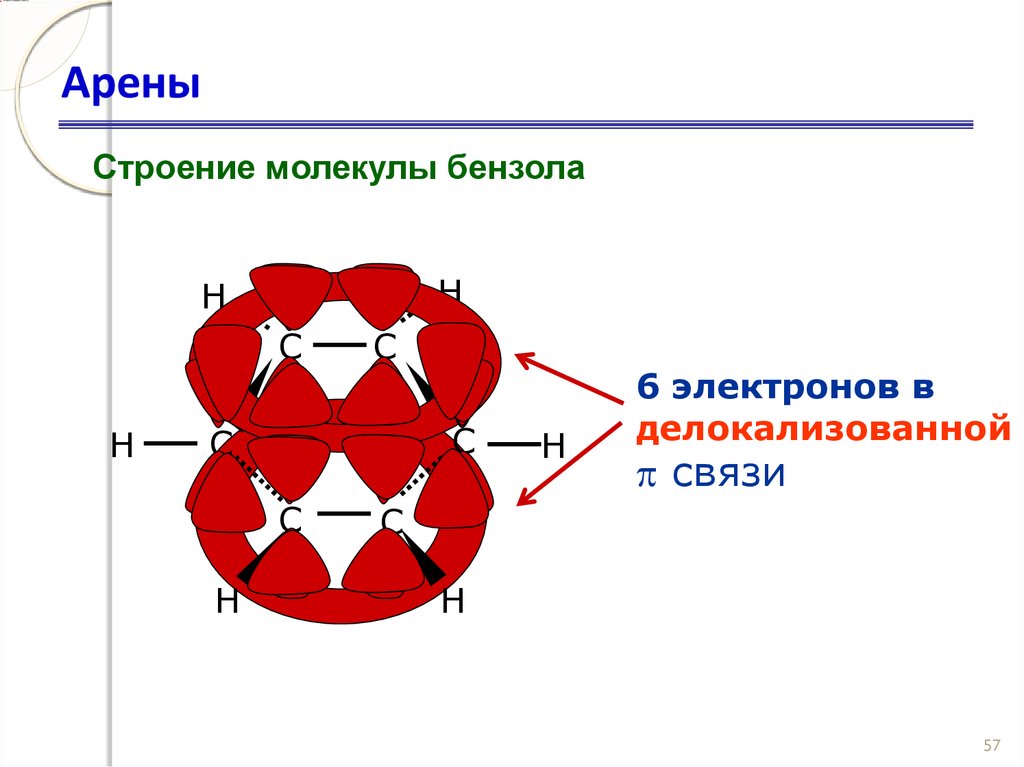
56. Арены
Строение молекулы бензолаH
H
C
H
C
C
C
C
H
H
6 электронов в
делокализованной
связи
C
H
57
57. Арены
Строение молекулы бензола58
58. Арены
Химические свойства. Реакции замещенияАлкилирование
Алкилирование — введение алкильной группы в
молекулу органического соединения (например, в
бензольное кольцо).
Реакция Фриделя—Крафтса
59
59. Арены
Химические свойства. Реакции замещенияАлкилирование
60
60. Арены
Химические свойства. Реакции замещения61
61. Арены
Химические свойства. Реакции замещенияЭффекты заместителей при электрофильном замещении
1. Заместители (ориентанты) первого рода: —ОН, —
OR, —OCOR, —SH, —NH2, —NHR, (Hal). Эти
заместители смещают электронную плотность в
сторону бензольного кольца, т.е. обладают
электронодонорными свойствами. Они
активируют бензольное кольцо (за исключением
галогенов). Облегчая вхождение электрофильных
реагентов в бензольное кольцо, они ориентируют
новый заместитель в орто- и пара-положения.
Такие заместители называют орто- и параориентантами.
62
62. Арены
Химические свойства. Реакции замещенияЭффекты заместителей при электрофильном замещении
2. Заместители (ориентанты) второго рода: —CN, —
СООН, —SO3H, —СНО, —COR, —COOR, —NO2. Эти
заместители смещают электронную плотность от
бензольного кольца, т.е. они обладают
электроноакцепторными свойствами. Эти
заместители дезактивируют бензольное кольцо,
затрудняя вхождение электрофильных реагентов.
При этом вновь входящий заместитель ориентируют в
мета-положение. Такие заместители называют метаориентантами.
63
63. Арены
Химические свойства. Реакции замещенияЭффекты заместителей при электрофильном замещении
фенол
64
64. Арены
Химические свойства. Реакции замещенияЭффекты заместителей при электрофильном замещении
толуол
65
65. Арены
Химические свойства. Реакции замещенияЭффекты заместителей при электрофильном замещении
хлорбензол
66
66. Арены
Химические свойства. Реакции замещенияЭффекты заместителей при электрофильном замещении
нитробензол
67
67. Арены
Химические свойства. Реакции замещенияЭффекты заместителей при электрофильном замещении
бензальдегид
68
68. Арены
Химические свойства. Реакции замещенияВлияние заместителей на реакционную способность
69
69. Арены
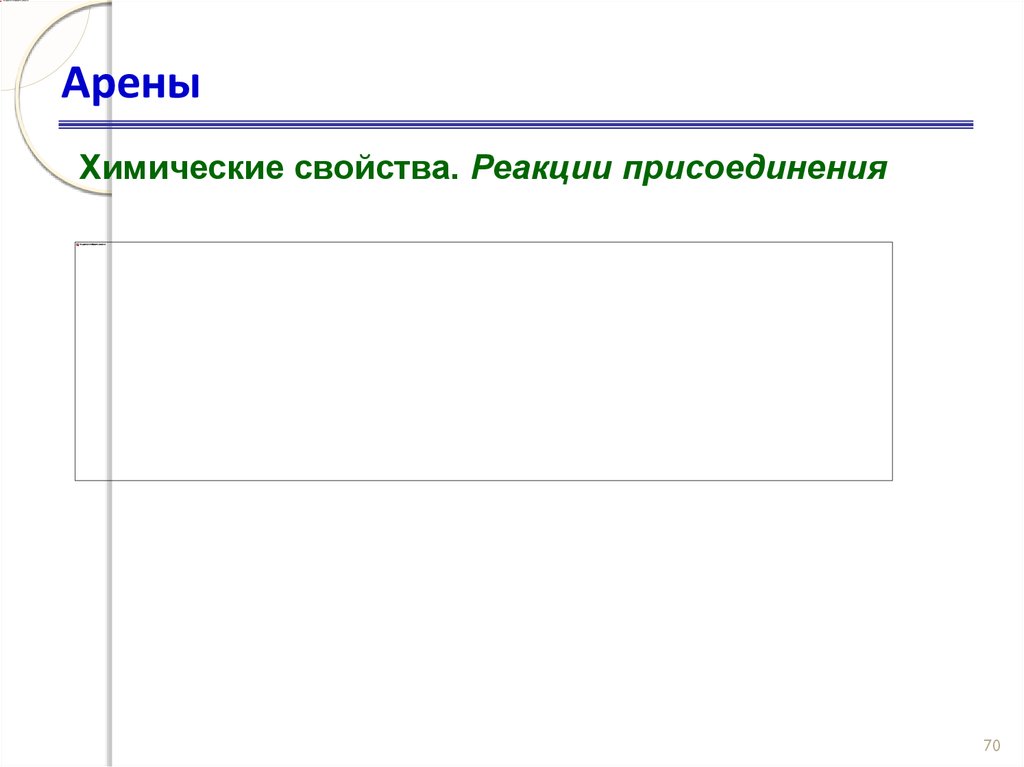
Химические свойства. Реакции присоединения70
70. Арены
Химические свойства. Реакции присоединения71
71. Арены
Химические свойства. Окисление72
72. Арены
Химические свойства. Окисление73
73. Арены
Химические свойства. Окисление74
74. Арены
Многоядерные ароматические соединенияАроматические соединения, содержащие в своих
молекулах несколько бензольных ядер, называют
многоядерными.
Соединения с неконденсированными бензольными
ядрами
75
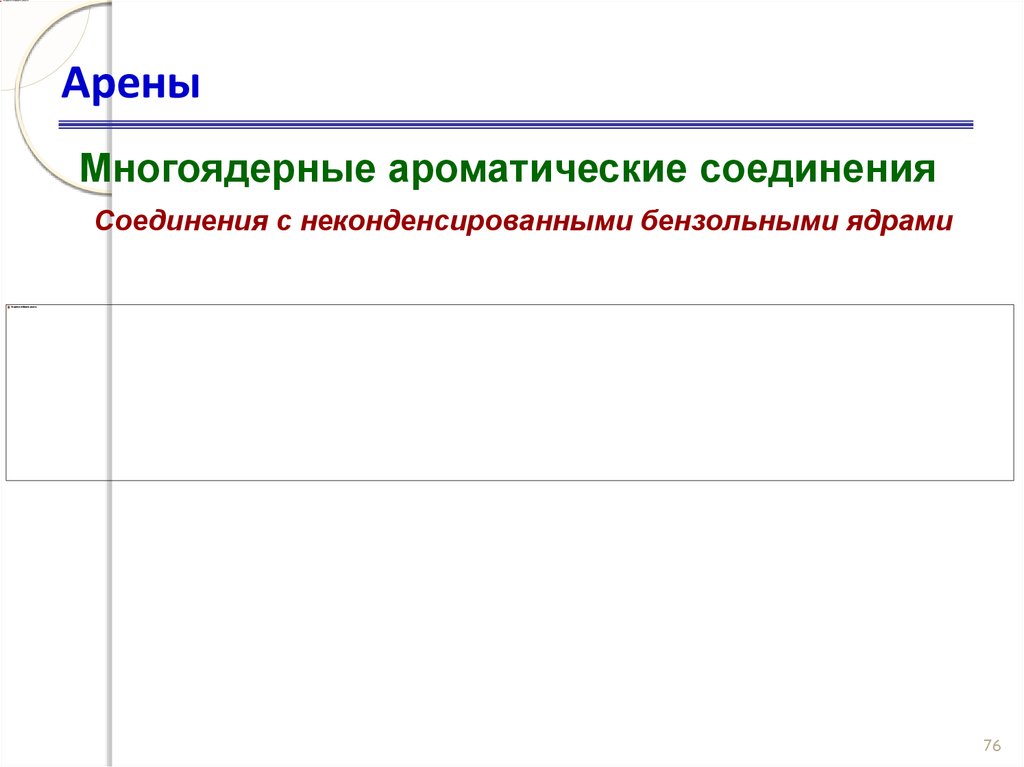
75. Арены
Многоядерные ароматические соединенияСоединения с неконденсированными бензольными ядрами
76
76. Арены
Многоядерные ароматические соединенияСоединения с неконденсированными бензольными ядрами
дифенилметан
77
77. Арены
Многоядерные ароматические соединенияСоединения с неконденсированными бензольными ядрами
бензофенон
78
78. Арены
Многоядерные ароматические соединенияСоединения с неконденсированными бензольными ядрами
Трифенилметан
79
79. Арены
Многоядерные ароматические соединенияСоединения с конденсированными бензольными ядрами
нафталин
80
80. Арены
Многоядерные ароматические соединенияСоединения с конденсированными бензольными ядрами
81
81. Арены
Многоядерные ароматические соединенияСоединения с конденсированными бензольными ядрами
а) Ангулярно конденсированные циклы:
перилен
коронен
82
82. Арены
Многоядерные ароматические соединенияСоединения с конденсированными бензольными ядрами
а) Ангулярно конденсированные циклы:
83
83. Арены
КАРБОНИЛСОДЕРЖАЩИЕСОЕДИНЕНИЯ
84
84. КАРБОНИЛСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Карбонилсодержащие соединенияОрганические соединения, в молекуле
которых имеется карбонильная группа С=O,
называются карбонильными соединениями,
или оксосоединениями.
Альдегиды содержат в молекуле
карбонильную группу, обязательно
связанную с атомом водорода, т. е.
альдегидную группу –СН=O.
Кетоны содержат карбонильную группу,
связанную с двумя углеводородными
радикалами, т. е. кетонную группу.
85
85. Карбонилсодержащие соединения
Карбонилсодержащие соединения.Классификация
86
86. Карбонилсодержащие соединения. Классификация
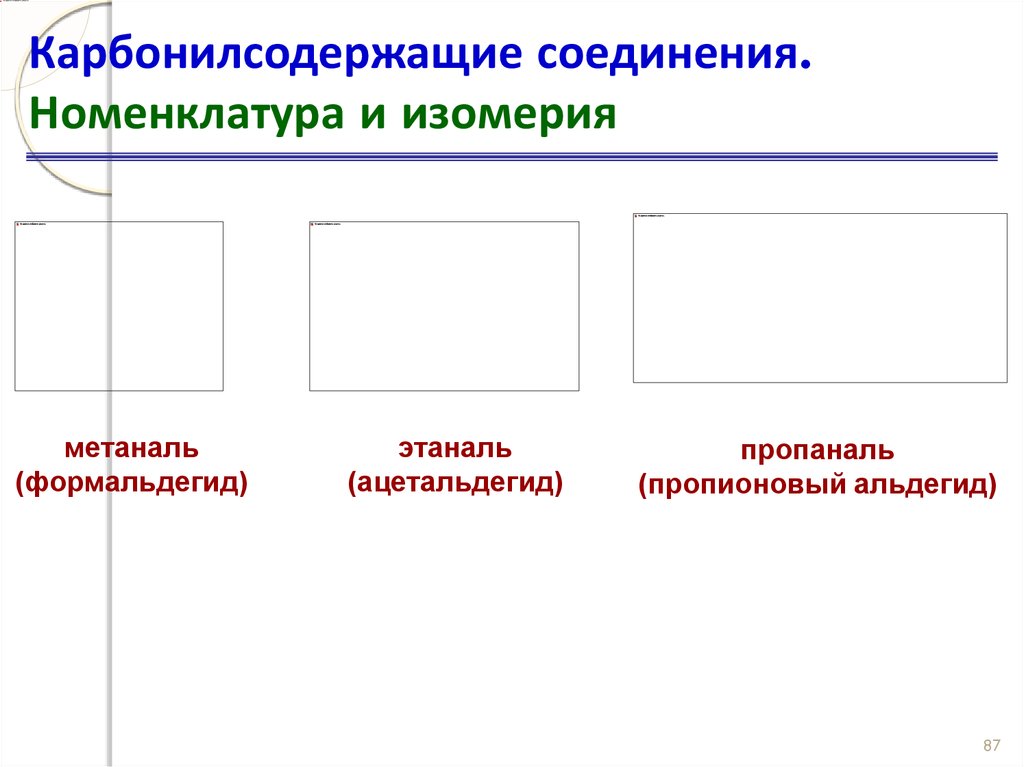
Карбонилсодержащие соединения.Номенклатура и изомерия
метаналь
(формальдегид)
этаналь
(ацетальдегид)
пропаналь
(пропионовый альдегид)
87
87. Карбонилсодержащие соединения. Номенклатура и изомерия
2-хлорциклогексанкарбальдегид
бензальдегид
3-бромбензальдегид
Может ли атом углерода кетонной группы получить
номер 1 при составлении названия алифатического
кетона?
88
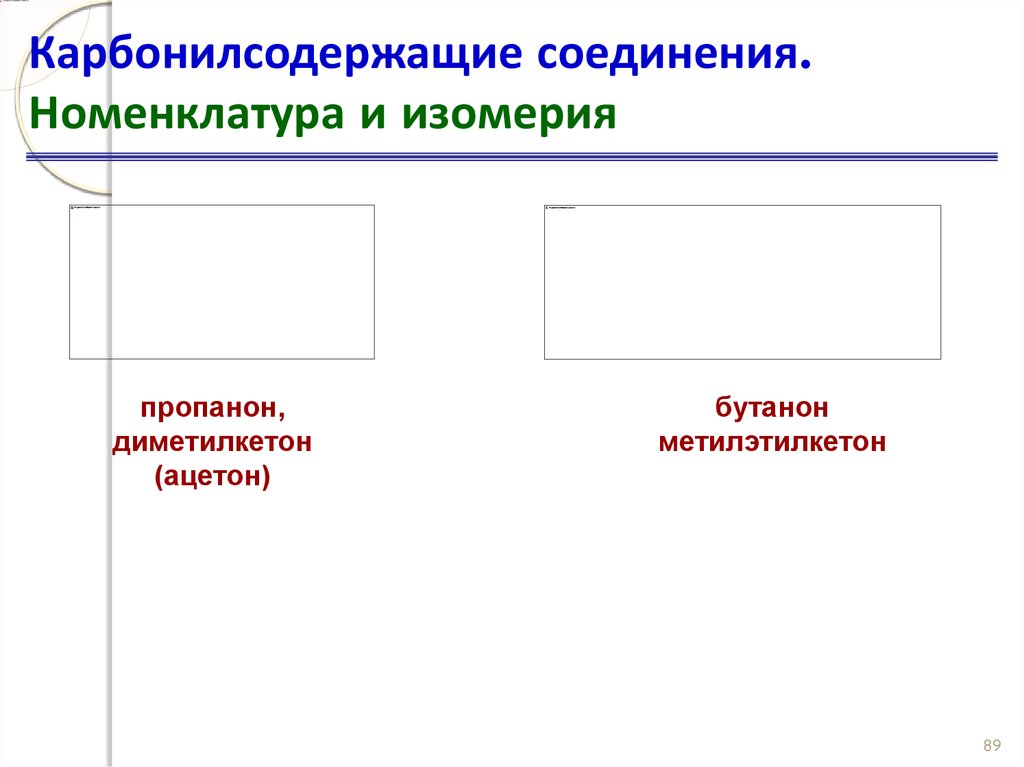
88. Карбонилсодержащие соединения. Номенклатура и изомерия
пропанон,диметилкетон
(ацетон)
бутанон
метилэтилкетон
89
89. Карбонилсодержащие соединения. Номенклатура и изомерия
дифенилкетон(бензофенон)
пропилфенилкетон
90
90. Карбонилсодержащие соединения. Номенклатура и изомерия
Карбонилсодержащие соединения.Химические свойства
91
91. Карбонилсодержащие соединения. Химические свойства
Реакции нуклеофильного присоединения92
92. Карбонилсодержащие соединения. Химические свойства
Взаимодействие со спиртами93
93. Карбонилсодержащие соединения. Химические свойства
Кето-енольная таутомерияПроцесс в котором осуществляется переход кетоформы в
енольную, называется енолизацией.
94
94. Карбонилсодержащие соединения. Химические свойства
Изомерия – явление существования разныхвеществ с одинаковым качественным и
количественным составом, но имеющих разное
строение и свойства.
Изомеры – вещества, имеющие одинаковую
молекулярную форму, но разное строение и
свойства.
95.
Нарисовать и назвать по другойноменклатуре:
винилбензол, бензилхлорид,
трифенилметан, дипропиламин,
дифениламин, бутаналь, бензальдегид,
бутанон-2, метилэтилкетон, вторичный
бутиловый спирт, бензиловый спирт,
изопропанол, трет-бутанол, 3фенилпропанол-2, дивиниловый эфир, 1метоксипропан, пентандиовая кислота, 1метокси-1-фенилпентен-4-овая кислота, 2метокси-4-хлорциклобутанол-2
96. Нарисовать и назвать по другой номенклатуре:
План реферата (объем 10-12 стр.)1. Происхождение названия
2. История открытия (обнаружения)
3. Физические свойства
4. Химические свойства
5. Способы получения
6. Применение




















































































 Химия
Химия








