Похожие презентации:
Карбоновые кислоты
1.
Выполнила:Яппарова Алсу Наилевна
учитель химии
Мурзинской СОШ
Республики Татарстан
2. Что мы узнаем на этом уроке
1.Определение карбоновых кислот2. Классификация
3.Электронное строение
4. Изомерия и номенклатура
5.Нахождение в природе
6. Получение
7.Физичесике свойства
8. Химические свойства
9.Применение
3.
Карбоновые кислоты - органическиесоединения, содержащие одну или
несколько карбоксильных групп –СООН.
Карбоксильная группа содержит две
функциональные группы - карбонил >С=О и, гидроксил OH
непосредственно связанные друг с другом:
O
R
C
O
H
4. Электронное строение
б-O
1.Электронная плотность сдвигается в
сторону кислорода
2.Атом углерода приобретает
положительный заряд
“
3. В результате этот атом углерода
притягивает к себе электронную пару
от атома кислорода
б+
R
C
б+
O
H
4. Компенсирую смещенную эл. плотность, атом кислорода оттягивает к
себе эл. пару соседнего водорода
Вывод: связь гидроксильной группе становится более полярной и атом
водорода приобретает большую подвижность
5.
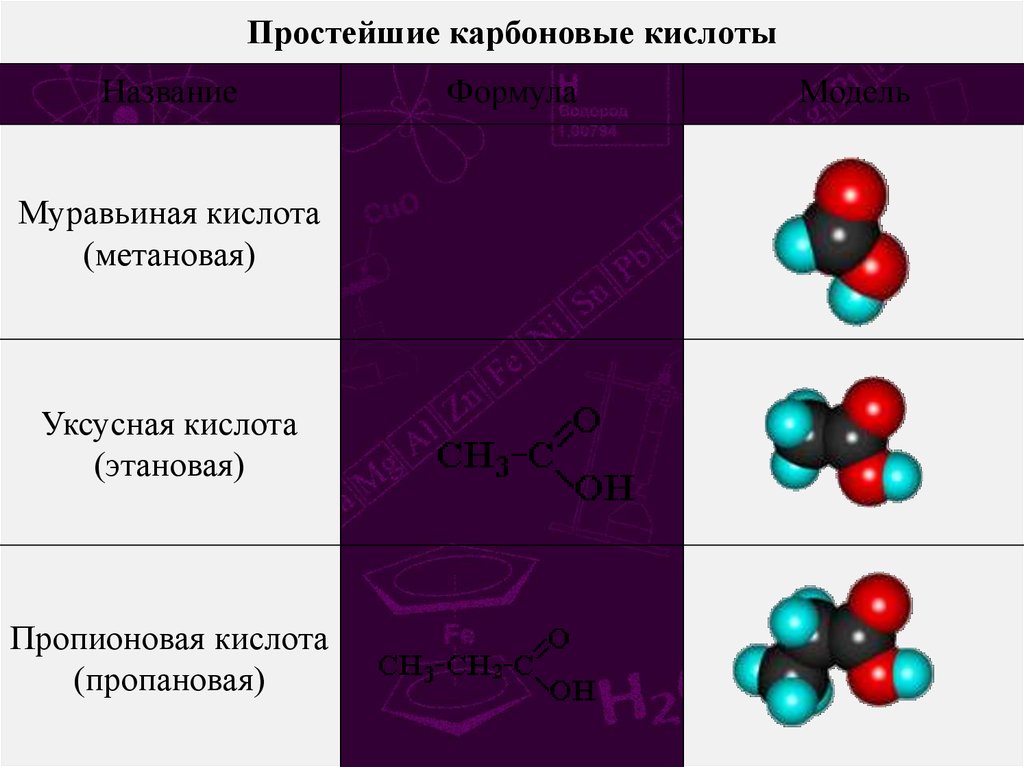
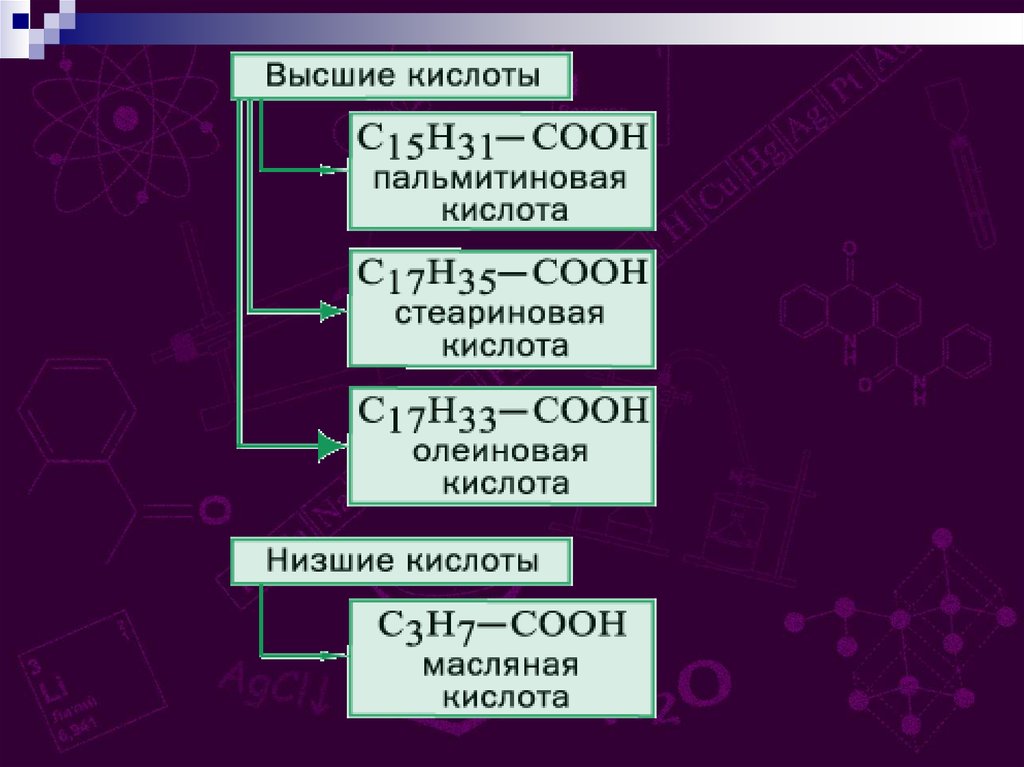
Простейшие карбоновые кислотыНазвание
Муравьиная кислота
(метановая)
Уксусная кислота
(этановая)
Пропионовая кислота
(пропановая)
Формула
Модель
6.
ГОМОЛОГИЧЕСКИЙ РЯД КИСЛОТ7.
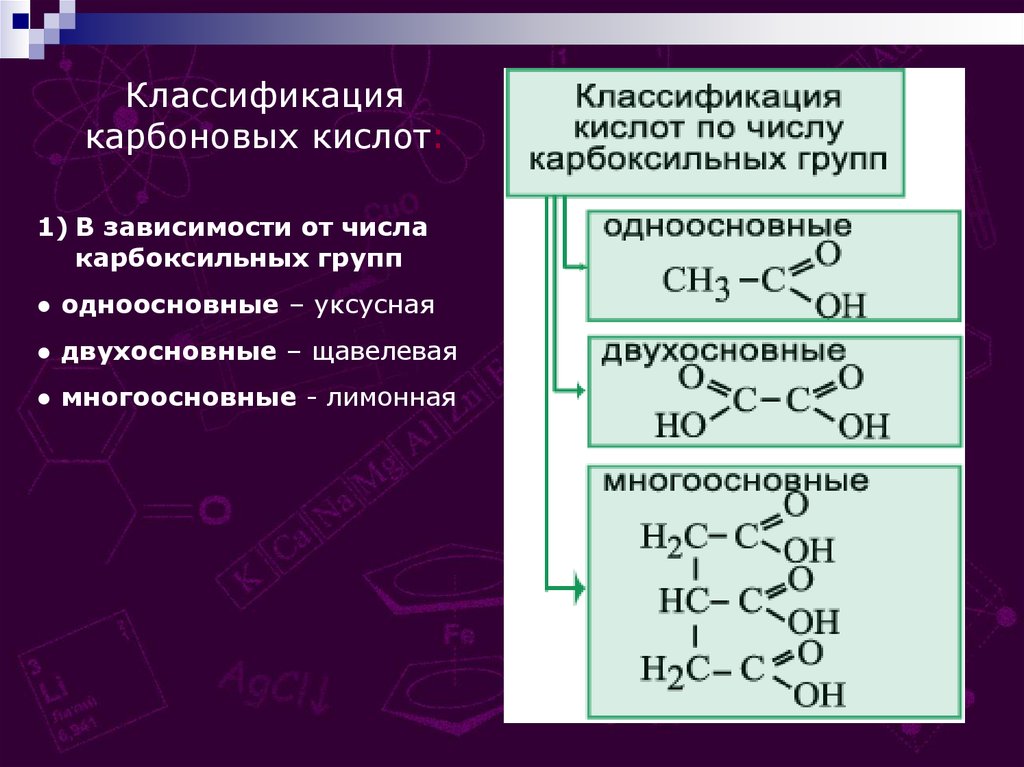
Классификациякарбоновых кислот:
1) В зависимости от числа
карбоксильных групп
● одноосновные – уксусная
● двухосновные – щавелевая
● многоосновные - лимонная
8.
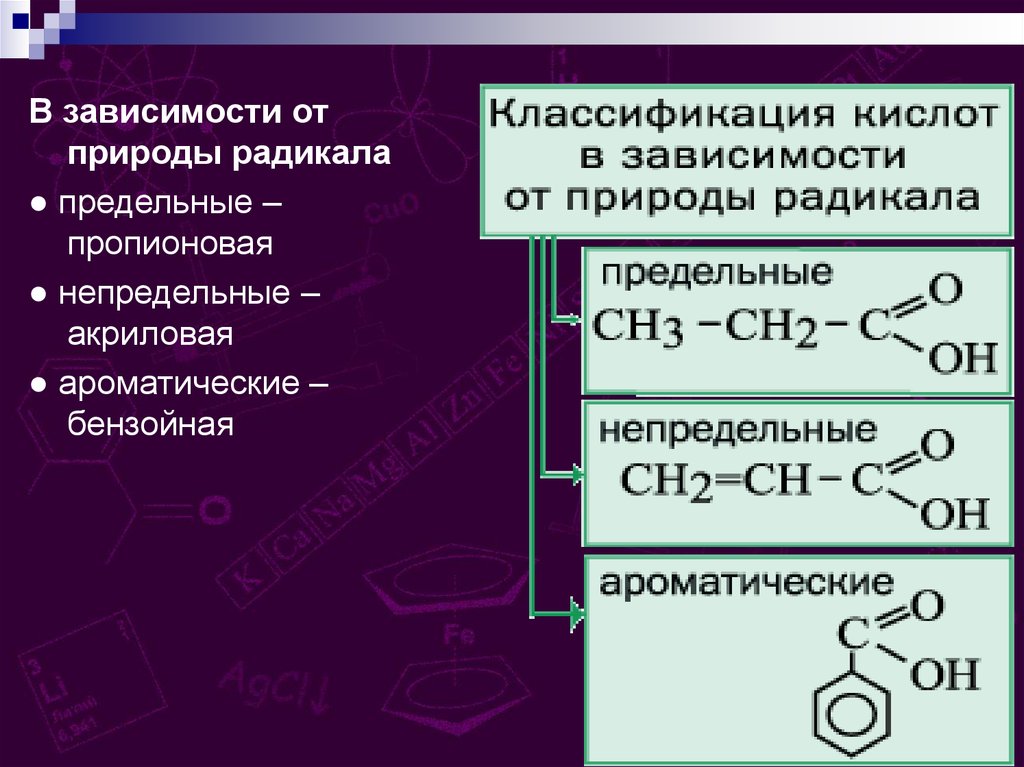
В зависимости отприроды радикала
● предельные –
пропионовая
● непредельные –
акриловая
● ароматические –
бензойная
9.
Многие кислоты имеют исторически сложившиеся илитривиальные названия, связанные главным образом с
источником их получения.
Карбоновые кислоты в
природе
10.
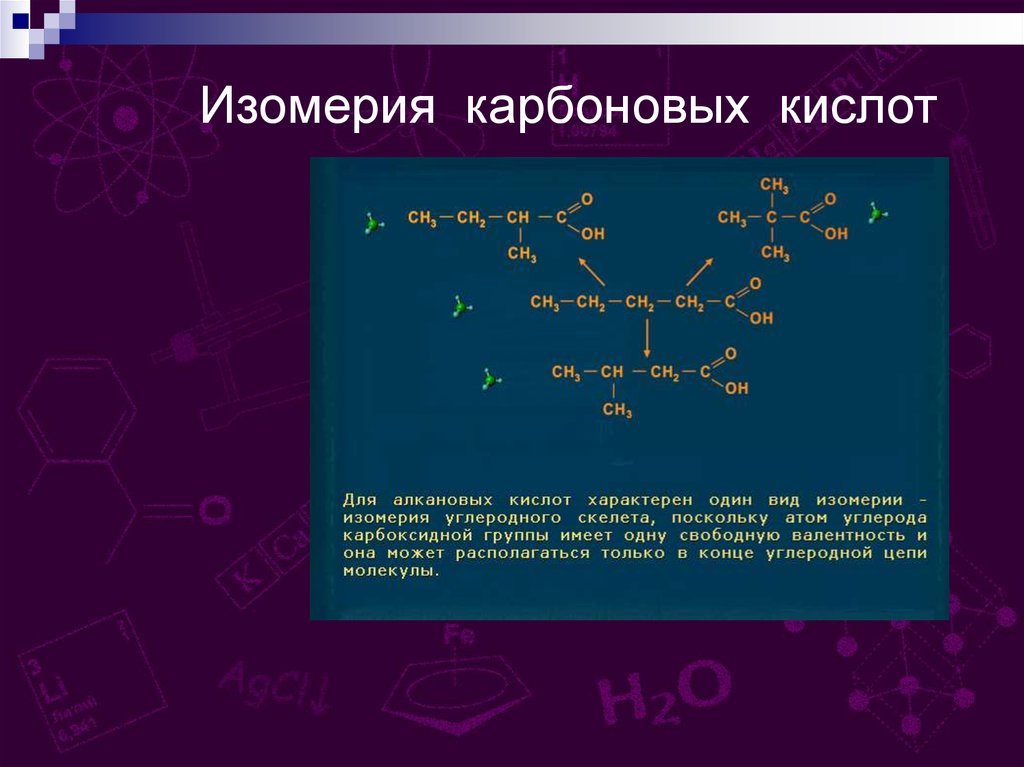
Изомерия карбоновых кислот11.
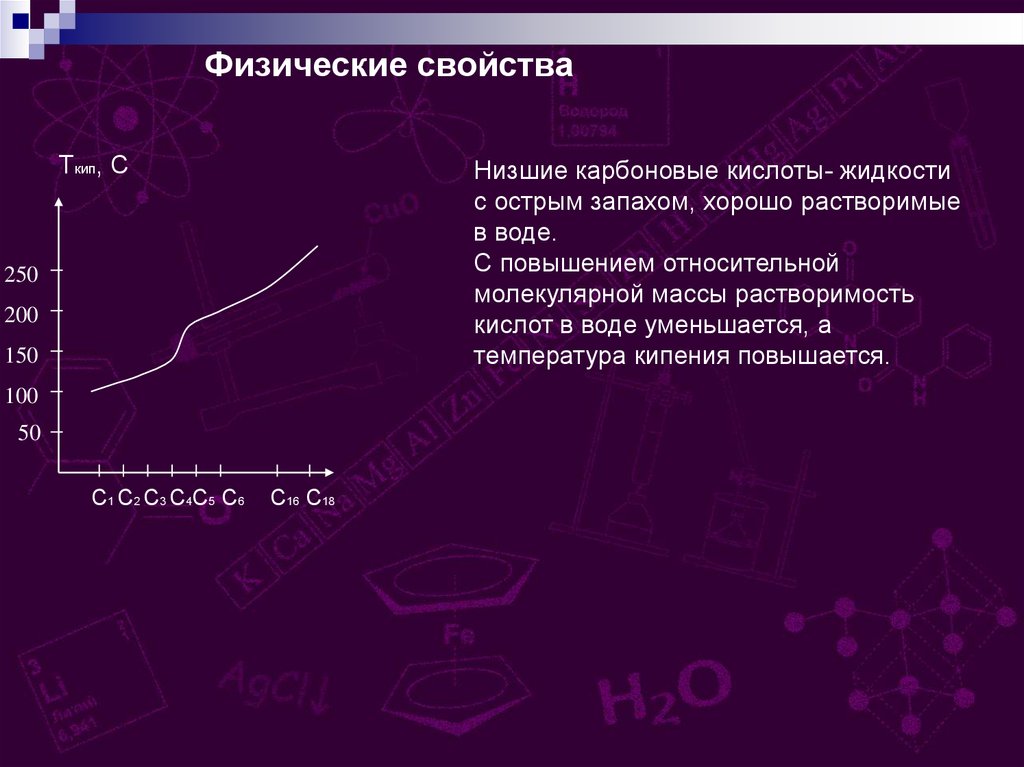
Физические свойстваTкип, С
Низшие карбоновые кислоты- жидкости
с острым запахом, хорошо растворимые
в воде.
С повышением относительной
молекулярной массы растворимость
кислот в воде уменьшается, а
температура кипения повышается.
250
200
150
100
50
С1 С2 С3 С4С5 С6
С16 С18






 Химия
Химия








